(2: 中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室, 南京 210008)
(2: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P.R.China)
蓝藻水华在富营养化的湖泊、水库和养殖池塘中频繁发生已成为当前水环境面临的重大问题.蓝藻水华能产生多种具有毒性效应的蓝藻毒素(Cyanotoxins),对水生态系统结构和功能、社会经济发展和人类健康都造成了严重的影响.微囊藻是形成蓝藻水华最常见的优势种类,微囊藻水华分布范围广,持续时间长,发生频率高,且微囊藻能合成产生一系列具有肝毒性效应的微囊藻毒素(Microcystin, MC),它们能够抑制肝细胞中的蛋白磷酸酶活性[1].长期饮用含有MC的水,可能引发肝癌[2].世界卫生组织(WHO)建议饮用水源中MC的安全浓度阈值<1.0μg/L,水产品中每日人体可允许摄入的MC<0.04μg/kg[3].
MC是一种小分子环状多肽,结构稳定.研究表明,MC是由微囊藻毒素合成酶基因家族(microcystin synthesis gene, mcy)编码的多酶复合体催化合成.应用分子生物技术已经阐明了mcy基因家族结构,并完成了序列分析. mcy基因家族是由两个反方向的操纵子组成,包含10个家庭成员(mcyA-J)[4-5].文献报道微囊藻细胞中是否含有mcy基因与微囊藻毒素产生有密切相关性[6].基于此,设计了针对mcy基因家族成员的引物,建立了检测微囊藻水华是否产毒的PCR扩增技术,可以对微囊藻水华是否产毒做出快速和准确判断[7-10].同时,针对MC的检测技术和分析方法也迅速发展,主要有生物分析法、化学分析法和生化分析法,高效液相色谱(High Performance Liquid Chromatography, HPLC)是目前应用、研究最多的方法[11].
近10多年来,我国河蟹养殖业有了迅猛的发展,养殖技术有了很大提高,池塘养殖密度不断增大,对水体的投入也在增加,造成养殖池塘水体富营养化和环境恶化,导致河蟹养殖池塘蓝藻水华频繁发生,对河蟹养殖造成巨大损失.已有一些文献对于养殖池塘蓝藻水华现象进行了报道,但对于微囊藻水华的毒性大小和微囊藻的生理特征尚缺乏研究.2013年7月和8月,苏州市吴中区一河蟹池塘发生了严重的微囊藻水华,显微镜检测结果表明铜绿微囊藻是其水华的优势种群.本研究采用全细胞PCR扩增快速检测微囊藻水华是否有毒,进一步应用HPLC分析方法测定了MC浓度.另外,应用Phyto-PAM荧光仪测定了微囊藻水华的光合作用活性,用于研究微囊藻的生理特征.本研究为了解河蟹养殖池塘微囊藻水华毒性和生理特征提供基础数据,同时为评价河蟹食品安全提供科学依据.
1 材料和方法 1.1 水样采集2013年7月和8月苏州吴中区一河蟹养殖池塘发生严重的微囊藻水华,分别于7月24日和8月23日上午10:00采集水样,使用有机玻璃采水器采集10 L水样(30cm),混合均匀,取1 L水样装入干净玻璃瓶中,每个水样取2个平行,带回实验室进行分析.
1.2 理化因子测定采用哈希水质监测仪(HQ-40, HACH)原位测定采样点水体的温度、溶解氧和pH.采用透明度盘测定水体的透明度.总氮采用碱性过硫酸钾消解紫外分光光度法测定,总磷采用钼酸铵分光光度法测定,叶绿素a采用90%丙酮萃取,分光光度法测定[12].
1.3 mcy基因片段的扩增和检测取5.0ml水样,10000转/mim离心10min收集微囊藻细胞,用超纯水洗涤,反复3次,最后用100μl超纯水定容,置于-20℃保存,作为PCR扩增模板.
本研究选择mcyA、mcyD和mcyG基因作为PCR扩增对象,PCR扩增所用引物见表 1.其中对mcyA基因采用单一PCR扩增,mcyD和mcyG采用双重PCR扩增.
| 表 1 PCR扩增引物 Tab.1 Primers used for PCR amplification |
扩增条件:PCR反应体系25μl,其中包含12.5μl, 2×PCR mix(上海博彩生物),1μl正反引物(10μmol),4μl模板,用超纯水补足25μl,阴性对照使用超纯水作为DNA模板.
反应程序:预变性95℃ 5min,变性95℃ 40s,引物退火58℃ 40 s(mcyA)和56℃ 40s(mcyD和mcyG),延伸72℃ 40s,30个循环,最后在72℃下保留8min.取5μl PCR产物,采用浓度1.5%的琼脂糖凝胶进行电泳,缓冲液是0.5×TAE,电泳结束后在紫外凝胶成像系统中观察、拍照.
1.4 微囊藻毒素浓度取200ml水样,经GF/C玻璃纤维滤膜过滤,滤膜和滤液分别用于测定胞内和胞外微囊藻毒素的浓度.将滤膜置于低温冷冻干燥机中冻干,剪碎滤膜,分别用5%的乙酸溶液和80%的甲醇溶液各5ml进行抽提[13],辅以超声波破碎,并充分震荡混匀,离心后合并上清液.采用C18固相萃取小柱富集和纯化滤膜提取液和滤液,用含0.1% TFA的甲醇溶液洗脱,洗脱液在40℃氮气吹干,0.5ml 50%的甲醇溶液定容待测.
采用带有紫外检测器的安捷伦高效液相色谱仪(Agilent1200, Agilent, USA)进行分析,检测条件为:流动相为含0.05% TFA的乙腈溶液,梯度从30%~70%,柱温40℃,流速1ml/min,紫外检测器波长为238nm.
1.5 光合作用活性分析采用浮游植物荧光仪Phyto-PAM(Walz, Effeltrich, German)测定微囊藻的光合作用活性,分析软件为Phyto-WIN v 2.13,校零采用0.22μm滤膜过滤水样.参照文献[14-15]测定水华微囊藻叶绿素荧光参数.取水样3.0ml,暗适应15min.首先打开光密度很弱的测量光MR(Measuring light),仪器检测到最小荧光值Fo,随后打开饱和脉冲(Saturation pulse),得到最大荧光值Fm,同时,在光照适应条件下测定其实际最大荧光值F m′和实际光合作用效率ΦPSII.设定仪器每隔20s加以逐渐增强光化光(active light)(16~764μmol/(s·m2),同时记录光量子产量,则得到快速光响应曲线(Rapid light response curve, RLC),通过此曲线,可以得到3个RLC曲线特征参数:线性区段斜率(α)、最大电子传递速率(rETRmax)和饱和光照强点(Ik)[16].其中Fv/Fm=(Fm- Fo)/Fm,NPQ=(Fm- F m′)/ Fm′. Fv/Fm是最大光量子产量,用于衡量浮游植物的潜在最大光合效率;NPQ(non-photochemical quenching)是非光化学荧光淬灭,表征浮游植物将过剩光能耗散为热的能力,即光保护能力[17].
2 结果和分析 2.1 理化因子河蟹养殖池塘采样点7月和8月总氮分别为1.68和1.05mg/L,总磷浓度分别为258.28和468.52μg/L,总氮和总磷浓度均超过水体富营养化标准;叶绿素a浓度分别为74.8和63.8μg/L,显微镜观察结果表明微囊藻水华主要是由铜绿微囊藻(Microcystis aeruginosa)组成;水温分别为28.5和31.5℃,有利于微囊藻水华形成;透明度较低,分别为30和25cm;水质呈碱性,pH分别为10.50和9.85;溶解氧分别为8.51和7.82mg/L.
2.2 PCR产物的检测PCR产物的凝胶电泳检测结果可以看出,PCR产物的特异性高,没有引物二聚体(图 1).7月和8月河蟹养殖池塘的微囊藻水华样品均能扩增出mcyA、mcyD和mcyG基因片段,片段大小与目的基因一致,可以初步判断,微囊藻水华具有产毒性.
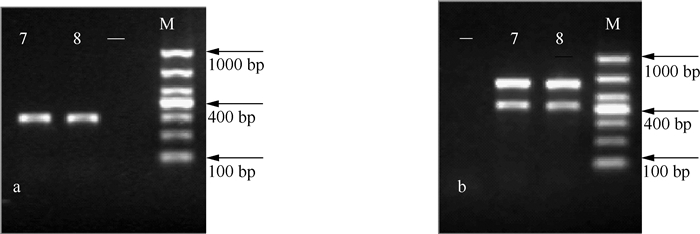
|
图 1 PCR产物凝胶电泳图谱(M:分子标记,DL1000;7和8:相应月份微囊藻水华样品,-:阴性对照;左图a:mcyA PCR产物,右图b:mcyD和mcyG PCR产物) Fig.1 Agarose gel electrophoresis images of PCR products(M: Marker, DNA ladder 1000; 7 and 8 indicate the Microcystis bloom samples in July and August, respectively; -: negative control; (a): mcyA, (b): mcyD and mcyG) |
采用HPLC分析方法测定河蟹养殖池塘微囊藻水华毒素浓度,结果如图 2所示.共检出3种异构体,异构体浓度在7月和8月存在差异:7月微囊藻水华胞内毒素浓度大于8月,而胞外毒素浓度相反. 7月微囊藻水华胞内毒素浓度为1.49μg/L,其中异构体RR、YR和LR浓度分别为0.46、0.45和0.58μg/L.胞外毒素浓度为0.75μg/L,RR、YR和LR浓度分别为0.22、0.18和0.35μg/L;8月胞内微囊藻毒素浓度达0.88μg/L,其中异构体RR、YR和LR浓度分别为0.27、0.31和0.30μg/L.胞外微囊藻毒素浓度为1.09μg/L,RR、YR和LR浓度分别为0.39、0.28和0.42μg/L.

|
图 2 胞内和胞外微囊藻毒素浓度 Fig.2 Intracelluar and extracellular microcystin concentrations |
从水华微囊藻的叶绿素荧光参数可以看出,7月和8月微囊藻的最大光量子产量Fv/Fm分别为0.48和0.44,实际光量子产量ΦPSII分别为0.38和0.32(图 3),表明水华期间微囊藻有较高的光合作用活性.从NPQ值可以看出,8月微囊藻的热耗散能力高于7月.从光响应曲线的特征参数可以看出,7月微囊藻的光能利用效率、耐受光强能力和电子传递速率均高于8月(图 3).
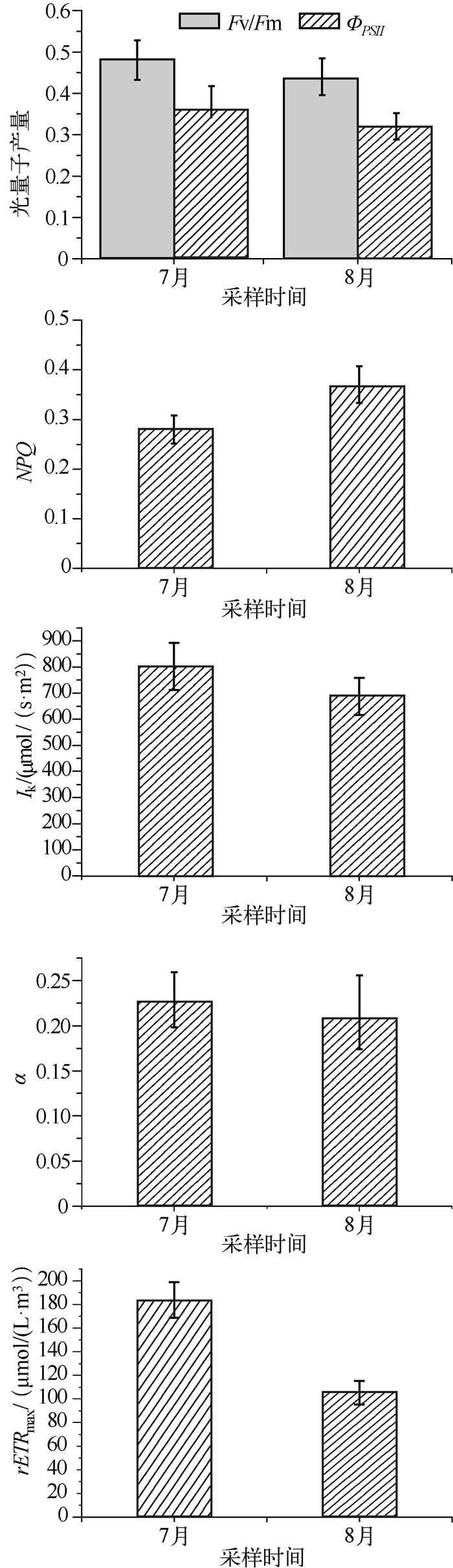
|
图 3 水华微囊藻的光合作用活性 Fig.3 Photochemical activity of bloom-forming Microcystis |
河蟹已成为我国淡水渔业养殖的重要品种之一.近年来,河蟹池塘养殖技术有很大提高,放养密度逐渐加大,饵料投入不断增加,导致养殖水体环境恶化,营养盐负荷增加,养殖水体变肥,呈现富营养化状态.池塘水体的总氮和总磷浓度均超过富营养化标准,导致水体透明度也较低,加之养殖池塘是封闭性水体,流动性差.同时,2013夏季7月和8月出现了长时间持续的高温晴朗天气,这些都是促使微囊藻水华发生的有利条件[18].在水华形成时,水体中叶绿素a的浓度一般在10μg/L以上.在该研究中,7、8月两次采样池塘水体中微囊藻水华的叶绿素a浓度分别达到74.8和63.5μg/L,均显著高于10μg/L,表明微囊藻水华强度较高.显微镜检测发现,铜绿微囊藻是微囊藻水华的优势种群.
光合作用活性是指示微囊藻生理特征的重要指标,目前多采用叶绿素荧光技术测定浮游植物的光合作用活性. Phyto-PAM是专一测定浮游植物光合活性的荧光仪,在研究湖泊微囊藻水华中广泛用来测定水华微囊藻的光合活性[19-20].从本研究结果可以得出(图 3),7月和8月水华微囊藻有较高的光合作用活性,其最大光量子产量Fv/Fm分别为0.48和0.44,实际光量子产量ΦPSII分别为0.38和0.32,这表明该河蟹养殖池塘形成水华的微囊藻有较高生长潜能,有利于微囊藻水华长时间存在.同时可以得出,7月和8月形成水华的微囊藻光合活性存在差异:7月微囊藻的光合活性高于8月.微囊藻光响应曲线的特征参数也可以说明这一点.从水温变化看,8月池塘水体的温度(31.5℃)高于7月(28.5℃),研究表明在上述温度范围内,温度升高有利于提高微囊藻的光合活性[21-22],但8月微囊藻的光合活性反而较低,可能是由于微囊藻受到夏季太阳光长时间照射产生光抑制的现象.已有许多文献报道微囊藻在夏季强光照射下,光合作用器官受到损伤,进而光合作用活性下降[19-20].另一方面,微囊藻可以通过NPQ机制降低光损伤[15],从本研究结果可以看出,8月微囊藻NPQ值高于7月微囊藻,这也是微囊藻在长时间高光强条件下的一种适应机制.
PCR检测法是检测微囊藻水华是否产毒的常用方法之一,它具有灵敏度高、操作简单、结果准确等优势[7-8]. PCR扩增对象可以是从水华微囊藻提取的DNA,也可以是微囊藻细胞.相比较而言,全细胞PCR可以直接以野外微囊藻细胞为扩增对象,省去了繁琐的DNA提取过程,在自然水体蓝藻水华检测中已有广泛应用[23].同时,从单一PCR扩增向双重和多重PCR扩增发展[8].本研究采用全细胞的单一和双重PCR方法扩增了河蟹养殖池塘水华微囊藻的mcy基因,结果显示为阳性(图 1),表明微囊藻水华是产毒的,与HPLC分析结果一致(图 2),表明该池塘水体受到MC污染.与张占会等[8]建立的全细胞多重PCR检测产毒微囊藻方法相比,本研究所选用引物特异性高,目的基因条带清晰,没有非特异性产物和引物二聚体出现.因此,对于野外微囊藻的全细胞PCR扩增而言,需要选择特异性高的引物,并对PCR反应进行优化.
从HPLC分析结果可以得出,7月微囊藻水华胞内、外MC浓度分别为1.49和0.75μg/L,8月胞内、外MC浓度分别为0.88和1.09μg/L,呈现出季节差异性,这可能与微囊藻水华生长阶段有关.一般而言,在微囊藻水华生长的前期和中期,胞内毒素含量较高,而胞外毒素浓度较低;在微囊藻水华的后期,微囊藻细胞出现衰亡,微囊藻毒素释放到水体中,微囊藻胞内毒素降低,胞外毒素升高.另外,环境因子(温度、光照和营养盐)的差异也可能是导致MC浓度变化的原因.由于MC性质较稳定,可以在水体中长期存在,且能通过食物链进行传递,在水生动物体内富集,对鱼类、甲壳类的食品安全构成潜在威胁,因此MC在可食性水产品中的分布及其动态变化成为研究热点[24-28].本研究结果表明,河蟹养殖池塘发生有毒微囊藻水华,水体受到MC污染,这可能会对河蟹食品安全构成威胁,需要对河蟹体内MC浓度及其动态变化做进一步研究.
| [1] |
Gehringer M. Microcystin-LR and okadaic acid-induced cellular effects: a dualistic response. FEBS Letters, 2003, 557(1/2/3): 1-8. |
| [2] |
Svirčev Z, Krstic' S, Miladinov-Mikov M et al. Freshwater cyanobacterial blooms and primary liver cancer epidemiological studies in Serbia. Journal of Environmental Science and Health Part C, 2009, 27(1): 36-55. DOI:10.1080/10590500802668016 |
| [3] |
Chorus I, Bartram J. Toxic cyanobacteria in water: A guide to their publichealth consequences, monitoring and management. World Health Organization, London/New York: E & FN Spon Publishers, 1999.
|
| [4] |
Nishizawa T, Ueda A, Asayama M et al. Polyketide synthase gene coupled to the peptide synthetase module involved in the biosynthesis of the cyclicheptapeptide microcystin. Journal of Biochemistry, 2000, 127(5): 779-789. DOI:10.1093/oxfordjournals.jbchem.a022670 |
| [5] |
Tillett D, Dittmann E, Erhard M et al. Structural organization of microcystin biosynthesis in Microcystis aeruginosa PCC 7806: an integrated peptide-polyketide synthetase system. Chemistry Biology, 2002, 7(10): 753-764. |
| [6] |
Kurmayer R, Dittmann E, Fastner J et al. Diversity of microcystin genes within a population of the toxic cyanobacterium Microcystis spp. in Lake Wannsee(Berlin, Germany). Microbial Ecology, 2002, 43(1): 107-118. DOI:10.1007/s00248-001-0039-3 |
| [7] |
潘卉, 宋立荣, 刘永定等. 水华蓝藻产毒特性的PCR检测法. 水生生物学报, 2001, 25(2): 159-166. |
| [8] |
张占会, 谢数涛, 韩博平等. 全细胞多重PCR检测蓝藻、微囊藻及产毒微囊藻方法初探. 生态科学, 2005, 24(1): 31-34. |
| [9] |
Hisbergues M, Christiansen G, Rouhiainen L et al. PCR-based identification of microcystin-producing genotypes of different cyanobacterial genera. Archives of Microbiology, 2003, 180(6): 402-410. DOI:10.1007/s00203-003-0605-9 |
| [10] |
Ouahid Y, Pérez-Silva G, Del Campo FF. Identification of potentially toxic environmental Microcystis by individual and multiple PCR amplification of specific microcystin synthetase gene regions. Environment Toxicology, 2005, 20(3): 235-242. DOI:10.1002/(ISSN)1522-7278 |
| [11] |
张维昊, 徐小清, 丘昌强. 水环境中微囊藻毒素研究进展. 环境科学研究, 2001, 14(2): 57-61. |
| [12] |
黄祥飞. 湖泊生态调查观测与分析. 北京: 中国标准出版社, 1999, 77-79.
|
| [13] |
彭亮, 陈伟, 宋立荣. 微囊藻胞内毒素的提取方法. 水生生物学报, 2011, 35(4): 708-712. |
| [14] |
吴晓东, 孔繁翔, 曹焕生等. 越冬浮游植物光合作用活性的原位研究. 湖泊科学, 2007, 19(2): 139-145. DOI:10.18307/2007.0205 |
| [15] |
Zhang M, Shi XL, Yu Y et al. The acclimative changes in photochemistry after colony formation of the cyanobacteria Microcystis aeruginosa. Journal of Phycology, 2011, 47(3): 524-532. DOI:10.1111/jpy.2011.47.issue-3 |
| [16] |
张曼, 曾波. PhytoPAM浮游植物分析仪用于微藻光合作用研究中集中参数设定的优化. 植物生理通讯, 2007, 43(1): 148-152. |
| [17] |
Juneau P, Harrison PJ. Comparison by PAM fluorometry of photosynthetic activity of nine marine phytoplankton grown under identical conditions. Photochemistry and Photobiology, 2005, 81(3): 649-653. DOI:10.1562/2005-01-13-RA-414.1 |
| [18] |
O' Neil JM, Davis TW, Burford MA et al. The rise of harmful cyanobacteria blooms: The potential roles of eutrophication and climate change. Harmful Algae, 2012, 14: 313-334. DOI:10.1016/j.hal.2011.10.027 |
| [19] |
Zhang M, Kong FX, Wu XD et al. Different photochemical responses of phytoplankters from the large shallow Taihu Lake of subtropical China in relation to light and mixing. Hydrobiologia, 2008, 603(1): 267-278. DOI:10.1007/s10750-008-9277-4 |
| [20] |
李大命, 阳振, 于洋等. 太湖春季和秋季蓝藻光合作用活性研究. 环境科学学报, 2013, 33(11): 3053-3059. |
| [21] |
Iberlings BW. Changesin photosynthesis in response to combined irradiance and temperatures stress in cyanobacterial surface water blooms. Journal of phycology, 1996, 32(4): 549-557. DOI:10.1111/j.0022-3646.1996.00549.x |
| [22] |
Christian JR, Coles JF. Effect of temperature on photosynthesis-light resonse and growth of four phytoplankton species isolated from a tidal freshwater river. Journal of Phycology, 2000, 36(1): 7-16. DOI:10.1046/j.1529-8817.2000.98219.x |
| [23] |
Pan H, Song LR, Liu YD et al. Detection of hepatotoxic Microcystis strains by PCR with intact cells from both culture and environmental samples. Archives of Microbiology, 2002, 78(6): 421-427. |
| [24] |
Magalhes VF, Soares RM, Azevedo SMFO. Microcystin contamination in fish from the Jacarepaguá Lagoon(Rio de Janeiro, Brazil):ecological implication and human health risk. Toxicon, 2001, 39(7): 1077-1085. DOI:10.1016/S0041-0101(00)00251-8 |
| [25] |
Mohamed ZA, Carmichael WW, Hussein AA et al. Estimation of microcystins in the freshwater fish Oreochromis niloticus in an Egyptian fish farm containing a Microcystis bloom. Environmental Toxicology, 2003, 18(2): 137-141. DOI:10.1002/(ISSN)1522-7278 |
| [26] |
Xie L, Xie P, Guo L et al. Organ distribution and bioaccumulation of Microcystins in freshwater fish at different trophic levels from the eutrophic lake Chaohu, China. Environmental Toxicology, 2005, 20(3): 293-300. DOI:10.1002/(ISSN)1522-7278 |
| [27] |
Dewes LJ, Sandrini JZ, Monserrat JM et al. Biochemical and physiological responses after exposure to microcystins in the crab Chasmagnathus granulatus(Decapoda, Brachyura). Ecotoxicology and Environmental Safety, 2006, 65(2): 201-208. DOI:10.1016/j.ecoenv.2005.07.013 |
| [28] |
Chen J, Xie P. Microcystin accumulation in freshwater bivalves from Lake Taihu, China, and the potential risk to human consumption. Environmental Toxicology and Chemistry, 2007, 26(5): 1066-1073. DOI:10.1897/06-423R1.1 |
 2015, Vol. 27
2015, Vol. 27 