(2: 中国科学院大学,北京 100049)
(3: 同济大学环境科学与工程学院,污染控制与资源化研究国家重点实验室,上海 200092)
(2: Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, P.R.China)
(3: State Key Laboratory of Pollution Control and Resource Reuse, College of Environmental Sciences and Engineering, Tongji University, Shanghai 200092, P.R.China)
水体腐殖酸是一种水体污染物中间体,是一大类具有相似化学结构和化学性质的有机物总称,其特点是极难降解,在自然界中的寿命可长达80年[1].腐殖酸在饮用水处理过程中易形成消毒副产物,从而影响饮用水的安全性,同时腐殖酸还是有色可溶性有机物(CDOM)的重要组成部分,在紫外和可见光波段有强烈的吸收作用,是湖泊水体中重要的发色物质,影响水的色度[2].根据近年来的研究,腐殖酸在天然水体中一般浓度为10~20 mg/L,在湖泊表层水体中可溶性有机物(DOM)可占50 %左右[3].水生生态系统中的腐殖酸在1930s末才被人们所认知,直到1974年才首次将水体腐殖酸与陆地腐殖酸进行区分研究,水体腐殖酸对水生生态环境的影响也慢慢被人们所了解[4].虽然已有研究表明,腐殖酸的形成与生物活动密切相关,然而水体中的腐殖酸,特别是在蓝藻水华的富营养化水体中的腐殖酸的来源和动态并不清楚,其与蓝藻之间的关系有待研究[5].我国针对水体腐殖酸的研究鲜见报道,且提取手段以酸碱析出法为主.由于水体中的腐殖酸中含有富里酸,其疏水性较弱、亲水性较强,因此酸碱析出法在提取过程中会造成较大的损耗.为此,国际腐殖酸协会规定了一种可以高效富集提取天然水体中腐殖酸的方法——大孔树脂DAX-8富集法,其通过分子间的作用力,可以从水溶液中吸附腐殖酸,并可方便地洗脱再生,从而实现水体腐殖酸的富集、分离和回收[6].
在近十年间,由于较严重的水体富营养化,太湖每年频繁发生蓝藻水华.与其他湖泊相比,太湖蓝藻水华具有周期长的特点,水华周期从5月持续至10月,横跨春、夏、秋3个季度,并以微囊藻水华为主,微囊藻生物量可占藻类总生物量的50 % ~98 % [7].微囊藻在生长过程中可以形成腐殖酸并向水体中释放[6],许多去除微囊藻水华的方法和技术也会导致腐殖酸在胞外大量释放,而水体中的腐殖酸又能进一步加速微囊藻水华的形成[8].因此,为了能够对水体腐殖酸进行有效控制,有必要研究腐殖酸与微囊藻的关系,并研究其释放特点.
以太湖常见的优势微囊藻——水华微囊藻(Microcystis flos-aquae)为材料,在实验室模拟研究其生长过程中腐殖酸的动态变化,同时对培养过程中浮游细菌的变化进行观察比较.
1 材料与方法 1.1 实验材料本实验中所使用的藻株为水华微囊藻(Microcystis flos-aquae T34),是从太湖中分离的单种藻株,保存于中国科学院水生生物研究所有害藻类学科组藻种库.藻株保存在温度为25±5℃、光照强度为25 μmol/(m2·s)、光暗周期为12h : 12h的条件下,所使用的培养基为CT完全培养基[9].
1.2 藻液的培养在5L锥形瓶中加入3L灭菌CT培养基,接入水华微囊藻藻种,使微囊藻初始密度为5×106 cells/L.培养条件为:温度25℃、光照强度25 μmol/(m2·s),光暗周期12 h : 12 h,并每日搅动3次[9].培养周期开始后,自第1d起,每隔一周取一定量的藻液,对其细胞数、细菌数及腐殖酸浓度进行测定分析.
1.3 藻细胞计数藻细胞计数采用视野法[10].计数前充分搅匀藻细胞培养液,取0.1ml样品注入浮游植物计数框内,在400倍的Olympus BX51型光学显微镜下计数100个视野,每个样本重复计数2次.采用视野法计算细胞个体数后,原水样中浮游植物数量的计算公式为:每升原水样中浮游植物数量=计数所得浮游植物数目×计数框面积/(视野面积×取样体积).
1.4 细菌计数细菌计数采用Dapi染色法[11].取1ml搅拌均匀后的藻细胞培养液至离心管,加入5 μl Dapi染料后,遮光染色10min.使用Millipore可拆卸式针筒过滤器将染好的藻液过滤至滤膜上,滤膜为Millipore过滤器配套黑膜,孔径0.2μm配套.滤干后,将滤膜取出,展平至载玻片上,在滤膜中间滴加香柏油后盖上盖破片排除空气.调处显微镜中与DAPI对应的荧光光源后,即可在油镜下观察并拍照计数.计算公式为:每毫升细菌总数=拍照面积细菌总数×滤膜有效过滤面积/(拍照面积×加样体积).
1.5 腐殖酸的富集腐植酸的提取采用国际腐植酸协会推荐的DAX-8大孔树脂提取法[12-13].大孔树脂经溶胀漂洗去杂质,再依次使用乙醇、乙腈、丙酮、甲醇在索氏提取器中分别提取4 h,树脂用甲醇浸泡备用.取5ml经纯化过的树脂装入内径为1cm的层析柱中,通过恒流泵用蒸馏水洗树脂至洗出液无甲醇味后,继续用500ml 0.1mol/L NaOH溶液与500ml 1 % HCl溶液交替洗树脂,最后用蒸馏水冲洗树脂至洗出液为中性.将40ml藻液用500℃灼烧后的玻璃纤维滤膜(孔径0.2 μm)过滤,调节pH至2,以3ml/min的流量使其中20ml水样通过树脂柱,将滤液以及另外20ml没有通过树脂柱的水样分别收集至灼烧后的TOC瓶中,使用TOC仪对其有机碳浓度进行测定.之后用30ml纯乙醇以3ml/min的速度将富集在树脂柱中的腐殖酸洗脱下来,使用平行蒸发仪蒸去乙醇后,用10ml去离子水重新溶解,以用于三维荧光光谱分析.本文中出现的腐殖酸浓度均以其有机碳浓度进行表证.计算公式为:腐殖酸有机碳浓度=未经过树脂柱富集的水样的有机碳浓度-经过树脂柱富集的水样的有机碳浓度.
1.6 三维荧光光谱分析三维荧光光谱分析利用日本岛津公司RF-5301PC荧光分光光度计及其配套的工作站软件,配上1cm石英比色皿完成.仪器分析条件设定为:激发和发射狭缝为5 nm,扫描速度为12000 nm/min;激发波长的扫描范围为200~ 450 nm,扫描间隔为5 nm;发射波长的扫描范围为250~550 nm,扫描间隔为5 nm;每个样平行测定3次,取平均值作为该样品的荧光光谱[14].
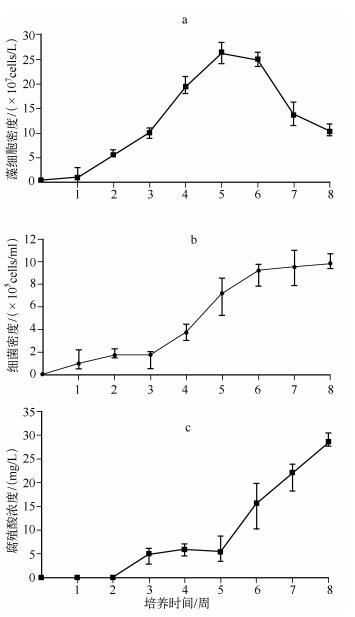
2 结果 2.1 培养过程中水华微囊藻细胞密度变化规律培养条件下,水华微囊藻T34藻细胞密度的变化如图 1a所示.其中,第1~5周为对数生长期.藻细胞密度起始值为5×106 cells/L,在第5周达到最高值2.64×108 cells/L.第6周为稳定期,藻细胞密度小幅度减少.第6~8周则为衰亡期,至第8周藻细胞密度为1.04×108 cells/L(图 1a).
|
图 1 培养过程中水华微囊藻细胞密度(a)、细菌密度(b)和腐殖酸浓度(c)的动态变化 Fig.1 Dynamics of M.flos-aquae cell density(a),bacterial cell density(b) and humic acid concentration(c) during the cultivation |
在培养的前3周中,细菌密度增长较缓慢,第2周细菌密度增长至1.68×105 cells/ml后在此水平上维持1周.第3周后之后细菌密度迅速增加,该迅速增长期从第3周持续到第6周,第4周细菌密度为第3周的2倍,至第6周细菌密度已达到9.23×105 cells/L.第6~8周为稳定期,细菌密度在此期间内小幅度增长,第8周细菌密度为9.83×105cells/L.与图 1a对比可发现,细菌对数期开始于第3周,即水华微囊藻对数期中期,当水华微囊藻进入衰亡期时,该迅速增长期结束,之后进入缓慢增长的稳定期(图 1b).
2.3 培养过程中腐殖酸浓度变化规律藻细胞培养液中的腐殖酸浓度在第1周低于检测阈值,第2~5周呈现小幅度增长趋势,浓度自1.6 mg/L增加到5.4 mg/L;第5~8周,腐殖酸浓度增长幅度较大,第8周达到最大值,为28.6 mg/L.整个培养周期中,腐殖酸浓度的变化趋势基本与细菌密度变化趋势一致,但其缓慢增长期出现在第2~5周,与细菌密度相比延迟2周;当水华微囊藻进入稳定期与衰亡期后,腐殖酸浓度迅速增加(图 1c).
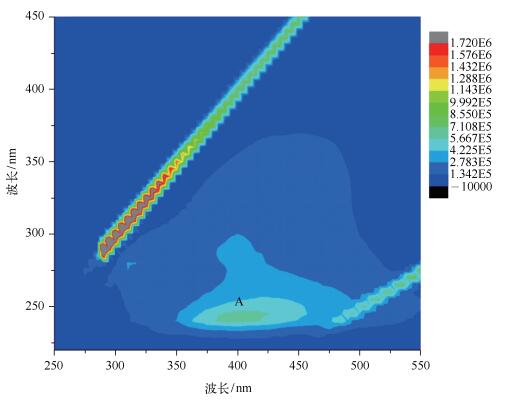
2.4 荧光光谱分析利用三维荧光谱图对洗脱下来的腐殖酸进行分析,可以获得激发波长和发射波长同时变化下腐殖酸的完整信息.从获得的三维荧光谱图可以观察到明显的荧光峰A(235~245 nm)/(380~425 nm)(图 2),属于类富里酸荧光峰.
|
图 2 水华微囊藻培养液中腐殖酸三维荧光光谱 Fig.2 3D EEM fluorescence spectrum of humic acid extrated from the M.flos-aquae cultures |
针对腐殖酸及其形成过程的研究大都集中在陆地高等生物上,水生系统中腐殖酸的形成依然是研究盲点.近10年来,大规模的蓝藻水华在太湖频繁暴发,而关于蓝藻水华的发生发展过程特别是在秋季消亡过程中,对太湖这样一个大型淡水富营养化湖泊所贡献的腐殖酸还鲜有报道[15].由于腐殖酸的难降解性,它们能在水体中不断累积,使可溶性有机物(DOM)含量不断增高.同时由于腐殖酸特殊的化学性质,能够与水中营养元素结合,使之持续为藻类提供所需要的元素,进一步促进水华蓝藻的生长[16-17].本研究结果显示,水华微囊藻在生长后期释放出大量的腐殖酸.结合叶琳琳等关于藻细胞裂解通常发生在水华后期并直接释放大量的溶解性有机碳的结论[18],我们更加确信蓝藻水华在秋季消亡过程会导致腐殖酸的大量产生.
目前已知水体腐殖质是一类多分散的、偶然性聚合的大分子有机物,来源于土壤腐殖质、水生植物和低等浮游生物的分解产物经过长期的物理、化学、生物作用而形成的复杂有机物.关于腐殖质形成机理目前比较流行的假说有木质素-蛋白质复合体假说、微生物合成假说、植物和微生物细胞自溶假说、厌氧发酵形成腐殖质三阶段理论等[5].虽然上述理论仍不能系统、完善地解释有机质形成腐殖质的生物化学过程,但都强调了微生物在这个过程中的重要作用[19].在本研究中,腐殖酸浓度的变化趋势与细菌数量变化趋势基本一致,并出现约2周的延迟效应,显示出在水生环境中,腐殖酸的生成与细菌的活动有密切联系.值得注意的是,在第5周时,藻细胞培养液中的细菌密度已达到较高水平,然而腐殖酸在第5周之前只出现缓慢的增长.至水华微囊藻开始裂解、消亡,腐殖酸浓度才出现大幅度增加.这说明在培养过程中,腐殖酸主要来源于裂解的藻细胞.当水华微囊藻细胞裂解后,其释放的DOM以及细胞残骸在细菌的作用下,一部分被细菌利用,另一部分则被转化为腐殖酸,并不断在溶液中积累,因而造成腐殖酸浓度不断升高的趋势.截止到第8周,腐殖酸浓度依然没有减缓趋势.因此,在蓝藻水华的治理技术中,应尽量选用避免藻细胞破裂的方法,以防止破裂的细胞持续释放腐殖酸到水体中,造成水质进一步恶化.
本研究采用目前国际上通用的分离和富集效果较好的DAX-8富集法来测定水华微囊藻培养液中的腐殖酸浓度,最高达28.6 mg/L,显示该方法对水华蓝藻腐殖酸研究的有效性.根据刘菲菲等对铜绿微囊藻胞外有机物释放的研究,当在25℃条件下培养至第50 d时,其细胞外的溶解性有机碳(DOC)浓度可达49.28 mg/L[20].鉴于本实验的培养条件和以上研究相似,当培养液中的腐殖酸浓度达到最高值时,胞外DOC浓度为59.66 mg/L.因此,推测微囊藻培养条件下腐殖酸浓度可占胞外DOC浓度的50 %或以上,支持Kim等的观点[3].
腐植酸作为一个多组分的复杂体系,传统的荧光发射或激发光谱很难完整地描述该体系的荧光特征,也很难解决组分之间的干扰问题.由于腐植酸来源与提取方法不同,结构上存在较大差异.紫外-可见光谱及红外光谱可以在一定情况下分析腐植酸的结构,但在区别不同来源腐植酸以及解释其细微差别时存在一定的难度,用三维荧光光谱对提取的腐植酸进行表征则较为可行,其具有图谱直观、测定迅速、适用范围较大的特点.由于水溶性的腐殖质主要是腐殖酸和富里酸,一般文献中所指的水体腐殖质即腐殖酸、富里酸或两者的混合物[21],三维荧光光谱分析可以用来对混合物中的多种成分更好地加以分辨.本实验中所提取得到的腐殖酸在三维荧光光谱分析中呈现出单一的荧光峰,属于类富里酸,而类胡敏酸区未见明显峰.荧光峰位置除了与离子强度、腐殖化程度等因素有关外,还与有机物的组成和来源有关,不同来源与组成的有机物含有不同的荧光基团,会导致荧光峰位置存在差异[22].而在一些高等植物的研究中,已经证明陆地植物叶部含有较多类腐殖酸物质,其茎部则含有较多类富里酸物质[18],三维荧光光谱对于异质性腐殖酸具有强大的甄别能力.因此,本实验证明了来源于水华微囊藻的腐殖酸,其特征峰出现于(235~245 nm)/(380~425 nm)范围内,属于类富里酸[23].张运林等[24]将太湖水样中提取得到的腐殖酸进行三维荧光光谱分析,发现太湖水体中的腐殖酸出现2个较强的峰,分别为A峰(225 nm/410 nm)和B峰(330 nm/410 nm),其中A峰与本实验中所获得的腐殖酸有相似的光谱学特征.而其他有关太湖DOM三维荧光分析中,该区域也通常有明显的峰[25-26].有关不同水华蓝藻种类的腐殖酸的类型和浓度,以及对富营养化水体中DOM的贡献还有待用更多的水华蓝藻藻种进行进一步扩展研究.
| [1] |
刘岩. 超声声化学降解水体腐殖酸的研究. 青海环境, 1996, 6(1): 43-43. |
| [2] |
姜广甲, 马荣华, 段洪涛. 利用CDOM吸收系数估算太湖水体表层DOC浓度. 环境科学, 2012, 33(7): 2235-2243. |
| [3] |
Kim KW, Rhee D, Ozon S. Hydrogen peroxide system for degradation of humic acid in water. Advanced Materials Research, 2014, 937: 620-623. DOI:10.4028/www.scientific.net/AMR.937 |
| [4] |
王亚军, 马军. 水体环境中天然有机质腐殖酸研究进展. 腐殖酸, 2012, 21(6): 1155-1165. |
| [5] |
崔俊涛. 微生物在土壤腐殖质形成与转化中作用的研究[学位论文]. 长春: 吉林农业大学, 2006.
|
| [6] |
Ohkubo N, Yagi O, Okada M. Effects of humic and fulvic acids on the growth of Microcystis aeruginosa. Environmental Technology, 1998, 19: 611-617. DOI:10.1080/09593331908616717 |
| [7] |
谭啸, 孔繁翔, 曾庆飞等. 太湖中微囊藻群落的季节变化分析. 生态与农村环境学报, 2009, 25(1): 47-52. |
| [8] |
Li L, Gao N, Deng Y et al. Characterization of intracellular & extracellular algae organic matters (AOM) of Microcystis aeruginosa and formation of AOM-associated disinfection by products and odor & taste compounds. Water Research, 2012, 46: 1233-1240. DOI:10.1016/j.watres.2011.12.026 |
| [9] |
潘倩倩, 朱梦灵, 刘洋等. 阿氏浮丝藻mcyT基因序列多样性研究. 水生生物学报, 2014, 38(1): 92-99. |
| [10] |
黄静, 柴文波, 李仁辉等. 桥墩湖浮游植物调查以及鲢、鳙鱼产力的研究. 江西师范大学学报:自然科学版, 2013, 37(5): 535-539. |
| [11] |
Porter KG. The use of DAPI for identifying and counting aquatic microflora. Limnology and Oceanography, 1980, 25: 943-948. DOI:10.4319/lo.1980.25.5.0943 |
| [12] |
Peuravuori J, Ingman P, Pihlaja K et al. Comparisons of sorption of aquatic humic matter by DAX-8 and XAD-8 resins from solid-state (13)C NMR spectroscopy's point of view. Talanta, 2001, 55(4): 733-742. DOI:10.1016/S0039-9140(01)00478-7 |
| [13] |
Hur J, Jung KY, Jung YM. Characterization of spectral responses of humic substances upon UV irradiation using two-dimensional correlation spectroscopy. Water Research, 2011, 45(9): 2965-2974. DOI:10.1016/j.watres.2011.03.013 |
| [14] |
Chai X, Liu G, Zhao X et al. Complexion between mercury and humic substances from different landfill stabilization processes and its implication for the environment. Journal of Hazardous Materials, 2012, 209: 59-66. |
| [15] |
秦伯强, 范成新. 大型浅水湖泊内源营养盐释放的概念性模式探讨. 中国环境科学, 2002, 22(2): 150-153. |
| [16] |
张树清, 刘秀梅, 冯兆滨. 腐殖酸对氮、磷、钾的吸附和解吸特性研究. 腐殖酸, 2007(2): 15-21. |
| [17] |
马梅, 王子健, 黄圣彪等. EDTA和腐殖酸对铜在淡水藻(Scenedesmus subspicatus 86.81 SAG)细胞内外分布的影响. 环境科学学报, 2003, 23(2): 239-245. |
| [18] |
叶琳琳, 史小丽, 吴晓东等. 西太湖秋季蓝藻水华过后细胞裂解对溶解性有机碳影响. 中国环境科学, 2011, 31(1): 131-136. |
| [19] |
谢理, 杨浩, 渠晓霞等. 滇池典型陆生和水生植物溶解性有机质组分的光谱分析. 环境科学研究, 2013, 26(1): 72-79. |
| [20] |
刘菲菲, 冯慕华, 尚丽霞等. 温度对铜绿微囊藻(Microcystis aeruginosa)和鱼腥藻(Anabaena sp.)生长及胞外有机物产生的影响. 湖泊科学, 2014, 26(5): 780-788. DOI:10.18307/2014.0517 |
| [21] |
冯华军, 胡立芳, 单丹等. 水体腐殖质危害及去除的研究进展. 科技通报, 2008, 24(4): 553-558. |
| [22] |
祝鹏, 华祖林, 张润宇等. 太湖溶解有机质光谱和氮磷污染的区域分布差异特征. 环境科学研究, 2010, 23(2): 129-136. |
| [23] |
Stedmon CA, Markager S, Bro R. Tracing dissolved organic matter in aquatic environments using a new approach to fluorescence spectroscopy. Marine Chemistry, 2003, 82(3): 239-254. |
| [24] |
Zhang Y, van Dijk MA, Liu M et al. The contribution of phytoplankton degradation to chromophoric dissolved organic matter (CDOM) in eutrophic shallow lakes:field and experimental evidence. Water Research, 2009, 43(18): 4685-4697. DOI:10.1016/j.watres.2009.07.024 |
| [25] |
Chen X, Chuai X, Yang L et al. Climatic warming and overgrazing induced the high concentration of organic matter in Lake Hulun, a large shallow eutrophic steppe lake in northern China. Science of the Total Environment, 2012, 431: 332-338. DOI:10.1016/j.scitotenv.2012.05.052 |
| [26] |
祝鹏, 华祖林, 张润宇等. 太湖溶解有机质光谱和氮磷污染的区域分布差异特征. 环境科学研究, 2010, 23(2): 129-136. |
 2015, Vol. 27
2015, Vol. 27 

