(2: 水资源高效利用与工程安全国家工程研究中心,南京 210098)
(3: 西北农林科技大学资源环境学院,杨凌 712100)
(2: National Engineering Research Center of Water Resources Efficient Utilization and Engineering Safety, Nanjing 210098, P.R.China)
(3: College of Resources and Environment, Northwest Agriculture and Forest University, Yangling 712100, P.R.China)
蓝藻水华的频繁发生,造成了一系列生态和环境问题[1-2].其中微囊藻属是水华蓝藻中分布最广、危害最严重的属[3].一些湖泊调查结果显示,微囊藻群落存在明显的季节演替规律.Park等[4]对日本诹访湖微囊藻种类组成进行调查,发现在6-8月间水华微囊藻(Microcystis flos-aquae)和惠氏微囊藻(M. wesenbergii)不断增多而占优势,9月之后铜绿微囊藻(M. aeruginosa)不断增多而占优势.在日本琵琶湖[5]、Hirosawa-no-ike pond[6]和我国的巢湖[7]都发现了类似的规律.
太湖是我国第3大淡水湖泊,近年来,夏季蓝藻水华频繁发生,其中铜绿微囊藻、水华微囊藻和惠氏微囊藻为主要优势种,占蓝藻总丰度的90 %以上[8].谭啸等[9]比较分析了太湖春、夏、秋、冬季微囊藻群落的组成,并未发现明显的季节变化规律.而Li等[10]发现太湖中微囊藻群落存在显著的季节演替现象,铜绿微囊藻和惠氏微囊藻在夏、秋季占优势,而较小的鱼害微囊藻(M. ichthyoblabe)在春季与冬季大量存在,但并没有对不同微囊藻的空间差异进行探讨.Otten等[11]在2009年6-7月及2010年7月对太湖的调查发现,太湖中微囊藻群落存在明显的空间差异.以上学者逐步提出了太湖微囊藻群落的演替规律及空间分布差异,但季节演替结果存在差异,且不同区域微囊藻群落的空间差异仍需要进一步明确.此外,有学者对微囊藻种类间季节性演替的机理进行了探讨.Imai等[12]通过野外调查发现铜绿微囊藻占优势时水温在24.7~33.9℃之间,而惠氏微囊藻占优势时水温为19.6~28.6℃,且通过室内培养实验发现高温条件下铜绿微囊藻的生长速率明显高于惠氏微囊藻,因此提出水温可能是影响微囊藻群落演替的重要因素.Amemiya等[13]对采自日本诹访湖的微囊藻进行室内培养,发现溶解性无机氮(DIN)浓度与铜绿微囊藻生长速率呈正相关,与绿色微囊藻(M. viridis)生长速率呈负相关,而温度对几种微囊藻的生长并没有明显的影响.此外,有研究者通过室内培养实验发现铜绿微囊藻、惠氏微囊藻对于P和Fe等的最适浓度存在差别[14-15].尽管对微囊藻种类间季节演替的机理已开展研究,但所得结论不一致[12, 21],且缺少野外环境中多种微囊藻同时存在时各种环境因子与微囊藻种类间的相关性分析.
本研究于2010年7月至2011年6月期间对太湖梅梁湾和贡湖湾进行为期一年的调查,观察微囊藻群落构成的季节变化及其在空间上的差异,并探讨影响微囊藻群落时空分布的因素.
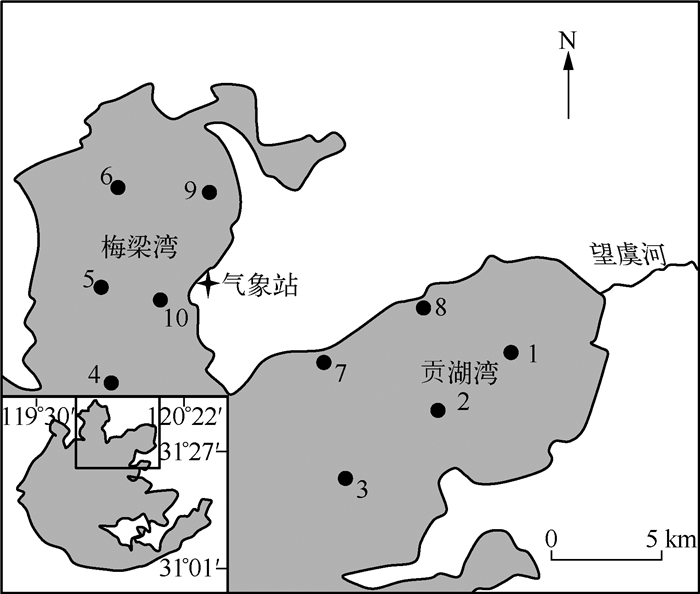
1 材料和方法 1.1 采样点布置及样品采集在太湖北部梅梁湾及贡湖湾各设置5个采样点(图 1),于2010年7月初到2011年6月初每月采样1次.用有机玻璃采水器采集水面以下30cm处水样并保存于500ml聚乙烯瓶中,冷藏带回实验室测定总溶解态氮(TDN)、总溶解态磷(TDP)浓度.另取10L水样通过64μm浮游植物网进行藻样富集,加入福尔马林固定后带回实验室进行微囊藻种类及丰度分析.现场用水温计(Mettler SG7)及pH仪(pH Testr30)测量水温及pH值.并通过10#样点附近的气象站记录风速与风向.
|
图 1 太湖梅梁湾与贡湖湾各采样点分布 Fig.1 Sampling sites in Meiliang Bay and Gonghu Bay of Lake Taihu |
根据《湖泊富营养化调查规范》[16]对水质指标进行监测.将水样通过0.45 μm微孔滤膜过滤后,分别测定水中TDN和TDP浓度.
1.2.2 藻类组成和细胞丰度分析将采集的藻样摇匀后均匀分为两份.一份用显微镜拍照(奥林巴斯CX31联同尼康C-5050数码相机),然后用UTHSCSA Image Tool v3.00软件(美国德克萨斯大学)量取照片中所有微囊藻群体粒径,每个样品至少量取200个群体,用球型体积计算公式计算各微囊藻群体的体积,并以此分析代表各种微囊藻的生物量比例.藻类鉴定依据虞功亮等[17]的方法,本研究将微囊藻分为鱼害微囊藻、惠氏微囊藻、铜绿微囊藻以及其它微囊藻.其中水华微囊藻因与鱼害微囊藻形态相近较难区分,本研究一并归为鱼害微囊藻[18].
将另外一份藻样摇匀,取3ml于离心管中,在100℃水浴振荡锅中以120转/min振荡5min,使藻细胞分散开[19].用血球计数板在显微镜(Olympus CX31)下对藻细胞数进行计数,计数3次,当3次误差小于10 %时以平均值表示细胞丰度,否则再进行计数,直到有3次的误差小于10 %.各种微囊藻的细胞丰度通过不同微囊藻所占比例与微囊藻总细胞丰度的乘积求得.
1.2.3 数据分析各环境因子与各微囊藻细胞丰度间的关系通过CANOCO 4.5(SCIENTIA Software)软件进行典范对应分析(CCA).为探讨风对藻群体空间分布的影响,将两个湖湾各点的不同微囊藻细胞丰度沿着风向进行绘制,并用SPSS 10.0软件对上风向和下风向各样点微囊藻细胞丰度分布之间的关系做单项方差分析.
2 结果 2.1 调查期间气象与环境因子表 1为太湖贡湖湾、梅梁湾不同月份主要气象因子及pH的变化情况.其中水温及pH为各采样点的平均值,风速和风向为采样时段内气象站处的平均风速和风向,风向以正北方向为0°,顺时针表示.7-9月份水温在30℃左右,之后逐渐降低,一直到3月份缓慢上升,6月平均水温为25.0℃.各采样时段内的pH值相近,均在8.0左右.平均风速为1.5~4.0m/s.风向主要表现为季风变化,7、8月份以东南风为主,9、10月大部分时间都受东北风的影响,11月至次年3月则主要为西北风,之后又逐渐受东南风影响.
| 表 1 太湖贡湖湾、梅梁湾不同月份主要气象因子及pH的变化 Tab.1 Meteorological factors and pH in different months in Gonghu Bay and Meiliang Bay of Lake Taihu |
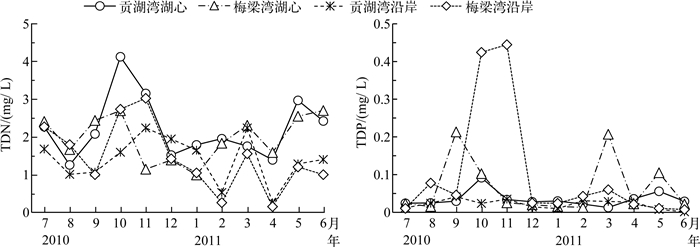
将2个湖湾以湖心及沿岸进行区域划分,分为4个区域,即贡湖湾湖心及沿岸、梅梁湾湖心及沿岸.对各区域进行统计分析,得到贡湖湾及梅梁湾湖心及沿岸区域水体TDN和TDP的平均浓度(图 2).结果表明,梅梁湾水体中TDP平均浓度均比贡湖湾高,而不同湖湾水体的TDN平均浓度没有明显的规律,同一湖湾不同区域间的TDN、TDP平均浓度规律性也不明显.
|
图 2 太湖贡湖湾和梅梁湾不同区域水体TDN和TDP的平均浓度 Fig.2 Average concentrations of TDN and TDP in different areas in Gonghu Bay and Meiliang Bay of Lake Taihu |
从贡湖湾和梅梁湾的微囊藻平均细胞丰度及各微囊藻种类的比例构成(图 3)可以看出,7-11月间,微囊藻平均细胞丰度较高,种类构成较丰富,各种微囊藻间存在明显的演替过程,表现为7月份以鱼害微囊藻为主,8-9月惠氏微囊藻占优势,期间铜绿微囊藻所占比例不断增加并于10-11月占优势;12月以后铜绿微囊藻及惠氏微囊藻迅速减少,鱼害微囊藻恢复优势地位;而次年1-4月水体中微囊藻较少,仅存在一些粒径较小且难以区分形态的其它微囊藻,5-6月鱼害微囊藻出现并逐渐增加.为探讨各微囊藻群落的空间分布差异性,将2个湖湾按湖心及沿岸区域进行划分,统计同一区域中各微囊藻群落的变化过程(图 4).在4个不同区域中都存在明显的微囊藻群落的演替过程,且变化过程与2个湖湾整体的统计结果类似.尽管4个不同区域内微囊藻群落的分布存在一些差异,但是较为随机,并无明显规律.

|
图 3 太湖贡湖湾和梅梁湾微囊藻群落的季节演替及平均细胞丰度的变化 Fig.3 Seasonal succession and average cell abundance of Microcystis colonies in Gonghu Bay and Meiliang Bay of Lake Taihu |

|
图 4 太湖贡湖湾和梅梁湾不同区域微囊藻群落的季节演替 Fig.4 Seasonal succession of Microcystis colonies in different areas in Gonghu Bay and Meiliang Bay of Lake Taihu |
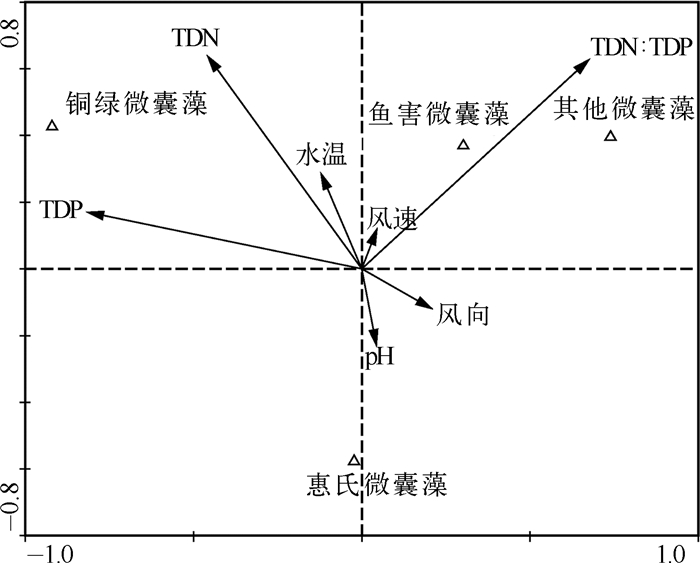
对不同种微囊藻细胞丰度与各环境因子进行CCA分析,结果见表 2.TDN(P=0.017)、TDP浓度(P<0.001)与铜绿微囊藻细胞丰度呈显著正相关,而与惠氏微囊藻、鱼害微囊藻及其他微囊藻细胞丰度并没有显著相关性(图 5).惠氏微囊藻多出现在pH值较高的情况下,而鱼害微囊藻及其他微囊藻则正好相反.水温、TDN : TDP与铜绿微囊藻细胞丰度间的相关性并不明显.风速与风向对微囊藻不同种间分布的影响较为显著.
|
图 5 环境因子与不同种类微囊藻细胞丰度关系的CCA结果 Fig.5 CCA analysis between environmental factors and cell abundance of different Microcystis colonies |
| 表 2 CCA分析前两轴的统计特征 Tab.2 Statistics characteristics of the first two axes of CCA |
蒙特卡罗检验结果显示,显著影响微囊藻不同种间分布的主要环境因子有TDN : TDP(P=0.002<0.01,F=24.60)、TDP浓度(P=0.002<0.01,F=18.72)、水温(P=0.002<0.01,F=11.74)、pH值(P=0.002<0.01,F=8.99)、TDN浓度(P=0.032<0.05,F=3.11)、风速(P=0.044<0.05,F=3.05)、风向(P=0.046<0.05,F=2.62).其中TDN : TDP、TDP浓度和水温对微囊藻种间分布的解释率高达83 %.
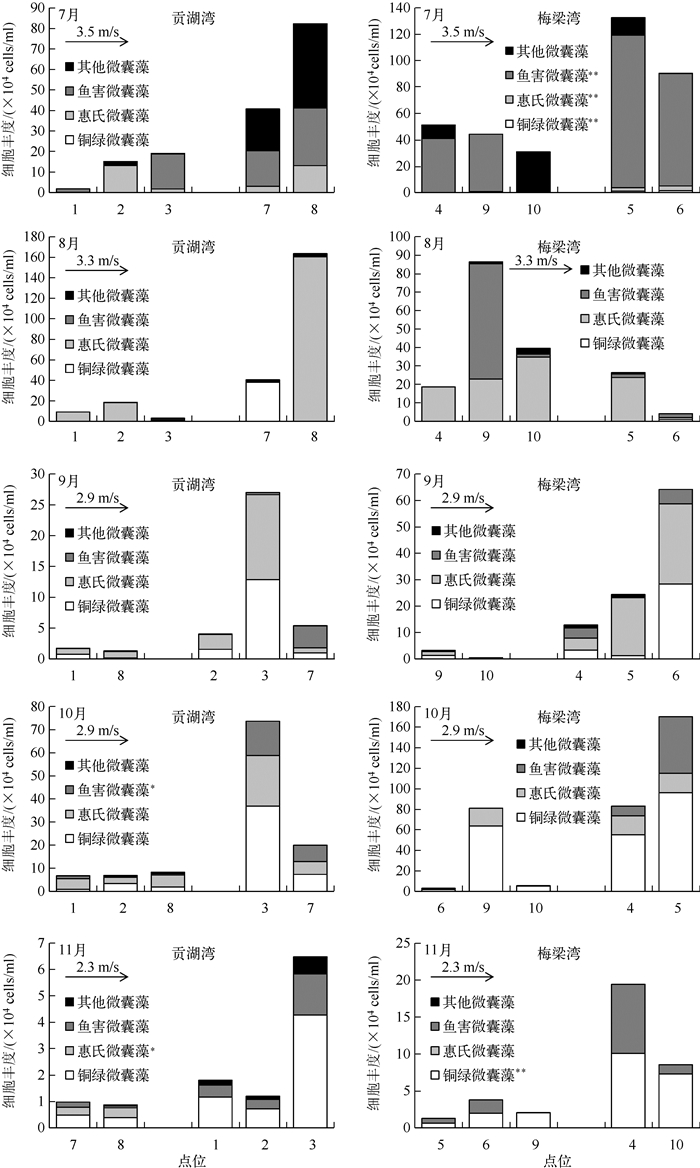
2.4 微囊藻细胞丰度及群落的空间分布7-11月太湖两个湖湾微囊藻的细胞丰度较大,种类构成更为丰富(图 3),因此以该时段内的微囊藻群落构成为研究对象,分析各区域微囊藻群落分布(图 4)产生差异的原因.图 6为7-11月两个湖湾中各样点不同种类微囊藻细胞丰度的变化情况,将各样点沿着风向进行排列可以看出,各样点的细胞丰度大小受风的影响十分明显,位于下风向的各样点细胞丰度明显高于位于上风向的各样点.且经过单项方差分析发现,7月份梅梁湾水体中铜绿微囊藻、惠氏微囊藻及鱼害微囊藻受到风向的影响极显著(P<0.01),10月份贡湖湾水体中的鱼害微囊藻与风向之间呈显著相关(P<0.05),而11月份贡湖湾及梅梁湾水体中分别为惠氏微囊藻(P<0.05)及铜绿微囊藻(P<0.01)受风向影响显著.
|
图 6 太湖贡湖湾和梅梁湾微囊藻群落的空间分布及其与风的关系 (*表示P<0.05, * *表示P<0.01) Fig.6 Spatial distribution of Microcystis colonies and the relationship with wind in Gonghu Bay and Meiliang Bay of Lake Taihu |
从图 6可以看出,铜绿微囊藻和惠氏微囊藻较鱼害微囊藻和其它微囊藻更易受到风的影响而发生迁移,对四者的平均粒径进行比较(图 7)可以看出,太湖两个湖湾中铜绿微囊藻、惠氏微囊藻、鱼害微囊藻及其它微囊藻粒径大小规律一致:铜绿微囊藻群体的平均粒径最大,接近1000μm;惠氏微囊藻的粒径次之,但平均粒径基本在500 μm以上;鱼害微囊藻粒径较小,但在7月份其粒径与铜绿微囊藻及惠氏微囊藻的相近;而其它微囊藻的平均粒径最小,基本在100~300μm之间.
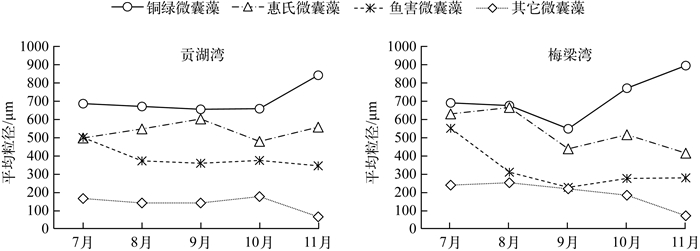
|
图 7 太湖贡湖湾和梅梁湾不同微囊藻群体的平均粒径 Fig.7 The mean size of colonies of different Microcystis species in Gonghu Bay and Meiliang Bay of Lake Taihu |
2010年7月至2011年6月间,太湖贡湖湾和梅梁湾内存在明显的微囊藻群落演替现象.在7-11月间,太湖梅梁湾及贡湖湾微囊藻种类构成丰富,以鱼害微囊藻、惠氏微囊藻及铜绿微囊藻为主,且整体上都表现为鱼害微囊藻、惠氏微囊藻及铜绿微囊藻顺次成为优势种的演替过程(图 3、4);12月以后种类构成单一,以鱼害微囊藻和其它微囊藻为主.这与Park等[4]对日本诹访湖、Yamamoto等[6]对Hirosawa-no-ike Pond和贾晓会等[7]对巢湖调查得到的规律相近.
氮、磷浓度是影响浮游植物生长的重要环境因子[20].本研究通过CCA分析发现,铜绿微囊藻出现在TDN和TDP浓度较高的环境中,而惠氏微囊藻与两者的相关性并不显著.TDN : TDP与铜绿微囊藻和惠氏微囊藻丰度间的相关性并不明显,与鱼害微囊藻(P<0.05)及其它微囊藻(P=0.01)丰度呈正相关,这可能是由不同微囊藻对营养盐的需求不同所导致的.不同种微囊藻与TDN浓度、TDP浓度、TDN : TDP等的相关性存在差别,也可能导致微囊藻的季节演替.但是不同湖泊中上述营养盐浓度相差较大,如中国的巢湖和太湖营养盐浓度较高,而日本的诹访湖等湖泊营养盐浓度要低很多.然而,湖泊中微囊藻种的演替规律却十分相似.Honma等[21]对日本琵琶湖的微囊藻群落组成进行研究,发现N、P浓度对微囊藻组成有所影响,但对演替过程的影响却不明显.可见,营养盐的差异不能解释多数湖泊中不同种微囊藻的季节演替现象.此外,尽管CCA结果显示pH值与不同微囊藻间相关性差异较大,但由于湖泊中pH值的变化范围很小,基本上可以排除其作为不同种微囊藻间演替的驱动因子的可能.
Imai等[12]认为温度是微囊藻属各种类发生演替的驱动因子,铜绿微囊藻适于在较高水温中生长,而惠氏微囊藻则在较低水温中生长得更好.Ohkubo等[22]对霞浦湖的调查也发现,铜绿微囊藻细胞丰度与水温之间存在明显的相关性.本研究通过CCA分析发现,水温与铜绿微囊藻细胞丰度呈正相关(P>0.05),而与惠氏微囊藻(P=0.071)及鱼害微囊藻(P=0.031)细胞丰度呈负相关,这与他们的结论一致.这可能是因为相比于惠氏微囊藻,铜绿微囊藻在高温环境中更易增殖生长.而野外观察发现,在温度较低的冬季及初春水体中以鱼害微囊藻和其它微囊藻为主.因此,温度可能是驱动太湖微囊藻季节演替的重要因素.
不同区域微囊藻群体的种类组成存在差异.Otten等[11]发现太湖湖心区域以惠氏微囊藻和水华微囊藻为主,而岸边以铜绿微囊藻为主.Wu等[23]分析了太湖微囊藻的水平迁移,指出太湖微囊藻的水平迁移主要是由风引起的表层迁移.本研究结果表明,受风的影响微囊藻存在空间上的迁移,位于下风向样点的细胞丰度明显高于位于上风向的样点.且通过单项方差分析发现,铜绿微囊藻和惠氏微囊藻更易受到风的影响而发生迁移.铜绿微囊藻、惠氏微囊藻、鱼害微囊藻以及其它微囊藻的群体粒径大小存在明显的规律性,铜绿微囊藻和惠氏微囊藻的群体粒径较大,而鱼害微囊藻及其它微囊藻的群体粒径较小.而Zhu等[24]指出大粒径的惠氏微囊藻和铜绿微囊藻群体更容易漂浮在表层.由此可见,本研究中下风向样点惠氏微囊藻和铜绿微囊藻生物量较高是因为它们易于漂浮在表层而通过表层迁移聚集于下风向处.
| [1] |
Prescott GW. Objectionable algae with reference to the killing of fish and other animals. Hydrobiologia, 1948, 1(1): 1-13. |
| [2] |
Paerl HW, Fulton RS, Moisander PH et al. Harmful freshwater algal blooms, with an emphasis on cyanobacteria. The Scientific World Journal, 2001, 1: 76-113. DOI:10.1100/tsw.2001.138 |
| [3] |
Sivonen K, Jones GG. Toxic cyanobacteria in water: a guide to their public health consequence, monitoring and management. London: E and FN Spon, 1999, 41-111.
|
| [4] |
Park HD, Watanabe MF, Harada KI et al. Seasonal variations of Microcystis species and toxic heptapeptide microcystins in Lake Suwa. Environmental Toxicology and Water Quality, 1993, 8(4): 425-435. DOI:10.1002/(ISSN)1098-2256 |
| [5] |
Ozawa K, Fujioka H, Muranaka M et al. Spatial distribution and temporal variation of Microcystis species composition and microcystin concentration in Lake Biwa. Environmental Toxicology, 2005, 20(3): 270-276. DOI:10.1002/(ISSN)1522-7278 |
| [6] |
Yamamoto Y, Nakahara H. Seasonal variations in the morphology of bloom-forming cyanobacteria in a eutrophic pond. Limnology, 2009, 10(3): 185-193. DOI:10.1007/s10201-009-0270-z |
| [7] |
贾晓会, 施定基, 史绵红等. 巢湖蓝藻水华形成原因探索及"优势种光合假说". 生态学报, 2011, 31(11): 2968-2977. |
| [8] |
陈宇炜, 高锡云. 太湖梅梁湾浮游植物动态及其初级生产力周年变化的研究. 见: 蔡启铭编. 太湖环境生态研究. 北京: 气象出版社, 1998: 98-108.
|
| [9] |
谭啸, 孔繁翔, 曾庆飞等. 太湖中微囊藻群落的季节变化分析. 生态与农村环境学报, 2009, 25(1): 47-52. |
| [10] |
Li M, Zhu W, Gao L et al. Seasonal variations of morphospecies composition and colony size of Microcystis in a shallow hypertrophic lake(Lake Taihu, China). Fresenius Environmental Bulletin, 2013, 22(12): 3474-3483. |
| [11] |
Otten TG, Paerl HW. Phylogenetic inference of colony isolates comprising seasonal Microcystis blooms in Lake Taihu, China. Microbial Ecology, 2011, 62: 907-918. DOI:10.1007/s00248-011-9884-x |
| [12] |
Imai H, Chang KH, Kusaba M et al. Temperature-dependent dominance of Microcystis(Cyanophyceae) species: M. aeruginosa and M. wesenbergii. Journal of Plankton Research, 2009, 31(2): 171-178. |
| [13] |
Amemiya Y, Okino T, Nakayama O. Factors possibly affecting dominance of Microcystis species. Janpanese Journal of Limnology, 1990, 51(1): 9-13. DOI:10.3739/rikusui.51.9 |
| [14] |
Xing W, Huang WM, Li DH et al. Effects of iron on growth, pigment content, photosystem Ⅱ efficiency, and siderophores production of Microcystis aeruginosa and Microcystis wesenbergii. Current microbiology, 2007, 55(2): 94-98. DOI:10.1007/s00284-006-0470-2 |
| [15] |
Davis TW, Berry DL, Boyer GL et al. The effects of temperature and nutrients on the growth and dynamics of toxic and non-toxic strains of Microcystis during cyanobacteria blooms. Harmful Algae, 2009, 8(5): 715-725. DOI:10.1016/j.hal.2009.02.004 |
| [16] |
金相灿, 屠清瑛. 湖泊富营养化调查规范. 北京: 中国环境科学出版社, 1990, 160-185.
|
| [17] |
虞功亮, 宋立荣, 李仁辉. 中国淡水微囊藻属常见种类的分类学讨论——以滇池为例. 植物分类学报, 2007, 45(5): 727-741. |
| [18] |
Watanabe MM. Isolation, cultivation and classification of bloom-forming Microcystis in Japan. In: Watanabe MF, Harada K, Carmichael WW et al eds. Toxic Microcystis. Boca Raton, FL: CRC Press, 1996: 13-34.
|
| [19] |
Joung S, Kim C, Ahn C et al. Simple method for a cell count of the colonial cyanobacterium, Microcystis sp.. The Journal of Microbiology, 2006, 44(5): 562-565. |
| [20] |
Elser JJ, Marzolf ER, Goldman CR. Phosphorus and nitrogen limitation of phytoplankton growth in the freshwaters of north America: a review and critique of experimental enrichments. Canadian Journal of Fisheries and Aquatic Sciences, 1990, 47(7): 1468-1477. DOI:10.1139/f90-165 |
| [21] |
Honma T, Park HD. Influences of nitrate and phosphate concentrations on Microcystis species composition and microcystin concentration in Lake Suwa. Journal of Japan Society on Water Environment, 2005, 28(6): 373-378. DOI:10.2965/jswe.28.373 |
| [22] |
Ohkubo N, Yagi O, Okada M. Studies on the succession of blue-green algae, Microcystis, Anabaena, Oscillatoria and Phormidium in Lake Kasumigaura. Environmental Technology, 1993, 14(5): 433-442. DOI:10.1080/09593339309385311 |
| [23] |
Wu XD, Kong FX, Chen YW et al. Horizontal distribution and transport processes of bloom-forming Microcystis in a large shallow lake(Taihu, China). Limnologica, 2010, 40(1): 8-15. DOI:10.1016/j.limno.2009.02.001 |
| [24] |
Zhu W, Li M, Luo YG et al. Vertical distribution of Microcystis colony size in Lake Taihu: Its role in algal blooms. Journal of Great Lakes Research, 2014, 40: 949-955. DOI:10.1016/j.jglr.2014.09.009 |
 2015, Vol. 27
2015, Vol. 27 
