(2: 流域水资源与生态环境科学湖北省重点实验室,武汉 430010)
(2: Hubei Provincial Key Laboratory of River Basin Water Resources and Eco-environmental Sciences, Wuhan 430010, P.R.China)
蓝藻水华治理是当今国内外正在探索的难题[1].电化学法作为一种高效友好的水处理技术,用于杀灭和抑制水中的藻类已有较多研究[2].当采用微小电流进行电解抑藻时能量消耗低,对水中其它组分影响小,也能获得很好的抑藻效果.笔者前期在微电流电解对铜绿微囊藻的抑制效能方面开展了部分研究,发现微电流电解对铜绿微囊藻(Microcystis aeruginosa)具有良好的杀灭和持续抑制效果[3].关于微电流电解对藻的作用机理国内外学者做了一些探索,已有的研究重点是从电化学本身的作用(包括阳极电氧化和电化学产生的氧化剂等)和电解后藻细胞表面形态结构的表征等方面开展研究,关于电解对藻类光合特性的影响还极少有报道.现有绝大多数研究认为细胞死亡是阳极电氧化或者是电化学产生的氧化剂造成的[2].电化学处理过程中,水和氯离子在阳极电解时会产生OH·或活性氯(包括OCl-、HClO和Cl2),这些氧化剂有着极强的氧化电位,对藻类有着很强的抑制能力[4].但电氧化或者电化学产生的氧化剂对藻细胞的损伤机制究竟如何,目前还很少有研究.
叶绿素荧光分析技术是一种以光合作用理论为基础、利用叶绿素作为天然探针、研究植物的光合特性及外界因子所带来影响的测定技术,是研究光合作用的良好方法.[5]叶绿素荧光参数与光合作用各种反应紧密相关,利用叶绿素荧光法可以快速、灵敏、无损伤地探测逆境对高等植物和藻类光合作用的影响[6].目前,应用叶绿素荧光技术研究低温[7]、干旱[8]、水体泥沙[9]、紫外光[10]、有毒污染物[11]等外界环境条件对高等植物和藻类的胁迫已有较多报道,而尚未见将叶绿素荧光技术应用于电解对藻类光合特性影响的研究.
本文选用铜绿微囊藻作为研究对象,测定电解时不同电流密度下铜绿微囊藻的叶绿素荧光参数变化,由此分析微电流电解对其光合特性的影响,从藻类生理生态特征方面揭示微电流电解对藻类的抑制机理.
1 材料与方法 1.1 实验设计实验装置为体积100ml的烧杯,采用板状电极材料,电极有效工作面积为2.5 cm×5.5 cm,极板间距4 cm.采用的极水比(即阳极工作面积与藻液体积之比)约为0.14.电解过程中采用磁力搅拌器对藻液进行匀速搅拌.采用直流稳压电源(30 V/5A)供电,通过调节直流稳压电源使电化学反应在一定电流密度下进行.室温控制在20℃左右.实验所用的玻璃容器使用前均经高压灭菌处理.
1.2 实验对象实验所用的铜绿微囊藻购自中国科学院水生生物研究所,编号为FACHB-905.藻液采用BG-11培养基,在光照培养箱中培养,培养条件为:25℃,光照强度为2000 lx,光暗比为14 h:10 h.将铜绿微囊藻培养至对数生长期后开始实验.
1.3 实验过程将培养至对数生长期的铜绿微囊藻接种于BG-11培养基中,分别配制5×105 cells/ml(OD680为0.026)、1×106 cells/ml(OD680为0.058)和5×106 cells/ml(OD680为0.272)初始细胞密度的藻液.取100ml藻液倒入反应器中,采用不同电流密度(6、8、10、12、14、18 mA/cm2)对藻液进行电解处理.根据笔者前期研究,当电解时间达到15~20 min时微电流电解即可产生较好的抑藻效果[3],本研究将电解时间控制在15 min.
电解处理结束后,将藻液放置20 min后进行取样分析,将测定结果标记为第0 d的结果.将电解组和对照组的藻液转入灭过菌的100ml三角瓶中,放入光照培养箱中培养,对培养至第0、2、4、6和8 d的藻液进行取样,测定藻液的光密度OD680、叶绿素a浓度和叶绿素荧光值.
1.4 实验方法铜绿微囊藻细胞密度采用血球计数板在普通光学显微镜(44X3A型)下计数,光密度OD680采用紫外可见分光光度计(Lambda 25型)进行测定[3].叶绿素a浓度的测定按照文献[12]进行,OD680和叶绿素a浓度用来表征藻细胞的生物量.
叶绿素荧光参数采用Multi-Color-PAM多激发波长调制叶绿素荧光仪(德国Walz公司)进行测定.测定前先将藻液暗适应5 min.通过叶绿素荧光仪直接读数,获得光系统Ⅱ的最大光化学量子产量Fv/Fm、光系统Ⅱ有效光学量子产量Y(Ⅱ)、光系统Ⅱ处非调节性能量耗散的量子产量Y(NO)、光合电子传递速率ETR、光化学淬灭系数qL及初始荧光Fo.
1.5 数据分析实验结果采用单因素方差分析法(One-way ANOVA)对不同电流密度下铜绿微囊藻的叶绿素荧光参数的差异显著性进行分析,显著水平设为P<0.05.
2 结果与分析 2.1 临界电流密度研究研究者通常认为当湖泊等水体中的蓝藻细胞密度达到1×105 cells/ml以上时,即已暴发蓝藻水华[13].因此,本研究选择5×105、1×106和5×106 cells/ml初始藻细胞密度的藻液,研究不同初始细胞密度下微电流电解对铜绿微囊藻生长的抑制效果.对于初始细胞密度不同的铜绿微囊藻藻液(藻液体积一定),微电流电解抑藻时存在相应的临界电流密度阈值,当电解所采用的电流密度≥阈值时,藻的生长能够得到完全抑制,且随着初始藻细胞密度的增加,临界电流密度值逐渐增大.对于初始细胞密度为5×105、1×106和5×106 cells/ml的铜绿微囊藻藻液(藻液体积为100ml),微电流电解抑藻的临界电流密度阈值分别为10、14和22 mA/cm2(图 1).

|
图 1 初始藻细胞密度为5×105 cells/ml(a、b)、1×106 cells/ml(c、d)和5×106 cells/ml(e、f)时不同电流密度下的微电流电解抑藻效果(图中虚线表示临界电流密度分界线) Fig.1 OD680 and chlorophyll-a concentrations of algal solutions at different current densities at 5×105 cells/ml(a, b), 1×106 cells/ml(c, d) and 5×106 cells/ml(e, f) initial cell densities (The dashed lines denote the observed boundary of threshold of current density) |
对藻细胞的生长曲线进行分析(以图 1a、b为例),可以看出当电流密度低于临界电流密度阈值时(6、8 mA/cm2),藻液的OD680和叶绿素a浓度在电解刚结束后略有降低,在电解结束后培养的第4 d开始大幅上升,说明前期藻细胞在电解作用下产生了一定损伤,而部分藻细胞在后期实现了自我修复,又恢复活性.当电流密度≥临界值时(10、12、14、18 mA/cm2),藻液的OD680和叶绿素a浓度在培养的前8 d内均呈逐渐下降的趋势,表明因电解受损的藻细胞在后期无法实现自我修复,全部失去了活性.
2.2 叶绿素荧光参数变化活体叶绿素荧光是光合作用的有效探针,可提供光系统Ⅱ的状态信息[14].光系统Ⅱ对于藻类的生理功能极其重要,光系统Ⅱ的损伤通常是藻细胞受到损害的直接表现[14].通过叶绿素荧光仪测得的荧光动力学参数能够灵敏地反映藻细胞当前的光合作用状况,间接反映藻细胞的生理状态.本节以初始细胞密度为5×105 cells/ml的铜绿微囊藻液为对象,分析微电流电解处理后不同电流密度下藻细胞的叶绿素荧光参数变化,通过叶绿素荧光参数变化间接揭示电解对藻细胞的损伤机制.
2.2.1 Fv/Fm的变化Fv/Fm是暗适应后的光系统Ⅱ最大量子产量[15],代表开放的光系统Ⅱ反应中心捕获激发能的效率,能有效地反映光系统Ⅱ的功能状态.当受到胁迫时,藻液的Fv/Fm显著下降. Fv/Fm可作为研究各种环境胁迫对光合作用影响的重要指标.本实验测得的对照组Fv/Fm值在第0~8 d一直保持在0.45左右,较为稳定(图 2a).
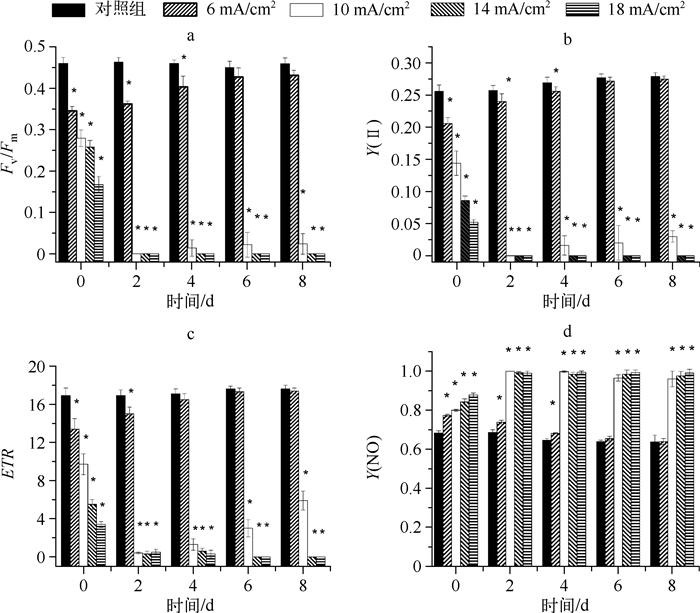
|
图 2 初始藻细胞密度为5×105cells/ml时不同电流密度下铜绿微囊藻叶绿素荧光参数的变化 (数据以5次平行实验的平均值表示,*表示在P<0.05水平下差异显著) Fig.2 Chlorophyll fluorescence parameters variation of the culture Microcystis aeruginosa at 5×105 cells/ml initial cell density(n=5, symbol * indicates significant differences at P < 0.05) |
电流密度为6 mA/cm2(小于临界电流密度值)的电解组在第0 d(即电解刚结束)时,藻细胞的Fv/Fm值与对照组相比显著降低(P<0.05),表明藻细胞受到电解作用的胁迫,光系统Ⅱ受到损伤;但Fv/Fm值仅下降了25.0 %,降低幅度不大,表明藻细胞光系统Ⅱ依然保持了相对较高的活性.在培养的第2~8 d,该电解组的Fv/Fm值随时间逐渐升高,从第6 d开始,电解组Fv/Fm值与对照组基本相同,两者间无显著差异(P>0.05)(图 2a).这表明6 mA/cm2电流密度下电解产生的胁迫未超过铜绿微囊藻的耐受能力,自第6 d起,藻细胞的光系统Ⅱ已经完全恢复,藻的生理活性回到正常水平.
电流密度为10、14和18 mA/cm2(≥临界电流密度值)的电解组在电解刚结束时,藻细胞的Fv/Fm值显著下降,分别降低了40.0 %、43.9 %和63.7 %,电解组和对照组之间存在显著差异(P<0.05),表明藻细胞受到了电解作用的胁迫,藻细胞光系统Ⅱ受损较为严重;从培养的第2 d开始,此3个电解组藻细胞的Fv/Fm均降低至趋于0(图 2a),Fv/Fm值反映了光系统Ⅱ最大光能转换效率,值为0表明藻细胞光系统Ⅱ的功能已完全丧失[16].
2.2.2 Y(Ⅱ)和ETR的变化Y(Ⅱ)是光适应下的光系统Ⅱ实际量子产量,反映光系统Ⅱ线性电子传递效率或光能捕获的效率. ETR代表光合电子传递效率,表征实际光合效率,即反映藻类用于光合电子传递的能量占所吸收能量的比例,是光系统Ⅱ反应中心关闭时的效率.不同电流密度作用下,藻液在培养第0~8 d内,Y(Ⅱ)和ETR的变化趋势与Fv/Fm值较为一致(图 2b、2c).李卓娜等[17]报道当藻类受到逆境胁迫时,Fv/Fm、Y(Ⅱ)和ETR值均会降低,本研究与其结论一致.当电流密度低于临界值(6 mA/cm2)时,Y(Ⅱ)和ETR从第2 d起逐渐上升,分别在第6 d和第4 d时恢复到与对照组相同的水平.而当电流密度≥临界电流密度时(10、14、18 mA/cm2),藻液的Y(Ⅱ)和ETR值从第2 d开始均降至趋于0.
2.2.3 Y(NO)的变化Y(NO)是指光系统Ⅱ处非调节性能量耗散的量子产量,是判断光损伤的重要指标.若Y(NO)较高,表明光化学能量转换和保护性的调节机制(如热耗散)不足以将藻类吸收的光能完全消耗掉,即入射光强超过了藻类能接受的程度,此时藻类已经受到损伤.从图 2d可以看出,电解刚结束时,4个电解组的Y(NO)值均大于对照组,且存在显著差异(P<0.05),表明电解组的藻细胞受到严重损伤.电流密度为6 mA/cm2的电解组在电解后0~6 d,Y(NO)值逐渐降低,表明藻细胞受到的损伤得以恢复,至第6 d时,与对照组的Y(NO)值无显著差异(P>0.05),表明该电解组藻细胞的光系统Ⅱ恢复正常.而电流密度≥10 mA/cm2的所有电解组,Y(NO)值从培养的第2 d起均升至接近1,表明藻细胞受到了不可逆转的损伤.
2.2.4 qL的变化qL反映的是由光合作用引起的荧光淬灭(光化学淬灭),可反映原初电子受体QA的还原状态.qL越大,光系统Ⅱ的电子传递活性越强.qL可反映植物和藻类光合活性的高低.
电流密度为6 mA/cm2时,电解刚结束后藻液qL值与对照组相比变化不显著(P>0.05),≥10 mA/cm2处理组的qL值显著低于对照组的(P<0.05)(表 1),说明电解使藻细胞光系统Ⅱ系统活性受到严重影响,且随着电流密度增大,光系统Ⅱ所受的损伤越来越严重.
| 表 1 电解刚结束时(第0 d)不同电流密度下铜绿微囊藻qL和Fo的变化*(初始藻细胞密度为5×105cells/ml) Tab.1 qL and Fo variations of Microcystis aeruginosa at different current densities after electrochemical treatment (initial cell density is 5×105 cells/ml) |
Fo是藻细胞的初始荧光[16].不同电流密度对Fo的影响趋势与qL较为一致(表 1).电流密度为6 mA/cm2时,电解后藻液的Fo与对照组相比无显著性差异(P>0.05);电流密度≥10 mA/cm2时,各处理组的Fo与对照组存在显著差异(P<0.05),且随着电流密度的上升Fo逐渐增大. Yamasaki等[18]和Inoue等[19]通过一系列研究表明,Fo值的增加可以反映高等植物和藻类捕光天线与光系统Ⅱ中心体之间发生了不可逆转的分离,以及光系统Ⅱ的部分反应中心发生了损伤.藻胆体是蓝藻的捕光系统,蓝藻细胞中的藻胆体与光系统Ⅱ相连接,是光系统Ⅱ的捕光天线,可以吸收460~670 nm范围内的光,吸收的激发能量以接近100 %的量子效率传到光合反应膜的中心体上进行光合作用[20-21].对于铜绿微囊藻而言,Fo的增加表明藻胆体与光系统Ⅱ反应中心之间发生了不可逆转的分离,同时也反映光系统Ⅱ的部分反应中心发生了损伤.电解后随着电流密度的上升藻细胞Fo逐渐增大,表明电流密度>10 mA/cm2(即大于临界电流密度)的电解作用会导致藻细胞光系统Ⅱ与藻胆体之间的连接受到破坏,且电流密度越大,二者之间的连接被破坏得越严重,由此将导致二者之间的能量传递受阻.
Xu等[4]通过藻液的紫外-可见光谱和荧光放射光谱分析,推测电解改变或者破坏了铜绿微囊藻中藻蓝蛋白和叶绿素a的结构,或者摧毁了二者之间的能量传递.藻蓝蛋白是藻胆体的一部分,藻蓝蛋白受到破坏意味着藻胆体的损伤,本研究得出的结论与其基本一致.本文通过对电解前后藻液的叶绿素荧光参数进行分析,证实了电解抑制铜绿微囊藻的生长,一方面是通过电解破坏藻细胞光系统Ⅱ和捕光天线藻胆体之间的连接,使藻胆体无法继续向光系统Ⅱ传递光能;另一方面是通过电解破坏藻细胞光系统Ⅱ结构,使光系统Ⅱ无法进行光合作用,最终导致藻细胞的死亡.
3 结论本文研究了微电流电解时不同电流密度下铜绿微囊藻的叶绿素荧光参数变化,从藻类生理生态特征方面揭示了电解抑藻的作用机理.主要研究结论如下:
1) 当藻液体积一定时,对于初始细胞密度不同的铜绿微囊藻藻液,微电流电解抑藻存在相应的临界电流密度阈值,当电解时所采用的电流密度≥阈值时,藻的生长能够得到完全抑制.且随着初始藻细胞密度的增加,临界电流密度值逐渐增大.对于初始细胞密度为5×105、1×106和5×106cells/ml的铜绿微囊藻液(藻液体积为100ml),微电流电解抑藻的临界电流密度阈值分别为10、14和22 mA/cm2.
2) 当电解电流密度<临界电流密度时,藻的光系统Ⅱ受损,但电解对铜绿微囊藻细胞的胁迫未超过藻的耐受能力,经过6 d的培养藻的生理活性可恢复正常.若电流密度>临界值,电解胁迫超过藻的耐受能力,从培养的第2 d开始藻的光系统Ⅱ功能完全丧失,藻细胞因受到不可逆转的损伤而无法继续生长繁殖.电解抑藻一方面是通过破坏光系统Ⅱ和捕光天线藻胆体之间的连接,使藻胆体无法继续向光系统Ⅱ传递光能;另一方面是通过破坏藻细胞光系统Ⅱ结构,使其无法进行光合作用,最终导致藻细胞的死亡.
致谢: 感谢上海泽泉科技有限公司吕中贤先生对叶绿素荧光参数分析提供的帮助!| [1] |
张晓峰, 孔繁翔, 曹焕生等. 太湖梅梁湾水华蓝藻复苏过程的研究. 应用生态学报, 2005, 16(7): 1346-1350. |
| [2] |
Liang WY, Qu JH, Chen LB et al. Inactivation of Microcystis aeruginosa by continuous electrochemical cycling process in tube using Ti/RuO2 electrodes. Environment Science & Technology, 2005, 39(12): 4633-4639. |
| [3] |
林莉, 李青云, 黄茁等. 微电流电解对铜绿微囊藻的持续抑制研究. 华中科技大学学报:自然科学版, 2012, 40(10): 87-90. |
| [4] |
Xu Y, Yang J, Ou M et al. Study of Microcystis aeruginosa inhibition by electrochemical method. Biochemical Engineering Journal, 2007, 36(3): 215-220. DOI:10.1016/j.bej.2007.02.022 |
| [5] |
梁英, 冯力霞, 尹翠玲等. 叶绿素荧光技术在微藻环境胁迫研究中的应用现状及前景. 海洋科学, 2007, 31(1): 71-76. |
| [6] |
王大平, 曾明, 朱钧等. 绿斑病藻寄生对夏橙叶片光合作用特性的影响. 应用生态学报, 2006, 17(6): 1141-1144. |
| [7] |
Rizza F, Pagani D, Stanca AM et al. Use of chlorophyll fluorescence to evaluate the cold acclimation and freezing tolerance of winter and spring oats. Plant Breeding, 2001, 120(5): 389-396. DOI:10.1046/j.1439-0523.2001.00635.x |
| [8] |
Massacci A, Nabiev SM, Pietrosanti L et al. Response of the photosynthetic apparatus of cotton(Gossypium hirsutum) to the onset of drought stress under field conditions studied by gas-exchange analysis and chlorophyll fluorescence imaging. Plant Physiology and Biochemistry, 2008, 46(2): 189-195. DOI:10.1016/j.plaphy.2007.10.006 |
| [9] |
李强, 王国祥. 水体悬浮泥沙对黑藻生长和叶绿素荧光特性的影响. 应用生态学报, 2009, 20(9): 2499-2505. |
| [10] |
Heraud P, Beardall J. Changes in chlorophyll fluorescence during exposure of Dunaliella tertiolecta to UV radiation indicate a dynamic interaction between damage and repair processes. Photosynthesis Research, 2000, 63: 123-134. DOI:10.1023/A:1006319802047 |
| [11] |
Li Y, Li C, Zheng Y et al. Cadmium pollution enhanced ozone damage to winter wheat: biochemical and physiological evidences. Journal of Environmental Sciences, 2011, 23(2): 255-265. DOI:10.1016/S1001-0742(10)60400-7 |
| [12] |
国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法:第4版. 北京: 中国环境科学出版社, 2002, 670-671.
|
| [13] |
李颖, 施择, 张榆霞等. 关于用藻密度对蓝藻水华程度进行分级评价的方法和运用. 环境与可持续发展, 2014, 39(2): 67-68. |
| [14] |
韩志国, 雷腊梅, 韩博平. 利用调制荧光仪在线监测叶绿素荧光. 生态科学, 2005, 23(3): 246-249. |
| [15] |
宋玉芝, 蔡炜, 秦伯强. 太湖常见浮叶植物和沉水植物的光合荧光特性比较. 应用生态学报, 2009, 20(3): 569-573. |
| [16] |
张景平, 黄小平. 叶绿素荧光技术在海草生态学研究中的应用. 海洋环境科学, 2009, 28(6): 772-778. |
| [17] |
李卓娜, 孟范平, 赵顺顺等. 四溴联苯醚BDE-47对2种海洋微藻光合特性的影响. 中国环境科学, 2010, 30(2): 233-238. |
| [18] |
Yamasaki T, Yamakawa T, Yamane Y et al. Temperature acclimation of photosynthesis and related changes in photosystem Ⅱ electron transport in winter wheat. Plant Physiology, 2002, 128: 1087-1097. DOI:10.1104/pp.010919 |
| [19] |
Inoue N, Taira Y, Emi T et al. Acclimation to the growth temperature and the high-temperature effects on photosystem Ⅱ and plasma membranes in a mesophilic cyanobacterium, Synechocystis sp. PCC6803. Plant & Cell Physiology, 2001, 42(10): 1140-1148. |
| [20] |
马为民, 米华玲, 沈允刚. 一种观察藻胆体移动的光漂白后荧光恢复技术. 植物生理学通讯, 2008, 44(3): 536-538. |
| [21] |
王慧, 赵井泉, 蒋丽金. 77K下藻胆体模型复合物能量传递过程. 中国科学: B辑:化学, 2000, 30(4): 347-352. |
 2015, Vol. 27
2015, Vol. 27 
