微囊藻水华导致湖泊、水库等水体水质恶化.尽管氮、磷浓度增加导致水体富营养化是引起蓝藻水华的主要因素,但关于微囊藻水华的形成详细生态机制至今依然所知甚少[1-3].在天然水体中,微囊藻细胞被大量的多糖裹挟以群体的形态存在[4-5],其胶被上粘附着大量的细菌,这些细菌与藻细胞构成了一个独特的微环境.由于微囊藻生长繁殖迅速,水华发生过程伴随着细胞的死亡与新生,附生菌的代谢可对水环境中的营养再生和物质循环产生重要影响,直接或间接地影响水华蓝藻的生长[6-8].因此分析微囊藻附生菌的代谢能力对揭示水华形成的微环境以及微生物种群之间的生态联系意义重大.
已有报道发现附生的产碱性磷酸酶细菌有助于微囊藻磷营养的供给[9-12];也有研究发现产碳酸酐酶附生菌有助于微囊藻利用无机碳[13];对微囊藻附生菌氮代谢的研究发现硝化细菌能对铜绿微囊藻产生一定程度的抑制作用[14-15];同时也有不少研究表明一些溶藻菌能裂解藻细胞[16-19].但这些研究仅是讨论单一菌株对微囊藻细胞的生物效应,迄今对天然水华中微囊藻附生菌的总体微生物环境所知甚少.
微囊藻附生菌可利用藻代谢产生的有机物进行生长繁殖,同时细菌代谢产生的酶及其自身的代谢过程又可影响藻细胞的生长,弄清微囊藻细胞附生菌的产酶能力有助于评价这些菌对藻细胞微环境的影响.氮、磷是影响蓝藻生长最重要的营养元素,细胞死亡分解后物质的再利用也是藻生长的重要营养来源,本文从这两个方面出发,研究微囊藻水华中与藻细胞紧密粘附的附生菌的产酶能力,包括:对不同形态氮的代谢能力(蛋白酶、硝酸还原酶、脱氨氮能力)、将有机磷转化为无机磷的能力(碱性磷酸酶)以及有机物分解能力(脂酶),并通过藻和菌共培养,观察附生菌对微囊藻生长的影响,以期为揭示藻际微生物环境对藻生长的影响奠定基础.
1 材料与方法 1.1 微囊藻附生菌的分离与培养于2012年6-7月采集太湖(梅梁湾)、巢湖(十五里河桥)、南京秦淮河(集庆门)以及南京财经大学中心湖中的微囊藻水华样品,新鲜藻样以6000转/min离心5 min后,小心吸取1 ml漂浮的微囊藻群体,转入10 ml灭菌的BG-11培养液中,涡旋振荡器震荡洗涤5 min,6000转/min离心5 min后吸取漂浮藻群体,重复上述过程3次,以洗去游离细菌.最后取漂浮的藻体,加入等体积灭菌的石英砂,用涡旋振荡器振荡5~10 min,至显微镜检查群体完全分散,静置15 min,取上层清液100 μl涂布于LB培养基平板上[20],恒温培养箱中30℃培养2 d后,分别挑出菌落形态不同的菌株,经反复划线纯化后保存备用.
为避免LB培养基中其他有机成分对后续实验的干扰,后期的细菌扩大培养均采用添加葡萄糖的M9无机盐培养基[21],培养条件为37℃摇床培养12 h.收获细胞时用6000转/min离心5 min沉淀出细菌,用无菌生理盐水重新悬浮沉淀,重复洗涤菌体沉淀3次,最终用0.9%的生理盐水调成菌悬液,菌浓度约为2.0×107 cells /ml,用于菌藻共培养实验.
1.2 菌株产酶能力的测定 1.2.1 酪蛋白酶活力的测定配制酪蛋白琼脂固体培养基[22],用灭菌的牙签挑取菌落,接种到酪蛋白培养基平板上,37℃培养48 h,观察平板颜色变化.活性大小以透明圈直径(D)与菌落直径(d)的比值(D/d)表示.
1.2.2 氨氮脱除能力的测定制备氨氮唯一氮源液体培养基[23].取50 μl生理盐水菌悬液接入2 ml以氨氮(50 mg/L)为氮源的筛选培养基,设置3个平行样.于150转/min的摇床上,30℃下培养36 h,采用纳氏试剂法[24],96微孔板进行显色,用酶标仪测定OD420,通过NH4+-N的初始和最终浓度变化,测出各附生菌的相对氨氮脱除率.
1.2.3 硝酸还原酶活力的测定制备硝酸盐唯一氮源液体培养基[23].取上述细菌的生理盐水菌悬液50 μl接入2 ml以NO3--N(50 mg/L)为氮源的筛选培养基,每个处理分3个平行.于30℃,150转/min条件下摇床培养.使用N-(1-萘基)-乙二胺光度法[24],通过96微孔板进行显色,使用酶标仪测定OD540,比较标准曲线,最后得出NO2--N浓度,以期得到每个菌株的硝酸还原酶活性.
1.2.4 菌株产碱性磷酸酶(ALP)活力的测定采用96微孔板4-氨基安替比林显色[25],酶标仪测定每个微孔反应液吸光值的方法测定.
1.2.5 菌株产酯酶活力的测定制备油脂培养基平板[26].分别滴加5 μl各个菌株的菌悬液在平板上,在37℃条件下培养12 h,取出平板,观察各菌株分解脂肪的能力.
1.3 附生菌对微囊藻生长的影响藻种铜绿微囊藻(Microcystis aeruginosa XW01)由本实验室分离保存.采用BG-11培养基28±2℃、24 h连续光照培养,光照强度为60 μmol/(m2·s),培养期间震荡摇匀. 100 ml三角瓶中装20 ml藻培养液,每瓶加入100 μl的菌悬液(1.1节中所述的生理盐水菌悬液),每个处理设置3个平行.于25℃的光照培养室连续培养7 d,用分光光度计测定藻的生长状况(OD650).
1.4 菌株的分子鉴定运用16S rRNA基因全序列分析方法对附生菌进行鉴定.菌落PCR扩增选用通用引物[27],PCR产物委托南京思普金生物科技有限公司测序,获得序列通过BLAST与GenBank数据库中的序列进行比对分析(http://blast.ncbi.nlm.nih.gov/),运用MEGA5.0软件构建进化树,选择Kimura2-Parameter Distance模型计算进化距离,Neighbor-Joining法建树(1000次随机取样,bootstrap检验可靠性).
1.5 数据统计分析数据分析采用Excel软件,差异显著性采用SPSS软件进行分析,P < 0.05认为差异具有显著性.
2 结果 2.1 附生菌的分离培养从4个不同采样地点的微囊藻水华样品中共分离出34株紧密粘附的附生菌,其中从秦淮河样品中分离获得14株菌(编号为Q1~Q14),从南京财经大学中心湖样品中分离获得3株菌(编号N-1~N-3),从巢湖样品中分离获得6株菌(编号CH-1~CH-6),从太湖样品中获得11株菌(编号8-1~8-5,E-1~E-2,E2-1~E2-4).
2.2 附生菌与氮代谢相关的产酶能力 2.2.1 附生菌产酪蛋白酶能力经测定产蛋白酶的菌株共13株,占附生菌总数的38%(表 1).由此可见,微囊藻附生菌中,有相当数量的蛋白酶产生菌.
| 表 1 附生菌株的酪蛋白酶活力* Tab.1 Casease activities of the attached strains |
各菌株脱氨氮能力的测定结果(图 1)可见,共有31株菌可脱除氨氮,占附生菌总数的91%,其中氨氮脱除率达60%以上的菌占9%,氨氮脱除率达40%以上的菌占18%,氨氮脱除率达30%以上的菌占38%.表明总体上附生菌有较强的脱氨氮能力.

|
图 1 附生菌的氨氮脱除率 Fig.1 Elimination rate of NH3-N of the attached strains |
对比菌的生长量与氨氮的消除量可见,除8-2、8-4、Q-1、Q-11附生菌外,大多数具有相对高脱除氨氮能力的菌其菌浓度并不高(如CH-4、CH-5、CH-6、8-1),表明这些氨氮的脱除并非由于附生菌生长对氮营养的消耗,而是将氨氮转变成其他形态的氮.
2.2.3 附生菌硝酸还原酶活力从34株藻附生菌中仅分离得到1株有显著硝酸还原酶活力的菌(即E-1),经过16S rRNA基因比对表明该菌是弗氏柠檬酸杆菌(与Citrobacter freundii JXMR0908L1的相似性为100%).
2.3 附生菌碱性磷酸酶活力碱性磷酸酶可促进有机态磷转化为藻类可利用的无机态磷.从34株藻附生菌中分离出4株ALP产生菌,分别为Q-9、8-3、N-1、CH-5,占附生菌总数的12%,其中Q-9的ALP活力最高(图 2).
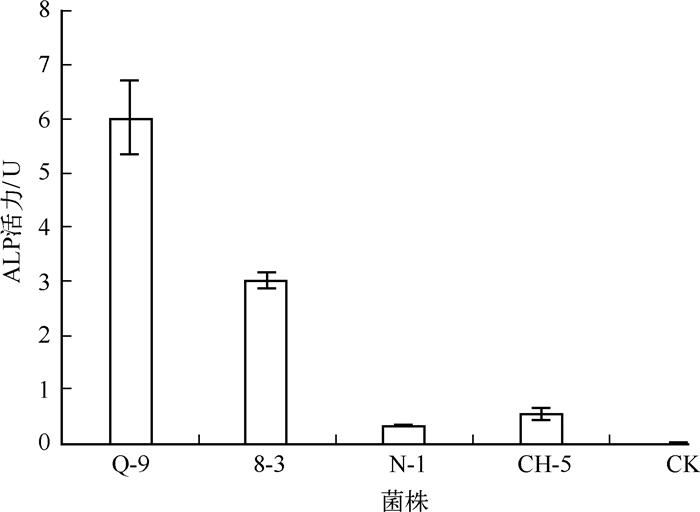
|
图 2 附生菌株的碱性磷酸酶活力 Fig.2 Alkaline phosphatase activities of the attached strains |
在34株藻附生菌中,11株具有产胞外脂酶活力,占总附生菌的32%(表 2).
| 表 2 附生菌的脂酶活力* Tab.2 Esterase activities of the attached strains |
在铜绿微囊藻XW01培养物中分别加入34株附生菌,培养7 d后测定藻浓度(图 3),结果表明Q-1、Q-2、Q-4、Q-6、Q-8、Q-11、Q-12、Q-14、CH-6、N-2、8-4共11株菌均表现出较明显的藻生长促进作用,占附生菌总数的32%;显著抑制藻生长的株菌是8-5、CH-3、N-1,占附生菌总数的9.9%;其它20株菌对藻生长无明显影响.

|
图 3 附生菌对铜绿微囊藻XW01生长的影响 Fig.3 Effects of the attached strains on the growth of Microcystis aeruginosa XW01 |
分别对2株显著抑制微囊藻生长(8-5、CH-3)和2株显著促进微囊藻生长(Q-4、Q-14)的菌进行分子鉴定.通过PCR扩增16S rRAN基因并测序,利用Blast软件在GenBank数据库中进行序列相似性比对,结果如表 3,与相似菌株的系统发育树见图 4.
| 表 3 菌株16S rRNA序列与相似性序列的比较分析 Tab.3 Comparison analysis of 16S rRNA gene with similar sequence |
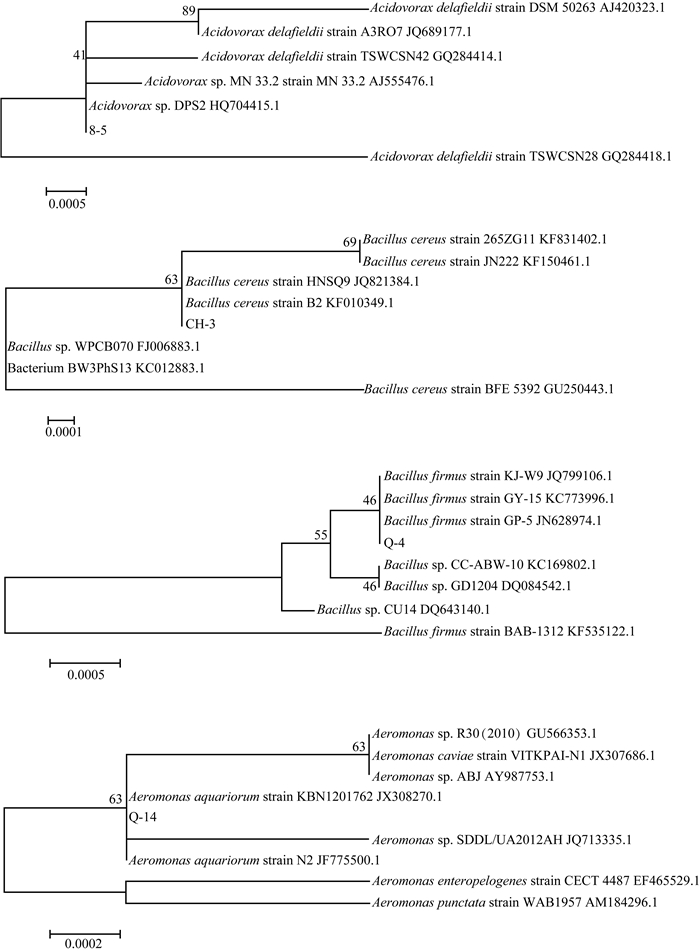
|
图 4 附生菌8-5、CH-3、Q-4和Q-14与相似菌株的系统发育树 Fig.4 Phylogenetic tree of the attached strains 8-5, CH-3, Q-4, Q-14 and related strains |
通常微囊藻水华暴发的水体中均有较高的细菌数量(高达106 CFU/ml),弄清水体中各种微生物代谢对藻生长的影响是一项艰巨的任务,因此本研究仅将目标聚焦于藻群体中与藻细胞紧密结合的附生菌.本研究采用反复洗涤、低速离心的方法,洗去与微囊藻群体表面粘附不紧密的细菌,最终从4个样品中筛选出34株菌落形态具有明显差异的菌株.由于自然界中大多数细菌具有不可培养性,本文筛选培养出的菌株仅是实际种类的一小部分,但通过这些菌的分析至少可以从一定程度上反映藻周际细菌环境状况.
DGGE法通常是分析环境中细菌群落生物多样性的重要工具,但这一方法并不能测定出细菌对环境中物质代谢的能力.本文通过分离纯培养方法,可定性或半定量地反映附生细菌在环境物质循环中的作用,从另一个角度描绘藻际微生物生态.
3.2 微囊藻附生菌的产酶能力及意义 3.2.1 附生菌产氮代谢相关酶的意义氮是微囊藻生长必需的重要元素,附生菌对不同形态氮的代谢必将影响相邻藻细胞的生长.
1) 酪蛋白酶活力:在水华大量生长过程中必然伴随着许多藻细胞的衰老、死亡,具有产生胞外蛋白酶的附生菌有助于迅速分解死亡细胞中的蛋白质(蓝藻细胞通常含有超过30%的蛋白质),转变为小分子的氨基酸,使其中的氮素可以迅速被再利用.本研究结果显示,38%的附生菌都具有产酪蛋白酶的活力,占有较大比例,也突显这些附生菌在氮营养循环中的作用.
2) 氨脱除能力:氨氮是常见的氮形态之一,低浓度的氨氮通常是藻细胞最容易利用的氮形态,但高浓度的氨氮通常对细胞有一定的毒害.微囊藻的附生菌中91%的菌株具有消除氨氮的能力,其中又有38%的菌显示较强的脱氨能力.
细菌对氨氮的消耗一方面是自身生长需要消耗氮营养,另一方面是将氨氮代谢为其他氮形式(在有氧条件下氧化成亚硝态氮或硝态氮).具有较高脱除氨氮能力的菌株,菌的生物量并没有大量增加,说明这些菌对氨的脱除并非是用于自身的生长(图 1).从对藻细胞的影响来看,虽然附生菌对氨氮的消耗会竞争氮营养的供给,但当稠密的水华细胞死亡时,死细胞分解产生的较高浓度氨氮会对其他藻细胞产生毒害,这些具有强脱氨能力的附生菌可能有助于保护藻细胞避免过高浓度氨氮的毒害.
3) 硝酸还原酶活力:附生菌中硝酸盐还原菌的数量很少,本研究中仅有一株菌有较高的硝酸还原酶活力.硝酸盐还原菌可将硝酸根还原成亚硝酸盐并进一步还原成氨或氮[28],这一还原过程主要在厌氧环境下发生.由于微囊藻细胞多漂浮于水面并可进行光合作用,其细胞周围总体上是处于有氧环境,这类菌对硝态氮的作用不大.即使当微囊藻群体下沉到水底的厌氧环境中,由于在附生菌中这类菌数量较少,对硝态氮代谢的贡献也有限.
3.2.2 附生菌产磷代谢相关酶的意义本文结果显示,12%的附生菌具有产胞外ALP的能力.当水体中无机磷缺乏时,ALP附生菌可以催化有机磷分解为无机磷,补充水体磷营养[9, 29].因此,这些菌的存在无疑有利于微囊藻的生长.
3.2.3 附生菌产脂肪酶的意义具有产脂肪酶能力的菌株在附生菌中的比例高达32%,这些菌的脂肪代谢作用对促进群体中衰老死亡细胞的分解,加快物质循环利用有一定的价值.由于蓝藻细胞壁的主要成分是脂多糖,因此这些菌的存在可能对细胞壁的分解代谢产生一定的影响.
3.3 附生菌产酶能力与对藻细胞生长影响的相关性为分析细菌的生理特征与藻的生长的关系,将5株显著促藻生长菌和4株显著抑藻生长菌的生理特征列于表 4.对微囊藻生长有促进作用的菌均具有产酪蛋白酶或(和)产脂肪酶活力,这有可能是因为藻的生长过程中一直都伴随藻细胞的衰亡和裂解,酪蛋白酶和脂酶会在这个过程中不断地发挥着催化水解作用,为藻的生长提供有利条件.但也有可能是伴随这些酶产生的过程,附生菌同时也产生一些生长刺激因子促进藻生长.附生菌促藻生长的机理有待进一步的工作进行验证.
| 表 4 显著影响微囊藻生长的菌株生理特征* Tab.4 Physiological characteristics of the strains with obvious effects on Microcystis growth |
然而显著抑制藻生长的4株菌均无显著的产酶特征,它们对藻生长的抑制可能是产生了某些抑制藻生长的物质,而并非胞外酶的作用所导致.
在本文的菌-藻共培养研究中,由于采用生长旺盛的藻和营养物充分的培养基(BG-11),理论上在较短的培养时间内细菌对营养环境的改变作用不会很大,因此,附生菌的ALP、NR以及脱氨酶的作用可能并未显现出来,这些产酶菌在自然环境下对藻生长的影响,需要通过进一步模拟自然生态实验来确定.
3.3 显著影响藻细胞生长的附生菌的多样性关于抑藻菌已有不少研究,席宇等分离出来的一株溶藻菌,鉴定为一种欧文氏菌[30];崔亚青等从太湖分离到一株强烈的溶藻菌,鉴定该菌株属于水单胞菌属[31];高菲等以巢湖作为采样点,分离得到2株溶藻菌,经分子鉴定为约氏不动杆菌和门多萨假单胞菌[32].而本文得到的藻生长抑制菌8-5、CH-3分别为徳氏食酸菌、蜡状芽孢杆菌属,不同于已报道的种类,显示微囊藻水华环境中抑藻菌具有丰富的多样性.
2株对微囊藻生长有促进作用的菌分属于芽孢杆菌属(Q-4,产脂肪酶)和产气单胞菌属(Q-14,产酪蛋白酶),也显示促生长类群的多样性.
3.4 结语通过附生菌代谢特性的分析,定性地给出各菌的代谢特征,推测其在改变微囊藻微环境中的作用.总体来看,附生菌中较多的菌株具有分解蛋白质和脂肪的能力,与藻细胞形成“生产者-分解者”密切相连的微环境,这种紧密相连的关系在自然生态环境中理应是对微囊藻有益的.但是,由于各种微生物具有复杂的代谢特征,很难通过单一的代谢能力去评价其在自然环境中的全面作用,特别是本文仅通过定性的方法(单一菌株纯培养)观察菌-藻的关系,而并未考虑自然环境中不同菌的丰度以及不同环境对菌代谢的影响,因此,有待通过进一步的大量研究,揭示微囊藻细胞周际的微生物对蓝藻水华的作用.
| [1] |
Paerl HW, Paul VJ. Climate change: Links to global expansion of harmful cyanobacteria. Water Research, 2012, 46(5): 1349-1363. DOI:10.1016/j.watres.2011.08.002 |
| [2] |
Brookes JD, Carey CC. Resilience to blooms. Science, 2011, 334: 46-47. DOI:10.1126/science.1207349 |
| [3] |
Roderick LO, George GG. The ecology of cyanobacteria. Netherlands Dordrecht: Kluwer Academic Publishers, 2000: 149-194.
|
| [4] |
Burkert U, Hyenstrand P, Drakare S. Effects of the mixotrophic flagellate Ochromonas sp. on colony formation in Microcystis aeruginosa. Aquatic Ecology, 2001, 35(1): 11-17. DOI:10.1023/A:1011454313607 |
| [5] |
Brunberg AK, Blomqvist P. Recruitment of Microcystis(Cyanophyceae) from lake sediments: the importance of littoral inocula. Journal of Phycology, 2003, 39: 58-63. |
| [6] |
王少沛, 曹煜成, 李卓佳等. 水生环境中细菌与微藻的相互关系及其实际应用. 南方水产, 2008, 4(1): 76-80. |
| [7] |
冯胜, 高光, 秦伯强等. 太湖北部湖区水体中浮游细菌的动态变化. 湖泊科学, 2006, 18(6): 636-642. DOI:10.18307/2006.0612 |
| [8] |
Worm J, Sonderguard M. Dynamics of heterotrophic bacteria attached to Microcystis spp.(Cyanobacteria). Aquatic Microbial Ecology, 1998, 14(1): 19-28. |
| [9] |
赵婕, 李建宏, 管章玲等. 一株产碱性磷酸酶附生菌对微囊藻生长的影响. 湖泊科学, 2011, 23(1): 49-55. DOI:10.18307/2011.0108 |
| [10] |
刘玲莉, 顾宇飞, 罗屿等. 一株自太湖微囊藻上分离到的细菌的生长及磷代谢. 湖泊科学, 2000, 12(4): 372-378. |
| [11] |
谭香, 沈宏, 宋立荣. 三种水华蓝藻对不同磷浓度生理响应的比较研究. 水生生物学报, 2007, 31(5): 693-699. |
| [12] |
Jochem FJ. Probing the physiological state of phytoplankton at the single cell. Scientia Marina, 2000, 64(2): 183-195. DOI:10.3989/scimar.2000.64n2 |
| [13] |
邓洁, 李建宏, 管章玲等. 一株产碳酸酐酶附生菌对铜绿微囊藻(Microcystis aeruginosa)生长的影响. 湖泊科学, 2012, 24(3): 429-435. DOI:10.18307/2012.0315 |
| [14] |
高杨, 宋志文. 硝化细菌对铜绿微囊藻生长的影响. 河北渔业, 2011(1): 9-12, 27. |
| [15] |
Abbasim K, Adams WA. Loss of nitrogen in compacted grassland soil by simultaneous nitrification and denitrification. Plant Soil, 1998, 200(2): 265-277. DOI:10.1023/A:1004398520150 |
| [16] |
汪辉, 刘兆普, 魏微等. 一株溶藻附生菌的分离、鉴定以及其溶藻物质的研究. 中国环境科学, 2008, 28(5): 461-465. |
| [17] |
吴敏, 陈明, 宦海琳等. 菌藻共固定化降解微囊藻毒素. 湖泊科学, 2007, 19(6): 627-631. DOI:10.18307/2007.0601 |
| [18] |
Manage PM, Kawabata Z, Nakano S. Dynamics of cyanophage-like particles and algicidal bacteria causing Microcystis aeruginosa mortality. Limnology, 2001, 2(2): 73-78. DOI:10.1007/s102010170002 |
| [19] |
Roth PB, Twiner MJ, Mikulski CM. Comparative analysis of two algicidal bacteria active against the red tide dinoflagellate Karenia brevis. Harmful Algae, 2008, 7(5): 682-691. DOI:10.1016/j.hal.2008.02.002 |
| [20] |
韩聪, 张惟材, 游松等. 大肠杆菌ptsG基因敲除及其缺陷株生长特性研究. 生物工程学报, 2004, 20(1): 16-20. |
| [21] |
Fujita Y, Hara Y, Suga C. Production of shikonin derivatives by cell suspension cultures of Lithospermum erythrorhizon. Plant Cell Reports, 1981(1): 61-63. |
| [22] |
杨天波. 蛋白酶水解酪蛋白透明圈初筛方法的条件探索与应用效应. 河北大学学报:自然科学版, 1982(2): 16-20. |
| [23] |
侯颖, 徐建强, 孙军德. 养殖水体高效氨氮脱除菌的分离及脱除特性研究. 西北农林科技大学学报:自然科学版, 2006, 34(11): 136-140. |
| [24] |
国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法:第4版. 北京: 中国环境科学出版社, 2002.
|
| [25] |
庄百川. 一株产碱性磷酸酶菌株的分离、鉴定及发酵条件研究[学位论文]. 杭州: 浙江大学, 2006. http://cdmd.cnki.com.cn/article/cdmd-10335-2007119142.htm
|
| [26] |
洪鲲, 张豪, 乙引等. 产脂肪酶细菌的筛选及发酵培养条件的优化. 贵州农业科学, 2011, 39(9): 103-105. |
| [27] |
管章玲, 辛海峰, 李建宏等. 小麦赤霉病拮抗菌的筛选及应用. 江苏农业学报, 2012, 28(2): 309-313. |
| [28] |
张涛, 陈云, 谢虹等. 硝酸还原酶活性的调节及可能机制的研究进展. 广西植物, 2004, 24(4): 367-372. |
| [29] |
杨柳燕, 王勤, 史小丽等. 铜绿微囊藻磷代谢过程研究. 农业环境科学学报, 2005, 24(4): 686-689. |
| [30] |
席宇, 吴刚, 张勇等. 一株淡水溶藻细菌的分离及初步研究. 华中师范大学学报:自然科学版, 2003, 37(2): 222-226. |
| [31] |
崔亚青, 雍晓雨, 张风革等. 一株溶藻细菌的分离鉴定及溶藻效果. 应用与环境生物学报, 2012, 18(5): 752-760. |
| [32] |
高菲, 张萍萍, 吴佳慧等. 两株溶藻细菌的分离及初步研究. 生物学杂志, 2012, 29(1): 42-46. |
 2015, Vol. 27
2015, Vol. 27 

