(2: 江苏省中国科学院植物研究所, 江苏省生物多样性与生物技术重点实验室, 南京 210023)
(2: Jiangsu Key Lab of Biodiversity and Biotechnology, Jiangsu Province Institute of Botany, Chinese Academy of Sciences, Nanjing 210023, P. R. China)
随着工业的迅速发展,大量磷肥的使用、镍(Ni)矿的开采及电子材料的制造等,使进入水环境中的Ni呈逐年上升之势,并且已成为污染水体的主要重金属之一[1].水体中的重金属不像有机化合物那样可自然降解或被生物降解.近年来,大多利用水生植物如香蒲(Typha orientalis Presl)[2]、水鳖(Hydrocarbons dubia)[3]、凤眼莲(Eichhornia crassipes)[4]、水生狐尾藻(Myriophyllum verticillatum)[5]等来吸收或吸附重金属,但水体中达到一定浓度的重金属会对植物产生毒害作用,影响植物的生理特性和光合作用. Ni近年来被确认为植物生长所必需的微量元素,它是某些酶(如脲酶、固氮酶、脱氢酶等)的组成成分[6],这些酶都影响植物的生长发育,参与细胞的氧化还原过程.天然淡水中Ni浓度约为0.5 μg/L,海水中的浓度为0.66 μg/L.不同工业废水中Ni浓度差别很大,如镀Ni工业废水为2~900 mg/L,机器制造业废水为5~35 mg/L,金属加工业废水为17~51 mg/L[7].低浓度的Ni可促进植物的生长,但过量的Ni会导致植物代谢紊乱,破坏光合作用,影响活性氧水平和抗氧化系统[8].尽管目前Ni污染不如Cd、Hg、Pb等元素严重,但由于Ni在环境中难迁移,一旦污染就很难改良、消除,加之Ni在植物体内极易迁移的特殊性更加重了其危害性[9].
在Ni胁迫下,菹草[10]、玉米[11]、水稻[12]、咖啡[13]的抗氧化酶活性发生变化,活性氧积累,膜脂过氧化程度加剧,表明Ni的毒害作用与其导致植物产生过氧化氢(H2O2)和超氧阴离子(O2·-)等活性氧(ROS)密切相关[12].植物具有清除ROS的抗氧化酶和抗氧化剂系统,主要的抗氧化酶有超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等;非酶类抗氧化剂包括类黄酮、α-生育酚、抗坏血酸、谷胱甘肽、胡萝卜素和甘露醇等,这些物质既可直接同ROS反应将其还原,又可作为酶的底物在ROS的清除中发挥重要作用[14].重金属的胁迫也能导致植物矿质营养的缺乏,引起它们参与代谢和物质组成过程的紊乱失调[15].许多研究表明,矿质营养的供应也可以部分或几乎全部地矫正重金属胁迫毒害作用[16].
水鳖属于单子叶纲水鳖科植物,生长在静水池沼中,分布广泛,江苏省各地常见.本文以水鳖为研究材料,探究添加不同浓度Ni对水鳖叶片中Ni元素及营养元素的吸收、光合色素含量、活性氧水平、抗氧化酶(SOD、CAT、POD)活性以及抗氧化物质(维生素E、黄酮、谷胱甘肽(GSH)、非蛋白巯基(NP-SH)和非蛋白巯基(PCs))含量的影响,以期为进一步阐明Ni对高等水生植物毒害的生理机制提供参考依据.
1 材料和方法 1.1 实验材料水鳖于2014年9月中旬(温度为18~25℃)采自南京江心洲(32°1′N,118°42′E),周围无污染源,选取长势良好(根系粗壮、叶片鲜绿)的植株置于无底泥水缸用自来水驯化培养5天.
1.2 实验方法 1.2.1 水鳖的实验处理选取大小相似(植株长约15 cm)、生长状况一致(无花、果的成熟植株)的水鳖,将这些植株分为5组,其中1组为对照(CK)组:用1/10 Hoagland营养液培养;其余4组为处理组,分别用含NiCl2浓度为0.05、0.10、0.15、0.20 mmol/L(预实验表明此浓度梯度下,水鳖受害差异明显)的1/10 Hoagland营养液培养.材料处理期间,每2天更换一次营养液,培养室中,光暗周期比为16 h :8 h,光照强度为240~300 μmol/(m2·s),光照温度为25℃ :18℃(L :D).实验设置3次重复. 6 d后,用去离子水洗净、揩干,取倒数第3叶(成熟叶片)进行各项生理指标的测定.
1.2.2 Ni积累及营养元素含量的测定用10 mmol/L EDTA清洗残留在叶片表面的金属离子.将清洗干净的叶片1.0 g用3 :1 HNO3/HClO4在95℃下消化,直到消化液清澈为止.消化后的残留物在最小体积的7%盐酸中溶解,用蒸馏水稀释.分解的样品用电感耦合等离子体原子发射光谱法分析Ni和营养元素(Ca、Mg、K、Fe、Mn)的含量.
1.2.3 叶绿素和类胡萝卜素含量的测定称取0.2 g叶片,用80%的丙酮冰浴研磨、离心,用分光光度计测定470、647和663 nm处的吸收度值,按Lichtenthaler[17]的公式计算光合色素含量.
1.2.4 O2·-产生速率、H2O2、MDA和可溶性蛋白含量的测定O2·-产生速率采用王爱国等[18]的方法测定;H2O2含量采用南京建成生物工程研究所的H2O2试剂盒(货号:A064) 测定;MDA含量参考文献[19]的方法测定.可溶性蛋白含量由中国南京建成生物工程研究所购买的试剂盒(货号:A045-2) 测定,以牛血清蛋白(BSA)(Sigma, USA)为标准蛋白.
1.2.5 SOD、POD和CAT活性的测定称取叶片0.5 g,加入50 mmol/L磷酸缓冲液(pH值为7.8),研磨,10000转/min,4℃离心20 min,将上清液定容至5 ml,取部分上清液经适当稀释后用于酶活性测定. SOD活性测定采用NBT光化还原法[20],以抑制NBT光还原50%所需的酶量为1个酶活性单位(U);POD活性测定采用愈创木酚方法[21],以每分钟OD470的变化为1个酶活性单位(U);CAT活性测定采用钼酸盐方法[22],以每分钟分解1 μmol H2O2所需的酶量为一个酶活性单位(U).
1.2.6 维生素E和黄酮含量的测定维生素E含量由中国南京建成生物工程研究所购买的试剂盒(货号:A008) 测定,单位为μg/g.
黄酮含量测定:参照韩国君等[23]的方法.(1) 标准曲线制作:精确称取芦丁标品20 mg,加70%乙醇定容至100 ml,得到0.2 mg/ml的标品溶液.准确吸取2.0、4.0、6.0、8.0、10.0、12.0、14.0、16.0、18.0、20.0 ml标准溶液,分别放入50 ml容量瓶中,加入少量水,再加入5 %的NaNO2 1.4 ml,摇匀,5 min后再加入0.3 mol/L的AlCl3 1.4 ml,摇匀,5 min后加入1 mol/L NaOH 4 ml,加水至刻度,摇匀,同时做空白对照.在510 nm处测定吸光度;(2) 水鳖黄酮含量的测定:将水鳖叶片冷冻干燥24 h,研磨成细粉,准确称量0.1 g,置于50 ml试管中,加入20 ml 70%乙醇,微沸至乙醇溶液蒸干,再加入20 ml 70%乙醇溶液,超声提取1 h,过滤,获得待测溶液.准确吸取待测溶液1 ml、水1.4 ml、5% NaNO3 0.4 ml,摇匀,5 min后加入10% Al(NO3)3 0.4 ml,摇匀,5 min后加入4.3% NaOH 4 ml、水2.8 ml,放置15 min显色,在510 nm处测分光光度值.
1.2.7 GSH、NP-SH和PCs的测定(1) GSH含量采用Anderson[24]的方法测定.(2) NP-SH和PCs含量按照Ellman[25]的方法测定.(3) NP-SH与GSH含量之差即为PCs含量.
1.2.8 总抗氧化能力(T-AOC)的测定T-AOC用从南京建成生物工程研究所购买的试剂盒(货号:A015) 测定,单位为U/g.
1.3 统计分析实验结果为3次实验结果的平均值±标准差的形式,用Excel和SPSS 19.0软件完成原始数据处理和制图.各指标不同处理间进行单因素方差分析,P≥0.05表示无显著差异;P < 0.05表示差异显著;P < 0.01表示差异极显著.图表中不同字母表示数值之间差异显著(P < 0.05),相同字母之间表示差异不显著.用相关系数r表示相关性统计分析,其中P≥0.05为无显著相关;P < 0.05为显著相关;P < 0.01为极显著相关.
2 结果与分析 2.1 Ni积累及营养元素含量变化随着Ni浓度的不断增加,发现Ni含量在水鳖叶片中呈浓度依赖性地增加(表 1).相关性分析表明,水鳖叶片中Ni积累量与外界溶液中Ni浓度呈极显著正相关(r=0.92,P < 0.01).在0.20 mmol/L Ni处理时,水鳖叶片中Ni含量竟高达201.0 μg/g FW.水鳖叶片中Ca、Mg含量受Ni浓度影响极显著(rCa=0.96,P < 0.01;rMg=0.95,P < 0.01),即随着Ni浓度的提高,水鳖叶片中Ca、Mg含量逐步上升.水鳖叶片中K含量随Ni浓度增加有所上升,在0.15 mmol/L Ni处理时,K含量最高.水鳖叶片中Fe含量与Ni浓度呈显著负相关(rFe=-0.58,P < 0.05),即Fe含量随Ni浓度增加而明显下降.水鳖叶片中Mn含量在低浓度时随Ni浓度增加而上升,在0.15 mmol/L时达到最高,而在较高Ni浓度处理时Mn含量下降,但仍高于对照组.
| 表 1 不同Ni浓度添加处理对水鳖叶片Ni的积累和营养元素的影响 Tab.1 The effect of Ni addition with different concentrations on Ni accumulation and nutrient element contents in Hydrocharis dubia leaves |
Ni对叶绿素a(Chl.a)、叶绿素b(Chl.b)和类胡萝卜素(Car)的抑制作用也随Ni浓度的增加而增加(图 1).光合色素含量和Ni浓度之间呈极显著负相关(rChl.a=-0.98,P < 0.01;rChl.b=-0.98,P < 0.01;rCar=-0.97,P < 0.01).
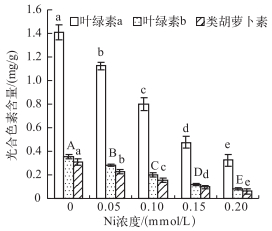
|
图 1 不同Ni浓度添加处理中水鳖叶片的光合色素含量 Fig.1 The photosynthetic pigment content in Hydrocharis dubia leaves under different Ni treatments |
水鳖叶片的O2·-产生速率和H2O2含量随Ni浓度的升高呈逐渐增大的趋势,在Ni浓度为0.20 mmol/L时最大,分别为对照组的3.95和2.19倍.相关性分析表明,O2·-的产生速率和H2O2含量与Ni处理浓度间达到极显著正相关(rO2·-=0.99,P<0.01;rH2O2 =0.98,P < 0.01)(图 2a、b).
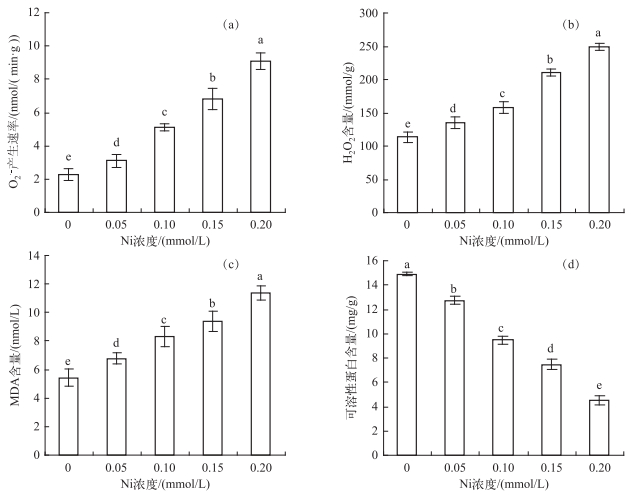
|
图 2 不同Ni浓度添加处理中水鳖叶片O2·-产生速率(a)、H2O2含量(b)、MDA含量(c)和可溶性蛋白含量(d) Fig.2 The generation rate of O2·-(a), H2O2 content(b), MDA content(c), and soluble protein content(d) in Hydrocharis dubia leaves under different Ni treatments |
MDA是膜质过氧化作用的主要产物,其含量是反映膜质过氧化作用强弱和质膜受破坏程度的重要标志. MDA含量变化与O2·-产生速率和H2O2含量变化一致,呈极显著正相关(r=0.98,P < 0.01)(图 2c).
受Ni浓度的影响,可溶性蛋白含量随着浓度的上升显著降低,呈极显著负相关(r=-0.99,P < 0.01)(图 2d).
2.4 抗氧化酶活性变化POD活性随Ni浓度增加而逐渐增强,在0.20 mmol/L时达到最高,为对照组的1.52倍(图 3a). CAT活性随Ni处理浓度增加而下降,呈显著负相关(r=-0.95,P < 0.05)(图 3b).在0.05 mmol/L Ni处理时,SOD活性增加,是对照组的1.17倍;其后,SOD活性随Ni浓度增加而下降(图 3c).
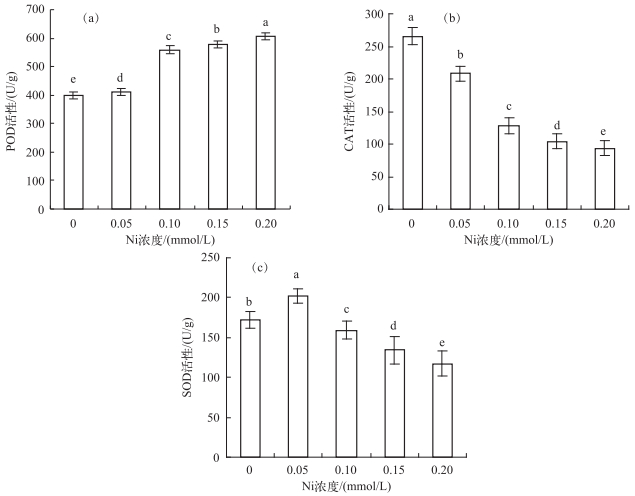
|
图 3 不同Ni浓度添加处理中水鳖叶片的抗氧化酶活性(a:POD活性;b:CAT活性;c:SOD活性) Fig.3 The activities of antioxidant enzymes in Hydrocharis dubia leaves under different Ni treatments(a: POD activity; b: CAT activity; c: SOD activity) |
维生素E含量随Ni处理浓度增加而缓慢增加,呈显著正相关(r=0.79,P < 0.05)(图 4a).黄酮含量随Ni浓度升高而升高,在0.20 mmol/L Ni处理时有所下降,但仍高于对照组,是其1.26倍(图 4b).

|
图 4 不同Ni浓度添加处理中水鳖叶片的维生素E(a)和黄酮含量(b) Fig.4 The vitamin E(a) and flavonoid contents(b) in Hydrocharis dubia leaves under different Ni treatments |
水鳖叶片的GSH含量不受Ni处理的影响,变化不明显(图 5a).而NP-SH含量随Ni处理浓度增加而先升后降,在0.10 mmol/L Ni处理时达到最高值,为对照组的1.21倍(图 5b). PCs含量变化趋势与NP-SH含量变化一致,同样在0.10 mmol/L Ni处理时达到峰值,是对照组的1.33倍(图 5c).
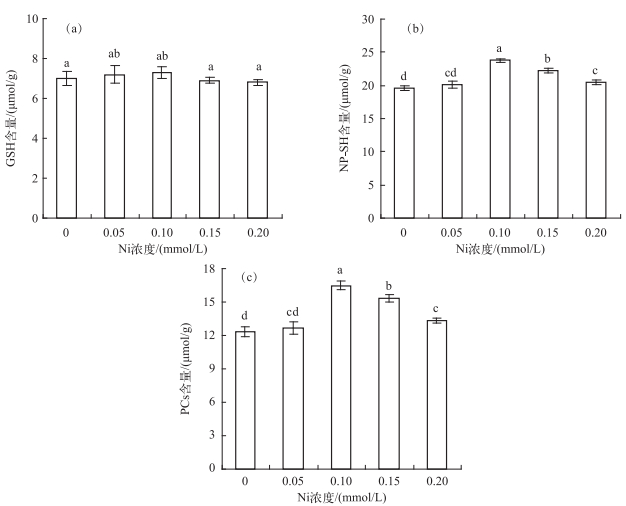
|
图 5 不同Ni浓度添加处理中水鳖叶片的GSH(a)、NP-SH(b)和PCs(c)含量 Fig.5 The GSH(a), NP-SH(b) and PCs(c) contents of Hydrocharis dubia leaves under different Ni treatments |
T-AOC随Ni处理浓度先上升后下降,与Ni处理浓度呈显著负相关(r=-0.83,P < 0.05).在0.05 mmol/L Ni处理时最大,为对照组的1.16倍.在0.20 mmol/L Ni处理时最小,为对照组的77.5% (图 6).
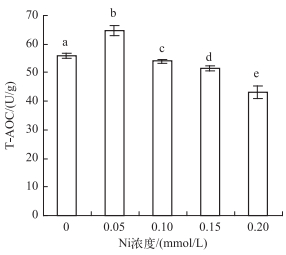
|
图 6 不同Ni浓度添加处理中水鳖叶片的T-AOC Fig.6 The T-AOC in Hydrocharis dubia leaves under different Ni concentrations treatments |
当水生植物从水体中吸收重金属后,会在体内积累,并通过食物链对高营养级的生物甚至人类造成危害.在本研究中,Ni的累积呈浓度依赖性(表 1),说明水鳖植株内Ni累积多少与水体中Ni浓度高低具有一致性,即水体中Ni浓度越高,水鳖植株体内Ni累积得越多.同时,Ni在水鳖植株内的大量累积导致叶片中营养元素含量的变化,破坏植株内抗氧化系统的平衡,使活性氧大量积累,植株生长受阻,叶片出现黄化现象,严重者产生枯斑.
Ca、Mg、K等作为植物所必需的营养元素,在植物体内对于渗透压的调节、代谢平衡的维持、物质的合成都有着不可或缺的作用,而重金属的胁迫作用常会导致它们参与代谢过程的紊乱和功能的失调.较高浓度的重金属能够抑制植物体对Ca、Mg等矿质营养元素的吸收和转运,但某些重金属的处理也能提高植物体内Ca、Mg等矿质营养元素含量[26].本实验中Ca、Mg含量随Ni处理浓度增加而上升,Ca、Mg矿质营养的充足供应有利于缓解重金属的毒害作用,这种缓解作用可能是由于Ca离子以及其他盐离子与重金属离子竞争吸收运输位点,导致重金属离子吸收的减少所致[27-28];另外,Ca、Mg离子的存在也有利于根系细胞维持正常的渗透系统,保证矿质营养较少受到重金属的胁迫作用.因此,Ca、Mg含量的增加可能是水鳖对抗Ni胁迫的一种机制[15]. K在维持液泡渗透压和细胞膨压中起着重要作用.以往研究表明,高浓度Ni处理导致K含量降低[29-30],而本实验中水鳖叶片中K含量随Ni处理浓度增加而增加,与以往研究不同,可能与植物通过对K的吸收来提高细胞内阳离子的有效浓度、在一定程度上缓解Ni毒性有关[31]. Fe是植物体必需的微量元素之一,存在于氧化还原中心蛋白中,对光合作用和细胞呼吸必不可少[32].重金属胁迫能够降低根系Fe还原酶的活性[33],由于二价铁是植物根系吸收的主要形态,根系还原酶活性的降低也就减少了植物根系对Fe的吸收.本实验中随着Ni处理浓度的增加,水鳖叶片中Fe含量急剧减少,说明Ni处理降低了根系还原酶的活性[15],同时,水鳖叶片中Mg含量增加、Fe含量下降,说明本研究中水鳖叶片失绿是由Fe元素的缺乏造成的.本实验中Mn含量先升高再降低,但始终高于对照组,与马建军等[29]用Ni处理小麦的研究结果相同,原因可能与Fe含量减少有关[34].此外,Mn本身就是重金属,其含量增加可能会对植物产生一定的不良影响[35].
叶绿素是植物吸收太阳能、进行光合作用的重要物质,其含量的高低在一定程度上反映了植株利用光能及制造有机物的能力.叶绿素含量降低是重金属对植物毒害的普遍现象.本研究中水鳖叶片中叶绿素a、叶绿素b和类胡萝卜素含量随Ni浓度升高呈减少趋势,且均与Ni浓度呈负相关,原因有两点:一是Ni能取代叶绿素中心的Mg原子,破坏叶绿体结构和功能,使叶绿素分解[36];二是Ni胁迫条件下植株体内ROS增多,叶绿体是ROS产生和攻击的主要部位,从而引起叶绿素含量的减少.叶绿素是植物进行光合作用所必需的,叶绿素含量减少必然导致植物光合作用降低,生长受阻,发育延迟.
MDA是生物膜中不饱和脂肪酸的分解产物,其形成通常作为氧化应激中脂质过氧化的指标[37].细胞膜脂受损伤,细胞内可溶性物质外渗,可能破坏细胞内酶及代谢作用原有的区域,使细胞代谢紊乱,从而出现生物量下降和叶片褪绿等情况,使植株出现毒害症状[38]. MDA含量的增加说明膜脂过氧化程度加剧,细胞膜的选择透过性被破坏,所以出现上述营养元素吸收紊乱的现象.本实验中,水鳖叶片中MDA含量升高说明其对植物毒害程度增强[39].活性氧包括超氧阴离子(O2·-)、H2O2、羟自由基(·OH)和单线态氧(1O2)等,其产生是需氧生物在有氧代谢过程中不可避免的[14].本实验中,H2O2含量与O2·-产生速率明显增加,表明原有的活性氧代谢平衡被破坏,这与水鳖体内抗氧化系统失调有显著关系.同时,H2O2含量与O2·-产生速率的增加也验证了上述光合色素含量下降的原因.而H2O2又能与O2·-发生Harber-Weis反应,产生更具毒性的·OH,启动膜脂过氧化[14].重金属胁迫通常导致植物体可溶性蛋白含量降低[40].本研究表明,水鳖叶片可溶性蛋白质含量显著下降,这与以往重金属毒害水鳖的研究结果一致[41-42],其主要原因可能是重金属胁迫能引起植物体内蛋白质的变性和凝聚,且抑制了新蛋白质的合成,从而使植物遭受伤害[43],因此可溶性蛋白质在Ni胁迫下表现出随浓度升高而下降的趋势.
植物体内具有复杂的抗氧化酶系统,可以清除由胁迫产生的大量ROS. SOD是植物中清除活性氧的第一个酶,它将细胞中产生的O2·-歧化为H2O2,形成的H2O2随即被CAT和POD等酶降解.本研究中,Ni胁迫导致水鳖叶片组织SOD和CAT活性显著降低,POD活性显著增强,这与Ni胁迫下小麦[12]表现出的现象十分相似;SOD、CAT活性逐渐下降,原因是重金属离子可与蛋白质巯基头部结合,抑制酶活性,改变蛋白结构[44].此外,Fe是多种抗氧化酶的辅基,因此水鳖叶片中Fe含量的下降也可能是SOD和CAT活性下降的原因[45].这表明在Ni胁迫的氧化应激反应中,CAT和SOD不起主要作用. POD活性显著增加,说明POD在水鳖中活性稳定,能够在受到氧化胁迫时弥补CAT活性的下降,在清除活性氧的反应中起主要作用. 3种抗氧化酶活性的变化,说明水鳖体内抗氧化酶系统平衡被打破,从而出现H2O2含量、O2·-产生速率和MDA含量明显增加以及可溶性蛋白含量明显下降的氧化胁迫现象.
通常,维生素E主要存在于绿色植物组织中,具有抗氧化剂和光合保护的功能,维生素E含量的增加代表了膜水平上植物为应对ROS的大量产生而采取的一种保护反应[46].黄酮是一种很强的抗氧化剂,其抗氧化机制是通过酚羟基与自由基反应生成较稳定的半醌式自由基,终止其链式反应,从而有效清除体内的活性氧自由基.本试验中,随着Ni处理浓度的增加,维生素E和黄酮含量均有所增加,说明在水鳖中维生素E和黄酮对氧化胁迫产生应激保护作用,这可能是水鳖对抗氧化酶活性下降的一种补偿机制[47-48].
植物在受到重金属胁迫时会产生低分子量、与有毒金属亲和性高的硫醇[49],其中最重要的低分子量生物硫醇是GSH、NP-SH和PCs[50]. GSH可作为一种重要的巯基化合物结合细胞内的重金属,减轻重金属对植物的毒害[51]. NP-SH代表含有S的氨基酸、谷胱甘肽和植物螯合肽等游离-SH基团,它的含量增加是重金属解毒机制中一个重要的组分[52]. PCs是指植物体内合成的一级结构相似的一系列小分子多肽,对重金属离子的螯合能力较强,因而在植物体内对重金属的累积和解毒过程发挥重要作用.本实验中,GSH含量并未随Ni处理浓度的增加而发生显著变化,与Tatyana等的研究结果相同[53],说明GSH在减轻Ni添加引起的氧化伤害方面未起到积极作用.处理组NP-SH的含量始终高于对照组,这与Cd和Hg处理的结果相同[54-55],这可能是由于Ni处理促进了硫酸盐还原途径中的APS还原酶和丝氨酸乙酰转移酶活性. PCs含量与对照组相比显著增加,与Cr胁迫的结果一致,可能是水鳖受到Ni胁迫启动了PCs合成机制,并在水鳖细胞中形成区室化,以减轻Ni对水鳖的毒害作用[56].
T-AOC是机体内所有抗氧化物质抗氧化能力的总和[57].本实验中,T-AOC随Ni处理浓度的增加而先上升后下降,表明水鳖在受到低浓度Ni胁迫时抗氧化保护系统中某些组分活性或含量出现应激性上升,但当Ni处理浓度为0.10 mmol/L时,T-AOC下降,表明其细胞内的抗氧化系统被破坏,防御功能随之丧失[58].
综上所述,Ni胁迫引起水鳖体内出现了氧化应激反应,导致活性氧大量积累、MDA含量明显增加,光合色素和可溶性蛋白质的含量显著下降.同时,水鳖体内的抗氧化机制也受到Ni胁迫的干扰,只有抗氧化酶POD以及抗氧化物质维生素E、黄酮、NP-SH和PCs含量上升,说明它们在水鳖的抗Ni胁迫过程中发挥着积极的作用.水鳖的T-AOC在受到高浓度Ni胁迫时下降,说明Ni产生的毒害较强,破坏了水鳖正常的生理代谢.
| [1] |
Sreekanth TVM, Nagajyothi PC, Lee KD et al. Occurrence, physiological responses and toxicity of nickel in plants. International Journal of Environmental Science and Technology, 2013, 10(5): 1129-1140. DOI:10.1007/s13762-013-0245-9 |
| [2] |
黄永杰, 刘登义, 王友保等. 八种水生植物对重金属富集能力的比较研究. 生态学杂志, 2006, 25(5): 541-545. |
| [3] |
丁春霞, 施国新, 徐勤松等. 水鳖叶片对不同浓度Pb2+胁迫的生理和结构响应. 广西植物, 2009, 29(6): 768-773. |
| [4] |
张冬冬, 肖长来, 梁秀娟等. 植物修复技术在水环境污染控制中的应用. 水资源保护, 2010, 26(1): 63-65. |
| [5] |
Hussner A. Growth and photosynthesis of four invasive aquatic plant species in Europe. European Weed Research Society Weed Research, 2009, 49(5): 506-515. |
| [6] |
Parvaze AW, Mohammad SK. Nickel detoxification and plant growth promotion by multi metal resistant plant growth promoting Rhizobium Species RL9. Bulletin of Environmental Contamination and Toxicology, 2013, 91(1): 117-124. DOI:10.1007/s00128-013-1002-y |
| [7] |
Zhai SJ, Xiao H, Shu Y et al. Countermeasures of heavy metal pollution. Chinese Journal of Geochemistry, 2013, 32(4): 446-450. DOI:10.1007/s11631-013-0654-y |
| [8] |
赵娜, 周米平. 镍胁迫对玉米苗根系生长及膜保护系统的影响. 安徽农业科学, 2011, 39(10): 5821-5823. DOI:10.3969/j.issn.0517-6611.2011.10.061 |
| [9] |
Valentina I, Fabrizio P, Alexandra C et al. Growth responses, metal accumulation and phytoremoval capability in Amaranthus plants exposed to nickel under hydroponics. Water Air and Soil Pollution, 2013, 224(2): 1450-1460. DOI:10.1007/s11270-013-1450-3 |
| [10] |
陈霖, 姜岩, 汪鹏合等. 镍胁迫对菹草(Potamoge toncrispus L.)活性氧及脯氨酸代谢的影响. 湖泊科学, 2013, 25(1): 131-137. DOI:10.18307/2013.0117 |
| [11] |
Tatyana A, Dmitry S, Vitalii G et al. Metal uptake, antioxidant status and membrane potential in maize roots exposed to cadmium and nickel. Biologia, 2014, 69(9): 1142-1147. |
| [12] |
Gajewska E, Rafał G, Janusz M et al. Differential response of wheat roots to Cu, Ni and Cd treatment:oxidative stress and defense reactions. Plant Growth Regulation, 2013, 71(1): 13-20. DOI:10.1007/s10725-013-9803-x |
| [13] |
Gomes-Junior RA, Moldes CA, Delite FS et al. Nickel elicits a fast antioxidant response in Coffea arabica cells. Plant Physiology and Biochemistry, 2006, 44(5/6): 420-429. |
| [14] |
Oksana S, Abhay K, Dariusz L et al. Heavy metal-induced oxidative damage, defense reactions, and detoxification mechanisms in plants. Acta Physiologiae Plantarum, 2013, 35(4): 985-999. DOI:10.1007/s11738-012-1169-6 |
| [15] |
Yusuf M, Fariduddin Q, Hayat S et al. Nickel:an overview of uptake, essentiality and toxicity in plants. Bulletin of Environmental Contamination and Toxicology, 2011, 86(1): 1-17. DOI:10.1007/s00128-010-0171-1 |
| [16] |
Singh V. K-Zn relationship in wheat. Journal of Indian Society Soil Science, 1993, 41: 789-790. |
| [17] |
Lichtenthaler HK. Chlorophylls and carotenoids:pigments of photosynthetic biomembrances. Methods in Enzymology, 1987, 148: 350-382. DOI:10.1016/0076-6879(87)48036-1 |
| [18] |
王爱国, 罗广华. 植物的超氧自由基与羟胺反应的定量关系. 植物生理学通讯, 1990, 26(6): 55-57. |
| [19] |
李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000, 164-165.
|
| [20] |
Beyer WF, Fridovich I. Assaying for superoxide dismutase activity:Some large consequences of minor changes in conditions. Analytical Biochemistry, 1987, 161: 559-566. DOI:10.1016/0003-2697(87)90489-1 |
| [21] |
张志良, 瞿伟菁. 植物生理学实验指导. 第3版. 北京: 高等教育出版社, 2003, 172-175.
|
| [22] |
Góth L. A simple method for determination of serum catalase activity and revision of reference range. Clinica Chimica Acta, 1991, 196: 143-151. DOI:10.1016/0009-8981(91)90067-M |
| [23] |
韩国君, 初敬华. 吉林西部罗布麻茎和叶中黄酮含量分析. 湖北农业科学, 2013, 52(24): 6089-6091. DOI:10.3969/j.issn.0439-8114.2013.24.040 |
| [24] |
Anderson ME. Determination of glutathione and glutathione disulfide in biological samples. Methods in Enzymology, 1985, 113: 545-548. |
| [25] |
Ellman GL. Tissue sulfhydryl groups. Archives of Biochemistry and Biophysics, 1959, 82: 70-77. DOI:10.1016/0003-9861(59)90090-6 |
| [26] |
翁南燕, 周东美, 武敬等. 铜镉复合胁迫下温度对小麦幼苗生长及其对铜、镉和矿质营养元素吸收与各元素在亚细胞分布的影响. 生态毒理学报, 2011, 6(6): 607-616. |
| [27] |
赵长江, 薛盈文, 杨克军等. 外源钙对盐胁迫下玉米幼苗不同器官离子含量的影响. 玉米科学, 2012, 20(3): 68-72. |
| [28] |
闫永庆, 袁晓婷, 刘威等. 盐胁迫及外源Ca2+对白刺离子吸收、运输的影响. 东北农业大学学报, 2014, 45(3): 71-78. |
| [29] |
马建军, 张淑霞, 吴贺平. 镍污染对小麦幼苗矿质营养元素吸收与累积的影响研究. 中国生态农业学报, 2004, 12(3): 89-91. |
| [30] |
Mysliwa KB, Prasad MNV, Strzalka K. Photosynthesis in heavy metal stressed plants. Heavy Metal Stress in Plants, 2004, 146-181. |
| [31] |
王丽娜, 杨靖民, 刘金华等. 镍胁迫对玉米幼苗氮、磷、钾积累与分配的研究. 中国农学通报, 2014, 30(27): 139-144. |
| [32] |
Sichul L, Jong-Seong J, Gynheung A. Iron homeostasis and fortification in rice. Journal of Plant Biology, 2012, 55(4): 261-267. DOI:10.1007/s12374-011-0386-7 |
| [33] |
Kovács K, Ernö K, Vértes A et al. Effect of cadmium on iron uptake in cucumber roots:A Mössbauer-spectroscopic study. Plant and Soil, 2010, 327(2): 49-56. |
| [34] |
詹孝慈, 朱守立, 武忠亮. 苔藓植物对重金属耐受和富集作用的研究进展. 兴义民族师范学报, 2014, 6(6): 59-66. |
| [35] |
计汪栋, 施国新, 徐勤松等. 水鳖叶片矿质营养、保护酶活性及同工酶对Cu2+胁迫的响应. 南京师范大学学报, 2008, 31(1): 93-99. |
| [36] |
Shu X, Yin LY, Zhang QF et al. Effect of Pb toxicity on leaf growth, antioxidant enzyme activities, and photosynthesis in cuttings and seedlings of Jatropha curcas L. Environmental Science and Pollution Research, 2012, 19(3): 893-902. DOI:10.1007/s11356-011-0625-y |
| [37] |
Monteiro MS, Santos C, Soares AMVM et al. Assessment of biomarkers of cadmium stress in lettuce. Ecotoxicology Environmental Safety, 2009, 72(3): 811-818. DOI:10.1016/j.ecoenv.2008.08.002 |
| [38] |
王艳, 王进鑫, 马惠芳等. 干旱和铅胁迫对刺槐和紫穗槐抗氧化酶活性的影响. 西北林学院学报, 2011, 26(6): 24-29. |
| [39] |
Gajewska E, Bernat P, Długonski J et al. Effect of nickel on membrane integrity, lipid peroxidation and fatty acid composition in wheat seedlings. Journal of Agronomy and Crop Science, 2012, 198(4): 286-294. DOI:10.1111/jac.2012.198.issue-4 |
| [40] |
John R, Ahmad P, Gadgil K et al. Effect of cadmium and lead on growth, biochemical parameters and uptake in Lemna polyrrhiza L. Plant Soil Environment, 2008, 54: 262-270. |
| [41] |
丁春霞, 施国新, 徐勤松等. 水鳖叶片对不同浓度Pb2+胁迫的生理和结构影响. 广西植物, 2009, 29(6): 768-773. |
| [42] |
王红霞, 胡金朝, 施国新等. 外源多胺对铜胁迫下水鳖叶片多胺代谢、抗氧化系统和矿质营养元素的影响. 生态学报, 2010, 30(10): 2784-2792. |
| [43] |
Muhammad SAA, Muhammad A. Essential roles and hazardous effects of nickel in plants. Reviews of Environmental Contamination and Toxicology, 2011, 214: 125-167. |
| [44] |
Muhammad YA, Rumana S, Mumtaz H et al. Toxic effect of Nickel(Ni) on growth and metabolism in germinating seeds of sunflower(Helianthus annuus L.). Biological Trace Element Research, 2011, 143(3): 1695-1703. DOI:10.1007/s12011-011-8955-7 |
| [45] |
Panday N, Sharma CP. Effect of heavy metals Co2+, Ni2+, and Cd2+ on growth and metabolism of cabbage. Plant Science, 2002, 163: 753-758. DOI:10.1016/S0168-9452(02)00210-8 |
| [46] |
鲁艳, 李新荣, 何明珠等. 镍、铜对矿业废弃地先锋植物盐生草和骆驼蓬抗氧化物质和渗透调节物质积累的影响. 中国沙漠, 2012, 32(6): 1681-1690. |
| [47] |
杨绍兰, 刘燕, 王成荣等. 采后水分和营养胁迫对西兰花未成熟衰老中相关酶活性的影响. 现代食品科技, 2014, 30(11): 53-59. |
| [48] |
刘美玲, 曹波, 刘玉冰等. 红砂(Reaumuria soongorica)黄酮类物质代谢及其抗氧化活性对UV-B辐射的响应. 中国沙漠, 2014, 34(2): 426-432. DOI:10.7522/j.issn.1000-694X.2013.00334 |
| [49] |
Yadav SK. Heavy metals toxicity in plants:An overview on the role of glutathione and phytochelatins in heavy metal stress tolerance of plants. South African Journal of Botany, 2010, 76(2): 167-179. DOI:10.1016/j.sajb.2009.10.007 |
| [50] |
Nouairi I, Ammar WB, Youssef NB et al. Antioxidant defense system in leaves of Indian mustard(Brassica juncea)and rape(Brassica napus)under cadmium stress. Acta Physiologiae Plantarum, 2009, 31(2): 237-247. DOI:10.1007/s11738-008-0224-9 |
| [51] |
Mohammad GM, Zeba IS, Masayuki F. Exogenous sodium nitroprusside and glutathione alleviate copper toxicity by reducing copper uptake and oxidative damage in rice(Oryza sativa L.) seedlings. seedlings. Protoplasma, 2014, 251(6): 1373-1386. DOI:10.1007/s00709-014-0639-7 |
| [52] |
Gajewska E, Sklodowska M. Differential effect of equal copper, cadmium and nickel concentration on biochemical reactions in wheat seedlings. Ecotoxicology Environmental Safety, 2010, 73(5): 996-1003. DOI:10.1016/j.ecoenv.2010.02.013 |
| [53] |
Tatyana A, Dmitry S, Vitalii G et al. Metal uptake, antioxidant status and membrane potential in maize roots exposed to cadmium and nickel. Biologia, 2014, 69(9): 1142-1147. |
| [54] |
吴娟, 施国新, 夏海威等. 外源钙对汞胁迫下菹草(Potamogeton crispus L.)叶片抗氧化系统及脯氨酸代谢的调节效应. 生态学杂志, 2014, 33(2): 380-387. |
| [55] |
Mishra S, Srivastava S, Tripathi RD. Phytochelatin synthesis and response of antioxidants during cadmium stress in Bacopa monnieri L. Plant Physiology and Biochemistry, 2006, 44(1): 25-37. DOI:10.1016/j.plaphy.2006.01.007 |
| [56] |
齐君, 吕金印, 李鹰翔等. Cr3+胁迫对青菜中植物络合素含量及AsA-GSH代谢关键酶活性的影响. 农业环境科学学报, 2012, 31(7): 1303-1309. |
| [57] |
İlhami Gülçin. Antioxidant activity of food constituents:an overview. Archives of Toxicology, 2012, 86(3): 345-391. |
| [58] |
Ya-Fen L, Mark GMA. The molecular mechanism of zinc and cadmium stress response in plants. Cellular and Molecular Life Sciences, 2012, 69(19): 3187-3206. DOI:10.1007/s00018-012-1089-z |
 2016, Vol. 28
2016, Vol. 28 
