(2: 中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室, 南京 210008)
(2: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P. R. China)
氨基酸和它们构成的蛋白质是水体中浮游藻类最主要的含氮有机质[1-2].在富营养化水体中,蓝藻过量堆积腐烂,继而释放大量的颗粒态氨基酸(PAA).这些PAA逐步分解为溶解态氨基酸(DAA),并最终转化为铵态氮(NH4+-N)、硝态氮(NO3--N)等无机氮,改变了水体中营养盐浓度和氮素组成[3-4],对水体中营养盐的供给和水生生物的生长繁殖至关重要.因为DAA是异养细菌最容易利用的氮源[5];而DAA分解的产物NH4+-N和NO3--N都是藻类优先利用的氮源[6-7],其中,NH4+-N在水体中的浓度直接影响到藻类的生长繁殖[8-9].因此,研究藻源性颗粒物中PAA各分解阶段产物的组成,有利于进一步了解藻类生长繁殖过程中对氮素利用的规律.
在夏季水华频繁暴发的西北太湖,氮磷营养盐、水温及光照的综合作用共同影响着太湖蓝藻的生长和水华的暴发[10].其中N被认为是蓝藻生长的第一限制性因子[11].在气候条件适宜的情况下,蓝藻水华暴发时间可长达数月之久[12].维持生物量庞大的蓝藻的生长和繁殖需要大量的N供给.有研究认为,蓝藻水华所需的N来自沉积物的加速释放和外源的输入[13-14].但是,研究中也发现在太湖藻型湖区中蓝藻死亡对NH4+-N的贡献极大,超过了沉积物[14],而PAA作为藻源性颗粒物中氮含量最大的组分,极易被生物利用[15]. PAA的分解势必会对蓝藻水华的维持起到很大的作用.在太湖蓝藻水华暴发的季节,适宜的光照条件下,蓝藻群体的分解与增殖同步进行,分解出的N对蓝藻水华维持时间长短以及PAA转化为NH4+-N的机制还有待研究.
本文对比了在自然光照和无光条件下,高密度太湖蓝藻分解过程中PAA的分解量、分解速率和组成,DAA含量和组成以及分解过程中氮形态的变化,并探讨了氨基酸态氮在富营养化水体氮循环中的作用,为阐明水华过程中氮素的迁移和转化规律及夏季水华现象发生的机理提供理论依据.
1 材料与方法 1.1 实验设置和样品采集 1.1.1 实验设置实验在中国科学院太湖湖泊生态系统研究站生态室水槽内进行.以6只用纯水洗净晾干的100 L有盖塑料水桶为培养容器,在各个水桶底部中央固定一造浪泵(功率为24 W),用以模拟水动力条件,保持整个系统内有一定的混合度.从太湖湖泊生态系统研究站栈桥打捞发生水华时的蓝藻和湖水,蓝藻藻浆用64 μm尼龙网浓缩,湖水用64 μm尼龙网过滤.将处理后的湖水加入上述水桶内,并添加适量蓝藻藻浆,混匀后测定水体中叶绿素a(Chl.a)浓度,保持水桶内Chl.a初始浓度为800 μg/L左右,与太湖蓝藻水华堆积时水体中的Chl.a浓度相当.实验时3只水桶暴露在自然光照之下(自然光照组);其余3只水桶外壁和上盖用铝箔包好,创造无光条件(无光分解组),使得每个处理组有3个平行.水桶以随机顺序悬挂放在有机玻璃房内的大型水槽内,每个水桶内放置一根加热棒,保持温度为28±2℃,连续培养21 d(实验时间为2014年8月1日-21日).
1.1.2 样品采集实验开始第0、1、2、3、4、5、6、8、10、13、16、21 d,每天上午9:00采集约500 ml水样,用于测定水体中总氮(TN)、铵态氮(NH4+-N)、硝态氮(NO3--N)、Chl.a、PAA及DAA浓度.在第0、4、8、21 d用YSI 6600监测实验体系中DO浓度.实验期间用照度计监测每天的光照强度,并计算得到每天的平均值.
1.2 理化因子分析TN、NH4+-N和Chl.a的测定方法主要参照《水与废水监测分析方法》[16]. NO3--N通过Skalar流动分析仪检测[17].
PAA的降解速率采用Olson的指数模型[18]计算:
| $ {C_t}/{C_0} = {{\rm{e}}^{-kt}} $ | (1) |
式中,C0为PAA初始浓度(mmol/L);Ct为降解时间t的PAA浓度(mmol/L);t为分解时间(d);k为降解速率常数(d-1).
1.3 氨基酸分析每次采集的水样经GF/F滤膜过滤(GF/F滤膜预先经500℃处理4 h),记录过滤体积,将膜对折,包于铝箔中,-20℃冷冻保存;另取25 ml上述用GF/F滤膜过滤后的水置于洗净烘干的塑料瓶中,-20℃冷冻保存,待分析.其中,滤膜上的为PAA,而塑料瓶中的用来测量DAA.
PAA浓度分析:将滤膜置于真空冷冻干燥机中冻干后放入水解管中,用5 ml 6 mol/L HCl溶解,氮吹1 min,封瓶,在110℃下水解22 h[19].水解结束后,打开水解管,吸取上层水解液离心(8000转/min)后, 取2 ml上清液置于旋转蒸发仪中蒸发至干,用1 ml样品稀释液(pH=2.2)溶解,并用0.2 μm滤膜过滤,收集滤液放入2 ml离心管中,然后用氨基酸分析仪(Sykam)进行分析.
DAA浓度分析:在冻干的塑料瓶中加5 ml 6 mol/L HCl溶解后将全部液体转移入水解管中,并加入微量0.2 % (w/v)抗坏血酸,氮吹1 min,封瓶,在110℃下水解22 h.冷却后打开水解管,将水解液中的液体完全取出,测量其体积并至于旋转蒸发仪中蒸发至干,用1 ml样品稀释液(pH=2.2)溶解,并用0.2 μm滤膜头过滤,收集滤液放入2 ml离心管中,然后用氨基酸分析仪(Sykam)进行分析.
1.4 数据分析实验数据通过Microsoft Excel 2013录入,分别采用SPSS 19.0和Origin 8.6软件分析及作图.采用独立样本t检验分析不同组别之间是否存在显著性差异.
2 结果 2.1 蓝藻分解过程中理化指标的变化实验时光照强度的变化因天气而异,出现了较为明显的波动.在实验初期(1~4 d),光照强度比较大,在第2 d达到最大值116.44 W/m2.随后出现两次波动,第1次波动的最小值为29.27 W/m2(第6 d),最大值为78.56 W/m2(第9 d);第2次波动在第15 d出现最小值15.75 W/m2,随后上升至82.69 W/m2(第21 d)(图 1).
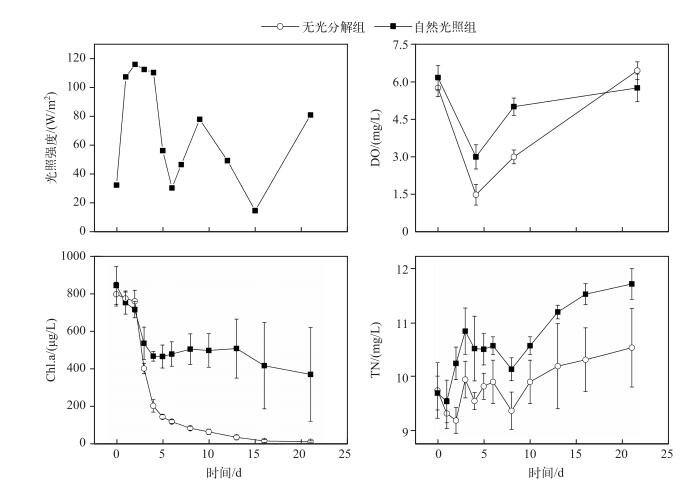
|
图 1 藻源性颗粒物降解过程中理化因子的变化 Fig.1 Variation of physical and chemical factors during the process of algae-originated particles decomposition |
实验开始时,在自然光照组和无光分解组DO浓度分别为6.16和5.76 mg/L,随后两种不同处理组中DO浓度均明显下降至最低,分别为3.18和1.61 mg/L.随后上升,到第21 d上升至实验初始水平(5.76和6.43 mg/L)(图 1).不同处理方式之间具有显著差异(P < 0.05).
实验初期,有光和无光条件下Chl.a浓度分别为804.61和793.96 μg/L,在0~5 d内均下降很快,分别降至463.80和114.23 μg/L,之后下降速率放缓,到21 d分别降至369.24和12.21 μg/L,自然光照组和无光分解组之间差异显著(P < 0.05).在8~13 d,自然光照组中Chl.a浓度甚至还有上升的趋势(图 1).
TN浓度在实验后期略有增加,整体变化不明显.有光和无光条件下从实验前的9.75和9.70 mg/L分别增加到实验后的10.54和11.72 mg/L.无光分解组的TN浓度总是稍小于自然光照组.不同处理方式之间不具有显著差异(图 1).
2.2 蓝藻分解过程中氨基酸浓度的变化实验期间,自然光照组和无光分解组中PAA浓度均随时间明显下降(图 2),在0~5 d,无光分解组和自然降解组中PAA浓度分别从0.44和0.46 mmol/L降至0.15和0.31 mmol/L,随后两种不同的处理中PAA浓度变化不明显,到实验结束时分别为0.06和0.30 mmol/L,无光分解组仍有一定的降解.通过分析可以看出,实验期间,自然光照组中PAA的降解率为34.8 %,而无光分解组中PAA的降解率高达86.0 %,无光分解组中PAA分解量较自然分解组更大,两组之间差异显著(P < 0.05).
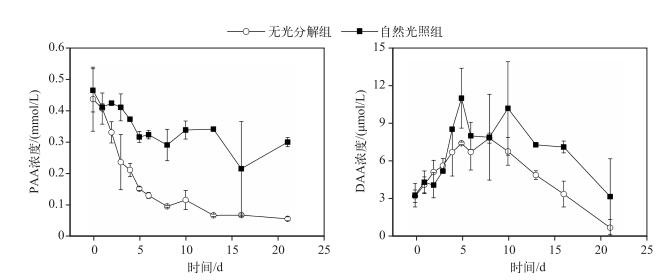
|
图 2 藻源性颗粒物降解过程中PAA和DAA浓度的变化 Fig.2 Variations of PAA and DAA during the process of algae-originated particles decomposition |
DAA浓度的变化与PAA不同,呈现出先增加后降低的趋势(图 2).实验前期0~6 d,自然光照组和无光分解组DAA浓度均显著增加,第6~8 d,分别上升到最大值(10.94和7.94 μmol/L).这时,水体中的DAA处于相对稳定的状态,DAA的生成与降解相对平衡.第8 d之后,均呈现一个下降的过程,在第21 d分别降至3.13和0.66 μmol/L.无光分解组DAA最终浓度低于初始浓度.将DAA随时间的变化曲线分为上升期(0~5 d)和降解期(10~21 d).可以发现在上升期,无光分解组DAA生成速率小于自然降解组;而在降解期,两组的分解速率并无显著性差异(P < 0.05).说明光照对上升期的DAA变化影响比较大.
无光分解组中PAA的降解比较符合Olson指数衰减模型(R2=0.9494),降解速率常数为0.17424 d-1;自然光照组的降解则不太符合,降解速率常数为0.03916 d-1(图 3).从PAA降解速率曲线来看,自然光照组的降解速率常数不足无光分解组的1/4,表明了光照对PAA降解的影响很大.
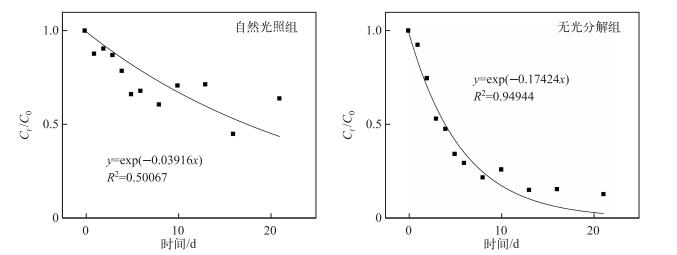
|
图 3 无光分解组和自然降解组中PAA的Olson指数衰减拟合曲线 Fig.3 Olson exponent fitting curves of PAA in aphotic decomposition group and natural light group |
选择实验初期(第0 d)、实验中期(第7 d)和实验末期(第21 d),在两种不同的处理条件下PAA和DAA中酸性、中性和碱性氨基酸的百分比含量的三角图(图 4).可以发现,在所有实验条件和时间点,PAA和DAA中中性氨基酸百分含量总是最大的,占总氨基酸含量的60 % ~90 %,酸性氨基酸次之,碱性氨基酸最小.
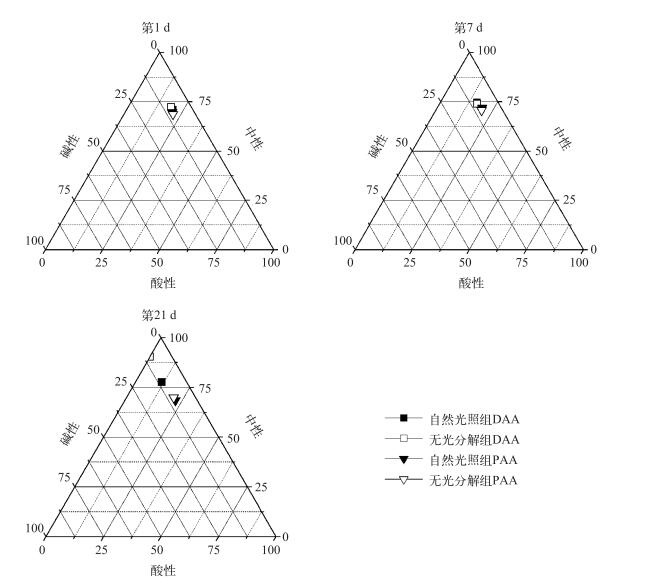
|
图 4 藻源性颗粒物分解过程中酸性、中性和碱性氨基酸的百分含量 Fig.4 Percentage composition of acidic, neutral and basic amino acids during the process of algae-originated particles decomposition |
随着实验的进行,PAA中氨基酸组分变化不明显,而DAA中则酸性氨基酸比重逐渐降低,从初始条件下的18 % ~20 %降低到11 %左右,而中性和碱性氨基酸比重则逐渐升高(中性氨基酸从70 % ~72 %增加到77 %左右、碱性氨基酸从8.8 %增加到10 %左右).其中,在第21 d无光分解组中DAA几乎检测不出酸性氨基酸,比重几乎为零.但是,在相同的时间点,不同处理方式对PAA和DAA的组成改变不大(图 4).
2.4 蓝藻分解过程中氮素百分含量的变化将TN浓度设为100 %,以百分比的形式表示NH4+-N、NO3--N、DAA、PAA和其他N浓度的关系.结果显示在藻源性颗粒物分解的过程中,存在着PAA先转化为NH4+-N,再转化为NO3--N的趋势.在实验初期,系统中的PAA百分含量占绝对优势(74 % ~80 %),而NH4+-N,NO3--N和DAA比例极低.随着实验的进行,PAA含量迅速降低,而NH4+-N浓度迅速升高.在无光分解组中,第4 d NH4+-N的百分含量超过了PAA,在第8 d达到最大值(79.8 %),随后逐步下降;而从第13 d开始,两个实验体系中NO3--N的百分含量均迅速增加.与无光分解组不同的是自然光照组中NH4+-N,NO3--N和PAA变化幅度较无光分解组要小,实验结束时PAA仍然是水体中百分含量最大的含氮化合物.此外,无光分解组中其他组份N浓度在实验末期明显增加,而在自然光照组中却不明显(图 5).
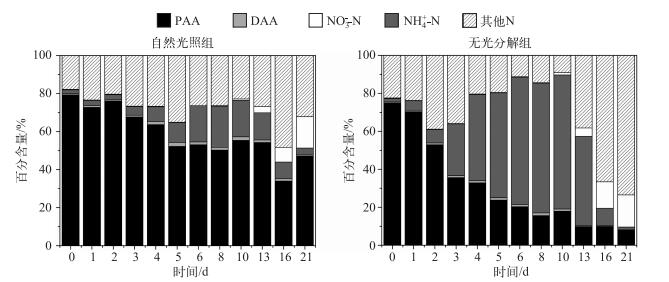
|
图 5 藻源性颗粒物分解过程中不同N素(NH4+-N、NO3--N、DAA、PAA和其他N)的百分含量 Fig.5 The percentage of different N forms (NH4+-N, NO3--N, DAA, PAA and the other forms of N) during the process of algae-originated particles decomposition |
PAA的分解量和分解速率会受到光照条件的制约;同样,作为PAA分解的中间产物,DAA也间接地受到光的作用.一般认为,光照对水华生消影响最大,是蓝藻生长和水华暴发的主导性因子[10],对PAA分解有着显著的影响.在有光照的条件下,PAA的分解会比无光条件下小得多.这是由两方面因素造成的:一方面,在光照条件下,浮游植物会通过光合作用进行有机质的合成[20-21],而PAA是合成的产物之一.这使得在自然光照条件下,堆积在上部的蓝藻可以通过光合作用合成PAA,宏观上降低了PAA的降解速度.一定条件下,甚至会趋于PAA的降解和合成的平衡状态,导致在往后的一段时间内Chl.a保持一个稳定的高值.另一方面,无光条件会使浮游植物细胞中进行氨基酸合成的碳骨架无效化,导致氨基酸的合成受到抑制[22-23],并且在光照强度很小的条件下,蓝藻的光合作用变弱, 而呼吸作用变强,迫使系统内的DO浓度水平降低,形成兼性厌氧的环境,加快了藻源性颗粒物中PAA的降解[24].因此,在光照较弱的甚至是无光的环境中,藻源性颗粒物中PAA分解很快,提高了藻源性颗粒物转化为无机氮的能力[25-26].
而水体中DAA的现存量取决于PAA转化为DAA和DAA转化为其他物质这两步反应.首先,PAA转化为DAA会受到光的影响.吴丰昌等[27]认为有机质从高分子量到低分子量降解途径可能主要是光化学降解.因此光照条件下DAA的生成量会大于无光条件.尽管在无光条件以及其造成的低氧环境可以促进有机质的分解[26],但是DAA的转化主要是依靠细菌的吸收[28],而光照与否引起水体中细菌的数量和结构以及功能的变化还需进一步深入探讨.
然而,光照并不能引起水体中PAA和DAA组成的变化,藻源性颗粒物分解过程中氨基酸组成的变化是由每种氨基酸自身的化学性质所决定的:酸性氨基酸由于自身降解性质容易降解[19-29],而碱性和中性氨基酸由于其化学惰性而难于降解[30-31].因此,随着有机质降解时间的增加,有机质中酸性氨基酸的含量会逐步降低,而碱性和中性氨基酸比例会有所提升.但是,由于氨基酸比较高的生物可利用性高[32],并且无论何种氨基酸,其分解的最终产物都是NH4+-N和NO3--N等无机氮,导致氨基酸自身的降解性质对藻类分解过程中氮释放的影响很小.
3.2 藻源性颗粒物中氨基酸分解转化对蓝藻水华维持的意义水体中PAA分解很快,分解量也大[7, 33];藻细胞中DAA浓度很可观[34],而DAA转化的速率可能比PAA更快[28].分解生成大量NH4+-N,并且能在水体中持续一定时间.另外,氨基酸不仅仅是水体中N的一种形式,也是水体中生物利用率较高的有机C的重要形式之一.甚至发现过一些浮游植物以DAA作为单一C源仍能继续生长的案例[35].而且一些氨基酸对特定藻类的生长具有特殊的作用[36].因此,在藻类生长的过程中,氨基酸可能是不可或缺的因子.
在富营养化程度较高的西北太湖,夏季大量的蓝藻群体过度堆积,导致水华下层容易出现蔽光低氧的环境[14],有利于蓝藻的分解,甚至可能出现类似于本次实验中无光分解组分解的情况,随后会导致大量PAA的转化[37].由于氨基酸较快的分解速度,使得藻类残体中的有机氮在残体逐渐下沉的过程中很大程度上被矿化,逐渐分解为DAA等小分子氮(图 6)[26, 34-38].研究显示,夏季富营养化水体中,异养细菌对游离氨基酸(DFAA,DAA中最易降解的一部分)的吸收转化要大于NH4+-N[39],而且更倾向于利用氨基酸作为自己的N源和C源[5],并通过自身的代谢作用氧化DAA使之同化为NH4+-N并释放到水体中[40],因而在上层处于生长期的藻类可以获得NH4+-N以供其继续生长增殖.实际上,在水华暴发的区域,处于生长期的蓝藻群体的N源可以通过处于衰亡期的蓝藻群体中的PAA分解提供,处于生长期的蓝藻群体在生命周期之后又会向下一代处于生长期的蓝藻群体提供氮源,使得氮素在水体表层蓝藻和在下层水体或沉积物表面的蓝藻残体之间往复循环,因此能够观察到在气象条件适宜的情况下蓝藻水华将会持续相当长的一段时间[41].然而长期避光厌氧的环境使得水体中生物群落结构发生改变,致使生成的无机氮(主要是NH4+-N)又转化为其他难以被生物利用的N.这些N可能是D型氨基酸和氨基糖等[15].
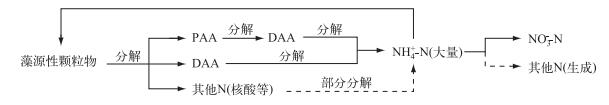
|
图 6 藻源性颗粒物分解过程中N素的可能转化途径 Fig.6 Possible transformation pathways of N forms during the process of algae-originated particles decomposition (实线表示无论是否光照,均会发生的转化途径;虚线表示主要发生在无光条件下的转化途径) |
在自然光照及无光条件下,藻源性颗粒物中PAA均有一定的分解量.无光条件下的分解量远大于自然光照组.无光条件下86.0 %的PAA被分解,分解速率常数高达0.17424 d-1.光照能够减缓PAA的分解.而DAA浓度呈现出先增加后减小的趋势,但所占N的百分比含量很低,最大仅占2 %.光照条件促进了DAA的生成.但是,光照并不能改变PAA和DAA的组成.藻源性颗粒物分解的过程中N素从PAA转化为NH4+-N和NO3--N,可向生长期的蓝藻群体提供无机氮,在一定程度上延长了夏季蓝藻水华的持续时间.
| [1] |
Yang GP, Chen Y, Gao XC. Distribution of dissolved free amino acids, dissolved inorganic nitrogen and chlorophyll a in the surface microlayer and subsurface water of the Yellow Sea, China. Continental Shelf Research, 2009, 29(14): 1737-1747. DOI:10.1016/j.csr.2009.05.015 |
| [2] |
Preston T, Bury S, Mcmeekin B et al. Isotope dilution analysis of combined nitrogen in natural waters:Ⅱ.amino acids. Rapid Communications in Mass Spectrometry, 1996, 10(8): 965-968. |
| [3] |
Lai Haiyan.Uptake and utilization characteristies of harmful algal bloom species for dissolved free amino acids[Dissertation].Guangzhou:Jinan University, 2011. [赖海燕. 典型赤潮藻对氨基酸的利用特性研究[学位论文]. 广州: 暨南大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10559-1011127784.htm ]
|
| [4] |
Zeng Jin, Yang Liuyan, Xiao Lin et al. Biogeochemical cycling of nitrogen in lakes and the role of microorganisms in conversion of nitrogen compounds. J Lake Sci, 2007, 19(4): 382-389. [曾巾, 杨柳燕, 肖琳等. 湖泊氮素生物地球化学循环及微生物的作用. 湖泊科学, 2007, 19(4): 382-389. DOI:10.18307/2007.0405] |
| [5] |
Wang Qiulu, Zhou Yanxia, Wang Jiangtao et al. Research of the assimilation of inorganic nitrogen by marine heterobacteria. Marine Science Bulletin, 2010, 29(2): 231-234, 240. [王秋璐, 周燕遐, 王江涛等. 海洋异养细菌对无机氮吸收的研究. 海洋通报, 2010, 29(2): 231-234, 240.] |
| [6] |
Hoch MP, Kirchman DL. Ammonium uptake by heterotrophic bacteria in the delaware estuary and adjacent coastal waters. Limnology and Oceanography, 1995, 40(5): 886-897. DOI:10.4319/lo.1995.40.5.0886 |
| [7] |
Antia NJ, Harrison PJ, Oliveira L. The Role of dissolved organic nitrogen in phytoplankton nutrition, cell biology and ecology. Phycologia, 1991, 30(1): 1-89. DOI:10.2216/i0031-8884-30-1-1.1 |
| [8] |
Zhou Tao, Li Zhengkui, Feng Lulu. The different roles of ammonium and nitrate in the bloom self-maintenance of Lake Taihu. China Environmental Science, 2013, 33(2): 305-311. [周涛, 李正魁, 冯露露. 氨氮和硝氮在太湖水华自维持中的不同作用. 中国环境科学, 2013, 33(2): 305-311.] |
| [9] |
Fiedler D, Graeber D, Badrian M et al. Growth response of four freshwater algal species to dissolved organic nitrogen of different concentration and complexity. Freshwater Biology, 2015, 60(8): 1613-1621. DOI:10.1111/fwb.12593 |
| [10] |
Huang Yuling, Chen Mingxi, Liu Defu et al. Effect of nitrogen, phosphorus, light and water temperature on the formation and disappearance of blue-green algae bloom. Journal of Northwest A & F University (Natural Science Edition), 2008, 36(9): 93-100. [黄钰铃, 陈明曦, 刘德富等. 不同氮磷营养及光温条件对蓝藻水华生消的影响. 西北农林科技大学学报:自然科学版, 2008, 36(9): 93-100.] |
| [11] |
Xu H, Paerl HW, Qin BQ et al. Nitrogen and phosphorus inputs control phytoplankton growth in eutrophic Lake Taihu, China. Limnology and Oceanography, 2010, 55(1): 420-432. DOI:10.4319/lo.2010.55.1.0420 |
| [12] |
Wu Shengli, Liu Cheng, Sun Jun et al. Remote sensing and analysis on meteorological factors of blue algal bloom in Lake Tai. Meteorological Monthly, 2009, 35(1): 18-23. [武胜利, 刘诚, 孙军等. 卫星遥感太湖蓝藻水华分布及其气象影响要素分析. 气象, 2009, 35(1): 18-23. DOI:10.7519/j.issn.1000-0526.2009.01.003] |
| [13] |
Zhu Guangwei. Spatio-temporal distribution pattern of water quality in Lake Taihu and its relation with cyanobacterial blooms. Resources and Environment in the Yangtze Basin, 2009, 18(5): 439-445. [朱广伟. 太湖水质的时空分异特征及其与水华的关系. 长江流域资源与环境, 2009, 18(5): 439-445.] |
| [14] |
Zhu Mengyuan, Zhu Guangwei, Wang Yongping. Influence of scum of algal bloom on the release of N and P from sediments of Lake Taihu. Environmental Science, 2011, 32(2): 409-415. [朱梦圆, 朱广伟, 王永平. 太湖蓝藻水华衰亡对沉积物氮、磷释放的影响. 环境科学, 2011, 32(2): 409-415.] |
| [15] |
Liu Zongguang, Wu Ying, Hu Jun et al. Distribution of particulate amino acids and its controlling factors in the PN transection of the East China Sea Shelf. Oceanologia et Limnologia Sinica, 2013, 44(3): 563-569. [刘宗广, 吴莹, 胡俊等. 东海陆架典型断面颗粒态氨基酸的分布及控制因素分析. 海洋与湖沼, 2013, 44(3): 563-569. DOI:10.11693/hyhz201303004004] |
| [16] |
"Monitoring and analysis method of water and wastewater" editorial board of State Environmental Protection Administration of China ed.Monitoring and analysis method of water and wastewater:Fourth Edition.Beijing:China Environmental Science Press, 2002. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法: 第4版. 北京: 中国环境科学出版社, 2002. ]
|
| [17] |
Yang Jingmin, Zhang Zhongqing, Cao Guojun. Soil nitrate and nitrite content determined by Skalar SAN++. Soil and Fertilizer Sciences in China, 2014, 2(2): 101-105. [杨靖民, 张忠庆, 曹国军. 应用间隔流动分析仪测定土壤硝态氮和亚硝态氮含量. 中国土壤与肥料, 2014, 2(2): 101-105. DOI:10.11838/sfsc.20140221] |
| [18] |
Olson JS. Energy storage and the balance of producers and decomposers in ecological systems. Ecology, 1963, 44(2): 322-331. DOI:10.2307/1932179 |
| [19] |
Xia Qingyan, Yang Guipeng, Gao Xianchi et al. Distribution and composition of dissolved amino acids in surface water of northern South China Sea. Marine Environmental Science, 2011, 30(6): 774-779. [夏清艳, 杨桂朋, 高先池等. 南海北部表层海水中溶解氨基酸的分布与组成研究. 海洋环境科学, 2011, 30(6): 774-779.] |
| [20] |
Qasim SZ, Bhattath PM, Devassy VP. The effect of intensity and quality of illumination on the photosynthesis of some tropical marine phytoplankton. Marine Biology, 1972, 16(1): 22-27. DOI:10.1007/BF00347843 |
| [21] |
Huang Yuling, Chen Mingxi. Simulation for algal bloom occurrence & disappearance and its variation process of dissolved oxygen. Environmental Science and Technology, 2013, 10(10): 67-72. [黄钰铃, 陈明曦. 水华生消模拟及其溶解氧变化过程分析. 环境科学与技术, 2013, 10(10): 67-72.] |
| [22] |
Fuhrman J, Ferguson R. Nanomolar concentrations and rapid turnover of dissolved free amino acids in seawater-agreement between chemical and microbiological measurements. Marine Ecology Progress Series, 1986, 33(3): 237-242. DOI:10.3354/meps033237 |
| [23] |
Fuhrman JA, Bell TM. Biological considerations in the measurement of dissolved free amino acids in seawater and implications for chemical and microbiological studies.Marine ecology progress series. Oldendorf, 1985, 25(1): 13-21. DOI:10.3354/meps025013 |
| [24] |
Sun Xiaojing, Qin Boqiang, Zhu Guangwei. Release of colloidal phosphorus, nitrogen and organic carbon in the course of dying and decomposing of cyanobacteria. China Environmental Science, 2007, 27(3): 341-345. [孙小静, 秦伯强, 朱广伟. 蓝藻死亡分解过程中胶体态磷、氮、有机碳的释放. 中国环境科学, 2007, 27(3): 341-345.] |
| [25] |
Li Ke, Guan Baohua, Liu Zhengwen. Experiments on decomposition rate and release forms of nitrogen and phosphorus from the decomposing cyanobacterial detritus. J Lake Sci, 2011, 23(6): 919-925. [李柯, 关保华, 刘正文. 蓝藻碎屑分解速率及氮磷释放形态的实验分析. 湖泊科学, 2011, 23(6): 919-925. DOI:10.18307/2011.0614] |
| [26] |
Shang Lixia, Ke Fan, Li Wenchao et al. Laboratory research on the contaminants release during the anaerobic decomposition of high-density cyanobacteria. J Lake Sci, 2013, 25(1): 47-54. [尚丽霞, 柯凡, 李文朝等. 高密度蓝藻厌氧分解过程与污染物释放实验研究. 湖泊科学, 2013, 25(1): 47-54. DOI:10.18307/2013.0107] |
| [27] |
Wu F, Mills R, Evans R et al. Kinetics of metal-fulvic acid complexation using a stopped-flow technique and three-dimensional excitation emission fluorescence spectrophotometer. Analytical Chemistry, 2004, 76(1): 110-113. DOI:10.1021/ac030005p |
| [28] |
Mulholland MR, Gobler CJ, Lee C. Peptide hydrolysis, amino acid oxidation, and nitrogen uptake in communities seasonally dominated by Aureococcus anophagefferens. Limnology and Oceanography, 2002, 47(4): 1094-1108. DOI:10.4319/lo.2002.47.4.1094 |
| [29] |
Carstens D, Köllner KE, Bürgmann H et al. Contribution of bacterial cells to lacustrine organic matter based on amino sugars and d-amino acids. Geochimica et Cosmochimica Acta, 2012, 89(4): 159-172. DOI:10.1016/j.gca.2012.04.052 |
| [30] |
Shen Bingliang, Cui Ying, Zhu Zhuoyi et al. Variation of particulate amino acid in the Suzhou River and the Huangpu River in Shanghai. Journal of East China Normal University (Natural Science Edition), 2014(1): 99-106. [沈冰良, 崔莹, 朱卓毅等. 苏州河和黄浦江颗粒态氨基酸的季节变化. 华东师范大学学报(自然科学版), 2014(1): 99-106.] |
| [31] |
Dauwe B, Middelburg JJ, Herman PM et al. Linking diagenetic alteration of amino acids and bulk organic matter reactivity. Limnology and Oceanography, 1999, 44(7): 1809-1814. DOI:10.4319/lo.1999.44.7.1809 |
| [32] |
Williams PLB. Heterotrophic utilization of dissolved organic compounds in the sea:I.size distribution of population and relationship between respiration and incorporation of growth substrates. Journal of the Marine Biological Association of the United Kingdom, 1970, 50(4): 859-870. DOI:10.1017/S0025315400005841 |
| [33] |
Palenik BP.Organic nitrogen utilization by phytoplankton:The role of cell-surface deaminases.DTIC Document, 1989.
|
| [34] |
Nguyen RT, Harvey HR. Protein and amino acid cycling during phytoplankton decomposition in oxic and anoxic waters. Organic Geochemistry, 1997, 27(3): 115-128. DOI:10.1016/S0146-6380(97)00076-4 |
| [35] |
Palenik B, Morel FMM. Amino acid utilization by marine phytoplankton:A novel mechanism. Limnology and Oceanography, 1990, 35(2): 260-269. DOI:10.4319/lo.1990.35.2.0260 |
| [36] |
Wang Xiaoxiong, Jiang Chengchun, Li Jinwei et al. Effects of Litchi chinensis defoliation on growth and photosynthesis of Microcystis aeruginosa. Envrionmental Science, 2015, 36(5): 1648-1654. [汪小雄, 姜成春, 李锦卫等. 荔枝落叶对铜绿微囊藻生长和光合作用的影响. 环境科学, 2015, 36(5): 1648-1654.] |
| [37] |
Hayashi T, Suitani Y, Murakami M et al. Protein and amino acid compositions of five species of marine phytoplankton. Bulletin of the Japanese Society of Scientific Fisheries (Japan), 1986, 26(8): 885-900. DOI:10.2331/suisan.52.337 |
| [38] |
Li Zhian, Zou Bi, Ding Yongzhen et al. Key factors of forest litter decomposition and research progress. Chinese Journal of Ecology, 2004, 23(6): 77-83. [李志安, 邹碧, 丁永祯等. 森林凋落物分解重要影响因子及其研究进展. 生态学杂志, 2004, 23(6): 77-83.] |
| [39] |
Pennock JR, Sharp JH. Temporal alteration between light-and nutrient-limitation of phytoplankton production in a coastal plain estuary. Marine Ecology Progress, 1994, 111(3): 275-288. DOI:10.3354/meps111275 |
| [40] |
Wheeler PA, Kirchman DL. Utilization of inorganic and organic nitrogen by bacteria in marine systems. Limnology and Oceanography, 1986, 31(5): 998-1009. DOI:10.4319/lo.1986.31.5.0998 |
| [41] |
Liu Jutao, Yang Yongsheng, Gao Junfeng et al. Characteristics of cyanobacteria bloom grading and its temporal and spatial varition in Taihu Lake. Resources and Environment in the Yangtze Basin, 2011, 20(2): 156-160. [刘聚涛, 杨永生, 高俊峰等. 太湖蓝藻水华分级及其时空变化. 长江流域资源与环境, 2011, 20(2): 156-160.] |
 2017, Vol. 29
2017, Vol. 29 

