(2: 国家环境保护湿地生态与植被恢复重点实验室, 长春 130024)
(3: 东北师范大学草地研究所植被生态科学教育部重点实验室, 长春 130024)
(2: State Environmental Protection Key Laboratory of Wetland Ecology and Vegetation Restoration, Changchun 130024, P. R. China)
(3: Institute of Grassland Science, Northeast Normal University, Key Laboratory for Vegetation Ecology, Ministry of Education, Changchun 130024, P. R. China)
自1950s末以来, 植硅体作为恢复古环境的代用指标, 被广泛应用于考古学、第四纪环境学中, 成为恢复古植被、古气候等的一种重要手段[1-6].而植硅体用于重建古环境是以植物植硅体的现代过程研究为基础的, 其中外界环境因子及植物的发育等自身因素对植硅体形态及组合特征影响的研究尤为关键.据介冬梅、李仁成等对羊草(Leymus chinensis)、芦苇(Phragmites australis)、竹子(Phyllostachys heterocycla)等少量植物与环境关系的研究发现, 不同植物的典型植硅体形态及植硅体形态组合特征都会不同程度地受温度、湿度、CO2浓度、土壤pH值等环境因子的影响[7-12], 且不同形态的植物植硅体对同一环境因子变化也具有不同的响应[13].目前的研究尽管明确了环境因子对现代植物植硅体形态有一定的影响, 但限于已有研究涉及的植物种类不同、研究区域不同, 尚存在对植硅体与环境的关系认识不统一、结果对比困难等问题, 因此, 亟待拓展植物种类和研究区域, 以期进一步丰富和完善已有的认识.
学者们通过测定多种植物的SiO2含量发现, 不同植物间硅含量不同, 同时, 同一植物不同器官的硅含量也存在明显差异[14-16].如水稻(Oryza sativa)各器官中硅(SiO2)的含量大小依次为谷壳、叶片、叶鞘、茎、根[17]; 玉米(Zea mays)中的硅主要分布在叶和根中[18].由于植物体内90 %以上的硅存在于植硅体中, 由此推断, 植物不同器官植硅体的含量也应有所不同, 王永吉等[2]也确实发现植物叶中植硅体含量远大于茎、根等部位.不仅植物不同器官的植硅体含量不同, 植物同一器官不同生长期的植硅体含量也有所不同.由于高等植物在不同的生育时期对硅的吸收量不同[19-20], 如水稻对硅的吸收主要在中后期, 分蘖前期吸收很少[21], 小麦在出苗至拔节期达到硅吸收的高峰期[22-23], 而植硅体的形成与细胞液泡溶解硅的浓度关系密切, 当溶解硅浓度达到一定限度后开始形成硅质颗粒[24], 因此, 植硅体的含量随植株的生长也有不同程度的变化.但由于自然界植物种类丰富, 对于植物植硅体的种类、数量, 特别是不同器官植硅体的种类和数量的分布还知之甚少, 同样, 不同植物植硅体类型随环境因子和生长期的变化特征也还不清楚.因此, 对于植物不同部位、不同生长期植硅体形态特征和一个完整的生长期内植物对硅的吸收过程的研究, 是深入理解植硅体的形成机理的必要途径.
湖沼湿地是湿地生态系统的重要组成部分,拥有丰富的水资源和野生动植物资源,并且在洪水调蓄、气候调节、维护生物多样性等方面发挥着不可替代的作用[25].湖沼湿地能综合反映气候和环境的变化,对全球气候变化响应敏感.近年来,随着全球气候变暖,湖泊面积、水位、水质及湖区生态多样化等均受到一定程度的影响[26].芦苇作为湖泊中优势植物种类,其数量和质量也对气候变化有所响应,而这种响应又间接影响到芦苇植硅体形态及数量特征的变化.于是,本文在自然湿度梯度条件下从芦苇生长期内植硅体类型组成和数量变化出发, 分析不同生长期、不同生境下芦苇茎、叶中同一类型植硅体的数量变化特征及其指示意义, 探讨植硅体形态及数量对环境因子的响应,以期为植硅体形成机理研究和利用植硅体定量恢复古环境提供理论依据及科学参考.
1 研究区域与研究方法 1.1 研究区域概况采样地点位于吉林省长春市区的南湖(43°50′6.23″~43°51′42″N, 125°16′59.12″~125°19′8.02″E).长春市位于吉林省的中部, 地处松辽平原的东部边缘,处于大陆性季风气候区, 是全国干湿气候分区中的湿润区向干旱区的过渡地带, 春季干燥多风, 夏季湿热多雨, 秋季天高气爽, 冬季干冷漫长[27].该地年平均气温4.8℃, 年最高气温39.5℃, 年最低气温-39.8℃.年降水量565 mm, 降水时空分布不均, 夏季多降雨, 降水量占全年的60 %以上, 空间分布自东向西递减.长春市主要的土壤类型有暗棕壤、黑土、黑钙土、草甸土.西部是黑钙土地带, 中部是黑土地带, 东部是暗棕壤地带, 自西向东更替.植被区系组成属于长白区系, 以红松和阔叶林为代表, 多为喜湿植物, 如红松(Pinus koraiensis)、紫椴(Tilia amurensis)、胡桃楸(Juglans mandshurica)和水曲柳(Fraxinus mandschurica)等[28].
1.2 研究方法 1.2.1 样点设计结合长春市自然状况, 采样时间设计为6个月, 分别为5、6、7、8、9、10月, 每个月采样时间为当月的15日, 并保证在同一样地采集样品.每月采集旱生(43°50′28.3″N,125°18′22.2″E)、季节性水生(43°50′49.1″N,125°18′47.2″E)及水生(43°50′28.5″N,125°18′27.1″E)3个生境的芦苇样品, 3个样地海拔分别为218、212和217 m.其中旱生生境是指长期不受湖水淹没影响的生长地;水生生境是指经常受到湖水淹没影响的生长地;季节性水生生境是指受到湖水季节性涨落淹没影响的生长地.
1.2.2 实验方法植硅体的提取采用湿式灰化法, 实验步骤如下:
(1) 清洗:分别选取不同采样点的5株芦苇样品的第3或4片叶子(或者是芦苇茎)混合后, 用超声波清洗仪反复清洗后放入烘箱中烘干.
(2) 氧化:将清洗干净的芦苇叶片(或芦苇茎)剪成小段, 称0.2 g, 放入离心管中, 加入浓硝酸, 高温氧化, 直至样品溶液澄清为止.
(3) 离心:在离心管中加入蒸馏水清洗样品, 用离心机(2000转/min)离心15 min并重复离心3次.
(4) 制片:将试管中的液体震荡均匀, 用一次性滴管取均匀样滴在载玻片上.用酒精灯加热, 样品均匀散开并干燥, 滴中性树胶于样品上并盖上盖玻片, 制成固定片.
(5) 鉴定与统计:将玻片置于MOTIC生物显微镜(DM-BA 300, 麦克奥实业集团有限公司, 厦门)下放大900倍观察、统计, 每个样品统计植硅体在300粒以上.
1.2.3 数据处理方法植硅体的数据处理方法主要包括利用SPSS 18.0进行聚类分析, 利用C2软件绘制植硅体组合图谱, 利用Photoshop 5软件绘制植硅体类型图版.
2 结果与分析 2.1 茎、叶植硅体组成共统计各个类型植硅体19100粒, 以鞍型、硅化气孔和帽型居多, 还有少量的尖型、毛发状、扇型、块状、棒型及其他类型(图 1、2).对典型的植硅体类型又进一步细分, 将鞍型的俯视及侧视图像分别命名为鞍型Ⅰ和鞍型Ⅱ; 帽型细分为平顶帽型、刺帽型和尖顶帽型; 棒型细分为光滑棒型、突起棒型和刺棒型.
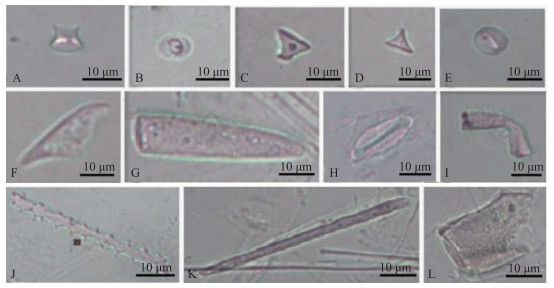
|
图 1 南湖芦苇茎中观察到的主要植硅体图版(A、B:鞍型;C~E:帽型;F、G:尖型;H:硅化气孔;I:小毛发状;J:刺状棒型;K:平滑棒型;L:块状) Fig.1 Typical phytoliths from Phragmites australis stem in Lake Nanhu(A, B: Saddle; C-E: Rondel; F, G: Lanceolate; H: Silicified stomata; I: Small hair; J: Elongate echinate; K: Elongate smooth; L: Blocky) |
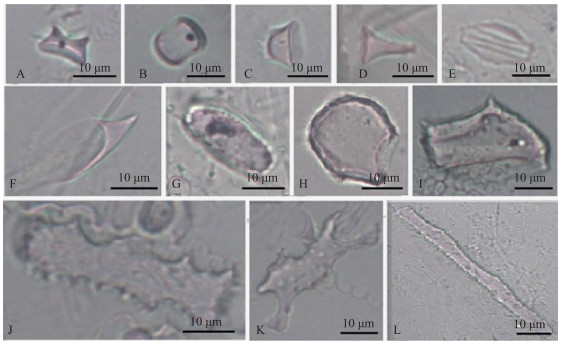
|
图 2 南湖芦苇叶中观察到的主要植硅体图版(A、B:鞍型;C、D:帽型;E:硅化气孔;F、G:尖型;H:扇型;I:块状;J:刺状棒型;K:牛角棒型;L:平滑棒型) Fig.2 Typical phytoliths from Phragmites australis leaf in Lake Nanhu (A, B: Saddle; C, D: Rondel; E: Silicified stomata; F, G: Lanceolate; H: Bulliform; I: Blocky; J: Elongate echinate; K: Elongate horned; L: Elongate smooth) |
由统计结果可知, 芦苇茎、叶中植硅体组合特征存在差异.首先, 虽然芦苇茎、叶中的植硅体都以鞍型、帽型等短细胞植硅体为主, 且茎、叶中鞍型含量都多于帽型, 但茎和叶中帽型的百分含量有很大差异.芦苇叶中帽型百分含量大多低于10 %, 而茎中帽型的百分含量集中于30 % ~40 %之间, 明显高于叶中.其次, 芦苇茎、叶中硅化气孔的含量差异明显.茎中硅化气孔很少见, 含量大多小于5 %,而叶中硅化气孔含量较多, 除5月的旱生芦苇叶外, 大多集中于40 % ~50 %之间.最后, 茎、叶中的尖型、块状、棒型、扇型等个体较大的植硅体组成也有所不同, 芦苇茎中尖型、扇型、棒型等个体较大的植硅体百分含量明显多于叶, 尤其是尖型和棒型.将不同生长期、不同生境的芦苇茎、叶中各类型植硅体的百分含量进行聚类分析(图 3), 也发现除了5月的旱生芦苇叶样品外, 其他芦苇叶样品与芦苇茎样品能够明显区分, 对每个月份的芦苇叶样品与芦苇茎样品分别进行聚类分析, 结果类似, 除了5月的旱生叶错误地归入茎中外, 其他月份的芦苇叶、茎都能够明显区分, 这进一步说明了芦苇叶与茎中植硅体组合特征存在明显差异.
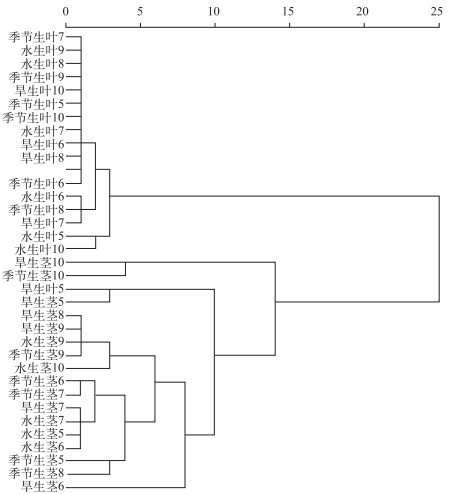
|
图 3 南湖芦苇茎和叶植硅体的聚类分析 Fig.3 Dendrogram resulting from cluster analysis on phytoliths from P. australis leaf and stem in Lake Nanhu |
不同生长期芦苇茎中植硅体组合都以鞍型为主, 占到总量的50 % ~60 %, 其次为帽型, 百分含量约为25 % ~35 %, 硅化气孔含量均小于7 %, 其他类型所占比例均小于5 % (图 4).随着芦苇的生长, 茎中鞍型植硅体的含量先下降后上升, 8月达到谷值, 变化幅度约为6 %; 帽型植硅体含量呈现先增加后减少又增加的变化趋势, 6月为帽型含量的峰值, 8月为其谷值, 生长后期含量稍有增加但含量仍小于生长前期, 百分含量于20 % ~36 %之间波动, 茎中鞍型、帽型等短细胞植硅体数量变化规律与叶中相似, 都随着植株的生长含量变化不大或生长后期有所减少, 不同的是, 茎中帽型含量及其变化幅度比叶中大的多; 茎中硅化气孔的含量呈现先增加后减少的趋势, 在8月达到峰值, 而叶中硅化气孔数量随着植株的生长一直持续增加; 茎中其他类型植硅体的百分含量大多低于5 %, 与叶中此类植硅体数量变化趋势较为一致, 即在植株生长后期此类植硅体含量有所上升, 但上升幅度不大, 其中棒型含量持续增加, 从1 %上升为6 %; 尖型的含量变化为先增加后减少; 茎中扇型、块状较少见.
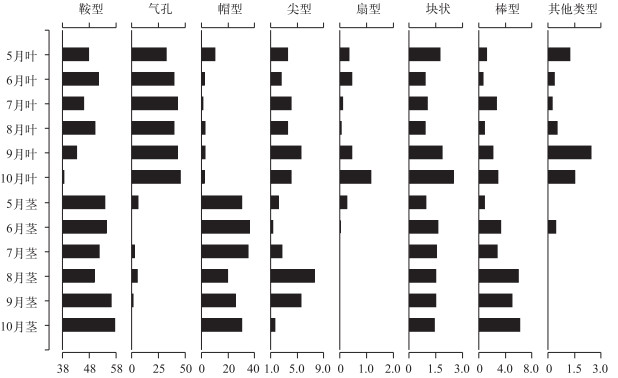
|
图 4 5-10月南湖芦苇叶、茎植硅体含量(%) Fig.4 Relative frequency (%) of various phytoliths from P. australis leaf and stem in different growth periods during May and October in Lake Nanhu |
不同生长期芦苇叶中植硅体组合差异较小, 都是鞍型、硅化气孔含量最多, 两者占到总量的80 % ~90 %, 尖型植硅体百分含量占3 % ~5 %, 其他类型所占比例大多小于3 % (图 4).虽然芦苇叶中不同生长期所统计到的植硅体类型相同且植硅体组合差异也较小, 但不同生长期芦苇叶中各类型植硅体所占比例也有细微差别.随着芦苇的生长, 鞍型植硅体的含量呈波动下降, 在6、8月分别达到峰值而生长后期从8月的50 %下降到10月的38 %, 波动幅度相对较大; 帽型植硅体含量也有波动下降的趋势, 但波动幅度较小, 除了5月含量较为异常, 高达10 %外, 其他月份均小于3 %; 叶中硅化气孔含量持续上升, 且上升幅度较大, 百分含量从32 %上升为46 %; 虽然个体相对较大的尖型、扇型、块状、棒型所占比重及波动幅度均较小, 但随着植株的生长都呈现持续或波动上升的趋势.
2.3 不同生境主要植硅体的含量变化不同生境芦苇茎中植硅体组合差异相对较小, 鞍型、帽型含量最多, 两者之和在旱生生境、季节性水生生境和水生生境下分别为88 %、79 %和84 %, 硅化气孔含量均小于5 %, 尖型、棒型等含量大多小于3 %.芦苇茎中不同类型的植硅体含量随生境的变化各有不同, 但整体来看, 相同类型的植硅体含量变化幅度均较小.一方面, 含量相对较多的鞍型、帽型于不同生境变化趋势不同.鞍型在旱生生境中含量最多, 其次分别是水生生境、季节性水生生境, 含量分别为58 %、55 %和48 %, 而叶中鞍型数量变化与其不同, 季节性水生生境中鞍型含量大于水生生境; 不同生境茎中帽型植硅体含量均为30 %左右, 而不同生境叶中帽型含量均低于5 %.另一方面, 与芦苇叶中含量较少的植硅体类型均表现为由旱生生境向水生生境递增的趋势不同, 茎中含量较少的植硅体含量波动范围均小于3 %, 但植硅体随生境的变化规律各有特点.茎中尖型和块状植硅体都是季节性水生生境含量最多, 水生生境居中, 旱生生境最少, 而棒型和硅化气孔植硅体的百分含量则是季节性水生生境含量最多, 旱生生境居中, 水生生境最少(图 5).
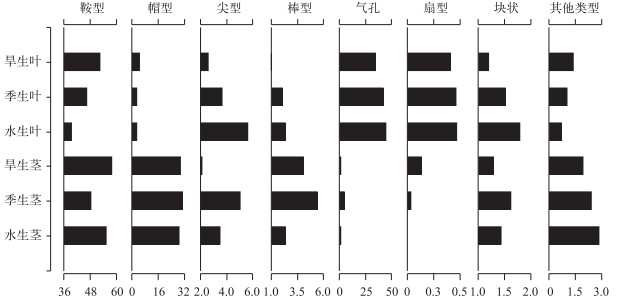
|
图 5 南湖不同生境芦苇茎、叶植硅体含量(%) Fig.5 Relative frequency (%) of various phytoliths from P. australis leaf and stem in different humidity in Lake Nanhu |
不同生境芦苇叶中植硅体组合都以鞍型、硅化气孔为主, 两者在旱生生境、季节性水生生境、水生生境分别占到总量的88 %、89 %和85 %, 帽型、尖型含量其次, 在3种生境下含量集中于2 % ~5 %, 棒型、扇型、块状等植硅体含量大多小于2 %.不同生境芦苇叶中同一类型植硅体含量呈现明显的规律性变化.一方面, 芦苇叶中鞍型、硅化气孔的含量较大且在不同生境中数量变化幅度也较大.芦苇叶中的鞍型含量由旱生生境向水生生境递减, 波动较大, 从52 %减为39 %, 而硅化气孔含量正相反, 由旱生生境的35 %递增为水生生境的45 %.另一方面, 芦苇叶中含量相对较少的棒型、块状、尖型含量于不同生境的变化趋势比较一致, 均由旱生生境向水生生境递增, 3种类型植硅体的增加幅度都小于3 % (图 5).
3 讨论由以上统计可知, 植硅体组合特征及相同类型的植硅体含量在芦苇的不同器官、不同生长期、不同湿度的变化规律各异, 以下主要从植硅体形成的植物自身因素及外界环境因素等方面分析植硅体含量变化的影响因素.
3.1 茎、叶的植硅体组合分析以上所研究的植硅体组合特征与介冬梅、刘利丹等关于芦苇植硅体组合的认识较为一致,都是以鞍型、帽型等短细胞植硅体居多, 还有少量的尖型、毛发状、扇型、块状、棒型及其他类型[7, 31].芦苇中茎、叶植硅体组合特征存在差别的观点也与其他学者们的认识相符,Montti等研究竹亚科植物时也发现植物根、茎、叶植硅体形态和数量明显不同[29].植物不同器官中植硅体组合特征存在差异, 归根结底是植物不同器官硅化部位的不同造成的.据研究, 根部的硅主要存在于内皮层细胞壁和通气组织中; 茎和叶鞘中硅主要存在于外表皮、维管束和薄壁组织的细胞壁中; 叶片中硅不仅存在于表皮细胞内, 同时还沉淀于细胞外[17, 30].茎中硅化气孔的含量普遍低于2 %, 而叶中则较高, 可达到40 %以上, 这与之前关于硅化气孔在芦苇植物叶中的含量较高、茎中相对较少的认识是一致的[31].这也易于理解, 硅化气孔是植物蒸腾过程中水蒸汽从体内排到体外的主要出口, 也是光合作用吸收空气中二氧化碳的主要入口[32], 而植物的蒸腾作用、光合作用主要发生于叶片中, 因此植物叶片中硅化气孔的含量远远高于茎中; 茎中棒型、扇型及尖型等个体较大的植硅体含量明显多于叶中可能与茎的支撑功能有关.可见, 芦苇茎中棒型、扇型及尖型等个体较大的植硅体的百分含量越大, 则说明芦苇抗倒伏的能力越强.
3.2 不同生长期主要植硅体的含量变化分析各类型植硅体含量变化规律随着植物发育阶段的不同也有所不同.鞍型、帽型等短细胞植硅体含量在芦苇生长初期含量较大, 随着植株的生长百分含量逐渐下降, 而尖型、扇型等个体较大的植硅体随着芦苇植株的生长含量有所增加.原因可能是芦苇在6、7月光合作用较强, 同时叶片表皮层的蒸腾作用增强, 此时叶片中的短细胞活动增强, 由短细胞硅化形成的鞍型、帽型植硅体也随之增多, 到了8月下旬生长旺期结束, 芦苇进入生长后期, 起支撑作用的机动细胞硅化作用增强, 形成的芦苇大型植硅体增多[31].这与吕厚远等的观点也是一致的, 其认为短细胞植硅体是由细胞内部物质的残遗物迅速硅化而成, 在植物早期生长过程就开始生长发育, 并可能形成于一个非常迅速的突变过程; 而长细胞、机动细胞中的植硅体填充可能是从外壁开始的, 然后逐渐充满整个细胞中心, 是一个在细胞中逐渐沉淀形成的长期过程[2]; 另有研究显示, 植物硅化气孔密度与温度呈正相关, 在温度较高的情况下, 植物的蒸腾作用较强, 为了水分和矿质元素的运输, 硅化气孔数目可能会增多[33-34].这一观点能够解释该研究中硅化气孔含量随植物生长逐渐增加的现象.同时, 芦苇叶中硅化气孔含量的增加也可能与芦苇植株叶面积的增大有关.总之, 不同生长期各类型的植硅体含量的变化与芦苇的光合作用及蒸腾作用关系密切, 而具体环境因子对植硅体的影响仍需深入探讨.
3.3 不同生境主要植硅体的含量变化分析不同生境中各类型植硅体含量的变化各有特点.一方面, 从数据中不难看出, 芦苇叶中硅化气孔含量在芦苇生长期内每个月份都是水生生境>季节性水生生境>旱生生境.有研究表明, 生境中水分亏缺是限制芦苇生长的主要环境因素[35], 生境中的水分条件差异将会导致植物的光合作用、蒸腾作用及呼吸作用等植物生理活动的差异[36-37].相对而言, 旱生芦苇生长在南湖周围的岸滩上, 土壤松散且湿度相对较小, 芦苇植物的蒸腾作用相对明显, 为了自我保护芦苇只能通过改变自身组织构造来适应周围的生长环境, 这种自我保护即抗干旱的表现[38], 而改变自身组织构造则是通过减少叶片中硅化气孔的数量, 以维持植株内水分的正常含量.水生生境的芦苇由于生长期内全部被湖水所浸润, 水分从湖水中不断向芦苇植株内渗透, 导致芦苇内水分过饱和, 为了使自身流动水达到平衡, 主要通过增大蒸腾作用及光合作用效率来消耗水分,而植物气孔是蒸腾过程中水蒸汽从体内排到体外的主要出口,也是光合作用和呼吸作用与外界气体交换的通道,因此,水生生境中硅化气孔含量相对普遍较多[39].季节性水生的芦苇植株生长环境介于旱生和水生两种生境之间, 其生长环境如土壤水分等也相对居中, 硅化气孔含量也介于旱生和水生生境之间.由此可推测芦苇叶中硅化气孔含量的多少可以表示芦苇生长环境的干湿状况.这一结论与Guo等[11]发现水生植物中硅化气孔的含量明显高于中生植物, Madella等[10]认为灌溉后小麦中硅化气孔含量多于旱生麦的认识都不谋而合.另一方面, 鞍型是芦竹亚科类植物的典型形态, 本文研究发现芦苇叶中鞍型百分含量各月份都表现为旱生生境下的含量最高, 其次是季节性水生生境和水生生境,即鞍型植硅体对湿度的响应表现为湿度越大,则鞍型含量越低.这一规律与其他学者的认识也是一致的,王永吉等[2]通过比较不同气候区若干表土中鞍型的数量, 认为鞍型代表暖干的气候特征, Liu等[40]研究芦苇植硅体对湿度的响应时,也发现湿度越大,鞍型含量越少的规律.
4 结论1) 芦苇茎、叶中都以鞍型、帽型等短细胞植硅体为主, 而芦苇茎中帽型含量明显高于叶中, 个体较大的植硅体含量也高于叶中, 但芦苇茎中硅化气孔含量远远低于叶中, 芦苇茎、叶中植硅体组合存在明显差异.
2) 不同生长期芦苇茎、叶中各类型植硅体的含量变化规律各异, 茎、叶中鞍型、帽型的含量都随着植株的生长变化不大或有所减少; 茎中硅化气孔先增加后减少而叶中硅化气孔含量持续增加; 茎中个体较大的植硅体含量为生长后期大于前期而叶中此类植硅体的总含量都有所增加, 而扇型、尖型等单独的植硅体含量变化规律性不强, 说明芦苇不同器官植硅体的硅化时间不同, 茎、叶植硅体随生长期的变化有所差异可能与植物自身的生理机制有关.
3) 不同生境条件下芦苇叶比茎中植硅体含量变化规律明显, 其中芦苇叶中硅化气孔、鞍型植硅体对环境的干湿状况有指示作用, 即芦苇叶中硅化气孔含量越高, 则表明芦苇生长环境越湿润, 而鞍型植硅体一般在干旱环境下含量越高.
| [1] |
Lü Houyuan, Wang Yongji. A study on phytoliths in Loess profile and paleoenvironmental evolution at HeiMuGou in LuoChuan, Shanxi Province since Late Pleistocene. Quaternary Sciences, 1991(1): 72-84. [吕厚远, 王永吉. 晚更新世以来洛川黑木沟黄土地层中植物硅酸体研究及古植被演替. 第四纪研究, 1991(1): 72-84.] |
| [2] |
Wang Yongji, Lü Houyuan. Phytolith study and its application contents. Beijing: China Ocean Press, 1992, 228. [王永吉, 吕厚远. 植物硅酸体研究及应用. 北京: 海洋出版社, 1992, 228.]
|
| [3] |
Wang Weiming, Liu Jinling, Zhou Xiaodan. Study on phytolith climate index in Homo erectus cave deposits Nanjing. Chinese Science Bulletin, 2003, 48: 1205-1208. [王伟铭, 刘金陵, 周晓丹. 南京直立人洞穴沉积的植硅体气候指数研究. 科学通报, 2003, 48: 1205-1208. DOI:10.3321/j.issn:0023-074X.2003.11.018] |
| [4] |
Horrocks M, Deng Y, Ogden et al. A reconstruction of the history of a Holocene sand dune on Great Barrier Island, northern New Zealand, using pollen and phytolith analyses. Journal of Biogeography, 2000, 27(6): 1269-1277. DOI:10.1046/j.1365-2699.2000.00508.x |
| [5] |
Gu YS, Pearsall DM, Xie SC et al. Vegetation and fire history of a Chinese site in southern tropical Xishuang banna derived from phytolith and charcoal records from Holocene sediments. Journal of Biogeography, 2008, 35: 325-341. |
| [6] |
Iriarte J, Paz EA. Phytolith analysis of selected native plants and modern soils from southeastern Uruguay and its implications for paleoenvironmental and archeological reconstruction. Quaternary International, 2009, 193: 99-123. DOI:10.1016/j.quaint.2007.10.008 |
| [7] |
Jie Dongmei, Ge Yong, Guo Jixun et al. Response of phytolith in Leymus chinensis to the simulation of global warming and nitrogen deposition on Songnen Grassland, China. Environmental Science, 2010, 31: 1708-1715. [介冬梅, 葛勇, 郭继勋等. 中国松嫩草原羊草植硅体对全球变暖和氮沉降模拟的响应研究. 环境科学, 2010, 31: 1708-1715.] |
| [8] |
Ge Yong, Jie Dongmei, Guo Jixun et al. Response of phytoliths in Leymus chinensis to the simulation of elevated global CO2 concentrations in Songnen Grassland, China. Chinese Science Bulletin, 2010, 55: 2735-2741. [葛勇, 介冬梅, 郭继勋等. 松嫩草原羊草植硅体对模拟全球CO2浓度升高的响应研究. 科学通报, 2010, 55: 2735-2741.] |
| [9] |
Lu HY, Liu KB. Morphological variations of lobate phytoliths from grasses in China and the southeastern USA. Diversity and Distributions, 2003, 9: 73-87. |
| [10] |
Madella M, Jones MK, Echlin P. Plant water availability and analytical microscopy of phytoliths:Implications for ancient irrigation in arid zones. Quaternary International, 2009, 193: 32-40. DOI:10.1016/j.quaint.2007.06.012 |
| [11] |
Guo ME, Jie DM, Liu HM et al. Phytolith analysis of selected wetland plants from Changbai Mountain region and implications for palaeoenvironment. Quaternary International, 2012, 250: 119-128. DOI:10.1016/j.quaint.2011.05.009 |
| [12] |
Liu LD, Jie DM, Liu HY et al. Response of phytoliths in Phragmites communis to humidity in NE China. Quaternary International, 2013, 304: 193-199. DOI:10.1016/j.quaint.2013.03.020 |
| [13] |
Li Rencheng, Fan Jun, Gao Chonghui. Advances in modern phytolith research. Advances in Earth Science, 2013, 28: 1287-1295. [李仁成, 樊俊, 高崇辉. 植硅体现代过程研究进展. 地球科学进展, 2013, 28: 1287-1295.] |
| [14] |
Gao Dan, Chen Jining, Cai Kunzheng et al. Distribution and absorption of silicon in plant and its role in plant disease resistance under environmental stress. Acta Ecologica Sinica, 2010, 30: 2745-2755. [高丹, 陈基宁, 蔡昆争等. 硅在植物体内的分布和吸收及其在病害逆境胁迫中的抗性作用. 生态学报, 2010, 30: 2745-2755.] |
| [15] |
Xu Yongjian, Tang Lingyun, Zhu Zhenfeng et al. Silicon content and their distribution in bamboo and straw. Paper And Paper Making, 2011, 30(11): 42-44. [徐永建, 唐凌云, 朱振峰等. 草类及竹类原料中硅的含量及分布. 纸和造纸, 2011, 30(11): 42-44.] |
| [16] |
Tang Xu, Zheng Yi, Zhang Chaochun. Silicon uptake by plants and its effects on pets and diseases resistance. Journal of Yunnan Agricultural University, 2005, 20(4): 495-499. [唐旭, 郑毅, 张朝春. 植物的硅吸收及其对病虫害的防御作用. 云南农业大学学报, 2005, 20(4): 495-499.] |
| [17] |
Liang Yongchao, Zhang Yongchun, Ma Tongsheng. Plant silicon nutrition. Progress in Soil Science, 1993, 21: 714. [梁永超, 张永春, 马同生. 植物的硅素营养. 土壤学进展, 1993, 21: 714.] |
| [18] |
Xiao Qianming, Ma Xingquan, Lou Chunrong et al. Study on the relationship between silicon nutrition and soil available Si relations in Corn. Chinese Journal of Soil Science, 1999, 30: 185-188. [肖千明, 马兴全, 娄春荣等. 玉米硅的阶段营养与土壤有效硅关系研究. 土壤通报, 1999, 30: 185-188. DOI:10.3321/j.issn:0564-3945.1999.04.014] |
| [19] |
Yang Jiantang, Gao Erming, Huo Xiaoting et al. Study on the characteristics of absorption and distribution of Si in rice. Journal of Henan Agricultural University, 2000, 34(1): 37-42. [杨建堂, 高尔明, 霍晓婷等. 沿黄稻区水稻硅素吸收、分配特点研究. 河南农业大学学报, 2000, 34(1): 37-42.] |
| [20] |
Li Zimin, Song Zhaoliang, Jiang Peikun. The production and accumulation of phytoliths in rice ecosystems:A case study to Jiaxing Paddy Field. Acta Ecologica Sinica, 2013, 33: 7197-7203. [李自民, 宋照亮, 姜培坤. 稻田生态系统中植硅体的产生与积累研究-以嘉兴稻田为例. 生态学报, 2013, 33: 7197-7203.] |
| [21] |
Zhu Xiaoping, Wang Yibing, Li Jiaquan. Study on the characteristics of silicon nutrition of rice. Chinese Journal of Soil Science, 1995, 26: 232-233. [朱小平, 王义炳, 李家全. 水稻硅素营养特性的研究. 土壤通报, 1995, 26: 232-233.] |
| [22] |
Chen Xinghua, Liang Yongchao. The study on silicon nutrient absorption of Wheat. Soil and Fertilizer, 1991(5): 38-40. [陈兴华, 梁永超. 小麦对硅素养分吸收的初探. 土壤肥料, 1991(5): 38-40.] |
| [23] |
Zhang Cuizhen, Quan Weizhan. Study on absorbing silicon characteristics and application effect in Wheat. Journal of Shandong Agricultural Science, 1998(4): 29-31. [张翠珍, 泉维沾. 小麦吸硅特点及应用效果的研究. 山东农业科学, 1998(4): 29-31.] |
| [24] |
Li Rencheng.Taxonomic significance and seasonal variations of lipid from Bamboo leaf and its phytolith[Dissertation].Wuhan:China University of Geosciences, 2010. [李仁成. 竹叶及其植硅体类脂物的分类学意义及其季节性变化[学位论文]. 武汉: 中国地质大学, 2010. ]
|
| [25] |
Gui Zhifan, Xue Bin, Yao Shuchun et al. Responses of lakes in the Songnen plain to climate change. J Lake Sci, 2010, 22(6): 852-861. [桂智凡, 薛滨, 姚书春等. 东北松嫩平原区湖泊对气候变化响应的初步研究. 湖泊科学, 2010, 22(6): 852-861. DOI:10.18307/2010.0607.] |
| [26] |
Xu Fengjiao.Researching Ecological zoning of lake and marsh wetlands in China[Dissertation].Beijing:Capital Normal University, 2014. [徐凤娇. 中国湖沼湿地生态分区研究[学位论文]. 北京: 首都师范大学, 2014. ]
|
| [27] |
Yin Hua.Study on environmental carrying capacity and total amount control in main rivers of Changchun city[Dissertation].Changchun:Jilin University, 2004. [尹华. 长春市主要河流环境容量及其总量控制研究[学位论文]. 长春: 吉林大学, 2004. ]
|
| [28] |
Sun Ming.Studies on the greenland plant arrangement and ecological suitability of residential districts in Changchun city[Dissertation].Changchun:Jilin Agricultural University, 2010. [孙铭. 长春市居住区绿地植物配置与生态适宜性研究[学位论文]. 长春: 吉林农业大学, 2010. ]
|
| [29] |
Montti L, Honaine MF, Osterrieth M et al. Phytolith analysis of Chusquea ramosissima Lindm.(Poaceae:Bambusoideae) and associated soils. Quaternary International, 2009, 193: 80-89. DOI:10.1016/j.quaint.2007.11.024 |
| [30] |
Kondo R. Phytolith Study Ⅱ. Japanese Society of Pedology, 2005, 49(1): 38-51. |
| [31] |
Liu Lidan, Jie Dongmei, Liu Hongyan et al. Change characters of Phragmites australis phytolith in Northeast China. Chinese Journal of Plant Ecology, 2013, 37: 861-871. [刘利丹, 介冬梅, 刘洪妍等. 东北地区芦苇植硅体的变化特征. 植物生态学报, 2013, 37: 861-871.] |
| [32] |
Hetherington AM, Woodward FI. The role of stomata in sensing and driving environmental change. Nature, 2003, 424: 901-908. DOI:10.1038/nature01843 |
| [33] |
Zuo Wenyun, He Jinsheng, Han Mei et al. Responses of plant stomata to elevated CO2 and temperature:Observations from 10 plant species grown in temperature and CO2 gradients. Acta Ecologica Sinica, 2005, 25: 565-574. [左闻韵, 贺金生, 韩梅等. 植物硅化气孔对大气CO2浓度和温度升高的反应-基于在CO2浓度和温度梯度中生长的10种植物的观测. 生态学报, 2005, 25: 565-574. DOI:10.3321/j.issn:1000-0933.2005.03.025] |
| [34] |
Shi Fusun, Wu Ning, Wu Yan et al. Effect of simulated temperature enhancement on growth and photosynthesis of Deschampsia caespitosa and Thlaspi arvense in northwestern Sichuan, China. Chinese Journal of Applied and Environmental Biology, 2009, 15: 750-755. [石福孙, 吴宁, 吴彦等. 模拟增温对川西北高寒草甸两种典型植物生长和光合特征的影响. 应用与环境生物学报, 2009, 15: 750-755.] |
| [35] |
Zhao Jiansong, Bai Mei, Cheng Fengming et al. Physio-ecological characteristica of Phragmite saustralis and Arundo donax under two types of constructed wetlands. Wetland Science, 2008(6): 398-404. [赵建松, 白梅, 程凤鸣等. 两种人工湿地条件下芦苇与芦竹生理生态特性研究. 湿地科学, 2008(6): 398-404.] |
| [36] |
Zhang Chenglie, Chen Guocang. Study on gas exchange characteristics of Phregmites communis Trin.in different ecotypes of dry desert of the Hexi Corridor. Acta Ecologica Sinica, 1991, 11: 250-255. [张承烈, 陈国仓. 河西走廊不同生态类型芦苇的气体交换特点的研究. 生态学报, 1991, 11: 250-255.] |
| [37] |
Bethke PC, Drew MC. Stomatal and nonstomatal components to inhibition of photosynthesis in leaves of Capsicum annmu during progressive exposure to NaCl salinity. Plant Physiology, 1992, 99: 219-226. DOI:10.1104/pp.99.1.219 |
| [38] |
Wang Xiyan, Zhang Yulong, Zhang Hengming et al. Research advance of silicon biochemical functions on crop. Soil and Fertilizer Sciences in China, 2007(6): 6-9. [王喜艳, 张玉龙, 张恒明等. 植物体内硅素生物化学作用及机理研究进展. 中国土壤与肥料, 2007(6): 6-9. DOI:10.11838/sfsc.20070602] |
| [39] |
Xu Jiang, Wei Jun, Gao Huiyuan et al. Studies on morpha and structure of three distinct growth forms Phargmites australis. Grassland of China, 1995(5): 49-52. [徐江, 卫军, 高辉远等. 三种生长型芦苇形态结构的研究. 中国草地, 1995(5): 49-52.] |
| [40] |
Liu LD, Jie DM, Liu HY et al. Response of phytoliths in Phragmites communis to humidity in NE China. Quaternary International, 2013, 304: 193-199. DOI:10.1016/j.quaint.2013.03.020 |
 2017, Vol. 29
2017, Vol. 29 

