(2: 水资源安全保障湖北省协同创新中心, 武汉 430072)
(2: Hubei Provincial Collaborative Innovation Center for Water Resources Security, Wuhan 430072, P. R. China)
水生植物是水生生态系统中重要的初级生产者, 是水体营养盐循环的重要环节, 也是水生生态系统结构和功能的重要组成部分[1].研究表明, 水生植物在生长发育过程中, 可以从水体和底泥中吸收和富集氮、磷等营养元素, 并通过根系和茎叶向水体和底泥释放氧气, 调节水体的营养物质平衡, 并通过与环境的相互作用来改变水体的理化性质[2-6].水生植物(尤其是沉水植物)的生长还可以吸附悬浮颗粒, 减少底泥的再悬浮, 从而达到提高水体透明度的目的[7].不仅如此, 水生植物还可以分泌他感物质抑制藻类生长繁殖, 可起到控制蓝藻水华的目的[8-10], 也可以通过影响水体微生物的种类多样性和群落结构来改善水质情况[11].基于以上特点, 水生植物修复已经成为水体富营养化生态治理的重要措施[12-13].
但是, 植物经历萌发-生长-衰亡的周期, 水生植物衰亡易引起二次污染[14], 也给水体修复带来不利影响.研究表明, 植物衰亡凋落后的腐烂分解, 经过一系列复杂的物理、化学和生物作用过程, 将有机质转换为无机质[15], 向水体释放有机物和营养盐对水生生态系统的修复产生负效应[16].该过程包括2个阶段, 即前期以淋溶作用为主的快速分解阶段和后期以生物作用为主的缓慢分解阶段[17-18].植物腐烂分解过程受到各种因子的影响, 包括生物因子和非生物因子, 植物的种类和化学组成、微生物群落结构、温度、pH、电导率、营养水平和水文情势等都可以影响植物的腐解速率[19-27].
目前关于水生植物腐烂分解的研究虽然很多, 但主要集中在植物化学组成、微生物群落组成和非生物因子对不同水生植物分解速率的影响以及水生植物腐解后所释放的营养盐对水体环境的影响上, 却很少关注不同季节水生植物腐烂分解过程的差异, 而对其的研究对水生植物的管理具有重要意义.本研究在模拟控制实验条件下, 选取2种在府河流域丘陵地带农业区小水系自然生长的广布种——芦苇(Phragmites australis)和狭叶香蒲(Typha angustifolia), 研究其在温度较低的冬季和气温回升的春季腐烂分解过程的差异和对水体营养盐水平的影响, 以期阐明挺水植物在冬、春季的腐解过程和对水质的影响机制, 为水体的生态修复和水生植物的管理提供基础数据和科学依据.
1 材料与方法 1.1 实验样本的采集以全国广布的2种挺水植物芦苇和狭叶香蒲作为研究对象, 分别于2014年4和12月采自府河流域丘陵地带黄陂农业区小水系(简称为黄陂湿地).黄陂湿地平均水深1~3 m, 主要以芦苇和狭叶香蒲为优势种.采集时, 采集地上部分, 清洗干净, 晾干水分.
1.2 实验设计将带盖的10 L塑料桶置于室外阴暗处, 底部铺放5 cm厚采自黄陂湿地的当季表层沉积物, 以模拟黄陂湿地环境, 缓慢添加9 L自来水稳定1周后, 用于水生植物腐烂分解实验.
实验采用分解袋法[21-22].分解袋由100目尼龙网(孔径0.15 mm, 规格20 cm×20 cm)制成.植物材料105℃杀青30 min后70℃烘干至恒重, 然后分别剪碎并混合均匀后装入分解袋, 投放到反应容器沉积物表面, 于第0、1、2、3、4、5、6周测定水体理化因子和总氮(TN)、总磷(TP)浓度, 并取出分解袋测定剩余干物质量及TN和TP含量.芦苇和狭叶香蒲冬、春季实验各6周, 每周3个重复样本, 共84个分解袋.
春季实验时间为2014年4-6月, 冬季实验时间为2014年12月-2015年3月.实验初始水体的常规理化指标及氮磷含量见表 1.
| 表 1 冬、春季实验水体的理化性质 Tab.1 Physicochemical properties of experiment water in winter and spring |
水体常规理化指标的测定采用便携式水质监测仪(PROPLUS, YSI, 美国)现场测定.植物TN含量采用H2SO4-H2O2消解, 凯氏法进行测定;植物TP含量采用H2SO4-H2O2消解, 钼锑抗比色法进行测定[28].水体的TN、TP浓度采用国标法测定[29].
1.4 数据计算与分析分解速率常数计算采用Olson指数衰减模型, 其公式为[30]:
| ${M_t}/{M_0} = {e^{ - kt}}$ | (1) |
式中, Mt为t时间分解物的干物质量, M0为分解物初始干物质量, k为分解速率常数(d-1), t为分解时间.植物分解过程中, 腐烂分解50%的时间(t50=0.693/k)、腐烂分解99%的时间(t99=1/k)和周转速率(1/k)的计算参照Singh和Shekhar[31]的方法.
植物氮(N)、磷(P)矿化速率的计算采用指数衰减模型,其公式为[32]:
| ${N_t}/{N_0} = {e^{ - kt}}$ | (2) |
式中, Nt为t时间分解物N、P含量; N0为分解物初始N、P含量; kN(P)为N、P的矿化速率常数(d-1).
数据分析采用SPSS 18.0软件, 并用Sigmaplot 11.0软件生成图表, 采用One-way ANOVA和Turkey检验进行种间和季节间比较的方差分析及差异性分析, 采用Spearman相关分析和双尾检验进行分解速率和植物体N、P含量及比值的相关性分析.
2 结果与分析 2.1 冬、春季实验水体温度芦苇组实验水体春季平均温度为22.54±2.54℃, 冬季平均温度为6.76±1.58℃; 狭叶香蒲组实验水体春季平均温度为22.56±2.53℃, 冬季平均温度为6.69±1.54℃.冬、春季实验水体的温度都呈现缓慢上升的趋势, 冬、春季的温度差大约在16℃左右(图 1).
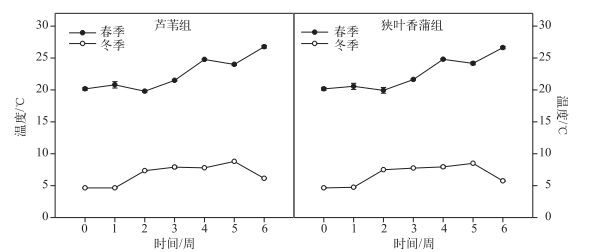
|
图 1 冬、春季实验水体的温度 Fig.1 Temperature of experimented water in winter and spring |
冬、春季6周的分解实验过程中, 2种挺水植物的剩余干物质量整体上都呈现先快速下降再缓慢下降的趋势(图 2), 第1周时, 春季芦苇、狭叶香蒲的干物质量分别为5.38±0.09和6.14±0.07 g, 分别减少了32.8%和23.3%, 冬季芦苇和狭叶香蒲的干物质量分别为7.36±0.02和6.42±0.01 g, 分别减少了8.0%和19.7%, 为快速分解期.第2~6周, 尤其是冬季, 植物残体分解缓慢, 实验结束时, 春季芦苇和狭叶香蒲的剩余干物质量分别为2.79±0.05和3.95±0.35 g, 分别为初始干物质量的34.9%和49.4%, 冬季芦苇和狭叶香蒲的剩余干物质量分别为7.12±0.07和6.43±0.0006 g, 分别为初始干物质量的89.0%和80.4%.同一季节2种挺水植物和不同季节的同一物种间的干物质剩余量差异显著(P<0.001), 芦苇和狭叶香蒲在春、冬季的剩余干物质量差异明显, 春季的剩余干物质量明显低于冬季.其中, 狭叶香蒲冬季最后的剩余干物质量甚至轻微上升, 这可能是由于一些附着物造成的.
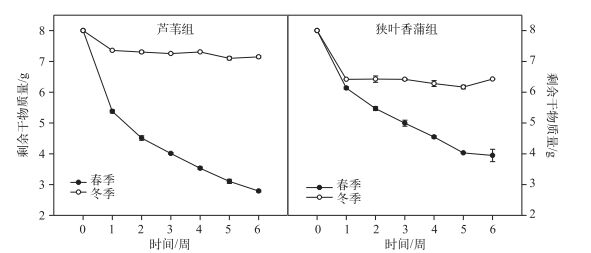
|
图 2 冬、春季2种挺水植物的剩余干物质量 Fig.2 Biomass remaining of two emergent plants in winter and spring |
冬、春季植物残体TN含量都呈现先下降后上升再下降的趋势, 但TP含量变化趋势却不一致(图 3a), 春季呈先下降再缓慢上升的趋势, 而冬季则呈先上升再急速下降, 再缓慢下降的趋势(图 3b).实验结束后, 春季芦苇的TN含量由初始的32.32 mg/g下降到24.12 mg/g, 狭叶香蒲TN含量由26.55 mg/g下降到19.95 mg/g;冬季芦苇TN含量由初始的9.43 mg/g下降到5.10 mg/g, 狭叶香蒲TN含量由15.10 mg/g下降到9.70 mg/g.春季芦苇TP含量由初始的3.41 mg/g下降到0.95 mg/g, 狭叶香蒲TP含量由3.98 mg/g下降到0.95 mg/g, 冬季芦苇的TP含量由初始的0.49 mg/g下降到0.22 mg/g, 狭叶香蒲TP含量由1.69 mg/g下降到0.64 mg/g.春季芦苇TN剩余含量总是大于狭叶香蒲, 冬季狭叶香蒲TN和TP剩余含量一直大于芦苇, 而春季2种挺水植物的TP含量都波动较大.
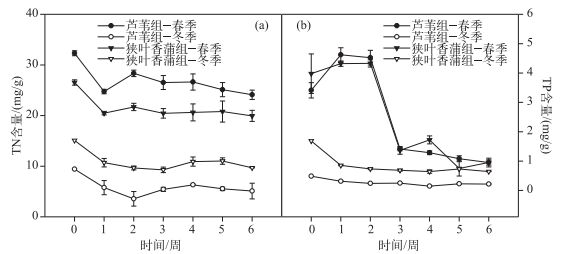
|
图 3 冬、春季2种挺水植物的TN(a)和TP(b)含量 Fig.3 Total nitrogen(a) and total phosphorus(b) contents of two emergent plants in winter and spring |
芦苇的腐烂分解速率受季节影响较狭叶香蒲更敏感.春季芦苇和狭叶香蒲的腐烂分解速率均显著高于冬季(P<0.001)(表 2).春季芦苇的分解速率高于狭叶香蒲, 而冬季相反.其中芦苇春季的分解速率为0.0251 d-1, 是冬季分解速率(0.0027 d-1)的10倍左右; 狭叶香蒲春季的分解速率为0.0169 d-1, 是冬季分解速率(0.0052 d-1)的3倍左右.芦苇春季的腐烂分解50%的时间(t50)为27.63 d, 而腐烂分解达到99%的时间(t99)为199.33 d, 周转速率为39.87 d, 冬季t50、t99和周转速率分别为259.09、1869.36和373.87 d; 狭叶香蒲春季t50、t99和周转速率分别为41.04、296.09和59.22 d, 冬季分别为133.23、961.24和192.25 d(表 2).
| 表 2 2种挺水植物在冬、春季的分解速率和氮、磷矿化速率* Tab.2 Decay rate constants and mineralisation rate constants for nitrogen(kN), phosphorus (kP) of two emergent plants in winter and spring |
春季芦苇和狭叶香蒲氮、磷矿化速率高于冬季, 芦苇春季氮、磷矿化速率分别为冬季的1.84和2.54倍, 狭叶香蒲春季氮、磷矿化速率分别为冬季的1.5和1.8倍.2种植物春、冬季磷矿化速率都大于氮矿化速率(表 2).
植物的腐烂分解速率与初始N、P含量以及N:P比都有一定相关性.其中, 芦苇和狭叶香蒲的分解速率与N、P含量均呈显著正相关, 与N:P比呈显著负相关(表 3).
| 表 3 植物的腐烂分解速率与N、P含量及N:P比的相关性 Tab.3 Spearman coefficients between decomposition rate and content of N, P, N:P of plant |
实验水体的TN和TP浓度在初期都呈先迅速上升至较高水平, 再迅速下降到较低水平, 之后缓慢下降的趋势, 但冬季TN和TP浓度波动比春季要小(图 4).冬、春季芦苇组水体TN浓度均在第2周达到最高(图 4a), 而TP浓度则在第1周达到最高(图 4b); 狭叶香蒲组水体的TN浓度总体在第1周达到最大, 第2周保持这个水平(图 4c), 第3周开始迅速下降, 而TP浓度在第1周就已达到最高水平(图 4d).
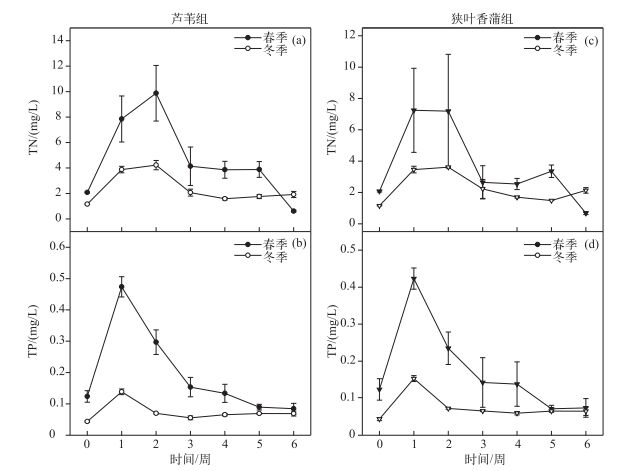
|
图 4 冬、春季2种挺水植物实验水体的TN和TP浓度 Fig.4 TN and TP concentrations of experiment water of two emergent plants in winter and spring |
植物的腐烂分解过程是一个复杂的生物、物理和化学过程, 受多种因素的影响.植物的种类、结构成分及植物体的化学组成、温度等生物和非生物因子等与其密切相关[21-23].
芦苇和狭叶香蒲在春、冬季的腐烂分解都呈现明显的2个阶段.第1周时, 春季芦苇、狭叶香蒲的干物质量分别减少了32.8%和23.3%, 冬季分别减少了8.0%和19.7%, 分解速率较快, 为快速阶段; 以植物组织内水溶性的物质快速淋溶析出作用为主, 主要是矿物质、糖类等物质的释放.第2~6周, 以微生物降解为主, 通过各种生理生化反应, 分解难溶有机质的过程, 随难分解物不断积累, 其分解速率逐渐减慢[21, 32-34].至实验结束春季芦苇和狭叶香蒲的剩余干物质量分别为初始的34.9%和49.4%, 冬季分别为初始的89.0%和80.4%.这与前人的研究结果基本一致.狭叶香蒲冬季最后的剩余干物质量出现了轻微上升, 可能是后期分解过程中吸附作用、微生物代谢和固定作用等原因导致的[35].
植物的腐烂分解速率受环境温度的影响很大.一定范围内, 温度较高可以提高微生物活性, 使植物的分解速率加快; 温度较低时, 微生物体内各种酶的活性降低, 使分解速率缓慢[16, 24].本研究中, 春、冬季的水体温度分别为22.54±2.54和6.76±1.58℃, 相差16℃左右, 由于微生物的代谢活动受其影响, 芦苇冬季的分解速率仅为春季的1/10左右, 狭叶香蒲为1/3左右(表 2).这与叶春等[16]、Melillo等[36]和俞振飞等[37]的研究结果一致.
有研究表明, 植物体内碳、氮、磷含量、木质素含量和纤维素含量以及相互之间的比值会影响植物的腐烂分解速率[23, 28, 38-39].植物组织内初始的氮含量较高时, 其分解速率较快[40-41].唐金艳等[21]研究也发现, 浮叶植物由于具有较高的氮含量, 其分解速率较氮含量偏低的挺水植物要快.春季芦苇的分解速率(0.0251 d-1)高于狭叶香蒲(0.0169 d-1); 冬季狭叶香蒲的分解速率(0.0052 d-1)高于芦苇(0.0027 d-1).植物分解速率与初始TN、TP含量呈显著正相关, 与N:P呈显著负相关(表 3).春季时, 芦苇的初始TN含量(32.32 mg/g)高于狭叶香蒲(26.55 mg/g), 芦苇分解速率更高; 而冬季芦苇的初始TN含量(9.43 mg/g)低于狭叶香蒲(15.10 mg/g), 狭叶香蒲分解速率更高.冬季芦苇初始TN含量较低, 可能是由于冬季实验采集野外样品时, 芦苇和狭叶香蒲都处于立枯阶段, 而立枯阶段也是植物分解的一个重要阶段, 淋溶或微生物作用导致冬季样品中芦苇的初始TN含量低于狭叶香蒲.
3.2 芦苇和狭叶香蒲腐烂分解过程中氮磷释放2种挺水植物TN含量的变化曲线呈现一个双峰动态, 春季在腐解第1周, 有一个显著下降的过程, 第2周又有所升高, 达到第二个高峰, 之后逐渐下降, 其绝对含量呈下降趋势; 冬季则在腐解后2周都在下降, 之后又有小幅增加, 在第4周达到第二个高峰, 之后逐渐下降.这与柳新伟等[42]对大汶河湿地植物香蒲和芦苇的研究结果基本一致.氮在狭叶香蒲和芦苇的腐烂分解过程中, 既有释放, 也有一定的积累.开始的下降可能主要是淋溶作用导致可溶性无机盐流失所致, 之后的积累过程可能是微生物固定作用或者植物TN的累积释放率小于同期干物质的损失率所致[43].Gessner[19]研究也发现, 芦苇在分解过程中氮含量上升可能是枯落物中微生物对外来氮源固定作用所致.
2种挺水植物TP含量的变化曲线也呈现一个双峰动态, 春季腐解第1周呈显著上升, 第2周有所下降, 第3周迅速下降, 第4周又有所升高, 达到第二个高峰, 之后逐渐下降, 实验结束时TP含量呈下降趋势; 冬季则在腐解4周内都在下降, 第5周有小幅增加, 第6周狭叶香蒲的TP含量仍在增加, 而芦苇却开始下降.春季第1周TP含量的增加可能是物理吸附作用导致, 之后TP含量的快速下降可能是由于淋溶作用导致的水溶性磷酸盐的快速释放, TP含量的上升可能是微生物活动所致[44].
芦苇和狭叶香蒲磷矿化速率无论是冬季还是春季都要大于氮矿化速率(表 2), 与顾久军等[45]的研究结果一致, 这可能与氮磷元素在植物体内的化学形式和所组成物质的结构不同有关.植物体内的磷主要存在于一些易于分解或淋溶的物质中, 以磷酸根离子或化合物的形态存在, 而较难分解的物质, 如纤维素、多糖等结构性物质都不含磷, 磷可快速矿化, 而氮主要存在于蛋白质中, 需要微生物作用才能分解, 所以磷的矿化速率要大于氮的矿化速率[22, 29].
3.3 植物分解对水质的影响水生植物腐烂分解过程中, 会向水体中释放大量营养盐, 使水体营养盐水平在短期内上升[17, 46].实验水体的TN和TP浓度在初期都有一个迅速上升至较高水平的阶段, 主要是前期的快速淋溶分解造成的; 之后腐解进入微生物分解阶段, 水体中的氮、磷经生物和物理化学作用, 迅速下降至较低水平, 之后进入缓慢下降的过程.冬季水体中氮、磷的波动水平比春季要小(图 4), 这是由于冬季低温, 微生物代谢活动微弱, 腐解速率和氮磷矿化速率较缓慢造成的.
实验结束时, 水体中的TN浓度较初始水平变小, 而TP浓度略有增加(图 4), 这可能是由于在整个分解过程中, 一部分氮元素, 经微生物硝化和反硝化作用, 使水体中的氮变成氮气, 释放到大气中, 另一部分因微生物的固定, 使最后水体的氮元素含量减少.而磷元素一般要经化学作用, 向底泥中迁移, 实验过程中水体相对静止, 迁移过程较为缓慢, 因此实验结束时, 总磷的水平较初始略有升高[47-49].
4 结论1) 芦苇和狭叶香蒲春冬季的腐解过程都呈现为快速淋溶和慢速分解2个阶段, 且受温度和植物初始N、P含量影响较大.冬季低温时的分解速率明显低于春季, 芦苇对温度反应更敏感, 分解速率与初始N、P含量呈显著正相关, 与N:P比呈负相关.
2) 春季芦苇和狭叶香蒲氮磷的矿化速率明显高于冬季.2种挺水植物在春、冬季磷的矿化速率都明显大于氮的矿化速率.
3) 芦苇和狭叶香蒲的腐烂分解对水质的影响具有时效性, 具体表现为水体的TN和TP浓度在其腐烂分解初期迅速上升、中期迅速下降、后期缓慢下降.
综上, 不同水生植物在不同环境条件下的腐烂分解差异较大, 后续可深入探究不同影响因素下水生植物腐解的特征, 进一步加强长期原位实验并探讨腐烂分解对水体和沉积物营养盐水平的影响机制.
| [1] |
Cronk JK, Fennessy MS. Wetland plants:Biology and ecology. Florida: CRC Press LLC, 2001.
|
| [2] |
Brix H, Schierup HH. The use of aquatic macrophytes in water-pollution control. Journal of Neurochemistry, 1989, 97(1): 190-200. |
| [3] |
Tong Changhua, Yang Xiaoe, Pu Peimin. Effects and mechanism of hydrophytes on control of release of nutrient salts in lake sediment. Journal of Agro-Environment Science, 2003, 22(6): 673-676. [童昌华, 杨肖娥, 濮培民. 水生植物控制湖泊底泥营养盐释放的效果与机理. 农业环境科学学报, 2003, 22(6): 673-676.] |
| [4] |
Tong Changhua, Yang Xiaoe, Pu Peimin. Purification of eutrophicated water by aquatic plant. Chinese Journal of Applied Ecology, 2004, 15(8): 1447-1450. [童昌华, 杨肖娥, 濮培民. 富营养化水体的水生植物净化试验研究. 应用生态学报, 2004, 15(8): 1447-1450. DOI:10.13287/j.1001-9332.2004.0304] |
| [5] |
Li Enhua. Effects of aquatic macrophytes on nutrient cycling in shallow freshwater lake ecosystems[Dissertation]. Wuhan:Wuhan Botanical Garden of the Chinese Academy of Sciences, 2006. [厉恩华. 大型水生植物在浅水湖泊生态系统营养循环中的作用[学位论文]. 武汉: 中国科学院武汉植物园, 2006. http://cdmd.cnki.com.cn/Article/CDMD-80108-2007147213.htm ]
|
| [6] |
Wu Zhenbin, Qiu Dongru, He Feng et al. Effects of rehabilitation of submerged macrophytes on nutrient level of a eutrophic lake. Chinese Journal of Applied Ecology, 2003, 14(8): 1351-1353. [吴振斌, 邱东茹, 贺锋等. 沉水植物重建对富营养水体氮磷营养水平的影响. 应用生态学报, 2003, 14(8): 1351-1353.] |
| [7] |
Wang Cun, Wang Chao. Flow characteristics of the emergent plant and the submerged plant. Advances in Water Science, 2010, 21(6): 816-822. [王忖, 王超. 含挺水植物和沉水植物水流紊动特性. 水科学进展, 2010, 21(6): 816-822.] |
| [8] |
Hong Yu, Hu Hongying. Research and application of inhibitory allelopathy from aquatic plants on algae. Chinese Science Bulletin, 2009, 54(3): 287-293. [洪喻, 胡洪营. 水生植物化感抑藻作用研究与应用. 科学通报, 2009, 54(3): 287-293.] |
| [9] |
Yu Ziwen, Sun Wenhao, Guo Keqin et al. Allelopathic effects of several aquatic plants on algae. Acta Hydrobiologica Sinica, 1992, 16(1): 1-7. [俞子文, 孙文浩, 郭克勤等. 几种高等水生植物的克藻效应. 水生生物学报, 1992, 16(1): 1-7.] |
| [10] |
Bai Fengqing, Zheng Binghui, Tian Ziqiang. Ecological effects of aquatic plants on water pollution control. Environmental Science & Technology, 2004, 27(4): 99-110. [白峰青, 郑丙辉, 田自强. 水生植物在水污染控制中的生态效应. 环境科学与技术, 2004, 27(4): 99-110.] |
| [11] |
Tang Jingjie, Cheng Xiaoying, Zhang Guangsheng. Study on elimination capacity of nitrogen and phosphorus by different aquatic plants-microorganism systems. Chinese Agricultural Science Bulletin, 2009, 25(22): 270-273. [唐静杰, 成小英, 张光生. 不同水生植物-微生物系统去除水体氮磷能力研究. 中国农学通报, 2009, 25(22): 270-273.] |
| [12] |
Wang Guoxiang, Cheng Xiaoying, Pu Peimin. Lake eutrophication control in technology, theory and application. J Lake Sci, 2002, 14(3): 273-282. [王国祥, 成小英, 濮培民. 湖泊藻型富营养化控制——技术、理论及应用. 湖泊科学, 2002, 14(3): 273-282. DOI:10.18307/2002.0313] |
| [13] |
Jin XC, Xu QJ, Huang CZ. Current status and future tendency of lake eutrophication in China. Science in China Series C:Life Sciences, 2005, 48: 948-954. |
| [14] |
Ye Chun, Wang Bo, Li Chunhua et al. Nutrient release process during decomposition of submerged macrophytes (Hydrilla verticillata Royle). China Environmental Science, 2014, 34(10): 2653-2659. [叶春, 王博, 李春华等. 沉水植物黑藻腐解过程中营养盐释放过程. 中国环境科学, 2014, 34(10): 2653-2659.] |
| [15] |
Liu Qiang, Peng Shaolin eds. Plant litter ecology. Beijing: Science Press, 2010. [刘强, 彭少麟. 植物凋落物生态学. 北京: 科学出版社, 2010.]
|
| [16] |
Ye Chun, Wang Bo. The early decomposition process of the submerged macrophyte Hydrilla verticillata and the factors that have a strong impact on it. Chinese Agricultural Science Bulletin, 2009, 25(17): 260-264. [叶春, 王博. 沉水植物黑藻早期分解过程及影响因素研究. 中国农学通报, 2009, 25(17): 260-264.] |
| [17] |
Pan Huiyun, Xu Xiaohua, Gao Shixiang. Study on process of nutrition release during the decay of submerged macrophytes. Research of Environmental Sciences, 2008, 21(1): 64-68. [潘慧云, 徐小花, 高士祥. 沉水植物衰亡过程中营养盐的释放过程及规律. 环境科学研究, 2008, 21(1): 64-68.] |
| [18] |
Zozaya IYBD, Neiff JJ. Decomposition and colonization by invertebrates of Typha latifolia L. litter in Chaco cattail swamp (Argentina). Aquatic Botany, 1991, 40: 185-193. DOI:10.1016/0304-3770(91)90096-N |
| [19] |
Gessner MO. Breakdown and nutrient dynamics of submerged Phragmites shoots in the littoral zone of a hardwater lake. Aquatic Botany, 2000, 66: 9-20. DOI:10.1016/S0304-3770(99)00022-4 |
| [21] |
Tang Jinyan, Cao Peipei, Xu Chi et al. Effects of aquatic plants during their decay and decomposition on water quality. Chinese Journal of Applied Ecology, 2013, 24(1): 83-89. [唐金艳, 曹培培, 徐驰等. 水生植物腐烂分解对水质的影响. 应用生态学报, 2013, 24(1): 83-89.] |
| [22] |
Li Wenchao, Chen Kaining, Wu Qinglong et al. Experimental studies on decomposition process of aquatic plant material from East Taihu Lake. J Lake Sci, 2001, 13(4): 331-336. [李文朝, 陈开宁, 吴庆龙等. 东太湖水生植物生物质腐烂分解实验. 湖泊科学, 2001, 13(4): 331-336. DOI:10.18307/20010407] |
| [23] |
Li X, Cui BS, Yang QC et al. Detritus quality controls macrophyte decomposition under different nutrient concentrations in an eutrophic shallow lake, North China. PLoS ONE, 2012, 7(7): e42042. DOI:10.1371/journal.pone.0042042 |
| [24] |
Sala MM, Karner M, Arin L, Marrasé C. Measurements of ectoenzyme activities as an indicator of inorganic nutrient imbalance in microbial communities. Aquatic Microbial Ecology, 2001, 23: 301-311. DOI:10.3354/ame023301 |
| [25] |
Corstanje R, Reddy KR, Portier KM. Typha latifolia and Cladium jamaicense litter decay in response to exogenous nutrient enrichment. Aquatic Botany, 2006, 84: 70-78. DOI:10.1016/j.aquabot.2005.07.013 |
| [26] |
Zhang Zhiyong, Peng Jianhua, Wan Chengyan et al. Distribution and decomposition dynamics of herb plants in Pengxihe water-fluctuation-zone of the Three Gorges Reservoir. Acta Prataculturae Sinica, 2010, 19(2): 146-152. [张志永, 彭建华, 万成炎等. 三峡库区澎溪河消落区草本植物的分布与分解. 草业学报, 2010, 19(2): 146-152. DOI:10.11686/cyxb20100221] |
| [27] |
Xie YH, Yu D, Ren B. Effects of nitrogen and phosphorus availability on the decomposition of aquatic plants. Aquatic Botany, 2004, 80(1): 29-37. DOI:10.1016/j.aquabot.2004.07.002 |
| [28] |
Institute of Soil Science, Chinese Academy of Sciences ed. Analysis of soil physico-chemical properties. Shanghai: Shanghai Science and Technology Press, 1978. [中国科学院南京土壤研究所. 土壤理化分析. 上海: 上海科学技术出版社, 1978.]
|
| [29] |
Ministry of Environmental Protection of the People's Republic of China, Editorial Board of Water and Wastewater Monitoring and Analysis Methods. Water and Wastewater Monitoring and Analysis Methods. 4th edition. Beijing: China Environmental Science Press, 2002. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法. 第4版. 北京: 中国环境科学出版社, 2002.]
|
| [30] |
Olson JS. Energy storage and the balance of producers and decomposers in ecological systems. Ecology, 1963, 44: 322-331. DOI:10.2307/1932179 |
| [31] |
Singh KP, Shekhar C. Concentration and release pattern of nutrients (N, P, K) during decomposition of maize and wheat roots in a seasonally dry tropical region. Soil Biology and Biochemistry, 1989, 21: 81-85. DOI:10.1016/0038-0717(89)90015-1 |
| [32] |
Balasubramanian D, Arunachalam K, Das AK et al. Decomposition and nutrient release of Eichhornia crassipes (Mart.) Solms. Under different trophic conditions in wetlands of eastern Himalayan foothills. Ecological Engineering, 2012, 44: 111-122. DOI:10.1016/j.ecoleng.2012.03.002 |
| [33] |
Zhang Ju, Deng Huanguang, Wu Aiqin et al. Decomposition of Potamogeton and its effect on the aquatic environment of Dongping Lake. Acta Scientiae Circumstantiae, 2013, 33(9): 2590-2596. [张菊, 邓焕广, 吴爱琴等. 东平湖菹草腐烂分解及其对水环境的影响. 环境科学学报, 2013, 33(9): 2590-2596.] |
| [34] |
Liu Xinwei. Decomposition dynamic of Phragmites australis and Typha angustata in Dawenhe wetland. Chinese Agricultural Science Bulletin, 2009, 25(24): 464-467. [柳新伟. 大汶河湿地香蒲和芦苇分解动态研究. 中国农学通报, 2009, 25(24): 464-467.] |
| [35] |
Shi Qi, Jiao Feng, Chen Ying et al. Decomposition of lotus leaf litter and its effect on the aquatic environment of the Beili Lake in the Hangzhou West Lake. Acta Ecologica Sinica, 2011, 31(18): 5171-5179. [史绮, 焦锋, 陈莹等. 杭州西湖北里湖荷叶枯落物分解及其对水环境的影响. 生态学报, 2011, 31(18): 5171-5179.] |
| [36] |
Melillo JM, Naiman RJ, Aber JD et al. Factors controlling mass loss and nitrogen dynamics of plant litter decaying in northern streams. Bulletin of Marine Science, 1984, 35(3): 341-356. |
| [37] |
Yu Zhenfei, Xu Dongpo, Wang Guoxiang et al. Effects of decline phase of Vallisneria natans on phosphorus transportation between water and sediment. J Lake Sci, 2015, 28(1): 94-104. [俞振飞, 徐东坡, 王国祥等. 苦草(Vallisneria natans)衰亡对水-沉积物之间磷迁移的影响. 湖泊科学, 2015, 28(1): 94-104. DOI:10.18307/2016.0111] |
| [38] |
Lan Y, Cui BS, You ZY et al. Litter decomposition of six macrophytes in a eutrophic shallow lake (Baiyangdian Lake, China). CLEAN-Soil, Air, Water, 2012, 40(10): 1159-1166. DOI:10.1002/clen.201200056 |
| [39] |
Berg B. Litter decomposition and organic matter turnover in northern forest soils. Forest Ecology and Management, 2000, 133: 13-22. DOI:10.1016/S0378-1127(99)00294-7 |
| [40] |
FOG K. The effect of added nitrogen on the rate of decomposition of organic matter. Biological Reviews, 1988, 63(3): 433-462. DOI:10.1111/brv.1988.63.issue-3 |
| [41] |
Taylor BR, Parkinson D, Parsons WFJ. Nitrogen and lignin content as predictors of litter decay rates:A microcosm test. Ecology, 1989, 70(1): 97-104. DOI:10.2307/1938416 |
| [42] |
Liu Xinwei, Liu Jun. N and P dynamic of Phragmites australis and Typha angustata litter in Dawen River wetland during the decomposition. Journal of Qingdao Agricultural University:Natural Science, 2012, 29(4): 289-293. [柳新伟, 刘君. 大汶河湿地香蒲和芦苇分解过程中N, P动态研究. 青岛农业大学学报:自然科学版, 2012, 29(4): 289-293.] |
| [43] |
Yang Jisong, Liu Jingshuang, Yu Junbao et al. Decomposition and nutrient dynamics of marsh litter in the Sanjiang Plain, China. Acta Ecologica Sinica, 2006, 26(5): 1297-1302. [杨继松, 刘景双, 于君宝等. 三江平原沼泽湿地枯落物分解及其营养动态. 生态学报, 2006, 26(5): 1297-1302.] |
| [44] |
Ozalp M, Conner WH, Lockaby BG. Above-ground productivity and litter decomposition in a tidal freshwater forested wetland on Bull Island, SC, USA. Forest Ecology and Management, 2007, 245(1): 31-43. |
| [45] |
Gu Jiujun, Jin Zhaohui, Liu Zhenying. Experimental studies on decomposition process of submerged macrophytes from Wuliangsuhai Lake. Journal of Arid Land Resources and Environment, 2008, 22(4): 181-184. [顾久君, 金朝晖, 刘振英. 乌梁素海沉水植物腐烂分解试验研究. 干旱区资源与环境, 2008, 22(4): 181-184.] |
| [46] |
Xie Li, Yang Hao, Qu Xiaoxia et al. Dissolved organic matter release of Zizania caduciflora and Phragmites australis from Lake Dianchi. Environmental Science, 2013, 34(9): 3458-3466. [谢理, 杨浩, 渠晓霞等. 滇池优势挺水植物茭草和芦苇降解过程中DOM释放特征研究. 环境科学, 2013, 34(9): 3458-3466.] |
| [47] |
Ma Pei, Li Xinyan, Wang Huaxin et al. Denitrification and its role in cycling and removal of nitrogen in river. Journal of Agro-Environment Science, 2014, 33(4): 623-633. [马培, 李新艳, 王华新等. 河流反硝化过程及其在河流氮循环与氮去除中的作用. 农业环境科学学报, 2014, 33(4): 623-633. DOI:10.11654/jaes.2014.04.002] |
| [48] |
Yang Wenbin, Wang Guoxiang, Wang Gang. Experiment study over the continuous effects of decaying Potamogeton crispus on water quality. Journal of Safety and Environment, 2010, 10(2): 90-92. [杨文斌, 王国祥, 王刚. 菹草衰亡腐烂对水质持续性影响试验研究. 安全与环境学报, 2010, 10(2): 90-92.] |
| [49] |
Yu Zhenfei. Effects of decline phase of submerged macrophytes on phosphorus transportation between overlying water and sediment[Dissertation]. Nanjing:Nanjing Normal University, 2012. [俞振飞. 沉水植物衰亡对上覆水和沉积物之间磷含量再分配的影响[学位论文]. 南京: 南京师范大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10319-1013105107.htm ]
|
 2017, Vol. 29
2017, Vol. 29 

