(2: 中国科学院大学, 北京 100049)
(2: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
湿地在全球碳储存方面扮演了一个重要的角色,尽管湿地只占陆地表面积的5 % ~8 % [1],但是据估计地球土壤碳库(2500 Pg)的20 % ~30 %储存在湿地中[2-4].湿地由于较低的有机质分解速率和较高的生产力而成为重要的碳汇[5],但是随着未来气候变化,湿地中储存的碳有可能以CO2或CH4的形式释放到大气中,从而加剧人类活动造成的温室效应[6-7].那么湿地到底是“源”还是“汇”?要回答这个问题,关键在于弄清不同区域不同湿地类型的碳排放及其影响因子,并评估其碳平衡.但是由于不同气候区不同湿地类型的CO2排放信息极为缺乏,这无疑阻碍了我们认识湿地碳循环的特征以及对未来气候变化或水文条件的响应,也限制了湿地有关碳循环模型的发展.
鄱阳湖是中国第一大淡水湖,其湿地面积达到3130 km2,约占鄱阳湖总面积的80 %,超过了洞庭湖或太湖的全湖面积[8].由于鄱阳湖是通江湖泊,年内、年际水位变化巨大,高水位时以湖泊为主体,低水位时以洲滩为主体,鄱阳湖这种独特的水文过程形成了多样的湿地类型以及显著的植被垂向分布,剧烈的水文波动以及由此引起的植被变化必然引起湿地碳动态的极大变化.目前对鄱阳湖湿地CO2排放的研究只有零星报道[9-11],且多位于鄱阳湖南部湖区,北部湖区研究较少,鄱阳湖南北湖区受地形、水情等影响,洲滩淹水与出露时间、代表性群落类型等存在一定的差异,因而,本研究在鄱阳湖北部星子洲滩沿水位梯度选择广泛分布于鄱阳湖典型洲滩湿地的2种代表性植被——薹草(Carex cinerascens)和藜蒿(Artemisia selengensis)群落开展CO2通量及其影响因子的观测,比较不同植被群落CO2通量释放的差异,为评估鄱阳湖湿地碳平衡,降低区域碳收支估测的不确定性,深入认识不同湿地类型对温室气体排放的贡献将具有重要意义.
1 材料与方法 1.1 研究区域实验样地位于中国科学院鄱阳湖湖泊湿地观测研究站附近的洲滩湿地(位于星子县)(29°26′40″N, 116°3′24″E).鄱阳湖属亚热带湿润季风气候,流域气候四季分明.年平均降水量为1878 mm,降雨主要集中于4—9月,降水量占全年降水量的70 %左右.年平均温度为18℃,7月平均温度为29.5℃,1月平均温度为5.1℃,实验样地土壤类型为草甸沼泽土.鄱阳湖退水期时间的长短取决于当地的降雨和长江的水文状况,在165~271 d之间变化.
于2014年10月依水位梯度选择鄱阳湖两种代表性的湿生植被群落——薹草和藜蒿.薹草是鄱阳湖区面积最大,分布最广的群落类型,常常是多种薹草混生在一起组成群落,常被湖区群众用作饲料、绿肥和燃薪,也是重要的放牧场所,于每年春、秋两季定期刈割.薹草是莎草科薹草属多年生草本,在鄱阳湖分春草和秋草,春草2月冬芽萌发,3—5月为生长期,4—5月为花期,丰水季节被水淹,薹草大量死亡或休眠,秋草9—12月为萌发生长期,开花数量较少,第二年涨水被淹时枯萎.该类型群落高度一般在40~60 cm之间,盖度大,常可达100 %,结构简单,一般由6~8种植物组成,常见伴生种有:下江萎陵菜(Potentilla limprichtii)、水田碎米荠(Cardamine lyrata)、水蓼(Polygonum hydropiper)、蚕茧草(Polygonum japonicum Meissn)、糠稷(Panicum bisulcatum Thunb)、紫花地丁(Viola philippica)、七重楼(Paris polyphylla)等[12].藜蒿是菊科蒿属的多年生草本植物,也是湖区牲畜以及部分鸟类的食物来源之一.藜蒿从10月份萌发,11月至来年4月为生长期,4—6月为枯黄期,丰水季节被水淹,藜蒿不同于薹草,它只有一个生长季.藜蒿群落主要分布在河道两侧滩地、堤坝及土丘上,藜蒿群落高度一般在45~65 cm, 盖度在95 %左右,主要伴生种有:水蓼、灰化薹草等.
1.2 样品采集和分析方法选择分布均一、具有代表性的薹草和藜蒿群落.每种群落设置3个重复,3个重复群落的间距大于5 m小于10 m.实验于2014年10月-2015年5月(鄱阳湖退水期)进行.
1.2.1 气体样品的采集和分析通量观测采用密闭静态箱—气相色谱法,观测频率为每月2~3次,遇到不可预测的事件比如下雨或大风等取样时间会有所调整.观测时间选择在9:00-11:00之间(代表一天中的平均值)[13].采样箱由箱体和底座2部分组成.箱体长、宽、高规格为50 cm×50 cm×50 cm, 底座为15 cm×50 cm×50 cm(底座于通量观测前埋入土壤中,为避免土壤扰动采样期间不再取出,并且为了减少土壤的干扰CO2通量的测定在底座安装完成的几天之后进行).采样箱外粘贴一层2 cm厚的铝箔隔热板,以防止太阳辐射下箱内温度的升高而影响观测结果.采样时底座密封槽内加水,使底座与顶箱间的气路密封,切断箱内外空气的自由交换.箱顶上安装1个搅拌风扇,外接移动充电电源,以充分混匀气体,箱侧面安装取气接口.样品采集用100 ml注射器,在30 min时间内每10 min采集1次气体样品(每次共采集4个气体样品).在进行气体收集的同时,还采用便携式土壤水分测量仪(TDR300, Spectrum Technologies, USA)对土壤10cm含水率进行测定,采用便携式温度计(JM624, Jin Ming Instruments, China)测定土壤5 cm温度.假如地表有积水,也要记录积水的深度和温度.同时利用鄱阳湖站气象观测场记录每天的气温、地表温度、降雨、大气压等数据.并在每个测量日登陆江西省水利厅的网站(http://www.jxsl.gov.cn)查询当日的鄱阳湖星子水位数据.气体样品采集后注入气袋运回实验室利用气相色谱仪(Agilent 4890D, Agilent Technologies, USA)进行CO2气体浓度分析,其中CO2检测器为FID(氢焰离子化检测器).载气为氮气,流速30 ml/min;氢气为燃气,流速为30 ml/min;空气为助燃气,流速为400 ml/min,检测器温度为200℃,柱箱温度为55℃.气体排放通量采用式(1)进行计算:
| $ \mathit{F = \rho } \cdot \mathit{H}\frac{\mathit{P}}{{{\mathit{P}_{\rm{0}}}}}\frac{\mathit{T}}{{{\mathit{T}_{\rm{0}}}}}\frac{{{\rm{d}}\mathit{c}}}{{{\rm{d}}\mathit{t}}} $ | (1) |
式中,F为气体排放通量(mg CO2/(m2·h));ρ为标准状态下的被测气体密度(g/L);H为测量时采样箱的高度(m);T0和P0分别为标准状况下的空气绝对温度(K)和气压(hPa);P为采样地点的气压(hPa);T为采样时的绝对温度(K);dc/dt为采样时气体浓度随时间变化的直线斜率(mg/(mol·h)). F值为正数时表示湿地生态系统释放CO2到大气中,为负数时表示湿地生态系统从大气中吸收CO2. CO2的线性回归系数(R2)要求大于0.9.
退水期薹草和藜蒿湿地生态系统呼吸的累积释放量计算公式为:
| $ {\mathit{F}_\mathit{j}} = \sum\limits_{\mathit{j} = 1}^8 {\frac{{\sum\limits_{\mathit{i} = 1}^8 {{\mathit{F}_\mathit{j}}} }}{\mathit{n}}} \times 24 \times {\mathit{M}_\mathit{j}} $ | (2) |
式中,Fi指每月测得的CO2通量(mg CO2/(m2·h)),n指每月采样的次数,24指将温室气体通量换算成小时,Mj指采样所在月份的天数,Fj指退水期的CO2释放通量(t CO2/hm2).
1.2.2 生态系统呼吸温度敏感性的计算通常使用Q10来表示生态系统呼吸或土壤呼吸对温度的敏感性, 它是指温度每升高10℃生态系统呼吸或土壤呼吸增加的倍数.公式如下:
| $ \mathit{R = a} \cdot {{\rm{e}}^{\mathit{b} \cdot \mathit{t}}} $ | (3) |
| $ {\mathit{Q}_{{\rm{10}}}} = {{\rm{e}}^{10\mathit{b}}} $ | (4) |
式中,R为生态系统呼吸速率(mg CO2/(m2·h)),t为温度(℃),a和b为拟合常数.
1.2.3 生物量的收集生物量测定采用收获法,在薹草和藜蒿群落分布区域内,每个群落设置生物量调查样方,样方大小为50 cm×50 cm,随机设置3个重复.收集样方内植物地上部分活体及地下植物根系.其中,地下部分根系采取挖掘法,野外初步分离根系与土壤后带回实验室清洗,生物量利用烘箱烘干后称量(85℃/48 h),得出地上和地下生物量.同时统计样方内植物的数量(包括优势种和伴生种),植物地上和地下根系的长度,估计每个样方植被的盖度.植被生物量每月收集1次.薹草分为秋草和春草,它们的第1次生物量测量分别在退水区域露出10 d后和2月初,藜蒿的第1次生物量测量在退水区域露出10 d后进行.
1.2.4 土壤理化指标的测定用土钻在每个样方随机钻取0~10 cm土样,每个样地20个土钻样品混合成一个样品,样品过2 mm筛除去可见的土壤动物、石块、根系等.土壤样品风干后用于土壤理化指标的测定.称取过100目筛的风干样品15~20 mg使用元素分析仪(Model CNS, Elementar Analysen Systeme GmbH, Germany)测定总有机碳、全氮、全磷.土壤pH值使用土水比1: 2.5浸提,电位法测定;土壤容重采用环刀法测定.
1.2.5 数据分析采用非参数Mann-Whitney U检验比较2种植被环境因子(土温、土壤含水率、pH值、全氮、全磷、土壤有机碳等)、生物因素(地上地下生物量、总生物量、密度)和CO2排放通量的差异,相关分析选择Pearson相关分析法,逐步多元线性回归分析被用来分析影响CO2排放通量的影响因子.所有统计分析用SPSS 20.0软件完成,绘图用Sigma Plot 11.0软件完成,显著性水平设定为α=0.05.文中数据均为平均值±标准误,n=3.
2 结果 2.1 薹草与藜蒿湿地表层土壤基本理化性状藜蒿湿地的10 cm土壤含水率为28.31 %,显著低于薹草湿地的土壤含水率58.44 % (P<0.01),两种植被5 cm土温、pH值、总有机碳、全氮、全磷、碳氮比、容重等其它理化性质没有显著差异(P>0.05,表 1).藜蒿湿地的植株密度为224株/m2,显著小于薹草湿地的密度811株/m2(P<0.01,表 1).
| 表 1 薹草和藜蒿湿地表层土壤基本理化性状* Tab.1 Physicochemical properties of the top soil from Carex cinerascens-dominated and Artemisia selengensis-dominated wetland |
薹草和藜蒿湿地地上生物量较地下生物量具有明显的季节变化动态.薹草地下生物量变化范围在808.00~2666.67 g/m2之间,平均值为1460.73 g/m2; 地上生物量变化范围在101.33~308.27 g/m2之间,平均值为222.73 g/m2; 总生物量季节变化范围在946.67~2768.00 g/m2之间,平均值为1683.47 g/m2.藜蒿地下生物量变化范围在131.20~1516.27 g/m2之间,平均值为949.87 g/m2,地上生物量变化范围在149.87~680.53 g/m2之间,平均值为361.93 g/m2; 总生物量季节变化范围在433.60~1778.67 g/m2之间,平均值为1311.80 g/m2.薹草的年均总生物量高于藜蒿(图 1).
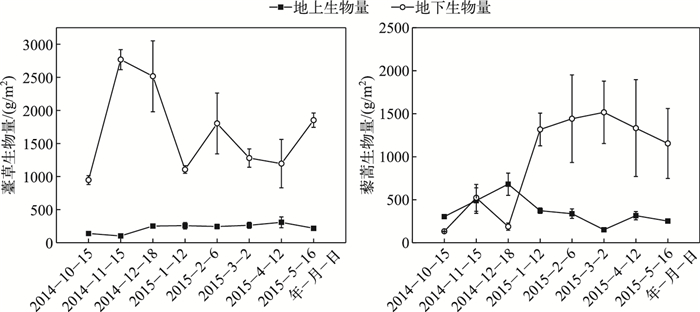
|
图 1 薹草和藜蒿湿地生物量的季节变化 Fig.1 Seasonal variations of biomass from Carex cinerascens-dominated and Artemisia selengensis-dominated wetland |
薹草和藜蒿湿地5 cm土壤温度具有相似的季节变化,自秋季开始逐渐降低,至冬季降至最低值,随着春季气温的上升逐渐升高.水位的季节变化与5 cm土壤温度相似,薹草10 cm土壤含水率的季节变化与水位变化相反,藜蒿10 cm土壤含水率的季节变化与水位变化相似(图 2).
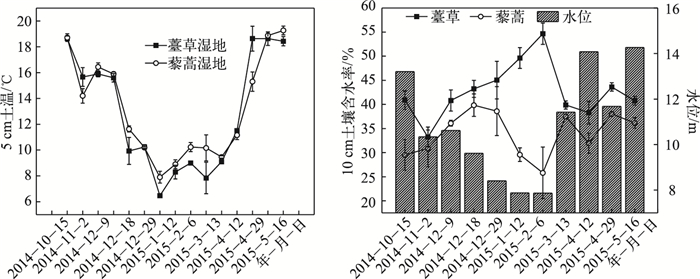
|
图 2 薹草和藜蒿湿地5 cm土壤温度、10 cm土壤含水率以及水位的季节变化 Fig.2 Seasonal variations of soil temperature at 5 cm depth, soil moisture at 10 cm depth and water level from Carex cinerascens-dominated and Artemisia selengensis-dominated wetland |
薹草湿地的生态系统呼吸具有明显季节变化模式,自秋季开始逐渐降低,至冬季降至最低值;随着气温的上升及春季薹草的萌发,生态系统呼吸速率逐渐上升.薹草湿地生态系统呼吸变化范围在411.87~6016.32 mg CO2/(m2·h)之间,平均值为3291.80 mg CO2/(m2·h),最小值出现在2014年12月29日(冬季),最大值出现在2015年4月12日(春季).藜蒿湿地生态系统呼吸季节变化模式与薹草湿地相似,变化范围在185.84~7213.94 mg CO2/(m2·h)之间,平均值为2581.89 mg CO2/(m2·h),最小值出现在2014年12月29日,在2015年5月16日出现最大值(春季)(图 3).退水期薹草湿地生态系统呼吸的平均值是藜蒿湿地生态系统呼吸的1.27倍.退水期薹草和藜蒿湿地累积的生态系统呼吸分别为213.71±2.27和176.39±11.48 t CO2/hm2,薹草湿地生态系统呼吸的累积释放量高于藜蒿湿地.

|
图 3 薹草和藜蒿湿地生态系统呼吸季节变化 Fig.3 Seasonal variations of ecosystem respiration from Carex cinerascens-dominated and Artemisia selengensiss-dominated wetland |
Pearson相关分析显示薹草湿地生态系统呼吸与5 cm土温呈显著正相关(P<0.01), 藜蒿湿地生态系统呼吸与5 cm土温、气温均呈显著正相关(P<0.01)(图 4).逐步多元回归分析表明,薹草湿地生态系统呼吸与5 cm土温呈显著正相关(薹草湿地生态系统呼吸=-1538.922+ 398.914×(5 cm土温), F=51.744, R2=0.896,P<0.001),5 cm土温是影响薹草湿地生态系统呼吸季节变化最重要的影响因子.藜蒿湿地生态系统呼吸与5 cm土温呈显著正相关,与气温呈显著负相关(藜蒿湿地生态系统呼吸=-6521.758+1210.856×(5 cm土温)-394.478×气温,F=130.071, R2=0.981,P<0.001),其中5 cm土温解释了藜蒿湿地生态系统呼吸季节变化的81.5 %,气温解释了藜蒿湿地生态系统呼吸季节变化的16.6 %,5 cm土温是影响藜蒿湿地生态系统呼吸季节变化最重要的影响因子.基于5 cm土温,计算出薹草和藜蒿湿地生态系统呼吸的Q10值分别为2.82±0.13和7.33±0.02,藜蒿湿地生态系统呼吸的Q10值是薹草的2.6倍. 2种植被所在湿地生态系统呼吸与土壤水分、植被地上地下生物量均无显著相关性(P>0.05).

|
图 4 薹草生态系统呼吸与5 cm土温(a), 藜蒿湿地生态系统呼吸与气温(b)、5 cm土温(c)的相关性 Fig.4 Relationship between soil temperature at 5 cm depth and ecosystem respiration from Carex cinerascens-dominated wetland (a); Relationship between air temperature(b), soil temperature at 5 cm depth(c) and ecosystem respiration from Artemisia selengensis-dominated wetland |
本研究实验样地位于中国科学院鄱阳湖湖泊湿地观测研究站附近的洲滩湿地(位于星子县),是鄱阳湖洲滩湿地的一个典型区域.鄱阳湖退水期时间的长短取决于当地的降雨和长江的水文状况,在165~271 d之间变化[12].有研究指出当湿地水位下降到一定程度时,湿地土壤的通气状况会改变,有机质分解产生的CO2也会增加,湿地可能由碳汇变成碳源[14].本研究鄱阳湖退水期达到8个月,那么退水期湿地的CO2排放在鄱阳湖碳平衡中将占有十分重要的地位.将鄱阳湖湖滨湿地的CO2排放与其他地区进行比较(表 2),整个退水期薹草和藜蒿湿地生态系统呼吸的平均值为2936.84±1219.35 mg CO2/(m2·h),高于鄱阳湖南矶湿地[11]、蚌湖[15]以及鄱阳湖水汽界面的CO2排放[16],这说明了鄱阳湖CO2排放的空间变异性,将来需要更加详细尺度的调查.并且鄱阳湖湖滨湿地的CO2排放远远高于三峡水库[17]、青藏高原沼泽化草甸[18]、诺尔盖高原沼泽湿地[19]、东北三江平原沼泽湿地[20],以及芬兰[21]、日本[22]、南极洲[23]的湖泊湿地,可能原因是鄱阳湖湿地植被生物量较高,土壤表面没有明显的立地积水以及适宜的温度所致[11].
| 表 2 鄱阳湖湖滨湿地CO2通量与其他地区的比较 Tab.2 Comparison of CO2 flux from littoral wetland in Lake Poyang with other regions |
退水期薹草湿地生态系统呼吸大于藜蒿湿地生态系统呼吸,可能原因是薹草的生物量相比藜蒿较高.有研究显示,植物的生物量与CO2排放有正相关效应,这是因为植物的呼吸作用与其相对生长速率呈正相关[25-26],生长速率快的植物需要更多物质和能量的输出,以满足较高生长速率的需要[27],由于薹草的总生物量高于藜蒿,导致其生态系统呼吸水平也高于藜蒿.
通过实验观测, 2014-2015年退水期鄱阳湖薹草和藜蒿湿地均具有较高的生态系统呼吸排放.鄱阳湖独特的水文状况决定了湿地植被的分布和生物量,不同湿地植被的分布和生物量影响着湿地生态系统呼吸的排放.光合作用和呼吸作用决定着植物的生产力,温度是影响植物生产力的最重要影响因子[28],因此,气候微小的变化将引起植物生产力和生物量的巨大变化[29].近年来,气候变化和三峡大坝的建设改变了鄱阳湖的水文状况,造成鄱阳湖夏季丰水期持续时间的缩短以及退水期的延长[30],那么薹草和藜蒿的生长期也会相应延长,薹草和藜蒿湿地的生态系统呼吸将会加强.
3.3 温度、水分和生物量对生态系统呼吸的影响本研究表明5 cm土温是影响薹草和藜蒿湿地生态系统呼吸最重要的影响因子,Q10值通常被用来评价土壤或生态系统呼吸对于温度变化的敏感性.不同地区湿地生态系统的Q10值有很大差异,全球土壤呼吸Q10平均值为2.4[31].北方泥炭地的Q10值在1.6~4.1之间[32],青藏高原湿地的Q10值在2.0~8.9之间[33],三江平原沼泽湿地的Q10值在2.37~2.98之间[34].在本研究中,薹草湿地的Q10值为2.82,介于上述报道的湿地CO2排放的温度敏感性指数之间.藜蒿湿地的Q10值较高,为7.33,Q10值容易受到根呼吸、土壤有机碳的有效性和微生物活动等因素的影响[35],藜蒿和薹草湿地之间Q10值较大的差异还需要进一步的研究.
水分也是控制呼吸过程的一个重要环境因子,但是本研究未发现藜蒿和薹草湿地CO2的排放通量与土壤含水率有显著相关性,这可能是由于薹草和藜蒿湿地土壤含水率较高且季节变异较小,对湿地CO2排放影响较小所致[11].研究表明植物呼吸速率与植物生物量呈显著线性正相关[36-37],植物生物量大,会有更多的光合产物向土壤运输,同时产生更多的根系分泌物,为土壤微生物提供能源,从而促进土壤呼吸,但是本研究未发现湿地生态系统呼吸与生物量呈显著相关性,可能原因是5 cm土温对湿地生态系统呼吸的影响削弱了植被生物量的作用,具体影响机理还需要进一步的研究.
4 结论1) 退水期薹草和藜蒿湿地的生态系统呼吸具有明显季节变化模式,它们的最小值均出现在2014年12月(冬季),最大值分别出现在2015年的4月和5月(春季),退水期薹草和藜蒿湿地累积的生态系统呼吸分别为213.71±2.27和176.39±11.48 t CO2/hm2.较高的生物量是薹草湿地生态系统呼吸高于藜蒿湿地的原因.
2) 5 cm土温是影响薹草和藜蒿湿地生态系统呼吸季节变化最重要的影响因子,藜蒿湿地生态系统呼吸对温度的敏感性高于薹草湿地.水分和植物生物量与薹草和藜蒿湿地生态系统呼吸无显著相关性.
致谢: 感谢中国科学院鄱阳湖湖泊湿地观测研究站刘贺和邓秋婷实验员在采样方面给予的支持和帮助!| [1] |
Mitsch WJ, Gosselink JG eds. Wetlands(fourth ed). Hoboken:Wiley, 2007.
|
| [2] |
Roulet N. Peatlands, carbon storage, greenhouse gases, and the Kyoto Protocol:Prospects and significance for Canada. Wetlands, 2000, 20: 605-615. DOI:10.1672/0277-5212(2000)020[0605:PCSGGA]2.0.CO;2 |
| [3] |
Bridgham S, Megonigal J, Keller J et al. The carbon balance of North American wetlands. Wetlands, 2006, 26: 889-916. DOI:10.1672/0277-5212(2006)26[889:TCBONA]2.0.CO;2 |
| [4] |
Lal R. Carbon sequestration. Philosophical Transactions of the Royal Society, 2008, 363: 815-830. DOI:10.1098/rstb.2007.2185 |
| [5] |
Kayranli B, Scholz M, Mustafa A et al. Carbon storage and fluxes within freshwater wetlands:A critical review. Wetlands, 2009, 30: 111-124. |
| [6] |
Gorham E. The biogeochemistry of northern peatlands and its possible responses to global warming. In:Woodwell GM, Mackenzie FT eds. Biotic Feedbacks in the global climatic system. Oxford, UK:Oxford University Press, 1995:169-187.
|
| [7] |
Keller JK, White JR, Bridgham SD et al. Climate change effects on carbon and nitrogen mineralization in peatlands through changes in soil quality. Global Change Biology, 2004, 10: 1053-1064. DOI:10.1111/gcb.2004.10.issue-7 |
| [8] |
Liu Xinzhong, Ye Juzheng. Jiangxi Wetland. Beijing: Chinese Forestry Press, 2000. [刘信中, 叶居正. 江西湿地. 北京: 中国林业出版社, 2000.]
|
| [9] |
Hu Qiwu, Xin Ruixin, Zhu Lili et al. Characteristics of CO2 emission from Carex-dominated wetland in Poyang lake in non-flooded period. Chinese Journal of Applied Ecology, 2011, 22(6): 1431-1436. [胡启武, 辛瑞新, 朱丽丽等. 鄱阳湖苔草湿地非淹水期CO2释放特征. 应用生态学报, 2011, 22(6): 1431-1436.] |
| [10] |
Lin Mao, Xu Ming, Geng Yuqing et al. Spatial heterogeneity and controlling factors of autumn CH4 flux at water-air interface in Poyang Lake of Jiangxi Province, China. Chinese Journal of Ecology, 2012, 31(8): 2112-2118. [林茂, 徐明, 耿玉清等. 鄱阳湖秋季水-气界面CH4排放通量的区域差异及影响因素. 生态学杂志, 2012, 31(8): 2112-2118.] |
| [11] |
Hu QW, Wu Q, Yao B et al. Ecosystem respiration and its components from a Carex meadow of Poyang Lake during the drawdown period. Atmospheric Environment, 2015, 100: 124-132. DOI:10.1016/j.atmosenv.2014.10.047 |
| [12] |
Hu Zhenpeng, Ge Gang, Liu Chenglin et al. Structure of Poyang Lake wetland plants ecosystem and inffluence of lake water level for the structure. Resource Environment Yangtze Basin, 2010, 19(6): 597-605. [胡振鹏, 葛刚, 刘成林等. 鄱阳湖湿地植物生态系统结构及湖水位对其影响研究. 长江流域资源与环境, 2010, 19(6): 597-605.] |
| [13] |
Tang XL, Liu SG, Zhou GY et al. Soil-atmospheric exchange of CO2, CH4, and N2O in three subtropical forest ecosystems in southern China. Global Change Biology, 2006, 12: 546-560. DOI:10.1111/gcb.2006.12.issue-3 |
| [14] |
Oechel WC, Vourlitis GL, Hastings SJ et al. The effects of water table manipulation and elevated temperature on the net CO2 flux of wet sedge tundra ecosystems. Global Change Biology, 1998, 4: 77-90. DOI:10.1046/j.1365-2486.1998.00110.x |
| [15] |
Wan HX, Qin ZH, Liu YB et al. Estimates of carbon fluxes from Poyang Lake wetlands vegetation in the growing season. In:Frouin RJ, Yoo HR, Won JS et al eds. Remote sensing of the coastal ocean, land, and atmosphere environment. Proceeding of SPIE Vol.7858; 2010 Nov 4; New York:SPIE.
|
| [16] |
Liu LX, Xu M, Lin M et al. Spatial variability of greenhouse gas effluxes and their controlling factors in the Poyang Lake in China. Polish Journal of Environment Study, 2013, 22: 749-758. |
| [17] |
Li Zhe, Bai Lei, Guo Jinsong et al. Comparative study on water-air CO2, CH4 flux in two tributaries in the Three Gorges Reservoir, China. Environmental Science, 2013, 34(3): 1008-1016. [李哲, 白镭, 郭劲松等. 三峡水库两条支流水气界面CO2、CH4通量比较初探. 环境科学, 2013, 34(3): 1008-1016.] |
| [18] |
Hu QW, Cao GM, Wu Q et al. Comparative study on CO2 emissions from different types of alpine meadows during grass exuberance period. Journal of Geographical Sciences, 2004, 14: 167-176. DOI:10.1007/BF02837532 |
| [19] |
Wang Dexuan, Song Changchun, Wang Yiyong et al. CO2 flux in mire and grassland on Ruoergai plateau. Chinese Journal of Applied Ecology, 2008, 19(2): 285-289. [王德宣, 宋长春, 王毅勇等. 若尔盖高原沼泽湿地与草地二氧化碳通量的比较. 应用生态学报, 2008, 19(2): 285-289.] |
| [20] |
Song CC, Yan BX, Wang YS et al. Fluxes of carbon dioxide and methane from swamp and impact factors in Sanjiang Plain, China. Chinese Science Bulletin, 2003, 48: 2749-2753. DOI:10.1007/BF02901769 |
| [21] |
Liikanen A, Ratilainen E, Saarnio S et al. Greenhouse gas dynamics in boreal, littoral sediments under raised CO2 and nitrogen supply. Freshwater Biology, 2003, 48(3): 500-511. DOI:10.1046/j.1365-2427.2003.01023.x |
| [22] |
Hirota M, Senga Y, Seike Y et al. Fluxes of carbon dioxide, methane and nitrous oxide in two contrastive fringing zones of coastal lagoon, Lake Nakaumi, Japan. Chemosphere, 2007, 68: 597-603. DOI:10.1016/j.chemosphere.2007.01.002 |
| [23] |
Ding W, Zhu RB, Ma DW et al. Summertime fluxes of N2O, CH4 and CO2 from the littoral zone of Lake Daming, East Antarctica:Effects of environmental conditions. Antarctic Science, 2013, 25(6): 752-762. DOI:10.1017/S0954102013000242 |
| [24] |
Cole JJ, Caraco NF, Kling GW et al. Carbon dioxide supersaturation in the surface water of lakes. Science, 1994, 265: 1568-1570. DOI:10.1126/science.265.5178.1568 |
| [25] |
Villar R, Held AA, Merino J. Comparison of methods to estimate dark respiration in the light in leaves of two woody species. Plant Physiology, 1994, 105: 167-172. DOI:10.1104/pp.105.1.167 |
| [26] |
Reich PB, Walters MB, Ellsworth DS et al. Relationships of leaf dark respiration to leaf nitrogen, specific leaf area and leaf life-span:a test across biomes and functional groups. Oecologia, 1998, 114: 471-482. DOI:10.1007/s004420050471 |
| [27] |
Atkin OK, Westbeek M, Cambridge ML et al. Leaf respiration in light and darkness (A comparison of slow-and fast-growing poa species). Plant Physiology, 1997, 113: 961-965. DOI:10.1104/pp.113.3.961 |
| [28] |
Aber JD, Melillo JM. Resource allocation and net primary production, seconded, Terrestrial Ecosystems. San Diego, CA: Harcourt/Academic Press, 2001, 183-189.
|
| [29] |
Hirota M, Tang YH, Hu QW et al. Methane emissions from different vegetation zones in a Qinghai-Tibetan Plateau wetland. Soil Biology and Biochemistry, 2004, 36: 737-748. DOI:10.1016/j.soilbio.2003.12.009 |
| [30] |
Zhang Q, Li L, Wang YG et al. Has the Three-Gorges Dam made the Poyang Lake wetlands wetter and drier?. Geophysical Research Letters, 2012, 39(20): L20402. |
| [31] |
Raich JW, Schlesinger WH. The globle carbon dioxide flux in soil respiration and its relationship to vegetation and climate. Tellus, 1992, 44B: 81-99. |
| [32] |
Bubier JL, Bhatia G, Moore TR et al. Spatial and temporal variability in growing-season net ecosystem carbon dioxide exchange at a large peatland in Ontario, Canada. Ecosystems, 2003, 6: 353-367. |
| [33] |
Hirota M, Tang YH, Hu QW et al. Carbon dioxide dynamics and controls in a deep-water wetland on the Qinghai-Tibetan Plateau. Ecosystems, 2006, 9: 673-688. DOI:10.1007/s10021-006-0029-x |
| [34] |
Song CC, Xu XF, Tian HQ et al. Ecosystem-atmosphere exchange of CH4 and N2O and ecosystem respiration in wetlands in the Sanjiang Plain, Northeastern China. Global Change Biology, 2009, 15: 692-705. DOI:10.1111/gcb.2009.15.issue-3 |
| [35] |
Davidson EA, Janssens IA, Luo YQ et al. On the variability of respiration in terrestrial ecosystems:Moving beyond Q10. Global Change Biology, 2006, 12: 154-164. DOI:10.1111/gcb.2006.12.issue-2 |
| [36] |
Lu Yan, Song Changchun, Wang Yiyong et al. Influence of plants on CO2 and CH4 emission in wetland ecosystem. Acta Bot Boreal-Occident Sin, 2007, 27(11): 2306-2313. [卢妍, 宋长春, 王毅勇等. 植物对沼泽湿地生态系统CO2和CH4排放的影响. 西北植物学报, 2007, 27(11): 2306-2313. DOI:10.3321/j.issn:1000-4025.2007.11.027] |
| [37] |
Sun Wenjuan, Huang Yao, Chen Shutao et al. CO2 emission from soil-crop system as influenced by crop growth and tissue N content. Environmental Science, 2004, 25(3): 1-6. [孙文娟, 黄耀, 陈书涛等. 作物生长和氮含量对土壤-作物系统CO2排放的影响. 环境科学, 2004, 25(3): 1-6.] |
 2017, Vol. 29
2017, Vol. 29 

