(2: 中国水利水电科学研究院, 北京 100038)
(2: China Institute of Water Resources and Hydropower Research, Beijing 100038, P. R. China)
三峡水库香溪河库湾自大坝蓄水后,冬春季常常发生拟多甲藻(Peridiniopsis sp.)水华[1].水华发生时,水体酱油色,成片出现.关于淡水甲藻水华对生态系统的危害已有研究,如Peridinium polonicum具有鱼毒素,可致使鱼类大量死亡[2],以色列Kinneret湖的Peridinium gatunense能放出臭鸡蛋气味的甲基硫化物—二甲基一硫醚(dimethyl sulfide, DMS),严重影响水的饮用品质[3-4].香溪河库湾甲藻水华常常发生在高岚河段与平邑口河段[5],分布不广,目前未有研究深入评估其危害.三峡水库香溪河库湾甲藻水华的发生地水体总氮(TN)浓度为1.25 mg/L,总磷(TP)浓度为0.27 mg/L,虽已较高,但距重度富营养化的湖泊,如滇池(全湖TN浓度为1.2~7.9 mg/L,TP浓度为0.18~0.95 mg/L)还有很大差距[6];因此,关注拟多甲藻对轻度富营养化水体的适应性机理研究,可为轻污染水体的治理提供新的思路.
拟多甲藻具备周期性昼夜垂直迁移的特性.通常对于藻类迁移的特性有很多解释,最多的解释是趋光性原理[7-8],如对香港海域甲藻塔玛亚历山大藻的研究表明其具有典型趋光性,光照的差别也可使得该藻的迁移节律有所差异[9];其次是温度,很多研究认为水温也对垂直迁移行为有影响,如对香溪河拟多甲藻的研究表明表层与表底水温的温差也干扰其迁移[2],海水的温跃层和水体分层形成的垂向结构也影响赤潮甲藻的迁移行为[10-11];除此之外,有研究认为营养盐浓度也是甲藻水华的影响因素之一[12-13].香溪河流域是我国最大的磷矿产区,具磷矿开采和磷化工加工的高磷来源背景,有调查表明香溪河多年堆积的磷矿渣经雨水淋溶进入河道造成外源污染,而且其化学形态十分复杂,有独特的地域特征[14].而拟多甲藻本身具胞外碱性磷酸酶(alkaline phosphatase,AP),碱性磷酸酶是藻类对磷限制响应生理机制的重要环节,当水华发生时,水体中无机态正磷酸盐迅速被消耗,这时溶解态的有机磷就会成为藻类可竞争利用的磷源,碱性磷酸酶可作用于可溶性有机磷的磷酸单酯上的P-O键,催化磷酸酯的水解生成正磷酸盐以解除磷限制,迅速占据种群优势[15-16].那么在香溪河独特的现状外源磷条件下,拟多甲藻对磷的利用是否因其胞外碱性磷酸酶而有所偏好?拟多甲藻的垂直迁移行为多被解释为趋光,趋光获得光能的同时,也固定CO2以支持其生长繁殖[17],碳酸酐酶(carbonic anhydrase,CA)活性是可以直观体现藻类固碳能力的指标,在水中生存的藻类比陆生植物更难获得碳源,因此其二氧化碳浓缩机制(CCM)发展出高效的CA运输和代谢机制[18],拟多甲藻的CA活性可在水下感知CO2限制,触发CCM机制,打开细胞膜上的碳源运输通道,在碳限制环境中最大限度获得碳源[19].拟多甲藻面临磷限制和碳限制,而磷限制可能因AP解除,碳限制可因触发CCM机制解除,那么其垂直迁移行为是否与之相关?因此,本研究拟通过探讨碳磷分布的现状条件下拟多甲藻的响应机制.
1 材料与方法 1.1 采样点的布设2015年春季,三峡水库香溪河库湾高岚河支流发生拟多甲藻水华.本研究于2015年2月26-27日,对水华发生处(31.74°N,110.51°E,图 1)的水体与浮游植物进行连续24 h现场监测.监测点位地处高山深谷,采样时水深62 m,且为水库回水河段,水流不易受风力影响,流速极低,拟多甲藻的昼夜迁移不易受流速影响,便于垂直采样.

|
图 1 香溪河库湾高岚河段监测点位 Fig.1 Location of sampling site in the Gaolan branch of the Xiangxi River Bay |
从2月26日8:00、12:00、16:00、20:00至27日0:00和4:00,进行昼夜定点分层的监测,水深梯度设置为0(表层)、3、6、9、12和15 m.在每个采样时间点,用5 L的Niskin卡盖式采水器(General Oceanics公司,美国)对不同水深分层采样,每层采样3次,12:00读取Niskin采水器记录的各层水温.每次采集5 L水样,其中1 L置于采样瓶中,加入1 %的鲁哥试剂固定,用于浮游植物的定性定量分析;取1 L置于采样瓶中,储存于设置为零度的便携式冰箱(Prima,英国)中带回实验室进行叶绿素a(Chl.a)浓度的检测分析;取1 L置于采样瓶中,储存于冰箱以便进行总磷(TP)、溶解性总磷(DTP)、溶解性反应磷(SRP)和溶解性有机磷(DOP)浓度等指标的检测分析;分别另取1 L置于采样瓶中,立即放入便携式冰箱带回实验室进行CA和AP的活性检测.
1.3 样品的检测方法 1.3.1 Chl.a浓度与拟多甲藻细胞密度的测定用90 %丙酮抽提后检测分析Chl.a浓度[20].将鲁哥试剂固定后的样品以沉降器沉淀96 h,虹吸上清液,将水样浓缩到40 ml保存.使用Olympus BX43光学显微镜观测浓缩样品,定性分析鉴定其所属门类[21],定量分析采用浮游植物计数框,获得细胞密度(cells/L).
1.3.2 磷相关指标的测定TP、DTP和SRP浓度采用钼酸铵分光光度法进行分析[20]. DOP浓度为DTP与SRP的差值.
1.3.3 CA活性的测定采用Wilbur-Anderson的量电法测定CA活性[22].将1 L水样离心浓缩,获得藻细胞,以12 mmol/L Veronal Buffer(pH为8.30)清洗两次并重悬浮,加入少许液氮研磨成匀浆;迅速将2 ml冰浴中的饱和CO2溶液(向蒸馏水中充60 min的纯CO2气体获得)注入由超级恒温水浴调控为2℃的细胞匀浆液中,用pH计监测匀浆液pH值变化,记录pH值从8.30下降到7.30的时间. CA活性以单位叶绿素(μg Chl.a)计算:
| $ {\rm{CA}}12({\rm{E}}{\rm{.U}}{\rm{.}}) = 10[({{\rm{T}}_0}/{\rm{T}})-1]({\rm{ \mathit{ μ} g}}\;{\rm{Chl}}.{\rm{a}}) $ | (1) |
式中,T与T0分别代表含有和不含CA时溶液pH值下降的时间.
1.3.4 AP活性的测定采用Ray等[23]1991年以对硝基苯磷酸二钠盐(p-nitrophenyl phosphate, pNPP)为底物的分光光度法.将1 L水样离心,浓缩并搜集藻液500 μl,分别加入200 μl 3.6 mmol/L的pNPP与2 mmol/L的MgCl2,以Tris-HCl buffer 0.2 mmol/L调整至终体积3 ml;在37℃恒温水浴反应2 h后加入300 μl浓度为4 mol/L的NaOH后终止反应,然后将样品离心(7000 rcf,4 min)后在分光光度计上于405 nm处测定其吸光度值.根据pNPP标准曲线换算其活性.酶活性定义为每小时每微克Chl.a在37℃释放的对硝基苯酚(pNP)的微摩尔数,单位为μmol pNP/(μg Chl.a ·h).
1.4 数据的统计分析方法现场采样分3份,实验检测3次.实验数据用Origin 8.5软件分析并绘制图表,并对各组数据进行方差分析和组间差异显著性检验(One-way ANOVA).用SPSS 13.0软件,进行Pearson相关性双侧检验,分析拟多甲藻水华密度与磷、CA、AP以及水深等因子的相关性.
2 结果与分析 2.1 拟多甲藻在水体中的昼夜垂直分布水华发生监测点位拟多甲藻的最低细胞密度出现在水下15 m,为1.2×103cells/L,最高值出现在表层,为5.2×106 cells/L,表层浮游植物总细胞密度均值为5.6×106 cells/L,其中拟多甲藻占据83.9 %以上,是绝对优势种,除拟多甲藻外,水样中存在数量不多的硅藻、绿藻、蓝藻.
上午8:00,拟多甲藻在表层的细胞密度为0.7×106cells/L,从表层至6 m水深处,拟多甲藻的分布呈现增加趋势,到6 m处密度最大,达到2.1×106 cells/L,9~15 m,密度较小,在2.0×104cells/L左右,呈现出拟多甲藻从深处向表层迁移的趋势;12:00时拟多甲藻在表层水细胞密度最大,达到5.2×106 cells/L,此时,拟多甲藻在水中的分布随着水深逐渐减少,至水下12 m深处,细胞密度降低至1.2×104 cells/L;下午16:00,拟多甲藻在表层的细胞密度降至3.0×106 cells/L,其在水中的垂直分布依然随着水深增加逐渐减少,但16:00相比于上午8:00,尤其是水下9 m和12 m处,其细胞密度略高,说明拟多甲藻在逐渐向水下迁移;20:00时,拟多甲藻在表层的细胞密度进一步降低至1.1×106 cells/L,而其他不同深度下拟多甲藻的分布趋于均匀,水下3~9 m,拟多甲藻的细胞密度在0.8×106~1.0×106 cells/L之间,水下12 ~15 m的细胞密度与16:00时差异不大;次日凌晨0:00时,拟多甲藻在水中的垂直分布更趋向均匀,表层细胞密度仅为0.4×106 cells/L,水下3~9 m,拟多甲藻有向下迁移的趋势,细胞密度从0.4×106 cells/L增加至1.9×106 cells/L,12~15 m水深处细胞密度也较高,在1.0×106 cells/L左右;凌晨4:00时,拟多甲藻在水中的分布较均匀,从表层至水下15 m,细胞密度为0.5×106~1.3×106 cells/L,9 m处细胞密度最大,为1.3×106 cells/L(图 2).

|
图 2 拟多甲藻细胞密度沿水深的分布 Fig.2 Vertical distribution of Peridiniopsis cell density along water depth |
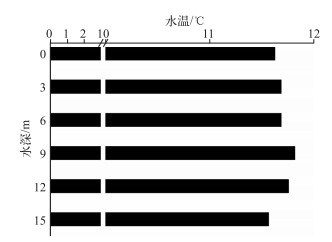
拟多甲藻水华发生时为2月,此时水温有极其微弱的分层,表层水温11.62℃,水下9 m处水温最高,为11.81℃,水下15 m水温为11.56℃;温差不及0.3℃(图 3).
|
图 3 水温沿水深的分布 Fig.3 Vertical distribution of water temperature along water depth |
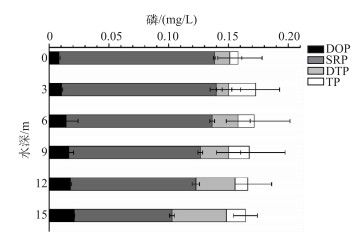
在水华发生处,水体TP浓度在0.16~0.18 mg/L之间,在不同深度的分布并无显著的规律;水体DTP浓度在0.15~0.16 mg/L之间,其分布也与水深无显著相关性;SRP浓度在表层和3 m处为0.14 mg/L,之后有随水深减小的趋势,至15 m深达0.11 mg/L(P<0.05);而DOP浓度随着水深有增加的趋势,表层为0.009 mg/L,至15 m处达到0.025 mg/L(P<0.05)(图 4).
|
图 4 不同形态磷沿水深的分布 Fig.4 Vertical distribution of various forms of phosphorus along water depth |
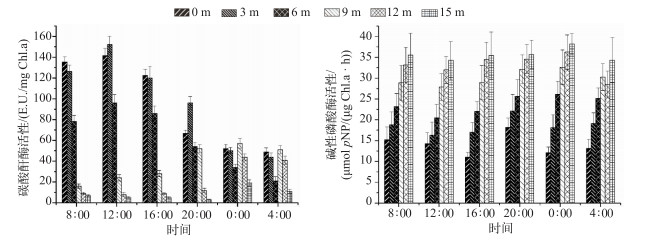
白天的8:00、12:00和16:00,水中CA活性显著高于夜晚(P<0.05),其中最高值出现在12:00时的3 m深处,为152 E.U./mg Chl.a;8:00和16:00时CA活性在水中呈现显著的垂直分布(P<0.05),越贴近表层越高;夜晚的20:00、0:00和4:00,水中不同深度CA活性与水深无显著相关性,20:00时,3 m处CA活性最高,达101 E.U./mg Chl.a,其余时段和深度的CA活性均低于72 E.U./mg Chl.a;夜晚时段9 m与12 m水深的CA活性略高于白天(图 5).
|
图 5 CA和AP活性沿水深的分布 Fig.5 Vertical distribution of carbonic anhydrase activity and alkaline phosphatase activity along water depth |
在取样的6个时间里AP活性有随着水深分布呈现显著增加的规律(P<0.01),但没有昼夜差异. 15 m水深时,AP活性在0:00时最大,可达37 μmol pNP/(μg Chl.a ·h),表层AP活性较低,在16:00时最小,为11 μmol pNP/(μg Chl.a ·h)(图 5).
2.6 拟多甲藻的垂直迁移行为与碳磷等因素的相关性分析拟多甲藻沿水深的细胞密度分布与碳磷等因素的相关性分析结果(表 1)显示,水温与其他指标不具有相关性;水深与细胞密度呈极显著负相关(r=-0.494,P<0.01);与SRP浓度呈显著负相关(r=-0.939,P<0.05),与DOP浓度呈显著正相关(r=0.972,P<0.05);拟多甲藻细胞密度与SRP浓度呈极显著正相关(r=0.476,P<0.01),与DOP浓度却呈极显著负相关(r=-0.474,P<0.01);SRP浓度与DOP浓度之间呈显著负相关(r=-0.915,P<0.05);CA活性与水深呈显著负相关(r=-0.766,P<0.05),与细胞密度呈极显著正相关(r=0.738,P<0.01),与SRP浓度呈显著正相关(r=0.734,P<0.05),与AP活性呈显著负相关(r=-0.772,P<0.05);AP活性与水深呈极显著正相关(r=0.959,P<0.01),与细胞密度呈极显著负相关(r=-0.492,P<0.01),与SRP和DOP浓度分别呈极其显著负相关(r=-0.921,P<0.01)和正相关(r=0.954,P<0.01).
| 表 1 拟多甲藻沿水深的细胞密度分布与碳磷等因素的相关性分析 Tab.1 Correlation analysis between the vertical distribution of Peridiniopsis cell density and related factors |
根据杨正健等与刘流等的研究[24-25],香溪河库湾垂向温差在早春2月最小,水温分层较弱,低于1℃,这是全年水体稳定度最差的时候,上下层水体可较为均匀地对流混合,通常认为这样的条件不利于水华的发生,通常在3月中旬之后,水温迅速升高,水体稳定度骤然增加,垂向水温出现显著的分层现象,此时可监测到Chl.a浓度随水温升高而升高,在易发生水华的河段,表层底层温差最大可达7.01℃[26];但是对于拟多甲藻而言,在弱分层的水体中细胞密度最大,而水体分层状态的加强反而会导致其细胞密度的减少[27],这可能是因为水温分层会影响拟多甲藻的垂直迁移,导致其夜间垂向迁移无法穿越温跃层.本研究于2月开展,此时表层与水下15 m水温几乎相同,最高温在水下9 m处,温差不及0.3℃,水体分层现象很弱,可以认为水温对拟多甲藻的影响较小,因此这样的条件反而促使拟多甲藻水华的发生.
3.2 拟多甲藻的垂直迁移行为与其获得碳源的关系有研究表明,拟多甲藻的CCM机制不同于蓝藻,它仅受环境CO2而非HCO3-浓度的限制[28-29],即拟多甲藻细胞质膜上的CA可能仅为α型,其功能为感知外界环境中的CO2浓度,调节CCM机制的表达,其活性不体现为电化学活性[30-31].拟多甲藻可检测到电化学活性的CA应是其细胞质内的β型CA,它是CCM机制的重要组成部分,它将进入胞内的CO2转化为HCO3-,阻止CO2外泄[32],因此本研究中即使在水下难以接触气态CO2,仍可以检测到CA活性.本研究结果表明,拟多甲藻白天逐渐迁移至水表层,至12:00时其细胞密度达到最大,日间的迁移过程伴随着其在水中CA活性的逐渐增加;夜晚迁移至水下,至凌晨0:00-4:00,细胞密度在水下的分布逐渐均匀,其CA活性不存在垂直分布.这可能是因为白天拟多甲藻为获取光照和CO2,受CCM机制调节,必须迁移至表层才能获取尽可能多的碳源,向表层迁移的过程中接触到气态CO2(aq),CO2随水深的减小在水中的扩散逐渐增加,拟多甲藻胞内CA活性逐渐升高;到夜晚无光照,CA活性也不再呈现垂直分布.
3.3 拟多甲藻的垂直迁移行为与磷分布的关系我国曾有多地发生拟多甲藻水华,如武汉东湖和福建九龙江北溪等[33-34];但已有的报道并未提到水华发生地磷的化学形态及其在水中是否存在垂直分布情况. 20世纪以色列Kinneret湖曾多次发生拟多甲藻水华,Kinneret湖平均水深为20 m,Wynne等[35]的研究表明此湖的拟多甲藻在对磷的利用在表层和深水层存在显著差异,体现在藻的AP活性与水体总AP活性在不同水深有垂直分布现象.本研究中香溪河库湾水体TP和DTP浓度都没有垂直分布规律,但DOP浓度存在典型的垂直分布情况,与之对应,拟多甲藻的AP活性也有典型的垂直分布规律,而且其活性与DOP浓度呈显著正相关;这可能是因为拟多甲藻自身的胞外AP水解水中的DOP,在水华暴发期迅速耗尽水中SRP后为其繁殖储备磷源,而由于DOP浓度在水中的垂直分布,导致AP在水中也呈相关性分布规律.在磷限制环境中,AP将水中的磷酸单酯水解成SRP,这是藻类在磷限制条件下利用磷的重要途径[15],如2002-2005年在长江口寡营养的海水中发生原甲藻和米氏凯伦藻的赤潮[36],监测均发现赤潮发生地AP出现峰值.
4 结论香溪河库湾拟多甲藻水华发生时水体分层弱,各层水温温差小,可以认为水温不是拟多甲藻水华发生的主要原因.本研究在结合碳磷分布以及拟多甲藻对碳磷生理响应的基础上分析其昼夜垂直迁移行为,认为日间其向表层水的迁移,是为了在光合作用获取光能的同时获得碳源CO2(aq),而夜间向水下深处的迁移,与其利用AP水解DOP获得磷源有关.
| [1] |
Tang HB, Liu GX, Hu ZY et al. Preliminary research on the algal bloom of Peridiniopsis sp. in gaolan river of the three gorges researvoir. Acta Hydrobiologica Sinica, 2006, 30(1): 47-50. [汤红波, 刘国祥, 胡征宇等. 三峡库区高岚河甲藻水华的初步研究. 水生生物学报, 2006, 30(1): 47-50.] |
| [2] |
Yang ZJ, Liu DF, Yi ZQ et al. Diurnal vertical migration of Peridiniopsis sp. in Xiangxi Bay of Three Gorges Reservoir. Res Environ Sci, 2010, 23: 26-32. [杨正健, 刘德富, 易仲强等. 三峡水库香溪河库湾拟多甲藻的昼夜垂直迁移特性. 环境科学研究, 2010, 23: 26-32.] |
| [3] |
Roset J, Gibello A, Aguayo S et al. Mortality of rainbow trout. Aquaculture Research, 2002, 33: 141-145. DOI:10.1046/j.1365-2109.2002.00660.x |
| [4] |
Ginzburg B, Chalifa I, Zohary T et al. Identification of oligosulfide odorous compounds and their source in the lake of Galilee. Water Research, 1998, 32: 1789-1800. DOI:10.1016/S0043-1354(97)00396-5 |
| [5] |
Xu YY, Cai QH, Li DF et al. Preliminary report on diel vertical distribution patterns of Peridiniopsis in Xiangxi Bay of the Three Gorges Reservoir. J Wuhan Bot Res, 2008, 26(6): 608-612. [徐耀阳, 蔡庆华, 黎道丰等. 三峡水库香溪河库湾拟多甲藻昼夜垂直迁移分布初步研究. 武汉植物学研究, 2008, 26(6): 608-612.] |
| [6] |
Peng L. Studies on the microcystin pollution of waterbodies and aquatic organisms in Lake Taihu, Lake Chaohu and Lake Dianchi[Dissertation]. Wuhan:Institute of Hydrobiology, CAS, 2010:41-59. [彭亮. 太湖、巢湖、滇池水体和水产品中微囊藻毒素污染状况研究[学位论文]. 武汉: 中国科学院水生生物研究所, 2010: 41-59. ]
|
| [7] |
Regel RH, Brookes JD, Ganf GG. Vertical migration, entrainment and photosynthesis of the freshwater dinoflagellate Peridinium cinctum in a shallow urban lake. Journal of Plankton Research, 2003, 26: 143-157. |
| [8] |
Olsson P, Graneli E. Observations on diurnal vertical migration and phased cell division for three marine dinoflagellates. Journal of Plankton Research, 1991, 13: 1313-1324. DOI:10.1093/plankt/13.6.1313 |
| [9] |
Qi YZ, Huang CJ, Zhong Y et al. Laboratory study on the diurnal vertical migration of a poisonus Red-tide dinoflagellate Alexandrium tamarense. Chin Limnol Oceanogr, 1997, 28(5): 458-467. [齐雨藻, 黄长江, 钟彦等. 甲藻塔玛亚历山大藻昼夜垂直迁移特性的研究. 海洋与湖沼, 1997, 28(5): 458-467.] |
| [10] |
Heaney SI, Eppley RW. Light, temperature and nitrogen as interacting factors affecting diel vertical migrations of dinoflagellates in culture. Journal of Plankton Research, 1981, 3(2): 331-344. DOI:10.1093/plankt/3.2.331 |
| [11] |
Kunihiko A, Masataka W, Kuniok et al. Conditions necessary for Chattonella antiqua red tides outbreaks. Limnology and Oceanography, 1998, 43(1): 117-128. DOI:10.4319/lo.1998.43.1.0117 |
| [12] |
Harris GP. Temporal and spatial scales in phytoplankton ecology:Mechanisms, methods, models and management. Canadian Journal of Fisheries and Aquatic Sciences, 1980, 37: 877-900. DOI:10.1139/f80-117 |
| [13] |
Wang JH, Huang XQ. Prorocentrum dentatum and the cause of harmful algae bloom formation in China Sea. Chin J Appl Ecol, 2003, 14(7): 1065-1069. [王金辉, 黄秀清. 具齿原甲藻的生态特征及赤潮成因浅析. 应用生态学报, 2003, 14(7): 1065-1069.] |
| [14] |
Zhang MZ, Xu ZH, Liang B. Evaluation of phosphorus relase from phosphate waste rock pile deposited in Xiangxi River watershed. Environ Chem, 2016, 35(7): 1390-1397. [张梦舟, 徐曾和, 梁冰. 香溪河流域磷矿废渣堆堑体磷素释放量预测. 环境化学, 2016, 35(7): 1390-1397. DOI:10.7524/j.issn.0254-6108.2016.07.2015121501] |
| [15] |
Berman T. Differential uptake of orthophosphate and organic phosphorus substrates by bacteria and algae in Lake Kinneret. Journal of Plankton Research, 1988, 10: 1239-1249. DOI:10.1093/plankt/10.6.1239 |
| [16] |
Štrojsová A, Vrba J, Nedoma J et al. Seasonal study of extracellular phosphatase expression in the phytoplankton of a eutrophic reservoir. European Journal of Phycology, 2003, 38: 295-306. DOI:10.1080/09670260310001612628 |
| [17] |
Berman-Frank I, Erez J, Kaplan A. Changes in inorganic carbon uptake during the progression of a dinoflagellate bloom in a lake ecosystem. Canadian Journal of Botany, 1997, 76: 1043-1051. |
| [18] |
Badger MR, Spalding MH. CO2 acquisition, concentration and fixation in cyanobacteria and algae. In:Leegood RC, Sharkey TD, von Caemmerer S eds. Photosynthesis:Physiology and metabolism. Dordrecht:Kluwer Academic Publishers, 2000:369-397.
|
| [19] |
Badger MR, Price GD. The role of carbonic anhydrase in photosynthesis. Annual Review of Plant Physiology and Plant Molecular Biology, 1994, 45: 369-392. DOI:10.1146/annurev.pp.45.060194.002101 |
| [20] |
"Monitoring and analysis method of water and wastewater" editorial board of State Environmental Protection Administration of China ed. Monitoring and analysis methods of water and wastewater:fourth edition. Beijing:China Environmental Science Press, 2002. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法: 第4版. 北京: 中国环境科学出版社, 2002. ]
|
| [21] |
Hu HJ, Wei YX eds. The freshwater algae of China:Systematics, taxonomy and ecology. Beijing: Science Press, 2006. [胡鸿均, 魏印心. 中国淡水藻类——系统, 分类及生态. 北京: 科学出版社, 2006.]
|
| [22] |
Wilbur KM, Anderson NG. Electrometric and colorimetric determination of carbonic anhydrase. The Journal of Biological Chemistry, 1948, 1715: 147-154. |
| [23] |
Ray JM, Bhaya D, Block MA et al. Isolation, transcription, and inactivation of the gene for an atypical alkaline phosphatase of Synechococcus sp. Strain PCC7942. Journal of Bacteriology, 1991, 173: 4297-4309. DOI:10.1128/jb.173.14.4297-4309.1991 |
| [24] |
Yang ZJ, Liu DF, Ma J et al. Effects of special vertical layered water temperatures on algal bloom in Xiangxi Bay of Three Gorges Reservoir. J Wuhan Univ:Techno ED, 2012, 45(1): 1-9. [杨正健, 刘德富, 马骏等. 三峡水库香溪河库湾特殊水温分层对水华的影响. 武汉大学学报:工学版, 2012, 45(1): 1-9.] |
| [25] |
Liu L, Liu DF, Xiao SB et al. Effects of thermal stratification on spring blooms in Xiangxi Bay of the Three Gorges Reservoir. Chin J Envir Sci, 2012, 33(9): 3046-3050. [刘流, 刘德富, 肖尚斌等. 水温分层对三峡水库香溪河库湾春季水华的影响. 环境科学, 2012, 33(9): 3046-3050.] |
| [26] |
Yi ZQ, Liu DF, Yang ZJ et al. Water temperature structure impact of which on the bloom in spring in Xiangxi Bay at Three Gorges Reservoir. J Hydroecology, 2009, 2(5): 6-11. [易仲强, 刘德富, 杨正健等. 三峡水库香溪河库湾水温结构及其对春季水华的影响. 水生态学杂志, 2009, 2(5): 6-11.] |
| [27] |
Yao XJ, Liu DF, Yang ZJ et al. Preliminary studies on the mechanism of winter Dinoflagellate bloom in Xiangxi Bay of the Three Gorges Rservoir. Res Environ Sci, 2012, 25(6): 645-651. [姚绪姣, 刘德富, 杨正健等. 三峡水库香溪河库湾冬季甲藻水华生消机理初探. 环境科学研究, 2012, 25(6): 645-651.] |
| [28] |
Berman-Frank I, Erez J. Inorganic carbon pools in the bloom-forming Dinoflagellate Peridinium gatunense. Limnology and Oceanography, 1996, 41: 1780-1789. DOI:10.4319/lo.1996.41.8.1780 |
| [29] |
Berman-Frank I, Erez J, Kaplan A. Changes in inorganic carbon uptake during the progression of a dinoflagellate bloom in a lake ecosystem. Canadian Journal of Botany, 1997, 76: 1043-1051. |
| [30] |
Fukuzawa H, Suzuki E, Komukai Y et al. A gene homologous to chloroplast carbonic anhydrase (icfA) is essential to photosynthetic carbon dioxide fixation by Synechococcus PCC7942. PNAS, 1992, 89: 4437-4441. DOI:10.1073/pnas.89.10.4437 |
| [31] |
So AKC, Espie GS. Cloning, characterization and expression of carbonic anhydrase from the cyanobacterium Synechocystis PCC 6803. Plant Molecular Biology, 1998, 37: 205-215. DOI:10.1023/A:1005959200390 |
| [32] |
Moroney JV, Somanchi A. How do algae concentrate CO2 to increase the efficiency of photosynthetic carbon fixation?. Plant Physiology, 1999, 119: 9-16. DOI:10.1104/pp.119.1.9 |
| [33] |
Cao XY, Štrojsová A, Znachor P et al. Detection of extracellular phosphatases in natural spring phytoplankton of a shallow eutrophic lake (Donghu, China). European Journal of Phycology, 2005, 40: 1-8. DOI:10.1080/09670260500192760 |
| [34] |
Bian GG, Chen N, Hu ZY et al. A River in Fujian algal dinoflagellate relationship with the pollution index. J Lake Sci, 2010, 22: 405-410. [边归国, 陈宁, 胡征宇等. 福建某河流甲藻水华与污染指标的关系. 湖泊科学, 2010, 22: 405-410. DOI:10.18307/2010.0313] |
| [35] |
Wynne D, Patni NJ, Aaronson S et al. The relationship between nutrient status and chemical composition of Peridinium cinctum during the bloom in Lake Kinneret. Journal of Plankton Research, 1982, 4: 125-136. DOI:10.1093/plankt/4.1.125 |
| [36] |
Ou LJ. Ecophysiological responses of typical harmful algal bloom species to phosphorus[Dissertation]. Xiamen:Xiamen University, 2006. [欧林坚. 典型赤潮藻对磷的生态生理响应[学位论文]. 厦门: 厦门大学, 2006. ]
|
 2018, Vol. 30
2018, Vol. 30 
