(2: 南京林业大学风景园林学院, 南京 210037)
(2: College of Landscape Architecture, Nanjing Forestry University, Nanjing 210037, P. R. China)
自然水位波动节律是湖泊水生植物种类组成和分布格局的主要影响因素[1-2].在长期的进化过程中,湖泊植物逐渐形成了与之相适应的形态特征、物候节律和生活史对策[3].长江中下游作为我国淡水湖泊最为集中的区域之一,历史上曾孕育了十分多样的水生植物群落.然而,由于人为的建闸筑坝,流域内绝大多数湖泊水位波动节律发生了改变,使水生植物的群落结构和物种多样性均发生了较大变化[4].
菰(Zizania latifolia),俗称茭白,为禾本科多年生挺水植物;株高可达3~4 m,具发达的地下茎,可通过种子、地上茎的分蘖芽和地下茎等繁殖,且以地下茎的无性繁殖为主[5].菰在长江中下游湖泊中广泛分布,然而在不同湖泊中该物种呈现两极化发展,其生态地位也完全相反.一些湖泊为了航运和灌溉,建闸后冬、春季节水位大幅提高(如巢湖、洪泽湖),菰群落由于不能萌发而消亡[2].另一些湖泊则为了防洪和渔业,建闸后水位波幅减小、年均水位降低,导致菰群落过度繁殖,湖泊面临严重的沼泽化(如武昌湖,菰群落分布面积已达50 %以上)[6].在前一类湖泊,菰由于具有较强的净化能力,同时其发达的地下茎还能稳固堤岸,因此是生态修复过程中重要的恢复类群[7];而在后一类湖泊中,如何控制菰的扩张反而成为首要问题.目前,已有研究表明水生植物在幼苗期抵抗外界不良环境的能力要弱于生活史的其他阶段[8].因此,就长江中下游湖泊而言,无论是菰群落的恢复或控制都必须首先了解菰幼苗生长所需的水文条件,而相应的研究却很少有人报道.
目前关于水文因素对菰影响的研究主要是水深、持续时间、水位上涨速率等对菰成株形态特征和生物量分配的影响[9-10];Zhang等[6]还通过野外调查分析了菰根状茎萌发的水深阈值.本研究中,为阐明不同时期菰幼苗对淹没的形态学响应是否有差异,我们分别选择株高为36 cm和70 cm的幼苗进行淹没实验,以期为长江中下游湖泊菰群落的恢复或生态控制提供理论基础.
1 材料与方法 1.1 实验设计2016年2月25日,从安徽省武昌湖湖滨带(30°15′27.90″N,116°42′45.29″E)采集菰的地下茎,然后立即运送到安庆师范大学生物园内, 截成8~10 cm长的小段后用沙土进行栽培. 4月9日,从苗圃中选择株高为36 cm、茎粗为0.4 cm的菰幼苗移植于长塑料盆中(长×宽×高:37 cm×28 cm×15 cm),每个塑料盆3株,所用基质均为武昌湖淤泥.然后把塑料盆用铁链悬挂在水泥池中(长×宽×高:3.5 m×2.2 m×1.2 m),实验共设置3个淹没深度,分别为基质以上0 cm(不淹没)、18 cm(50 %淹没)和36 cm(100 %淹没). 5月15日,从苗圃中选择株高为70 cm、茎粗为0.8 cm的菰幼苗再次进行实验,淹没深度分别为0 cm(不淹没)、35 cm(50 %淹没)和70 cm(100 %淹没).由于长江中下游湖泊在菰的幼苗期水位相对稳定,但受强降雨或闸坝调节的影响,水位的快速上涨或下降一般仅对菰幼苗造成短暂的淹没,因此本实验持续时间均设置为14 d.以上每组实验均设置3次重复.实验期间,水泥池中水体的总氮和总磷浓度分别为0.22和0.01 mg/L;基质中总氮和总磷含量分别为1.52和0.68 mg/g,有机质含量为35.56 mg/g.
1.2 数据分析实验结束后,将所有植物从塑料盆中收获.洗净植物根部的泥土和杂质后采用卷尺测量菰幼苗的株高和最大根长,用游标卡尺测量幼苗基部的茎粗和最大叶宽.采用WinRHIZO根系分析系统(Regent Instruments Canada Inc., Otlawa, Canada),在扫描分辨率为300 dpi的情况下,以0.5 mm为一个径级,获得每株植物根系的总根长、表面积、平均直径、体积、根分叉数等指标.然后,所有植物分为地上和地下两部分在烘箱(80℃)中持续烘干3 d,以获得根重、茎重和总重.采用单因素方差分析(One-way ANOVA)来分析淹没深度对不同时期菰幼苗地上和地下部分形态学参数和生物量分配的影响.采用Tukey's HSD (Honestly Significant Difference)多重比较来检验组间的差异.在数据分析过程中,如果需要则采用log转化来满足正态分布和方差齐性[11].所有分析通过SPSS 13.0软件完成.
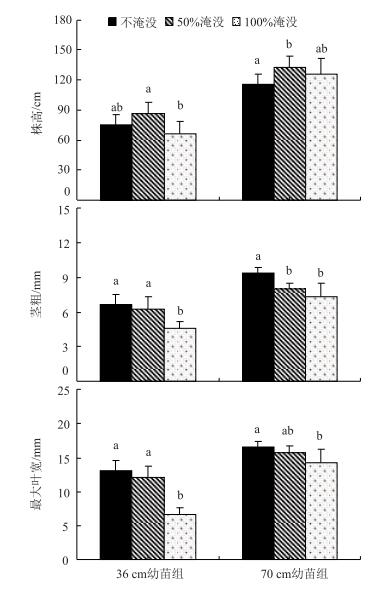
2 研究结果 2.1 地上部分形态学参数两组菰幼苗株高、茎粗和最大叶宽的形态学响应有一定差异(图 1).随着淹没强度的增加,虽然菰幼苗株高均先升高后下降,而茎粗和最大叶宽均逐渐降低,但36 cm幼苗组株高在100 %淹没处理下最低,而70 cm幼苗组在不淹没处理下最低.方差分析结果表明,36 cm幼苗组茎粗和最大叶宽在不淹没和50 %淹没处理下无显著差异,却均显著高于100 %淹没;而70 cm幼苗组茎粗和最大叶宽在50 %和100 %淹没处理下均无显著差异.
|
图 1 不同淹没深度下菰幼苗的株高、茎粗和最大叶宽的对比 (每个幼苗组内上标不同的字母表示有显著差异,下同) Fig.1 Comparison of the plant height, shoot thickness, and maximum leaf wide of Z. latifolia under different depths of submergence (The different superscript letters within each group represent significant differences, the same below) |
两个时期菰幼苗根系形态学参数对淹没的响应也有较大差异(表 1). 36 cm幼苗组,在不淹没和50 %淹没处理下最大根长、总根长、表面积、体积和根分叉数均显著高于100 %淹没处理组,但根系平均直径却显著低于100 %淹没处理组. 70 cm幼苗组,在不淹没情况下所有6个根系指标均与其他两种淹没处理有显著差异;在50 %和100 %淹没处理组之间,最大根长、平均直径、表面积和体积均无显著差异,但总根长和根分叉数却存在显著差异.
| 表 1 不同淹没深度下菰幼苗根部形态特征对比* Tab.1 Comparison of the root morphological characteristics of Z. latifolia under different depths of submergence |
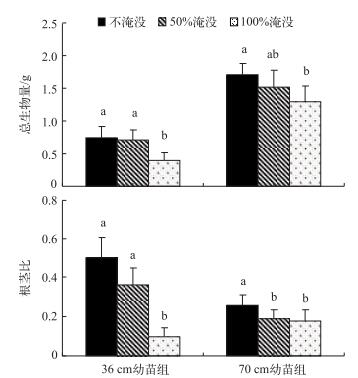
随着淹没深度的增加,不同时期菰幼苗总生物量和根茎比均表现出逐渐下降的趋势(图 2).方差分析结果表明,36 cm幼苗组在100 %淹没处理下总生物量和根茎比均显著低于不淹没和50 %淹没处理组;而70 cm幼苗组在100 %淹没处理下总生物量仅显著低于不淹没处理组,且50 %和100 %淹没处理组之间根茎比无显著差异.
|
图 2 不同淹没深度下菰幼苗总生物量和根茎比的对比 Fig.2 Comparison of the total biomass and root :shoot of Z. latifolia under different depths of submergence |
湿地植物由于生长环境的特殊性,经常会受到周期性或非周期性淹没的胁迫[12].然而,挺水植物和沉水植物不同,当植株全部被淹没的时候不能够继续进行光合作用.虽然也有研究表明淹没对部分挺水植物地上部分形态学参数影响不大[13],但大多数挺水植物常通过时间和空间上的逃避或者新陈代谢的改变来进行适应[14].在淹没状态下,挺水植物最常见的形态学响应是通过细胞生长或细胞分裂来促进茎的延长,同时减少根部生物量的分配[15].因此许多对挺水植物的研究都表明随着淹没深度的增加,植株的茎粗会变细、株高会增加以获得空气中的氧气[9, 16].
本研究中,随着淹没深度的增加,36 cm和70 cm幼苗组茎粗均逐渐降低,与此一致.然而,36 cm幼苗组在100 %淹没下茎粗才表现出显著差异,而70 cm幼苗组在50 %淹没处理下就已经表现出显著差异,这表明70 cm幼苗组可能对淹没更为敏感,其形态学响应能力更强.株高是决定挺水植物能否及时露出水面的重要因素.随着淹没深度的增加,本研究中两个时期菰幼苗株高均出现先上升后下降的趋势(图 1),这表明在一定程度内菰幼苗可以通过形态学响应进行适应,但淹没强度过大反而抑制菰茎的伸长.对芦苇(Phragmites australis)、大米草(Spartina anglica)等挺水植物幼苗的研究也有类似结论[16-17].此外,方差分析表明,36 cm幼苗组在不淹没和50 %淹没情况下株高无显著差异,而70 cm幼苗组在50 %淹没下却显著高于不淹没处理,这表明70 cm幼苗组在淹没情况下可能生长速率更高,形态学适应能力更强.有野外研究表明,菰在夏季其生长速率可达10 cm/d以上[5].这可能主要是因为在较高的光照强度和温度下更有利于菰有机物的合成,也是70 cm幼苗组地上部分比36 cm幼苗组有更大形态学响应的主要原因.水生植物的叶片形态影响着光合作用的效率,然而不同种类水生植物在淹没下其叶片的形态学响应差异较大[18].一部分种类叶宽变窄、叶面积减小,以降低对光的需求[19];但也有一些种类则刚好相反,其叶宽增加、叶面积增大,以适应弱光环境[18].此外,对水蓼(Polygonum hydropiper)的研究结果还表明,随着淹没时间的增加其叶宽出现先降低后增加的现象[13].本研究中,随着淹没深度的增加,两个时期幼苗叶宽均表现出逐渐降低的趋势,且100 %淹没处理组叶宽显著低于不淹没处理,这说明菰幼苗可能主要是通过减小叶面积来适应氧气的相对不足.
3.2 地下部分形态学响应植物根系除了起到锚定作用外,其主要功能是吸收植物生长所需的营养元素和水分,然而这些生理功能的实现均有赖于根部充足的氧气供应[20].在淹没情况下,空气中的氧气很难通过水层进入到底质中,导致植物根系氧气供应减少,有氧呼吸受到抑制,根系活力下降[13].在长期进化过程中,一些植物根部也形成了相应的形态学策略来进行适应.由于氧气在底质中的分布会随深度的增加而减少,因此植物根系长度常会变短、分布变浅,形成位于表层的根系系统[12].还有一些种类会着生大量不定根从周围环境中获得氧气[21].本研究中,不同时期菰幼苗在淹没情况下均未形成不定根,而主要是通过根部形态特征的改变来进行适应.随着淹没深度的增加,两个时期菰幼苗最大根长、总根长、表面积、体积和根分叉数均逐渐降低,这是对根部氧气减少作出的有效适应.但36 cm幼苗组在不淹没和50 %淹没处理下以上5个指标均无显著差异,而70 cm幼苗组却存在显著差异,这表明在相同淹没深度下70 cm幼苗组根系的形态学响应能力更强.根系平均直径也是反映根系特征的重要指标之一,但不同研究者得出的结论不同.例如对小叶章(Deyeuxia angustifolia)的研究结果表明,随着淹没深度的增加,对根部抑制作用的加强会导致根系平均直径的变细[22];然而对酸模属(Rumex)植物的研究结果却表明,随着淹没深度的增加,根系平均直径会增加,以提高根系内部的气体传导能力[23].本研究中,36 cm幼苗组根系平均直径在100 %淹没情况下显著高于其他两个淹没处理,而70 cm幼苗组却在不淹没情况下显著高于其他两个淹没处理,产生这种差异的具体原因还有待进一步分析.
3.3 生物量分配及对湖泊管理的意义通过资源分配的改变来适应淹没也是水生植物的生存策略之一[11].在频繁的干扰情况下,水生植物常会分配更多的生物量到能够抵抗这种干扰的器官[24].许多研究结果均已表明,随着淹没深度的增加,水生植物总生物量会降低,且会分配更多的资源到地上部分以适应不良的环境[25-26].本研究中,随着淹没深度的增加,两个时期菰幼苗总生物量和根茎比均逐渐降低,且3个处理之间存在显著差异,与以上研究结果一致.然而,Wang等对菰成株的实验结果却表明,随着淹没深度的增加不同处理间菰的根茎比存在显著差异,但总生物量却并没有显著差异[9].这表明菰在生活史不同阶段对淹没的响应可能也有一定差异.此外,本研究中36 cm幼苗组在不淹没和50 %淹没情况下根茎比不存在显著差异,而70 cm幼苗组却存在显著差异,这也表明随着菰幼苗的生长,其对淹没的形态学适应能力会逐渐增强.
长江中下游是我国淡水湖泊最为集中、也是湿地退化最严重的区域[27].在过去的几十年里,本区域水生植物多样性严重下降,湖泊富营养化和沼泽化成为亟待解决的两大难题.本研究结果表明,随着菰幼苗的生长,其对淹没的形态学响应能力增强,这对该区域湖泊的生态恢复具有重要意义.我们建议在武昌湖、龙感湖、泊湖和东太湖等以菰为先锋物种的沼泽化湖泊,在菰幼苗期尽早的调节水位进行防控是十分必要的.针对菰的过度繁殖问题,国内早在“八五”期间针对东太湖提出以沉水植物取代菰群落的防治对策[28];Zhang等还通过对武昌湖的研究,提出了提高水位抑制菰萌发的策略[6].然而,对菰幼苗期相应的研究一直未见报道,本研究结果可以作为以上结论很好的补充.此外,在巢湖等严重富营养化湖泊,由于较小的菰幼苗对淹没的形态学响应能力较弱,在菰群落的恢复过程中应重点关注此时期湖泊的水位变化.鉴于现阶段大多数湖泊水位能够通过闸坝进行控制,因此在菰幼苗期保持较浅的水深是促进其快速恢复的有效方法之一.
| [1] |
Raulings EJ, Morris K, Roache MC et al. The importance of water regime operating at small spatial scales for the diversity and structure of wetland vegetation. Freshwater Biology, 2010, 55: 701-715. DOI:10.1111/fwb.2010.55.issue-3 |
| [2] |
Zhang XK, Liu XQ, Wang HZ. Developing water level regulation strategies for macrophytes restoration of a large river-disconnected lake, China. Ecological Engineering, 2014, 68: 25-31. DOI:10.1016/j.ecoleng.2014.03.087 |
| [3] |
Lytle DA, Poff NL. Adaption to natural flow regimes. Trends in Ecology and Evolution, 2004, 19: 94-100. DOI:10.1016/j.tree.2003.10.002 |
| [4] |
Zhang XK, Liu XQ, Wang HZ. Effects of water level fluctuations on lakeshore vegetation of three subtropical floodplain lakes, China. Hydrobiologia, 2015, 747: 43-52. DOI:10.1007/s10750-014-2121-0 |
| [5] |
Wang YQ. The biology of Zizania Latifolia. In:Research group of Honghu Lake of Chinese Academy of Science, Institute of Hydrobiology ed. Comprehensive development of biological productivity and ecological optimization of ecological environment in Honghu Lake. Beijing:China Ocean Press, 1991:65-67. [王业勤. 野菰的生物学. 见: 中国科学院水生生物研究所洪湖课题研究组主编. 洪湖水体生物生产力综合开发及湖泊生态环境优化研究. 北京: 海洋出版社, 1991: 65-67. ]
|
| [6] |
Zhang XK, Wan A, Wang HL et al. The overgrowth of Zizania latifolia in a subtropical floodplain lake:Changes in its distribution and possible water level control measures. Ecological Engineering, 2016, 89: 114-120. DOI:10.1016/j.ecoleng.2016.01.069 |
| [7] |
Li EH, Li W, Wang XL et al. Experiment of emergent macrophytes growing in contaminated sludge:Implication for sediment purification and lake restoration. Ecological Engineering, 2010, 36(4): 427-434. DOI:10.1016/j.ecoleng.2009.11.009 |
| [8] |
Nishihiro J, Miyawaki S, Fujiwara N et al. Regeneration failure of lakeshore plants under an artificially altered water regime. Ecological Research, 2004, 19: 613-623. DOI:10.1111/ere.2004.19.issue-6 |
| [9] |
Wang QL, Chen JR, Liu F et al. Morphological changes and resource allocation of Zizania Latifolia (Griseb.) Stapf in response to different submergence depth and duration. Flora, 2014, 209: 279-284. DOI:10.1016/j.flora.2014.03.006 |
| [10] |
Wang QL, Chen JR, Liu H et al. The growth responses of two emergent plants to the water depth. Acta Hydrobiologica Sinica, 2012, 36(3): 583-587. [王秋林, 陈静蕊, 刘晖等. 两种挺水植物对水位变化的生长响应. 水生生物学报, 2012, 36(3): 583-587.] |
| [11] |
Zhang XK, Liu XQ, Ding QZ. Morphological responses to water level fluctuations of two submerged macrophytes, Myriophyllum spicatum and Hydrilla verticillata. Journal of Plant Ecology, 2013, 6: 64-70. DOI:10.1093/jpe/rts009 |
| [12] |
Luo WB, Xie YH, Song FB. Survival strategies of wetland plants in flooding environments. Chinese Journal of Ecology, 2007, 26(9): 1478-1485. [罗文泊, 谢永宏, 宋凤斌. 洪水条件下湿地植物的生存策略. 生态学杂志, 2007, 26(9): 1478-1485.] |
| [13] |
Chen FQ, Li Y, Qie GW et al. The morphological responses and endurance of Polygonum hydropiper to flooding stress. Journal of Wuhan Botanical Research, 2008, 26(2): 142-146. [陈芳清, 李永, 郄光武等. 水蓼对水淹胁迫的耐受能力和形态学响应. 武汉植物学研究, 2008, 26(2): 142-146.] |
| [14] |
Macek P, Rejmánková E, Houdková K. The effect of long-term submergence on functional properties of Eleocharis cellulosa Torr. Aquatic Botany, 2006, 84: 251-258. DOI:10.1016/j.aquabot.2005.11.003 |
| [15] |
Cooling MP, Ganf GG, Walker KF. Leaf recruitment and elongation:An adaptive response to flooding in Villarsia reniformis. Aquatic Botany, 2001, 70: 281-294. DOI:10.1016/S0304-3770(01)00153-X |
| [16] |
Mauchamp A, Blanch S, Grillas P. Effects of submergence on the growth of Phragmites australis seedlings. Aquatic Botany, 2001, 69(2): 147-164. |
| [17] |
Li HL, Zhi YB, Lei GC et al. Plant growth, reproduction characters and biomass allocation in response to water level gradient in the clonal plant Spartina anglica. Acta Ecologica Sinica, 2009, 29(7): 3525-3531. [李红丽, 智颖飙, 雷光春等. 不同水位梯度下克隆植物大米草的生长繁殖特性和生物量分配格局. 生态学报, 2009, 29(7): 3525-3531.] |
| [18] |
Tan SD, Zhu MY, Zhang KR et al. Response and adaptation of plants to submergence stress. Chinese Journal of Ecology, 2009, 28(9): 1871-1877. [谭淑端, 朱明勇, 张克荣等. 植物对水淹胁迫的响应与适应. 生态学杂志, 2009, 28(9): 1871-1877.] |
| [19] |
Gordon DM, Grey KA, Chase SC et al. Changes to the structure and productivity of a Posidonia sinuosa meadow during and after imposed shading. Aquatic Botany, 1994, 47(3/4): 265-275. |
| [20] |
Bardgett RD, Mommer L, De Vries FT. Going underground:Root traits as drivers of ecosystem processes. Trends in Ecology and Evolution, 2014, 29(12): 692-699. DOI:10.1016/j.tree.2014.10.006 |
| [21] |
Pezeshki SR. Wetland plant responses to soil flooding. Environmental and Experimental Botany, 2001, 46: 299-312. DOI:10.1016/S0098-8472(01)00107-1 |
| [22] |
Xie Y, Luo W, Wang K et al. Root growth dynamics of Deyeuxia angustifolia seedlings in response to water level. Aquatic Botany, 2008, 89(3): 292-296. DOI:10.1016/j.aquabot.2008.03.003 |
| [23] |
Visser EJW, Blom CWPM, Voesenek LACJ. Flooding-induced adventitious rooting in Rumex:Morphology and development in an ecological perspective. Acta Botanica Neerlandica, 1996, 45(1): 17-28. DOI:10.1111/plb.1996.45.issue-1 |
| [24] |
Barrat-Segretain MH. Biomass allocation in three macrophyte species in relation to the disturbance level of their habitat. Freshwater Biology, 2001, 46(7): 935-945. DOI:10.1046/j.1365-2427.2001.00728.x |
| [25] |
Coops H, van den Brink FWB, van der Velde G. Growth and morphological responses of four helophyte species in an experimental water-depth gradient. Aquatic Botany, 1996, 54(1): 11-24. DOI:10.1016/0304-3770(96)01025-X |
| [26] |
Lieffers VJ, Shay JM. The effects of water level on the growth and reproduction of Scirpus maritimus var. paludosus. Canadian Journal of Botany, 1981, 59(2): 118-121. DOI:10.1139/b81-019 |
| [27] |
Fang J, Wang Z, Zhao S et al. Biodiversity changes in the lakes of the Central Yangtze. Frontiers in Ecology and the Environment, 2006, 4(7): 369-377. DOI:10.1890/1540-9295(2006)004[0369:BCITLO]2.0.CO;2 |
| [28] |
Wu QL. Experiment of pen fish farming in Zizania caduciflora area of East Taihu Lake. Transactions of Oceanology and Limnology, 1997(1): 38-42. [吴庆龙. 东太湖茭草区网围养鱼模式试验研究. 海洋湖沼通报, 1997(1): 38-42.] |
 2018, Vol. 30
2018, Vol. 30 

