(2: 浙江省环境监测中心, 杭州 310012)
(2: Zhejiang Provincial Environmental Monitoring Center, Hangzhou 310012, P. R. China)
蓝藻水华近年来已成为一个全球性的挑战,并且随全球变暖呈扩张加剧之势[1-2].因为很多形成水华的蓝藻种类通常能够产生多种有毒的次生代谢产物,后者会对包括浮游植物在内的其他生物产生不利影响, 甚至对人类健康产生威胁[3-6],因此蓝藻水华受到广泛关注.次生代谢物是指不直接参与生物体正常的生长、发育和繁殖的有机化合物,但是这类物质具有生物活性,并可能对其他生物的生长发育产生影响,这一过程被称为化感作用或化感效应[7].其又可以定义为一个物种通过产生并向环境中释放某种或某些化合物而对另一种物种产生的直接或间接影响[8].能够产生对其他物种有害的生物活性物质的物种通常具有较强的种间竞争能力,从而在生态系统中占据主导地位[1, 9-10].因而化感物质被认为是促进和维系海洋和淡水生态系统中蓝藻水华形成的一个主要原因[11].化感效应能够影响生物体的多种生理过程,例如一些可以形成水华的蓝藻可以抑制其他藻类的光合放氧、光系统Ⅱ(PSII)元件合成、ATP酶合成,诱导活性氧自由基(ROS)的生成甚至引起细胞解体和死亡[1, 6, 12].
浮游藻类在细胞内合成化感物质并通过主动分泌或细胞裂解释放至水体中[13-15].目前已有研究发现蓝藻产生的化感物质能够影响水生植物的出芽、生长、多个生理及生化过程[16-19].蓝藻能够产生多种毒素,如肝毒素(hepatotoxins)、神经毒素(neurotoxins)和皮肤毒素(dermatotoxins)等,其中具有肝毒性的微囊藻毒素(microcystins, MCs)最为常见[20-23]. MCs通常由铜绿微囊藻(Microcystis aeruginosa)和阿氏浮丝藻(Planktothrix agardhii)产生,是一类环状七肽化合物,能够强烈抑制动植物中蛋白磷酸酶1和2A(PPP1 and PPP2A)的活性[24-25].其不仅可以在衰亡期通过细胞的裂解大量释放至周围水体中,也可以从活性较好的细胞直接分泌至水体中[26-28].
MCs是蓝藻的主要次生代谢产物,已有研究证实其能够抑制一些沉水植物的生长及光合放氧[29],并且被认为是影响其他浮游植物生长的关键化感物质[1, 30-32].最近有研究发现处于指数生长期及稳定期的铜绿微囊藻分泌物能够抑制绿藻四尾栅藻(Scenedesmus quadricauda)、蛋白核小球藻(Chlorella pyrenoidosa)及硅藻梅尼小环藻(Cyclotella meneghiniana)的生长[32].但是也有研究人员发现微囊藻毒素-LR (MC-LR)和蓝藻提取物对多种藻类光合作用的影响因种类和感染时间的不同表现出不同的生物学效应[33]. Sukenik等[34]认为微囊藻对加顿多甲藻(Peridinium gatunense)生长和光合作用的抑制作用不是因为MC-LR而是由一种分子量为5 kDa的热稳定性疏水化合物引起的.也有一些研究者认为MC-LR的化感作用可能有限,并且在蓝藻细胞内外均不够稳定[18, 35].因此,尽管目前有关MC-LR的毒性效应开始受到越来越多的关注,但是对该物质在水生生态系统的生物学功能尚存在很多争议.
浮游绿藻和蓝藻都是富营养化水体中的常见优势种群, 并且其种群丰度因受营养盐和温度等环境因子的驱动而处于动态变化之中[36-37].普通小球藻(C. vulgaris)通常被用作化感效应研究的模式物种[1, 6, 8].我们的前期研究表明,铜绿微囊藻能够通过化感作用抑制普通小球藻生长及光合放氧,且产毒品系的抑制效应大于非产毒品系[1].因此推测这种差异可能是由于前者能够产生MC-LR及其他具有异味的化合物等次生代谢物导致的.而有效量子产率代表着藻类PSII的表观光化学效率(apparent photochemical efficiency),对环境胁迫非常敏感[38]; 此外,MC-LR在进入叶绿体后,会与PSII中的结构蛋白反应 [29, 进而引发抑制作用.为了检验以上科学假设,本文研究了MC-LR与普通小球藻生长及有效量子产率之间的剂量—效应关系;并利用特定浓度的MC-LR、能够产生相同MC-LR浓度的产毒品系铜绿微囊藻细胞滤液和细胞粗提液分别感染普通小球藻,通过比较不同处理条件下其生长及有效量子产率的变化,考察分析MC-LR及其他次生代谢物的化感效应.
1 材料与方法 1.1 藻种及培养条件产毒品系铜绿微囊藻(M. aeruginosa FACHB-905)与绿藻普通小球藻(C. vulgaris FACHB-8)均购自中国科学院水生生物研究所淡水藻种库.二者均预先用BG-11培养基[39]在光照培养箱中进行扩大培养,培养温度为25℃; 光照强度为60 μmol·photons/(m2·s); 光暗比为12 h :12 h.培养期间每天人工摇匀3~4次,以确保其生长良好,同时每天用Z2TM全自动细胞分析计数仪(Beckman Coulter, Buckinghamshire, UK)测定其细胞浓度的变化,取处于对数生长期的细胞用于后续实验.
1.2 微囊藻毒素(MC-LR)与普通小球藻生长及有效量子产率的剂量—效应关系研究取处于对数生长期的小球藻培养液稀释至叶绿素a(Chl.a)浓度为1500 μg/L并置于100 ml锥形瓶中, 而后分别加入纯MC-LR (Sigma, USA),使其初始浓度分别为50、100、200、400、800、1600 μg/L.以未添加MC-LR的培养组为对照组,每组设置3个重复,每个培养瓶中含小球藻培养液50 ml,置于光照培养箱中培养,温度为25℃, 光照强度依旧为60 μmol·photons/(m2·s).持续光照下培养24 h后取样,用浮游植物叶绿素荧光仪Phyto-PAM (Heinz Walz GmbH, Effeltrich, Germany)测定小球藻的叶绿素a浓度及有效量子产率.根据二者在24 h时的变化确定能够对小球藻生长和有效量子产率产生显著(P < 0.05)抑制作用的MC-LR浓度,在此基础上进行下一步实验的研究.
1.3 不同次生代谢产物对小球藻影响的处理方法根据2.2节的结果,当MC-LR浓度为200 μg/L时,对小球藻的生长及有效量子产率表现出显著的抑制效应,因此在后续毒性效应研究中MC-LR均采用此浓度.为了区分MC-LR及其他次生代谢产物的作用,该研究共设置4个不同的处理:(1)小球藻的纯培养,即空白对照组(CV, Control);(2)小球藻与200 μg/L的MC-LR共培养(CV+MC-LR);(3)小球藻与细胞浓度为能产生约200 μg/L总MC-LR的产毒品系铜绿微囊藻FACHB-905细胞滤液(CV+MA filtrates);(4)小球藻与细胞浓度为能产生约200 μg/L MC-LR的产毒品系铜绿微囊藻FACHB-905细胞粗提液共培养(CV+ MA extracts).在处理(3)和(4)的配制过程中,滤液及粗提液分别与BG-11培养液按照1 :1配比,即各25 ml.而小球藻浓度的确定则是各取25 ml小球藻培养液(叶绿素a浓度约为3000 μg/L),经5000 g离心5 min后,去其上清液,重新悬浮至各处理液中.微囊藻细胞粗提液的制备方法为通过超声波细胞破碎仪在冰浴条件下破碎微囊藻细胞,而后在5000 g下离心10 min,上清液即为微囊藻细胞粗提液.能够产生200 μg/L MC-LR的铜绿微囊藻FACHB-905的细胞浓度则根据文献报道中该品系对数生长期细胞中MC-LR含量[40]确定.具体原理及过程如下:处于对数生长期的产毒品系铜绿微囊藻FACHB-905胞外MC-LR浓度与细胞浓度关系的回归方程为y=0.08x+0.85;而胞内MC-LR浓度与细胞浓度关系的回归方程为y=0.58x-25.54, 其中y为藻毒素质量浓度(μg/L), x为细胞浓度(106 cells/ml)[40].因此能够产生200 μg/L MC-LR浓度的铜绿微囊藻细胞滤液或粗提液所对应的铜绿微囊藻FACHB-905的细胞浓度为340×106 cells/ml.本研究则是根据室内培养的铜绿微囊藻FACHB-905培养液的细胞浓度,取相应的培养液体积,通过离心收集细胞,重新悬浮后在一定体积的BG-11培养基中获得实验设定浓度的微囊藻培养液.每组设置3个平行样品,每瓶中的小球藻培养液终体积为50 ml,叶绿素a初始浓度为1500 μg/L.分别在第1、2、4、8、12、24 h取样,并测定小球藻培养液的叶绿素a浓度及有效光合量子产率.
1.4 小球藻比生长速率的测定用浮游植物叶绿素荧光仪Phyto-PAM (Heinz Walz GmbH, Effeltrich, Germany)测定不同浓度MC-LR处理组中普通小球藻的叶绿素a浓度,并根据如下公式计算培养期间小球藻的比生长速率(μ, d-1): μ=(ln x2-ln x1)/(t2-t1), 其中x1和x2分别表示在t1和t2时刻小球藻培养液的叶绿素a浓度.
1.5 有效光合量子产率的测定有效量子产率(Effective quantum yield, ΔF/Fm′)代表浮游藻类PSII的光化学反应效率, 即光合活性[41-42].为了考察感染过程中小球藻光合活性的变化,在特定的时间间隔每个样品各取3 ml培养液用Phyto-PAM (Heinz Walz GmbH, Effeltrich, Germany)测定ΔF/Fm′. ΔF为光适应条件下的可变荧光,其为光适应状态下最大荧光(Fm′)和稳态荧光的(Ft′)的差值.
1.6 比生长速率及光化学效率抑制率的计算根据公式Ih=(PT-PA)/PT×100 %计算MC-LR对小球藻比生长速率及有效量子产率的抑制率(%),其中,对比生长速率而言,PT和PA分别代表对照组和不同浓度MC-LR处理组小球藻在24 h内的比生长速率;对有效量子产率而言,PT和PA分别代表对照组和不同浓度MC-LR处理组小球藻在24 h时的有效光合量子产率[1].
1.7 统计分析利用均值±标准差(mean ± SD)描述实验数据的数字特征,并采用单因素方差分析(One-way ANOVA)和LSD检验进行差异性分析,显著水平设定为P=0.05.数据处理及分析采用的软件为SPSS 19.0和Excel 2010,作图软件为Origin7.0.
2 结果 2.1 MC-LR与小球藻生长和有效量子产率的剂量—效应关系在MC-LR感染24 h后,与对照组(MC-LR浓度为0 μg/L)相比,不同浓度的MC-LR处理均不同程度地降低了小球藻培养液的叶绿素a浓度,并且MC-LR浓度越高,小球藻培养液的叶绿素a浓度越低.在MC-LR浓度分别为0、50、100、200、400、800和1600 μg/L时,培养24 h后小球藻培养液的叶绿素a浓度分别为1812.32±29.52、1773.26±27.03、1754.98±34.73、1697.67±53.04、1647.10±36.98、1527.34±37.01和1497.12±34.58 μg/L.当MC-LR浓度≥200 μg/L时,与对照组相比,处理组的小球藻培养液叶绿素a浓度开始出现显著差异(P < 0.05) (图 1a).

|
图 1 不同浓度MC-LR处理下培养24 h后普通小球藻培养液的叶绿素a浓度(a)、比生长速率(b)和有效量子产率(c)的变化(n=3)(列上方标注不同字母表示不同处理间在P=0.05水平上有显著差异) Fig.1 Effects of MC-LR concentrations on chlorophyll-a concentration (a), specific growth rate (b) and effective quantum yield (c) of Chlorella vulgaris in 24 h (n=3) (The different letters above the columns indicate significant differences between treatments at P=0.05 level) |
通过由初始及24 h培养结束时小球藻培养液叶绿素a浓度的变化求得其比生长速率,其在0、50、100、200、400、800和1600 μg/L MC-LR处理下的比生长速率分别为0.19±0.02、0.17±0.02、0.16±0.01、0.11±0.02、0.09±0.02、0.02±0.01和0.00±0.00 d-1.可见随着MC-LR浓度的增大,小球藻比生长速率不断下降; 当微囊藻毒素浓度为1600 μg/L时,小球藻的生长完全被抑制(图 1b).
与比生长速率相对应,经过24 h的培养,不同浓度MC-LR处理下小球藻的有效量子产率也受到了抑制, 且MC-LR浓度越高,有效量子产率越低.在0、50、100、200、400、800和1600 μg/L MC-LR处理下小球藻的有效量子产率分别为0.66±0.01、0.66±0.01、0.65±0.01、0.64±0.01、0.64±0.01、0.63±0.01和0.61±0.02.也是在MC-LR≥200 μg/L时,处理组的小球藻有效量子产率开始与对照组出现显著差异(P < 0.05) (图 1c).
2.2 MC-LR对小球藻生长及有效量子产率的抑制率为了更加直观地显示MC-LR与小球藻生长及有效量子产率的剂量—效应关系,把不同MC-LR浓度处理下小球藻的比生长速率及有效量子产率的变化转化为对二者抑制率的变化.结果显示MC-LR对小球藻比生长速率及有效量子产率的抑制率均随其浓度的增加而增加(图 2).浓度为50、100、200、400、800和1600 μg/L的MC-LR在24 h内对普通小球藻比生长速率的抑制率分别为11.59 % ±3.38 %、17.11 % ±5.56 %、41.57 % ±6.77 %、50.31 % ±8.20 %、90.53 % ±14.75 %和101.65 % ±16.57 % (图 2a).
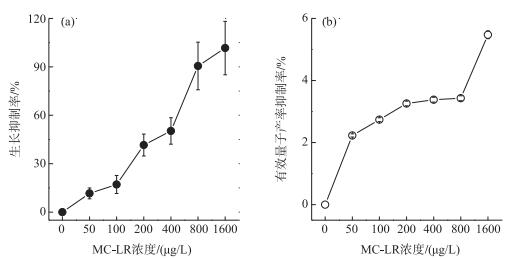
|
图 2 MC-LR处理24 h对小球藻比生长速率(a)和有效量子产率(b)的抑制率随MC-LR浓度的变化(n=3) Fig.2 Changes of inhibition on the specific growth rate(a) and effective quantum yield (b) of Chlorella vulgaris treated with different concentrations of MC-LR for 24 h (n=3) |
MC-LR对小球藻有效量子产率的抑制率随处理浓度的变化趋势与对生长的抑制类似,但是其程度却小得多(图 2b).浓度为50、100、200、400、800和1600 μg/L的MC-LR处理24 h对小球藻有效量子产率的抑制率分别为2.23 % ±0.05 %、2.74 % ±0.06 %、3.26 % ±0.08 %、3.38 % ±0.08 %、3.43 % ±0.08 %和5.47 % ±0.12 % (图 2b).
2.3 不同处理对普通小球藻生长的影响不同次生代谢产物处理条件下小球藻培养液的叶绿素a浓度均随培养时间的延长而增加(图 3a).与对照组(CV, Control)相比,添加MC-LR (CV+MC-LR)、产生相等MC-LR浓度的铜绿微囊藻细胞滤液(CV+MA filtrate)及细胞粗提液(CV+MA extract)的处理组中小球藻培养液的叶绿素a浓度在各时间点均有所降低.培养24 h后,对照组小球藻叶绿素a浓度为2230.08±57.70 μg/L;MC-LR处理组为2044.45±52.12 μg/L;铜绿微囊藻细胞滤液处理组与细胞粗提液处理组的小球藻叶绿素a浓度分别为2183.37±72.83和1758.24±121.86 μg/L(图 3a).铜绿微囊藻细胞滤液处理组和对照组之间没有显著差异(P>0.05); MC-LR及微囊藻细胞粗提液处理组与对照组之间均存在显著差异(P < 0.05).而与MC-LR处理组相比,含有等量MC-LR的微囊藻细胞粗提液处理组中小球藻培养液的叶绿素a浓度降低了14 %,且二者存在显著差异(P < 0.05), 说明除了MC-LR,细胞粗提液中所含有的其他次生代谢物对小球藻的生长也具有抑制作用.
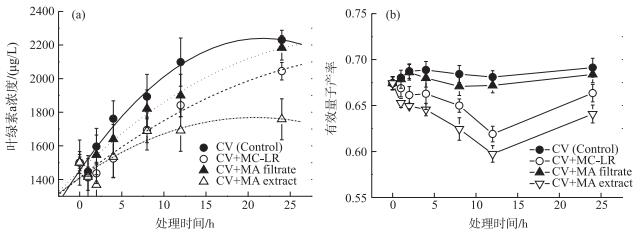
|
图 3 不同处理下小球藻培养液叶绿素a浓度(a)和有效量子产率(b)的变化(n=3) Fig.3 Changes in chlorophyll-a concentration (a) and effective quantum yield (b) of Chlorella vulgaris under different treatments (n=3) |
在培养过程中,对照组与3个处理组中小球藻的有效量子产率均呈先降低再升高的变化趋势, 在第12 h时降至最低点.此时对照组、MC-LR处理组、细胞滤液处理组和细胞粗提液处理组中小球藻的有效量子产率分别为0.68±0.01、0.62±0.01、0.67±0.01和0.60±0.01.而当培养时间延长至24 h时,对照组、MC-LR处理组、细胞滤液处理组和细胞粗提液处理组中小球藻的有效量子产率分别为0.69±0.01、0.66±0.01、0.68±0.01和0.64±0.01(图 3b).细胞滤液处理组与对照组的小球藻有效量子产率差异不显著(P>0.05);而MC-LR处理组和细胞粗提液处理组中的小球藻有效量子产率均显著(P < 0.05)低于对照组.表明微囊藻细胞滤液对小球藻光合活性没有显著的抑制作用,而MC-LR以及其他次生代谢产物却对其有显著的抑制作用.此外,含有等量MC-LR的细胞粗提液处理组的小球藻有效量子产率比纯MC-LR处理组降低了3 %,且二者之间存在显著差异(P < 0.05).这表明除了MC-LR外,铜绿微囊藻细胞中含有的其他次生代谢产物也会对小球藻的光合活性产生抑制作用.
3 讨论目前人们对微囊藻毒素的生物学功能及临界作用浓度尚无定论,如Zak等[6]认为自然水体中所能达到的MC-LR浓度水平并不会对浮游植物的生长产生负面影响;甚至有研究认为微囊藻毒素可能对某些浮游植物的生长具有促进作用[33].但是大多数研究则认为MC-LR应该是微囊藻水华释放的主要化感物质,能够对多种浮游藻类的生长产生负面影响[1, 29, 32, 43-48].根据本研究结果,以往研究得出上述差异甚至相反结论的主要原因可能是忽略了MC-LR浓度与浮游植物生物量之间的映射关系:当MC-LR浓度较高或者受感染浮游藻类细胞浓度较低时,其单个细胞接触MC-LR量就较多,从而引起抑制效应(图 1和图 2); 而当MC-LR浓度很低时,因为MC-LR本身在水体的稳定就较差[18, 33, 35]以及浮游植物的吸收与转化,使其不足以引起显著的抑制效应甚至会出现“没有影响或者貌似刺激生长”的表象.以往的一些研究发现低于50 μg/L的MC-LR即可抑制多种浮游植物的生长及光合活性[6, 32, 43, 49].而在本研究中,只有当MC-LR接近200 μg/L时,才会对普通小球藻的生长及有效量子产率产生显著的抑制作用(图 1和图 2).这既有可能是因为不同种类浮游植物对微囊藻次生代谢产物的耐受性存在差异,更可能是因为本研究中所用小球藻细胞浓度(1500 μg/L Chl.a)远大于上述研究(≤ 300 μg/L Chl.a).
在本研究中,铜绿微囊藻细胞滤液对普通小球藻生长及有效量子产率的影响不显著,因此可以认为“没有影响” (图 3).也有研究发现含有微囊藻的培养液对共存微藻的抑制效应大于无细胞滤液[5-6],这可能是由于滤液中的MC-LR等化感物质的浓度本来就较低,在经过细胞吸收转化后已降低至不足以引起显著抑制效应的浓度水平,而培养液中含有代谢旺盛的微囊藻细胞,能够向培养液持续分泌MC-LR等次生代谢产物[13],因而能够产生比无细胞滤液更强的抑制作用.现有研究表明蓝藻毒素主要积累在活细胞中[29, 48],只有在遭遇严酷的胁迫条件而细胞衰老或破裂时才被大量释放至水体中[29, 46, 48, 50].因此相对细胞滤液的“没有影响”,细胞粗提液对普通小球藻生长及有效量子产率均具有显著的(P < 0.05)抑制作用,甚至大于单纯的MC-LR处理(图 3).这既说明了粗提液中含有大量的次生代谢产物,也说明除MC-LR外,铜绿微囊藻产生的其他次生代谢产物同样对小球藻的生长及光合活性具有抑制效应.例如杨佳等[47]在研究铜绿微囊藻对惠氏微囊藻的化感效应时也发现不含MC-LR的铜绿微囊藻提取物仍具有显著的化感活性.
部分MC-LR在进入细胞后会非酶性地与谷胱甘肽(GSH)结合; 或通过谷胱甘肽转移酶系统的酶促作用与GSH缀合[51-52]; 余下的MC-LR则会与蛋白磷酸酶结合[24].最终,任何剩余的MC-LR都将被叶绿体吸收.在叶绿体中,MC-LR又有3种去向:与GSH非酶结合; 通过GST系统与GSH的酶偶联; 与叶绿体内PSII的结构蛋白反应进而引起抑制作用[29, 48].产毒品系铜绿微囊藻次生代谢物对普通小球藻有效光合量子产率的抑制强度在前12 h内随感染时间的延长而增加,而后则开始减弱,即其光合活性开始部分恢复,至24 h时已恢复至第6 h时的水平(图 3b).其一可能是因为小球藻细胞通过在细胞质和叶绿体中进行的GST途径解毒过程,结束了GSH、谷氨酰半胱氨酸和半胱氨酸上的MC-LR等缀合物, 降低了植物细胞中的MC-LR浓度; 其二则可能是因为与PSII的结构蛋白——D1蛋白结合的MC-LR因为该蛋白的快速合成更新而失去抑制作用,从而使光合活性在MC-LR浓度降低后快速恢复[29].
有研究发现MC-LR暴露会显著降低大型水生植物水蕴(Elodea canadensis)及金鱼藻(Ceratophyllum demersum)的光合放氧速率,并且认为这是蓝藻水华多发水体中大型水生植物由优势地位逐渐转变为从属地位的主要原因[29].同时化感作用也被认为是蓝藻克“敌”制胜进而在生态系统中占据主导地位并能形成水华的主要因素之一[1, 9-11].我们在前期的研究中还发现铜绿微囊藻对普通小球藻的化感效应具有温度依赖性,并且产毒品系铜绿微囊藻对小球藻生长及光合放氧的抑制作用均大于非产品系,因而与非产毒品系相比,产毒品系铜绿微囊藻在自然水体中更具有竞争优势[1]. MC-LR作为产毒微囊藻的主要次生代谢产物[24-25],其产生的化感效应有助于自身优势地位的确立[1, 32],在影响水体中浮游植物群落演替的同时也会改变浮游动物等食物链下游生物的饵料供应状况.这种生态系统内物质循环和能量流动途径的改变,可能会进一步降低水生生态系统中的生物多样性并使其进一步恶化.
4 结论MC-LR对普通小球藻的生长及光合活性的影响由小球藻细胞浓度和MC-LR浓度共同决定:较高的小球藻细胞浓度(1500 μg/L Chl.a)下,需要较高的MC-LR浓度(≥200 μg/L)才能产生抑制作用;小球藻比生长速率随着MC-LR浓度的增加而快速下降直至完全被抑制.虽然小球藻有效量子产率的变化趋势与比生长速率类似,但是其受到的抑制程度却小得多.产毒品系铜绿微囊藻FACHB-905培养液滤液对小球藻的抑制作用不明显,但是含有相同总MC-LR浓度的FACHB-905细胞粗提液对小球藻生长及有效量子产率的抑制作用大于纯MC-LR处理,说明除MC-LR外,产毒品系铜绿微囊藻的其他次生代谢产物也能够产生化感效应.
| [1] |
Ma Z, Fang T, Thring RW et al. Toxic and non-toxic strains of Microcystis aeruginosa induce temperature dependent allelopathy toward growth and photosynthesis of Chlorella vulgaris. Harmful Algae, 2015, 48: 21-29. DOI:10.1016/j.hal.2015.07.002 |
| [2] |
Visser PM, Verspagen JMH, Sandrini G et al. How rising CO2 and global warming may stimulate harmful cyanobacterial blooms. Harmful Algae, 2016, 54: 145-159. DOI:10.1016/j.hal.2015.12.006 |
| [3] |
Keating KI. Blue-green algal inhibition of diatom growth:transition from mesotrophic to eutrophic community structure. Science, 1978, 199: 971-973. DOI:10.1126/science.199.4332.971 |
| [4] |
Suikkanen S, Fistarol GO, Graneli E et al. Allelopathic effects of the Baltic cyanobacteria Nodularia spumdigena, Aphanizomenon flos-aquae and Anabaena lemmermannii on algal monocultures. Journal of Experimental Marine Biology and Ecology, 2004, 308: 85-101. DOI:10.1016/j.jembe.2004.02.012 |
| [5] |
Żak A, Musiewicz K, Kosakowska A. Allelopathic activity of the Baltic cyanobacteria against microalgae. Estuarine, Coastal and Shelf Science, 2012, 112: 4-10. DOI:10.1016/j.ecss.2011.10.007 |
| [6] |
Żak A, Kosakowska A eds. Allelopathic influence of cyanobacteria Microcystis aeruginosa, on green algae Chlorella vulgaris, insights on environmental changes. Springer International Publishing, 2014: 141-150.
|
| [7] |
Graneli E, Weberg M, Salomon PS. Harmful algal blooms of allelopathic microalgal species:the role of eutrophication. Harmful Algae, 2008, 8: 94-102. DOI:10.1016/j.hal.2008.08.011 |
| [8] |
Fergola P, Cerasuolo M, Pollio A et al. Allelopathy and competition between Chlorella vulgaris and Pseudokirchneriella subcapitata:Experiments and mathematical model. Ecological Modelling, 2007, 208: 205-214. DOI:10.1016/j.ecolmodel.2007.05.024 |
| [9] |
Mulderij G, Mooij WM, Smolders AJP et al. Allelopathic inhibition of phytoplankton by exudates from Stratiotes aloides. Aquatic Botany, 2005, 82: 284-296. DOI:10.1016/j.aquabot.2005.04.001 |
| [10] |
Tillmann U, Alpermann T, John U et al. Allelochemical interactions and short-term effects of the dinoflagellate Alexandrium on selected photoautotrophic and heterotrophic protists. Harmful Algae, 2008, 7: 52-64. DOI:10.1016/j.hal.2007.05.009 |
| [11] |
Legrand C, Reigefors K, Fistarol GO et al. Allelopathy in phytoplankton-biochemical, ecological and evolutionary aspects. Phycologia, 2003, 42: 406-419. DOI:10.2216/i0031-8884-42-4-406.1 |
| [12] |
Fistarol GO, Legrand C, Selander E et al. Allelopathy in Alexandrium spp.:effect on a natural plankton community and algal monocultures. Aquatic Microbial Ecology, 2004, 35: 45-56. DOI:10.3354/ame035045 |
| [13] |
Zheng G, Xu R, Chang X et al. Cyanobacteria can allelopathically inhibit submerged macrophytes effects of Microcystis aeruginosa extracts and exudates on Potamogeton malaianus. Aquatic Botany, 2013, 109: 1-7. DOI:10.1016/j.aquabot.2013.02.004 |
| [14] |
Sivonen K, Jones G. Cyanobacterial toxins. In: Chorus I, Bartram J ed. Toxic cyanobacteria in water: a guide to their public health consequences, monitoring and management. London: Spon Press, 1999: 41-111.
|
| [15] |
Song L, Chen W, Peng L et al. Distribution and bioaccumulation of microcystins in water columns:A systematic investigation into the environmental fate and the risks associated with microcystins in Meiliang Bay, Lake Taihu. Water Research, 2007, 41: 2853-2864. DOI:10.1016/j.watres.2007.02.013 |
| [16] |
Mitrovic SM, Pflugmacher S, James KJ et al. Anatoxin-a elicits an increase in peroxidase and glutathione S-transferase activity in aquatic plants. Aquatic Toxicology, 2004, 68: 185-192. DOI:10.1016/j.aquatox.2004.03.017 |
| [17] |
Ha MH, Pflugmacher S. Phytotoxic effects of the cyanobacterial neurotoxin anatoxin-a:morphological, physiological and biochemical responses in aquatic macrophyte, Ceratophyllum demersum. Toxicon, 2013, 70: 1-8. DOI:10.1016/j.toxicon.2013.03.021 |
| [18] |
Rojo C, Segura M, Cortés F et al. Allelopathic effects of microcystin-LR on the germination, growth and metabolism of five charophyte species and a submerged angiosperm. Aquatic Toxicology, 2013, 144: 1-10. |
| [19] |
Xu R, Hilt S, Pei Y et al. Growth phase-dependent allelopathic effects of cyanobacterial exudates on Potamogeton crispus L. seedlings. Hydrobiologia, 2016, 767: 137-149. DOI:10.1007/s10750-015-2489-5 |
| [20] |
Codd GA, Morrison LF, Metcalf JS. Cyanobacterial toxins:risk management for health protection. Toxicology and Applied Pharmacology, 2005, 203: 264-272. DOI:10.1016/j.taap.2004.02.016 |
| [21] |
Zurawell RW, Chen HR, Burke JM et al. Hepatotoxic cyanobacteria:a review of the biological importance of microcystins in freshwater environments. Journal of Toxicology and Environmental Health-Part B-Critical Reviews, 2005, 8: 1-37. DOI:10.1080/10937400590889412 |
| [23] |
Prasanna R, Sood A, Jaiswal P et al. Rediscovering cyanobacteria as valuable sources of bioactive compounds (review). Applied Biochemistry and Microbiology, 2010, 46: 119-134. DOI:10.1134/S0003683810020018 |
| [24] |
Mackintosh C, Beattie KA, Klumpp S et al. Cyanobacterial microcystin-LR is a potent and specific inhibitor of protein phosphatase-1 and phosphatase-2A from both mammals and higher plants. FEBS Letters, 1990, 264: 187-192. DOI:10.1016/0014-5793(90)80245-E |
| [25] |
Gulledge BM, Aggen JB, Huang HB et al. The microcystins and nodularins:cyclic polypeptide inhibitors of PP1 and PP2A. Current Medicinal Chemistry, 2002, 9: 1991-2003. DOI:10.2174/0929867023368845 |
| [26] |
Rapala J, Sivonen K, Lyra C et al. Variation of microcystins, cyanobacterial hepatotoxins, in Anabaena spp. as a function of growth stimuli. Applied and Environmental Microbiology, 1997, 63: 2206-2212. |
| [27] |
Park HD, Iwami C, Watanabe MF et al. Temporal variabilities of the concentrations of intra and extracellular microcystin and toxic Microcystis species in hypertrophic lake, Lake Suwa, Japan (1991-1994). Environmental Toxicology and Water Quality, 1998, 13: 61-72. DOI:10.1002/(ISSN)1098-2256 |
| [28] |
Böttcher G, Chorus I, Ewald S et al. Lightlimited growth and microcystin content of Microcystis aeruginosa and Planktothrix agardhii in turbidostats. In: Chorus I ed. Cyanotoxins-occurrence, causes, consequences. New York: Springer-Verlag, 2001: 115-133.
|
| [29] |
Pflugmacher S. Possible allelopathic effects of cyanotoxins, with reference to microcystin-LR, in aquatic ecosystems. Environmental Toxicology, 2002, 17: 407-413. DOI:10.1002/(ISSN)1522-7278 |
| [30] |
Yang J, Deng X, Xian Q et al. Allelopathic effect of Microcystis aeruginosa on Microcystis wesenbergii:Microcystin-LR as a potential allelochemical. Hydrobiologia, 2014, 727: 65-73. DOI:10.1007/s10750-013-1787-z |
| [31] |
Bittencourt-Oliveira MC, Chia MA, Oliveira HSB et al. Allelopathic interactions between microcystin-producing and non-microcystin-producing cyanobacteria and green microalgae:Implications for microcystins production. Journal of Applied Phycology, 2015, 27: 275-284. DOI:10.1007/s10811-014-0326-2 |
| [32] |
Wang L, Zia J, Xua R et al. Allelopathic effects of Microcystis aeruginosa on green algae and a diatom:Evidence from exudates addition and co-culturing. Harmful Algae, 2017, 61: 56-62. DOI:10.1016/j.hal.2016.11.010 |
| [33] |
García-Espín L, Cantoral EA, Asencio AD et al. Microcystins and cyanophyte extracts inhibit or promote the photosynthesis of fluvial algae. Ecological and management implications. Ecotoxicology, 2017, 26: 658-666. |
| [34] |
Sukenik A, Eskhol R, Livne A et al. Inhibition of growth and photosynthesis of the dinoflagellate Peridinium gatunense by Microcystis sp. (cyanobacteria):a novel allelopathic mechanism. Limnology and Oceanography, 2002, 47: 1656-1663. DOI:10.4319/lo.2002.47.6.1656 |
| [35] |
Casanova MT, Burch MD, Brock MA et al. Does toxic Microcystis aeruginosa affect aquatic plant establishment?. Environmental Toxicology, 1999, 14: 97-109. DOI:10.1002/(ISSN)1522-7278 |
| [36] |
Elliott JA. The seasonal sensitivity of cyanobacteria and other phytoplankton to changes in flushing rate and water temperature. Global Change Biology, 2010, 16: 864-876. DOI:10.1111/gcb.2010.16.issue-2 |
| [37] |
Salmaso N, Buzzi F, Garibaldi L et al. Effects of nutrient availability and temperature on phytoplankton development:a case study from large lakes south of the Alps. Aquatic Sciences, 2012, 74: 555-570. DOI:10.1007/s00027-012-0248-5 |
| [38] |
Schreiber U, Endo T, Mi H et al. Quenching analysis of chlorophyll fluorescence by the saturation pulse method:particular aspects relating to the study of eukaryotic algae and cyanobacteria. Plant and Cell Physiology, 1995, 36: 873-882. DOI:10.1093/oxfordjournals.pcp.a078833 |
| [39] |
Allen MM, Stanier RY. Selective isolation of blue-green algae from water and soil. Journal of General and Applied Microbiology, 1968, 51: 203-209. DOI:10.1099/00221287-51-2-203 |
| [40] |
Fang L, Liu WQ, Zhao NJ et al. Study on the accumulation effects of heavy metal nickel in the growth of alfalfa and the soil. Journal of Safety and Environment, 2013, 13(5): 1-6. [方丽, 刘文清, 赵南京等. 铜绿微囊藻生长过程中毒素的产生与释放特性. 安全与环境学报, 2013, 13(5): 1-6.] |
| [41] |
Kolber Z, Falkowski PG. Use of fluorescence to estimate phytoplankton photosynthesis in situ. Limnology and Oceanography, 1993, 38: 1646-1665. DOI:10.4319/lo.1993.38.8.1646 |
| [42] |
Ma Z, Gao K. Photosynthetically active and UV radiation act in an antagonistic way in regulating buoyancy of Arthrospira (Spirulina) platensis (cyanobacterium). Environmental and Experimental Botany, 2009, 66: 265-269. DOI:10.1016/j.envexpbot.2009.02.006 |
| [43] |
Singh DP, Tyagi MB, Kumar A et al. Antialgal activity of a hepatotoxin-producing cyanobacterium, Microcystis aeruginosa. World Journal of Microbiology and Biotechnology, 2001, 17: 15-22. DOI:10.1023/A:1016622414140 |
| [44] |
Hu Z, Liu Y, Li D. Physiological and biochemical analyses of microcystin-RR toxicity to the cyanobacterium Synechococcus elongatus. Environmental Toxicology, 2004, 19: 571-577. DOI:10.1002/(ISSN)1522-7278 |
| [45] |
Hu Z, Liu Y, Li D et al. Growth and antioxidant system of the cyanobacterium Synechococcus elongatus in response tomicrocystin-RR. Hydrobiologia, 2005, 534: 23-29. DOI:10.1007/s10750-004-1319-y |
| [46] |
Babica P, Hilscherová K, Bártová K et al. Effects of dissolved microcystins on growth of planktonic photoautotrophs. Phycologia, 2007, 46: 137-142. DOI:10.2216/06-24.1 |
| [47] |
Yang J, Wang JJ, Xian QM et al. Allelopathic effect of Microcystis aeruginosa on Microcystis wesenbergii. Chinese Journal of Ecology, 2012, 31(1): 131-137. [杨佳, 王经洁, 鲜啟鸣等. 铜绿微囊藻(Microcystis aeruginosa)对惠氏微囊藻(Microcystis wesenbergii)的化感作用. 生态学杂志, 2012, 31(1): 131-137.] |
| [48] |
Wiegand C, Pflugmacher S. Ecotoxicological effects of selected cyanobacterial secondary metabolites a short review. Toxicology and Applied Pharmacology, 2005, 203: 201-218. DOI:10.1016/j.taap.2004.11.002 |
| [49] |
Pietsch C, Wiegand C, Ame MV et al. The effects of a cyanobacterial crude extract on different aquatic organisms:evidence for cyanobacterial toxin modulating factors. Environmental Toxicology, 2001, 16: 535-542. DOI:10.1002/tox.v16:6 |
| [50] |
Jones GJ, Orr PT. Release and degradation of microcystin following algicide treatment of a Microcystis aeruginosa bloom in a recreational lake, as determined by HPLC and protein phosphatase inhibition assay. Water Research, 1994, 28: 871-876. DOI:10.1016/0043-1354(94)90093-0 |
| [51] |
Pflugmacher S, Wiegand C, Beattie KA et al. Uptake of the cyanobacterial hepatotoxin microcystin-LR by aquatic macrophytes. Journal of Applied Botany, 1998, 72: 228-232. |
| [52] |
Pflugmacher S, Wiegand C, Beattie KA et al. Uptake, effects and metabolism of cyanobacterial toxins in the emergent reed plant Phragmites australis (Cav.) Trin. ex Streud. Environmental Toxicology and Chemistry, 2001, 20: 846-852. DOI:10.1002/etc.v20:4 |
 2018, Vol. 30
2018, Vol. 30 

