河流作为一个由干流和各级支流共同组成的复杂网络结构[1-2],其内部发生的输运过程在河流流域水文、生物和生态过程的相互作用中扮演了重要的角色[3].在此过程中,等级化以及分支化的河流网络与动态的流域扰动相作用,导致河流生境在时空上的不均匀分布,并最终决定了不同区域的生物多样性和生产力[2, 4].而鱼类作为河流生物及其生产力的重要组成部分,往往具有在不同栖息生境之间进行主动迁徙或移动的能力[5-6].特别地,对许多河流而言,其干支流之间鱼类的迁徙或移动不仅是常见的,而且通常与鱼类的繁殖活动相联系[7-9].在此情况下,支流鱼类的群聚结构很可能会随着鱼类在干支流的迁徙或移动而显著变动[9-10].研究鱼类产卵迁徙对某一支流鱼类群聚结构变动的影响,不仅有助于加深对这条支流群聚结构变动模式的理解[11-12],而且能够明确保持这一支流与干流联通性对区域鱼类种群维持的重要性,有利于优先保护支流的选择[13-14].而且,在辨识鱼类产卵迁徙对支流鱼类群聚结构影响的同时,通过对产卵鱼类种类和数量的分析,也可以确定支流保护对区域鱼类资源维持的意义,并能够为有针对性地提出保护措施(例如河流连通性恢复、设立保护区等)保护某些重要鱼类提供基础数据支撑[15-16].
金沙江下游作为长江上游的重要组成部分,具有众多的支流、较为丰富的集合生境以及较高的鱼类物种多样性[13].其中较大的一级支流有15条,共分布有长江上游特有鱼类23种,占金沙江下游特有鱼类总种数的39.66 %,为长江上游特有鱼类重要的分布区域[13].这些支流作为金沙江下游河流网络的重要组成部分,其自然生境的维持,特别是产卵场的维持对金沙江下游干流部分鱼类种群的维系也许具有重要的意义.关于这方面的研究,迄今为止,还未有报道加以证实.而且,金沙江下游支流的鱼类群聚结构变动是否受鱼类干支流产卵迁徙的影响也需要进行深入研究.
黑水河位于金沙江左岸,全长173.3 km,流域面积3653 km2,是金沙江下游15条主要支流中的一条,为白鹤滩库区干流鱼类的重要替代生境和优先保护支流[13].白鹤滩蓄水前,黑水河下游老木河电站坝址至河口江段保持自然流水生境,分布着众多的鱼类种类,为上述科学问题的探索提供了良好的研究场所[13, 17].本研究拟通过在2014年对黑水河下游的逐月渔获物进行调查,首先获得黑水河下游鱼类种类组成和丰度以及性成熟个体丰度的逐月数据,然后采用聚类分析以及相似性检验(analysis of similarity test,ANOSIM)确定鱼类群聚结构在不同月份上的聚类情况,并在此聚类结果上获得不同聚类组的指示种组成,最后基于距离的线性模型方法(distance-based linear model, DistlLM)分析群聚结构的逐月变动与指示种性成熟个体丰度逐月变动之间的关系,并采用基于距离的冗余分析方法(distance-based redundancy analysis,dbRDA)对DistlLM结果进行可视化.本文旨在确定:1)黑水河下游群聚结构的逐月变动是否严重依赖于鱼类在干支流之间的产卵迁徙;2)黑水河下游自然生境的维持对区域鱼类种群的维系是否具有重要意义.
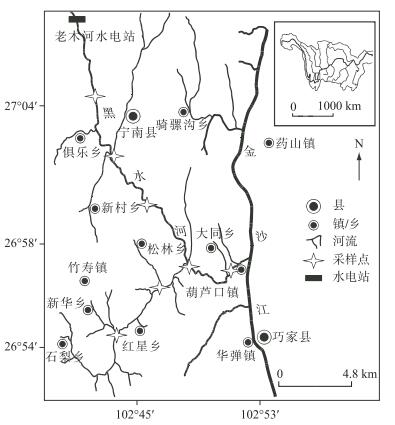
1 材料与方法 1.1 调查区域与调查方法调查区域包括黑水河下游老木河电站坝下约40 km的干支流河段(图 1).黑水河下游多年平均流量70.0 m3/s,其径流年内分布不均,其中汛期(6-10月)径流量占年径流量的73.2 %,而枯季(12月至翌年5月)仅占年径流量的19.7 % [17].调查区域主要为急流砾石生境[17],非汛期时其断面平均流速通常在1.1~2.0 m/s之间,断面平均水深通常在0.8~1.7 m之间.调查区域上游分布有4个梯级水电站,从上至下分别为苏家湾、公德房、松新和老木河水电站,其坝高分别为5.1、18.0、5.3和5.0 m[18].调查区域位于老木河水电站下游.调查时水温的分布范围为10.1~24.4℃,平均水温18.1℃.根据不同江段微生境的差异,2014年1—12月在调查区域设置采样点7个,并采用背负式电捕鱼器(电瓶:20 A,12 V;电鱼器:3000 W)进行逐月采样(图 1),每月中旬采集渔获物4~5 d,每天采集约6 h.每个采样点采集河段距离约2 km.对所有采集到的鱼类标本进行种类鉴定,并测量每尾个体的全长、体长(精确到1 mm)和体重(精确到0.1 g).样本采集后,随机抽样每种鱼类约50 % ~100 %个体进行解剖,观测鱼类的性腺发育期,并参照王剑伟[19]的标准,将Ⅳ期及其以上发育期个体认定为性成熟个体.性腺发育期的分类标准参考殷名称[11]所描述的方法.
|
图 1 黑水河下游调查采样点分布 Fig.1 Distribution of the sampling sites in the lower reaches of the Heishui River |
首先计算不同鱼类种类及其性成熟个体在各月的单位捕捞努力量的渔获量(catch per unit effort,CPUE),其计算公式为:CPUEis=Nis/Hi,其中,CPUEis为第i月每小时采集到第s种鱼类的尾数或性成熟个体尾数(尾/h);Nis为第i月采集到第s种鱼类的尾数或性成熟个体尾数;Hi为第i月的总采样时间(h),然后基于不同鱼类种类的CPUE,以Bray-Curtis相似性系数为基础构建不同月份之间的相似性矩阵,采用等级聚类分类方法(cluster analysis,CA)分析调查区域不同月份鱼类群聚结构的聚类情况[20].采用One-way ANOSIM方法检验各组之间群聚结构的差异是否显著[20].
1.2.2 指示种分析指示种是最能代表某一类群生境特征的种类,其已在群落生态学中得到广泛的应用[21].通过计算指示值(IndVal),各组指示种的组成得以明确.这里的各组为群聚结构分析的结果.指示值的计算公式为:IndValij=100Aij·Bij,其中,IndValij为物种i在组j中的指示值,Aij为物种i在组j中的平均数量占其在各个组平均数量之和的比例,当物种i仅在组j中发现时,Aij 值最大为1;Bij为物种i在组j中出现的月份数占组j总月份数的比例,当物种i在组j中的各月均出现时,Bij值最大为1[22-23].通过软件自动迭代,不同组之间的月份随机重分配过程被用来检验指示种的显著性.某一物种在某一组的指示值与其在其他组的指示值在统计学上显著差异时,该物种才能被认定为指示种[22-23].
1.2.3 群聚结构的逐月变动与指示种性成熟个体丰度逐月变动的关系基于各个月份指示种性成熟个体的丰度(CPUE)以及各个月份鱼类群聚结构的丰度(CPUE),采用DistlLM构建鱼类群聚结构的逐月变动与指示种性成熟个体丰度逐月变动的关系模型,其中指示种的性成熟个体丰度为自变量而鱼类群聚结构的丰度为因变量.采用逐步回归的方法选择模型参数,并使用Adjusted R2评判模型的优劣[24].进一步采用dbRDA分析对DistlLM结果进行可视化[24].
1.2.4 分析软件采用PRIMER 6软件(版本1.0.6)进行CA、One-way ANOSIM、DistlLM以及dbRDA分析,并使用CorelDRAW 12.0和R软件(版本R.i386 3.0.1)进行绘图.本文的显著性水平设置为P < 0.05.
2 结果 2.1 群聚结构2014年1-12月共统计渔获物71.99 kg,10531尾,鉴定出种类28种,隶属于3目8科23属(表 1). 28种鱼类中,采集尾数排在前3位的种类为短体副鳅、红尾副鳅和前鳍高原鳅,共采集到9293尾,占采样期间总采样尾数的88.24 %.渔获物中,除墨头鱼、中华倒刺鲃、齐口裂腹鱼、短须裂腹鱼、昆明裂腹鱼、鲇和瓦氏黄颡鱼外,其他22种鱼类的平均体重均小于50 g.采样期间,某一种类性成熟个体的平均体重均明显大于该物种所有个体的平均体重(表 1).
| 表 1 2014年黑水河下游鱼类种类组成及其基础生物学参数 Tab.1 Species composition and basic biological parameters of fishes collected from the lower reaches of Heishui River in 2014 |
聚类分析结果表明:在56.55 %的Bray-Curtis相似性水平上可将监测区域12个月的鱼类优势种群聚结构分为两组:组1包括1-6月和11-12月的群聚结构;组2包括7-10月的群聚结构(图 2). One-way ANOSIM检验显示组1和组2的群聚结构在统计学上差异显著(全局R=0.982,P=0.002,迭代次数495次时满足软件收敛要求).

|
图 2 2014年1-12月黑水河下游鱼类群聚结构的聚类分析 Fig.2 Cluster analysis of fish assemblage structures in the lower reaches of the Heishui River from January to December of 2014 |
共有8种鱼类可以作为黑水河下游2014年各聚类组的指示种(表 2),其中组1有指示种3种,分别为齐口裂腹鱼、短体副鳅和红尾副鳅,组2有指示种5种,分别为前鳍高原鳅、凹尾拟鲿、犁头鳅、短须裂腹鱼和大鳞副泥鳅.这些鱼类中,齐口裂腹鱼、短体副鳅、前鳍高原鳅和短须裂腹鱼均为长江上游特有鱼类.
| 表 2 各聚类组的指示种及其指示值和各指示种在不同聚类组中的丰度 Tab.2 Indicator species and their indicative values in two groups (grouped by cluster analysis) and the abundance of each indicator species in different groups |
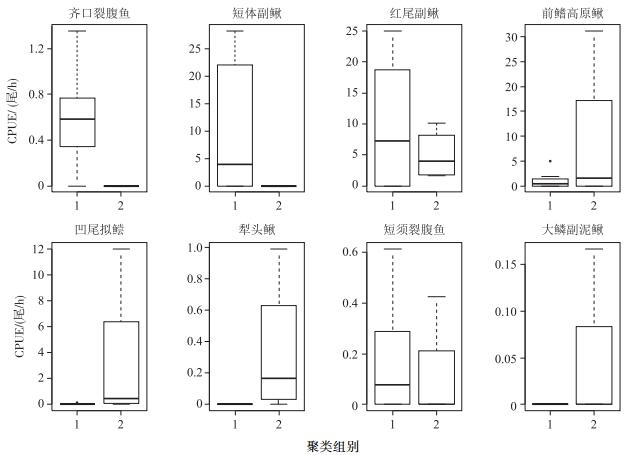
齐口裂腹鱼、短体副鳅、红尾副鳅和短须裂腹鱼4种指示种的性成熟个体的丰度分布范围(极差)和平均值在组1大于组2,其余4种鱼类(前鳍高原鳅、凹尾拟鲿、犁头鳅和大鳞副泥鳅)性成熟个体的分布范围(极差)和平均值均为组1小于组2(图 3).
|
图 3 8种指示种的性成熟个体在组1和组2中的丰度分布 Fig.3 Abundance distribution of sexually mature individuals for 8 indicator species in group 1 and group 2 |
DistlLM的分析结果由两部分组成:1)边际检验:显示单一预测变量与鱼类群聚结构变动的关系,其结果表明齐口裂腹鱼和犁头鳅性成熟个体丰度的逐月变动与鱼类群聚结构的逐月变动具有显著相关性(P < 0.05);2)序列检验:显示所有预测变量与鱼类群聚结构变动的关系,其结果表明齐口裂腹鱼、大鳞副泥鳅和犁头鳅的性成熟个体丰度的逐月变动与鱼类群聚结构的逐月变动具有显著相关性(P < 0.05)(表 3).尽管如此,预测模型的选择结果表明:除凹尾拟鲿以外,其他7种鱼类加入模型时的Adjusted R2最大,为0.772,显示这7种鱼类的性成熟个体丰度能够有效地预测黑水河下游鱼类群聚的丰度,黑水河下游鱼类群聚的丰度会随着这7种鱼类性成熟个体丰度的增加而增加.
| 表 3 基于DistlLM对群聚结构变动与指示种性成熟个体丰度变动的关系进行分析的结果 Tab.3 Results of relationships between monthly variations of abundance of sexual mature individuals for indicator species and monthly variations of fish assemblage structures by using DistlLM |
dbRDA分析结果如图 4所示.图中,月份点垂直投影到轴1或轴2上,投影点位置为各月鱼类群聚结构在轴1或轴2上的得分,图中圆圈为半径为1的圆,圆中直线(向量)长度代表某一预测变量与轴1和轴2的Spearman相关性.总之,图 4显示:1)轴1能够解释鱼类群聚结构逐月变动总变异的65.1 %,而轴2能够解释总变异的14.5 %,两轴共解释总变异的79.6 %;2)1-6月的鱼类群聚结构与轴1呈正相关,但7-12月的鱼类群聚结构与轴1呈负相关;3)1月和3-7月的鱼类群聚结构与轴2呈正相关,但2月和8-12月的鱼类群聚结构与轴2呈负相关;4)1-6月鱼类群聚结构的丰度主要受齐口裂腹鱼和短体副鳅性成熟个体丰度增加而短须裂腹鱼、大鳞副泥鳅、红尾副鳅、犁头鳅和前鳍高原鳅性成熟个体丰度减少的影响,而7-12月鱼类群聚结构的丰度主要受短须裂腹鱼、大鳞副泥鳅、红尾副鳅、犁头鳅和前鳍高原鳅性成熟个体丰度增加而齐口裂腹鱼和短体副鳅性成熟个体丰度减少的影响,即不同月份的鱼类丰度会随着7种鱼类产卵群体数量的变动而变动;5)组1除受短体副鳅性成熟个体丰度正向影响的同时,也受前鳍高原鳅和短须裂腹鱼性成熟个体丰度的负向影响,而组2的鱼类丰度受这3种鱼类性成熟个体丰度的影响与组1刚好相反.

|
图 4 基于距离的冗余分析方法解析黑水河下游鱼类群聚结构变动与指示种性成熟个体丰度变动关系的可视化结果 Fig.4 Visualizing results of the relationships between the monthly variations of fish assemblage structure in the lower reaches of the Heishui River and the monthly variations of abundance of sexual mature individuals of indicator species by using the distance-based redundancy analysis (dbRDA) |
研究表明,许多鱼类具有在产卵季节向干流或支流某些河段进行产卵迁徙的特征[8-10, 15].这种特征将导致某些河段鱼类的季节性变动,进而在很大程度上影响局域鱼类群落的结构和功能[10 15, 25].特别就较小支流而言,其鱼类群落结构的稳定以及季节性更替很可能严重依赖于干流鱼类向支流的产卵迁徙[26].在本研究中,伴随着鱼类群聚结构在雨季和旱季[17]的显著分离(图 2,组1和组2),8种指示种的性成熟个体丰度也在黑水河下游雨季和旱季间发生不同程度的变动(图 3). DistlLM结果进一步显示:7种指示种鱼类的性成熟个体丰度的变动能够解释鱼类群聚结构变动77.20 %的变异,其中齐口裂腹鱼、大鳞副泥鳅和犁头鳅性成熟个体丰度的变动是影响鱼类群聚结构变动的3个最显著的因素(表 3),表明黑水河下游鱼类,特别是齐口裂腹鱼、大鳞副泥鳅和犁头鳅的季节性产卵活动对该区域鱼类的群聚结构造成了明显的影响. dbRDA结果与DistlLM结果一致(图 4).
已有研究表明,大坝(即使坝高小于7.6 m的小型大坝)会对鱼类的群聚结构造成明显影响,不仅导致坝上区域鱼类的物种数、资源丰度和Shannon's指数显著低于坝下江段,而且会导致坝上江段的鱼类群聚向以适应静缓流生境为主的鱼类群聚变化[27-28],从而使得坝上区域的鱼类,特别是喜流水性的鱼类,难以或仅有少量个体补充到坝下江段.在本研究中,调查区域上游分布有多个首尾连接的梯级小水电(坝高在5.0~18.0 m之间)[17],且所有指示种均为适应流水生境的种类[29],因此在该区域的8种指示种个体(表 2)应该难以在调查区域上游的梯级水库群内形成大规模的种群,并有效地下行过坝达到本研究调查区域,因此这8种鱼类指示种在调查区域的种群应该主要为黑水河下游(老木河水电站以下)和金沙江下游干流江段的种群.各个指示种在不同聚类组之间均显现明显丰度差异的特征(表 2),表明任一指示种在某一聚类组中的平均丰度均会显著高于其在另一聚类组中的平均丰度.显然,这些鱼类在某一聚类组中丰度的明显增加(表 2),表明许多个体在该聚类组对应的月份从金沙江干流迁徙到黑水河下游调查区域.同时,结合性成熟个体丰度在不同聚类组的变动(图 3)可知:除短须裂腹鱼外,齐口裂腹鱼、短体副鳅、红尾副鳅、前鳍高原鳅、凹尾拟鲿、犁头鳅和大鳞副泥鳅在某一聚类组中丰度增加的同时,其性成熟个体的丰度也在该聚类组(为这些鱼类的繁殖季节)呈增加的趋势.以齐口裂腹鱼为例,其为组1的指示种,组1的丰度平均值大于组2;相应地,组1的性成熟个体丰度也大于组2,而组1对应的月份(11-12月以及1-6月)为齐口裂腹鱼的繁殖季节[30].上述这种对应关系表明:除短须裂腹鱼以外,其他7种指示种在黑水河下游的聚集是因为这些鱼类的产卵繁殖而非仅因觅食等因素导致的移动或迁徙.许多研究也发现,鱼类在繁殖时具有聚群的特征,其性成熟个体在繁殖季节在某一生境区域内的大量聚集表征了这些鱼类将在该区域进行产卵活动的极大可能性[11, 31-34].此外,就短须裂腹鱼而言,其在组1中显示较低的总丰度(表 2)但显示较高的性成熟个体丰度(图 3),表明在9-10月(图 4,圆中直线指向9-10月)就有较多的性成熟个体进入黑水河下游调查江段,其产卵活动在黑水河下游的发起时间很可能早于齐口裂腹鱼(图 4);同时,短须裂腹鱼在组2中显示较高的总丰度(表 2),但显示较低的性成熟个体丰度(图 3),表明洄游到黑水河下游的许多短须裂腹鱼个体在组2包括的月份内,有许多个体很可能不能在该区域进行自然繁殖(产卵场面积有限)或许多为未成熟的个体(表 1),这仍需要进行进一步研究.
3.2 支流生境保护对金沙江下游鱼类种群维持的意义研究表明,鱼类群聚结构的动态变化除与鱼类的产卵迁徙有关以外,栖息地的环境条件也是影响其变动的关键因素[25, 35-37].在局域尺度上,表征物理生境特征的流速、底质组成、溶解氧、水深和河流宽度等参数以及表征化学污染物的溶解氧浓度、电导率、总氮浓度、高锰酸盐指数等参数的显著变动通常能够对鱼类群聚结构的变动产生明显影响[25, 36-37].此外,就溪流鱼类而言,溪流的空间位置(溪流级别、下游量级等)[1, 38]以及干支流的连通性[39]也均会对支流鱼类的群聚结构变动造成一定程度的影响.在本文中,调查区域显示的受产卵迁徙明显影响的鱼类群聚变动模式(表 2和图 4),表明调查区域具有较好的物理和化学生境特征[13, 17]、有利的溪流空间位置(较高的溪流级别以及下游量级)[40]以及良好的干支流连通性.同时,调查区域分布有至少12种长江上游特有鱼类(表 1),是金沙江下游主要支流中除牛栏江以外特有鱼类分布最多的支流[13].因此,维持黑水河下游现有的自然流水生境,对该区域部分鱼类特别是长江上游特有鱼类生活史的完成具有重要的意义.许多研究也表明,支流生境维持对部分鱼类生活史的完成具有重要的意义[6, 8, 16, 41].特别地,随着金沙江下游干流梯级水电站的陆续建设完工,金沙江下游干流的绝大部分江段将成为静、缓流的库区江段,从而使得黑水河下游现有的自然生境变得更为重要.张雄等报道,除黑水河外,金沙江下游还分布有其他生境条件较好的支流,包括牛栏江、西溪河、普渡河、龙川江等[13],这些河流的部分河段很可能与黑水河下游河段一样,扮演着许多鱼类关键生境的角色.甚至对于许多受水电开发而生境发生明显改变的金沙江下游支流河段而言,其未开发前这些河段的生境也很可能是许多鱼类觅食或繁殖的关键栖息地.长期以来,由于缺乏对金沙江下游干支流关键鱼类生境(特别是产粘性或沉性鱼卵鱼类的产卵场)的详细调查,因此在比较不同江段的生境功能时,常常无法确定支流对某些鱼类的重要生态学意义.而且,在对金沙江下游水电开发对鱼类群聚结构影响的分析中,通常着重考虑干流梯级开发对鱼类的影响,而往往忽略支流梯级开发对金沙江干流鱼类群聚结构的影响[42-43].就本文而言,7种指示种鱼类在繁殖季节大量聚集到黑水河下游产卵,表明这7种指示种鱼类能够在黑水河下游完成生活史周期,并且其出生的后代有很大部分能够补充到金沙江干流群体中,因此黑水河下游生境的维持和保护对这些鱼类种群规模的维持具有重要的意义.而且,研究表明,黑水河现有的小水电开发已对该区域的鱼类生境造成明显影响[18].因此,在白鹤滩蓄水前,这7种指示种鱼类在黑水河的产卵生境面积也很可能已比小水电未修建前明显缩小.由于这7种鱼类是金沙江下游干流鱼类的重要组成部分,因此黑水河产卵生境面积的缩小很可能对金沙江下游干流的鱼类群聚结构造成明显影响. Wang等也发现,由于河流连通性的变化,非淹没区的鱼类群聚结构也受到了上下游大坝蓄水运行的影响[44].
张雄等报道,在金沙江下游一期水电工程完成以前,金沙江下游的12条支流已修建了大量水电站,而且在未来,所有较大的1级支流将形成梯级水电群[13],这对金沙江下游鱼类(特别是仅局限分布在该区域的鱼类)的保护是非常不利的:鱼类在干流和支流均无适宜面积的生境进行栖息繁衍.就黑水河而言,尽管本调查江段已作为白鹤滩库区干流鱼类的替代生境(http://www.cec.org.cn),但是白鹤滩水电站蓄水到825 m后,现有调查江段的大部分江段将变为永久淹没区或回水变动区;该区域自然生境长度在白鹤滩蓄水运行后的极其有限性,决定了黑水河下游江段作为白鹤滩库区干流鱼类替代生境的有限作用.已有研究表明,只有保持一定面积的关键栖息生境,鱼类才能够维持一定数量的种群规模而保持种群的延续[45],因此为维持现有的自然流水生境长度并发挥黑水河正常的替代生境功能,黑水河小型水电站的拆除应是白鹤滩库区鱼类保护优先选择的保护措施.在此措施进行后,采取其他措施对黑水河自然流水生境进行保护才可能发挥其作为白鹤滩干流部分鱼类关键栖息地的作用.
| [1] |
Li YH, Yan YZ, Zhu R et al. Spatial variations in fish assemblages within the headwater streams of the Wanhe watershed:A river network-based approach. Journal of Fishery Sciences of China, 2014, 21(5): 988-999. [李艳慧, 严云志, 朱仁等. 基于河流网络体尺度的皖河河源溪流鱼类群落的空间格局. 中国水产科学, 2014, 21(5): 988-999.] |
| [2] |
Benda L, Poff NL, Miller D et al. The Network dynamics hypothesis:how channel networks structure riverine habitats. BioScience, 2004, 54(5): 413-427. DOI:10.1641/0006-3568(2004)054[0413:TNDHHC]2.0.CO;2 |
| [3] |
Rodriguez-Iturbe I, Muneepeerakul R, Bertuzzo E et al. River networks as ecological corridors:a complex systems perspective for integrating hydrologic, geomorphologic, and ecologic dynamics. Water Resources Research, 2009, 45(1): 1413-1434. |
| [4] |
Brown BL, Swan CM, Auerbach DA et al. Metacommunity theory as a multispecies, multiscale framework for studying the influence of river network structure on riverine communities and ecosystems. Freshwater Science, 2011, 30(1): 310-327. |
| [5] |
Fukushima M. Damming in the Mekong River and its impacts on fish migration. Bmc Bioinformatics, 2011, 10(1): 1-11. |
| [6] |
Hladík M, Kubečka J. Fish migration between a temperate reservoir and its main tributary. Hydrobiologia, 2003, 504(1): 251-266. |
| [7] |
Walters DM, Zuellig RE, Crockett HJ et al. Barriers impedes upstream spawning migration of flathead chub. Transactions of the American Fisheries Society, 2014, 143(1): 17-25. DOI:10.1080/00028487.2013.824921 |
| [8] |
Youngson AF, Jordan WC, Hay DW. Homing of Atlantic salmon (Salmo salar, L.) to a tributary spawning stream in a major river catchment. Aquaculture, 1994, 121(1/2/3): 259-267. |
| [9] |
Nunn AD, Copp GH, Vilizzi L et al. Seasonal and diel patterns in the migrations of fishes between a river and a floodplain tributary. Ecology of Freshwater Fish, 2010, 19(1): 153-162. DOI:10.1111/eff.2010.19.issue-1 |
| [10] |
Baxter CV. Fish movement and assemblage dynamics in a Pacific Northwest riverscape[Dissertation]. Corvallis: Oregon State University, 2002. http://agris.fao.org/agris-search/search.do?recordID=AV20120157166
|
| [11] |
Yin MC. Fish ecology. Beijing: China Agricultural Press, 1995, 105-269. [殷名称. 鱼类生态学. 北京: 中国农业出版社, 1995, 105-269.]
|
| [12] |
Armichardy DJ. The role of migration in community dynamics in Beaver Lake basin[Dissertation]. USA: Northern Michigan University, 2008: 55-82. http://www.researchgate.net/publication/36712019_The_role_of_migration_in_community_dynamics_in_Beaver_Lake_Basin
|
| [13] |
Zhang X, Liu F, Lin PC et al. Habitat assessment and conservation priority for fishes in the lower Jinsha River. Resources and Environment in the Yangtze Basin, 2014, 23(4): 496-503. [张雄, 刘飞, 林鹏程等. 金沙江下游鱼类栖息地评估和保护优先级研究. 长江流域资源与环境, 2014, 23(4): 496-503.] |
| [14] |
Gosset C, Rives J, Labonne J. Effect of habitat fragmentation on spawning migration of brown trout (Salmo trutta L.). Ecology of Freshwater Fish, 2006, 15(3): 247-254. |
| [15] |
Silva PS, Makrakis MC, Miranda LE et al. Importance of reservoir tributaries to spawning of migratory fish in the upper Paraná River. River Research & Applications, 2015, 31(3): 313-322. |
| [16] |
Meyer JL, Strayer DL, Wallace JB et al. The contribution of headwater streams to biodiversity in river networks. Jawra Journal of the American Water Resources Association, 2007, 43(1): 86-103. DOI:10.1111/j.1752-1688.2007.00008.x |
| [17] |
Sun JN. Fish habitat simulation of the Heishui River-the backwater tributary of Baihetan reservoir[Dissertation]. Hangzhou: Zhejiang University, 2013. [孙嘉宁. 白鹤滩水库回水支流黑水河的鱼类生境模拟研究[学位论文]. 杭州: 浙江大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10335-1013147658.htm ]
|
| [18] |
Fu JJ, Huang B, Rui JL et al. Application of habitat simulation to fishery habitat protection in Heishui River. Journal of Hydroecology, 2016, 37(3): 70-75. [傅菁菁, 黄滨, 芮建良等. 生境模拟法在黑水河鱼类栖息地保护中的应用. 水生态学杂志, 2016, 37(3): 70-75.] |
| [19] |
Wang JW. Reproduction biology of Gobiocypris rarus. Acta Hydrobiologica Sinica, 1992, 16(2): 165-174. [王剑伟. 稀有鮈鲫的繁殖生物学. 水生生物学报, 1992, 16(2): 165-174.] |
| [20] |
Majewski AR, Lynn BR, Lowdon MK et al. Community composition of demersal marine fishes on the Canadian Beaufort Shelf and at Herschel Island, Yukon Territory. Journal of Marine Systems, 2013, 127(11): 55-64. |
| [21] |
Siddig AAH, Ellison AM, Ochs A et al. How do ecologists select and use indicator species to monitor ecological change? Insights from 14 years of publication in Ecological Indicators. Ecological Indicators, 2016, 60: 223-230. DOI:10.1016/j.ecolind.2015.06.036 |
| [22] |
Dufrêne M, Legendre P. Species assemblages and indicator species definition:the need of an asymmetrical and flexible approach. Ecol Monogr, 1997, 67(3): 345-366. |
| [23] |
Urban NA, Swihart RK, Malloy MC et al. Improving selection of indicator species when detection is imperfect. Ecological Indicators, 2012, 15(1): 188-197. |
| [24] |
Anderson MJ, Gorley RN, Clarke KR. PERMANOVA+for PRIMER: guide to software and statistical methods. Plymouth, UK, 2008. http://www.researchgate.net/publication/285237419_PERMANOVA_for_primer_Guide_to_software_and_statistical_methods
|
| [25] |
Li QF, Yan YZ, Chu L et al. Spatial and temporal patterns of stream fish assemblages within Taihu Basin. J Lake Sci, 2016, 8(6): 1371-1380. [李其芳, 严云志, 储玲等. 太湖流域河流鱼类群落的时空分布. 湖泊科学, 2016, 8(6): 1371-1380. DOI:10.18307/2016.0623] |
| [26] |
Taylor CM, Winston MR, Matthews WJ. Temporal variation in tributary and mainstem fish assemblages in a Great Plains stream system. Copeia, 1996, 1996(2): 280-289. |
| [27] |
Fencl JS. How big of an effect do small dams have?: using ecology and geomorphology to quantify impacts of low-head dams on fish biodiversity[Dissertation]. Manhattan: Kansas State University, 2015. http://hdl.handle.net/2097/18960
|
| [28] |
Holcomb JM, Nichols RB, Gangloff MM. Effects of small dam condition and drainage on stream fish community structure. Ecology of Freshwater Fish, 2016, 25(4): 553-564. |
| [29] |
Yang SR. Fish community ecology in the Yangtze River Basin[Dissertation]. Beijing: University of Chinese Academy of Sciences, 2012. [杨少荣. 长江流域鱼类群落生态学研究[学位论文]. 北京: 中国科学院大学, 2012. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2250014 ]
|
| [30] |
Cheng F, Li W, Castello L et al. Potential effects of dam cascade on fish:lessons from the Yangtze River. Reviews in Fish Biology & Fisheries, 2015, 25(3): 569-585. |
| [31] |
Heyman WD, Kjerfve B, Graham RT et al. Spawning aggregations of lutjanus cyanopterus (cuvier) on the Belize Barrier Reef over a 6 year period. Journal of Fish Biology, 2005, 67(1): 83-101. |
| [32] |
Domeier ML, Colin PL. Tropical reef fish spawning aggregations:defined and reviewed. Bulletin of Marine Science, 1997, 60(3): 698-726. |
| [33] |
Karnauskas M, Chérubin LM, Paris CB. Adaptive significance of the formation of multi-species fish spawning aggregations near submerged capes. PloS One, 2011, 6(7): e22067. DOI:10.1371/journal.pone.0022067 |
| [34] |
Pears RJ, Choat JH, Mapstone BD et al. Reproductive biology of a large, aggregation-spawning serranid, Epinephelus fuscoguttatus (Forsskål):management implications. Journal of Fish Biology, 2007, 71(3): 795-817. DOI:10.1111/j.1095-8649.2007.01545.x |
| [35] |
Kapuscinski KL, Farrell JM. Habitat factors influencing fish assemblages at muskellunge nursery sites. Journal of Great Lakes Research, 2014, 40(1): 135-147. |
| [36] |
Bonaca MO, Lipej L. Factors affecting habitat occupancy of fish assemblage in the Gulf of Trieste (Northern Adriatic Sea). Marine Ecology, 2005, 26(1): 42-53. DOI:10.1111/mae.2005.26.issue-1 |
| [37] |
Gao X, Zhang Y, Ding S et al. Response of fish communities to environmental changes in an agriculturally dominated watershed (Liao River Basin) in northeastern China. Ecological Engineering, 2015, 76: 130-141. |
| [38] |
Zhang XK, Wang HL, Wan A et al. Fishes in headwater streams of the Pihe River Basin:spatial distribution pattern and its main influencing factors. J Lake Sci, 2017, 29(1): 176-185. [张晓可, 王慧丽, 万安等. 淠河流域河源溪流鱼类空间分布格局及主要影响因素. 湖泊科学, 2017, 29(1): 176-185. DOI:10.18307/2017.0119] |
| [39] |
Thornbrugh DJ. Influence of stream connectance and network spatial position on fish assemblage structure in the Kansas River basin, USA[Dissertation]. Manhattan: Kansas State University, 2008. http://www.researchgate.net/publication/29867865_Influence_of_stream_connectance_and_network_spatial_position_on_fish_assemblage_structure_in_the_Kansas_River_basin_USA
|
| [40] |
Yan YZ, Zhan YJ, Chu L et al. Effects of stream size and spatial position on stream-dwelling fish assemblages. Acta Hydrobiologica Sinica, 2010, 34(5): 1022-1030. [严云志, 占姚军, 储玲等. 溪流大小及其空间位置对鱼类群落结构的影响. 水生生物学报, 2010, 34(5): 1022-1030.] |
| [41] |
Kanno Y, Letcher BH, Coombs JA et al. Linking movement and reproductive history of brook trout to assess habitat connectivity in a heterogeneous stream network. Freshwater Biology, 2013, 59(1): 142-154. |
| [42] |
Tang HY, Yang Z, Gao SB et al. Annual dynamics of fish biodiversity and community structure in the non-impounded reaches of the lower Jinsha River:case study of the Qiaojia section. Journal of Hydroecology, 2014, 35(6): 7-15. [唐会元, 杨志, 高少波等. 金沙江下游巧家江段鱼类生物多样性及群落结构的年际动态. 水生态学杂志, 2014, 35(6): 7-15.] |
| [43] |
Fan XG, Wei QW, Chang JB et al. A review on conservation issues in the upper Yangtze River-a last chance for a big challenge:Can Chinese paddlefish (Psephurus gladius), Dabry's sturgeon, (Acipenser dabryanus) and other fish species still be saved?. Journal of Applied Ichthyology, 2006, 22(s1): 32-39. |
| [44] |
Wang L, Infante D, Lyons J et al. Effects of dams in river networks on fish assemblages in non-impoundment sections of rivers in Michigan and Wisconsin, USA. River Research & Applications, 2011, 27(4): 473-487. |
| [45] |
Benaka LR. Fish habitat:essential fish habitat and rehabilitation. The Quarterly Review of Biology, 2001, 76(1): 1288-1289. |
 2018, Vol. 30
2018, Vol. 30 

