(2: 中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室, 南京 210008)
(3: 中国科学院大学, 北京 100049)
(2: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P. R. China)
(3: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
多环芳烃(PAHs)是环境中广泛存在的一类持久性有机污染物,经地表径流、污水排放及大气颗粒迁移和沉降而进入湖泊、河流等水体中,进入水体中的PAHs易于吸附在颗粒物上,极易聚集到沉积物中,因此沉积物被认为是其主要的环境归宿之一[1-2].而水生植物,特别是沉水植物在污染沉积物的修复方面发挥着重要的作用.苦草属(Vallisneria)是一类具有很强环境适应能力的沉水植物类群,不仅可以作为水体受污染程度的指示物种,对水环境质量进行监测[3];且对沉积物中毒性有机污染物具有很好的修复性能[4-7].
目前已有的研究表明沉水植物苦草(Vallisneria spiralis)可以有效地修复沉积物中菲[4-5],种植苦草的沉积物中菲的去除率要提高18 %;苦草的根对菲的毒性效应最为敏感,苦草通过根部形态可塑性增强其抗逆境能力[5].然而,已有的研究对修复过程中PAHs的降解动力学以及高分子量PAHs的修复效果并未涉及,且原有的研究是通过添加PAHs菲进入到沉积物中而开展,而实际情况下沉积物中PAHs污染水平以及污染状况更为复杂.那么,生长在不同污染程度的沉积物中苦草是否对PAHs具有不同的修复效应?沉积物中PAHs是否具有不同的降解特征?这些问题的解决对于污染沉积物的生物修复在选择沉水植物方面显得尤为重要.
藉此,本文以东太湖2个典型的PAHs污染程度不同的沉水植物苦草生长区域为研究对象,采集2个区域的根际沉积物和苦草样品,研究不同污染程度的沉积物中苦草对PAHs的修复性能影响,分析不同污染程度下沉积物中PAHs降解行为和降解动力学,为沉水植物苦草在水体环境修复中的应用提供理论依据.
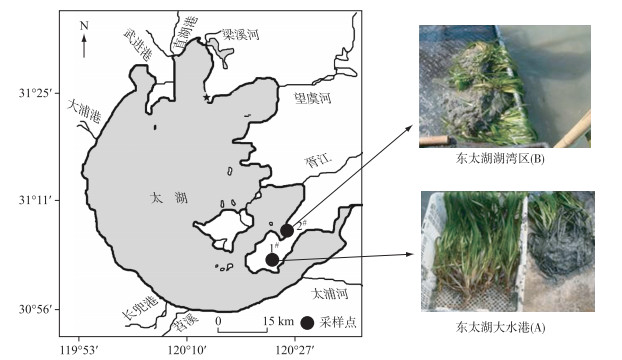
1 材料与方法 1.1 采样点与材料以东太湖2个典型的污染程度不同的沉水植物苦草生长区域为研究对象.采样点分别为:样点1位于东太湖入湖河道大水港(31°4′N,120°24′E),是苏州东山镇船舶建造、船舶维修基地,大水港的水体常年处于溢油(机油、柴油等)污染(图 1A);样点2位于东太湖湖湾区,是太湖东南隅的一个浅水草型湖湾(31°6′N,120°25′E),是水生植物生长繁殖的一个重要区域(图 1B).采集上述两个区域内的根际沉积物和苦草样品.选取长势良好、带根且无损伤的苦草植株,其中大水港的苦草株高为31±4 cm,东太湖湖湾区的苦草株高为54±8 cm.苦草经自来水冲洗干净,室内驯化后分别进行移栽.同时采集苦草根际沉积物,其中大水港的根际沉积物呈明显的黝黑色,而东太湖湖湾区的根际沉积物表层呈灰色.
|
图 1 东太湖入湖河道大水港(A)和东太湖湖湾区(B)示意 Fig.1 The distribution of Dashui harbour(A) and the bay(B) of east Lake Taihu |
将采集的根际沉积物和苦草样品进行室内模拟试验.试验设置4种处理组,分别为:(1)大水港苦草处理组;(2)大水港对照组,不种植苦草;(3)东太湖湖湾区苦草处理组;(4)东太湖湖湾区对照组,不种植苦草.每种处理组设3个平行,共12个试验桶.每个试验桶内放置约520 g(湿重)根际沉积物,将大水港和东太湖湖湾区的苦草(鲜重约45 g)分别移栽到试验桶内.试验桶内上覆水为霍格兰氏营养液[8],水深为70 cm.试验过程中苦草的光照条件是889~1261 lux.实验前后测定苦草湿重和株高等生长指标.
1.3 样品的采集与处理定期采集试验桶内根际沉积物样品(每个试验桶内均匀采集5个点的沉积物柱状样品混合而成),测定其PAHs含量,同时分析试验前后沉水植物苦草的PAHs含量.沉积物和苦草经冷冻干燥、研磨后过60目筛备用.样品采用加速溶剂萃取方法(ASE)进行萃取[9]:称取4 g左右的样品粉末,加入8 g左右的石英砂和3 g铜粉,充分摇匀后装入加速溶剂萃取仪(ASE,Dionex 100)的萃取池中进行高温高压萃取.萃取所用溶剂为色谱纯二氯甲烷,加热温度为100℃,压力为1500 psi,每个样品静态提取2次,每次10 min.将萃取完的溶液转移至蒸发瓶内,通过旋转蒸发仪旋转蒸发至近干,加入5 ml乙腈为置换溶剂,继续浓缩至3 ml左右转移至10 ml刻度管中.再将浓缩液通过弗罗里硅土的玻璃层析柱,用乙腈淋洗有机组分,收集乙腈淋洗液并旋蒸浓缩至1 ml,并转移至进样小瓶中,-20℃保存待仪器分析.
1.4 样品分析PAHs检测采用Agilent 1200高效液相色谱仪(HPLC)完成,以二极管阵列紫外检测器(DAD)串联荧光检测器(FLD)进行PAHs的定性和定量分析[8]. DAD检测器波长设定为254 nm,FLD检测器激发(Ex)和发射(Em)波长条件根据时间而改变,具体方法参考文献[10-11].色谱柱为C18(4.6 mm×150 mm),流动相为乙腈水溶液,进样量为20 μl,流速为1 ml/min,柱温为30℃.沉积物中总溶解性碳(TOC)含量测定采用重铬酸钾氧化法,总氮(TN)和总磷(TP)含量的测定均采用过硫酸盐氧化法[2].
为了保证实验分析数据的准确性和可靠性,样品分析的过程中同步设置方法空白实验判定整个实验操作过程中是否有基质的干扰.方法回收率实验选用经马弗炉焙烧处理过的石英砂代替环境样品,加入定量的PAHs标准化合物,按照上述同样的预处理方法进行样品处理,一起分析测定每种化合物的方法回收率.石英砂为分析纯,马弗炉450℃焙烧6 h后于干燥器内保存.实验表明,测定16种优先控制PAHs的方法回收率为75.92 % ~139.53 %.试验中总PAHs为16种PAH同系物的总量.通过分别添加已知浓度的菲到沉积物和苦草样品中,测定其菲的回收率分别为89.65 % ±3.55 %和90.27 % ±2.31 %.
1.5 数据处理沉积物中PAHs的降解动力学采用一级反应动力学方程(C=C0·e-kt)进行拟合[2],其中,C0为PAH的初始含量,k为速率常数,t为降解时间. PAH的半衰期t1/2的计算:t1/2= (ln 2)/k.
实验数据用Origin Pro 8.5软件处理与绘图.显著性检验采用IBM SPSS Statistics 19软件的单因素方差检验(One way ANOVA,P<0.05为显著相关),若方差齐性则采用LSD方法进行多重比较检验,若方差不齐性,则采用Dunett's T3进行多重比较检验.
2 结果与讨论 2.1 沉积物与苦草的初始理化特征分析东太湖入湖河道大水港与东太湖湖湾区的沉积物和苦草的初始理化指标如表 1所示.东太湖入湖河道大水港沉积物中PAHs含量为70.10±16.40 mg/kg,显著高于(P < 0.05)湖湾区的PAHs含量(3.68±1.20 mg/kg).而且大水港沉积物中以高分子量PAHs为主,4~6环PAHs占总PAHs比例高达83 %.同样,大水港沉积物中TOC、TN和TP浓度均显著高于(P < 0.05)湖湾区.此外,两处沉积物的Fe(Ⅲ)含量较为接近,但是Fe(Ⅱ)含量有着明显区别,大水港处Fe(Ⅱ)含量明显高于(P < 0.05)湖湾区,接近其2倍.表明东太湖入湖河道大水港处沉积物与东太湖湖湾区处沉积物污染程度存在明显差异.根据沉积物质量评价等级,大水港沉积物中PAHs污染为重度污染,其含量已超过生态风险区间低值(4 mg/kg),该区域内PAHs污染可能会对生物产生负面影响,威胁人类的身体健康[12-13].而东太湖湖湾区PAHs污染水平相对较低,但仍处于中度污染程度.
| 表 1 东太湖入湖河道大水港和湖湾区沉积物和苦草的初始属性指标 Tab.1 Initial properties of sediment and V. natans in Dashui harbour and the bay of east Lake Taihu |
对大水港和湖湾区2处采集的苦草研究发现,湖湾区苦草的平均株高和鲜重均要高于大水港苦草.而从苦草体内富集的总PAHs来看,大水港处苦草体内富集的PAHs含量远远超过了湖湾区的苦草,接近湖湾区处苦草体内的4倍,其中在总PAHs中,4~6环的PAHs也占了很大的比重.可见,在不同污染程度的区域中,苦草均能生长,但是在污染程度相对较高的区域中,生长的苦草其体内富集的PAHs含量也较高.表明沉水植物苦草对PAHs具有很好的富集性能.早先的研究同样表明苦草的根部对菲的富集系数为0.63~2.85,且苦草的叶部对菲的富集系数为0.19~1.62[4-5].
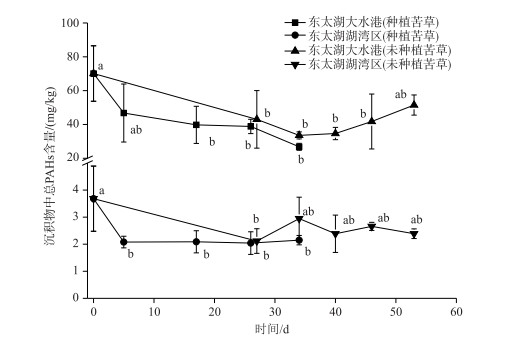
2.2 东太湖大水港与湖湾区苦草对沉积物中PAHs的修复效果通过设置不同的实验处理组,考察东太湖大水港与湖湾区苦草对沉积物中PAHs的修复效果,沉积物中PAHs含量随时间的变化曲线如图 2所示.在整个修复过程中,种植苦草沉积物处理组与未种植苦草沉积物对照组总PAHs含量均有一定程度的降低.其中,种植苦草沉积物处理组的PAHs含量降低程度较为明显.经过34 d的植物修复,东太湖大水港沉积物的总PAHs含量由70.1 mg/kg降至26.78 mg/kg,降低了62 %;而东太湖湖湾区沉积物的总PAHs去除率为42 %,PAHs含量在第5天时出现最低值,后续时间基本维持不变.与未种植苦草的对照组相比较(图 2),2个种植苦草的沉积物PAHs去除率较未种植区域分别提高了21 %和14 % (P<0.05).此外, 为获得未种植苦草的对照组中PAHs的降解动力学, 对照组中PAHs降解时间持续了53 d.结果表明,对于PAHs高含量和低含量污染的沉积物,苦草均有较好的修复效果,而高浓度沉积物区域的修复效果更为显著.这种修复效果除了与苦草对PAHs的富集作用有关,而且与苦草的根系泌氧造成根际沉积物区域具有较高的氧化还原电位(ORP)以及苦草的根与根际微生物协同作用密切相关[4-6];已有的研究发现,在有挺水植物菖蒲(Acorus calamus)的沉积物的ORP(149±19 mV)要显著高于未种植植物沉积物(-53±20 mV),且根际沉积物内主要富集了好氧PAHs降解菌属(福格斯氏菌Vogesella、假单胞菌Pseudomonas、黄杆菌Flavobacterium和根瘤菌Rhizobium)[8].此外,植物的根系泌氧可明显提高沉积物中PAHs降解菌数至少1个数量级[8].与未种植苦草的对照组相比,种植苦草处理组因植物新生有机碳不断输入到沉积物中,沉积物中PAHs的生物有效性会明显提高[2, 14, 16],改善了沉积物中PAHs的修复效果.
|
图 2 东太湖大水港与湖湾区的苦草对沉积物中PAHs的修复以及沉积物中PAHs的自然降解 (不同小写字母表示差异具有显著性) Fig.2 The remediation of PAHs-contaminated sediment with planting V. natans and natural attenuation of PAHs in sediment in Dashui harbour and the bay of east Lake Taihu (Different small letters refer to significant differences) |
本实验考察了16种主要的PAHs,分别为2环:萘;3环:苊烯、苊、芴、菲、蒽;4环:荧蒽、芘、苯并(a)蒽、屈;5环:苯并荧(k)蒽、苯并(b)荧蒽、苯并(a)芘、二苯并(a, h)蒽;6环:茚并(1, 2, 3-cd)芘,苯并(g, h, i)芘.
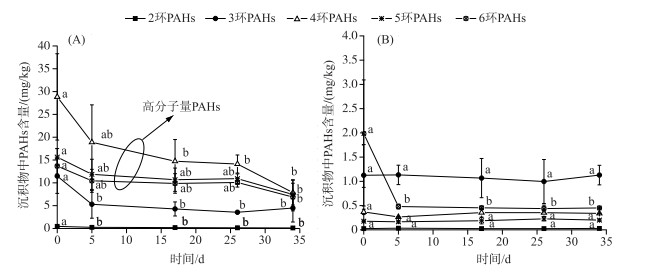
东太湖大水港区4~6环PAHs的初始含量较高,分别为28.84±9.46、15.64±1.88和13.68±1.77 mg/kg,而在经过34 d的修复后,分别降为7.89±2.71、7.44±3.23和6.89±3.03 mg/kg,去除率分别为72.75 %、52.37 %和49.63 %.而沉积物中2环和3环的PAHs初始含量较低,其去除率分别为74.47 %和61.06 % (图 3A).对于污染程度相对低的东太湖湖湾区(图 3B),其沉积物中PAHs的去除主要表现为6环PAHs的去除,去除率高达77.22 %.由此可见,苦草对于沉积物中高分子量PAHs有较好的修复效果.这种沉积物中高分子量PAHs的去除主要通过植物的根系分泌物作为共代谢基质实现,植物根系分泌物中的芳香族有机酸可以作为PAHs微生物分解代谢的中间产物[8, 14],这些中间体可以诱导PAHs降解酶的表达或者作为共代谢基质,从而促进PAHs的生物降解.此外,植物的内生菌不仅可以促进植物生长,同时可以协同降解有机污染物,对植株体内的污染物也具有代谢功能;且植物内生菌群落与植物种类、植物的不同组织部位以及植物生境类型有关[15].目前,有关沉水植物苦草内生菌的群落结构及分布特征还未见报道.
|
图 3 东太湖大水港(A)和湖湾区(B)的苦草对沉积物中不同环PAHs的修复 (不同小写字母表示差异具有显著性) Fig.3 The remediation of different ring-PAHs in sediment with planting V. natans in Dashui harbour (A) and the bay(B) of east Lake Taihu (Different small letters refer to significant differences) |
沉积物中PAHs的降解速率及半衰期可看出,大水港(种植苦草)处理组对PAHs的降解速率为0.024 d-1,半衰期为28.36 d,而未种植苦草沉积物中PAHs的降解速率为0.007 d-1,半衰期为95.61 d(表 2).可见,大水港种植苦草的沉积物中PAHs的降解速率明显快于未种植苦草的降解速率,并且半衰期也显著低于未种植苦草的半衰期,PAHs的降解速率加快了3倍左右.同样在湖湾区,种植苦草的降解速率是未种植苦草的降解速率的2.15倍,半衰期是未种植苦草的半衰期的0.46倍.结果表明在高浓度和低浓度的污染环境中,种植苦草均可有效地加快沉积物中PAHs的降解速率并且缩短降解周期.
| 表 2 不同处理条件下沉积物中PAHs的降解速率及半衰期* Tab.2 Degradation rate and half-life of PAHs in sediments under different treatment conditions |
此外,大水港(种植苦草)降解速率是湖湾区(种植苦草)降解速率的1.65倍,半衰期是湖湾区(种植苦草)的0.61倍,说明苦草在高浓度PAHs中的修复效果要明显优于在低浓度中的效果.表明苦草对沉积物中PAHs具有很好的修复潜能,在苦草的耐受限范围内(沉积物中菲浓度80 mg/kg[4-5]),沉积物污染程度越高,苦草的修复作用更为显著.
通过研究大水港(种植苦草)降解速率可发现,沉积物中PAHs的降解速率表现为3环PAHs>4环PAHs>5环PAHs>6环PAHs,表明沉积物中低环PAHs更易于降解.在自然环境中低分子量PAHs相对比较容易降解,而高分子量PAHs具有更强疏水性、难降解以及持久性特点[2, 16].
3 结论1) 沉水植物苦草对PAHs具有很好的富集潜能,PAHs污染重的入湖河道大水港处苦草体内富集的PAHs含量明显高于湖湾区苦草.在不同污染程度的2个区域中,苦草均能生长,但是湖湾区苦草的平均株高和鲜重均要高于大水港苦草.
2) 在不同污染程度的2个区域中,苦草对沉积物中PAHs均有较好的修复效果,而且在PAHs污染重的沉积物区域的修复效果更加显著,尤其表现为高分子量PAHs的去除.
3) 苦草的种植可以有效地加快沉积物中PAHs的降解速率并且缩短降解周期.因此,沉水植物苦草在污染沉积物的修复方面发挥着重要的作用.不过,苦草的修复机制有待进一步研究,尤其是苦草植株体内富集的微生物群落对PAHs的分解转化是今后研究的重点.
| [1] |
Tao S, Luo YM, Zhu LZ et al. Regional environmental processes of typical trace organic pollutants. Journal of Environmental Science, 2006, 26(1): 168-171. [陶澍, 骆永明, 朱利中等. 典型微量有机污染物的区域环境过程. 环境科学学报, 2006, 26(1): 168-171.] |
| [2] |
Yan ZS, Jiang HL, Li XH et al. Accelerated removal of pyrene and benzo[a]pyrene in freshwater sediments with amendment of cyanobacteria-derived organic matter. Journal of Hazardous Materials, 2014, 272: 66-74. DOI:10.1016/j.jhazmat.2014.02.042 |
| [3] |
Biernacki M, Lovett-Doust J. Vallisneria americana (Hydrocharitaceae) as a biomonitor of aquatic ecosystems:comparison of cloned genotypes. American Journal of Botany, 1997, 84(12): 1743-1751. DOI:10.2307/2446474 |
| [4] |
Yan ZS, Guo HY, Song TS et al. Tolerance and remedial function of rooted submersed macrophyte Vallisneria spiralis to phenanthrene in freshwater sediments. Ecological Engineering, 2011, 37(2): 123-127. DOI:10.1016/j.ecoleng.2010.07.026 |
| [5] |
Yan ZS, Hu Y, Jiang HL. Toxicity of phenanthrene in freshwater sediments to the rooted submersed macrophyte Vallisneria spiralis. Bulletin of Environmental Contamination and Toxicology, 2011, 87(2): 129-133. DOI:10.1007/s00128-011-0324-x |
| [6] |
Liu HY, Meng FB, Tong YD et al. Effect of plant density on phytoremediation of polycyclic aromatic hydrocarbons contaminated sediments with Vallisneria spiralis. Ecological Engineering, 2014, 73(0): 380-385. |
| [7] |
Li XH, Yan ZS, Jiang HL. Effect of direct-current electric field on the growth of submerged macrophyte Vallisneria natans. J Lake Sci, 2016, 28(5): 1023-1030. [李晓红, 晏再生, 江和龙. 直流电场对沉水植物苦草(Vallisneria natans)生长的影响. 湖泊科学, 2016, 28(5): 1023-1030. DOI:10.18307/2016.0512] |
| [8] |
Yan ZS, Jiang HL, Cai HY et al. Complex interactions between the macrophyte Acorus Calamus and microbial fuel cells during pyrene and benzo[a]pyrene degradation in sediments. Scientific Reports, 2015, 5: 10709. DOI:10.1038/srep10709 |
| [9] |
Yan ZS, Zhang HC, Wu HF et al. Occurrence and removal of polycyclic aromatic hydrocarbons in real textile dyeing wastewater treatment process. Desalination and Water Treatment, 2016, 57(47): 22564-22572. DOI:10.1080/19443994.2015.1132396 |
| [10] |
Zhao ZH, Zhang L, Cai YJ et al. Distribution of polycyclic aromatic hydrocarbon (PAH) residues in several tissues of edible fishes from the largest freshwater lake in China, Poyang Lake, and associated human health risk assessment. Ecotoxicology and Environmental Safety, 2014, 104: 323-331. DOI:10.1016/j.ecoenv.2014.01.037 |
| [11] |
Li QY, Zhao ZH, Jiang Y et al. Vertical distribution characteristics of organochlorine pesticdes and polycyclic aromatichydrocarbons in a sedimentary core from Zhouxi Bay, Lake Poyang. J Lake Sci, 2016, 28(4): 765-774. [郦倩玉, 赵中华, 蒋豫等. 鄱阳湖周溪湾沉积物中有机氯农药和多环芳烃的垂直分布特征. 湖泊科学, 2016, 28(4): 765-774. DOI:10.18307/2016.0409] |
| [12] |
Baumard P, Budzinski H, Michon Q et al. Origin and bioavailability of PAHs in the Mediterranean sea from mussel and sediment records. Estuarine, Coastal and Shelf Science, 1998, 47(1): 77-90. DOI:10.1006/ecss.1998.0337 |
| [13] |
Long ER, Macdonald DD, Smith SL et al. Incidence of adverse biological effects within ranges of chemical concentrations in marine and estuarine sediments. Environmental Management, 1995, 19(1): 81-97. DOI:10.1007/BF02472006 |
| [14] |
Rentz JA, Alvarez PJJ, Schnoor JL. Benzo[a]pyrene co-metabolism in the presence of plant root extracts and exudates:Implications for phytoremediation. Environmental Pollution, 2005, 136(3): 477-484. DOI:10.1016/j.envpol.2004.12.034 |
| [15] |
Yang MZ, Yan ZS, Wu H et al. Effects on interactions between aquatic plants and rhizosphere/endophytic microorganism on degradation of polycyclic aromatic hydrocarbons in sediments. Chemistry & Bioengineering, 2016, 33(12): 6-13. [杨明忠, 晏再生, 吴慧芳等. 水生植物与根际/根内微生物相互作用对沉积物中多环芳烃降解的影响. 化学与生物工程, 2016, 33(12): 6-13. DOI:10.3969/j.issn.1672-5425.2016.12.002] |
| [16] |
Toyama T, Furukawa T, Maeda N et al. Accelerated biodegradation of pyrene and benzo[a]pyrene in the Phragmites australis rhizosphere by bacteria-root exudate interactions. Water Research, 2011, 45(4): 1629-1638. DOI:10.1016/j.watres.2010.11.044 |
 2018, Vol. 30
2018, Vol. 30 

