1960年美国生态学家Whittaker首次提出将物种多样性分成alpha(α)、beta(β)和gamma(γ)3个层次[1],但过去很长一段时间内,众多的研究主要集中在局域(α)和区域(γ)物种丰富度方面.近些年来,用来描述不同群落(样方、位点)组成变化的β多样性越来越受到关注,理解β多样性背后的形成机制成为群落生态学研究的一个主要领域[2].最初Whittaker将β多样性定义为γ/α,但其后的研究中,研究者们根据自己研究内容和目的不同,建立了众多的β多样性度量和统计方法用来解释不同的生态现象,例如相异性指数的方法[3-4].
Baselga[5]提出有两种不同的途径会导致物种集合体组成不同(β多样性):一是物种替换(周转),即一个集合体中的物种在另一个集合体中被其他物种代替;二是物种的丢失(获得),即物种的灭绝(增加)只在其中一个集合体中发生,导致物种贫乏集合体是物种丰富集合体的严格子集,即一种嵌套模式.据此,Baselga提出了利用Sørensen指数和Jaccard指数(两种严格意义上β多样性的单调转换)将总的相异性(β多样性)分解成两个独立的可相加的成分,分别对应由周转和嵌套导致的相异性[5-6].该分解方法有利于我们更好地理解生物地理学、生态学和生物多样性保护[5],已被应用于鸟类和蜥蜴[7]、鱼类[8]、大型底栖动物[9]、寄生虫[10]等生物类群的研究.生活在淡水中的软体动物包括腹足纲(Gastripoda)和瓣鳃纲(Lamellibranchia),是底栖动物的重要组成部分,亦是水生态系统食物网的重要环节.由于活动能力弱、生活周期较长、不同物种对环境变化的敏感性不一样等因素,淡水软体动物容易受到水环境污染、生态入侵以及人类对贝类资源过度开发利用等不利因素的影响[11].云南高原湖泊群位于我国五大湖区之一的云贵高原,是云南省极为珍贵的自然资源.这些湖泊由于海拔高,湖盆较深,位于石灰岩和砂岩地区,因而湖泊特征与我国长江中下游浅水湖泊显著不同,也是比平原湖泊更脆弱的水生态系统[12].在相对隔离的云南高原湖泊中,水生生物区系分布上的特化现象明显,有着众多特有物种,如螺蛳属(Margarya)[13].但随着湖泊周边地区工农业的发展,引起一系列环境问题,导致生物多样性减少[14].在中国科学院昆明动物研究所开展的“滇池淡水生物多样性恢复项目”中,按照世界自然保护联盟濒危物种红色名录(IUCN RED LIST)评价标准,对滇池流域13种土著特有鱼类和5种软体动物的濒危程度进行了评估,评估结果表明滇池流域特有物种螺蛳(M. melanioides)、光肋螺蛳(M. mansuyi)、牟氏螺蛳(M. monodi)和飘棱拟珠蚌(Rhombuniopsis tauriformis)为极危物种,滇池圆田螺(Cipangopaludina dianchiensis)为濒危物种.
描述不同群落(样方、位点)物种组成变化的β多样性,作为物种丰富度标准的补充,在指导保护区域选择和确定区域保护的优先级等方面有重要作用[15].例如,嵌套和周转是两个对立的过程,也分别暗含着不同的保护措施,嵌套为主导的多样性需要优先保护物种多样性丰富度高的群落,周转为主导的多样性则需要同时保护多个群落[16].因此我们采用β多样性分解方法,对云南高原湖泊软体动物组成进行β多样性分析,探讨引起该地区软体动物β多样变化的原因, 为该地区软体动物物种多样性保护和资源合理利用提供科学依据.
1 材料和方法 1.1 研究区概况云南高原湖泊地处亚热带湿润、半干旱地区,季风影响大,常年平均气温在15℃左右,从省会昆明往南逐渐升高,大屯海所在的蒙自,年平均气温可达20.3℃.四季不明显,主要为春、秋两季.年降雨量在1000 mm左右,主要集中在5—8月份.年平均蒸发量达1800 mm[12].本次研究共整理了云南高原15个湖泊的软体动物分布资料,分别为滇池[17-22]、清水海[20-23]、洱海[20-22, 24-25]、茈碧湖[20-22, 24]、抚仙湖[20-22, 26]、剑湖、泸沽湖、程海、阳宗海、星云湖、杞麓湖、长湖、月湖、异龙湖和大屯海[20-22].其中海拔最高的是泸沽湖(27°41′~27°45′N,100°45′~100°50′E,2685 m),分布在最北.海拔最低的是大屯海(23°25′38″N,103°18′39″E,1284 m),分布在最南.这些湖泊分别属于金沙江水系(4个湖泊)、澜沧江水系(3个湖泊)、南盘江水系(6个湖泊)和元江水系(2个湖泊).根据湖泊平均深度分成2种深度类型,平均深度为11 m以上的划分为深水型湖泊(6个湖泊),平均深度为11 m及以下的划分为浅水型湖泊(9个湖泊)[12, 27].各湖泊特征见表 1.
| 表 1 云南高原湖泊特征及软体动物物种数 Tab.1 Distribution of mollusk in lakes of Yunnan Plateau |
在云南高原15个湖泊中,共记录了软体动物108种(表 2),隶属于2纲9科.其中双壳类2科25种,腹足类7科83种[17-26].种类最多的为田螺科(33种),最少的为拟沼螺科(1种).腹足类中扁卷螺科的大脐圆扁螺(Hippeutis umbilicalis)分布最广泛,分布在13个湖泊中;其次是田螺科的中国圆田螺(C. chinensis)和椎实螺科的椭圆萝卜螺(Radix swinhoei),分布在12个湖泊中.双壳类中分布最广的是背角无齿蚌和河蚬(Corbicula fluminea),在7个湖泊中出现.只在1个湖泊中有记录的物种共54种,占总种数的50%.在各个湖泊中,以滇池中记录的软体动物物种数最多,为83种,程海和月湖中记录的物种数最少,为5种(表 1),在月湖中没有瓣鳃类分布记录.
| 表 2 云南高原湖泊软体动物组成概况 Tab.2 Composition of mollusk in lakes of Yunnan Plateau |
本文主要依据20世纪发表的广泛调查的记录,将云南高原湖泊软体动物分布情况编辑整理成数据集.数据每行代表一个湖泊,每列代表一个物种,某物种在该湖泊出现就记录为“1”,反之则标记为“0”,最终数据记录成为有/无类型的二元数据矩阵.对于同一物种出现不同中文名则依据其拉丁名统一为一个物种.为了使统计数据统一为物种水平,有的物种有多个亚种,则将所有亚种归为一个物种,例如圆背角无齿蚌(Anodonta woodiana pacifica)、椭圆背角无齿蚌(A. woodiana elliptica)、鱼形背角无齿蚌(A. woodiana piscatorum)和背角无齿蚌(A. woodiana woodiana)都统一记录为背角无齿蚌.有的文献中记录的物种虽然没有鉴定到种名,仍然将其作为独立物种计入分析数据中[8].
1.3 β多样性分解方法采用Baselga提出的β多样性加法分解方法,将β多样性分解成周转和嵌套两部分[5].首先,采用多位点计算方法,用Sørensen相异性指数计算总相异性(βSOR)以及其周转(βSIM)和嵌套(βSNE)成分:βSOR=βSIM + βSNE.其次,利用配对的计算方法,分析各个湖泊对之间总β多样性(βsor)及其组成(βsim和βsne)变化:βsor=βsim + βsne. Baselga基于Sørensen相异性指数的β多样性分解方法计算公式见表 3.
| 表 3 β多样性指数及计算公式* Tab.3 Dissimilarity index and formula of measurement to determine β diversity |
表 3公式中a为两个位点都有的物种数,b、c分别为只在其中一个位点分布的物种数.在Baselga分解方法中,总β多样性以及周转成分是直接计算得到的,嵌套成分是前二者相减得出的[5].
除此之外,Baselga还提出了基于Jaccard相异性指数的β多样性分解方法,其多位点的总β多样性及其周转和嵌套组成分解方法为:βJAC=βJTU + βJNE,相应的配对计算的分解方法为:βjac=βjtu + βjne.计算公式见文献[6].
1.4 统计分析β多样性分析计算过程在R语言环境中进行[28],β多样性分解采用betapart工具包[29]以及R基础包完成.用beanplot图[30]展示各β多样性及其周转和嵌套组分度量值和分布密度.为了可视化不同湖泊对之间的β多样性关系,利用配对计算的相异性矩阵进行非度量多维尺度分析(NMDS)和聚类分析(UPGMA法).为了进一步了解不同软体动物类群、不同水系、不同深度类型湖泊β多样性的变化特征,进一步将数据按照类群、水系、深度进行分组,探讨相应的β多样性.
2 结果与分析 2.1 多位点方法计算的β多样性 2.1.1 湖泊软体动物总β多样性利用Sørensen和Jaccard指数计算云南高原15个湖泊软体动物组成总相异性(总β多样性)分别为0.8903和0.9419.其中周转组分分别是0.7205和0.8375,分别占总β多样性的80.93%和88.92%.嵌套导致的β多样性分别为0.1698和0.1044,嵌套组分所解释的比例都少于周转组分(表 4).
| 表 4 多位点计算的β多样性 Tab.4 β diversity based on multiple-site calculating method |
在云南高原湖泊分布的软体动物中,利用Sørensen和Jaccard指数计算的不同类群总β多样性为瓣鳃类(0.9291和0.9633)大于腹足类(0.8811和0.9367).在不同组分中,瓣鳃类周转成分所占总β多样性的比例(83.87%和90.93%)大于腹足类周转成分在其总β多样性的比例(80.34%和88.49%),嵌套成分则相反(表 4).
2.1.3 不同水系β多样性云南高原15个湖泊分属4个水系,其中金沙江水系湖泊软体动物β多样性最高(Sørensen和Jaccard指数法分别为0.8827和0.9377),其次为南盘江水系和澜沧江水系,元江水系β多样性最低(0.5000和0.6667).元江水系湖泊软体动物周转成分占β多样性比例最大(88.88%和92.31%),其次为南盘江水系和澜沧江水系,金沙江水系湖泊软体动物周转成分占β多样性比例最小(55.02%和69.72%)(表 4).
2.1.4 不同深度湖泊β多样性云南高原湖泊软体动物β多样性是浅水型湖泊(Sørensen和Jaccard指数法分别为0.8349和0.9100)略高于深水型湖泊(0.8136和0.8972).周转成分在总β多样性所占比例为浅水型湖泊(62.58%和75.43%)小于深水型湖泊(81.48%和88.85%),嵌套成分相反(表 4).
2.2 配对方法计算的β多样性 2.2.1 基于Sørensen指数的β多样性采用Sørensen指数进行配对的β多样性计算结果表明,β多样性及其周转和嵌套组分分布形式不同(图 1). β多样性周转的成分分布比较均匀;嵌套成分呈现一种单峰分布,其值集中在低于平均值部分;总β多样性值则近似于一种正态分布.
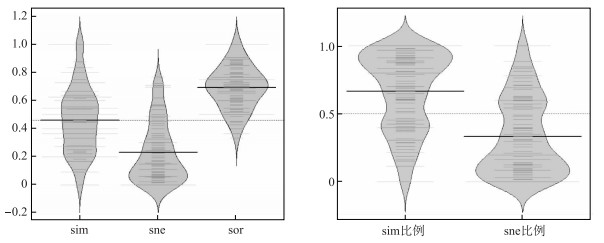
|
图 1 基于Sørensen指数算法的βsim和βsne及其在βsor中所占比例分布 Fig.1 Distribution of βsim, βsne and their proportion in βsor based on Sørensen index |
不同湖泊对的软体动物βsor最大值为1,最小值为0.3333,平均值为0.6914. βsim最大值为1,最小值为0,平均值为0.4601,βsim在βsor中的比例平均为66.60%. βsne最大值为0.7674,最小值为0,平均值为0.2313,βsne在βsor中的比例平均为33.40%.湖泊CH与LGH、YH、YLH、DTH,CHH和DTH之间的βsim值为1,表明相应湖泊对之间软体动物组成完全不同,相对应的湖泊对之间βsne值为0.除此之外,湖泊XYH和QLH、DTH,QLH和DTH,CHH和YH之间的βsne值也为0,即β多样性完全是由于物种周转.湖泊YH与EH、CBH、FXH之间的βsim值为0,表明这些湖泊对之间β多样性完全是由嵌套原因形成的.
根据配对计算的βsim、βsne和βsor值分别进行非度量多维尺度分析(NMDS)和聚类分析(UPGMA法)(图 2).利用βsim聚类分析表明,云南高原湖泊在0.55处分成3个类群,QSHH和CH为一群,YZH单独为一群,其余为一群. NMDS分析的应力函数值为0.1912,表明二维点阵图对原始距离有一定解释意义.利用βsne聚类分析表明,云南高原湖泊在0.25处分成3个类群,EH和FXH为1群,DCH单独为一群,其余为一群.其NMDS分析的应力函数值为0.0873,表明二维点阵图是较好的排序,可以较好地反映云南高原湖泊软体动物分布的关系.利用βsor聚类分析表明,云南高原湖泊在0.75处分成2个类群,第1群有QSHH、CHH和CH,其余12个湖泊为第2群. NMDS分析的应力函数值为0.1306,表明二维点阵图对原始距离有参考作用.
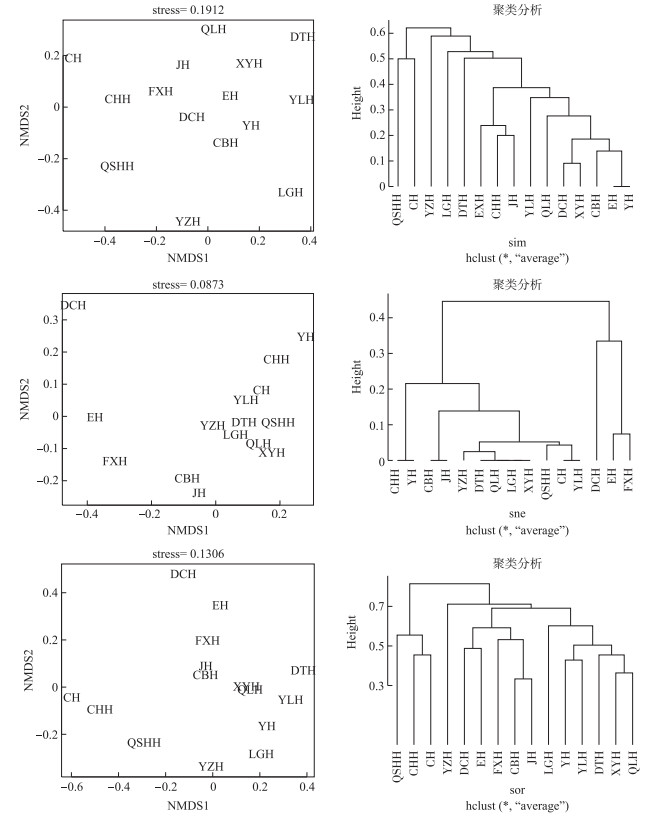
|
图 2 基于Sørensen指数算法的βsim, βsne and βsor NMDS分析和聚类分析 Fig.2 NMDS analysis and cluster analysis of βsim, βsne and βsor based on Sørensen index |
采用Jaccard指数进行配对方法计算,结果显示β多样性及其周转和嵌套组分分布形式与Sørensen指数计算结果分布基本一致(图 3).不同湖泊对的软体动物βjac最大值为1,最小值为0.5,平均值为0.8080. βjtu最大值为1,最小值为0,平均值为0.5939,βjtu在βjac中的比例平均为73.55%. βjne最大值为0.8684,最小值为0,平均值为0.2142,βjne在βjac中的比例平均为26.45%.各湖泊对间完全的周转或完全的嵌套格局与Sørensen指数计算结果一致.利用配对计算的βjtu、βjne和βjac值分别进行非度量多维尺度分析(NMDS)和聚类分析(UPGMA法)的结果(图 4)也与Sørensen指数分析结果基本一致.
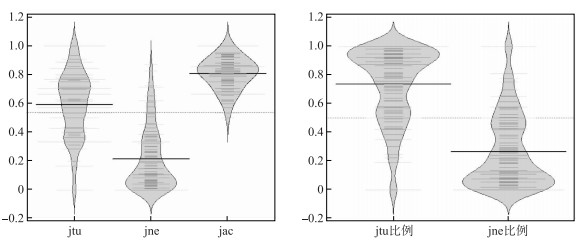
|
图 3 基于Jaccard指数算法的βjtu和βjne及其在βjac中所占比例分布 Fig.3 Distribution of βjtu, βjne and their proportion in βjac based on Jaccard index |
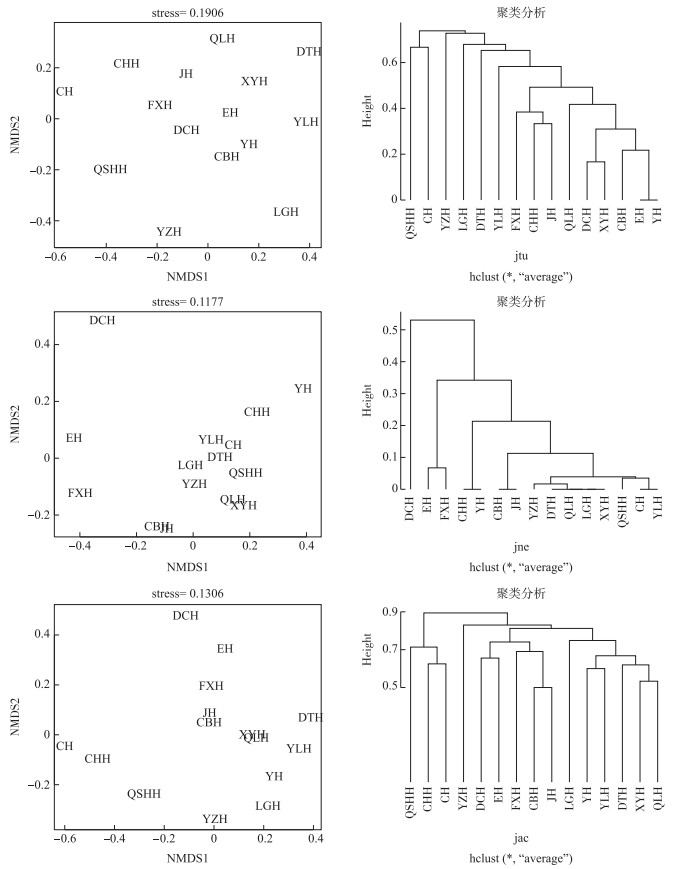
|
图 4 基于Jaccard指数算法的βjtu, βjne and βjac NMDS分析和聚类分析 Fig.4 NMDS analysis and cluster analysis of βjtu, βjne and βjac based on Jaccard index |
软体动物类群的繁殖方式、摄食方式、扩散能力以及对栖息地环境要求等多种因素决定了软体动物的群落结构[31],从而影响软体动物的β多样性.
物种形成、扩散、生态位选择和生态随机漂变4个基本过程通过单独或综合作用影响着区域和局域物种多样性,从而来决定β多样性[32],此次研究表明,瓣鳃类β多样性高于腹足类,可能原因有两个方面,一是云南高原湖泊中瓣鳃类主要分布在底质为草渣加淤泥或者粉砂的水域[18, 24],而螺类在水草区、无水草的较深水域以及粗砂、砾石区域分布[22],因而和腹足类相比,瓣鳃类分布范围更窄.另外,瓣鳃类一般营半底埋生活,运动扩散能力比腹足类弱,因而β多样性更高.千岛湖中小岛繁殖鸟类和蜥蜴β多样性研究结果也表明,扩散能力弱的蜥蜴因局部灭绝使得嵌套导致的β多样性值更高[7],因而运动能力差的物种一般容易形成比较高的β多样性[33].
在一定程度内,研究区域越大,相应的环境异质性可能增加,因而导致β多样性增大[8].此次研究的15个湖泊分别属于金沙江水系(4个湖泊)、澜沧江水系(3个湖泊)、南盘江水系(6个湖泊)和元江水系(2个湖泊).其中金沙江水系湖泊软体动物β多样性最高(Sørensen和Jaccard指数法分别为0.8827和0.9377),元江水系β多样性最低(0.5000和0.6667).不同水系湖泊软体动物β多样性不同可能与2个因素有关:一个因素是研究区域湖泊数量[10].不同水系用于β多样性分析的湖泊数多寡不同.为了消除不同水系湖泊数量不同而带来的β多样性计算上的差异,以样本数为2(元江水系只有2个湖泊)对金沙江水系、澜沧江水系、南盘江水系进行抽样100次计算[29],则不同流域平均总β多样性(βSOR)从大到小依此为金沙江水系(0.7668)、南盘江水系(0.6888)、元江水系(0.5000)和澜沧江水系(0.4563).可见金沙江水系、澜沧江水系、南盘江水系总β多样性值有所降低,并且澜沧江水系要低于元江水系.但重抽样计算后金沙江水系总β多样性仍最大,说明金沙江水系湖泊软体动物在较小区域(2个湖泊)和较大区域(4个湖泊)都有较高的β多样性.另一个因素是区域内物种数组成差异.在金沙江水系,虽然湖泊数量少于南盘江水系,但湖泊间软体动物物种数差异大而导致β多样性值增加.在金沙江水系的4个湖泊中,滇池记录有软体动物种类83种,远高于其他湖泊,其他湖泊中分布的种类基本在滇池都有分布,因此由于嵌套而形成的β多样性在总β多样性中比例高,也远高于其他水系.
从湖泊深度类型来看,深水型湖泊总β多样性大于浅水型湖泊.以样本数为6(深水型湖泊数)对浅水型湖泊抽样100次计算[29],总β多样性(βSOR)平均为0.7910,和未抽样计算结果一致,浅水型湖泊软体动物β多样性小于深水型湖泊.但在浅水型湖泊中,由于嵌套而导致的β多样性在总β多样性的比例明显高于深水型湖泊,这也可能是浅水型湖泊滇池软体动物种类多的原因.
由于云南高原湖泊在形态、底质、水化学特征以及生物组成等各方面不同[12],因而导致云南湖泊软体动物β多样性变化的具体原因还有待进一步研究.
Baselga[5-6]将β多样性分解成周转和嵌套两部分,在多位点分析云南高原湖泊软体动物β多样性时,周转成分所占的比例均大于嵌套成分,表明β多样性主要是由于软体动物物种在空间上的相互替换形成的.在配对的β多样性分析时,周转和嵌套成分具有0值出现,表明湖泊对之间存在完全的周转和完全的嵌套格局.周转成分为0值,说明软体动物贫乏的湖泊中的物种在软体动物丰富的湖泊中也全部出现,是其一个真正的子集.嵌套成分为0值,主要有2种原因:一是两个湖泊所分布的软体动物物种数相等时,即b=c时,Sørensen指数:(b+c)/(2a+b+c) =b/(b+a),βsor =βsim;Jaccard指数:(b+c)/(a+b+c) =2b/(2b+a),βjac =βjtu.二是两个湖泊中软体动物物种完全不同,即a=0,Sørensen指数:(b+c)/(b+c) =b/b,βsor =βsim;Jaccard指数:(b+c)/(b+c) =2b/2b,βjac =βjtu.
我们采用Baselga提出的利用Sørensen指数和Jaccard指数计算、分解β多样性,虽然在具体数值上有些差异,但两个指数计算的结果总体趋势是一致的.利用Sørensen指数和Jaccard指数的计算结果进一步进行NMDS非约束性排序分析和聚类分析(UPGMA法)得到的结论也相同,反映了这两个指数均是Whittaker提出的比例β多样性的单调转换.
云南高原湖泊具有独特的自然地理环境,其具有的丰富资源对经济发展和人民生活水平提高有重要作用,因而也就面临着巨大的环境压力[34].人类活动对物种β多样性也有多方面的影响,有研究表明,人类农业活动会造成河流生境同质化,在微栖息地尺度上造成水生昆虫β多样性降低[35];自然的选择压主要使得大型底栖生物β多样性周转成分发生变化,而人为的选择压主要使嵌套组分发生变化[9].对云南高原15个湖泊软体动物β多样性研究表明,该区域软体动物β多样性值较高.但由于环境变化、生态入侵等多种原因,云南高原部分湖泊软体动物种类减少[36],区系组成也在发生着变化[37-38],相应地β多样性也会发生变化,因此要注意对云南高原湖泊软体动物多样性的保护.针对不同水系(局域)湖泊软体动物β多样性及其组分组成特点,嵌套组分比例大的可采取重点区域保护,而周转比例大的要采取多区域保护,或者两者相结合.
| [1] |
Whittaker RH. Vegetation of the Siskiyou Mountains, Oregon and California. Ecological Monographs, 1960, 30: 279-338. DOI:10.2307/1943563 |
| [2] |
Anderson MJ, Crist TO, Chase JM et al. Navigating the multiple meanings of β diversity:a roadmap for the practicing ecologist. Ecology Letters, 2011, 14: 19-28. DOI:10.1111/j.1461-0248.2010.01552.x |
| [3] |
Koleff P, Gaston KJ, Lennon JJ. Measuring beta diversity for presence-absence data. Journal of Animal Ecology, 2003, 72: 367-382. DOI:10.1046/j.1365-2656.2003.00710.x |
| [4] |
Hanna T. A diversity of beta diversities:straightening up a concept gone awry, Part 1. Defining beta diversity as a function of alpha and gamma diversity. Ecography, 2010, 33: 2-22. DOI:10.1111/eco.2010.33.issue-1 |
| [5] |
Baselga A. Partitioning the turnover and nestedness components of beta diversity. Global Ecology and Biogeography, 2010, 19: 134-143. DOI:10.1111/j.1466-8238.2009.00490.x |
| [6] |
Baselga A. The relationship between species replacement, dissimilarity derived from nestedness, and nestedness. Global Ecology and Biogeography, 2012, 21: 1223-1232. DOI:10.1111/j.1466-8238.2011.00756.x |
| [7] |
Si XF, Baselga A, Ding P. Revealing beta-diversity patterns of breeding bird and lizard communities on inundated land-bridge islands by separating the turnover and nestedness components. PLoS One, 2015, 18: 1-19. |
| [8] |
Langer TA, Murry BA, Pangle KL et al. Species turnover drivers β-diversity patterns across multiple spatial and temporal scales in Great Lake coastal wetland communities. Hydrobiologia, 2016, 777: 55-66. DOI:10.1007/s10750-016-2762-2 |
| [9] |
Gutiérrez-Cánovas C, Millán A, Velasco J et al. Contrasting effects of natural and anthropogenic stressors on beta diversity in river organisms. Global Ecology and Biogeography, 2013, 22: 796-805. DOI:10.1111/geb.12060 |
| [10] |
Warburton EM, van der Mescht L, Stanko M et al. Beta-diversity of ectoparasites at two spatial scales:nested hierarchy, geography and habitat type. Oecologia, 2017, 184: 507-520. DOI:10.1007/s00442-017-3876-6 |
| [11] |
Dong ZG, Li JL. Biodiversity and conservation of freshwater mollusks. Acta Hydrobiologica Sinica, 2004, 28(4): 440-444. [董志国, 李家乐. 淡水贝类生物多样性保育. 水生生物学报, 2004, 28(4): 440-444.] |
| [12] |
Li SH, Yu MJ, Li GZ et al. Limnological survey of the lakes of Yunnan Plateau. Oceanologia et Limnologia Sinica, 1963, 5(2): 87-114. [黎尚豪, 俞敏娟, 李光正等. 云南高原湖泊调查. 海洋与湖沼, 1963, 5(2): 87-114.] |
| [13] |
Wang WG, Wang LZ. Analysis on shell morphology and karyotype of Margarya monodi (Viviparidae). Sichuan Journal of Zoology, 2010, 29(4): 622-624. [王魏根, 王丽珍. 螺蛳属牟氏螺蛳的壳形及核型分析. 四川动物, 2010, 29(4): 622-624.] |
| [14] |
Ding CZ, Jiang XM, Xie ZC et al. Seventy-five years of biodiversity decline of fish assemblages in Chinese isolated plateau lakes:widespread introductions and extirpations of narrow endemics lead to regional loss of dissimilarity. Diversity and Distributions, 2017, 23: 171-184. DOI:10.1111/ddi.2017.23.issue-2 |
| [15] |
Wiersma YF, Urban DL. Beta diversity and nature reserve system design in the Yukon, Canada. Conservation Biology, 2005, 19(4): 1262-1272. DOI:10.1111/j.1523-1739.2005.00099.x |
| [16] |
Wright DH, Reeves JH. On the meaning and measurement of nestedness of species assemblages. Oecologia, 1992, 9: 416-428. |
| [17] |
Zhang L. A new species of genus Cipangopaludina from Dianchi Lake in Yunnan province, China (Mesocastropoda:Viviparidae). Acta Zootaxonomica Sinica, 1990, 15(1): 25-27. [张立. 云南滇池圆田螺属一新种(中腹足目:田螺科). 动物分类学报, 1990, 15(1): 25-27.] |
| [18] |
Huang BY, Zhou XD, Zhang NG et al. Distribution and environment of the Anodonta in Dianchi Lake of Yunnan province. Studia Marina Sinica, 1997, 39: 133-135. [黄宝玉, 周晓丹, 张遒光等. 云南滇池无齿蚌的分布与环境. 海洋科学集刊, 1997, 39: 133-135.] |
| [19] |
Wang LZ. A reseach of bigger invertebrates in Yunnan Dianchi Lake. Journal of Yunnan University, 1985, 7(Supplement): 73-84. [王丽珍. 滇池的大型无脊椎动物. 云南大学学报, 1985, 7(增刊): 73-84.] |
| [20] |
Zhang NG, Hao TX, Wu CY et al. Primary investigation of freshwvater gastropoda in Yunnan province. Studia Marina Sinica, 1997, 39: 15-26. [张遒光, 郝天锡, 吴春云等. 云南省淡水腹足类的初步调查. 海洋科学集刊, 1997, 39: 15-26.] |
| [21] |
Wang LZ. An ecological study on mollusca population in plateau lakes of Yunnan. Journal of Yunnan University, 1988, 10(Supplement): 37-43. [王丽珍. 云南高原湖泊贝类种群的生态学研究. 云南大学学报, 1988, 10(增刊): 37-43.] |
| [22] |
Zhang L. On the snails belonging to Viviparidae (Mesogastropoda) from the major lakes in Yunnan province. In: Chinese Society of Malacology ed. Transactions of the Chinese Society of Malacology (NO. 4). Qingdao: Qingdao Ocean University Press, 1993: 69-75. [张立. 云南主要湖泊的田螺科种类. 见: 中国贝类学会编. 贝类学论文集(第四辑). 青岛: 青岛海洋大学出版社, 1993: 69-75. ]
|
| [23] |
Wang LZ. The species component and distribution of zoobenthos in Qingshuihai Lake, Xundian County. Journal of Yunnan University, 1988, 10(Supplement): 154-157. [王丽珍. 寻甸清水海底栖动物种群结构及分布. 云南大学学报, 1988, 10(增刊): 154-157.] |
| [24] |
Huang BY, Zhang L. Freshwater lamellibranches from Erhai and Cibihu Lakes of Yunnan province China. Memoirs of Nanjing Institute of Geography, Academia Sinica, 1984, 2: 36-46. [黄宝玉, 张立. 云南洱海、茈碧湖淡水瓣鳃类. 中国科学院南京地理研究所集刊, 1984, 2: 36-46.] |
| [25] |
Zhang L. Freshwater gastropods from Erhai lake in Yunnan province China. Memoirs of Nanjing Institute of Geography, Academia Sinica, 1985, 3: 40-48. [张立. 云南洱海淡水腹足类. 中国科学院南京地理研究所集刊, 1985, 3: 40-48.] |
| [26] |
Wang LZ. Macrozoobenthos in Yunnan Fuxianhu Lake. Yunnan Fisheries, 1995(2): 30-36. [王丽珍. 抚仙湖的底栖生物. 云南水产, 1995(2): 30-36.] |
| [27] |
Yang LF. The preliminary study on the original classification and distribution law of lakes on the Yunnan Plateau. Transactions of Oceanology and Limnology, 1984, 1: 34-39. [杨留法. 云南高原湖泊的成因类型及其分布规律的初步探讨. 海洋湖沼通报, 1984, 1: 34-39.] |
| [28] |
R Development Core Team ed. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. http://www.R-project.org/. 2016.
|
| [29] |
Baselga A, Orme CDL. Betapart:an R package for the study of beta diversity. Methods in Ecology and Evolution, 2012, 3(5): 808-812. DOI:10.1111/j.2041-210X.2012.00224.x |
| [30] |
Kampstra P. Beanplot:a boxplot alternative for visual comparison of distributions. Journal of Statistical Software, 2008, 28(c01): 1-9. |
| [31] |
Kolodziejczyk A, Lewandowski K, Stanczykowska A. Long-term changes of mollusk assemblages in bottom sediments of small semi-isolated lakes of different trophic state. Polish Journal of Ecology, 2009, 57: 331-339. |
| [32] |
Soininen J, Lennon JJ, Hillebrand H. A multivariate analysis of beta diversity across organisms and environments. Ecology, 2007, 88(11): 2830-2838. DOI:10.1890/06-1730.1 |
| [33] |
Silva VXD, Sacramento M, Hasui É et al. Taxonomic groups with lower movement capacity may present higher beta diversity. Iheringia Série Zoologia, 2016, 107: e2017005. |
| [34] |
Li CH, Zhang ST, Ye XC. Problems of development and protection of lakes on Yunnan Plateau. Yunnan Geology, 2005, 24(4): 462-470. [李春卉, 张世涛, 叶许春. 云南高原湖泊面临的保护与开发问题. 云南地质, 2005, 24(4): 462-470.] |
| [35] |
Sueyoshi M, Ishiyama N, Nakamura F. β-diversity decline of aquatic insects at the microhabitat scale associated with agricultural land use. Landscape and Ecological Engineering, 2016, 12: 187-196. DOI:10.1007/s11355-015-0283-1 |
| [36] |
Du LN, Li Y, Chen XY et al. Effect of eutrophication on molluscan community composition in the Lake Dianchi (China, Yunnan). Limnologica, 2011, 41: 213-219. DOI:10.1016/j.limno.2010.09.006 |
| [37] |
Du LN, Chen XY, Yang JX et al. A survey of molluscan compositions in four plateau lakes, northwest Yunnan, China. Journal of Hydroecology, 2012, 33(6): 44-49. [杜丽娜, 陈小勇, 杨君兴等. 滇西北四大高原湖泊软体动物现状调查. 水生态学杂志, 2012, 33(6): 44-49.] |
| [38] |
Xiong F, Li WC, Pan JZ. Species composition and spatial distribution of benthic mollusk in Fuxian Lake. Chinese Journal of Ecology, 2008, 27(1): 122-125. [熊飞, 李文朝, 潘继征. 抚仙湖底栖软体动物的种类组成与空间分布. 生态学杂志, 2008, 27(1): 122-125.] |
 2018, Vol. 30
2018, Vol. 30 
