(2: 江苏省地理信息资源开发与利用协同创新中心, 江苏省环境演变与生态建设重点实验室, 江苏省水土环境生态修复工程实验室, 南京 210023)
(2: Jiangsu Center for Collaborative Innovation in Geographical Information Resource Development and Application, Jiangsu Key Laboratory of Environmental Change and Ecological Construction, Jiangsu Engineering Laboratory of Water and Soil Eco-remediation, Nanjing 210023, P. R. China)
内陆淡水生态系统在全球温室气体排放量中具有重要贡献, 全球淡水生态系统甲烷(CH4)排放量折算为二氧化碳(CO2)量甚至能够抵消陆地生态系统碳吸收量的25%[1-2].湖泊作为内陆水圈的重要组成部分[3], 流域尺度上由自然或者人为活动向湖泊输入的营养负荷都会导致湖泊生态系统碳、氮等的积累[4].对于湖泊生态系统来说, 任何加速有机质转化的因子都会对湖泊生物地球化学循环产生重要影响, 同时也会促进温室气体在湖泊水—气界面的交换[5]. CH4和氧化亚氮(N2O)作为大气中重要的温室气体, 在湖泊沉积物和水体中均存在产生和消耗的过程[5].尽管湖泊面积占地球陆地表面积仅为3.7%[6], 但其在全球碳循环以及气候调控中具有不可忽略的重要作用[2, 7-8].因此, 湖泊温室气体的产生和消耗过程对大气中温室气体的浓度以及热量收支具有重要意义[7].近年来, 关于富营养化湖泊温室气体的产生、排放等问题也逐渐成为研究热点.
关于湖泊温室气体排放通量的相关问题国外研究者开展得较早, 并取得了一系列的研究成果. Bastviken等[9]通过对全球湖泊CH4排放量进行估算, 结果表明, 湖泊CH4排放量相对CO2来说较小, 为8~48 Tg C/a, 同时在对全球CH4排放量的估算过程中应当把湖泊这一重要排放源考虑进去. Huttunen等[10]对芬兰一些湖泊CH4的排放进行研究, 结果表明, 湖泊的营养状态、冬季水体的含氧量以及冰面覆盖对来年春季CH4的排放具有重要影响, 冬季冰面覆盖时期产生的CH4在冰融化时会向大气释放(3.6~7.9 g CH4/m2).此外, 在温室气体排放途径[9]、影响因素[11-13]等方面也取得了相关成果.国内学者Wang等[14-15]对太湖梅梁湾CH4和N2O排放通量的研究表明, CH4排放量最高达到131 mg CH4/(m2·h), 湖泊近岸带N2O排放量最高, 达到2101 μg N2O/(m2·h). Xing等[16]对武汉东湖CH4排放通量的研究表明, CH4平均排放通量为332.3±160.1 mg/(m2·d), 其排放通量在夏季达到最高.
现有的大多数研究采用静态箱法对湖泊近岸带温室气体排放通量进行观测, 而对于开阔湖区, 由于风浪扰动较大, 静态箱法不便于操作.除静态箱观测法外, 顶空平衡法也是较为常用的方法之一, 虽然其不能像静态箱法一样直接反映温室气体从水体向大气排放的量, 但是按照基本理论, 水中温室气体向大气发生交换的前提条件是气体在两相之间存在浓度梯度.除浓度梯度外, 水中温室气体向大气的交换速率受气体扩散系数的影响, 该扩散系数与水体扰动密切相关, 如风速[9]等.因此, 气体在表层水体的溶存浓度及饱和度在一定程度上能够反映出气体向大气迁移的潜力.本研究选择我国典型富营养化浅水湖泊太湖作为研究对象, 采用顶空平衡法对竺山湾和太湖西岸近岸带表层水体CH4和N2O两种温室气体的浓度进行测定, 同时计算了两种温室气体在水中的饱和度, 分析其与水质指标之间的关系, 为今后太湖温室气体排放的深入研究提供参考.
1 材料与方法 1.1 采样点位于2017年8月在太湖竺山湾和西岸近岸带共采集27个样品, 其中点位1和2均位于西岸芦苇带的槽沟内, 蓝藻水华在外力作用下常在此聚集堆积.相比于其他点位, 点位1和2的蓝藻水华聚集严重, 其中样点2最为严重.点位3~27均为开阔湖区, 无明显蓝藻堆积(图 1).虽然太湖蓝藻水华在4—5月份已经形成, 如果开展整个蓝藻水华从形成—暴发—衰亡整个过程中的研究更具有代表性, 但是本研究所选择的区域为富营养化较为严重的竺山湾和太湖西岸, 采样时间为8月份, 此时调查区域蓝藻水华仍然较为严重, 温度较高, 研究范围较广, 采样点位较多, 而且近岸带和开阔湖区区域本身蓝藻生物量具有一定差异, 增强了研究结果的可靠性.
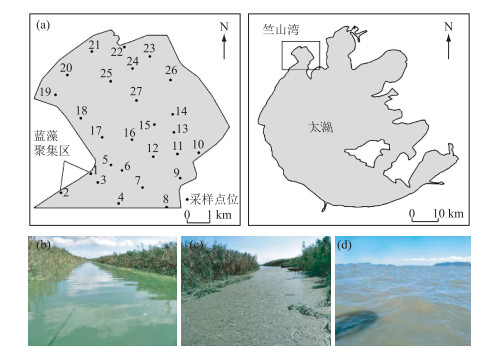
|
图 1 采样点位示意图(a)以及现场图(b:点位1;c:点位2;d:点位3~27) Fig.1 Sampling sites (a) and field pictures of sampling sites 1 (b), 2 (c) and 3-27 (d) |
到达点位后, 尽量避免对水体造成过多的扰动, 用针筒注射器缓慢吸取表层0~10 cm的水样, 注入23 ml预先加入0.05 ml HgCl2的血清瓶中, 迅速用塞子和盖子密封, 避光低温保存, 待测两种温室气体, 每个点做3个平行, 并用1 L水样瓶采集表层水样用于测定营养盐浓度.水体温度、pH、溶解氧(DO)、氧化还原电位(ORP)、电导率(EC)用便携式水质分析仪测定(YSL, USA).
水中溶解的温室气体浓度采样顶空平衡法测定.用5 ml超纯氮气(纯度99.9999%)置换血清瓶中的水样后, 25℃水浴加热, 剧烈摇晃2 min后, 用注射器抽取2 ml顶空气体注入气相色谱仪(Agilent 7890B, USA)中测定CH4和N2O含量.水样测定总氮(TN)、总磷(TP)、铵态氮(NH4+-N)、硝态氮(NO3--N)、溶解性有机碳(DOC)和磷酸盐(PO43--P)浓度等指标. TN、TP浓度采用碱性过硫酸钾联合消解法测定; NH4+-N、NO3--N和PO43--P浓度用连续流动分析仪(Auto Analyzer 3, 德国)测定, DOC浓度用TOC分析仪(岛津TOC-L, 日本)测定.
数据作图及分析分别采用Origin 8.5和SPSS 18.0软件.
1.3 水体温室气体浓度及饱和度的计算水中温室气体的饱和度计算公式为:
| $ R = {C_{{\rm{l}}}}/{C_{{\rm{eq}}}} \times 100 $ | (1) |
式中,R为温室气体在水中的饱和度(%), Cl为气体在水中的浓度, Ceq为与大气达到平衡时水中温室气体的理论平衡浓度, 利用两种气体在大气中的平均浓度及测得的水体温度, 参照Weiss等[17]和Wiesenburg等[18]的公式进行计算, 其中CH4和N2O在大气中的平均体积浓度为1.8×10-6和324.7×10-9(数据来源为中国气象局官网, 两种气体的平均值为2011年瓦里关大气本底站观测值).
水中温室气体的浓度等于气相浓度与平衡时液相气体浓度之和, 顶空内气体浓度由Dalton分压定律计算, 平衡时水中N2O浓度参照文献[17]计算, CH4浓度参照文献[18]计算, 具体的计算方式见文献[19].
2 结果与分析 2.1 表层水体温室气体浓度各点位表层水体溶解的温室气体浓度总体上表现为西岸蓝藻聚集区远远高于其他点位.其中点位2最高, CH4和N2O浓度分别为3.79± 0.095 μmol/L和0.078±0.003 μmol/L.湖面开阔区点位表层水体CH4和N2O浓度分别为0.019~0.24 μmol/L和0.011~0.53 μmol/L.蓝藻水华堆积区和开阔湖区CH4平均浓度分别为2.33±1.46 μmol/L和0.14±0.059 μmol/L, N2O的平均浓度分别为0.054±0.024 μmol/L和0.023±0.012 μmol/L.同时也不难看出, 除了蓝藻聚集区域外, 太湖竺山湾北部点位(点位21~24)和西部点位19表层水体的N2O浓度也较高(图 2).
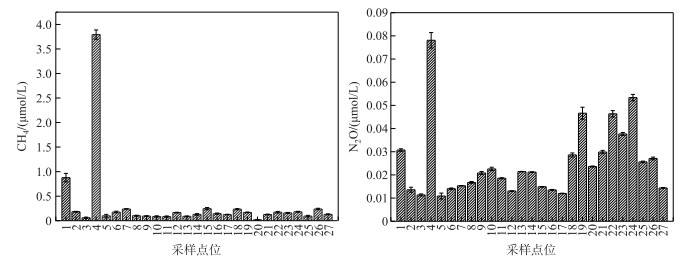
|
图 2 表层水体温室气体浓度 Fig.2 Concentrations of dissolved greenhouse gases in the surface water |
各点位两种温室气体在水中均呈为过饱和, 表明这两种温室气体均具有向大气迁移的潜力.两种气体在水中的饱和度与其在水体中浓度的空间差异一致.其中点位2水体的CH4和N2O饱和度最高, 分别为175797%和1220%, CH4的饱和度是N2O的144倍.西岸近岸点点位1的CH4饱和度也较高, 达到40694%和650%.此外, 竺山湾北部水体N2O饱和度较高.总体来看, 近岸带蓝藻水华聚集区两种温室气体的排放潜力较其他点位大, 竺山湾北部也可能是N2O较为重要的排放区域(图 3).
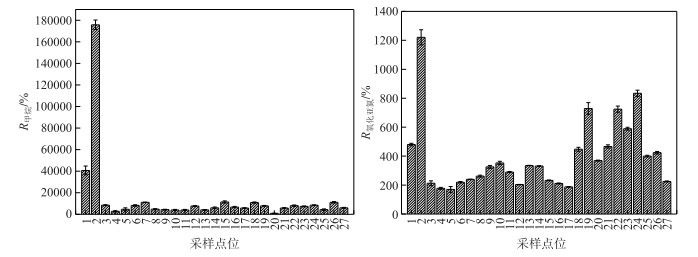
|
图 3 表层水体温室气体的饱和度 Fig.3 Saturations of dissolved greenhouse gases in the surface water |
总体来看, 西岸近岸点位1和2的营养盐浓度较高.其中TN、TP、NH4+-N和DOC浓度于点位2 (蓝藻水华聚集区域)达到最大值, 分别为8.90±0.02(平均值±标准差,下同)、2.90±0.02、5.98±0.05和103.6±0.01 mg/L, 而NO3--N浓度在点位2最低, 为0.006±0.004 mg/L.此外, 点位3由于采样时水面有蓝藻, 因此其TN和TP浓度也较高, 分别达到6.65±0.17和1.01±0.06 mg/L.点位5~27的NH4+-N浓度较低, 为0.041~0.17 mg/L.蓝藻聚集区(点位1和2)NO3--N浓度低于开阔湖区, 点位3~27的NO3--N浓度为0.63~2.39 mg/L.总体上看, 竺山湾西部点位19、北部点位(点位21~26)以及东部(点位13~15)NO3--N浓度较高.而各点的PO43--P浓度无明显变化规律, 其平均浓度为0.029~0.1 mg/L. DOC浓度在除点位2外的其他点位均较低, 平均值为12.15~28.9 mg/L(图 4).
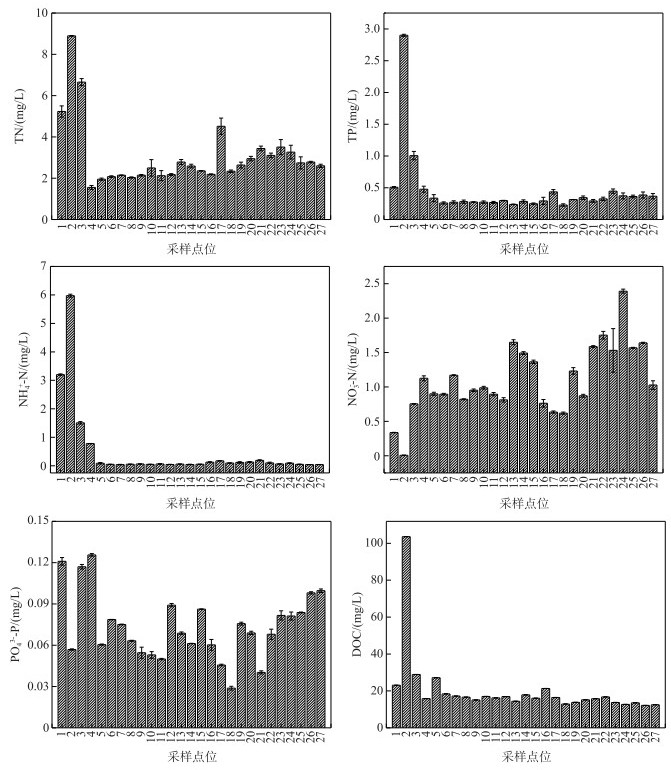
|
图 4 表层水体营养盐浓度 Fig.4 Concentrations of nutrients in the surface water |
水体中CH4和N2O浓度与TN、TP、NH4+-N和DOC浓度的相关性显著(P < 0.01,表 1). CH4浓度与DOC浓度相关性最为显著, 表明水中的DOC在微生物的代谢作用下可能会对CH4的产生具有重要影响.
| 表 1 表层水体温室气体浓度与水体环境因子之间的相关性分析 Tab.1 Correlations between dissolved greenhouse gas contents and environmental factors in the surface water |
本研究中, 湖泊近岸带点位两种温室气体浓度及饱和度高于开阔湖区点位, 表明湖泊近岸带在其温室气体排放过程中发挥着重要的作用, 具有非常大的排放潜力.湖泊近岸带是蓝藻水华聚集的主要场所, 太湖西岸芦苇群丛蓝藻聚集严重, 湖泊中产生的蓝藻水华在风力等外力的作用下常在此聚集、分解, 其分解过程会导致周边水体理化环境产生显著改变, 如低溶解氧、强烈的还原环境[14], 同时会释放大量的营养盐以及有机质[20].蓝藻从上覆水体沉降至表层沉积物的过程中, 会被水和沉积物中的细菌利用, 大大增加发酵型微生物丰度[21], 同时促进水体和沉积物异养微生物的生长[22].
CH4是有机质在厌氧条件下矿化的最终产物[23], 其产生过程需要利用3种类型微生物(水解细菌、产氢产乙酸细菌以及产甲烷细菌)[24].本研究中, 近岸带点位1和2水体CH4浓度和饱和度远远高于其他点位, 可能是因为这两个点位均位于近岸带芦苇群丛内, 蓝藻水华长期在此堆积(图 1b、c)、腐烂、分解, 并向水体中释放大量的有机质, 这些有机质在微生物的作用下被矿化; 同时, 沉降在沉积物中的蓝藻残体也会在微生物的作用下分解, 除了产生CO2以外, 还会产生CH4.以往的研究认为湖泊沉积物是CH4产生的重要场所, 但胡万婷等[25]通过对富营养化湖泊蓝藻水华分解中水体CH4浓度的动态研究, 表明CH4不仅来源于沉积物, 而且还可以由水体蓝藻分解过程中释放的有机质转化而来.沉积物产生的CH4并不是全部释放到大气中, 大部分在向上迁移的过程中会被以各种形式损耗, 如被O2氧化、厌氧氧化等.本研究表明, 太湖西岸近岸带蓝藻水华堆积区是CH4重要的潜在排放源, 这点与Wang等[14]的研究一致.此外, Juutinen等[26]对芬兰几个湖泊CH4排放的研究也表明, 湖泊近岸区域也是CH4排放的重要场所.本研究所有点位水体中CH4均为过饱和状态, 表明除近岸带以外, 开阔湖区也是CH4的潜在排放源.
N2O产生于微生物的硝化和反硝化过程中[27], 因此其在水体的浓度会受到NO3--N浓度的影响.而在厌氧及NO3--N浓度低的情况下, N2O会被反硝化细菌作为电子受体所消耗[28].有研究表明, 当水中NO3-浓度小于0.5 mg/L时, N2O的消耗就会进行[29].本研究中, 点位2水体N2O浓度仍然最高, 但是点位1并不均高于其他点位.已有研究表明, 蓝藻水华暴发会对湖泊氮循环产生重要影响, 因为大量蓝藻的存在, 其光合作用能够通过为硝化细菌提供O2, 而促进硝化反应, 间接为反硝化细菌提供充足的NO3--N, 因此, 在蓝藻水华暴发时, N2O的排放量很高[15, 30].此外, 研究发现, 由于竺山湾主要入湖河流为殷村港、漕桥河和太滆运河、雅浦港、环山河, 分别在竺山湾的西部、北部和东部区域, 这些河流的存在可能是导致点位13~15、19和21~25水体中NO3--N浓度较高的主要原因.研究表明, 太湖西部和北部入湖河流氮浓度明显高于对应湖区, 入湖河流携带的氮素进入湖泊, 从而影响湖泊水体营养盐浓度[31].同时, 位于殷村港、漕桥河和太滆运河附近的点位19、21~24表层水体中N2O浓度较高, 可能是由于入湖河流输入各种形态的氮素后, 在适宜条件下发生硝化和反硝化作用, 从而产生N2O, 但是由入湖河流输入的氮素对N2O产生的影响和机制需要进一步研究才能得出明确结论.
富营养化湖泊蓝藻水华暴发会对CH4和N2O产生具有重要影响. CH4和N2O浓度与TN、TP、NH4+-N、DOC浓度的相关性显著(P < 0.01), 其中CH4浓度与DOC浓度相关性最为显著, 表明水中的DOC在微生物的代谢作用下会对CH4的产生重要影响.众多研究均表明, CH4的产生与可利用性有机碳浓度有关[10, 32]. Xiao等[33]对太湖CH4排放的研究结果表明, 水体透明度、溶解氧浓度以及蓝藻和水生植被分布等均对CH4排放有重要影响.除DOC外, 水中CH4和N2O浓度与TP浓度呈显著正相关, 而磷作为限制水体初级生产力及衡量水体富营养化的重要因子, 表明水体富营养化程度的加剧或者水体初级生产力的提高, 可能对水体CH4和N2O的产生具有一定影响.但是TP对两种温室气体产生的影响可能是间接的, 即可能是通过促进蓝藻水华暴发而实现的, 但该过程的影响机制尚不明确, 需要开展深入的研究.
我国是一个多湖泊的国家, 全国共有1 km2以上的湖泊2759个, 其中约三分之一为淡水湖泊, 主要分布在东部沿海和长江中下游地区, 将近70%为浅水湖泊[34], 由于近几十年来的经济发展和对湖泊资源不合理的开发利用, 这些湖泊大多数已经成为富营养化湖泊或者有富营养化趋势[35].研究表明, 浅水湖泊对CH4排放具有重要影响.因为产生于厌氧沉积物中的CH4在向大气迁移的过程中, 能够在好氧的水柱中被氧化消耗.浅水湖泊相对于深水湖泊来说, CH4向大气迁移的时间较短, 因此其被氧化而消耗的量相对较少[36].结合本研究结果, 提出开展富营养化湖泊蓝藻水华对温室气体产生、排放的影响及机制研究对于未来我国湖泊生态系统温室气体排放的估算具有重要意义.
太湖近岸带蓝藻堆积区是CH4和N2O产生的热点区域, 尽管对这两种气体在水中饱和度的计算并不能直接反映出其向大气的排放通量, 因为水中温室气体向大气的排放通量与其在水—气界面的浓度梯度、风速、水体温度等因素有关, 但是气体在水中的饱和度能够在一定程度上反映出其向大气释放的潜力.此外, 如果想弄清楚太湖对两种温室气体究竟扮演的是源还是汇的角色, 还需要进行长时间、多点位的连续观测.
4 结论1) 太湖近岸带蓝藻堆积区表层水体CH4和N2O两种温室气体浓度和饱和度均高于开阔湖区, 表明太湖近岸带蓝藻水华堆积区是温室气体产生的热点区域, 具有较大的向大气迁移的潜力.
2) 入湖河流河口区域N2O浓度较高, 表明入湖河流的输入的氮源可能会促进水体N2O的产生, 但其机制需要进一步研究.
3) 表层水体温室气体浓度与水体理化指标关系密切, 其中CH4浓度与DOC浓度相关性最为显著, N2O浓度与TP浓度相关性最为显著; 研究揭示了蓝藻水华暴发可能对湖泊温室气体的产生具有重要影响, 但其产生过程和影响机制仍然需要进一步研究.
4) 基于本研究结果, 提出开展富营养化湖泊蓝藻水华对温室气体产生、排放的影响及机制研究对于未来我国湖泊生态系统温室气体排放的估算具有重要意义.
| [1] |
Bastviken D, Tranvik LJ, Downing JA et al. Freshwater methane emissions offset the continental carbon sink. Science, 2011, 331(6013): 50-50. DOI:10.1126/science.1196808 |
| [2] |
Cole JJ, Prairie YT, Caraco NF et al. Plumbing the global carbon cycle:integrating inland waters into the terrestrial carbon budget. Ecosystems, 2007, 10(1): 172-185. DOI:10.1007/s10021-006-9013-8 |
| [3] |
Wu QL, Xing P, Li HB et al. Impacts of regime shift between phytoplankton and macrophyte on the microbial community structure and its carbon cycling in lakes. Microbiology, China, 2013, 40(1): 87-97. [吴庆龙, 邢鹏, 李化炳等. 草藻型稳态转换对湖泊微生物结构及其碳循环功能的影响. 微生物学通报, 2013, 40(1): 87-97. DOI:10.13344/j.microbiol.china.2013.01.003] |
| [4] |
Carpenter SR, Caraco NF, Correll DL et al. Nonpoint pollution of surface waters with phosphorus and nitrogen. Ecological Applications, 1998, 8(3): 559-568. DOI:10.2307/2641247 |
| [5] |
Huttunen JT, Hammar T, Alm J et al. Greenhouse gases in non-oxygenated and artificially oxygenated eutrophied lakes during winter stratification. Journal of Environmental Quality, 2001, 30(2): 387-394. DOI:10.2134/jeq2001.302387x |
| [6] |
Verpoorter C, Kutser T, Seekell DA et al. A global inventory of lakes based on high-resolution satellite imagery. Geophysical Research Letters, 2014, 41(18): 6396-6402. DOI:10.1002/2014GL060641 |
| [7] |
Tranvik LJ, Downing JA, Cotner JB et al. Lakes and reservoirs as regulators of carbon cycling and climate. Limnology and Oceanography, 2009, 54(6part2): 2298-2314. DOI:10.4319/lo.2009.54.6_part_2.2298 |
| [8] |
Battin TJ, Kaplan LA, Findlay S et al. Biophysical controls on organic carbon fluxes in fluvial networks. Nature Geoscience, 2008, 1(2): 95-100. DOI:10.1038/ngeo602 |
| [9] |
Bastviken D, Cole J, Pace M et al. Methane emissions from lakes:Dependence of lake characteristics, two regional assessments, and a global estimate. Global Biogeochemical Cycles, 2004, 18(4): GB4009. DOI:10.1029/2004GB002238 |
| [10] |
Huttunen JT, Alm J, Saarijärvi E et al. Contribution of winter to the annual CH4 emission from a eutrophied boreal lake. Chemosphere, 2003, 50(2): 247-250. DOI:10.1016/S0045-6535(02)00148-0 |
| [11] |
Gudasz C, Bastviken D, Steger K et al. Temperature-controlled organic carbon mineralization in lake sediments. Nature, 2010, 466(7305): 478-481. DOI:10.1038/nature09186 |
| [12] |
Walter Anthony KM, Vas DA, Brosius L et al. Estimating methane emissions from northern lakes using ice-bubble surveys. Limnology & Oceanography Methods, 2010, 8(6): 592-609. |
| [13] |
Marotta H, Pinho L, Gudasz C et al. Greenhouse gas production in low-latitude lake sediments responds strongly to warming. Nature Climate Change, 2014, 4(6): 467-470. DOI:10.1038/NCLIMATE2222 |
| [14] |
Wang H, Lu J, Wang W et al. Methane fluxes from the littoral zone of hypereutrophic Taihu Lake, China. Journal of Geophysical Research-Atmospheres, 2006, 111(D17): 4093-4100. DOI:10.1029/2005JD006864 |
| [15] |
Wang H, Wang W, Yin C et al. Littoral zones as the "hotspots" of nitrous oxide (N2O) emission in a hyper-eutrophic lake in China. Atmospheric Environment, 2006, 40(28): 5522-5527. DOI:10.1016/j.atmosenv.2006.05.032 |
| [16] |
Xing Y, Xie P, Yang H et al. Methane and carbon dioxide fluxes from a shallow hypereutrophic subtropical Lake in China. Atmospheric Environment, 2005, 39(30): 5532-5540. DOI:10.1016/j.atmosenv.2005.06.010 |
| [17] |
Weiss RF, BA Price. Nitrous oxide solubility in water and seawater. Marine Chemistry, 1980, 8(4): 347-359. DOI:10.1016/0304-4203(80)90024-9 |
| [18] |
Wiesenburg DA, Guinasso Jr NL. Equilibrium solubilities of methane, carbon monoxide, and hydrogen in water and sea water. Journal of Chemical and Engineering Data, 1979, 24(4): 356-360. DOI:10.1021/je60083a006 |
| [19] |
Yao XL, Xu HX, Tang CJ et al. Denitrification potential of high suspend sediments in Poyang Lake, China. China Environmental Science, 2015, 35(3): 846-855. [姚晓龙, 徐会显, 唐陈杰等. 鄱阳湖水体悬浮物反硝化潜力模拟研究. 中国环境科学, 2015, 35(3): 846-855.] |
| [20] |
Yan X, Xu X, Wang M et al. Climate warming and cyanobacteria blooms:Looks at their relationships from a new perspective. Water Research, 2017, 125: 449-457. DOI:10.1016/j.watres.2017.09.008 |
| [21] |
Chen M, Li XH, He YH et al. Increasing sulfate concentrations result in higher sulfide production and phosphorous mobilization in a shallow eutrophic freshwater lake. Water Research, 2016, 96: 94-104. DOI:10.1016/j.watres.2016.03.030 |
| [22] |
Komada T, Burdige DJ, Crispo SM et al. Dissolved organic carbon dynamics in anaerobic sediments of the Santa Monica Basin. Geochimica et Cosmochimica Acta, 2013, 110(3): 253-273. DOI:10.1016/j.gca.2013.02.017 |
| [23] |
Duc NT, Crill P, Bastviken D. Implications of temperature and sediment characteristics on methane formation and oxidation in lake sediments. Biogeochemistry, 2010, 100(1/2/3): 185-196. DOI:10.1007/s10533-010-9415-8 |
| [24] |
Lay JJ, Miyahara T, Noike T. Methane release rate and methanogenic bacterial populations in lake sediments. Water Research, 1996, 30(4): 901-908. DOI:10.1016/0043-1354(95)00254-5 |
| [25] |
Hu WT, Tang Q, Sun W et al. Dissovled methane dynamics during the degradation of organic matter derived from cyanobacterial bloom. China Environmental Science, 2017, 37(2): 702-710. [胡万婷, 唐千, 孙伟等. 水体中蓝藻水华分解产甲烷动态过程研究. 中国环境科学, 2017, 37(2): 702-710.] |
| [26] |
Juutinen S, Alm J, Larmola T et al. Major implication of the littoral zone for methane release from boreal lakes. Global Biogeochemical Cycles, 2003, 17(4): 1117. DOI:10.1029/2003GB002105 |
| [27] |
Seitzinger SP. Denitrification in freshwater and coastal marine ecosystems:ecological and geochemical significance. Limnology and Oceanography, 1988, 33(4part2): 702-724. DOI:10.4319/lo.1988.33.4part2.0702 |
| [28] |
Usui T, Koike I, Ogura N. N2O production, nitrification and denitrification in an estuarine sediment. Estuarine Coastal & Shelf Science, 2001, 52(6): 769-781. DOI:10.1006/ecss.2000.0765 |
| [29] |
Johansson AE, Kasimir Klemedtsson Å, Klemedtsson L et al. Nitrous oxide exchanges with the atmosphere of a constructed wetland treating wastewater. Tellus Series B-chemical & Physical Meteorology, 2003, 55(3): 737-750. DOI:10.3402/tellusb.v55i3.16363 |
| [30] |
Jørgensen CJ, Struwe S, Elberling B. Temporal trends in N2O flux dynamics in a Danish wetland-effects of plant-mediated gas transport of N2O and O2 following changes in water level and soil mineral-N availability. Global Change Biology, 2012, 18(1): 210-222. DOI:10.1111/j.1365-2486.2011.02485.x |
| [31] |
Gao YX, Cai LL, Zhao LL et al. Water quality comparison between lake Taihu and contribute river during high water-level period. Environmental Science, 2011, 32(10): 2840-2848. [高永霞, 蔡琳琳, 赵林林等. 丰水期环太湖河流与湖区水质比较研究. 环境科学, 2011, 32(10): 2840-2848. DOI:10.13227/j.hjkx.2011.10.025] |
| [32] |
King GM, Wiebe WJ. Methane release from soils of a Georgia salt marsh. Geochimica et Cosmochimica Acta, 1978, 42(4): 343-348. DOI:10.1016/0016-7037(78)90264-8 |
| [33] |
Xiao Q, Zhang M, Hu Z et al. Spatial variations of methane emission in a large shallow eutrophic lake in subtropical climate. Journal of Geophysical Research Biogeosciences, 2017, 122(7): 1-18. DOI:10.1002/2017JG003805 |
| [34] |
Wang SM, Dou HS. Chinese lakes. Beijing: Science Press, 1998, 3-21. [王苏民, 窦鸿身. 中国湖泊志. 北京: 科学出版社, 1998, 3-21.]
|
| [35] |
Qin BQ. Approaches to mechanisms and control of eutrophication of shallow lakes in the middle and lower reaches of the Yangtze River. J Lake Sci, 2002, 14(3): 193-202. [秦伯强. 长江中下游浅水湖泊富营养化发生机制与控制途径初探. 湖泊科学, 2002, 14(3): 193-202. DOI:10.18307/2002.0301] |
| [36] |
Bastviken D, Cole JJ, Pace ML et al. Fates of methane from different lake habitats:Connecting whole-lake budgets and CH4 emissions. Journal of Geophysical Research Biogeosciences, 2008, 113(G02024): 61-74. DOI:10.1029/2007JG000608 |
 2018, Vol. 30
2018, Vol. 30 

