(2: 重庆师范大学地理与旅游学院, 重庆 401331)
(3: 重庆大学煤矿灾害动力学与控制国家重点实验室, 重庆 400030)
(4: 重庆大学资源及环境科学学院, 重庆 400030)
(5: 重庆师范大学生命科学学院, 重庆 401331)
(2: College of Geography and Tourism, Chongqing Normal University, Chongqing 401331, P. R. China)
(3: State Key Laboratory of Coal Mine Disaster Dynamics and Control, Chongqing University, Chongqing 400030, P. R. China)
(4: College of Resource and Environmental Science, Chongqing University, Chongqing 400030, P. R. China)
(5: College of Life Sciences, Chongqing Normal University, Chongqing 401331, P. R. China)
随着全球气候变化趋势日益增强,温室气体排放一直是科学界研究的热点.氧化亚氮(N2O)是重要的温室气体之一,尽管大气中含量较低,但其百年温室效应潜势是CO2的298倍[1],且能够与臭氧反应进而破坏臭氧层[2].因此N2O“源-汇”研究受到越来越多关注.据估算,N2O对全球变暖的贡献率约为6.4 % [3],且大气中N2O含量以每年0.3 %的速率增加[4],研究自然过程和人为活动的N2O排放对有效调控全球N2O平衡具有重要意义.水生生态系统作为陆源及人为源氮素的“汇”,是全球氮素地球化学循环的“生物反应器”,并向大气中排放大量的N2O.其中,湖、库作为目前分布广泛、水文条件特殊的内陆淡水水体,在全球N2O排放中具有不可忽视的作用.据估算,全球湖、库系统N2O排放量高达0.78 Tg/a[5],占全球淡水生态系统N2O排放总量的71 % [6].随着人类氮肥生产与使用对全球氮循环影响不断增强,湖、库系统中氮素富集已经成为潜在的N2O排放热点[7-9].然而,湖、库水体中氮素来源及转化过程极为复杂,受到自然与人为因素的多重影响.随着全球环境变化与人类活动不断加剧,湖、库水体N2O产生、排放过程,时空特征及驱动机制等方面研究对认识湖、库生态系统功能具有重要意义.
目前,研究者对湖、库水体N2O排放的研究主要集中在:(1)N2O排放时空变异特征及调控机制[5, 10-14];(2)特殊水文区(如水陆交错区、水生植物生长区、水库消落区等)N2O排放[7-8, 15-17];(3)富营养化或污染性湖、库N2O产生与排放过程[18-19]等,少数研究者开展了区域湖、库群N2O排放的比较研究和总量估算.然而,这些研究存在明显的地域集中特征,湖泊研究主要分布在北欧[7, 20-21]、北美[22]等地区,水库则主要集中在热带[23-24]和高纬度地区[25-26].从全球尺度上看,研究仍然非常薄弱,特别是亚洲地区研究明显落后与其他区域.我国在湖、库N2O排放研究近年来取得了一定进展,在太湖[8, 16, 18, 27]、鄱阳湖[14, 28]、三峡水库[15]、密云水库[10]及青藏高原区湖泊[9, 29-30]等都进行了N2O排放的相关研究,但多数仍处于初步探索阶段,缺乏从区域尺度,尤其是人类活动干扰差异角度的湖、库系统N2O排放研究.为了进一步完善湖、库系统氮循环基本理论,加深对近年来国内外湖、库氮排放研究,进而推进湖、库系统N2O排放的调控机制研究,本研究从湖、库生态系统N2O生物转化过程切入,总结湖、库水体N2O产生和排放过程,并从不同时空尺度综述湖、库生态系统N2O排放的变异特征,归纳湖、库生态系统N2O关键影响因素,进而提出现阶段湖、库生态系统N2O的研究在微生物产生机制、研究区域的典型性、人类活动干扰下排放特征、监测方法不确定性等方面的不足,对未来的研究提出展望.
1 湖、库水体N2O产生和排放过程湖、库水体中的氮素主要源于上游河流输入、陆源氮素随地表径流输入以及污水排放输入,极少部分源于水生植物的固氮作用.自然湖、库不断接纳和储存陆源氮素,并不断在沉积层累积,在微生物作用下参与生物地化循环并产生N2O.自然水体中N2O产生速率较低,不易形成气泡[31],因此主要排放途径包括扩散、植物传输,仅在有机质及氮素丰富的水体存在少量气泡排放(图 1)[32].此外,人为污水排放也可能直接携带N2O进入湖、库水体,成为污染型湖、库N2O排放的重要来源.湖、库水体N2O产生与排放是一个生物转化与多界面传输的综合过程[14, 18, 33],一方面需要厘清N2O的微生物产生过程,另一方面需要关注不同界面(水-陆界面、沉积物-上覆水界面、水-气界面、地下水-潜流界面等)N2O相对通量,才能够更准确地构建不同类型湖、库N2O排放模型,进而有效预测其排放强度.
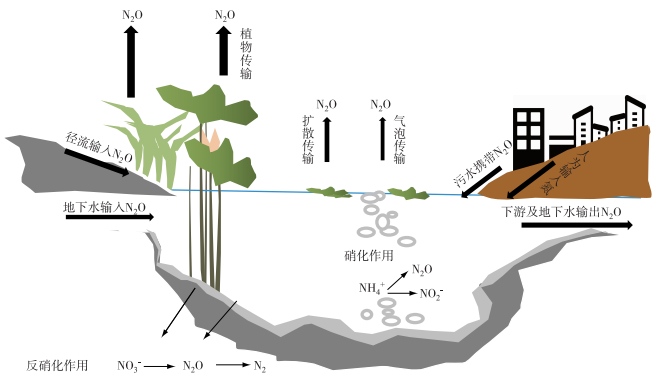
|
图 1 湖、库N2O产生及排放示意图(根据文献[32]修改) Fig.1 Schematic diagram for generation and emission of N2O in lakes and reservoirs[32] |
湖、库水体中N2O的内源产生主要发生在沉积层氧化还原区,是不同形态氮素在微生物的硝化作用、反硝化作用、硝化-反硝化耦合作用以及脱氮作用等过程中发生生化转化的产物[34-36](图 2).同时,沉积物中部分底栖无脊椎动物(如摇蚊幼虫)代谢过程也被认为会释放一定N2O[37-38],但相对释放量较低,因此相关研究较少.
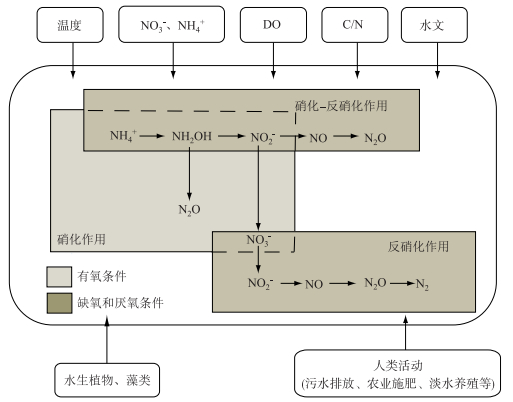
|
图 2 湖、库N2O产生过程及影响因子框架 Fig.2 Framework for generation and controls of N2O in lakes and reservoirs |
首先,N2O是硝化过程的中间产物.目前尚未发现可以直接将NH4+氧化为NO3-的微生物[39],硝化作用过程均需要先将NH4+氧化为NO2-再进一步氧化为NO3-,NH2OH作为其中间产物,部分分解产生N2O [40].值得注意的是,硝化作用是耗氧过程,当溶解氧(DO)不足时,微生物的硝化活性受到制约[41].其次,由于湖、库沉积层大部分属于厌氧环境,因此反硝化作用被认为是水体N2O产生的最主要途径.沉积物及上覆水体中的NO3-在反硝化细菌的代谢作用下,被还原成N2,N2O其缺氧条件下的中间产物[42].由于反硝化速率与湖、库上覆水体中的NO3-浓度呈正相关,因此沉积物厌氧水平也是调控N2O产生的重要因素.此外,当湖、库系统缺少氮源补给,尤其是NO3-时,反硝化必须依赖于硝化作用产生的NO3-才能继续进行,这一过程被称为硝化-反硝化耦合作用.该过程通常被认为发生在水体有氧-厌氧界面,且N2O产生速率较高[43].最后,硝化细菌脱氮作用是在高氮、低碳和低氧条件下发生的N2O产生途径.湖、库水体中NH3、NH4+在硝化细菌的作用下氧化为NO2-,由于自养氨氧化细菌作用,NO2-不继续氧化为NO3-,而是在亚硝酸还原酶的作用下还原为NO、N2O以及N2[36].
由此可见,湖、库系统中N2O产生途径较为复杂,在不同环境条件下,4种微生物过程的相对贡献不尽相同,其主要决定因素包括溶解氧、氮浓度及其形态、碳素丰度等.这一特征决定了湖、库N2O排放的变异性.而目前对于不同营养水平的湖、库系统中4种生化过程对水体N2O相对贡献的研究缺乏,限制了全球湖、库水体N2O排放的预测和估算.同时,随着湖、库水污染加剧,沉积物中摇蚊等耐污性底栖动物大量繁殖[44],可能增加沉积物N2O的产生[38],因此需要进一步明确不同底栖动物类群在湖、库N2O产生中的潜在作用.
1.2 外源输入除水体原位生物代谢产生N2O,湖、库上游河水输入也是N2O重要来源(图 1). Yuan等[45]研究表明太湖上游水体具有较高的N2O浓度和排放.同时,农业流域内土壤中通常具有较高的N2O浓度,其中少部分会随地表径流和壤中流进入湖泊、河流、湿地等邻近水体中[46],构成湖、库水体N2O的外源输入. Audet等[47]研究瑞典农业区流域水体发现,仅占流域面积0.1 %的水生系统中N2O溶存总量占了流域范围内N2O总排放量的4 %,因此径流过程可能存在大量溶存N2O输移.此外,人为生活污水、工业废水中通常含有较高浓度的N2O,可能成为部分城市湖、库水体N2O的重要外源[48].在人为干扰较大的流域,除直接N2O输入,农业区域化肥的大量使用,城市区域工业废水、生活污水排放导致水体氮浓度增加,间接刺激内源产生[49],干扰外源直接输入的定量研究,因此在研究中需要考虑径流输入过程中和输入后的N转化.目前的研究中对于地下水、上游水体、污水排放等N2O输入研究虽然有所涉及,但仍以间接证据为主,直接量化研究比较缺乏.随着同位素分析技术的运用,从流域尺度上量化不同过程的外源输入对于准确评估湖、库N2O动力学过程具有重要意义.
1.3 输出湖、库水体中N2O的去向通常有两种,一种是在极度缺氧的状态下反硝化过程会将浓度过高的N2O进一步还原为N2[50],但目前关于N2O在淡水水体中的原位消耗的研究较少,并没有充足的量化证据;另一种则是通过水-气界面排放入大气[51].对于水库而言,部分溶存N2O也会随水流输入到下游.目前扩散排放研究较多,其排放速率主要受水-气N2O浓度差、水面扰动、水深、风速等影响[52],是水体排放的最主要的途径;植物传输作用则主要指沉积层产生的N2O通过分子扩散和对流传输方式,进入水生植物输导组织,并向上输移排入大气的途径,该途径是湖、库浅水沿岸等水生植物丰富的水域区N2O排放的重要方式[51].植物种类差异对N2O的传输影响显著.目前研究者针对不同植物覆盖区N2O排放特征展开了分析[16-17],少数研究者也探讨了水生植物对N2O产生的影响[53],但关于水生植物分布与湖、库N2O排放总量的关系鲜见报道.随着湖、库治理工作的开展,湿地植物种植可能影响湖、库在氮循环中的作用.尽管气泡排放被认为不是湖、库N2O主要的排放方式[31],但对于污染严重的湖、库,特别是在城市区小型湖、库群,沉积层N2O产生速率较高时,也可能形成不均匀的气泡排放,但目前研究尚少,在过去的研究中可能被低估.除此之外,对于一些下泄方式的水库,下泄水通常具有较高N2O浓度[54],加之涡轮或跌水扰动,形成脱气,成为水库N2O排放的重要途径[55]. Liu等[56]在河流梯级水库溶存N2O浓度的研究中发现,下泄水N2O浓度远高于下游水体,表明下泄水中的N2O浓度在短时间内排入了大气. Frederic等[23]研究热带水库也发现通过水轮机的水体会有部分N2O快速释放到大气中.虽然水体N2O浓度较低,水轮机对N2O的脱气作用远小于CH4、CO2,但作为水库水体N2O排放的一个特殊释放途径,近年来逐渐受到关注.
2 湖、库水体N2O排放的时空变异性时空变异性是自然过程的重要特征,是对某一研究现象在空间和时间上的量度,而这种变异性通常在时间尺度和空间尺度上表现不同的特征[5, 12, 17, 57].氮元素的生物地化循环过程随着地理距离、环境因子或人类活动强度的变化而呈现某种规律性的分布[8, 18, 21, 27].深入理解湖、库N2O时空变异规律及其对环境变化的响应是研究淡水生态系统功能的重要环节,也是构建湖、库N2O排放理论框架及预测模型的基础.湖、库N2O产生、消耗及排放过程复杂,受到物理、化学、生物作用和环境因子的综合影响,加之人类活动干扰不断加剧导致大部分研究中湖、库N2O排放呈现显著的时空变异特征.综合已有研究,本文试图从不同时间尺度、空间尺度探讨湖、库N2O排放的潜在普遍规律及其调控机制.
2.1 时间变异特征在对湖、库系统N2O排放的时间变异特征的研究中,多以季节变化和日变化规律为主[33, 57-58],年际变化规律在水库研究中有涉及[59]. Huttunen等[7]对芬兰Kevaton湖的湖滨带研究表明,夏季N2O的排放量远高于(-26~146 μg/(m2 ·h))冬季(-7~4 μg/(m2 ·h)));Freymond等[60]在研究北方的高山湖泊也发现,大部分湖泊水-气界面N2O排放表现为8-10月最高、4月较低、1-3月最低,而其认为这种变异性主要受温度和降雨影响. Wang等[18]对太湖N2O排放的研究发现,夏季(6-9月)显著高于冬季,其将这种季节规律归因于夏季大型植物生长和藻华暴发,二者为沉积物微生物繁殖提供了大量新鲜有机碳,促使了单转化细菌的繁殖代谢.水库与湖泊具有相似性,大部分水库研究中,N2O排放季节规律也表现为夏季高于冬季,雨季高于旱季. Yang等[10]对北京的密云水库消落带及水域区为期一年的定点监测发现,无论是消落带还是水体,夏季(7-8月)N2O排放量最高,相当于冬季排放通量的2~3倍;Zhu等[33]发现三峡水库水气界面N2O排放的季节变化显著,6月的排放量达到最大,1月最低,其认为三峡水库冬水夏陆的调水机制使消落带植物冬季淹水后腐烂分解,退水后成为N2O排放的热点.然而,乌江上的两个亚热带水库的N2O通量却呈明出与三峡水库的季节截然相反的排放模式,冬季达到排放的最高峰[12].这可能因为水库N2O排放的季节变化受到水位变动以及库龄等影响.总体上,湖、库N2O排放的季节规律基本一致,温度、降雨以及藻华暴发对二者的季节变化均可能产生显著影响,同时,湖泊N2O排放的季节变化还受到水生植物的生长状况、沉积物的理化性质、湖泊水位的变化等因素影响,水库则受到库龄和调水机制的影响.
除季节变化外,湖、库N2O的昼夜变化也是准确估算区域湖、库氮平衡及模型优化的限制因素.日变化规律是自然界生态系统的普遍规律,但湖、库N2O的日变化则普遍受到忽视,仅极少数研究者开展了相关的探索.黄文敏等[58]对三峡水库支流N2O排放的昼夜变化研究表明,三峡蓄水初期N2O水气界面排放通量具有显著的昼夜波动,且呈现午后至17:00最高,夜间则整体较低,并认为水体溶解氧、气压以及pH的昼夜波动是主要影响因子.这与Harrison等[61]对富营养化的缓流水体的研究结果相似,进一步表明淡水系统水-气N2O排放确实存在昼夜变化.然而,我国研究者对太湖梅梁湾水体N2O排放研究中则发现N2O饱和度昼夜变化呈明显的单锋模式,凌晨两点水体N2O最高,随后不断降低,日落前降至全天最低点后开始升高,这一日变化模式主要与水体藻类光合作用以及沉积物-水界面的有机质降解有关[57].目前,对于湖、库N2O排放的研究在全球开展的较多,也有丰富的研究成果,但忽略了其昼夜变异性及其影响机制.研究不同区域湖、库N2O的日变化动态,对精确估算湖、库对大气N2O的贡献具有重要意义.
2.2 空间上的变异性湖、库水体N2O的排放通量空间变异特征主要表现在湖、库间和湖、库内两方面.目前,大部分研究针对单一湖、库内水平、垂直结构上N2O溶存变异特征,而对不同区域湖、库之间N2O排放的比较研究相对较少,特别对于不同流域特征或人类活动干扰强度下湖、库间的比较研究是认识自然过程对环境变化响应的关键,但相关报道涉及较少.
2.2.1 区域空间变异性在全球淡水生态系统N2O排放的估算研究中,最大的瓶颈和限制是数据不足以及较大的空间变异性,跨区域、多系统的定量研究至关重要.目前,关于湖、库系统N2O排放研究的区域集中性特征较大程度上限制了对全球分布规律的分析.基于有限的数据(表 1),湖、库N2O排放呈明显的纬度变化,低纬度地区湖、库(热带湖泊除外)N2O排放显著高于高纬度地区. Soued等[5]对加拿大魁北克321个湖泊、河流和池塘水体N2O浓度与通量的研究中,结合全球不同区域研究结果,估算热带、温带、寒带湖和库系统N2O年排放速率分别为64.7、3.4、1.1 μmol/(m2 ·d),尽管热带区域湖、库水域面积仅为寒带的1/3,但其N2O年排放总量高达0.510±0.244 Tg N,分别是温带和寒带的10倍和23倍,较高的温度、陆源氮的输入是导致热带湖、库N2O排放高的关键因素.然而,数据不足使得这种全球尺度上的量化缺乏强有力的证据,因此对于湖泊系统而言,需要加强亚热带和热带地区的研究,水库则应加强温带和寒带区域的研究.总体上,全球尺度下开展湖、库系统N2O排放的定量和模型研究目前较为滞后,仍需积累数据和总结全球尺度的变异规律.
| 表 1 全球范围内湖、库N2O的排放通量 Tab. 1 The global N2O emission flux of lakes and reservoirs |
然而,由表 1可知,并非低纬度湖、库都具有较高的N2O排放速率,同一区域湖、库而言,N2O排放也存在较大的变异性.例如热带地区的Kivu湖N2O的排放通量仅为0.43 μmol/(m2 ·d),远低于热带湖、库的平均值,这主要由于其流域内采用传统农业模式,施肥量较小[62].太湖N2O排放量远高于亚热带其他湖、库,这与其较高的氮含量以及藻华生长密切相关[18, 27].巴西的Serrade Mesa水库和Manso水库的N2O平均排放通量只有3 μmol/(m2 ·d)[23],远低于热带地区的N2O的排放通量,消落带面积小,极低的人为氮和有机碳输入是导致二者N2O较低的主要原因;Wang等[48]则对都市区及周边的小型湖、库N2O排放研究中提出,人类活动和城市化是导致区域湖、库N2O排放空间差异的主要驱动因子.由此可见,人类活动(城市化、施肥、排污)通常是区域尺度上湖、库群N2O排放的空间变异主要影响因素.通常水质较差的湖、库水体,特别是富营养化的湖、库具有更高的N2O排放通量. Liu等[13]对长江中下游湖、库群水体氮生物转化速率研究认为,流域内人类活动是不同湖、库N2O排放大小的主导因素. He等[63]和Yu等[64]分别对重庆市、上海市河网N2O排放研究中也强调,城市化和生活污水排放是导致水体高N2O排放的关键因子.由此,区域尺度上湖、库群N2O排放研究对于理解区域人类活动对全球气候变化的潜在贡献具有重要意义.
现阶段,对于不同流域N2O的排放差异的比较研究以及影响因素分析开展得较少.许多发展中国家为应对能源危机和水源危机,建设大大小小的水坝,形成众多大小不一的湖、库群,然而,对于这些湖、库群N2O排放及其对全球气候变化的贡献研究较少,使人们极大地忽视了筑坝拦水,特别是小型水坝的潜在生态影响.城市内部众多的不同功能的湖、库群,研究表明这些小型湖、库N2O排放非常高,甚至比一些热带湖、库高数倍,已经成为温室气体排放的热点区域.加之城市区大量的C、N输入,这部分水体的N2O排放需要得到更多的关注.
2.2.2 湖、库内部的空间变异性湖、库水体内部N2O排放的空间变异性分为纵向变异性和横向变异性.横向变异性指同一湖、库水-气界面N2O排放通量在不同位置的差异.一般认为,水文分带特征、水生植物生长以及水深等是决定湖、库水体N2O排放横向变异性的主导因素[8, 17].湖泊水文空间分带特征将湖区分为湖滨带、浅水带、深水带[73],大部分研究认为不同分带区水体N2O排放速率差异显著,并且湖滨带通常最高,浅水带次之,深水带最低[8-9, 29]. Wang等[8]对太湖湖滨地区进行N2O排放研究发现,湖滨带N2O排放速率可达到429.5 μg/(m2 ·h),比富营养化期间太湖梅梁湾区N2O排放速率高4倍左右.由于湖滨带通常被作为湖泊生态缓冲带,能够拦击和富集陆源氮素,进而成为湖泊N2O排放的主要区域[74].然而,目前开展湖泊分带区的研究多局限于氮源丰富的农业区周围湖、库N2O排放,缺乏城市、牧业等其他土地利用方式下湖、库水体分带区的N2O排放研究[30].湖、库与河流相比,具有相对封闭的汇水环境和静水特征,蓄水区内氮素汇集、沉积,分解过程活跃,有利于N2O的产生[75].因此,湖、库内不同区域N2O排放出现差异. Frederic等[23]发现Petit Saut水库蓄水区N2O溶存量比水库上游水体以及大坝下游水体高.同时,由于水生植物生长差异,湖、库内N2O排放也会出现差异.湖、库内水生植物生长旺盛的区域,水体溶解氧浓度下降,总氮浓度增高,从而有利于反硝化过程,促进湖、库的N2O产生. Wang等[8]和郑小兰等[16]发现太湖在7-9月藻华暴发,大型植物生长旺盛,N2O的排放量达到峰值.并且,占全球湖泊总面积近一半的浅水湖(面积小于1 km2)[76],由于浅水环境,有利于植物生长,成为N2O排放的潜在热点区[29]. Zhu等[9]研究表明,浅水湖中由于湖滨带的水生植物比其他区域生长旺盛,N2O的排放量最高.除此之外,湖、库水体由于季节性水位变化,形成消落带,受到水生环境和陆地环境的交替影响,土壤的理化性质、植物生长状态、微生物区系等都发生复杂变化,从而促进N2O的产生,湖、库消落带可能是N2O排放的重点区[15, 23, 77-78].但是目前缺少大范围、长期的消落带区域N2O排放研究.
纵向变异性是指同一湖、库水体内N2O溶存浓度在沉积物与不同水层中的分布差异. Fleur等[62]研究Kivu湖发现,由于溶解氧浓度、温度在湖泊中具有垂直差异,并且造成细菌种群成层分布,N2O溶存浓度具有垂直变异性,在湖泊表层水体中的浓度范围为6~9 nmol/L,在底层水体中的浓度范围为0~16 nmol/L,其中最大浓度超过58 nmol/L,出现在有氧-厌氧交界面. Christine等[79]研究Lugano湖也发现,湖泊水柱N2O浓度不均一,大量N2O累积在厌氧的底层水中,并且在水-沉积物交界面1米深处测得N2O浓度达到峰值(918 nmol/L),是大气平衡值的100倍;其次出现在有氧-厌氧交界面.同时,湖、库中垂直方向上NO3-浓度差异也是N2O溶存浓度垂直变异性的一个原因. Christine等[79]观测发现湖、库水柱中N2O浓度峰值出现在NO3-浓度峰值之后. Johanna等[80]也认为水体内部N2O浓度在垂直方向上与NO3-浓度的变化趋势一致.目前,对于湖、库N2O产生、排放变异性研究多数集中于横向,极少数涉及纵向.未来,可以针对不同类型的湖、库水体进行水平方向分区(进水区、深水区、浅水区、出水区、岸边区),垂直方向分层(表水层、有氧层、氧跃层、厌氧层)设置综合的N2O监测垂线,更加系统地研究湖、库水体内部的N2O空间变异性.
3 湖、库水体N2O排放影响因子框架湖、库水体N2O排放的动力学过程和时空变异性研究表明,湖、库N2O排放受多重因素影响[5, 18, 57, 62, 73].在大部分湖、库N2O排放研究中对影响因素的讨论有所涉及,但缺乏系统性的、框架性的要素概括.构建系统的湖、库N2O排放影响因子框架,更加有层次性地讨论个因素的相互关系,同时为有效地控制N2O排放做出正确的指导.影响N2O排放的理化参数和环境因素有很多,例如DO、氧化还原电位、滞水时间、可利用的有机碳、pH、NO3-、NO2-、NH4+、水生植物以及其他因素[78, 80-82].分析以往研究中涉及的环境影响因素和理化参数,本文将框架将分为水体理化因子、生物因子、人类影响因子3个层次来讨论,水体理化因子是N2O产生的理化条件,包括温度、营养盐、DO、C/N、水文(扰动、水深、水位变化);生物因子主要指水生植物、藻类与微生物的作用;人类影响因子包括人类一系列生产活动(图 2).
3.1 理化因子 3.1.1 温度温度作为影响因子,包括水温和气温两部分.水温是影响自然湖、库水体微生物活性的关键因子,对N2O产生过程影响显著[83],湖、库沉积物中水温升高会显著增加N2O的产生量. Dorland等[84]研究表明,在-2~25℃之间,反硝化速率的平方根与温度呈显著的正相关关系. Silvennoinen等[85]也表明,随着水温增加,湖、库水体中微生物活性增强,水体的硝化速率和反硝化速率增大,从而促进了水-气界面N2O的排放速率.同时,由于湖、库沉积物中的底栖无脊椎动物也是N2O的产生源[37-38].水温是影响无脊椎动物摄食、呼吸作用等生命活动的重要环境因子[86-87],并且水温能够控制无脊椎动物内脏中的反硝化细菌代谢速率,从而间接影响N2O的产生速率[37].水温直接影响湖、库N2O的产生、排放过程,气温作为外部环境影响因素,通过调节湖、库水温和沉积物温度使N2O的排放具有明显的时间变异性,无论是N2O排放速率的季节变化[7, 60],还是日际变化[57-58],都离不开气温的间接影响.目前,关于温度与湖、库水体N2O产生、排放过程的研究集中于气温的外部影响,直接涉及内部的水温作用研究相对缺乏,未来可以通过室内实验,加强探索水温对N2O产生、排放的作用.
3.1.2 营养盐湖、库水体中营养盐的种类和浓度对N2O的产生具有直接或间接的影响,相关的研究较多.由湖、库N2O的动力学过程可知,硝化、反硝化以及硝化-反硝化耦合作用是N2O的内源产生途径. NH4+是硝化作用的反应物,在有氧条件下迅速被氧化为NO3-、NO2-,因此,NH4+浓度与NO3-浓度密切相关.同时,湖、库水体中NO3-、NO2-浓度增加对于N2O的产生具有正效应[41, 88-90]. Beaulieu等[91]表明,当人为输入的NO3-浓度增加时,水体原位产生N2O的量加大.在厌氧的条件下NO3-浓度增大,其作为电子受体的功能增强,反硝化作用增强[42]. Usui等[88]认为,在反硝化过程中,(NO3-+NO2-)供给和电子供体需求平衡调控N2O的产生量,当NO3-浓度升高时NO3-作为比N2O更强的电子受体对一氧化二氮合酶产生抑制,使得N2O难以继续还原为N2,从而使得N2O得以累积产生并释放. Yuan等[45]研究也表明,湖、库水体中NO3-浓度较高时,硝化产物(NO3-、NO2-)浓度过高,导致硝化过程中羟胺的转化受抑制,从而氧化为N2O.目前关于湖、库水体中磷素对N2O产生是否直接作用还有待探索,但人为磷输入可能导致水体富营养化,进而影响N2O的产生. Wang等[48]研究指出,在城市小水库群中TP、DTP和PO43-浓度均与N2O排放量显著相关,其对N2O排放的时空变异的解释量分别达到49 %、59 %和48 %.湖、库水体中的磷素作为水生植物生长的必要营养元素,也是水体富营养化的一个关键影响因子,目前对富营养化湖、库N2O排放量也有不少涉及[18, 27, 69].未来,湖、库水体中C、N、P对N2O产生、排放的耦合作用还需要进一步探索.
3.1.3 DO湖、库水体中的DO浓度对水体中的微生物群落结构影响较大,决定着是氮素转化的途径.水体在缺氧的条件下,硝化过程初始阶段的中间产物羟胺发生不完全氧化,从而生成N2O[92],同时在厌氧条件下NO3-能够代替O2作为电子受体,且当DO浓度小于5 %时,DO会抑制了一氧化二氮合酶的活性,水体中N2O的产生不断增加[88].然而,绝对的厌氧环境也并不利于N2O的产生. Jonathan等[50]通过采取沉积物通量室实验发现,在沉积物的反硝化过程中,N2O的产生需要一个适度缺氧的环境,即通量室顶部空间的氧浓度为1.2 %时,N2O的产生速率最大;同时指出当极度缺氧的条件下,N2O会以115 nmol/(m2 ·d)的速率被快速消耗. Zheng等[93]也认为,水体最高的N2O浓度和转化率是在氧浓度为0.2 mg/L时,并且认为NO2-的积累可能有助于硝化过程中大量的N2O产生.目前的研究中,湖、库水体中DO浓度对氮循环的影响研究仍处于定性阶段,对于定量地研究水体DO与N2O产生之间的关系还相对薄弱,但这对于了解N2O的产生机制有重要意义.
3.1.4 C/N湖、库水体和沉积物中的C/N会直接影响N2O的产生速率以及方式. N2O产生途径以及速率主要受氧气的影响,但是碳的可利用性会影响氧气的消耗速率,促使厌氧环境的形成,因此水体附近若有机碳的来源丰富,则形成明显的厌氧微空间[94]. C/N比是调节沉积物微生物代谢的关键因子,进而影响硝化、反硝化微生物的群落结构和代谢.此外,在反硝化过程中,有机碳是电子的供给者[84],C/N比会影响反硝化程度和N2O的产生.研究表明,湖、库水体在厌氧的条件下,N2O产生速率会随着C/N比的增加而减小[24, 95-96]. Itokawa等[97]研究发现,沉积物中C/N比为2时比C/N比为5时的N2O产生速率高. Yan等[98]也发现,随着C/N比增高,硝化和反硝化过程产生的N2O量都减小,N2O-N在代谢产物中的比率明显地从2.23 %减小到0.05 %.淡水生态系统中C/N比对流域人类活动的影响极为敏感,从湖、库水体C/N比变化指示N2O排放强度有利于更科学评估人类活动对生态系统功能的影响强度.
3.1.5 水文水文过程一方面影响湖、库水体N2O的外源输入,另一方面影响水-气界面N2O排放过程.首先,水文过程是陆源氮素输入湖、库的重要途径,改变水体氮素的供给,同时也能够增加陆域土壤N2O的直接输入.其次湖、库中产生的N2O从水体释放到大气是一个与水文特征(包括扰动、水深、水位变化等)密切相关的动力学过程.研究表明,湖、库水面风速增大,将会加大水面的扰动,水气界面N2O的扩散排放[99-100].而同时,湖、库水体的水深会影响溶解氧和营养盐的浓度,从而影响N2O产生和排放的过程与途径. Christine等[79]对Lugano湖夏季水体溶解氧和营养盐浓度垂直分布结果表明,溶解氧浓度随水深增加而逐渐降低,水深达20 m后则基本达到无氧水平,而且水体NO3-、NO2-与溶解氧的浓度变化趋势大致相同.除此之外,湖、库水位变化是N2O产生和排放的重要影响因素[51, 101-102].大部分研究表明,湖、库季节性水位变化所形成的消落区是整个湖、库水体N2O排放的热点区域,一方面是因为该区域通常具有更丰富的有机质和氮累计,另一方面则是因为间歇性的淹水导致土壤处于有氧-无氧界面,进而有利于N2O产生[51].当前的研究中,尽管关于水位变化导致河岸带[103]、湿地区[102]、潜流区[104]成为潜在的N2O排放热源的结论较多,但相关的积累探讨仍显得较为薄弱,且从微生物群落结构、氮来源等角度开展的相关研究较少.
3.2 生物因子影响湖、库水体N2O产生和排放过程的生物因子主要包括水生植物、藻类及微生物.湖、库中的水生植物通过自身特性来影响、改变所处水体环境中的理化条件,从而影响内陆水体中的N2O产生和排放过程.研究表明有芦苇生长的水体N2O的排放量是无芦苇生长的14倍[105].郑小兰等[16]对夏季太湖的草/藻型湖区研究发现,水-气界面N2O通量特征是:挺水植物湖区(115.807±7.583 μg/(m2·h))>藻型湖区(79.768±1.842 μg/(m2·h))>沉水植物湖区(3.685±0.925 μg/(m2·h)).水生植物生长对N2O排放的影响有4个方面:(1)挺水植物、浮叶根生植物等通气组织发达,能够为深水区的N2O提供排放通道,从而提高排放速率;(2)沉水植物能够显著改变水体营养状况、溶解氧等,从而影响原位N2O的产生过程[16];(3)水生植物生长通常根系释放小分子分泌物,改变根际微环境,从而促使根际氮转化微生物的代谢;(4)水生植物死亡分解,能够提供大量集中氮源和碳源,为N2O产生提供原料[106].水生植物的生活型、种类等不同,对N2O的产生和排放的影响也截然不同,但目前关于不同植物间和群落间的比较研究相对较少,导致对水生植物在氮循环和全球气候变化中的生态学功能受到较大的忽视.
除水生植物,水体藻类暴发也被认为是影响湖、库N2O排放的重要因素.藻型湖、库由于藻类暴发,溶解氧含量降低,形成厌氧条件,同时藻类死亡提供高浓度的新鲜有机质均为N2O的产生提供了条件,因此成为N2O的排放热点[8, 18-19, 27, 38, 69]. Wang等[27]发现太湖北部藻湖区的N2O饱和度最大,并向南部草型湖区递减. Wang等[18]发现,太湖梅梁湾在夏季藻类暴发时,N2O排放量最大.随着湖、库水体富营养化程度加剧,一些研究者已经提出这可能导致湖、库系统成为全球气候变化的潜在驱动者,因此水华过程对N2O产生的影响机制研究至关重要,也是未来研究的重要方向.
3.3 人类活动因子人类活动对湖、库水体N2O排放的影响方式多样,包括城市化、污水排放、养殖、生态修复等,均能够改变淡水生态系统的C、N循环而间接影响N2O排放,因此不同于生物因素.近年,人类活动对淡水生态系统N2O排放的影响研究越来越受到关注. Beaulieu等[91]估算,在全球淡水生态系统中,每年有0.68 Tg人为氮源通过微生物的硝化、反硝化作用,被转化为N2O排入大气中.人类活动使城市区的生活污水、农业区的农业废水大量排放,加大对湖、库水体碳、氮、磷的输入,促使N2O排放增加. Wang等[48]研究城市流域内不同的小型水库群N2O排放发现,流域内不同土地利用下的水库N2O排放通量表现出明显的梯度:城市用地>农业用地>森林用地,与碳、氮、磷的人为输入量梯度吻合.人为土地利用会使湖泊中的NO3-、NH4+、颗粒氮浓度增加,DO浓度降低,增加N2O的产生. Liu等[13]研究长江中下游湖泊群表明,人类活动改变了湖、库水质,影响沉积物的反硝化作用,从而使N2O的产生速率具有差异.除此之外,湖、库水体在淡水养殖过程中,大量含氮饲料的投放,使氮沉积在底泥中,参与水体中的生化过程,影响N2O排放. Williams等[107]初步估计2009年全球水产养殖系统的N2O排放量为9.3×107 kg,占全球N2O总排放量的0.5 %,到2030年水产养殖系统的N2O排放量可能达到3.83×108 kg,占人为N2O排放量的5.7 % [108].随着人类活动,特别是城市化、农业活动以及水产养殖等对湖、库生态系统影响不断增大,全球氮循环的重要过程也将随之发生变化,因此在未来估算淡水系统N2O排放时,应更加重视人类活动所起的促进作用.
除理化因素、生物因子及人类活动影响外,气象要素(风速、气压、降雨等)对湖、库水体N2O排放季节和大空间尺度的变异性也具有一定驱动作用[52].风速通过改变湖、库水面扰动进而增强N2O扩散排放[109].黄文敏等[58]研究香溪河温室气体排放发现,风速最大时刻N2O释放通量最大.同时,风速变化会影响水体中N2O的饱和度,高风速条件下,大气N2O被稀释,导致N2O从水体向大气产生泵吸作用[110].气压对湖、库水体N2O溶解度和排放速率也有影响[58, 111],但影响相对较小,相关研究也较少.气象要素在研究对于构建湖、库N2O排放的估算模型具有一定意义,目前相关研究略显不足,需要进一步通过高分辨率的数据进行相关模型参数的优化.
4 湖、库水体N2O排放的监测方法全球淡水生态系统N2O排放除了与水体的时空差异和各种理化、生物、人类活动等影响因子有关,监测技术也是其重要的限制因素.目前,在湖、库水体温室气体排放的研究过程中,监测方法主要包括漂浮箱法[21, 25, 33]、薄边界层法[12, 48]、涡度相关法[112]、倒置漏斗法(气泡研究)[113]等.国内学者针对水-气界面温室气体排放监测方法已经做了较为系统的综述[114-115],本研究在此不做过多赘述.但与水体CH4和CO2相比,N2O的产生速率和溶解性均较低,因此其对监测方法的敏感性更强,优化监测方法对精确估算N2O排放至关重要.漂浮箱法是通过测定箱体内N2O浓度变化率来估算排放通量的方法[109].薄边界层方法主要基于亨利定律,通过湖、库水-气界面N2O的浓度差以及气体交换系数来估算其排放通量[116].两种方法都具有成本低廉、测量便捷、操作简单等优势,适用于大尺度、多样点的监测[117].但二者均容易受到水面非自然扰动、风速扰动、温度、降雨、流速等不确定因素的影响[117-120],而且不能进行自动连续监测.涡度相关法是一种自动连续监测N2O排放通量的技术,但价格昂贵,应用范围较小.
不同监测方法对水体N2O排放通量监测的差异较大,导致不同区域N2O排放研究结果的可比性较差.高洁等[121]同时使用漂浮箱法和薄边界层方法对内陆水体水-气界面N2O交换通量进行观测,发现两种方法的测量结果平均相差2.3倍.研究认为,薄边界层方法和漂浮箱法测定的水体N2O排放通量比实际通量偏低[122-124],其中薄边界层方法误差更大[123-124].薄边界层方法误差的来源主要是气体交换系数(k值)的计算,因此不少学者利用漂浮箱法通量值和水体N2O浓度反推k值,并不断优化k值的模型.受环境因子(大小、污染、水文过程等)的影响,k值模型仍然存在较大的误差,因此仍需要开展更广泛的研究来构建和优化k值模型.随着涡度相关法不断发展,对水体N2O排放的长期、连续监测发挥了重要作用.未来研究中,将传统的漂浮箱法和薄边界层方法与新型的涡度相关法相结合,进一步增强研究方法的标准化和系统化,减小监测方法的不确定性,是区域乃至全球湖、库N2O排放研究的重点.
5 问题与展望 5.1 问题湖、库水体是淡水生态的重要组成部分,其水-气界面N2O排放对全球氮循环和气候变化具有潜在重要影响.湖、库水体N2O一方面源于水体内部的微生物硝化作用、反硝化作用、硝化-反硝化耦合作用以及脱氮作用等,另一方面源于上游河流、地表径流、污水排放、地下水排泄等外源输入.水体溶存的N2O可以通过扩散、植物传输和少量气泡方式排放,下泄式水库还存在涡轮脱气方式的排放途径.然而,目前对多种微生物代谢途径对不同湖、库N2O产生的相对贡献仍然存在争议,随着环境条件变化,关键微生物种类、丰度及活性改变,主导微生物代谢途径确定对于湖、库氮循环研究至关重要.同时,外源N2O输入多以间接证据为主,定量研究少见报道,限制了对湖库N2O动力学模型的构建.
湖、库N2O排放在不同的时空尺度上均表现出明显的变异性,导致全球或区域湖、库N2O排放总量的估算仍然存在较大的不确定性.大部分水体N2O排放夏季高于冬季,主要受温度因素的驱动;而不同水体昼夜变化规律并不一致,受溶解氧、温度以及水体光合、呼吸作用的昼夜转变影响显著.空间尺度上,高纬度区域湖、库N2O排放低于低纬度区域,但研究数据不足、研究地域集中,亚热带和温带研究较少,限制了全球分布规律的分析;由于人类活动以及自然条件差异,区域尺度上湖、库N2O排放变异性较大,但关键驱动因素仍不清楚;湖、库内部N2O溶存浓度与排放存在横向、纵向变异,对湖、库内部的N2O排放热点区域(滨湖区、消落区)的调控机制仍需进一步深入研究.总体上,湖、库N2O排放的时空变异性主要受到湖、库理化因子、生物因子以及陆源人类活动等影响,而不同环境条件下的关键驱动因子的识别及定量(或预测)关系的建立仍是当前研究的薄弱环节.随着人类活动不断增强,区域内湖、库N2O排放时空变异性增大,进一步影响全球尺度的估算.
最后,监测方法的不确定性也是限制当前湖、库N2O排放研究的重要因子,如何提高方法的精确性、实现传统漂浮箱法、薄边界层法与新型的涡度相关法的结合和相互优化是亟待解决的问题.
5.2 展望鉴于湖、库N2O排放的重要性以及当前研究存在的问题,本研究建议未来的研究应主要关注以下方面:(1)深入研究不同界面以及不同环境条件下湖、库N2O产生与消耗的关键微生物过程及控制机制;(2)结合不同界面过程(水-陆界面、水-气界面、沉积物-上覆水界面等),构建和优化变化环境下湖、库N2O排放的相关模型,特别是明确不同条件下湖、库外源N2O输入途径的相对贡献;(3)开展不同区域高时空分辨率的监测和数据补充,尤其加强对不同人为干扰梯度下的区域湖、库群N2O排放时空特征的研究,并结合遥感空间数据,从区域尺度阐明陆域人类活动(城市化、农业活动、污水排放等)与湖、库群N2O的耦合关系及调控机制;(4)开展不同环境变化过程(如气候变化、水华过程、生态修复过程等)中,湖、库N2O排放动力学、关键驱动因子及其模型关系的研究;(5)加强湖、库N2O排放监测方法的标准化,开展多种方法相结合的连续监测,进一步优化通量估算模型,提监测方法的精确性.
| [1] |
Alexander LV, Allen SK, Bindoff NL et al. Climate change 2013: The physical science basis, in contribution of Working Group I (WGI) to the Fifth Assessment Report (AR5) of the Intergovernmental Panel on Climate Change (IPCC). Computational Geometry, 2013, 18(2): 95-123. |
| [2] |
Ravishankara AR, Daneil JS, Portmann RW. Nitrous oxide (N2O): the dominant ozone-depleting substance emitted in the 21st century. Science, 2009, 326(5949): 123. DOI:10.1126/science.1176985 |
| [3] |
Forster P, Ramaswamy V, Artaxo P et al. Changes in atmospheric constituents and in radiative forcing. Climate Change, 2007, 129-234. |
| [4] |
Søvik AK, Augustin J, Heikkinen K et al. Emission of the greenhouse gases nitrous oxide and methane from constructed wetlands in Europe. Journal of Environmental Quality, 2006, 35(6): 2360-2373. DOI:10.2134/jeq2006.0038 |
| [5] |
Soued C, Giorgio PAD, Maranger R. Nitrous oxide sinks and emissions in boreal aquatic networks in Quebec. Nature Geoscience, 2015, 9(2): 1-5. |
| [6] |
Seitzinger SP, Carolien K, Renee VS. Global distribution of N2O emissions from aquatic systems: natural emissions and anthropogenic effects. Chemosphere-Global Change Science, 2000, 2(3/4): 267-279. |
| [7] |
Huttunen JT, Juutinen S, Alm J et al. Nitrous oxide flux to the atmosphere from the littoral zone of a boreal lake. Journal of Geophysical Research Atmospheres, 2003, 108(D14): 4421. DOI:10.1029/2002JD002989 |
| [8] |
Wang H, Wang W, Yin C et al. Littoral zones as the "hotspots" of nitrous oxide (NO2) emission in a hyper-eutrophic lake in China. Atmospheric Environment, 2006, 40(28): 5522-5527. DOI:10.1016/j.atmosenv.2006.05.032 |
| [9] |
Zhu D, Chen H, Yuan X et al. Nitrous oxide emission from infralittoral zone and pelagic zone in a shallow lake: Implications for whole lake flux estimation and lake restoration. Ecological Engineering, 2015, 82: 368-375. DOI:10.1016/j.ecoleng.2015.05.032 |
| [10] |
Yang M, Geng XM, Grace J et al. Responses of N2O flux to water level fluctuation and other environmental factors at littoral zone of Miyun Reservoir: A comparison with CH4 fluxes. Biogeosciences Discussions, 2015, 12(7): 5333-5363. DOI:10.5194/bgd-12-5333-2015 |
| [11] |
Zhu D, Chen H, Yuan X et al. Nitrous oxide emissions from the surface of the Three Gorges Reservoir. Ecological Engineering, 2013, 60(11): 150-154. |
| [12] |
Liu XL, Liu CQ, Li SL et al. Spatiotemporal variations of nitrous oxide (N2O) emissions from two reservoirs in SW China. Atmospheric Environment, 2011, 45(31): 5458-5468. DOI:10.1016/j.atmosenv.2011.06.074 |
| [13] |
Liu W, Yao L, Wang Z et al. Human land uses enhance sediment denitrification and N2O production in Yangtze lakes primarily by influencing lake water quality. Biogeosciences, 2015, 12(10): 7815-7844. DOI:10.5194/bgd-12-7815-2015 |
| [14] |
Liu L, Xu M. Microbial biomass in sediments affects greenhouse gas effluxes in Poyang Lake in China. Journal of Freshwater Ecology, 2016, 31(1): 1-13. DOI:10.1080/02705060.2015.1035345 |
| [15] |
Chen H, Yuan X, Yuan Y et al. Nitrous oxide emissions from newly created littoral marshes in the drawdown area of the Three Gorges Reservoir, China. Water Air & Soil Pollution, 2010, 211(1/2/3/4): 25-33. |
| [16] |
Zheng XL, Wen SL, Li X et al. Characteristics of N2O release and influencing factors in grass-type and algae-type zone of TaiHu Lake during summer season. Environmental Science, 2018, 39(5): 1-12. [郑小兰, 文帅龙, 李鑫等. 夏季太湖草/藻型湖区N2O生成与迁移特征及其影响因素. 环境科学, 2018, 39(5): 1-12. DOI:10.13227/j.hjkx.201709212] |
| [17] |
Liu Y, Zhu R, Ma D et al. Temporal and spatial variations of nitrous oxide fluxes from the littoral zones of three alga-rich lakes in coastal Antarctica. Atmospheric Environment, 2011, 45(7): 1464-1475. DOI:10.1016/j.atmosenv.2010.12.017 |
| [18] |
Wang H, Yang L, Wang W et al. Nitrous oxide (N2O) fluxes and their relationships with water-sediment characteristics in a hyper-eutrophic shallow lake, China. Journal of Geophysical Research Biogeosciences, 2015, 112(G1): 129-137. |
| [19] |
Wang S, Liu C, Yeager KM et al. The spatial distribution and emission of nitrous oxide (N2O) in a large eutrophic lake in eastern China: anthropogenic effects. Science of the Total Environment, 2009, 407(10): 3330-3337. DOI:10.1016/j.scitotenv.2008.10.037 |
| [20] |
Whitfield CJ, Aherne J, Baulch HM. Controls on greenhouse gas concentrations in polymictic headwater lakes in Ireland. Science of the Total Environment, 2011, 410(411): 217-225. DOI:10.1016/j.scitotenv.2011.09.045 |
| [21] |
Huttunen JT, Alm J, Liikanen A et al. Fluxes of methane, carbon dioxide and nitrous oxide in boreal lakes and potential anthropogenic effects on the aquatic greenhouse gas emissions. Chemosphere, 2003, 52(3): 609-621. DOI:10.1016/S0045-6535(03)00243-1 |
| [22] |
Lemon E, Lemon D. Nitrous oxide in freshwaters of the Great Lakes Basin. Limnology and Oceanography, 1981, 26(5): 867-879. DOI:10.4319/lo.1981.26.5.0867 |
| [23] |
Frederic G, Gwenael A, Alain T et al. Nitrous oxide emissions from tropical hydroelectric reservoirs. Geophysical Research Letters, 2008, 35(6): L06404. DOI:10.1029/2007GL033057 |
| [24] |
Kumar A, Sharma MP. Estimation of green house gas emissions from Koteshwar hydropower reservoir, India. Environmental Monitoring & Assessment, 2017, 189(5): 240-251. DOI:10.1007/s10661-017-5958-7 |
| [25] |
Huttunen JT, Vaisanen TS, Hellsten SK et al. Fluxes of CH4, CO2, and N2O in hydroelectric reservoirs Lokka and Porttipahta in the northern boreal zone in Finland. Global Biogeochemical Cycles, 2002, 16(1): 3-1. DOI:10.1029/2000GB001316 |
| [26] |
Hendzel LL, Matthews CJ, Venkiteswaran JJ et al. Nitrous oxide fluxes in three experimental boreal forest reservoirs. Environmental Science & Technology, 2005, 39(12): 4353-4360. DOI:10.1021/es049443j |
| [27] |
Wang S, Liu C, Yeager KM et al. The spatial distribution and emission of nitrous oxide (N2O) in a large eutrophic lake in eastern China: anthropogenic effects. Science of the Total Environment, 2009, 407(10): 3330-3337. DOI:10.1016/j.scitotenv.2008.10.037 |
| [28] |
Wang H, Zhang L, Yao X et al. Dissolved nitrous oxide and emission relating to denitrification across the Poyang Lake aquatic continuum. Journal of Environmental Science, 2017, 52(2): 130-140. |
| [29] |
Chen H, Wang M, Wu N et al. Nitrous oxide fluxes from the littoral zone of a lake on the Qinghai-Tibetan Plateau. Environmental Monitoring & Assessment, 2011, 182(1/2/3/4): 545-553. DOI:10.1007/s10661-011-1896-y |
| [30] |
Gao YH, Luo P, Wu N et al. Impacts of grazing intensity on nitrogen pools and nitrogen cycle in an Alpine Meadow on the Eastern Tibetan Plateau. Applied Ecology & Environmental Research, 2009, 6(3): 69-79. DOI:10.15666/aeer/0603_069079 |
| [31] |
Yang L, Lu F, Zhou XP et al. Progress in the studies on the greenhouse gas emissions from reservoirs. Acta Ecologica Sinica, 2014, 34(4): 204-212. DOI:10.1016/j.chnaes.2013.05.011 |
| [32] |
Diem T. Methane dynamics in oxic and anoxic aquatic systems (Discussions). Zurich: Eidgenossische Technische Hochschule Zurich, 2008.
|
| [33] |
Zhu D, Chen H, Yuan X et al. Nitrous oxide emissions from the surface of the Three Gorges Reservoir. Ecological Engineering, 2013, 60(11): 150-154. |
| [34] |
Seitzinger SP. Denitrification in aquatic sediments. Denitrification in Soil and Sediment, 1990, 56: 301-322. DOI:10.1007/978-1-4757-9969-9-19 |
| [35] |
Antonio CH, David CG, Carrillo P et al. Denitrification and biodiversity of denitrifiers in a high-mountain mediterranean lake. Frontiers in Microbiology, 2017, 8(1911): 1-12. DOI:10.3389/fmicb.2017.01911 |
| [36] |
Wrage N, Velthof GL, van Beusichem ML et al. Role of nitrifier denitrification in the production of nitrous oxide. Soil Biology & Biochemistry, 2001, 33(12): 1723-1732. |
| [37] |
Stief P, Polerecky L, Poulsen M et al. Control of nitrous oxide emission from Chironomus plumosus larvae by nitrate and temperature. Limnology and Oceanography, 2010, 55(2): 872-884. DOI:10.4319/lo.2010.55.2.0872 |
| [38] |
Jonas MS. Emission of N2O, nitrification and denitrification in a eutrophic lake sediment bioturbated by Chironomus plumosus. Aquatic Microbial Ecology, 1998, 14(3): 289-299. |
| [39] |
Loosdrecht MCMV, Jetten MSM. Microbiological conversions in nitrogen removal. Water Science & Technology, 1998, 38(1): 1-7. |
| [40] |
Stein LY, Klotz MG. Surveying N2O-producing pathways in bacteria. Methods Enzymol, 2011, 486: 131-152. DOI:10.1016/B978-0-12-381294-0.00006-7 |
| [41] |
Martin TL, Kaushik NK, Trewors JT et al. Review: Denitrification in temperate climate riparian zones. Water Air & Soil Pollution, 1999, 111(1/2/3/4): 171-186. |
| [42] |
Knowles R. Denitrification. Microbiological Reviews, 1982, 46(1): 43-70. |
| [43] |
Nils RP, Lars PN, Søren R et al. Application of the isotope pairing technique in sediments where anammox and denitrification coexist. Limnology and Oceanography Methods, 2003, 1(1): 63-73. DOI:10.4319/lom.2003.1.63 |
| [44] |
Wang Q, Pang X, Wang ZJ et al. Advances in research on the influence of urbanization on stream benthic macroinvertebrate communities. Acta Ecological Sinica, 2017, 37(18): 6275-6288. [王强, 庞旭, 王志坚等. 城市化对河流大型底栖动物群落的影响研究进展. 生态学报, 2017, 37(18): 6275-6288.] |
| [45] |
Yuan S, Wang W. Characteristics of nitrous oxide (N2O) emission from a headstream in the upper Taihu Lake Basin. Acta Ecologica Sinica, 2012, 32(20): 6279-6288. DOI:10.5846/stxb |
| [46] |
Hama AZQ, Hiscock KM, Cooper RJ. Dissolved nitrous oxide (N2O) dynamics in agricultural field drains and headwater streams in an intensive arable catchment. Hydrological Processes, 2017, 31(6): 1371-1381. DOI:10.1002/hyp.1111 |
| [47] |
Audet J, Wallin MB, Katarina K et al. Nitrous oxide emissions from streams in a Swedish agricultural catchment. Agriculture Ecosystems & Environment, 2017, 236: 295-303. |
| [48] |
Wang X, He Y, Yuan X et al. Greenhouse gases concentrations and fluxes from subtropical small reservoirs in relation with watershed urbanization. Atmospheric Environment, 2017, 154: 225-235. DOI:10.1016/j.atmosenv.2017.01.047 |
| [49] |
Stow CA, Walker JT, Cardoch L et al. N2O emissions from streams in the Neuse river watershed, North Carolina. Environmental Science & Technology, 2005, 39(18): 6999-7004. |
| [50] |
Jonathan B, Robert CUG. The denitrification paradox: The role of O2 in sediment N2O production. Estuarine, Coastal and Shelf Science, 2018, 200: 270-276. DOI:10.1016/j.ecss.2017.11.018 |
| [51] |
Deshmukh C. Greenhouse gas emissions (CH4, CO2 and N2O) from a newly flooded hydroelectric reservoir in subtropical South Asia: The case of Nam Theun 2 Reservoir, Lao PDR[Dissertation]. New Delhi: TERI University, 2013.
|
| [52] |
Wanninkhof R. Relationship between wind speed and gas exchange over the ocean. Journal of Geophysical Research Oceans, 1992, 97(C5): 7373-7382. DOI:10.1029/92JC00188 |
| [53] |
Nils RP, Kim J. Nitrification and denitrification in the rhizosphere of the aquatic macrophyte Lobelia dortmanna L. Limnology and Oceanography, 1997, 42(3): 529-537. DOI:10.4319/lo.1997.42.3.0529 |
| [54] |
Lv X, Liu XL, Li J et al. Advances in studies on nitrous oxide(N2O) emission in the reservoirs under the back-ground of river impoundment. Chinese Journal of Ecology, 2018, 37(3): 613-623. [吕鑫, 刘小龙, 李军等. 河流拦截背景下水库氧化亚氮(N2O)排放的研究进展. 生态学杂志, 2018, 37(3): 613-623.] |
| [55] |
Fearnside PM. Greenhouse gas emissions from hydroelectric dams: Controversies provide a springboard for rethinking a supposedly "clean" energy source. An editorial comment. Climatic Change, 2004, 66(1/2): 1-8. DOI:10.1023/B:CLIM.0000043174.02841.23 |
| [56] |
Liu XL, Liu CQ, Li SL et al. Producing and releasing mechanism of N2O in cascade reservoirs of Maotiao River in summer. Resources and Environment in the Yangze Basin, 2009, 18(4): 373-378. [刘小龙, 刘丛强, 李思亮等. 猫跳河流域梯级水库夏季N2O的产生与释放机理. 长江流域资源与环境, 2009, 18(4): 373-378. DOI:10.3969/j.issn.1004-8227.2009.04.013] |
| [57] |
Wang SL. Diurnal variation in Greenhouse gas (CO2, CH4 and N2O) concentration of Meiliang Bay, Taihu Lake and their controlling factors. Quaternary Sciences, 2010, 30(6): 1186-1192. [王仕禄. 太湖梅梁湾温室气体(CO2, CH4和N2O)浓度的昼夜变化及其控制因素. 第四纪研究, 2010, 30(6): 1186-1192. DOI:10.3969/j.issn.1001-7410.2010.06.16] |
| [58] |
Huang WM, Zhu KG, Zhao W et al. Diurnal changes in greenhouse gases at water-air interface of Xiangxi River in autumn and their influencing factors. Environmental Science, 2013, 34(4): 1270-1276. [黄文敏, 朱孔贤, 赵玮等. 香溪河秋季水-气界面温室气体通量日变化观测及影响因素分析. 环境科学, 2013, 34(4): 1270-1276.] |
| [59] |
Chandrashekhar D, Frédéric G, Claire D et al. The net GHG (CO2, CH4 and N2O) footprint of a newly impounded subtropical hydroelectric reservoir: Nam Theun 2. EGU General Assembly, 2013. |
| [60] |
Freymond CV, Wenk CB, Frame CH et al. Year-round N2O production by benthic NOx reduction in a monomictic south-alpine lake. Biogeosciences, 2013, 10(12): 8373-8383. DOI:10.5194/bg-10-8373-2013 |
| [61] |
Harrison JA, Matson PA, Fendorf SE. Effects of a diel oxygen cycle on nitrogen transformations and greenhouse gas emissions in a eutrophied subtropical stream. Aquatic Sciences, 2005, 67(3): 308-315. DOI:10.1007/s00027-005-0776-3 |
| [62] |
Fleur AER, Francois D, Cedric M et al. Nitrous oxide and methane seasonal variability in the epilimnion of a large tropical meromictic lake (Lake Kivu, East-Africa). Aquatic Sciences, 2016, 79(2): 1-10. |
| [63] |
He Y, Wang X, Chen H et al. Effect of watershed urbanization on N2O emissions from the Chongqing metropolitan river network, China. Atmospheric Environment, 2017, 171: 70-81. DOI:10.1016/j.atmosenv.2017.09.043 |
| [64] |
Yu Z, Deng H, Wang D et al. Nitrous oxide emissions in the Shanghai river network: implications for the effects of urban sewage and IPCC methodology. Global Change Biology, 2013, 19(10): 2999-3010. DOI:10.1111/gcb.2013.19.issue-10 |
| [65] |
Du R, Daren L, Wang G. Diurnal, seasonal, and inter-annual variations of N2O fluxes from native semi-arid grassland soils of inner Mongolia. Soil Biology & Biochemistry, 2006, 38(12): 3474-3482. |
| [66] |
Chen J, Cao W, Cao D et al. Nitrogen loading and nitrous oxide emissions from a river with multiple hydroelectric reservoirs. Bulletin of Environmental Contamination and Toxicology, 2015, 94(5): 633-639. DOI:10.1007/s00128-015-1525-5 |
| [67] |
Xu HX, Jiang XY, Yao XL et al. Characteristics of nitrous oxide(N2O) emissions and the related factors in Lake Poyang. J Lake Sci, 2016, 28(5): 972-981. [徐会显, 姜星宇, 姚晓龙等. 鄱阳湖水体氧化亚氮排放特征及影响因素. 湖泊科学, 2016, 28(5): 972-981. DOI:10.18307/2016.0506] |
| [68] |
Dowenes MT. The production and consumption of nitrate in an eutrophic lake during early stratification. Archiv für Hydrobiologie, 1991, 122(3): 257-274. |
| [69] |
Deemer BR, Harrison JA, Whitling EW. Microbial dinitrogen and nitrous oxide production in a small eutrophic reservoir: An in situ approach to quantifying hypolimnetic process rates. Limnology and Oceanography, 2011, 56(4): 1189-1199. DOI:10.4319/lo.2011.56.4.1189 |
| [70] |
Faye NO, Kevin MH. Indirect nitrous oxide emissions from surface water bodies in a lowland arable catchment: a significant contribution to agricultural greenhouse gas budgets?. Environmental Science & Technology, 2012, 46(15): 8156-63. |
| [71] |
Martin M, Gachter R, Bernhard W. Nitrous oxide emissions to the atmosphere from an artificially oxygenated lake. Limnology and Oceanography, 1996, 41(3): 548-553. DOI:10.4319/lo.1996.41.3.0548 |
| [72] |
Yang H, Tom A, Peter D et al. Greenhouse gas metabolism in Nordic boreal lakes. Biogeochemistry, 2015, 126(1/2): 211-225. |
| [73] |
Carole AL. Limnology, lake and river ecosystems. Journal of Phycology, 2001, 37(6): 1146-1147. DOI:10.1111/jpy.2001.37.issue-6 |
| [74] |
Elisabeth AH, Bobby HB, James S et al. Nitrogen deposition on the United States and Western Europe: Synthesis of observations and models. Ecological Applications, 2005, 15(1): 38-57. DOI:10.1890/03-5162 |
| [75] |
Cassie CK, Jennifer B, Blair PG. Case studies in dam decommissioning at the bureau of reclamation. World Water & Environmental Resources Congress, 2003. |
| [76] |
John D, Yves TP, Jonathan C et al. The global abundance and size distribution of lakes, ponds, and impoundments. The American Society of Limnology and Oceanography, 2009, 51(5): 469-478. |
| [77] |
Nichols TD, Wolf DC, Rogers HB et al. Rhizosphere microbial populations in contaminated soils. Water Air & Soil Pollution, 1997, 95(1/2/3/4): 165-178. |
| [78] |
Ryan KM, Mary KF. Phenanthrene-degrader community dynamics in rhizosphere soil from a common annual grass. Journal of Environmental Quality, 2000, 29(2): 584-592. |
| [79] |
Christine BW, Caitliin HF, Keisuke K et al. Differential N2O dynamics in two oxygen-deficient lake basins revealed by stable isotope and isotopomer distributions. Limnology and Oceanography, 2016, 61(5): 1-15. |
| [80] |
Johanna S, Lars L. Greenhouse gas production in a pond sediment: effects of temperature, nitrate, acetate and season. Science of the Total Environment, 2007, 387(1): 194-205. |
| [81] |
Wu J, Zhang J, Jia WL et al. Impact of COD/N ratio on nitrous oxide emission from microcosm wetlands and their performance in removing nitrogen from wastewater. Bioresource Technology, 2009, 100(12): 2910-2917. DOI:10.1016/j.biortech.2009.01.056 |
| [82] |
Zhou S, Hou H, Masaaki H. Nitrogen removal, N2O emission, and NH3 volatilization under different water levels in a vertical flow treatment system. Water Air & Soil Pollution, 2008, 191(1/2/3/4): 171-182. |
| [83] |
Huang L, Gao X, Gou JS et al. A review on the mechanism and affecting factors of nitrous oxide emission in constructed wetlands. Environmental Earth Sciences, 2013, 68(8): 2171-2180. DOI:10.1007/s12665-012-1900-z |
| [84] |
Dorland S, Beauchamp EG. Denitrification and ammonification at low soil temperatures. Canadian Journal of Soil Science, 1991, 71(3): 293-303. DOI:10.4141/cjss91-029 |
| [85] |
Silvennoinen H, Liikanen A, Torssonen J et al. Denitrification and N2O effluxes in the Bothnian Bay (Northern Baltic Sea) river sediments as affected by temperature under different oxygen concentrations. Biogeochemistry, 2008, 88(1): 63-72. DOI:10.1007/s10533-008-9194-7 |
| [86] |
Wang FY, Andre T, Landis H. Oxygen measurements in the burrows of freshwater insects. Freshwater Biology, 2010, 46(3): 317-327. |
| [87] |
Hymel SN, Craig JP. Feeding and bacteriolytic responses of the deposit-feeder Abarenicola pacifica (Polychaeta: Arenicolidae) to changes in temperature and sediment food concentration. Marine Biology, 2000, 136(6): 1019-1027. DOI:10.1007/s002270000301 |
| [88] |
Usui T, Koike I, Ogura U. N2O production, nitrification and denitrification in an estuarine sediment. Estuarine Coastal & Shelf Science, 2001, 52(6): 769-781. |
| [89] |
Craig AS, John TW, Lynette C et al. N2O emissions from streams in the Neuse River Watershed, North Carolina. Environmental Science & Technology, 2005, 39(18): 6999-7004. |
| [90] |
Robert EM, Roger K. Production of NO and N2O in the presence and absence of C2H2 by soil slurries and batch cultures of denitrifying bacteria. Soil Biology & Biochemistry, 2003, 35(8): 1115-1122. |
| [91] |
Beaulieu JJ, Jennifer LT, Stephen KH. Nitrous oxide emission from denitrification in stream and river networks. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(1): 214-219. DOI:10.1073/pnas.1011464108 |
| [92] |
Donald EC, Alexander NG, Paul GF. The evolution and future of Earth's nitrogen cycle. Science, 2010, 330(6001): 192-196. DOI:10.1126/science.1186120 |
| [93] |
Zheng H, Keisuke H, Matsuo T. Production of nitrous oxide gas during nitrification of wastewater. Water Science & Technology, 1994, 30(6): 133-141. |
| [94] |
Rajkumar AN, Barnes J, Ramesh R et al. Methane and nitrous oxide fluxes in the polluted Adyar River and estuary, SE India. Marine Pollution Bulletin, 2008, 56(12): 2043-2051. DOI:10.1016/j.marpolbul.2008.08.005 |
| [95] |
Park KY, Inamori Y, Motoyuki M et al. Emission and control of nitrous oxide from a biological wastewater treatment system with intermittent aeration. Journal of Bioscience & Bioengineering, 2000, 90(3): 247-252. |
| [96] |
Kim P, Skiba U, Pur A et al. Factors controlling regional differences in forest soil emission of nitrogen oxides (NO and N2O). Biogeosciences, 2006, 3(4): 651-661. DOI:10.5194/bg-3-651-2006 |
| [97] |
Itokawa H, Hanaki K, Matsuo T. Nitrous oxide production in high-loading biological nitrogen removal process under low COD/N ratio condition. Water Research, 2001, 35(3): 657-664. |
| [98] |
Yan X, Zhen J, Han Y et al. Effect of influent C/N ratio on N2O emissions from anaerobic/anoxic/oxic biological nitrogen removal processes. Environmental Science & Pollution Research, 2017, 24(71): 1-11. |
| [99] |
Rosa LP, Marco S, Bohdan M et al. Bogenic gas production from major Amazon reservoirs, Brazil. Hydrological Processes, 2003, 17(7): 1443-1450. DOI:10.1002/hyp.v17:7 |
| [100] |
Wanninkh Broecker WS. Gas exchange-wind speed relation measured with sulfur hexafluoride on a lake. Science, 1985, 227(4691): 1224-1226. DOI:10.1126/science.227.4691.1224 |
| [101] |
EricAD, Michael K, Heather EE et al. Testing a conceptual model of soil emissions of nitrous and nitric oxides. Bioscience, 2000, 50(8): 667-680. DOI:10.1641/0006-3568(2000)050[0667:TACMOS]2.0.CO;2 |
| [102] |
Lars L, Lars PN, Niels PR et al. Extreme emission of N2O from tropical wetland soil (pantanal, South america). Frontiers in Microbiology, 2013, 433(3): 1-13. |
| [103] |
Hill AR, Devito KJ, Campagnolo S et al. Subsurface denitrification in a forest riparian zone: interactions between hydrology and supplies of nitrate and organic carbon. Biogeochemistry, 2000, 51(2): 193-223. DOI:10.1023/A:1006476514038 |
| [104] |
Robert MH, Jeremy BJ, Stuart GF et al. Denitrification in a nitrogen-limited stream ecosystem. Biogeochemistry, 1996, 33(2): 125-146. DOI:10.1007/BF02181035 |
| [105] |
Gu X, Chen K, Fan C. Preliminary evidence of effects of Phragmites australis growth on N2O emissions by laboratory microcosms. Ecological Engineering, 2015, 83(5): 33-38. |
| [106] |
Windham L, Lathrop R. Effects of Phragmites australis (common reed) invasion on aboveground biomass and soil properties in brackish tidal marsh of the Mullica river, New Jersey. Estuaries, 1999, 22(4): 927-935. DOI:10.2307/1353072 |
| [107] |
Williams J, Crutzen PJ. Nitrous oxide from aquaculture. Nature Geoscience, 2010, 3(3): 143. |
| [108] |
Hu Z, Jae WL, Kartik C et al. Nitrous oxide (N2O) emission from aquaculture: a review. Environmental Science & Technology, 2012, 46(12): 6470-6480. DOI:10.1021/es300110x |
| [109] |
Eric D, Marc L, Rene C et al. Comparison of static chamber and thin boundary layer equation methods for measuring greenhouse gas emissions from large water bodies. Environmental Science & Technology, 1999, 33(2): 350-357. |
| [110] |
Crosswell JR, Wetz MS, Hales B et al. Air-water CO2 fluxes in the microtidal Neuse River Estuary, North Carolina. Journal of Geophysical Research Oceans, 2012, 117(C08017): 1-12. |
| [111] |
Hang Y, Zhen YF, Wu RJ et al. Nitrous oxide flux at the water-air interface of the rivers in Nanjing during summer. Environmental Science, 2014, 35(1): 348-355. [韩洋, 郑有飞, 吴荣军等. 南京河流夏季水-气界面N2O排放通量. 环境科学, 2014, 35(1): 348-355.] |
| [112] |
Frédéric G, Gwenaël A, Dominique S et al. Gas transfer velocities of CO2 and CH4 in a tropical reservoir and its river downstream. Journal of Marine Systems, 2007, 66(1-4): 161-172. DOI:10.1016/j.jmarsys.2006.03.019 |
| [113] |
Michael K, Robert FS. Methane emission by bubbling form Gatun Lake, Panama. Journal of Geophysical Research Atmospheres, 1994, 99(4): 8307-8319. |
| [114] |
Yang P, Tong C. Emission paths and measurement methods for greenhouse gas fluxes from freshwater ecosystems: A review. Acta Ecologica Sinica, 2015, 35(20): 6868-6880. [杨平, 仝川. 淡水水生生态系统温室气体排放的主要途径及影响因素研究进展. 生态学报, 2015, 35(20): 6868-6880.] |
| [115] |
Zhao Y, Zeng Y, Wu BF et al. Review of methods for measuring greenhouse gas flux from the air-water interface of reservoirs. Advances in Water Science, 2011, 22(1): 135-146. [赵炎, 曾源, 吴炳方等. 水库水气界面温室气体通量监测方法综述. 水科学进展, 2011, 22(1): 135-146.] |
| [116] |
Rik W. Relationship between wind speed and gas exchange over the ocean. Journal of Geophysical Research Oceans, 1992, 97(C5): 7373-7382. DOI:10.1029/92JC00188 |
| [117] |
Peter AR, Jonathan JC. Cole, gas exchange in rivers and estuaries: Choosing a gas transfer velocity. Estuaries, 2001, 24(2): 312-317. DOI:10.2307/1352954 |
| [118] |
Nicolas S, Eric D, Rene C et al. Greenhouse gas emissions from reservoirs of the western United States. Global Biogeochemical Cycles, 2004, 18(3): 3022-3032. |
| [119] |
Nicolas S, Rene C, Marc L. Evaluation of two current approaches for the measurement of carbon dioxide diffusive fluxes from lentic ecosystems. Environmental Science & Technology, 2008, 42(8): 2964-2969. |
| [120] |
Dominic V, Yves TP, Jonathan C. The relationship between near-surface turbulence and gas transfer velocity in freshwater systems and its implications for floating chamber measurements of gas exchange. Limnology and Oceanography, 2010, 55(4): 1723-1732. DOI:10.4319/lo.2010.55.4.1723 |
| [121] |
Gao J, Zheng XH, Wang R et al. Preliminary comparison of the static floating chamber and the diffusion model methods for measuring water-atmosphere exchanges of methane and nitrous oxide from inland water bodies. Climatic and Environmental Research, 2014, 19(3): 290-302. [高洁, 郑循华, 王睿等. 漂浮通量箱法和扩散模型法测定内陆水体CH4和N2O排放通量的初步比较研究. 气候与环境研究, 2014, 19(3): 290-302.] |
| [122] |
Wang K, Liu C, Zheng X et al. Comparison between static chamber and tunable diode laser-based eddy covariance techniques for measuring nitrous oxide fluxes from a cotton field. Agricultural & Forest Meteorology, 2013, 171/172(8): 9-19. |
| [123] |
Cory JDM, Vincent SL, Hesslein RH. Comparison of three techniques used to measure diffusive gas exchange from sheltered aquatic surfaces. Environmental Science & Technology, 2003, 37(4): 772-780. |
| [124] |
Dennis DB. Assessing the eddy covariance technique for evaluating carbon dioxide exchange rates of ecosystems: past, present and future. Global Change Biology, 2003, 9(4): 479-492. |
 2019, Vol. 31
2019, Vol. 31 

