(2: 青海省盐湖资源化学重点实验室, 西宁 810008)
(2: Key Laboratory of Salt Lake Resources Chemistry of Qinghai Province, Xining 810008, P. R. China)
盐湖是在封闭性汇水盆地及错综复杂的地质条件下,自然界富含成盐元素的水体在干旱为主的气候条件下长期演化、发展到末期的产物[1].卤水矿化度非常高,已经接近或达到饱和状态[2].卤水富含多种盐类矿物,如石盐、碱、芒硝及发展国民经济所急需的K、Li、B、Mg、Rb、Cs、Sr、U等矿物原料,极具开发前景和利用价值[3-5].随着矿石资源的日益枯竭,盐湖蕴藏的多种矿产资源在国民经济中发挥着越来越重要的作用.我国盐湖资源集中分布于青藏高原,该地区具有日照充足、多风沙、少降水、蒸发量大等气候特征,适宜于盐田技术进行大规模卤水开发,尤以夏季突出.以水盐体系相图为理论计算依据,开展盐湖卤水水化学及夏季蒸发中K、Li、B等行为实验研究,对盐湖卤水的实际盐田滩晒工艺设计和生产具有重要意义.
一里坪盐湖位于青海柴达木盆地中部,卤水富含K、Li、B、Mg等元素资源,具有很高的工业开发价值[6];地质成盐特征及水文地球化学等研究表明,一里坪盐湖与东台吉乃尔湖和西台吉乃尔湖“三湖”属于那棱格勒河(即那仁郭勒河)水系所形成冲积扇的扇前湖,盐湖卤水中的锂、硼、钾等资源主要来自洪水河-那棱格勒河(洪-那)水系中的洪水河补给[7-8]. “三湖”卤水类型虽同属于硫酸镁亚型,但水化学组成不相同,一里坪卤水中Li+、B2O3、SO42-等浓度及矿化度较东、西台吉乃尔湖低,K+、Mg2+等浓度反向升高[9],从而具有极高镁锂比、高镁硼比的显著特征,自然蒸发结晶规律有很大差异,需对其进行必要的蒸发实验研究.
作为柴达木盆地最后一个待开发的盐湖,目前关于一里坪盐湖研究的文献报道很少. 1999年姚燕等[10]引入Pitzer离子作用模型,对一里坪盐湖晶间卤水中离子和盐的活度系数、卤水的渗透系数、水活度、蒸汽压等卤水物化性质进行预测.之后相继进行了相关的蒸发实验研究:夏季蒸发过程中,K以钾混盐、光卤石形式结晶[11-12];冬季蒸发过程中,卤水中的SO42-以芒硝、白钠镁矾、泻利盐等形式结晶后,K以钾石盐、光卤石形式结晶[12-13];当蒸发温度升至32~35℃时,钾混盐阶段出现新的物相钾盐镁矾[12, 14];Li、B在不同蒸发过程中均得到浓缩,浓缩倍数低于卤水浓缩倍数,表明蒸发过程中两元素存在一定损失,由结晶固相夹湿所致,尤以水氯镁石最为严重[15].而关于一里坪盐湖晶间卤水水化学特征变化及卤水夏季蒸发计算等方面研究尚未有相关报道.
本文以柴达木盆地一里坪盐湖晶间卤水为研究对象,以Na+, K+, Mg2+//Cl-, SO42--H2O五元水盐体系介稳(25℃[16]、15℃[17])、稳定(0℃[18])相图及其他含Li+、borate、Mg2+水盐体系相图为理论指导,综合利用水盐体系干基图、水图及钠图,研究分析卤水水化学类型、特征变化,对一里坪盐湖卤水进行夏季蒸发理论计算,并对其进行实际蒸发浓缩,研究卤水盐类结晶规律及过程中各离子尤其K+、Mg2+、SO42-、Li+、B2O3等的行为,对比分析硫酸盐型卤水水化学特征与钾盐成盐特征的关系,为综合开发利用一里坪盐湖卤水或其他极高镁锂比、高镁硼比的硫酸盐型卤水中K、Li、B等资源提供盐田工艺设计基础和理论依据指导.
1 实验部分 1.1 原料原料为一里坪盐湖晶间卤水.
依据取样时间进行分类,L10为2012年1月钻孔取得的那棱格勒河洪水溶浸后浅层晶间卤水(2009-2011年那棱格勒河流域发生两千年一遇洪水),卤水采集深度4 m. L20为2014年7月洪水退去后大规模采输卤得到的晶间卤水,卤水采集深度13 m. 表 1为晶间卤水相关组分分析结果.
| 表 1 柴达木盆地一里坪盐湖晶间卤水化学组成 Tab. 1 Chemical composition of the intercrystal brine of Yiliping salt lake in Qaidam Basin |
通过计算卤水类型和水化学特征系数[19],一里坪晶间卤水类型始终为硫酸镁亚型,主成分近似用Na+, K+, Mg2+//Cl-, SO42--H2O五元水盐体系相图来表示,卤水K、Li水化学特征系数高,为K、Li盐的集中区.初始卤水Li、B等微量元素含量较低,须通过卤水蒸发浓缩提高含量,为进一步开发利用奠定基础.
1.2 卤水蒸发理论预测计算利用Na+, K+, Mg2+//Cl-, SO42--H2O五元水盐体系介稳相图数据[16-17],对一里坪盐湖晶间卤水夏季蒸发过程进行理论预测,确定蒸发过程中的析盐顺序、种类及卤水浓缩规律.结合该五元体系干基图、水图、钠图,运用过程向量法和直线规则[20],计算卤水蒸发各阶段水分蒸失率、析盐率、盐类组成及成卤率,为一里坪盐湖盐田蒸发阶段的精确控制,以及获取高品位钾盐矿提供理论支撑.
1.3 卤水蒸发实验卤水L10和L20蒸发实验在室内进行,晶间卤水初始量为50.00 kg,控制蒸发温度为20~25℃.以阶段水分蒸失率理论计算结果为实验控制节点,当晶间卤水蒸至第一阶段蒸发节点时,进行固液分离;分离后的卤水继续蒸至第二阶段蒸发节点,再进行固液分离;以此类推,避免各个阶段内多次固液分离的重复性工作.对分离后的卤水和湿固相进行组分分析,测定卤水的波美度,并以X-射线衍射仪判断固相物相,验证理论预测的准确性.
1.4 试样的分析和鉴定方法本实验离子组分采用的分析方法[21]:Cl-:硝酸汞容量法;SO42-:硫酸钡重量法;K+:四苯硼化钠重量法;Ca2+、Mg2+:EDTA容量法;B2O3:甘露醇法;Li+:原子发射光谱法(等离子体发射光谱仪,ICAP 6500 DUO,美国热电公司);Na+:差减法计算.固相的物相以X-射线衍射仪(X′ pert Pro,荷兰帕纳科公司)鉴定.卤水的波美度由玻璃比重计测定.
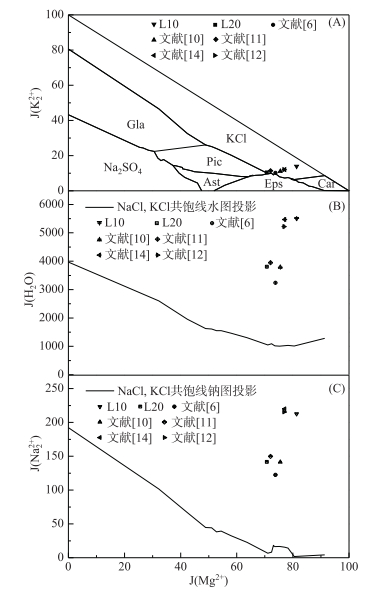
2 结果与讨论 2.1 晶间卤水水化学特征变化分析将实验晶间卤水组成与不同年代取样的晶间卤水进行统计对比(表 2).以1960年晶间卤水组成为参考标准,对晶间卤水组成进行相对偏差计算,晶间卤水各离子组成波动见图 1.同时将晶间卤水组成标绘于25℃ Na+, K+, Mg2+//Cl-, SO42--H2O五元水盐体系介稳干基图、水图和钠图(图 2).
| 表 2 不同年代一里坪晶间卤水化学组成 Tab. 2 Chemical composition of Yiliping intercrystal brine at different times |

|
图 1 一里坪晶间卤水各离子组成随年代波动 Fig.1 The ion composition fluctuation of Yiliping intercrystal brine at different times |
|
图 2 不同年代一里坪卤水组成位置于25℃五元介稳体系Na+, K+, Mg2+//Cl-, SO42--H2O干基图(A),水图(B),钠图(C) (Gla-钾芒硝,Pic-软钾镁矾,Ast-白钠镁矾,Eps-泻利盐,Car-光卤石,Bis-水氯镁石) Fig.2 Position of Yiliping brine at different times in the metastable phase diagram of reciprocal quinary system Na+, K+, Mg2+//Cl-, SO42--H2O at 25℃(A), the projection phase diagram of water(B) and sodium(C) (Gla-Glaserite, Pic-Picromerite, Ast-Astrakhanite, Eps-Epsomite, Car-Carnallite, Bis-Bischofite) |
由表 2和图 1、2可知,在无外界影响的条件下,2009年洪水发生前晶间卤水组成、性质相对稳定,卤水矿化度介于335~340 g/L,相对平均偏差仅为1.06 %;各离子的相对偏差控制在-0.30~0.02范围内.那棱格勒河流域洪水发生后,受洪水的外来影响,晶间卤水组成、特征发生显著变化,卤水矿化度降至315~320 g/L;离子的相对偏差变化趋势不尽相同,Na+,Cl-相对偏差控制在-0.01~0.11范围内,K+、Mg2+、B2O3、Li+相对偏差降至-0.50~-0.15范围内,SO42-相对偏差降至-0.75~-0.50范围内.反映在Na+, K+, Mg2+//Cl-, SO42--H2O五元水盐体系介稳水图和钠图中(图 2B、2C),卤水J(H2O)、J(Na22+)值与洪水前相比,大幅度升高;同时由于SO42-质量分数降低趋势最大,卤水变质系数MgSO4/MgCl2比值大幅度降低,反映在五元体系介稳干基图中(图 2A),卤水组成点向KCl-MgCl2边线方向移动,卤水特征由硫酸镁亚型向氯化物型转化过渡.洪水退去后,晶间卤水组成及特征重新恢复至初始状态,表明在无外界河流或其他补给影响的条件下,一里坪晶间卤水水化学特征保持稳定.
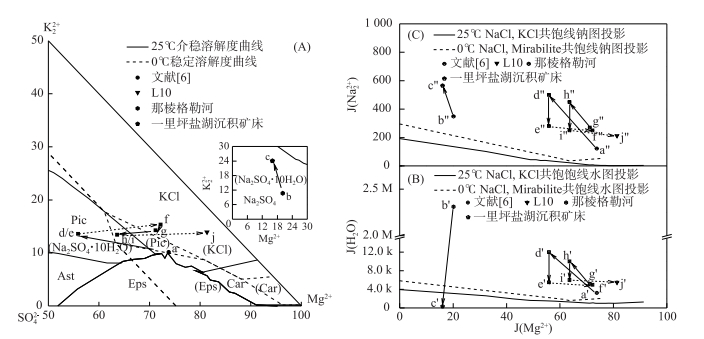
上述组成及水化学特征变化过程,可以用Na+, K+, Mg2+//Cl-, SO42--H2O五元水盐体系相图(图 3)来说明,以1960年晶间卤水为对象,设定晶间卤水年温度在0~25℃之间变化.
|
图 3 一里坪卤水组成变化轨迹于0~25℃五元体系Na+, K+, Mg2+//Cl-, SO42--H2O干基图(A)、水图(B),钠图(C)[6] Fig.3 Movements of Yiliping brine in the phase diagram of reciprocal quinary system Na+, K+, Mg2+//Cl-, SO42--H2O at 0℃ and 25℃(A), the projection phase diagram of water(B) and sodium(C) |
依据柴达木盆地区域地球化学及水化学特征研究[6],一里坪盐湖补给淡水及沉积矿床平均组分见表 3.夏、秋季(如25℃)那棱格勒河水系汛期来临时,大量淡水涌入一里坪干盐滩进行补给,溶解矿层中的石盐;随着淡水的不断下渗,石盐层中的钾石盐、石膏、芒硝、白钠镁矾等继续被选择性溶解,K+、Ca2+、Mg2+、SO42-和NaCl等离子和矿物进入淡水,但仍处于不饱和状态,如图 3A所示,b→c表示夏、秋季较高温度下淡水补给下一里坪沉积矿层选择性溶解的过程.淡水下渗过程中,与矿层中共存的晶间卤水发生掺杂,晶间卤水中K+、SO42-、NaCl等相对含量升高,组成点进入软钾镁矾相区,同时淡水的引入使其进入不饱和状态,a→d表示晶间卤水与选择性溶解后淡水之间掺杂作用的过程.
| 表 3 一里坪盐湖区补给淡水和沉积矿床平均化学组成 Tab. 3 Average chemical composition of supplemental water and salt deposits in Yiliping lake area |
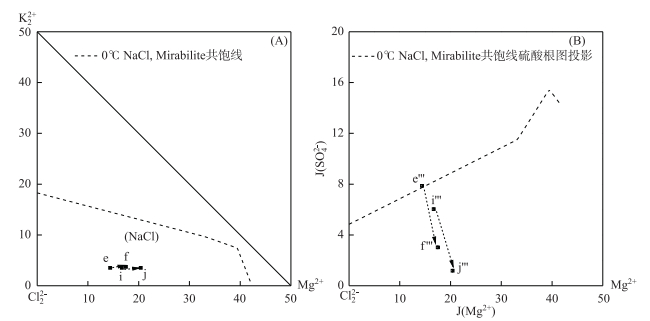
柴达木盆地每年4-10月气温较高,为全年的主要蒸发季节.掺杂后的晶间卤水蒸发浓缩(如25℃),盐度升高至NaCl饱和阶段,如图 3-B所示,d′→e′表示随着NaCl的析出晶间卤水组成点的变化;此时软钾镁矾未饱和,卤水干基组成点不变,图 3-A所示;图 3-C钠图d″→e″表示浓缩过程中NaCl的不断析出.进入10月后气温大幅度降低(如0℃),由于温度对芒硝和石盐溶解度影响很大[22],如图 4 Na+, K+, Mg2+//Cl-, SO42--H2O五元水盐体系0℃局部NaCl相区相图(对芒硝饱和)所示,此时芒硝呈饱和状态而开始析出,卤水中Na2SO4含量急剧减少,MgCl2含量急剧升高,如图 3-A e→f所示,卤水组成点进入氯化钾相区,水化学特征由硫酸镁亚型向氯化物型转化过渡;图 4-B硫酸根图e'''→f'''表示低温蒸发析硝的过程.
|
图 4 一里坪卤水组成变化轨迹于低温0℃五元体系Na+, K+, Mg2+//Cl-, SO42--H2O局部干基图(A)(芒硝饱和),硫酸根图(B)[6] Fig.4 Movements of Yiliping intercrystal brine in the partial phase diagram of reciprocal quinary system Na+, K+, Mg2+//Cl-, SO42--H2O at 0℃(A) (Mirabilite saturated), the projection phase diagram of sulfate(B) |
第二年随着温度的回升,前一年析出的芒硝部分被重新溶解,f→g表示回溶过程中卤水组成点的变化. 4月后随着汛期的再次来临,晶间卤水存在选择性溶解、掺杂、蒸发浓缩、低温析硝等往复变化(图 3所示g→h→i→j变化过程),从而导致卤水水化学特征随不同季节而发生改变.
综上所述,一里坪盐湖晶间卤水水化学特征变化是由淡水补给掺杂作用[23]、选择性溶解[24]及年温差[25]等多重因素影响所致.其中温度为主要影响因素.晶间卤水L10取样时间为2012年1月,此时为低温析硝阶段,卤水中SO42-含量大幅度降低,水化学变质系数MgSO4/MgCl2比值急剧下降,卤水组成点进入氯化钾相区,与表 1的分析结果相一致,进一步证实了卤水该阶段的水化学特征变化过程.
2.2 蒸发理论预测计算结果依据卤水蒸发实验控制温度20~25℃,本文选择25℃ Na+, K+, Mg2+//Cl-, SO42--H2O五元体系介稳相图[16]数据,进行卤水蒸发理论预测计算.
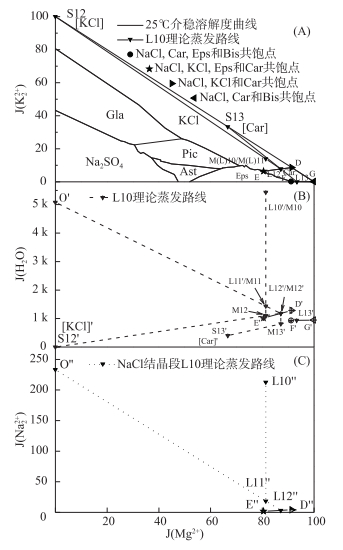
一里坪晶间卤水组成以NaCl最多,蒸发时首先对NaCl饱和,并且此后NaCl始终饱和.卤水L10初始干基组成点位于KCl相区,运用过程向量法,卤水L10的蒸发析盐路线为:NaCl(石盐段)→NaCl、KCl(钾石盐段)→NaCl、Car(光卤石段)(图 5-A所示L10→L13变化过程);在NaCl析出阶段,利用Na+, K+//Cl--H2O三元体系25℃时NaCl、KCl共饱点水图O′及钠图O″,预测NaCl析出至对KCl饱和界线点水图L11′及钠图L11″[20](图 5-B、5-C所示);光卤石段固相析出后剩余的卤水组成接近25℃介稳相图无变量点F(NaCl、Car、Eps与Bis共饱点).利用直线规则,理论计算卤水各节点组成、成卤率,析盐种类、含量、析盐率及水分蒸失率等各类工艺参数,结果见表 4. K以KCl和Car两种形式析出,总析出率为85 %,其中以KCl形式析出率为34 %,以Car形式析出率为51 %.
|
图 5 L10卤水25℃理论蒸发路线 Fig.5 L10 theoretical evaporation route in the metastable phase diagram of reciprocal quinary system Na+, K+, Mg2+//Cl-, SO42--H2O at 25℃(A), the projection phase diagram of water(B) and sodium(C) |
| 表 4 L10卤水25℃理论蒸发计算结果 Tab. 4 Theoretical evaporation results of L10 at 25℃ |
由于卤水L20初始干基组成点非常接近KCl、Eps共饱线,卤水L20的蒸发析盐路线为:NaCl(石盐段)→ NaCl、KCl、Eps(钾混盐段)→NaCl、Car、Eps(光卤石段)(图 6-A所示L20→L23变化过程),Eps与KCl或Car共同析出;同样利用Na+, K+//Cl--H2O三元体系25℃时NaCl、KCl共饱点水图O′及钠图O″,预测NaCl析出至对KCl、Eps共饱和界线点水图L21′及钠图L21″[20](图 6-B、6-C所示);光卤石段固相析出后剩余的卤水组成同样接近25℃介稳相图无变量点F.利用直线规则,相关理论计算结果见表 5. K仍以KCl和Car两种形式析出,总析出率为98 %,其中以KCl形式析出率为57 %,以Car形式析出率为41 %.
|
图 6 L20卤水25℃理论蒸发路线 Fig.6 L20 theoretical evaporation route in the metastable phase diagram of reciprocal quinary system Na+, K+, Mg2+//Cl-, SO42--H2O at 25℃(A), the projection phase diagram of water(B) and sodium(C) |
| 表 5 L20卤水25℃理论蒸发计算结果 Tab. 5 Theoretical evaporation results of L20 at 25℃ |
以阶段水分蒸失率理论计算结果控制实际卤水蒸发,蒸发结果分别见表 6和表 7.分析结果表明,各阶段的湿固相中均附着一定量的母液[15].为精确考察各个离子在卤水蒸发过程中的行为变化,本文对各阶段析盐率、盐类组成和成卤率的实测结果,采用以下方式进行修正处理[26]:对各阶段湿固相进行X-射线衍射物相鉴定(图 7和图 8),以各阶段湿固相中Li、B2O3或其他不以固体盐形式析出的组分含量作为分离湿固相中附着母液量的计算参数,计算湿固相中的附着母液量,从而得到在这一阶段纯固相的析出量(等于湿固相量-附着母液量),固相所含物相组成和真实的浓缩卤水量(等于实测残存卤水量+附着母液量),进而修正各阶段的析盐率和成卤率,修正后蒸发结果见表 6和表 7.
| 表 6 L10卤水蒸发实验修正后结果 Tab. 6 Experimental evaporation results of L10 (modified) |
| 表 7 L20卤水蒸发实验修正后结果 Tab. 7 Experimental evaporation results of L20 (modified) |

|
图 7 L10蒸发过程中石盐段(A)、钾石盐段(B)和光卤石段(C)物相鉴定 Fig.7 XRD patter analysis in the stage of halite(A), sylvite(B), and carnallite(C) during L10 evaporation |
|
图 8 L20蒸发过程中石盐段(A)、钾混盐段(B)和光卤石段(C)物相鉴定 Fig.8 XRD patter analysis in the stage of halite(A), potassium mixed salt(B), and carnallite(C) during L20 evaporation |
经过计算,L10卤水中CaSO4的初始浓度积为1293 (mmol/L)2,接近饱和状态[27-29];随着卤水的不断浓缩,CaSO4达到过饱和状态,以生石膏的形式与其他盐类共同析出,其中石盐段生石膏的沉积率占总石膏量的91.71 %. L20初始卤水中不含Ca2+离子,蒸发析盐过程中始终无生石膏固相析出.
石盐段的目标是尽可能多的NaCl从卤水中沉积,同时避免其他盐的析出,影响NaCl的含量.修正后L10卤水石盐段固相NaCl含量达到97.64 %,本阶段NaCl的沉积率占NaCl总量的92.35 %. L20卤水由于不含Ca2+离子,石盐段固相NaCl含量达到100.00 %,本阶段NaCl的沉积率占NaCl总量的97.52 %.石盐段剩余卤水(即卤水L11′和L21′)中K+、Mg2+、SO42-等离子质量分数增大,卤水中K+离子呈饱和状态,即将进入钾盐析出阶段.
由于石盐段剩余卤水中SO42-离子质量分数不同,L10和L20卤水在钾盐阶段析出固相组分截然不同.修正后L11′卤水中K以KCl和Car两种形式析出,总析出率为98.78 %,分两个阶段进行:第1阶段为钾石盐段,此时卤水组成点靠近KCl与Car共饱线,KCl与Car同时析出,K的阶段析出率为55.52 %,其中以KCl形式的K析出率为30.36 %,以Car形式的钾析出率为25.16 %,两种形式K的析出质量比为K(KCl):K(Car)= 1.21:1.00;第2阶段为光卤石段,K的阶段析出率为43.26 %,以Car形式析出为主,析出率为38.48 %,其余以KCl形式的K析出率仅为4.78 %.由于L11′卤水中SO42-离子质量分数低,钾盐析出过程中无泻利盐共同析出,该段固相均为氯化物,可用于制备KCl.
根据修正后钾盐阶段蒸发计算结果,L21′卤水K仍以KCl和Car两种形式析出,总析出率为94.15 %.与L10卤水不同,由于L21′卤水中SO42-离子质量分数高,蒸发过程中泻利盐与钾盐共同析出,固相与L10卤水钾盐段不同,分两个阶段进行:第一阶段为钾混盐段,K仅以KCl形式析出,K的阶段析出率为44.17 %;第二阶段为光卤石段,K的阶段析出率为49.98 %,以Car形式析出为主,析出率为38.78 %,其余11.20 %以KCl形式析出,两种形式K的析出质量比为K(KCl):K(Car)=1.00:3.46.由于析出固相存在泻利盐,L20卤水蒸发获得的钾盐用于制备软钾镁矾或硫酸钾等硫酸盐产品.
通过石盐段和钾盐段的析盐,钾盐段剩余的卤水(即卤水L13′和L23′)中Na+、K+离子质量分数分别降至0.60 %和0.30 %以下,盐分均以MgCl2和MgSO4为主,MgCl2接近饱和状态.同时Li、B等微量元素含量得到大幅度提高,卤水进入老卤阶段,老卤水组成近似以Li+, Mg2+//Cl-, SO42-, borate-H2O五元水盐体系相图表示.
2.4 硫酸盐型卤水钾盐成盐特征分析硫酸盐型卤水钾盐成盐特征与卤水水化学特征系数密切相关,因其特征系数不同,卤水的结晶途径存在着差异,所形成的钾盐及其矿物组分也不尽相同.
依据一里坪盐湖卤水实际蒸发实验结果,计算统计各阶段卤水水化学特征系数MgSO4/MgCl2、KCl/MgCl2、Mg2+/Li+、Mg2+/B2O3等质量比值(表 8).同时以特征系数KCl/MgCl2比值为x,变质系数MgSO4/MgCl2比值为y,分析各阶段卤水水化学特征系数变化(图 9).
| 表 8 实际蒸发过程中一里坪卤水水化学特征系数变化 Tab. 8 Hydrochemical characteristic coefficients of Yiliping brines during the experimental evaporation |
|
图 9 一里坪卤水蒸发过程中钾盐沉积段组成与水化学特征系数关系 Fig.9 Correlation between solid phase compostition and hydrochemical characteristic coefficients of Yiliping brines during the experimental evaporation |
利用金作美[16]等25℃ Na+, K+, Mg2+//Cl-, SO42--H2O五元体系介稳相图数据,计算共饱点E、F的水化学特征系数MgSO4/MgCl2、KCl/MgCl2,对硫酸盐型卤水盐分结晶区域进行分区,如图 9虚线所示.水化学特征系数KCl/MgCl2高于0.15时,卤水中的K优先以KCl形式析出;降至0.0031~0.15范围内,K以Car形式结晶.变质系数MgSO4/MgCl2高于0.13时,卤水钾盐矿物析出的同时,伴随着含镁硫酸盐(即泻利盐)的析出;低于0.13时,卤水无泻利盐析出,卤水水化学特征向氯化物型过渡.
25℃温度下一里坪初始卤水L10和L20特征系数KCl/MgCl2均高于0.15,K以KCl和Car两种形式析出,特征系数逐渐减小;卤水L20变质系数MgSO4/MgCl2质量比值为0.46,高于泻利盐析出限值0.13,蒸发过程中泻利盐与钾盐共同析出;而卤水L10变质系数MgSO4/MgCl2质量比值0.078远低于泻利盐析出限值,蒸发过程中泻利盐不析出,得到的固相组分为氯化物;随着变质程度的加深,卤水的变质系数均向泻利盐析出限值移动,卤水水化学特征接近氯化物型,与一里坪盐湖卤水实际蒸发实验结果相一致.
2.5 卤水蒸发过程中Li+、B2O3等离子的行为依据修正后蒸发结果,对蒸发过程中各阶段的累积成卤率求倒数,即为卤水的浓缩倍数.用初始卤水中离子的质量分数去除浓缩卤水中离子的质量分数,即为离子在浓缩卤水中的富集倍数.以卤水浓缩倍数为x,离子富集倍数为y,分析卤水蒸发过程中Li+、B2O3等各离子的行为[26, 30](图 10).
|
图 10 L10(A)和L20(B)卤水蒸发浓缩倍数与浓缩卤水中离子富集倍数的关系 Fig.10 Correlation between ion concentration multiple and brine L10(A), L20(B) concentration multiple during the experimental evaporation |
受淡水补给等的作用L10卤水J(H2O)和J(Na22+)值升高,蒸发过程中浓缩倍数高于L20卤水(图 10).卤水中Na+、K+、Ca2+、Mg2+、SO42-等离子行为与固相析出过程相一致,蒸发过程向MgCl2饱和状态方向运动,卤水中Cl-离子呈近似线性缓慢增长趋势,经过线性拟合计算,L10卤水Cl-离子行为拟合斜率仅为0.055,L20卤水Cl-离子行为拟合斜率为0.076. B2O3、Li+等离子在浓缩卤水中的富集倍数与卤水的浓缩倍数始终一致,因此可以认为一里坪盐湖卤水蒸发至老卤阶段过程中Li、B均以离子形式完全赋存于浓缩卤水中.
钾盐成盐过程中,随着Mg2+离子不断以Car、Eps等形式析出,老卤水中残存的Mg2+离子总质量减少,浓缩卤水中的镁锂比(即Mg2+/Li+)、镁硼比(即Mg2+/B2O3)等质量比值呈逐渐降低趋势.由于L10卤水初始比值高于L20卤水,在卤水浓缩倍数接近的情况下,L10老卤水比值仍高于L20老卤水(图 11).
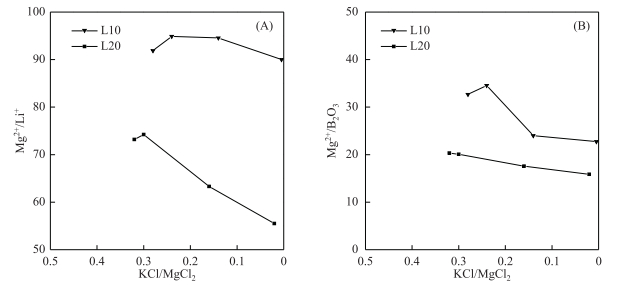
|
图 11 卤水蒸发过程中Mg2+/Li+、Mg2+/B2O3质量比值与水化学特征系数KCl/MgCl2的关系 Fig.11 Correlation between Mg2+/Li+(A), Mg2+/B2O3(B) and hydrochemical characteristic coefficients of Yiliping brines during the experimental evaporation |
图 12为卤水理论与实际蒸发路线对比. L10卤水中饱和CaSO4的存在,促使实际蒸发路线向Na2SO4组成点方向平行移动;而L20卤水不存在Ca2+离子沉积的影响,实际蒸发路线与理论路线接近重合.

|
图 12 L10(A)和L20(B)卤水理论与实际蒸发路线对比 Fig.12 Contrast of L10(A), L20(B) theoretical and experimental evaporation route in the metastable phase diagram of reciprocal quinary system Na+, K+, Mg2+//Cl-, SO42--H2O at 25℃ |
图 13为卤水理论计算与实际蒸发工艺累积比率对比.经过计算,L10卤水累积成卤率相对误差为3.94 %,累积析盐率相对误差为8.20 %;L20卤水累积成卤率相对误差为8.91 %,累积析盐率相对误差为2.28 %.整体相对误差均能控制在5 %范围内.

|
图 13 L10(A)和L20(B)理论计算与实际蒸发工艺累积比率对比 Fig.13 Contrast of L10(A), L20(B) theoretical and experimental accumulated rate during the evaporation |
经过蒸发路线、累计比率等多方面对比,利用25℃ Na+, K+, Mg2+//Cl-, SO42--H2O五元体系介稳相图进行理论预测,能够很好地指导一里坪盐湖卤水或其他极高镁锂比、高镁硼比的硫酸盐型卤水大规模蒸发析盐工艺,同时证实了金作美等[16]相图数据的准确性.
2.7 老卤水深度蒸发过程中Li+、B2O3的行为预测与周边的东、西台吉乃尔盐湖相比,一里坪盐湖卤水初始Mg2+/Li+、Mg2+/B2O3等质量比值较高,分别为70~95、20~35.经过钠盐与钾盐沉积,剩余老卤水的Li+、B2O3等离子质量分数分别增高至0.090 % ~0.14 %、0.35 % ~0.50 %,Mg2+/Li+、Mg2+/B2O3比值分别降至55~90、15~25,Li+、B2O3离子含量仍处于较低水平,因此仍需对老卤水进行深度蒸发,预测与分析Li+、B2O3的进一步行为.
针对青藏高原独特的高镁锂比盐湖类型,已有大量的含Li+、borate、Mg2+水盐体系相图研究报道[31-41].综合对比,选择郭智忠等[33]Li+, Mg2+//Cl-, SO42--H2O四元体系介稳相图(25℃)和王士强[36] Li+, Na+, Mg2+//Cl-, SO42--H2O五元体系介稳相图(0℃),预测变温条件下(0~25℃)老卤水深度蒸发过程中Li+的行为(图 14),表 9为相关含锂盐析出的共饱点液相结果.选择杜宪惠等[39]Mg2+//Cl-, SO42-, B4O72--H2O四元体系相图(25℃)和孟令宗[41] Li+, Mg2+//SO42-, borate-H2O四元体系介稳相图(0℃),预测变温条件下(0~25℃)老卤水深度蒸发过程中B2O3的行为(图 15),表 10为相关含硼酸盐析出的共饱点液相结果.

|
图 14 老卤水深度理论蒸发路线中Li+离子的行为 Fig.14 Li ion behavior in the metastable phase diagram of reciprocal quaternary system Li+, Mg2+//Cl-, SO42--H2O at 25℃[33](A), and reciprocal quinary system Li+, Na+, Mg2+//Cl-, SO42--H2O at 0℃[36](B) during the further evaporation(Ls-Lithium Sulfate Monohydrate, Lc-Lithium Chloride Monohydrate, LiC-Lithium Carnallite, Hex-Hexahydrite, Pen-Pentahydrite) |
| 表 9 含锂水盐体系共饱点液相数据 Tab. 9 Chemical composition of some co-saturated points in the Li-containing salt-water systems |

|
图 15 老卤水深度理论蒸发路线中B2O3的行为(Tet-四水泻盐,Ⅶ-镁硼酸盐) Fig.15 B2O3 behavior in the phase diagram of quaternary system Mg2+//Cl-, SO42-, B4O72--H2O at 25℃[39](A), and reciprocal quaternary system Li+, Mg2+//SO42-, borate-H2O at 0℃[41](B) during the further evaporation (Tet-Tetrahydrite, Ⅶ-Magnesium Borates) |
| 表 10 含硼水盐体系共饱点液相数据 Tab. 10 Chemical composition of some co-saturated points in the B-containing salt-water systems |
图 14所示,0~25℃温度内,一里坪老卤水初始点位于泻利盐(Eps、Hex或Pen)区域,依据相图过程向量法和直线规则,深度蒸发路线为Eps→Eps、Bis,至Li+离子开始以Ls(一水合硫酸锂)形式,与Eps、Bis共同析出(表 9中点R、T).在Ls析出前,Li+离子始终赋存于浓缩卤水中,Li+离子质量分数升高至0.30 % ~0.50 %.同时Eps、Bis等镁盐的进一步析出,剩余深度浓缩卤水中的Mg2+/Li+比值继续降低至16~27. Li2SO4溶解度温度系数为负值[42],与MgSO4、MgCl2溶解度趋势相反,在低温条件下Li+离子富集程度更高,卤水Mg2+/Li+比值更小.经过理论计算,25℃下,老卤水深度蒸发至点R时,卤水的阶段成卤率为43.91 %;0℃下,老卤水蒸发至点T时,卤水的阶段成卤率为23.91 %.
相近地,图 15所示含硼水盐体系相图,0~25℃温度内,一里坪老卤水初始点同样位于泻利盐(Eps、Hex、Pen或Tet)区域.低温(如0℃)条件下,结合王士强[34] Na+, Mg2+//Cl-, SO42--H2O四元体系介稳相图(0℃)数据,老卤水深度蒸发路线为Eps→Eps、Bis,至B2O3开始以MgB4O7 ·9H2O(章氏硼镁石)形式,与Eps、Bis共同析出(表 10中点P),升温至25℃蒸发时析出的硼酸盐为多种镁硼酸盐的统计形式(表 10中点M).
在镁硼酸盐析出前,B2O3同样始终赋存于浓缩卤水中,B2O3质量分数升高至2.50 % ~3.30 %,剩余深度浓缩卤水中的Mg2+/B2O3比值继续降低至3~5.经过理论计算,25℃下老卤水深度蒸发至点M时,卤水的阶段成卤率仅为13.12 %,0℃下老卤水蒸发至点P时,卤水的阶段成卤率为19.60 %.
综合含Li+、B2O3老卤水深度蒸发理论预测计算,一里坪老卤水深度蒸发过程中,剩余老卤水Mg2+/Li+比值降至27时,卤水中的Li+、B2O3仍以离子形式赋存于卤水中继续富集,Li+、B2O3等离子质量分数分别增高至0.30 % ~0.32 %、0.80 % ~1.15 %,一里坪卤水的累积成卤率仅为2.50 % ~3.20 %;本阶段析出盐类组分为Eps和Bis混合物,间接证明前述蒸发实验结果分析的合理性.受限于极低成卤率和镁盐结晶,直接蒸发获得高质量Li、B矿物不现实,引入新的Li、B提取工艺技术成为必然.
3 结论1) 综合利用Na+, K+, Mg2+//Cl-, SO42--H2O五元体系干基图、水图、钠图,研究了一里坪盐湖晶间卤水水化学特征随淡水补给掺杂、选择性溶解及年温差等因素发生的季节性变化,其中温度为主要因素.卤水温度降低至0℃时,卤水对芒硝呈饱和状态并开始析出芒硝,卤水变质系数MgSO4/MgCl2比值急剧下降,水化学特征由硫酸镁亚型向氯化物型转化过渡.
2) 从蒸发路线、液固相组成、X-射线衍射物相鉴定、水化学特征系数、工艺累积收率、离子行为等方面对一里坪晶间卤水进行蒸发析盐研究(20~25℃),K以钾石盐、光卤石、钾混盐等形式析出,Li、B等微量元素始终以离子形式富集于老卤水中.
3) 利用水化学特征系数KCl/MgCl2、MgSO4/MgCl2,分析了25℃下硫酸盐型盐湖钾盐成盐特征.水化学特征系数KCl/MgCl2高于0.15时,K先后以KCl、Car两种形式析出,同时变质系数MgSO4/MgCl2高于0.13时,伴随有泻利盐与钾盐共同析出.
4) 一里坪卤水蒸发沉积实验结果与理论预测计算综合对比,二者吻合程度比较好,整体相对误差能控制在5 %范围内,表明Na+, K+, Mg2+//Cl-, SO42--H2O五元体系介稳相图能够很好地指导实际硫酸盐型卤水蒸发析盐.
5) 利用含Li+、borate、Mg2+水盐体系相图,研究了一里坪老卤水深度蒸发中Li、B的行为.理论预测计算结果,剩余老卤水Mg2+/Li+比值降至27时,卤水中的Li、B仍以离子形式赋存于卤水中继续富集,Li+、B2O3等离子质量分数分别增高至0.30 % ~0.32 %、0.80 % ~1.15 %.卤水累积成卤率极低,仅为2.50 % ~3.20 %,需引入新的工艺技术进行Li、B提取.
| [1] |
Yang SX. The origin and distribution of salt lakes in Qinghai-Xizang Plateau. J Lake Sci, 1989, 1(1): 28-36. [杨绍修. 青藏高原盐湖的形成与分布. 湖泊科学, 1989, 1(1): 28-36. DOI:10.18307/1989.0104] |
| [2] |
Song PS, Li W, Sun B et al. Recent development on comprehensive utilization of salt lake resources. Chinese Journal of Inorganic Chemistry, 2011, 27(5): 801-805. [宋彭生, 李武, 孙柏等. 盐湖资源开发利用进展. 无机化学学报, 2011, 27(5): 801-805.] |
| [3] |
Zheng XY. Comprehensive utilization of salt lake resources over Qinghai-Xizang(Tibet) Plateau. J Lake Sci, 1994, 6(3): 267-275. [郑喜玉. 青藏高原盐湖资源的开发利用. 湖泊科学, 1994, 6(3): 267-275. DOI:10.18307/1994.0310] |
| [4] |
Gao SY, Song PS, Xia SP. Chemistry of salt lakes. Beijing: Science Press, 2007: 26-35. [高世扬, 宋彭生, 夏树屏等. 盐湖化学. 北京: 科学出版社, 2007: 26-35.]
|
| [5] |
Zhou Y, Li LJ, Wu ZJ et al. Exploitation and comprehensive utilization of Qinghai salt lakes. Progress in Chemistry, 2013, 25(10): 1613-1624. [周园, 李丽娟, 吴志坚等. 青海盐湖资源开发及综合利用. 化学进展, 2013, 25(10): 1613-1624.] |
| [6] |
Zhang PX. Salt lakes in Qaidam basin. Beijing: Science Press, 1987: 209-211. [张彭熹. 柴达木盆地盐湖. 北京: 科学出版社, 1987: 209-211.]
|
| [7] |
Zhu YZ, Li WS, Wu BH et al. New recognition on the geology of the Yiliping Lake and the east and west taijinar lakes in the Qaidam basin, Qinghai province. Geological Review, 1989, 35(6): 558-565. [朱允铸, 李文生, 吴必豪等. 青海省柴达木盆地一里坪和东、西台吉乃尔湖地质新认识. 地质论评, 1989, 35(6): 558-565. DOI:10.3321/j.issn:0371-5736.1989.06.009] |
| [8] |
Zhan DP, Yu JQ, Gao CL et al. Hydrogeochemical conditions and lithium brine formation in the four salt lakes of Qaidam basin. J Lake Sci, 2010, 22(5): 783-792. [展大鹏, 余俊清, 高春亮等. 柴达木盆地四盐湖卤水锂资源形成的水文地球化学条件. 湖泊科学, 2010, 22(5): 783-792. DOI:10.18307/2010.0522] |
| [9] |
Zhang PX, Zhang MG, Xu C. China salt lake scripts. Beijing: Science Press, 2002: 162-167. [张彭熹, 张明刚, 徐昶等. 中国盐湖志. 北京: 科学出版社, 2002: 162-167.]
|
| [10] |
Yao Y, Song PS, Zhang Q. Prediction of osmotic and activity coefficients and saturation degrees of a salt lake brine yiliping, Qinghai Li-Na-K-Mg-Cl-SO4-H2O system at 25℃. Oceanologia et Limnologia Sinica, 1999, 30(1): 6-13. [姚燕, 宋彭生, 张契. 青海一里平盐湖卤水Li-Na-K-Mg-Cl-SO4-H2O体系25℃时渗透系数、活度系数和饱和度的预测. 海洋与湖沼, 1999, 30(1): 6-13. DOI:10.3321/j.issn:0029-814X.1999.01.002] |
| [11] |
Li JD, Shi TC, Wang YX et al. Research on natural evaporation of brine in yiliping mining area. Journal of Salt Lake Science, 2008, 16(4): 32-36, 65. [李俊德, 石天成, 王英孝等. 一里坪矿区卤水自然蒸发试验研究. 盐湖研究, 2008, 16(4): 32-36, 65.] |
| [12] |
Bi SF. Study on natural and freezing evaporation of Yiliping brine[Dissertation]. Xining: Qinghai University, 2016. [毕思峰.一里坪盐湖卤水的自然及冷冻蒸发实验[学位论文].西宁: 青海大学, 2016. 一里坪盐湖卤水的自然及冷冻蒸发实验 ]
|
| [13] |
Yang CJ, Zhang DY, Wang QY et al. Study on natural evaporation of brine in Yiliping Salt Lake in winter. Industrial Minerals & Processing, 2014, 43(12): 29-31. [杨春节, 张大义, 汪全义等. 一里坪盐湖冬季卤水自然蒸发试验研究. 化工矿物与加工, 2014, 43(12): 29-31.] |
| [14] |
Li JG, Yu MX, Yu XF et al. Phase diagram and computation for the process of brine evaporation in Yiliping salt lake. Journal of Salt and Chemical Industry, 2011, 40(5): 40-43. [李建国, 余明祥, 于雪峰等. 一里坪盐湖卤水蒸发过程相图分析及计算. 盐业与化工, 2011, 40(5): 40-43.] |
| [15] |
Cui XM, Liu HN, Wen XM. Brine entrainment rate and material balance of Yiliping salt brine evaporation. Inorganic Chemicals Industry, 2016, 48(7): 33-35, 47. [崔香梅, 刘海宁, 温现明. 一里坪卤水蒸发过程固相夹湿率及物料平衡. 无机盐工业, 2016, 48(7): 33-35, 47.] |
| [16] |
Jin ZM, Xiao XZ, Liang SM. Study of the metastable equilibrium for pentanary system of (Na+, K+, Mg2+), (Cl-, SO42-), H2O. Acta Chimica Sinica, 1980, 38(4): 313-321. [金作美, 肖显志, 梁式梅. (Na+、K+、Mg2+), (Cl-、SO42-), H2O五元体系介稳平衡的研究. 化学学报, 1980, 38(4): 313-321.] |
| [17] |
Jin ZM, Zhou HN, Wang LS. Studies on the metastable phase equilibrium of Na+, K+, Mg2+//Cl-, SO42--H2O quinary system at 15℃. Chemical Journal of Chinese Universities, 2002, 23(4): 690-694. [金作美, 周惠南, 王励生. Na+, K+, Mg2+//Cl-, SO42--H2O五元体系15℃介稳相图研究. 高等学校化学学报, 2002, 23(4): 690-694. DOI:10.3321/j.issn:0251-0790.2002.04.034] |
| [18] |
Zdanovskiy AB. Handbook of experimental solubility data in quaternary and complex salt-water systems: 2nd. Leningrad: National Chemistry Books Press, 1975: 894-896.
|
| [19] |
Liu DG, Chen JQ, Zhang CM. The types and hydrochemical charactars of salt lakes in chaidamud basin. Journal of Salt Lake Science, 1996, 4(3/4): 9-19. [柳大纲, 陈敬清, 张长美. 柴达木盆地盐湖类型和水化学特征. 盐湖研究, 1996, 4(3/4): 9-19.] |
| [20] |
Liang BM. Salt-water system phase diagrams principles and applications. Beijing: China Light Industry Press, 1986: 488-516. [梁保民. 水盐体系相图原理及应用. 北京: 轻工业出版社, 1986: 488-516.]
|
| [21] |
Qinghai Institute of Salt Lakes, Chinese Academy of Sciences. Analysis methods for brines and salts: 2nd. Beijing: Science Press, 1988. [中国科学院青海盐湖研究所. 卤水和盐的分析方法(第二版). 北京: 科学出版社, 1988.]
|
| [22] |
Zdanovskiy AB. Handbook of experimental solubility data in pure salt systems. Leningrad: National Chemistry Books Press, 1963.
|
| [23] |
Yuan JQ, Duan ZH. Mixation of natural waters and the application of HW-model to the study of mixation. Earth Science-Journal of China University of Geosciences, 1989, 14(5): 553-562. [袁见齐, 段振豪. 掺杂作用与HW模型在掺杂作用研究中的应用. 地球科学——中国地质大学学报, 1989, 14(5): 553-562.] |
| [24] |
Yuan JG, Zhang DA, Zhao J. Study on the new process of potassium salt mining by selective leaching. China Well and Rock Salt, 2004, 35(4): 16-18. [袁基刚, 张德安, 赵杰. 选择性溶浸法开采钾盐矿新工艺探讨. 中国井矿盐, 2004, 35(4): 16-18. DOI:10.3969/j.issn.1001-0335.2004.04.006] |
| [25] |
Han WT, Yang CX. Effect of annual temperature difference on brine-mineral equilibrium—Evaporation and deposition of natural brine during variable temperature. Geology of Chemical Minerals, 1987(1): 1-12. [韩蔚田, 杨长辛. 年温差对卤水-矿物平衡的影响——天然卤水变温蒸发析盐作用. 化工地质, 1987(1): 1-12.] |
| [26] |
Gao SY, Li GY. The chemistry of borate in salt lake brine(Ⅰ)—behaviour of borate during solar evaporation of brine. Chemical Journal of Chinese Universities, 1982, 3(2): 141-147. [高世扬, 李国英. 盐卤硼酸盐化学(Ⅰ)——含硼盐卤天然蒸发过程中硼酸盐的行为. 高等学校化学学报, 1982, 3(2): 141-147. DOI:10.3321/j.issn:0251-0790.1982.02.001] |
| [27] |
Eugster HP, Harvie CE, Weare JH. Mineral equilibria in a six-component seawater system, Na-K-Mg-Ca-SO4-Cl-H2O, at 25℃. Geochimica et Cosmochimica Acta, 1980, 44: 1335-1347. DOI:10.1016/0016-7037(82)90317-9 |
| [28] |
Arslan A, Dutt GR. Solubility of gypsum and its prediction in aqueous solutions of mixed electrolytes. Soil Science, 1993, 155(1): 37-47. DOI:10.1097/00010694-199301000-00006 |
| [29] |
Yan YM, Zhang L. Study on the solubility and solubility product of calcium sulfate in brine. Journal of Salt and Chemical Industry, 2014, 43(11): 27-30. [颜亚盟, 张仂. 硫酸钙在盐水中的溶解度及溶度积实验研究. 盐业与化工, 2014, 43(11): 27-30.] |
| [30] |
Ogawa Y, Koibuchi H, Suto K et al. Effects of the chemical compositions of salars de Uyuni and Atacama brines on lithium concentration during evaporation. Resource Geology, 2014, 64(2): 91-101. DOI:10.1111/rge.12030 |
| [31] |
Zhang FX, Guo ZZ, Chen PH et al. Studies on the quaternary system LiCl-KCl-MgCl2-H2O at 25℃. Chemical Journal of Chinese Universities, 1987, 8(5): 387-392. [张逢星, 郭志箴, 陈佩珩等. 四元体系LiCl-KCl-MgCl2-H2O 25℃时等温研究. 高等学校化学学报, 1987, 8(5): 387-392. DOI:10.3321/j.issn:0251-0790.1987.05.001] |
| [32] |
Zhang FX, Guo ZZ, Chen PH et al. Studies on the solubility and the isothermal evaporation process in the quinary system Li, Na, K, Mg/Cl-H2O at 25℃. Chemical Journal of Chinese Universities, 1987, 8(4): 301-305. [张逢星, 郭志箴, 陈佩珩等. 五元体系LiCl-NaCl-KCl-MgCl2-H2O 25℃时溶度研究和等温蒸发实验. 高等学校化学学报, 1987, 8(4): 301-305. DOI:10.3321/j.issn:0251-0790.1987.04.003] |
| [33] |
Guo ZZ, Liu ZQ, Chen JQ. The metastable phase equilibrium in the system Li+, Mg2+//Cl-, SO42--H2O at 25℃. Acta Chimica Sinica, 1991, 49(10): 937-943. [郭智忠, 刘子琴, 陈敬清. Li+, Mg2+/Cl-, SO42--H2O四元体系(25℃)的介稳平衡. 化学学报, 1991, 49(10): 937-943.] |
| [34] |
Ren KW, Song PS. Solubilities and properties of solution in the system Li+, Mg2+/Cl-, SO42--H2O at 25℃. Chinese Journal of Inorganic Chemistry, 1994, 10(1): 69-74. [任开武, 宋彭生. 四元交互体系Li+, Mg2+/Cl-, SO42--H2O 25℃相平衡及物化性质研究. 无机化学学报, 1994, 10(1): 69-74.] |
| [35] |
Christov C, Balarew C, Petrenko S et al. Investigation of the aqueous lithium and magnesium halide systems. Journal of Solution Chemistry, 1994, 23(5): 595-604. DOI:10.1007/BF00972747 |
| [36] |
Wang SQ. Metastable equilibria of the quinary system Li+, Na+, Mg2+//Cl-, SO42--H2O and its subsystems at 273.15K[Dissertation]. Xining: Qinghai Institute of Salt Lakes, Chinese Academy of Sciences, 2009. [王士强.五元体系(Li+, Na+, Mg2+//Cl-, SO42--H2O)及子体系273.15K介稳相平衡研究[学位论文].西宁: 中国科学院青海盐湖研究所, 2009. ]
|
| [37] |
Song PS, Du XH, Sun B. Study on the ternary system MgB4O7-MgSO4-H2O at 25℃. Chinese Science Bulletin, 1988, 33(23): 1971-1973. DOI:10.1360/sb1988-33-23-1971 |
| [38] |
Song PS, Fu HA. Solubilities and properties of solution in the reciprocal system Li+, Mg2+/SO42-, B4O72--H2O at 25℃. Chinese Journal of Inorganic Chemistry, 1991, 7(3): 344-348. [宋彭生, 付宏安. 四元交互体系Li+, Mg2+/SO42-, B4O72--H2O 25℃溶解度和溶液物化性质的研究. 无机化学学报, 1991, 7(3): 344-348.] |
| [39] |
Du XH, Song PS. Study on the quaternary system of MgB4O7-MgSO4-MgCl2-H2O at 25℃. Journal of Salt Lake Science, 1992(1): 9-15. [杜宪惠, 宋彭生. 四元体系MgB4O7-MgSO4-MgCl2-H2O 25℃时相关系的研究. 盐湖研究, 1992(1): 9-15.] |
| [40] |
Bi WB, Sun B, Song PS et al. Study on the phase diagram of Mg2+/Cl-, Borate-H2O at 25℃. Journal of Salt Lake Science, 1997, 5(3/4): 42-46. [毕渭滨, 孙柏, 宋彭生等. 三元体系Mg2+/Cl-, Borate-H2O 25℃相关系和溶液性质的研究. 盐湖研究, 1997, 5(3/4): 42-46.] |
| [41] |
Meng LZ. Phase equilibria of the quinary system (Li+, Mg2+//Cl-, SO42-, borate-H2O)[Dissertation]. Xining: Qinghai Institute of Salt Lakes, Chinese Academy of Sciences, 2009. [孟令宗.五元体系(Li+, Mg2+//Cl-, SO42-, borate-H2O)相平衡研究[学位论文].西宁: 中国科学院青海盐湖研究所, 2009. http://ir.isl.ac.cn/handle/363002/2611 ]
|
| [42] |
Friend JAN. CCCIV.—The hydrates of lithium sulphate and their Solubility in Water between -16° and +103°. Journal of the Chemical Society, 1929, 49: 2330-2333. DOI:10.1039/JR9290002330 |
 2019, Vol. 31
2019, Vol. 31 

