(2: 广东省水库蓝藻水华防治中心, 广州 510632)
(2: Improvement Center of Cyanobacterial Blooms in Guangdong Province, Guangzhou 510632, P.R.China)
浮游植物是水库生态系统中最主要的初级生产者,对生态系统的结构和功能有关键的作用.浮游植物个体小,对环境变化敏感,能快速响应环境变化.浮游植物细胞体积、比表面积和最大轴性长度(GALD)是描述细胞形态的主要参数,反映浮游植物资源竞争和抵御浮游动物牧食的能力[1].在水体中,耐资源胁迫的种类(S策略种)具有小的比表面积,而资源竞争种类(C策略种)和临时性资源竞争种类(R策略种)具有更大的比表面积[2].浮游植物的形态大小不仅直接影响浮游植物的代谢活动、生长速率等,还影响其下沉速度,进一步影响生物地球化学循环过程[3].水体中浮游动物多为滤食性,例如枝角类和轮虫,主要滤食30 μm以下的浮游植物,具有较大体积和轴性长度的浮游植物不易被浮游动物牧食[4-5].因此,浮游植物形态性状不仅反映生态位还反映其生态功能,在浮游植物生态分类群方法中,形态参数常被作为主要的划分依据,例如浮游植物功能群(FG)[6-7]、浮游植物形态功能群(MBFG)[1]、浮游植物生态功能群(MFG)[8]均把体积、比表面积、最大轴性长度等作为划分浮游植物功能类群的主要参数.
传统的浮游植物群落分析主要以生物学的分类或功能类群作为浮游植物群落的描述方法,分析群落结构的组成和演替及关键因子.较少将浮游植物群落作为整体分析浮游植物形态性状特征,而群落水平的浮游植物形态性状可直观地反映群落的状态,更有利于对生态系统状态进行分析.热带水库受热带气候的影响,水温全年较高,全年均适合浮游植物生长,通常认为环境条件的季节性变化较小,在理论上可能导致群落的性状组成季节变化不明显.
高州水库位于广东省茂名市,是一座热带大型深水水库,是重要的供水水源地.水库水力滞留时间长且水体长时间处于分层状态,有较高的水体稳定性,浮游植物群落主要受环境选择作用[9].本文以高州水库为研究对象,分析浮游植物形态性状在群落和种群水平的季节特征及影响因子,探索浮游植物形态性状在评价群落特征中的应用,有利于更好地进行水库生态系统和水质评价及管理.
1 材料与方法 1.1 水库概况高州水库(22°2′N,111°1′E)位于广东省茂名市西北部,主要承担茂名市及湛江部分地区的供水任务,是重要的供水水源地.高州水库总库容为1.15×109 m3,分为石骨(0.50×109 m3)和良德(0.65×109 m3)两个库区,主要来水河流为曹江与大井河.
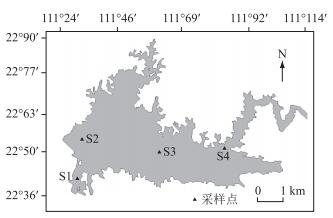
1.2 采样点设置与采样频率在高州水库石骨库区共设置4个采样点(图 1). S1样点(22°2′8″N,111°1′3″E)位于取水口;S2样点(22°2′53″N,111°4′12″E)位于河流入库口;S3样点(22°2′57″N,111°2′34″E)位于库中;S4样点(22°3′6″N,111°1′7″E)位于主坝附近. 2016年1 -12月,每月采样1次.
|
图 1 高州水库石骨库区采样点分布 Fig.1 Sampling sites in Shigu zone of Gaozhou Reservoir |
用YSI水质分析仪现场测定水温(Temp)、pH值、溶解氧(DO)等环境参数,用塞氏黑白盘测定透明度(SD),同时采集表层0.5 m的水样按照国家《地表水环境质量标准》(GB 3838 -2002)测定总磷(TP)、总氮(TN)、硝态氮(NO3--N)和铵态氮(NH4+-N)、正磷酸盐(PO43--P)浓度,叶绿素a(Chl.a)浓度通过反复冻融-浸提,再用丙酮分光光度法测定[10].
各个采样点用采水器采集水样后,取1 L现场加入1 %鲁哥试剂,带回实验室沉淀48 h后用虹吸管吸出“上清液”,将浮游植物样品浓缩至约30 ml,取0.1 ml样品在计数框下镜检计数.在Olympus CX41显微镜下对浮游植物进行种类鉴定和计数,每个至少计数400个藻类个体[11].水文数据(水库流域降雨量、蒸发量、出库流量、库容和水位)由高州水库管理局与广东省水文局茂名分局提供.
1.4 数据统计与处理浮游植物群落优势种突出,群落形态性状近似正态分布,对数据进行lg(x+1)转换后正态性更明显,使用Levene's test检验方差齐性,通过单因素方差分析(One-way ANOVA)检验浮游植物形态性状的时空差异.使用SPSS Statistics 20进行单因素方差分析和相关性分析.设定P < 0.05有显著差异.采用Pearson相关分析研究浮游植物形态性状与各环境变量之间的相关性,通过逐步线性回归模型分析水库浮游植物形态性状与环境因子的回归关系.
群落数据分析使用R语言平台中的MASS、vegan和packfor函数包.利用RDA分析环境变量中的化学变量(TN、TP、NO3--N、NH4+-N、PO43--P)和物理变量(Temp、pH值、水体稳定度(RWCS))对浮游植物群落粒径组成变异的解释率,并使用前向选择去除自相关变量后筛选得到对浮游植物群落粒径组成有显著影响的环境变量.采用非度量多维尺度分析(Nonmetric Multidimensional Scaling,NMDS)研究不同时空条件下浮游植物群落的相似关系.所有数据处理和绘图均在SPSS、Origin8.5、Microsoft Office、R语言平台中完成.
| 表 1 参数计算公式 Tab. 1 Calculation formulas |
| 表 2 参数名称和含义 Tab. 2 Parameters' name and meaning |
| 表 3 浮游植物体积和表面积计算公式 Tab. 3 Formulas for calculating the volume and surface area of phytoplankton |
调查期间,春季营养盐浓度(TN、TP、NO3--N、NH4+-N、PO43--P)稍高于其他季节,RWCS、Temp、pH均为夏季稍高于其他季节,各采样点之间的环境理化因子变化均无显著差异(P>0.05). TN平均浓度为0.769 mg/L,最大值出现在4月,最小值出现在11月;TP平均浓度为0.027 mg/L,最大值出现在3月,最小值出现在6月;NO3--N平均浓度为0.284 mg/L,最大值出现在3月,最小值出现在9月;NH4+-N平均浓度为0.069 mg/L,最大值出现在5月,最小值出现在1月;PO43--P平均浓度为0.004 mg/L,最大值出现在3月,最小值出现在11、12月;RWCS平均值为208.171,最大值出现在6月,最小值出现在1月;Temp平均值为25.24℃,最大值出现在6月,最小值出现在2月;pH平均值为8.346,最大值出现在7月,最小值出现在10月(表 4).
| 表 4 高州水库水体环境因子状况 Tab. 4 Variations of environmental factors of Gaozhou Reservoir |
蓝藻和绿藻是高州水库浮游植物群落结构的主要组成部分,其次是甲藻和硅藻,其生物量只有个别月份在群落中有较大的比例,而隐藻、裸藻生物量全年在群落结构中的比例均较低.蓝藻在1 -4月期间成为群落中的优势类群,而绿藻在6 -9月期间成为群落中的优势类群(图 2).

|
图 2 不同采样点的浮游植物群落结构变化 Fig.2 Phytoplankton community structure at different sampling sites |
高州水库浮游植物群落VT在108.52~753.25 μm3之间, S/VT在0.93~2.08 μm-1之间,LT在5.21~17.44 μm之间.浮游植物群落VT、S/VT和LT均呈现出明显的季节性特征:夏、秋季的VT和LT显著大于冬、春季(P < 0.05),S/VT在春、秋季显著高于其他时期(P < 0.05).各采样点之间浮游植物群落的VT、S/VT和LT变化没有显著差异(P>0.05)(图 3).浮游植物群落S/VT与环境因子的相关性分析表明,S/VT与NO3--N浓度呈显著负相关性(r=-0.299,P < 0.05).浮游植物群落VT和LT的逐步回归表明,TN浓度和Temp是决定浮游植物群落VT和LT的重要变量(表 5).

|
图 3 浮游植物群落平均体积、平均比表面积和平均最大轴性长度的季节动态 Fig.3 Seasonal dynamic of VT, S/VT and LT of phytoplankton community |
| 表 5 浮游植物群落VT和LT的多元逐步回归分析 Tab. 5 Multiple stepwise regression of phytoplankton morphological characters (VT and LT) |
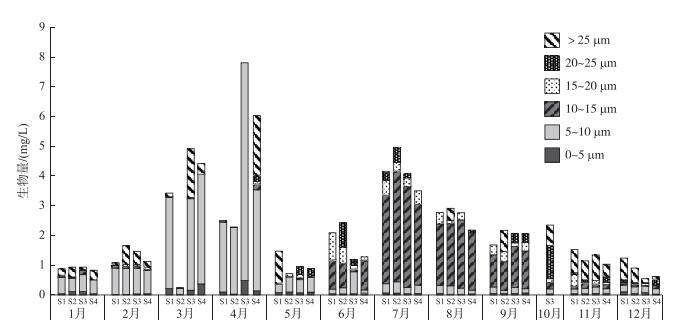
采样期间的浮游植物平均生物量为2.17 mg/L,主要由Dc在5~15 μm之间的浮游植物组成,其中Dc在5~10 μm之间的浮游植物生物量波动范围为0.11~7.32 mg/L,而Dc在10~15 μm之间的浮游植物生物量最大值为3.72 mg/L,出现在7月(图 4).
|
图 4 浮游植物粒径组成 Fig.4 Phytoplankton size composition |
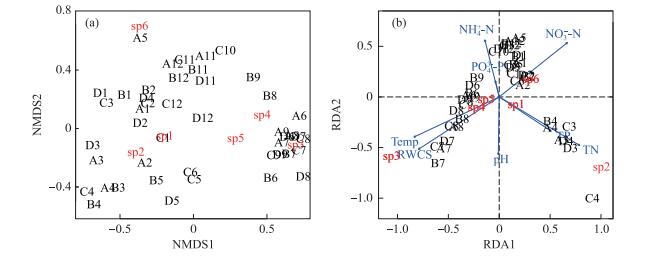
浮游植物群落粒径组成有明显的时空差异. NMDS分析表明6 -9月(丰水期)期间,样点之间群落粒径组成相似性较高,而其他月份(枯水期)的样点之间相似性降低.浮游植物群落有明显的季节演替.对每个采样点时间序列上的浮游植物群落进行比较,1 -5月期间,各月的群落相似性高,均以Dc小于10 μm的浮游植物为主;7 -9月期间各月群落粒径组成相似性较高,以Dc在10~15 μm之间的浮游植物为主;11 -12月期间各月群落粒径组成相似性较高,以Dc大于25 μm的浮游植物为主;3个时期之间的月份相似性明显降低,6和10月为群落发生较大改变的时期(图 5a).对浮游植物群落粒径组成与环境变量进行冗余分析(RDA),结果表明,TN、TP、NO3--N、NH4+-N、PO43--P、Temp、pH值和RWCS这8个环境变量对高州浮游植物群落粒径组成变化的累积解释率为71 %.其中Temp(R2=0.28,P=0.001)、TN(R2=0.20,P=0.001)、NH4+-N(R2=0.09,P=0.001)、pH值(R2=0.05,P=0.005)、RWCS(R2=0.05,P=0.005)和NO3--N(R2=0.02,P=0.036)这6个变量是影响群落粒径组成变化的显著相关因子(图 5b).
|
图 5 基于NMDS的浮游植物群落粒径组成分析(Stress=0.114)(a);环境影响因子与浮游植物群的RDA分析(b)(A1~A12代表 1 -12月采样点S1的样本;B1~B12代表 1 -12月采样点S2的样本;C1~C12代表 1 -12月采样点S3的样本;D1~D12代表 1 -12月采样点S4的样本;sp1~sp6代表 6个不同粒径等级的浮游植物) Fig.5 nmds plot of phytoplankton with different grain sizes (stress=0.114)(a); rda plot of phytoplankton community with environmental variables (b)(a1-a12:samples from january to december in site s1; b1-b12:samples from january to december in site s2;c1-c12:samples from january to december in site s3; d1-d12:samples from january to december in site s4; sp1-sp6: phytoplankton of different grain sizes) |
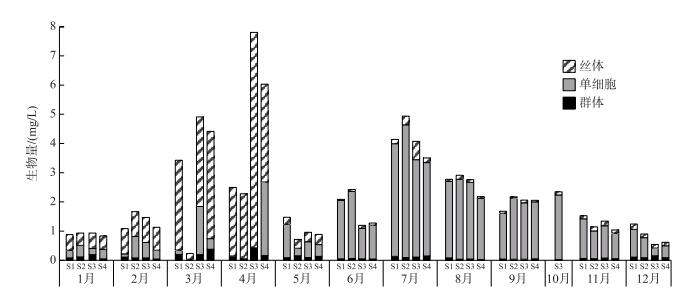
根据浮游植物形态将高州浮游植物划分为丝状、群体、单细胞态.采样期间的浮游植物生物量主要由丝状和单细胞浮游植物组成.丝状浮游植物的生物量在0.040~7.382 mg/L之间,单细胞浮游植物的生物量0.020~4.548 mg/L之间,群体浮游植物的生物量在0.017~0.424 mg/L之间(图 6).浮游植物生物量的逐步回归表明,TN浓度是决定群体浮游植物生物量的重要变量;TN浓度和Temp是决定单细胞浮游植物生物量的重要变量;TN和NH4-N浓度是决定丝状浮游植物生物量的重要变量(表 6).
|
图 6 丝体、群体、单细胞浮游植物生物量的季节动态 Fig.6 Seasonal dynamic of biomass of filament, colony and unicellular phytoplankton |
| 表 6 浮游植物群体、单细胞和丝状生物量与环境因子的多元逐步回归分析 Tab. 6 Multiple stepwise regression of biomass of filament, colony and unicellular phytoplankton |
粘质长孢藻是调查期间高州水库浮游植物优势种之一,在冬、春季占优势.其VT在113.04~298.07 μm3之间,S/VT在0.73~1.00 μm-1之间,LT在6~8.22 μm之间,VT、S/VT和LT均呈现出明显的季节性特征,夏季VT和LT显著低于其他季节(P < 0.05),而S/VT显著高于其他时期(P < 0.05).各采样点之间VT、S/VT和LT变化均没有显著差异(P>0.05)(图 7).粘质长孢藻形态性状的逐步回归表明,Temp和TN浓度是解释粘质长孢藻细胞形态性状变异的关键因子(表 7).

|
图 7 粘质长孢藻平均体积、比表面积和最大轴性长度的季节变化动态 Fig.7 Seasonal dynamic of VT, S/VT and LT of Dolichospermum mucosa |
| 表 7 粘质长孢藻VT、S/VT和LT的多元逐步回归分析 Tab. 7 Multiple stepwise regression of morphological characters of Dolichospermum mucosa |
光角星鼓藻生物量在夏、秋季较高,在水库中占优,其他季节较少出现,其VT在510.25~1307.81 μm3之间,S/VT在0.64~0.95 μm-1之间,LT在13.00~17.00 μm之间.各采样点之间VT、S/VT和LT变化均没有显著差异(P>0.05)(图 8).将光角星鼓藻的形态性状与环境因子进行相关性分析,结果表明,其VT和PO43--P浓度呈极显著正相关(r=0.654,P < 0.01). LT与TP浓度呈显著正相关(r=0.554,P < 0.05),与PO43--P浓度呈极显著正相关(r=0.759,P < 0.01). S/VT与各环境变量均没有显著相关性(P>0.05).多元逐步回归结果显示,PO43--P浓度是解释光角星鼓藻细胞形态性状变异的关键因子.

|
图 8 光角星鼓藻平均体积、比表面积和最大轴性长度的季节变化动态 Fig.8 Seasonal dynamic of VT, S/VT and LT of Staurastrum muticum |
高州水库浮游植物细胞形态性状在群落水平具有明显的季节特征:浮游植物VT和LT均有较大的季节差异,表现为12月、1 -5月小,6 -11月大,为单峰模式;S/VT除2月均在1~2 μm-1之间,呈双峰模式.浮游植物个体小,对环境变化敏感,在形态上表现为明显的可塑性.细胞体积、最大轴性长度、比表面积、存在体制(即丝体、群体或单细胞)均属于细胞形态性状描述参数[1].蓝藻在1 -4月期间成为群落中的优势类群,而绿藻在6 -9月期间成为群落中的优势类群,浮游植物群落结构是其对环境适应的结果[5],形态性状的差异是浮游植物适应性变化最重要的体现[16].
浮游植物形态性状的季节性差异反映了浮游植物资源竞争和抵御浮游动物牧食的能力[1].浮游植物对资源的竞争能力取决于其资源的收支平衡,即资源吸收和资源利用的平衡[17].细胞比表面积越大越有利于资源的吸收;同时细胞体积越大,单位体积营养元素的含量越低[18].比表面积大、个体小的种类,资源吸收能力相对较强但对资源胁迫的耐受性较弱;比表面积大、个体大的种类对资源的吸收能力和对资源胁迫的耐受性均较高[2].高州水库浮游植物群落细胞体积最小的时期在3月,同时3月浮游植物生物量最高,表明丰富的资源供应条件下,体积小、比表面积相对较大的细胞快速增殖.高州水库6 -10月期间,水温高且分层,营养盐浓度较低,资源胁迫增强,有利于个体较大的、对资源胁迫耐受性较强的种类发挥竞争优势,同时大个体的浮游植物能减少被牧食的压力,本研究结果表明6 -10月的浮游植物细胞体积明显大于其他月份.本研究数据表明,冬、春季占优势的小细胞种类主要以丝状体存在,到了夏、秋季,细胞体积和最大轴性长度较大的单细胞种类逐渐成为优势类群,这可能与水库的环境因子相关.有研究表明:胞外多糖是微囊藻形成群体的关键因素,而水体中的营养盐浓度会影响胞外多糖的合成[19]. Dokulil等[20]研究表明丝状蓝藻对水流的平流冲刷较为敏感,容易在平流冲刷率较低的水体成为优势种.在冬、春季,高州水库库区降雨稀少,入库流量较小,水体冲刷率较低,有利于丝状藻类的生长.
进一步对细胞形态性状与环境因子的关系进行统计分析,结果表明群落水平的细胞形态性状与营养盐(TP、TN)和物理环境(水温、水体稳定性)均有显著的相关性.浮游植物的形态性状和其生态属性之间具有很强的关联性[21],形态性状影响着浮游植物的沉降率[22]、生长率[23]以及对营养盐和光能的吸收能力[24].浮游植物形态的变化是为了更好地适应生境[25],在复杂多变的自然环境中,浮游植物及其后代会出现表观性状上的差异[26],同时这些差异又成为浮游植物群落结构演替最重要的表征[16].浮游植物群落演替和驱动因子是水生态系统研究的重点内容,自Sommer等提出浮游生物群落演替模型[27],限制性营养盐和浮游动物的牧食作用被认为是浮游植物群落演替的关键因素.但Padisák等对欧洲8个具长期观测数据的湖泊中浮游植物群落演替进行分析,表明物理因素(光、电导、水体混合、水温)与生物因素(溶解性氮、磷、硅,牧食作用,细菌寄生)对浮游植物群落演替都很重要,且在水体之间,这些因素对浮游植物群落演替的作用有明显的差异[28].高州水库是一座大型、中-富营养的热带水库,水温常年在16℃以上,水体具有明显的分层,水温、pH值和水体稳定度对浮游植物群落演替有关键的作用[29].本研究进一步表明水温、水体稳定度与营养盐共同影响形态性状,对浮游植物群落特征有关键作用.
自然水体环境条件复杂多变,通过形态的可塑性物种可增加种群的生态位宽幅,有利于在多变的环境中维持种群,在被其他种群取代之前,浮游植物可通过调节个体大小以适应环境变化[30].粘质长孢藻和光角星鼓藻是调查期间高州水库浮游植物群落的优势种,其中,粘质长孢藻在冬、春季占优势;而光角星鼓藻在夏、秋季浮游植物群落中占优势.对两个种的形态性状进行分析,结果表明,两个种的细胞形态性状在种群水平也有明显的季节特征.前期有研究对热带大型水库长孢藻的丝体长度季节动态进行分析,表明丝体长度主要受光照条件的影响[31].本文对高州水库粘质长孢藻的VT、LT和S/VT进行了分析,结果表明,夏季的VT和LT均小于其他季节,S/VT在夏季较高,缩小的体积和增加的比表面积反映粘质长孢藻在资源吸收能力及耐受低营养盐浓度能力的改变.将粘质长孢藻的细胞形态性状与环境因子进行统计分析表明,水温和TN浓度是影响其细胞形态性状改变的关键因子. TN浓度与粘质长孢藻的VT和LT呈显著正相关,表明在TN浓度较高的环境下,利于粘质长孢藻细胞的增大. Zohary等对Kinneret湖的浮游植物粒径进行分析,结果表明同一种类夏季细胞粒径明显低于其他季节,夏季水体密度降低,大细胞快速沉降是导致小个体浮游植物更具有优势的重要原因[30].高州水库粘质长孢藻具有伪空泡,能够调节浮力,因此,细胞沉降不是导致其细胞小型化的原因,水温升高及氮浓度的降低是导致其细胞小型化的主要原因.
光角星鼓藻为绿藻门鼓藻目种类,细胞顶角壁延长为臂状凸起,细胞体积在800 μm3以上,细胞比表面积在0.7左右,常以单细胞存在,较大的体积使其对资源胁迫的耐受性较强,在水体分层、溶解性营养盐不足的夏、秋季节成为高州水库浮游植物优势种.结果表明,其形态性状也有明显的变化.统计分析结果表明,PO43--P浓度与光角星鼓藻的VT和LT呈显著正相关,表明PO43--P浓度降低是导致光角星鼓藻小型化的重要原因.角星鼓藻没有伪空泡和鞭毛,不能主动调节细胞位置,因此形态阻力是其在水体稳定性较高的分层水体中抵御沉降的主要方式[32].在Kinneret湖中,夏季水温较高,水的密度和粘性减小,浮游植物的下沉速度较快,大细胞在夏季会迅速下沉,并从水柱中消失,而小细胞的下沉速度比大细胞慢,因此在夏季,较小的细胞生长得更好[30].同样,在高州水库夏季水温较高,沉降阻力大的小细胞和具有臂状凸起的角星鼓藻类具有抵御沉降的优势.同时,我国热带地区的水体溶解性磷浓度长期偏低,夏季水体的分层导致磷进一步不足,而鼓藻具有较强的低磷耐受能力[33],因此,高的形态阻力及低磷耐受性是细胞体积较大的光角星鼓藻成为夏季浮游植物优势类群的重要原因.
4 结论1) 高州水库的浮游植物细胞形态性状在群落水平有明显的季节特征,平均细胞体积和最大轴性长度呈单峰模式,夏季浮游植物以细胞体积和轴性长度均较大的角星鼓藻为优势种;冬、春季以细胞体积小的丝状蓝藻为优势类群.水温、水体稳定度、氮和磷浓度是影响群落水平形态性状季节动态的主要因子.
2) 粘质长孢藻和光角星鼓藻是高州水库浮游植物优势种,形态性状均受环境条件的影响,具有明显的时空特征,表现出明显的形态可塑性,且影响两者形态性状的因素存在明显种间差异:水温和TN浓度是导致粘质长孢藻细胞改变的关键因子,PO43--P浓度是导致光角星鼓藻细胞形态性状改变的关键因子.
| [1] |
Kruk C, Huszar VLM, Peeters ETHM et al. A morphological classification capturing functional variation in phytoplankton. Freshwater Biology, 2010, 55(3): 614-627. DOI:10.1111/fwb.2010.55.issue-3 |
| [2] |
Reynolds CS. The ecology of phytoplankton. New York: Cambridge University Press, 2006.
|
| [3] |
Jiang L, Schofield OM, Falkowski PG. Adaptive evolution of phytoplankton cell size. American Naturalist, 2005, 166(4): 496-505. DOI:10.1086/444442 |
| [4] |
GilbertI JJ. Competition between Rotifers and Daphnia. Ecology, 1985, 66(6): 1943-1950. DOI:10.2307/2937390 |
| [5] |
Xiao LJ, Wang T, Han BP. Grazing of Daphnia galeata and Phyllodiaptomus tunguidus on phytoplankton in Liuxihe Reservoir, South China: in situ bottle experiments. Ecologic Science, 2008, 27(5): 362-367. [肖利娟, 望甜, 韩博平. 流溪河水库的盔形滔和舌状叶镖水蚤对浮游植物的牧食影响研究. 生态科学, 2008, 27(5): 362-367. DOI:10.3969/j.issn.1008-8873.2008.05.018] |
| [6] |
Reynolds CS, Huszar V, Kruk C et al. Towards a functional classification of the freshwater phytoplankton. Journal of Plankton Research, 2002, 24(5): 417-428. DOI:10.1093/plankt/24.5.417 |
| [7] |
Padisák J, Crossetti L, Naselli-Flores L. Use and misuse in the application of the phytoplankton functional classification: a critical review with updates. Hydrobiologia, 2009, 621(1): 1-19. DOI:10.1007/s10750-008-9645-0 |
| [8] |
Salmaso N, Padisák J. Morpho-Functional Groups and phytoplankton development in two deep lakes (Lake Garda, Italy and Lake Stechlin, Germany). Hydrobiologia, 2007, 578(1): 97-112. DOI:10.1007/s10750-006-0437-0 |
| [9] |
Xiao L, Ouyang H, Li H et al. Enclosure study on phytoplankton response to stocking of Silver Carp (Hypophthalmichthys molitrix)in a eutrophic tropical reservoir in south China. International Review of Hydrobiology, 2010, 95(4/5): 428-439. |
| [10] |
Lin SJ, He LJ, Huang PS et al. Comparison and improvement on the extraction method for chlorophyll a in phytoplankton. Ecologic Science, 2005, 24(1): 9-11. [林少君, 贺立静, 黄沛生等. 浮游植物中叶绿素a提取方法的比较与改进. 生态科学, 2005, 24(1): 9-11. DOI:10.3969/j.issn.1008-8873.2005.01.003] |
| [11] |
Hu HJ, Wei YX. The freshwater algae of China: Systematics, taxonomy and ecology. Beijing: Science Press, 2006. [胡鸿均, 魏印心. 中国淡水藻类——系统, 分类及生态. 北京: 科学出版社, 2006.]
|
| [12] |
Jin XC, Tu QY. Specifications for lake eutrophication survey. Beijing: China Environmental Science Press, 1990. [金相灿, 屠清瑛. 湖泊富营养化调查规范. 北京: 中国环境科学出版社, 1990.]
|
| [13] |
Hillebrand H, Dürselen CD, Kirschtel D et al. Biovolume calculation for pelagic and benthic microalgae. Journal of Phycology, 1999, 35(2): 403-424. DOI:10.1046/j.1529-8817.1999.3520403.x |
| [14] |
Feng Y, Xiao LJ, Wei GF et al. Responses of phytoplankton community to increasing water level in the lacustrine zone near the dam of a large tropical reservoir: Gaozhou Reservoir, South China. Chin J Appl Environ Biol, 2014, 20(3): 529-536. [冯喻, 肖利娟, 韦桂峰等. 高州水库水位上升期坝前深水区浮游植物群落的响应特征. 应用与环境生物学报, 2014, 20(3): 529-536.] |
| [15] |
Padisák J, Barbosa FAR, Koschel R et al. Deep layer cyanoprokaryota maxima in temperate and tropical lakes. Advances in Limnology, 2003, 58: 175-199. |
| [16] |
Morabito G, Oggioni A, Caravati E et al. Seasonal morphological plasticity of phytoplankton in Lago Maggiore (N. Italy). Hydrobiologia, 2007, 578(1): 47-57. DOI:10.1007/s10750-006-0432-5 |
| [17] |
Litchman E, Klausmeier CA, Schofield OM et al. The role of functional traits and trade-offs in structuring phytoplankton communities: scaling from cellular to ecosystem level. Ecology Letters, 2007, 10(12): 1170-1181. DOI:10.1111/ele.2007.10.issue-12 |
| [18] |
Montagnes DJS, Berges JA, Harrison PJ et al. Estimating carbon, nitrogen, protein, and chlorophyll a from volume in marine phytoplankton. Limnology and Oceanography, 1994, 39(5): 1044-1060. DOI:10.4319/lo.1994.39.5.1044 |
| [19] |
Sun MJ. Effects of nutrients on the exopolysaccharide production and colony formation of unicellular and colonial Microcystis [Dissertation]. Nanjing: Nanjing University, 2014. [孙梦家.不同营养条件对单细胞和群体微囊藻胞外多糖产率以及群体形成的影响[学位论文].南京: 南京大学, 2014. ]
|
| [20] |
Dokulil MT, Teubner K. Cyanobacterial dominance in lakes. Hydrobiologia, 2000, 438(1): 1-12. |
| [21] |
McGill BJ, Enquist BJ, Weiher E et al. Rebuilding community ecology from functional traits. Trends in Ecology & Evolution, 2006, 21(4): 178-185. |
| [22] |
Salmaso N. Life strategies, dominance patterns and mechanisms promoting species coexistence in phytoplankton communities along complex environmental gradients. Hydrobiologia, 2003, 502: 13-36. DOI:10.1023/B:HYDR.0000004267.64870.85 |
| [23] |
Tang EPY. The allometry of algal growth rates. Journal of Plankton Research, 1995, 17(6): 1325-1335. DOI:10.1093/plankt/17.6.1325 |
| [24] |
Sommer U. The paradox of the plankton: Fluctuations of phosphorus availability maintain diversity of phytoplankton in flow-through cultures. Limnology and Oceanography,, 1984, 29(3): 633-636. DOI:10.4319/lo.1984.29.3.0633 |
| [25] |
Margalef R. Life-forms of phytoplankton as survival alternatives in an unstable environment. Oceanol Acta, 1978, 1(4): 493-509. |
| [26] |
Padisák J. Seasonal Succession of phytoplankton in a large shallow lake (Balaton, Hungary): A dynamic approach to ecological memory, its possible role and mechanisms. Journal of Ecology, 1992, 80(2): 217-230. DOI:10.2307/2261008 |
| [27] |
Sommer U. The PEG-model of seasonal succession of planktonic events in fresh waters. Archiv Fur Hydrobiologie, 1986, 106(4): 433-471. |
| [28] |
Padisák J, Hajnal E, Naselli-Flores L et al. Convergence and divergence in organization of phytoplankton communities under various regimes of physical and biological control. Hydrobiologia, 2010, 639(1): 205-220. DOI:10.1007/s10750-009-0021-5 |
| [29] |
Xiao L, Hu R, Peng L et al. Dissimilarity of phytoplankton assemblages in two connected tropical reservoirs: effects of water transportation and environmental filtering. Hydrobiologia, 2016, 764(1): 127-138. DOI:10.1007/s10750-015-2400-4 |
| [30] |
Zohary T, Fishbein T, Shlichter M et al. Larger cell or colony size in winter, smaller in summer-a pattern shared by many species of Lake Kinneret phytoplankton. Inland Waters, 2017, 7(2): 200-209. DOI:10.1080/20442041.2017.1320505 |
| [31] |
Liu JF, Hu R, Duan XK et al. The relationship between abundance and filament length of Dolichospermum and its indicative function of bloom. Ecology and Environmental Sciences, 2016, 25(3): 496-502. [刘金福, 胡韧, 段雪珂等. 长孢藻(Dolichospermum)丝体长度与丰度的变化关系及其水华指示作用. 生态环境学报, 2016, 25(3): 496-502.] |
| [32] |
Padisák J, Soróczki-Pintér É, Rezner Z. Sinking properties of some phytoplankton shapes and the relation of form resistance to morphological diversity of plankton—an experimental study. Springer Netherlands, 2003, 171(1/2/3): 243-257. |
| [33] |
Spijkerman E, Coesel PFM. Alkaline phosphatase activity in two planktonic desmid species and the possible role of an extracellular envelope. Freshwater Biology, 1998, 39(3): 503-513. DOI:10.1046/j.1365-2427.1998.00299.x |
 2019, Vol. 31
2019, Vol. 31 

