(2: 中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室, 南京 210008)
(3: 国科学院大学, 北京 100049)
(2: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjng 210000, P. R. China)
(3: Univesity of Chinese Academy of Sciences, Beijing 100049, P. R. China)
近十年来,太湖水体长时间处于中度富营养化状态,蓝藻水华发生日趋频繁,这引起了国内外学者的普遍关注.水华暴发期间,微囊藻(Microcystis)、鱼腥藻(Anabaena)、颤藻(Oscillatoria)等浮游藻类大量繁殖,同时藻细胞死亡破裂后会向水体释放多种蓝藻毒素,危害水生态系统的安全[1],其中微囊藻毒素(microcystins,简称MCs)是一种分布广泛且毒性最强的蓝藻毒素. MCs是由7个氨基酸组成的单环七肽,由于多肽组成中氨基酸种类和位置的变化,导致了MCs结构上的多样性,目前已经发现了200多种不同类型的MCs异构体[2],其中MC-LR、MC-RR、MC-YR(L、R、Y分别代表亮氨酸、精氨酸和酪氨酸)为最主要的3种类型, 且MC-LR和MC-RR是在我国天然水体中检出频率最多和浓度最高的MCs异构体. MCs有着环状和间隔双键的结构特性,性质稳定,耐高温,易溶于水[3],且自然水体中MCs的归趋主要分为以下5个途径[4]:(1)大量自然湖泊水体的稀释作用,(2)沉降物或悬浮物对水体中MCs的吸附作用,(3)在特定的水温及pH条件下的热分解作用,(4)光降解作用,(5)生物降解作用.此外,研究证明,MCs还可以在鱼体、螺类及其他水生生物体内积累[5-7],一旦人类食用被MCs污染的水产品,MCs很有可能在人体内富集,从而对人体造成很大的伤害[8].
目前,国内外学者对太湖梅梁湾水体及沉积物中MCs浓度已开展了部分研究,并取得了一系列的研究结果. Xu等[9]用酶联免疫法(ELISA)分析了梅梁湾水体中MCs总浓度的变化,发现一年之中的7-10月为水体中MCs总浓度较高的时间段. Song等[10]用酶联免疫法分析了梅梁湾表层水和上覆水MCs总浓度的变化,结果表明表层水中MCs总浓度略高于上覆水.高振美等[11]用高效液相色谱法分析了梅梁湾水体中MC-LR、MC-RR、MC-YR的浓度变化,结果发现水体中MC-LR和MC-RR这2种异构体浓度较高. Chen等[4]用酶联免疫法分析了梅梁湾沉积物中MCs总含量的变化,研究表明蓝藻暴发期间,沉积物中MCs总含量较高.但前人的研究工作大多注重于水体,少有对间隙水以及沉积物中MCs的含量报道,没有对MCs的垂向分布进行充分阐释,且研究方法以酶联免疫法居多,但ELISA是一项把抗原抗体的免疫反应和酶的高效催化作用原理有机结合起来的一种检测技术,其存在的问题是抗体往往只是针对某一种毒素建立起来的,对其他类型毒素的交叉反应性不高[12],不能够较全面地反映MCs不同异构体在水体及沉积物中的含量分布情况.
因此本研究选取太湖蓝藻水华较严重的梅梁湾为研究区,在蓝藻水华强度较大的5月[13],采集梅梁湾表层水、上覆水、混合水、间隙水以及柱状沉积物样品,并采用超高效液相色谱-串联质谱法(UPLC-MS/MS)准确分析样品中MCs三种主要异构体(MC-LR、MC-RR、MC-YR)含量,进而从垂向空间变化来详细分析蓝藻水华期间MCs在梅梁湾水体以及底泥中具体分布情况,以便后期更深入地探讨MCs在水体以及沉积物中的环境归趋.
1 材料与方法 1.1 研究区概况梅梁湾位于太湖的北部,属于典型的藻型湖湾,其水域面积约为100 km2[14].据《2017年太湖健康状况报告》数据显示[13],梅梁湾蓝藻数量与其他湖区相比,处于较高水平,营养状况为中度富营养化水平,蓝藻水华强度较大的两个时段分别出现在4-6月和8-11月.
1.2 样品采集依据梅梁湾湖面地形、湖底淤泥深度等现状以及参考中国科学院太湖湖泊生态系统研究站布设的采样点位,于2018年5月在梅梁湾共布设6个采样点,这6个点位均匀地覆盖整个梅梁湾,具有较好的代表性(图 1).用2.5 L有机玻璃采水器采集表层0~0.5 m处水样,取1 L过GF/C玻璃纤维滤膜(1.2 μm, Whatman, Brentford, UK),收集滤液用于测定表层水MCs的浓度,另取500 ml用于测定表层水体理化指标.用2.5 L有机玻璃采水器采集表层(水下0~0.5 m)、中层(水深一半处)、底层(水底泥上0~0.5 m)的水样,混合后取1 L过滤后用于测定混合水MCs浓度,另取500 ml用于测定混合水体理化指标.用自重力柱状采泥器在6个点位采集沉积物柱状样,每个点位采集4根柱子,参考Song等[10]对上覆水的采样方法,在现场用50 ml针筒注射器吸取4根柱状泥样表层以上0~10 cm处上覆水,混匀后取1 L过滤后用于测定上覆水MCs浓度,另取500 ml用于测定上覆水体理化指标.在每个点位选取1根柱子利用1 cm切环将柱状沉积物自上而下分割成10层,混匀后装袋带回实验室,在-80℃条件下冷冻保存,用于沉积物中MCs含量的测定.剩余6个点位的3根柱子利用10 cm切环直接切取表层10 cm厚的沉积物,混匀后装袋带回实验室,在离心机(ThermoFisher, Heraeus, Multifuge, X1R)4℃条件下以1200转/min离心25 min得到间隙水,经GF/C滤膜过滤后,测定间隙水MCs浓度,另取200 ml用于测定间隙水体理化指标.
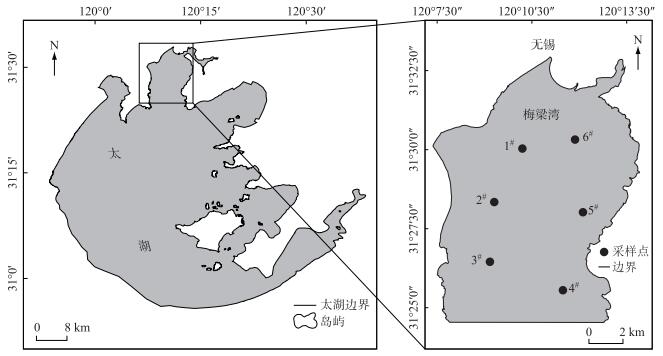
|
图 1 太湖梅梁湾采样点位置 Fig.1 Distribution of sampling sites in Meiliang Bay of Lake Taihu |
多参数水质仪(YSI 6600 V2)现场测定表层水、上覆水以及混合水的水温(Temp)、溶解氧(DO)、酸碱度(pH),黑白透明度盘测定各点位水体透明度(SD);按照《湖泊富营养化调查规范》中的方法测定上述水体以及间隙水中总氮(TN)、总磷(TP)、亚硝态氮(NO2--N)、硝态氮(NO3--N)、铵态氮(NH4+-N)、磷酸根(PO43--P)、叶绿素a(Chl.a)(间隙水除外)、高锰酸盐指数(CODMn)[15].沉积物中各层样品的溶解性总氮(STN)、溶解性总磷(STP)分别采用半微量凯氏定量法和硫酸-高氯酸消煮磷钼蓝比色法测定[16].梅梁湾水体及沉积物理化指标见表 1.
| 表 1 梅梁湾水体及沉积物理化指标* Tab. 1 Physical and chemical indexes in Meiliang Bay |
滤后的水样按Su等[17]的方法处理.将1 L过滤后的水样以1 ml/min的速度流经活化好的0.2 g HLB富集柱(Oasis©, Waters, Milford, MA, USA),然后将柱子用15 ml 5 %的甲醇溶液淋洗,去除杂质,最后再10 ml 100 %的甲醇溶液洗脱,用玻璃管收集洗脱液.将收集的洗脱液用氮吹仪(EYELA, MG-2200)吹干,残留物用100 %甲醇溶解,溶解后再用真空离心浓缩仪(EYELA, Centrifugal, Evaporator, CVE-2000)浓缩,最后将浓缩后的残留物用500 μl 100 %甲醇溶解,待测.
1.3.3 沉积物中MCs的富集冷冻保存的样品取出,在-50℃条件下冷冻干燥.在冷冻干燥完毕之后,用玻璃棒压散冷冻干燥后的样品,并剔除样品中的生物残体等杂质,混匀并取其1/4作为研磨样品,经玛瑙研钵研细过200目尼龙筛后,储存于聚乙烯瓶中待测.过筛后的泥样按Chen等[18]的方法处理.称取2 g泥样倒入50 ml离心管中,用25 ml 0.1 mol/L EDTA-0.1 mol/L Na4P2O7(pH值用三氟乙酸调节为3)超声10 min,然后在4℃、10000转/min条件下离心15 min后得到上清液,用1 ml移液枪吸取上清液并转移至100 ml烧杯中,重复上述步骤3次,3次得到的上清液中MCs提取富集方法同水样.
1.3.4 MCs的测定用超高效液相色谱串联三重四级杆质谱仪(UPLC-MS/MS)测定MCs.流动相为0.1 %甲酸(A)和乙腈(B).流动相梯度淋洗程序为:0~4.0 min,75 % A;4.0~4.1 min,55 % A;4.1~7.0 min,75 % A.流速为0.5 ml/min,进样量为10 μl.色谱柱为Acquity UPLC BEH C18 column(100 mm × 1 mm, 1.7 μm).质谱采用正离子扫描,多离子反应检测(MRM)模式,离子源温度150℃,喷雾电压5500 V,雾化温度450℃,雾化气压为55 kPa.固体MC-LR、MC-RR和MC-YR溶于100 %甲醇后用于制作标准曲线(表 2),线性范围为0.1~500 μg/L,MC-LR、MC-RR、MC-YR的质荷比分别为995.6、519.9、1045.5.
| 表 2 MC-LR、MC-RR、MC-YR的标准曲线回归方程 Tab. 2 Standard curve regression equations of MC-LR, MC-RR and MC-YR |
运用Excel 2013和SPSS 20.0软件对实验数据进行统计计算、相关性分析;此外,采用ArcGIS 10.3软件绘制太湖采样点位置图,其余图片均由Origin 2017软件绘制.
2 结果与分析 2.1 水体中MCs分布特征梅梁湾表层水中MC-LR、MC-RR、MC-YR的浓度分别为76.47±76.05(平均值±标准差,下同)、14.25±14.52、6.63±3.44 ng/L,上覆水中MC-LR、MC-RR、MC-YR的浓度分别为26.63±7.97、3.88±1.18、2.94±1.31 ng/L,混合水中MC-LR、MC-RR、MC-YR的浓度分别为52.99±42.07、7.28±5.84、5.93±2.79 ng/L,间隙水中MC-LR、MC-RR、MC-YR的浓度分别为483.88±422.21、351.25±264.17、85.83±54.29 ng/L(图 2).从点位分布上看,5#点位MCs总浓度(MC-LR、MC-RR、MC-YR的浓度之和)在表层水、上覆水、混合水以及间隙水中均表现为最高.

|
图 2 梅梁湾水体中MCs浓度变化 Fig.2 The changes of MCs concentration in water of Meiliang Bay |
各点位表层水、上覆水以及混合水中MC-LR的浓度均高于MC-RR和MC-YR,MC-RR和MC-YR之间差别较小,而间隙水中MCs三种异构体浓度大小顺序为:MC-LR>MC-RR>MC-YR.从垂直分布上看,各点位间隙水中MC-LR、MC-RR、MC-YR的浓度均高于表层水、上覆水以及混合水,其均值分别为表层水的6、25、13倍,上覆水的39、91、29倍,混合水的9、48、14倍,表层水MCs异构体浓度较高于上覆水,其MC-LR、MC-RR、MC-YR均值分别为表层水的3、4、2倍,混合水MCs异构体浓度介于表层水和上覆水之间.
2.2 沉积物中MCs分布特征梅梁湾沉积物中MC-LR在沉积物1~10 cm分层中均能被检测到,且含量较高,最大值为26.95 ng/g,最小值为0.60 ng/g,MC-RR含量较低,含量范围为0~0.9 ng/g,在6个点位沉积物1~10 cm分层中检出率不高,仅为70 %;MC-YR含量范围为0~8.10 ng/g,仅在1#和3#点位沉积物9~10 cm深度处未被检测出,检出率为92 %,沉积物中MCs三种异构体在不同深度中平均含量大小顺序为:MC-LR>MC-YR>MC-RR(图 3).
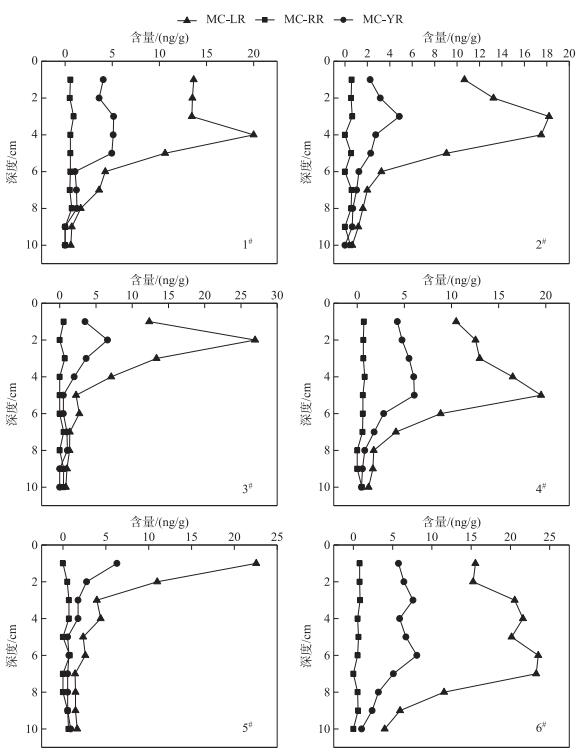
|
图 3 梅梁湾各样点沉积物中MCs含量垂向变化 Fig.3 The vertical changes of MCs content in sediments of each site in Meiliang Bay |
从垂直分布上看,MC-RR含量较低且变化不大,而MC-LR和MC-YR含量总体趋势为随着沉积物深度的增加先上升后下降(5#点位除外).其中1#点位和2#点位MC-LR和MC-YR含量分别在3和4 cm处出现最大值,然后在4~6 cm段急剧下降后一直处于较低状态;3#点位MC-LR和MC-YR含量在2 cm处出现最大值,然后在2~5 cm段迅速下降,剩余5~10 cm段含量处于较低水平;4#点位MC-LR和MC-YR含量在5 cm处出现最大值,然后在5~8 cm段迅速下降,之后8~10 cm段含量处于较低水平;5#点位MC-LR和MC-YR含量在表层1~3 cm段急剧下降之后一直处于低含量状态;6#点位MC-LR和MC-YR含量具有一定波动性,MC-LR含量在4和6 cm处出现2个极大值,MC-YR含量在3和6 cm处出现2个极大值,然后MC-LR和MC-YR含量在6 cm处开始下降,在10 cm处时,MC-LR含量降至4 ng/g,MC-YR含量已处于较低水平(图 3).
2.3 水体及沉积物中MCs相对丰度变化梅梁湾表层水、上覆水和混合水中MCs三种异构体的占比变化不大,其中MC-LR、MC-RR、MC-YR的占比范围分别为77 % ~80 %和11 % ~15 %、7 % ~10 %;而间隙水中MC-LR的占比减小为53 %,MC-RR的占比增加到38 %,MC-YR变化不大,仅为9 % (图 4).
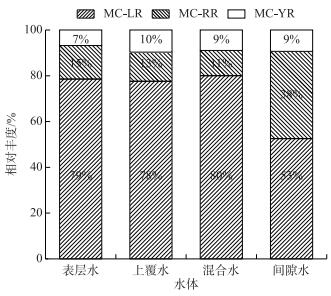
|
图 4 梅梁湾水体中MCs异构体相对丰度 Fig.4 Relative abundance of three MC congeners (LR, RR and YR) in water of Meiliang Bay |
梅梁湾沉积物MC-LR在MCs垂直分布中占比变化较大,最大值为77 %,最小值为66 %,表层1~2 cm处的占比(74.5 %)大于9~10 cm处(66.5 %);MC-RR在表层1~2 cm处的占比仅为3 %,而随着深度的增加占比有所上升,在9~10 cm处增加到13 %;MC-YR在MCs垂直分布中占比变化较小,整体范围为18 % ~26 %,其中表层1~2 cm处的占比略高于9~10 cm处(图 5).
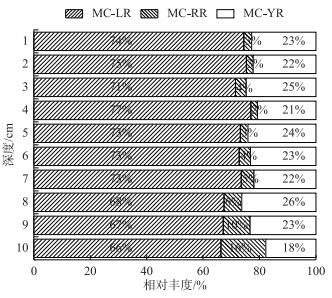
|
图 5 梅梁湾沉积物中MCs异构体相对丰度 Fig.5 Relative abundance of three MC congeners (LR, RR and YR) in sediment of Meiliang Bay |
MCs在水体及沉积物中的含量直接受到产毒蓝藻生物量的影响,但也间接受到其他生物和非生物环境因子的影响,比如叶绿素a、氮磷营养盐浓度等.将水体以及沉积物中MCs与环境因子进行Pearson相关性分析,结果可知表层水中MC-LR、MCs与TP、Chl.a、CODMn均呈显著正相关(P < 0.05),而与TN等其他环境因子均无显著相关性,MC-RR、MC-YR与所分析的环境因子均无显著相关性;上覆水中MC-LR、MCs与TN、TP均呈显著正相关(P < 0.05),而与Chl.a、CODMn等其他环境因子均无显著相关性,此外,MC-RR、MC-YR与环境因子无显著相关;混合水中MC-LR、MC-RR、MCs与TP、Chl.a、CODMn均呈显著正相关(P < 0.05),而与TN等其他环境因子均无显著相关性,MC-YR与所分析的环境因子均无显著相关;间隙水中MC-LR、MC-RR、MC-YR、MCs与TN、TP均具有显著正相关性(P < 0.05),而与CODMn等其他环境因子无显著相关性(表 3).由表 4可知,沉积物中MC-LR、MC-YR、MCs含量与STN、STP浓度均呈显著正相关(P < 0.01),而MC-RR与STN、STP浓度之间均无显著相关性.
| 表 3 梅梁湾水体中MCs与环境因子的相关分析1) Tab. 3 The correlation between MCs and environmental factors in water of Meiliang Bay |
| 表 4 梅梁湾沉积物中MCs与STN、STP含量的相关分析1) Tab. 4 Correlations of STN, STP and MCs content in sediment of Meiliang Bay |
本研究发现,梅梁湾水体中MCs浓度在垂直空间分布上表现出一定的差异性,表层水MCs异构体浓度均略高于相应点位的上覆水浓度,这与Song等[10]在2005-2006年对梅梁湾调查得出的结果相似,但与王经结等[19]在2009年对太湖湖中心调查得出的结果不一致,推测可能与研究区域有关. Arnold等[20]对澳大利亚西部某浅水湖泊研究发现,湖面风力大小对水体中各种物质是否分层起着重要的作用.梅梁湾与湖中心相比,风浪远小于湖中心,水体易形成分层现象.此外,蓝藻暴发期间,表层水中微囊藻细胞数量远高于上覆水[21],藻细胞破裂后易释放出较多的MCs且沉积物上覆水中微生物数量远高于表层水[4],加剧上覆水中MCs的降解,这可能也是本研究水体中MCs浓度垂直空间分布差异性的另一重要原因.
微囊藻属于间歇性浮游藻类,其生命周期分为浮游生长期、下沉期、越冬期和复苏期[22].水华暴发后期,大量的微囊藻会下沉进入沉积物,在沉积物表面度过越冬期[23-24],到了春季复苏期,沉积物中部分微囊藻会作为“种源”复苏至水柱中,但大部分(65 % ~85 %)微囊藻会死亡分解[25],导致大量的MCs从藻细胞内释放出来,此外,由于MCs为亲水性物质,沉积物对其吸附效果较差,只有不到20 %的MCs能够被沉积物吸附[26],因此这些释放出来的MCs大部分都保留在间隙水中,成为间隙水中MCs异构体浓度较高的主要原因.本研究发现,5#点位MCs总浓度在各层水体中均表现为最高,结合周边环境调查发现,5#点位近岸为居民聚集区,频繁的人类活动导致该区域内水体富营养化非常严重,表层水体中Chl.a浓度达到了167.89 μg/L,蓝藻水华在此聚集,腐烂分解后释放出大量的溶解态MCs.
沉积物中MCs主要由沉积物中藻细胞内MCs以及沉积物吸附水体中溶解态MCs组成[27].太湖1~15 cm段表层沉积物中微囊藻丰度会随着沉积物深度增加而先增大后减小[28],这与本研究得到的沉积物中MCs含量变化趋势大体一致,而5#点位MCs含量变化与其他点位有所不同,可能因为该点位经过生态疏浚[29],因此变化趋势缺少增大部分.有研究发现[30-32],沉积物pH、粒度、有机质含量以及黏土矿物含量是影响沉积物吸附MCs的主要因素,当沉积物处于低pH、细粒度时,沉积物对MCs的吸附能力强.至于有机质和黏土矿物两者产生的影响,Wu等[32]研究结果表明,当沉积物中有机质含量处于较低水平时,黏土矿物含量主导着对MCs吸附,黏土矿物含量越高,吸附能力越强.结合前人对梅梁湾沉积物理化性质的调查结果[33-35]可知,梅梁湾沉积物pH、粒度均随着深度的加深而变大,而黏土矿物含量变化与之相反,因此沉积物吸附MCs的能力随着沉积物深度的加深而变弱.但结合上述分析可知,沉积物吸附MCs的量有限,因此沉积物对MCs吸附能力的强弱的变化不会对沉积物中MCs含量产生趋势上的变化.
3.2 水体以及沉积物中MCs相对丰度变化分析本研究中水体及沉积物中MCs以MC-LR为主,这与Su等[17]的研究结果大体一致,这可能因为太湖蓝藻细胞内合成MC-LR的基因种类较多,因此藻细胞内MCs中MC-LR占比较高[36],进而藻细胞死亡后释放到湖水中的MC-LR较多.此外,自然水体中MC-LR的微生物降解速率较其他构型慢[37-38],且微生物对MC-LR的降解需要一段时间的滞后期[39].沉积物中MC-RR占比较小而间隙水中MC-RR占比有所上升,可能因为在光照限制以及缺氧的环境中,底泥中藻细胞内MC-RR较易释放出胞外[40].此外,Chen等[41]研究发现MC-RR在泥柱中迁移速率明显低于MC-LR,导致单位体积内MC-RR的含量增加,这可能也是间隙水中MC-RR占比上升的原因之一,有关间隙水中MCs的报道较少,因此间隙水中MCs的产生以及迁移转化机理还需更深入的研究. MC-RR在沉积物9~10 cm处占比有所增加,主要因为MC-LR和MC-YR含量减少,而MC-RR变化不大,而MC-RR变化不大的原因可能是沉积物中MC-RR主要存在于间隙水中,沉积物中藻细胞内以及被沉积物吸附的含量很低.
3.3 水体及沉积物中MCs与主要环境因子的相关性探讨本研究中总磷浓度与各层水体和沉积物中的MCs总浓度均呈显著正相关,说明总磷浓度是限制产微囊藻毒素的藻株生长和产毒的主要因素[11],总磷在蓝藻水华发生和MCs产生过程中发挥着重要的作用.此外Rinta-Kanto等[42]和Lee等[43]调查结果表明,高磷有利于微囊藻产毒;万翔等[44]对洱海的研究也发现,磷为微囊藻产毒主要限制因子,但磷对于微囊藻产毒的影响机制还不清楚,这有待后续更深入的研究.本研究发现,总氮浓度与表层水以及混合水中MCs总浓度无显著相关性,这与高振美等[11]得到的研究结果一致,但总氮浓度与上覆水、间隙水以及沉积物中MCs总含量呈显著正相关,说明底泥中氮元素可能会影响底泥界面处微囊藻中产毒微囊藻的相对含量[45],从而进一步影响底泥界面处MCs的含量分布.此外,表层水以及混合水中Chl.a、CODMn与MCs总浓度均呈显著正相关,主要因为蓝藻水华暴发期间,藻细胞破裂死亡后,会产生大量有机物及MCs,且Chl.a不会立即被降解[46-47],而上覆水中Chl.a与MCs总浓度无显著相关性,可能因为上覆水体中MCs来源复杂,会受到表层水中MCs的迁移或者间隙水中MCs的释放的影响.本研究发现,水体中MC-LR与TP浓度呈显著正相关,这与王经结等[19]研究结果一致.但袁丽娟等[48]对鄱阳湖的研究发现,水体中MC-LR、MC-RR、MC-YR与TP浓度均呈显著负相关,这与本研究得出的结论不一致,主要因为鄱阳湖存在明显的丰枯水期[48],而太湖水位变化相对较小[49],鄱阳湖藻类生长旺盛的季节正好处于丰水期,TP浓度被大量水体稀释,所以与MCs含量呈负相关.
4 结论1) 从垂直分布上看,梅梁湾间隙水中MCs异构体(MC-LR、MC-RR、MC-YR)浓度均远高于表层水、上覆水以及混合水,表层水MCs异构体浓度较高于上覆水,混合水MCs异构体浓度介于表层水和上覆水之间;沉积物中MC-RR含量较低且变化不大,而MC-YR和MC-LR含量均随沉积物深度的增加先上升后下降.
2) 梅梁湾表层水、上覆水以及混合水中MC-LR为主要的毒素类型,占比约为79 %;而间隙水中MC-LR的占比下降至53 %,MC-RR的占比上升到38 %,MC-YR变化不大,维持在9 %;在表层10 cm沉积物中MC-LR为主要的毒素类型,且随着沉积物深度的增加,MC-LR的占比小幅度下降,而MC-RR的占比有所增加,MC-YR的占比变化不大.
3) 相关性分析表明,表层水和混合水中MCs与TP浓度呈显著正相关(P < 0.05),而与TN浓度无显著相关性;上覆水、间隙水以及沉积物中MCs与TN、TP浓度均呈显著正相关(P < 0.05).
| [1] |
Falconer IR. Tumor promotion and liver injury caused by oral consumption of cyanobacteria. Environ Toxic Water, 1991, 6(2): 177-184. DOI:10.1002/tox.2530060207 |
| [2] |
Meriluoto J, Spoof L, Codd GA. Handbook of cyanobacterial monitoring and cyanotoxin analysis. Chichester: John Wiley & Sons, 2017: 526-537. DOI:10.1002/9781119068761
|
| [3] |
Dziga D, Wasylewski M, Wladyka B et al. Microbial degradation of microcystins. Chem Res Toxicol, 2013, 26(6): 841-852. DOI:10.1021/tx4000045 |
| [4] |
Chen W, Song L, Peng L et al. Reduction in microcystin concentrations in large and shallow lakes:Water and sediment-interface contributions. Water Research, 2008, 42(3): 763-773. DOI:10.1016/j.watres.2007.08.007 |
| [5] |
Jia J, Luo W, Lu Y et al. Bioaccumulation of microcystins (MCs) in four fish species from Lake Taihu, China:Assessment of risks to humans. Science of the Total Environment, 2014, 487(1): 224-234. DOI:10.1016/j.scitotenv.2014.04.037 |
| [6] |
Zhang J, Wang Z, Song Z et al. Bioaccumulation of microcystins in two freshwater gastropods from a cyanobacteria-bloom plateau lake, Lake Dianchi. Environmental Pollution, 2012, 164(1): 227-234. DOI:10.1016/j.envpol.2012.01.021 |
| [7] |
Zhang D, Xie P, Chen J et al. Determination of microcystin-LR and its metabolites in snail (Bellamya aeruginosa), shrimp (Macrobrachium nipponensis) and silver carp (Hypophthalmichthys molitrix) from Lake Taihu, China. Chemosphere, 2009, 76(7): 974-981. DOI:10.1016/j.chemosphere.2009.04.034 |
| [8] |
Zhang D, Xie P, Liu Y et al. Transfer, distribution and bioaccumulation of microcystins in the aquatic food web in Lake Taihu, China, with potential risks to human health. Science of the Total Environment, 2009, 407(7): 2191-2199. DOI:10.1016/j.scitotenv.2008.12.039 |
| [9] |
Xu Q, Chen W, Gao G. Seasonal variations in microcystin concentrations in Lake Taihu, China. Environ Monit Assess, 2008, 145(1-3): 75-79. DOI:10.1007/s10661-007-0016-5 |
| [10] |
Song L, Chen W, Peng L et al. Distribution and bioaccumulation of microcystins in water columns:A systematic investigation into the environmental fate and the risks associated with microcystins in Meiliang Bay, Lake Taihu. Water Research, 2007, 41(3): 2853-2864. DOI:10.1016/j.watres.2007.02.013 |
| [11] |
Gao ZM, Zhao ZH, Zhang B et al. Seasonal variation of microcystins concentration and influencing factors in Meiliang Bay, Lake Taihu. Ecology and Environmental Sciences, 2011, 20(6/7): 1063-1067. [高振美, 赵中华, 张波等. 太湖梅梁湾水体微囊藻毒素含量的季节变化特征及其影响因素研究. 生态环境学报, 2011, 20(6/7): 1063-1067.] |
| [12] |
Wang L, Li XY, Xue WT et al. Review on research progress of microcystins detection. Food Science, 2005, 26(Z): 136-138. [王蕾, 李小艳, 薛文通等. 微囊藻毒素检测方法研究进展. 食品科学, 2005, 26(Z): 136-138.] |
| [13] |
Water resources department of the Taihu basin Jiangsu provincial department of water resources, Zhejiang provincial department of water resources, Shanghai municipal water bureau eds. Taihu health report. 2017. [水利部太湖流域管理局, 江苏省水利厅, 浙江省水利厅, 上海市水务局.太湖健康状况报告. 2017. ]
|
| [14] |
Ke ZX, Xie P, Guo LG et al. Effects of large bio-manipulation fish pen on community structure of crustacean zooplankton in Meiliang Bay of Taihu Lake. Chinese Journal of Applied Ecology, 2012, 23(8): 2270-2276. [柯志新, 谢平, 过龙根等. 太湖梅梁湾大型控藻围栏对浮游甲壳动物群落结构的影响. 应用生态学报, 2012, 23(8): 2270-2276. DOI:10.13287/j.1001-9332.2012.0317] |
| [15] |
Jing XC, Tu QY. The standard methods in lake eutrophication investigation:The second edition. Beijing: China Environmental Science Press, 1990: 229-230. [金相灿, 屠清瑛. 湖泊富营养化调查规范:第2版. 北京: 中国环境科学出版社, 1990: 229-230.]
|
| [16] |
Bao SD. Agricultural soil analysis:The third edition. Beijing: China Agricultural Press, 1981: 30-33. [鲍士旦. 土壤农化分析:第3版. 北京: 中国农业出版社, 1981: 30-33.]
|
| [17] |
Su X, Steinman AD, Xue Q et al. Evaluating the contamination of microcystins in Lake Taihu, China:The application of equivalent total MC-LR concentration. Ecological Indicators, 2018, 89: 445-454. DOI:10.1016/j.ecolind.2017.11.042 |
| [18] |
Chen W, Li L, Gan N et al. Optimization of an effective extraction procedure for the analysis of microcystins in soils and lake sediments. Environmental Pollution, 2006, 143(2): 241-246. DOI:10.1016/j.envpol.2005.11.030 |
| [19] |
Wang JJ, Yang J, Xian QM et al. Characteristic of microcystin distributions and its relationships with environmental factors in Lake Taihu. J Lake Sci, 2011, 23(4): 513-519. [王经结, 杨佳, 鲜啟鸣等. 太湖微囊藻毒素时空分布特征及与环境因子的关系. 湖泊科学, 2011, 23(4): 513-519. DOI:10.18307/2011.0404] |
| [20] |
Arnold TN, Oldham CE. Trace-element contamination of a shallow wetland in Western Australia. Marine & Freshwater Research, 1997, 48(6): 531-539. DOI:10.1071/MF96088 |
| [21] |
Zhu W, Li M, Dai X et al. Differences in vertical distribution of Microcystis morphospecies composition in a shallow hypertrophic lake (Lake Taihu, China). Environmental Earth Sciences, 2015, 73(9): 1-10. DOI:10.1007/s12665-014-3826-0 |
| [22] |
Ihle T, Jähnichen S, Benndorf J. Wax and wane of Microcystis (Cyanophyceae) and microcystins in lake sediments:A case study in Quitzdorf Reservoir (Germany). Journal of Phycology, 2010, 41(3): 479-488. DOI:10.1111/j.1529-8817.2005.00071.x |
| [23] |
Boström B, Pettersson AK, Ahlgren I. Seasonal dynamics of a cyanobacteria-dominated microbial community in surface sediments of a shallow, eutrophic lake. Aquatic Sciences, 1989, 51(2): 153-178. DOI:10.1007/BF00879300 |
| [24] |
Tsujimura S, Tsukada H, Nakahara H et al. Seasonal variations of Microcystis populations in sediments of Lake Biwa, Japan. Hydrobiologia, 2000, 434(1/2/3): 183-192. DOI:10.1023/A:1004077225916 |
| [25] |
Wang CB. Study on the dynamic and affecting factors of Microcystis and microcystin in sediment[Dissertation]. Beijing: University of Chinese Academy of Sciences, 2014. [王纯波.微囊藻及其毒素在沉积物中的动态变化及影响因素研究[学位论文].北京: 中国科学院大学, 2014. ]
|
| [26] |
Lahti K, Rapala J, Färdig M et al. Persistence of cyanobacterial hepatotoxin, microcystin-LR in particulatematerial and dissolved in lake water. Water Research, 1997, 31(5): 1005-1012. DOI:10.1016/S0043-1354(96)00353-3 |
| [27] |
Song H, Coggins LX, Reichwaldt ES et al. The importance of lake sediments as a pathway for Microcystin dynamics in shallow eutrophic lakes. Toxins, 2015, 7(3): 900-918. DOI:10.3390/toxins7030900 |
| [28] |
Ye W, Tan J, Liu X et al. Temporal variability of cyanobacterial populations in the water and sediment samples of Lake Taihu as determined by DGGE and real-time PCR. Harmful Algae, 2011, 10(5): 472-479. DOI:10.1016/j.hal.2011.03.002 |
| [29] |
Ma QQ, Wang B, Zhang ZY et al. Study on heavy metals pollution in sediments from North of Taihu Lake and its biological toxicity. Asian Journal of Ecotoxicology, 2016, 11(3): 204-210. [马青清, 王博, 张责研等. 太湖北部表层沉积物重金属污染及其生物毒性研究. 生态毒理学报, 2016, 11(3): 204-210. DOI:10.7524/AJE.1673-5897.20150901001] |
| [30] |
Miller MJ, Critchley MM, Hutson J et al. The adsorption of cyanobacterial hepatotoxins from water onto soil during batch experiments. Water Research, 2001, 35(6): 1461-1468. DOI:10.1016/S0043-1354(00)00419-X |
| [31] |
Grützmacher G, Wessel G, Klitzke S et al. Microcystin elimination during sediment contact. Environmental Science & Technology, 2010, 44(2): 657-662. DOI:10.1021/es9016816 |
| [32] |
Wu X, Xiao B, Li R et al. Mechanisms and factors affecting sorption of microcystins onto natural sediments. Environmental Science & Technology, 2011, 45(7): 2641-2647. DOI:10.1021/es103729m |
| [33] |
Lu M, Zhang WG, Shi YX et al. Vertical variations of metals and nutrients in sediments from northern Taihu Lake and the influencing factors. J Lake Sci, 2003, 15(3): 213-220. [陆敏, 张卫国, 师育新等. 太湖北部沉积物金属和营养元素的垂向变化及其影响因素. 湖泊科学, 2003, 15(3): 213-220. DOI:10.18307/2003.0304] |
| [34] |
Zhao XQ, Yang LY, Yu ZY et al. Temporal and spatial distribution of physicochemical characteristics and nutrients in sediments of Lake Taihu. J Lake Sci, 2007, 19(6): 698-704. [赵兴青, 杨柳燕, 于振洋等. 太湖沉积物物理化性质及营养盐的时空变化. 湖泊科学, 2007, 19(6): 698-704. DOI:10.18307/2007.0612] |
| [35] |
Wang FW. Temporal and spatial variations of physico-chemical characteristics in sediments of Lake Taihu, China[Dissertation]. Guangzhou: Jinan University, 2011. [王锋文.太湖沉积物物理化学性质时空变化特征研究[学位论文].广州: 暨南大学, 2011. ]
|
| [36] |
Su X, Xue Q, Steinman AD et al. Spatiotemporal dynamics of microcystin variants and relationships with environmental parameters in Lake Taihu, China. Toxins, 2015, 7(8): 3224-3244. DOI:10.3390/toxins7083224 |
| [37] |
Park HD, Sasaki Y, Maruyama T et al. Degradation of the cyanobacterial hepatotoxin microcystin by a new bacterium isolated from a hypertrophic lake. Environmental Toxicology, 2010, 16(4): 337-343. DOI:10.1002/tox.1041 |
| [38] |
Yan H, Deng YM, Zou H et al. Isolation and activity of bacteria for the biodegradation of microcystins. Environmental Science, 2004, 25(6): 336-339. [闫海, 邓义敏, 邹华等. 降解微囊藻毒素菌种的筛选和活性研究. 环境科学, 2004, 25(6): 336-339. DOI:10.13227/j.hjkx.2004.06.010] |
| [39] |
Jones GJ, Orr PT. Release and degradation of microcystin following algaecide treatment of a Microcystis aeruginosa bloom in a recreational lake, as determined by HPLC and protein phosphatase inhibition assay. Water Research, 1994, 28(4): 871-876. DOI:10.1016/0043-1354(94)90093-0 |
| [40] |
Van DB, Verspagen JM, Lürling M et al. The ecological stoichiometry of toxins produced by harmful cyanobacteria:an experimental test of the carbon-nutrient balance hypothesis. Ecology Letters, 2010, 12(12): 1326-1335. DOI:10.1111/j.1461-0248.2009.01383.x |
| [41] |
Chen W, Song L, Gan N et al. Sorption, degradation and mobility of microcystins in Chinese agriculture soils:Risk assessment for groundwater protection. Environmental Pollution, 2006, 144(3): 752-758. DOI:10.1016/j.envpol.2006.02.023 |
| [42] |
Rinta-Kanto JM, Konopko EA, Debruyn JM et al. Lake Erie Microcystis:Relationship between microcystin production, dynamics of genotypes and environmental parameters in a large lake. Harmful Algae, 2009, 8(5): 665-673. DOI:10.1016/j.hal.2008.12.004 |
| [43] |
Lee TA, Rollwagen-Bollens G, Bollens SM et al. Environmental influence on cyanobacteria abundance and microcystin toxin production in a shallow temperate lake. Ecotoxicology & Environmental Safety, 2015, 114: 318-325. DOI:10.1016/j.ecoenv.2014.05.004 |
| [44] |
Wan X, Tai YP, Wang R et al. Distribution patterns of microcystins-producing Microcystis and microcystin-LR during blooms in drinking watersource areas of Lake Erhai. Acta Scientiae Circumstantiae, 2017, 37(6): 2040-2047. [万翔, 邰义萍, 王瑞等. 洱海水华期间饮用水源区产毒微囊藻和微囊藻毒素-LR的分布特征. 环境科学学报, 2017, 37(6): 2040-2047. DOI:10.13671/j.hjkxxb.2017.0037] |
| [45] |
Wu WX. Unique spatiotemporal distribution of total and toxic Microcystis populations in water and sediments in Lake Taihu[Dissertation]. Shanghai: East China University of Science and Technology, 2016. [吴文仙.太湖水体和底泥中总微囊藻与产毒微囊藻丰度的分布特征[学位论文].上海: 华东理工大学, 2016. ]
|
| [46] |
Zhang YL, Yang LY, Qing BQ et al. Spatial distribution of COD and the correlations with other parameters in the northern region of Lake Taihu. Environmental Science, 2008, 29(6): 1457-1462. [张运林, 杨龙元, 秦伯强等. 太湖北部湖区COD浓度空间分布及与其他要素的相关性研究. 环境科学, 2008, 29(6): 1457-1462. DOI:10.13671/j.hjkxxb.2017.0037] |
| [47] |
Wang JG, Zou H, Zhang Q et al. Spatial and temporal distribution of microcystin in Taihu Lake. Research of Environmental Sciences, 2014, 27(7): 696-703. [王靖国, 邹华, 张强等. 太湖微囊藻毒素的时空分布特征. 环境科学研究, 2014, 27(7): 696-703.] |
| [48] |
Yuan LJ, Liao QG, Zhang L et al. Seasonal and spatial variations of microcystins and their relationships with physiochemical and biological factors in Poyang Lake. Environmental Science, 2018, 39(1): 450-459. [袁丽娟, 廖且根, 张莉等. 鄱阳湖微囊藻毒素时空分布格局及其与理化和生物因子的关系. 环境科学, 2018, 39(1): 450-459. DOI:10.13227/j.hjkx.201708227] |
| [49] |
Wang LZ, Hu QF, Hu Y et al. Changes and cause analysis of water level characteristic factors in Taihu Lake during period from 1954 to 2013. Journal of Hohai University:Natural Sciences, 2016, 44(1): 14-19. [王磊之, 胡庆芳, 胡艳等. 1954-2013年太湖水位特征要素变化及成因分析. 河海大学学报:自然科学版, 2016, 44(1): 14-19.] |
 2019, Vol. 31
2019, Vol. 31 

