(2: 江西师范大学鄱阳湖湿地与流域研究教育部重点实验室, 南昌 330022)
(2: Key Laboratory of Lake Poyang Wetland and Watershed Research, Ministry of Education, Jiangxi Normal University, Nanchang 330022, P. R. China)
中国是一个渔业大国,2017年水产品消费总产量6901.25万吨[1].水产品中含有丰富的能量、蛋白质、维生素和矿物质都对人类健康有益[2].同时还能降低多基因疾病、心血管疾病、癌症和阿尔茨海默症等风险[3].然而,水产品中残留的各种污染物如微塑料和重金属等则可能引发致癌、致突和致畸等问题[4-5].微塑料是一种粒径 < 5 mm的新型污染物,主要来源于工业制备中产生的微米级初生塑料颗粒[6]和工农业、日常生活中废弃产生的大塑料碎片裂解后形成的次生塑料颗粒[7].重金属分为必需元素(Zn、Cu、Mn、Se和Fe)和潜在有毒元素(Ni、Cd、Pb和Hg).目前国内外围绕水产品中微塑料与重金属的来源及分布特征已开展了大量研究[8-9],但对微塑料与重金属污染物的生物累积和复合污染的研究尚较缺乏[10].而水产品中微塑料与重金属的生物累积量却是决定其安全食用与否的关键所在,过量微塑料和重金属都会对生物体自身的生理活动造成影响,且微塑料可作为重金属迁移运输的载体,通过食物链或直接接触在体内逐渐传递并富集,最终可危及到人类健康[11-12].因此,两者复合污染对水产品的安全乃至整个食物链的影响可能比单一的污染源更持久、更复杂.
鱼类是水环境污染物的有效指示生物,水体中污染物的有效浓度、生物的生理过程及摄食行为是影响鱼体生物积累程度的主要因素[13-14].污染物在鱼体不同组织(肌肉、鳃和消化道)中的累积是不一样的,肌肉是鱼类可食用的主要组织,肌肉组织中的累积含量直接决定水产品的安全食用性[15];鳃部和消化道是微塑料的主要拦截和累积部位[16].已往的研究多针对鱼体各组织中的微塑料、重金属的单一污染效应开展研究[9],而相同环境中鱼类的种类、摄食习惯对二者共同污染效应方面的研究并不充分,以及将生存环境(污染的源)、鳃部及消化道(污染交换通道)、肌肉(污染的汇)统一联系起来的研究非常少.因此,对鱼体内微塑料和重金属的累积效应及复合污染方面的研究具有重要意义.
鄱阳湖是中国最大的内陆淡水湖,既是江湖徊游性鱼类重要的摄食与育肥场所,也是一些过河口徊游性鱼类重要的繁殖通道或繁殖场[17].饶河-鄱阳湖入湖区龙口段位于鄱阳湖饶河水系的下游,是饶河入鄱阳湖的汇集区.饶河上游流经德兴铜矿、铅山铅锌矿等矿场开采区,矿山开采的酸性废水导致水体存在重金属污染问题[18];中下游工业污染排放、居民生活垃圾倾倒、无序采砂等人类活动频繁,导致生态环境受到显著污染[19].龙口所在区是采砂、航运及渔业活动较频繁的区域;同时也是长江江豚出没的重要场所,是江西省长江江豚省级自然保护区所在区域[20].本研究以鄱阳湖-饶河入湖段龙口为研究区,通过监测分析水环境中微塑料与重金属污染物的赋存现状,并以主要优势种淡水鱼类为研究对象,分析鱼体内微塑料与重金属Cu、Cd、Pb、Zn、Cr等元素的污染状况与分布特征,探讨微塑料与重金属对水产品的复合污染,旨在为微塑料与重金属的生态与健康风险评估提供一定依据,并为水产品生态安全提供一定参考.
1 材料与方法 1.1 样品采集于2018年10月,在饶河-鄱阳湖入湖区龙口段采集8种优势淡水鱼,采样点如图 1所示.鱼类样品包括鲶鱼(Silurus asotus)、鲫鱼(Carassius auratus)、乌鳢(Channa argus)、鲤鱼(Cyprinus carpio)、鲦鱼(Hemicculter leuciclus)、刀鱼(Coilia ectenes)、草鱼(Ctenopharyngodon idellus)、黄颡鱼(Pelteobagrus fulvidraco),每种鱼至少10尾,共采集鱼类222尾,样品采集后保存于冷藏箱;并采用拖网(网孔径330 μm)的方式采集所在水域的水样,保存于采样瓶中,运回实验室置于4℃冰柜中储存待用,以备监测水样中的微塑料及重金属含量.所有采样工具及保存容器事先均需在实验室利用去离子水清洗干净以防止污染.

|
图 1 采样点位置 Fig.1 Location of the sampling sites |
鱼样带回实验室,鉴定种类、分析其食性,经测定其体长及体重后,将各鱼样解剖后取消化道(包括肠、胃和食道)及鳃部并称鲜重,用于微塑料的鉴定与分析,取肌肉组织(用不锈钢刀具剔除鱼刺)用于重金属含量测定,所有样品于-20℃冰箱中冷冻保存.
1.3 样品微塑料的分离与鉴定 1.3.1 水体微塑料分离按照3 :1(水样:消解液)的比例加入10 % KOH以消解有机质[21],在恒温振荡箱(65℃)下加热并振荡直至水样澄清.使用真空抽滤装置(GM-0.33A)进行抽滤,滤膜采用Φ50 mm×5 μm的醋酸-纤维素滤膜,将抽滤的滤膜放入玻璃培养皿中保存.
1.3.2 鱼体微塑料分离将解剖并解冻后的消化道与鳃分别置于250 mL锥形瓶中,根据样品重量按照1 :30(W/V)的比例加入30 % H2O2和65 % HNO3(以1 :3比例混合)进行消解[22],在恒温振荡箱(65~95℃)下振荡16 h.采用两步分离法(NaCl-NaI饱和溶液)进行浮选分离[23].首先,按照1 :2(消解液:浮选液)的比例往锥形瓶中加入饱和的NaCl浮选液,再以350 r/min转速振荡5 min后转至离心管以4000 r/min离心3 min,上清液使用真空抽滤装置进行抽滤,在抽滤过程中用60~95℃的表面活性剂溶液(十二烷基硫酸钠溶液)冲洗得到脱脂的微塑料.其次,按照1 :2(剩余残渣:浮选液)的比例向上一步残渣中加入NaI浮选液(1.6 g/cm3),离心和抽滤流程同上.将抽滤的滤膜放入玻璃培养皿中保存,整个过程尽量保持样品不受周围环境的污染,全部实验中均设置空白对照组.
1.3.3 微塑料的鉴定首先采用倒置生物显微镜下(XD-202)观察微塑料的形态特征(颜色、粒径大小、类型),采用Nano Measuer 1.2软件统计各样点微塑料的丰度值(items/g, 以湿重计,简称WW),微塑料粒径以最长一边的长度记为粒径大小.其次,对于不确定的颗粒或粒径小于500 μm的微塑料,借助型号为S-3400N台式扫描电子显微镜-能谱仪(SEM-EDS,日本日立电子)进一步观察微塑料形貌及其表面附着物化学成分,放大倍数5~30000倍,加速电压为15 kV,图像储存像素为640×480.最后,取各类型的部分微塑料(n=122,确保每种鱼体内的微塑料鉴定数量不少于10个)鉴定其聚合物成分,与60℃下真空干燥的100 mg溴化钾混合,在玛瑙研钵中研磨,压片,置于型号为Nicolet 6700的红外光谱仪测定样品的红外光谱图.扫描次数32次,分辨率为4 cm-1,扫描范围400~4000 cm-1;通过与数据库内聚合物光谱数据比较,实现目标成分的识别.
1.4 样品重金属含量的测定 1.4.1 水体重金属含量测定将采集回来的水样立即用5 μm滤膜抽滤,并将滤液加HNO3(1 mol/L)酸化至pH < 2,利用等离子体发射光谱仪(725-ES)测定重金属元素.分析过程中利用国家标准样品《GSB04-1742-2004》、平行样、空白样进行质量控制,确保各元素的回收率均在90 % ~102 %,相对标准偏差均小于12 %.
1.4.2 鱼体重金属含量测定测定前将样品置于室温下解冻,放入组织破碎器中均浆,准确称取0.5 g鲜样于消解罐中,加8 mL HNO3、2 mL H2O2后,采用微波消解仪进行消解.消解结束后,将消解液移至50 mL容量瓶,并用超纯水润洗定容至50 mL.采用等离子体发射光谱仪测定重金属元素.实验过程中,采用粉状盲样(黄鱼粉)及平行双样进行质量控制,其中平行双样的相对偏差均小于15 %,粉状盲样测定值均达到允许误差.分析过程中所用聚四氟乙烯容器均在10 % HNO3溶液中浸泡48 h以上,玻璃容器浸泡24 h,超纯水冲洗后晾干,分析所用酸均为优级纯,以消除样品处理及测定过程中可能带入的污染.
1.5 生物累积效应评价采用生物累积系数(BAF, Bioaccumulation Factor)评价生物对污染物的累积效应,BAF是指生物体内某种污染物浓度与其栖息环境背景浓度值之比,能有效地评价生物对外界环境中某污染物的生物有效利用程度[24]. BAF计算方法如下:
| $ B A F=C_{\text {biota }} / C_{\mathrm{W}} $ | (1) |
式中,当生物累积因子为微塑料时,Cbiota是鱼体内微塑料丰度(items/g, W.W.),CW是鱼类生存水环境中微塑料丰度(items/g,水密度以1.02 g/cm3计)[25];当生物累积因子为重金属时,Cbiota是鱼体内重金属含量(mg/kg, W.W.),CW是鱼类生存水环境中重金属含量(mg/kg;水密度以1.02 g/cm3计)[26].
1.6 数据处理采用SPSS 20.0软件对鱼体形态、微塑料丰度和重金属含量等数据进行统计,并进行单因素方差检验(One-way ANOVA),相关性分析则采用Pearson检验法.所有数据结果均在显著性水平P=0.05上进行检验并以Origin 9.0软件整理绘图.
2 结果 2.1 鱼类的形态指标及食性特征8种优势淡水鱼类的形态参数及食性特征如表 1所示.结果表明,鱼类食性大多数为肉食性和杂食性,生活水层大多为底层或中下层;鱼体长范围为13.11~47.56 cm,体重范围为32.34~1344.27 g.草鱼和乌鳢体长、体重均显著高于其他淡水鱼类(P < 0.05).
| 表 1 鱼类形态参数及其食性特征* Tab. 1 Morphological parameters and feeding characteristics of fishes |
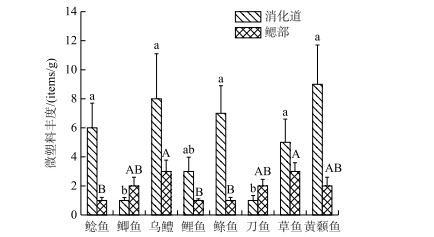
8种淡水鱼类体内均检测出微塑料,其中消化道检出率为95 %,鳃部检出率为84 %,微塑料丰度分布如图 2所示.消化道微塑料丰度范围为1.21~9.11 items/g,平均丰度为5.40 items/g;鳃部微塑料丰度范围为0.61~5.00 items/g,平均丰度为2.87 items/g,消化道微塑料丰度大都高于鳃部(鲫鱼和刀鱼除外).不同鱼类体内微塑料丰度也具有差异性,鲶鱼、乌鳢、鲦鱼、草鱼和黄颡鱼消化道微塑料丰度显著高于鲫鱼和刀鱼,乌鳢、草鱼鳃部微塑料丰度与鲶鱼、鲤鱼、鲦鱼比较存在显著差异(P < 0.05).总体结果表明,8种鱼类消化道微塑料丰度与鳃部的微塑料丰度大多不具一致性(乌鳢和草鱼除外).
|
图 2 鱼类消化道与鳃部微塑料丰度特征 (不同小写字母表示各消化道间差异性显著,不同大写字母表示各鳃部间差异性显著(P < 0.05)) Fig.2 Characteristics of microplastics abundance in digestive tract and gill of fishes |
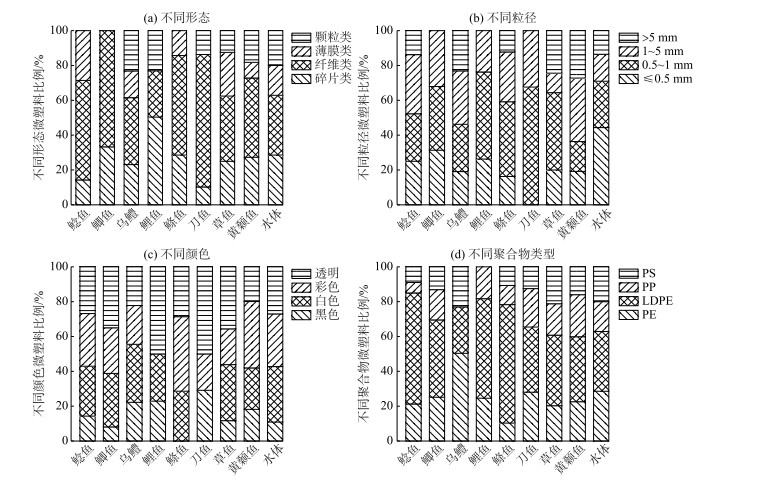
分别对8种优势淡水鱼体及水体中微塑料的形态、粒径、颜色和聚合物成分特征进行分析,结果如图 3所示.
|
图 3 鱼类及水体中微塑料的丰度特征 Fig.3 Characteristics of microplastics in fishes and water |
按不同形态划分,在鱼体内分别检测出碎片类、纤维类、薄膜类和颗粒类4种形态,图 3a所示.其中以纤维类和碎片类微塑料为主, 其平均值所占比例分别为50.62 %和26.53 %.刀鱼体内纤维类微塑料占比最高,达到76.00 %,鲤鱼体内碎片类微塑料高达50.33 %.
按不同粒径划分,鱼体内检测出的微塑料粒径范围在0.01~9.5 mm之间,图 3b所示.绝大多数微塑料粒径> 0.5 mm,所占比例79.07 %,粒径>5 mm微塑料占12.65 %.不同鱼类微塑料的粒径范围具有差异性,刀鱼体内未检测出粒径≤ 0.5 mm和> 5 mm的微塑料,鲫鱼和鲤鱼体内未检测出粒径> 5 mm的微塑料.
按微塑料的颜色划分,鱼体内检测出的微塑料颜色主要有黑色、白色、透明及彩色(以蓝色、绿色、黄色等为主)共4类,图 3c所示.以透明和彩色为主, 其所占比例分别为33.51 %和28.52 %.鲫鱼、鲤鱼和鲦鱼体内未检测出黑色微塑料.
按聚合物主要成分划分,不同鱼体内含有的微塑料聚合物成分主要有聚苯乙烯(PS)、聚丙烯(PP)、聚乙烯(PE)以及低密度聚乙烯(LDPE),图 3d所示.低密度聚乙烯是微塑料的主要聚合物成分(百分比平均值达45.50 %),其次是聚乙烯.碎片类成分主要为聚乙烯,纤维类成分主要为低密度聚乙烯,薄膜类成分主要为聚丙烯,颗粒类成分主要为聚苯乙烯.
鱼类生存水环境中微塑料的丰度范围10~64 items/L(平均值38.56 items/L).图 3各结果显示,水体中检测出颗粒类(20.00 %)、薄膜类(17.10 %)、纤维(28.57 %)和碎片类(34.33 %)4种微塑料,这与鱼体中检测的微塑料一致,但微塑料形态所占比例有差异;还发现微塑料粒径不同,水体中粒径≤ 0.5 mm的微塑料比例(44.37 %)高于鱼体.总体分析表明,鱼体内与其生存水环境中微塑料的丰度特征(形态、粒径、颜色和聚合物类型组分比例)具有一定的相似性.
2.3 鱼类重金属的含量特征5种重金属元素在8种优势淡水鱼体内均有检出,检出率为98.40 %,测定结果见表 2.结果表明,Cu、Cd、Pb、Zn、Cr的含量范围分别为1.10~7.24 mg/kg(平均值4.27 mg/kg)、0.02~0.31 mg/kg(平均值0.13 mg/kg)、0.07~0.75 mg/kg(平均值0.28 mg/kg)、4.02~18.32 mg/kg(平均值11.73 mg/kg)、0.08~0.98 mg/kg(平均值0.53 mg/kg),5种重金属含量的平均值基本符合以下规律:Zn>Cu>Cr>Pb>Cd.
| 表 2 鱼体内重金属含量(mg/kg, WW)* Tab. 2 Contents of heavy metals in fishes |
一般情况下,通常将鱼体肌肉组织中的重金属含量用来评价人类摄食鱼肉的安全性[27].根据中华人民共和国农业部发布的行业标准《NY 5073-2006无公害食品水产品中有毒有害物质限量》[28],5种重金属含量均低于相应的限量标准,符合无公害水产品的要求;参考澳大利亚国家卫生和医学研究理事会制定的人体消费卫生标准中鱼类重金属的限定值[29],5种重金属含量均低于人体消费卫生标准,属于安全食用范围.
2.4 鱼类对微塑料与重金属的累积效应 2.4.1 鱼类对微塑料的累积效应根据8种优势淡水鱼类体内微塑料总丰度(鳃部与消化道)及水体中微塑料丰度计算各类鱼对微塑料的生物累积系数,结果如图 4所示.微塑料累积系数达到77.80~285.27(平均值178.29),8种鱼类对微塑料累积能力的大小次序为:乌鳢、黄颡鱼>鲦鱼、草鱼、鲶鱼>鲤鱼、刀鱼、鲫鱼(相同字母间累积能力大小无显著性).

|
图 4 鱼类微塑料生物累积系数 (不同小写字母表示差异性显著(P < 0.05)) Fig.4 Bioaccumulation factors of microplastics in fishes |
鱼类生存水体环境中的Cu、Cd、Pb、Zn、Cr含量平均值分别为10.26、4.07、12.96、26.77、30.04 μg/L.根据8种鱼体和水体的重金属含量计算鱼类对重金属的生物累积系数,结果见表 3.结果表明,Cu、Cd、Pb、Zn、Cr的生物累积系数范围分别为122.81~811.89(平均值416.54)、9.83~66.34(平均值32.56)、9.26~39.35(平均值21.51)、212.92~718.34(平均值437.66)和11.98~23.97(平均值17.68),鱼类对不同重金属的累积大小次序为Zn>Cu>Cd>Pb>Cr.不同鱼类对不同重金属的累积能力具有种类差异性,乌鳢对Cd、Zn、Cr的累积能力较强,黄颡鱼和鲶鱼对Cu、Zn的累积能力明显高于其他鱼类,鲤鱼对Pb的累积能力较强,刀鱼对Cd的累积能力较强.
| 表 3 鱼类对重金属的生物累积系数* Tab. 3 Bioaccumulation factors of heavy metals in fishes |
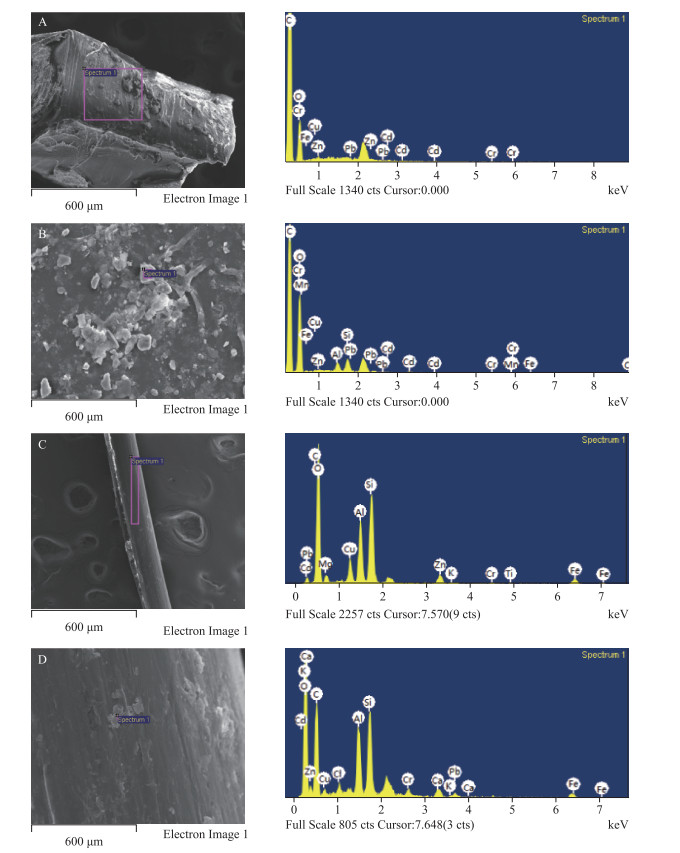
采用扫描电子显微镜(SEM)与能谱分析(EDS)相结合的方法,分析鱼体内粒径小于500 μm的微塑料表面,结果如图 5所示.
|
图 5 鱼体内不同微塑料局部SEM-EDS图(A.碎片类;B.薄膜类;C.纤维类;D.颗粒类) Fig.5 SEM-EDS images of different microplastics in fishes (A. Fragments; B. Films; C. Fibers; D. Pellets) |
SEM图像表明,微塑料表面多具粗糙、多孔、裂痕和撕裂等特征,碎片类表面呈不规则的层状结构及不规则的裂痕;薄膜类表面有矿物质凸起,呈现层状轮廓并一定程度粉化;纤维类表面含有形状不一的沟壑和凸起的小球状气泡;颗粒类表面有氧化和风化的痕迹且附着有机质.微塑料表面多样化的形貌特征有利于增加其比表面积,提高微塑料对重金属的吸附能力. EDS分析发现,大部分微塑料表面均含有C、O、S、Si、Ti、Cl和S元素,但不同结构的微塑料对重金属的亲和力及吸附能力也表现出差异性.例如,碎片类微塑料表面主要吸附有Fe、Cu、Pb、Cd、Pb、Zn、Cr,薄膜类吸附有Fe、Mn、Cr、Al、Cu、Pb、Cd、Pb、Zn,纤维类主要吸附有Cu、Cd、Pb、Zn、Mg、K、Cr、Fe元素,颗粒类主要吸附有Ca、K、Fe、Al、Cu、Cd、Pb、Zn,5种重金属元素在各类型微塑料表面均检测到,表明微塑料可作为重金属污染物的附着载体.
进一步对微塑料表面附着物的重金属能谱进行统计分析,结果如表 4. Cd和Al主要以氧化态的形式存在,其化合物为一种常用的塑料稳定剂;Pb主要以PbF2的形式存在,是一种常见的有毒、强腐蚀的助溶剂;Fe主要以可氧化态的有效形态(Fe2O3)存在;Ti为检测浓度最高的金属元素,TiO2是一种广泛应用于复合材料的抗腐蚀性白色颜料.未检测出微塑料表面吸附的Cu、Zn、Cr和Mn元素的存在形态,仅测出其质量比及原子比.
| 表 4 鱼体微塑料表面金属元素的能谱分析 Tab. 4 EDS analysis of metal elements on the surface of microplastics in fishes |
通过统计并分析微塑料总丰度、鱼类形态与重金属间的相关性,探讨其复合污染和累积效应,结果如表 5.微塑料总丰度与Cu呈极显著相关(P < 0.01),与Cd、Pb均呈显著相关(P < 0.05),体长与微塑料总丰度、Cu均呈显著相关(P < 0.05).
| 表 5 微塑料总丰度、重金属含量与鱼体形态指标的相关性 Tab. 5 Correlation of total abundance of microplastics and heavy metal contents with morphological indices of fishes |
在研究过程中通过检测微塑料在鱼体鳃部及消化道内的分布状况,并根据微塑料在鄱阳湖主要优势淡水鱼体内的污染状况,探索微塑料进入滤食性生物体内的不同方式.结果显示,各鱼类消化道微塑料丰度较高,原因是微塑料通过鳃部呼吸作用过滤淡水残留在鳃部,再通过细胞内吞作用汇集到消化道[33],这些不规则而锋利的微塑料边缘可能会对胃壁造成机械损伤及超负荷压力.鱼类体内与其生存水环境的微塑料丰度特征具有相似性,体内的微塑料累积可能与水环境中微塑料污染程度有关[34],鱼类和水环境中均以纤维类微塑料为主,主要来源于废弃的渔线渔网碎裂成的细小纤维状残体[35]及生活废水中排放的衣物洗涤纤维[36],有研究表明生活污水中含有大量的合成纤维和人造纤维,在日常清洗衣物过程中,每次清洗可产生2900多个纤维进入废水中,单位体积废水中的纤维量可高达100 n/L以上[37];此外,鄱阳湖频繁的渔业活动中会产生大量老化的渔具,例如渔网、渔线和绳索.鱼体内微塑料颜色以彩色为主,由于彩色微塑料颗粒与食物具有相似性,进入水体后在一定程度上混淆生物的视觉,而被生物误食.值得注意的是,鱼体内79.07 %的微塑料粒径>0.5 mm,这与Romeo和Rummel等[38-39]的结果一致,由于大型纤维类微塑料易与鱼类食物缠绕而被带入体内,大型微塑料易在肠道的螺旋结构中积累而难以通过消化系统排出,并进一步通过食物链或食物网向高等生物迁移或累积[40]. Jabeen等的研究表明,不管是在海水鱼还是淡水鱼中,小型微塑料都比大型微塑料更易于累积在体内[41].此外,本研究还发现,8种优势淡水鱼对微塑料的累积能力具有一定的差异性,这可能与不同鱼类的摄食特性及生活习性不同均有关[42].因此,不同鱼类对微塑料的摄食行为和累积特性需要进一步研究.
3.2 鱼类重金属的含量特征本文研究结果与鄱阳湖吴城鱼类重金属含量比较发现[30],鲤鱼和草鱼体内Cu和Pb含量高于吴城,Cd和Zn含量结果一致;鄱阳湖草鱼中5种重金属含量都高于长江流域,鲫鱼、鲦鱼和鲶鱼中Cu和Zn含量均显著高于长江中下游流域[31].其原因可能是龙口是乐安河支流入湖口,乐安河流经德兴铜矿和铅山铅锌矿,Zn又是Cu的伴生矿,这些受重金属污染的工业废水流经饶河龙口入湖段,最终汇入鄱阳湖[18].检测出Zn含量最高,其原因可能是Zn一方面是鱼体必需的微量元素,其在鱼体内具有一定功能,不仅参与生物体内的多种代谢过程,还是许多酶的组成成分或激活剂[43]. Cu在鱼体中含量也较高,可能是因为Cu在生物体内的主要作用是参与氧化还原反应,在生物系统中起着独特的催化剂,其不仅参与造血过程中铜及铁的代谢,同时还参与一些酶的合成与黑色素合成[44]. 5种重金属元素在鱼体内的平均含量特性符合生物体必需元素(Zn、Cu)>非必需元素(Pb、Cd、Cr)含量.
本研究结果与匡荟芬等的鄱阳湖经济鱼类重金属累积系数对比发现[32],龙口鱼类5种重金属累积系数均显著高于鄱阳湖流域,表明饶河龙口鱼类受到重金属的严重污染.此外,不同鱼类间重金属累积系数也差异较大,可能是由于不同鱼类的食性及习性不同导致.不同鱼类间重金属累积系数差异较大结果表明肉食性或杂食性鱼类重金属含量水平相对较高,而草食性鱼类重金属含量水平较低.从食物链角度分析,高营养级的生物累积程度略高于低营养级的生物,肉食性鱼类在其食物链中处于较高的营养级,因此其体内累积重金属的程度要高于杂食性和草食性鱼类[45-46];从鱼类的生活习性分析,肉食性鱼类和杂食性鱼类多栖息于水体中下层,而草食性鱼类多活动于水体中上层,重金属通过迁移转化或吸附作用多沉积于水体沉积物中,肉食性和杂食性鱼类摄食过程中吸收和接触受污染的沉积物较多[47],从而导致体内重金属累积程度较高.
3.3 微塑料与重金属的生物累积和复合污染效应塑料在生产过程中往往会通过添加稳定剂来提高塑料制品的交联稳定性,而稳定剂中通常含有Pb、Cd、Ba和Sn等有毒的金属离子,这也是微塑料毒性的重要来源之一[48].本研究通过SEM-EDS分析发现,5种重金属元素在微塑料表面均被检测到,同时不同微塑料表面位置上的金属元素具有差异性,结果表明微塑料携带的金属元素并非完全是塑料生产过程中的添加物,还可以积聚周围环境中的重金属元素[49].这一吸附过程可能与塑料表面附着的有机物质对表面的改性有关[50],金属阳离子或络合物可与微塑料表面的带电位点或中性区域相互作用,并与水合氧化物共同沉淀或吸附[51].相关性分析发现,微塑料的存在一定程度上增强了Cu、Cd和Pb的累积效应,微塑料和Cu在鱼体内不断累积和逐级传递,还可能产生复合污染效应.鱼体通过摄食或鳃部呼吸作用将微塑料积累在体内后,重金属在消化道内的酸性条件下会从微塑料上解吸下来,并通过血液循环输送到肌肉组织中[52].值得注意的是,这些金属元素可能在水生生物体内的酸性、酶富集的消化系统中被激活,从而影响它们的繁殖与发育,并干扰其体内重要的生物代谢过程[53-54].而且,微塑料与重金属产生的复合污染效应还可能影响生物种群、生态系统功能甚至威胁人类健康.
4 结论1) 8种淡水鱼类消化道内微塑料丰度范围为1.21~9.11 items/g,平均丰度为5.40 items/g;鳃部丰度为0.61~5.00 items/g,平均丰度为2.87 items/g.微塑料类型主要有碎片类、纤维类、薄膜类和颗粒类4种,其聚合物成分分别为聚乙烯、低密度聚乙烯、聚丙烯和聚苯乙烯;颜色以透明及彩色为主;微塑料粒径范围为0.01~9.5 mm,粒径>0.5 mm的微塑料所占比例为79.07 %.
2) 8种淡水鱼受到不同程度的重金属污染,但均符合无公害水产品的要求且低于人体消费卫生标准,属于安全食用范围.鱼体内重金属Cu、Cd、Pb、Zn、Cr的平均含量分别为4.27、0.13、0.28、11.73、0.53 mg/kg,基本符合以下特性:生物体必需元素(Zn、Cu)含量>非必需元素(Pb、Cd、Cr)含量.
3) 微塑料的生物累积系数范围为77.80~285.27(平均值为178.29),不同鱼类对微塑料的生物累积系数大小次序为:乌鳢、黄颡鱼>鲦鱼、草鱼、鲶鱼>鲤鱼、刀鱼、鲫鱼;5种重金属元素在鱼体中的累积含量大小次序为Zn>Cu>Cd>Pb>Cr,不同鱼类对不同重金属的累积能力具有种类差异性;各类型微塑料表面均检测到5种重金属元素,证实微塑料可能成为水环境中重金属污染物的附着载体,相关性表明微塑料与Cu呈极显著相关(P < 0.01),与Cd、Pb均呈显著相关(P < 0.05);微塑料的存在一定程度上会增强Cu、Cd与Pb在生物体内的累积效应,从而产生复合污染效应.
| [1] |
Fisheries Bureau, Ministry of Agriculture. China fisheries statistics yearbook. Beijing: China Agricultural Press, 2017. [农业部渔业局. 中国渔业统计年鉴. 北京: 中国农业出版社, 2017.]
|
| [2] |
Gu YG, Huang HH, Lin Q et al. Concentrations and human health implications of heavy metals in wild aquatic organisms captured from the core area of Daya Bay's Fishery Resource Reserve, South China Sea. Environmental Toxicology and Pharmacology, 2016, 45: 90-94. DOI:10.1016/j.etap.2016.05.022 |
| [3] |
Maulvault AL, Cardoso C, Nunes ML et al. Risk-benefit assessment of cooked seafood:Black scabbard fish (Aphanopus carbo) and edible crab (Cancer pagurus) as case studies. Food Control, 2013, 32(2): 518-524. DOI:10.1016/j.foodcont.2013.01.026 |
| [4] |
Jabeen K, Su L, Li J et al. Microplastics and mesoplastics in fish from coastal and fresh waters of China. Environmental Pollution, 2017, 221: 141-149. DOI:10.1016/j.envpol.2016.11.055 |
| [5] |
Obaidat MM, Massadeh AM, Al-Athamneh AM et al. Heavy metals in fish from the Red Sea, Arabian Sea, and Indian Ocean:effect of origin, fish species and size and correlation among the metals. Environmental Monitoring and Assessment, 2015, 187(4): 218-227. DOI:10.1007/s10661-015-4463-0 |
| [6] |
Cooper DA, Corcoran PL. Effects of mechanical and chemical processes on the degradation of plastic beach debris on the island of Kauai, Hawaii. Marine Pollution Bulletin, 2010, 60(5): 650-655. DOI:10.1016/j.marpolbul.2009.12.026 |
| [7] |
Liu Q, Xu XD, Huang W et al. Research advances on the ecological effects of microplastic pollution in the marine environment. Acta Ecologica Sinica, 2017, 37(22): 7397-7409. [刘强, 徐旭丹, 黄伟等. 海洋微塑料污染的生态效应研究进展. 生态学报, 2017, 37(22): 7397-7409.] |
| [8] |
Gu YG, Lin Q, Wang XH et al. Heavy metal concentrations in wild fishes captured from the South China Sea and associated health risks. Marine Pollution Bulletin, 2015, 96(1/2): 508-512. |
| [9] |
Grigorakis S, Mason SA, Drouillard KG. Determination of the gut retention of plastic microbeads and microfibers in goldfish (Carassius auratus). Chemosphere, 2017, 169: 233-238. DOI:10.1016/j.chemosphere.2016.11.055 |
| [10] |
Vendel AL, Bessa F, Alves VEN et al. Widespread microplastic ingestion by fish assemblages in tropical estuaries subjected to anthropogenic pressures. Marine Pollution Bulletin, 2017, 117(1/2): 448-455. |
| [11] |
Abdolahpur MF, Safahieh A, Savari A et al. The relationship between heavy metal (Cd, Co, Cu, Ni and Pb) levels and the size of benthic, benthopelagic and pelagic fish species, Persian Gulf. Bulletin of Environmental Contamination and Toxicology, 2013, 90(6): 691-696. DOI:10.1007/s00128-013-0986-7 |
| [12] |
Teuten EL, Saquing JM, Knappe DRU et al. Transport and release of chemicals from plastics to the environment and to wildlife. Philos Trans R Soc Lond B Biol Sci, 2009, 364(1526): 2027-2045. DOI:10.1098/rstb.2008.0284 |
| [13] |
Bellas J, Martínez-Armental J, Martínez-Cámara A et al. Ingestion of microplastics by demersal fish from the Spanish Atlantic and Mediterranean coasts. Marine Pollution Bulletin, 2016, 109: 55-60. DOI:10.1016/j.marpolbul.2016.06.026 |
| [14] |
Koide S, Silva JAK, Dupra V et al. Bioaccumulation of chemical warfare agents, energetic materials, and metals in deep-sea shrimp from discarded military munitions sites off Pearl Harbor. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 2015, 128: 53-62. |
| [15] |
Hosseini M, Nabavi SM, Nabavi SN et al. Heavy metals (Cd, Co, Cu, Ni, Pb, Fe, and Hg) content in four fish commonly consumed in Iran:risk assessment for the consumers. Environmental Monitoring and Assessment, 2015, 187(5): 237. DOI:10.1007/s10661-015-4464-z |
| [16] |
Neves D, Sobral P, Ferreira JL et al. Ingestion of microplastics by commercial fish off the Portuguese coast. Marine Pollution Bulletin, 2015, 101(1): 119-126. DOI:10.1016/j.marpolbul.2015.11.008 |
| [17] |
Chen WJ, He G, Wu B et al. Spatial distribution and biomass assessment of fish in the channel connecting the Lake Poyang and the Yangtze River. J Lake Sci, 2017, 29(4): 923-931. [陈文静, 贺刚, 吴斌等. 鄱阳湖通江水道鱼类空间分布特征及资源量评估. 湖泊科学, 2017, 29(4): 923-931. DOI:10.18307/2017.0416] |
| [18] |
Jian MF, Zhou XL, Yu HP et al. Plant community characteristics and the enrichment of heavy metals copper, lead and cadmium in the dominant plant species grown in the wetland of Lean River and Poyang Lake. Guihaia, 2015, 35(3): 295-302, 324. [简敏菲, 周雪玲, 余厚平等. 乐安河-鄱阳湖湿地植物群落特征及其优势植物对重金属Cu、Pb、Cd的富集. 广西植物, 2015, 35(3): 295-302, 324.] |
| [19] |
Li WH, Jian MF, Yu HP et al. Characteristics of microplastic pollution and temporal-spatial distribution in the sediments of the five rivers in the Lake Poyang Basin. J Lake Sci, 2019, 31(2): 397-406. [李文华, 简敏菲, 余厚平等. 鄱阳湖"五河"入湖口沉积物中微塑料污染物的特征及其时空分布. 湖泊科学, 2019, 31(2): 397-406. DOI:10.18307/2019.0209] |
| [20] |
Xiong YH, Zhang XQ. Study on the number, distribution and activity of finless porpoise in Xinluojiang section of Yangtze river. Resources and Environment in the Yangtze Basin, 2011, 20(2): 143-149. [熊远辉, 张新桥. 长江湖北新螺江段长江江豚数量、分布和活动的研究. 长江流域资源与环境, 2011, 20(2): 143-149.] |
| [21] |
Zou YD, Xu QQ, Zhang Q et al. Influence of six digestion methods on determination of polystyrene microplastics in organisms by fluorescence. Environmental Science, 2019, 40(1): 496-503. [邹亚丹, 徐擎擎, 张哿等. 6种消解方法对荧光测定生物体内聚苯乙烯微塑料的影响. 环境科学, 2019, 40(1): 496-503.] |
| [22] |
De Witte B, Devriese L, Bekaert K et al. Quality assessment of the blue mussel (Mytilus edulis):comparison between commercial and wild types. Marine Pollution Bulletin, 2014, 85(1): 146-155. |
| [23] |
Prata JC, da Costa JP, Duarte AC et al. Methods for sampling and detection of microplastics in water and sediment:a critical review. TrAC Trends in Analytical Chemistry, 2018, 110: 150-159. |
| [24] |
Arnot JA, Gobas FA. A review of bioconcentration factor (BCF) and bioaccumulation factor (BAF) assessments for organic chemicals in aquatic organisms. Environmental Reviews, 2006, 14(4): 257-297. DOI:10.1139/a06-005 |
| [25] |
Besseling E, Wegner A, Foekema EM et al. Effects of microplastic on fitness and PCB bioaccumulation by the Lugworm Arenicola marina (L.). Environmental Science & Technology, 2013, 47(1): 593-600. |
| [26] |
Wei LL, Zhou Q, Xie CX et al. Bioaccumulation and biomagnification of heavy metals in Three Gorges Reservoir and effect of biological factors. Environmental Science, 2016, 37(1): 325-334. [韦丽丽, 周琼, 谢从新等. 三峡库区重金属的生物富集、生物放大及其生物系数的影响. 环境科学, 2016, 37(1): 325-334.] |
| [27] |
Food and Agricultural Organization (FAO). Statistics Division. Food Security Statistics. Food Consumption. 2008, URL: < http://www.fao.org/es/ESS/faostat/foodsecurity/index_en.htm>.
|
| [28] |
The limit of Poisonous and harmful material in aquaticproducts (NY5073-2006). [无公害食品水产品有毒有害物质限量(NY5073-2006). ]
|
| [29] |
Chen HH, Wu HF, Huang LM et al. Analysis and evaluation of five heavy metals in edible fish in a market in Guangzhou. Chinese Journal of Health Laboratory Technology, 2008, 18(12): 2736-2738. [陈红红, 毋福海, 黄丽玫等. 广州市场食用鱼中5种重金属含量分析及评价. 中国卫生检验杂志, 2008, 18(12): 2736-2738. DOI:10.3969/j.issn.1004-8685.2008.12.120] |
| [30] |
Tu ZC, Pang JJ, Zheng TT et al. Enrichment and safety evaluation of fish weight metal in Wucheng Poyang Lake nature reserve. Acta Hydrobiologica Sinica, 2017, 41(4): 878-883. [涂宗财, 庞娟娟, 郑婷婷等. 吴城鄱阳湖自然保护区鱼体重金属的富集及安全性评价. 水生生物学报, 2017, 41(4): 878-883.] |
| [31] |
Yi Y, Yang Z, Zhang S et al. Ecological risk assessment of heavy metals in sediment and human health risk assessment of heavy metals in fishes in the middle and lower reaches of the Yangtze River basin. Environmental Pollution, 2011, 159(10): 2575-2585. DOI:10.1016/j.envpol.2011.06.011 |
| [32] |
Kuang HF, Hu CH, Sun LL et al. Accumulation characteristics and health risk assessment of heavy metals in fish species from Poyang Lake. Journal of Nanchang University:Natural Science, 2018, 42(6): 578-583. [匡荟芬, 胡春华, 孙丽丽等. 鄱阳湖鱼类重金属积累特征及其健康风险评价. 南昌大学学报:理科版, 2018, 42(6): 578-583.] |
| [33] |
Trevisan R, Mello DF, Delapedra G et al. Gills as a glutathione-dependent metabolic barrier in Pacific oysters Crassostrea gigas:Absorption, metabolism and excretion of a model electrophile. Aquatic Toxicology, 2016, 173: 105-119. DOI:10.1016/j.aquatox.2016.01.008 |
| [34] |
Sanchez W, Bender C, Porcher JM. Wild gudgeons (Gobio gobio) from French rivers are contaminated by microplastics:Preliminary study and first evidence. Environmental Research, 2014, 128: 98-100. DOI:10.1016/j.envres.2013.11.004 |
| [35] |
Gallagher A, Rees A, Rowe R et al. Microplastics in the Solent estuarine complex, UK:An initial assessment. Marine Pollution Bulletin, 2015, 102(2): 243-249. |
| [36] |
Browne MA, Galloway TS, Thompson RC. Spatial patterns of plastic debris along Estuarine shorelines. Environmental Science & Technology, 2010, 44(9): 3404-3410. |
| [37] |
Napper IE, Thompson RC. Release of synthetic microplastic plastic fibres from domestic washing machines:Effects of fabric type and washing conditions. Marine Pollution Bulletin, 2016, 112(1/2): 39-45. |
| [38] |
Romeo T, Pietro B, Peda C et al. First evidence of presence of plastic debris in stomach of large pelagic fish in the Mediterranean Sea. Marine Pollution Bulletin, 2015, 95(1): 358-361. |
| [39] |
Rummel C, Loder MG, Fricke N et al. Plastic ingestion by pelagic and demersal fish from the North Sea and Baltic Sea. Marine Pollution Bulletin, 2016, 102(1): 134-141. |
| [40] |
Peters CA, Bratton SP. Urbanization is a major influence on microplastic ingestion by sunfish in the Brazos River Basin, Central Texas, USA. Environmental Pollution, 2016, 210: 380-387. DOI:10.1016/j.envpol.2016.01.018 |
| [41] |
Jabeen K, Su L, Li J et al. Microplastics and mesoplastics in fish from coastal and fresh waters of China. Environmental Pollution, 2017, 221: 141-149. DOI:10.1016/j.envpol.2016.11.055 |
| [42] |
Silvacavalcanti JS, Silva JD, De Franca EJ et al. Microplastics ingestion by a common tropical freshwater fishing resource. Environmental Pollution, 2017, 221(221): 218-226. |
| [43] |
Schmidt C, Beyersmann D. Transient peaks in zinc and metallothionein levels during differentiation of 3T3L1 cells. Archives of Biochemistry & Biophysics, 1999, 364(1): 91-98. |
| [44] |
Göran D, Xiu R. Toxicity of mercury, copper, nickel, lead, and cobalt to embryos and larvae of zebrafish, Brachydanio rerio. Archives of Environmental Contamination and Toxicology, 1991, 21(1): 126-134. DOI:10.1007/BF01055567 |
| [45] |
Chi QQ, Zhu GW, Langdon A. Bioaccumulation of heavy metals in fishes from Taihu Lake, China. Journal of Environmental Sciences, 2007, 19(12): 1500-1504. DOI:10.1016/S1001-0742(07)60244-7 |
| [46] |
Ahmad MK, Islam S, Rahman et al. Heavy metals in water, sediment and some fishes of Buriganga River, Bangladesh. International Journal of Environmental Research, 2010, 4(2): 321-332. |
| [47] |
Yi YJ, Wang ZY, Zhang K et al. Sediment pollution and its effect on fish through food chain in the Yangtze River. International Journal of Sediment Research, 2008, 23: 338-347. DOI:10.1016/S1001-6279(09)60005-6 |
| [48] |
Imhof HK, Laforsch C, Wiesheu A C et al. Pigments and plastic in limnetic ecosystems:A qualitative and quantitative study on microparticles of different size classes. Water Research, 2016, 98: 64-74. DOI:10.1016/j.watres.2016.03.015 |
| [49] |
Rochman CM, Hoh E, Kurobe T et al. Ingested plastic transfers hazardous chemicals to fish and induces hepatic stress. Scientific Reports, 2013, 3(1): 3263. DOI:10.1038/srep03263 |
| [50] |
Turner A, Holmes L. Adsorption of trace metals by microplastic pellets in fresh water. Environmental Chemistry, 2015, 12(5): 600-610. DOI:10.1071/EN14143 |
| [51] |
Ashton K, Holmes L, Turner A et al. Association of metals with plastic production pellets in the marine environment. Marine Pollution Bulletin, 2010, 60(11): 2050-2055. DOI:10.1016/j.marpolbul.2010.07.014 |
| [52] |
Shang XD, He ZQ. Research progress on accumulation of heavy metals in fish. Hebei Fishery, 2009(5): 44-45. [尚晓迪, 何志强. 重金属在鱼体内积累作用的研究进展. 河北渔业, 2009(5): 44-45. DOI:10.3969/j.issn.1004-6755.2009.05.016] |
| [53] |
Cole M, Lindeque P, Halsband C et al. Microplastics as contaminants in the marine environment:A review. Marine Pollution Bulletin, 2011, 62(12): 2588-2597. DOI:10.1016/j.marpolbul.2011.09.025 |
| [54] |
Holmes L, Turner A, Thompson RC et al. Adsorption of trace metals to plastic resin pellets in the marine environment. Environmental Pollution, 2012, 160(1): 42-48. |
 2020, Vol. 32
2020, Vol. 32 

