(2: 中国科学院南京地理与湖泊研究所, 湖泊与环境国家重点实验室, 南京 210008)
(2: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P. R. China)
植物通过根系分泌物与根际环境进行着物质、能量与信息的交流, 从而调节自身的生命活动过程来适应环境胁迫.在众多植物根系分泌物中, 小分子有机酸(LMWOAs)如柠檬酸、草酸、苹果酸、甲酸等占有很大比重, 且在调控根际微环境、矿物溶解、养分供应和污染物毒害等过程起到至关重要的作用[1-4].众多研究表明, LMWOAs能通过根际还原作用及螯合、酸化及离子交换的方式溶解和转化部分难溶性矿物, 并可调节根表细胞的通透性, 达到释放和增加根际养分生物有效性的效果, 进而促进植物吸收和生长[5-7].绝大多数LMWOAs具有1个或多个羟基或羧基功能团, 可参与重金属等污染物配位结合, 参与重金属元素的吸收、运输、积累等过程, 从而促进植物对重金属的超积累达到解毒植物体内重金属的目的[4, 8].除此之外, LMWOAs植物分泌物中的有机酸是根际圈最活跃的碳循环方式, 40 % ~80 %的有机酸最初来源于光合作用固定的碳, LMWOAs可为根际微生物提供了更容易利用的碳源, 对推动土壤养分循环具有重要意义[3].由此可见, LMWOAs与植物生长发育、抗逆性和生产力具有直接关系, 全面认识植物根系LMWOAs分泌特征对探索元素在根-土界面迁移转化和生态效应, 以及污染修复控制方法和机理等方面具有重要意义.
植物根系是对外界环境变化响应较为敏感的部位, 根系分泌LMWOAs组成和含量变化被认为是植物响应环境胁迫最直接、最明显的反应, 可在一定程度上反映植物应对外界环境胁迫能力的强弱, 也可以指示植物在逆境下的自我调节能力高低[9].众多研究表明, 植物基因类型不同以及外界环境因素变化如温度、光照、盐分以及营养盐和重金属水平等会显著影响植物根系LMWOAs分泌种类和数量[1, 7].例如, 李煜姗等[10]发现不同温度处理对番茄根系分泌LMWOAs具有显著影响, 显著高于负昼夜温差的处理.茶树、大豆、油菜等植物可通过分泌具有羧基基团的LMWOAs如苹果酸、草酸、柠檬酸和乙酸等适应低磷介质环境[11].徐国伟等[12]研究表明过量施氮会显著抑制水稻根系活力和根系LMWOAs的分泌. Cd胁迫同样会显著影响烟草、玉米和蚕豆等植物根系分泌LMWOAs组成特征, 并会促进草酸和柠檬酸含量增加以及Cd在植物体内积累[13-14].目前针对植物根系LMWOAs分泌特征及其胁迫响应机理的研究多集中在水稻、小麦、油菜、番茄、白羽扇豆等陆生植物, 尤其比较受关注的是其对磷素和重金属胁迫响应方面.相对而言, 人们对水生植物根系LMWOAs组成、含量及环境胁迫影响特征的研究报道则较为少见.
本研究选择我国湖(库)、河流中普遍分布且在湿地生态修复工程广泛应用的6种水生植物包括:2种典型沉水植物即马来眼子菜(Potamogeton malaianus)和苦草(Vallisneria natans), 2种典型挺水植物即芦苇(Phragmites australis)、菖蒲(Acorus calamus), 以及2种典型浮叶植物即莕菜(Nymphoides peltatum)和菱角(Trapa incisa)为研究对象, 重点研究在不同环境胁迫(温度、缺磷和高铵态氮)处理下不同水生植物根系LMWOAs组成和含量变化特征, 研究结果对深入认识水生植物生理生态效应及其对环境因子胁迫响应, 以期为日后湿地恢复提供科学依据.
1 材料与方法 1.1 植物材料和培养方法现有的根系分泌物收集装置或方法仅适用于陆生植物, 无法满足有水覆盖的水生植物根系分泌物收集.为此, 本研究自主构建一种新型水生植物根系分泌物原位收集装置(CN201811634672.2), 如图 1所示, 本装置包括依次螺纹连接的储水管、阻隔管和根系生长管.出水管中上下设置有进水管和出水管, 便于实现流动培养;阻隔管的中部设置有第一圆环, 根系生长管靠近阻隔管的一端与阻隔管夹设有第二圆环, 第二圆环的内径小于第一圆环的内径, 第二圆环的底部固设有与第二圆环的内环相通的根袋, 根袋位于根系生长管中;根系生长管的底端封闭, 且根系生长管的底面中央设置有底部通孔, 侧壁上设置有上、下两处通孔, 并通过快接插口在线更新培养液和收集分泌物.该装置结构简单, 实现了不同类型水生植物根系分泌物的原位收集.本研究中的受试水生植物和上覆水体均采集于东太湖.现场连根采集生长状态良好的完整水生植物植株, 充分洗净泥土, 立刻放入1/5 Hoagland's培养液中, 并在智能光照培养箱(GZX-300BSH-Ⅲ, 上海新苗, 中国)模拟自然条件进行预培养2周, 光暗时间比为12 h :12 h;随后分别挑选生长均匀、健壮植株进行统一修剪, 其中马来眼子菜、苦草、莕菜和菱角株高约35 cm, 芦苇和菖蒲株高约50 cm, 洗净后移植于自制根系分泌收集装置中进行LMWOAs原位收集.培养时, 受试水生植物的根系主要生长在装有Hoagland营养液的根系生长管内, 而地上组织部分则生长于装有太湖水体的储水管内, 二者通过中间阻隔管进行隔离避免溶液串扰.
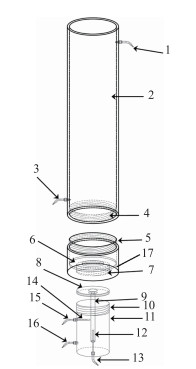
|
图 1 水生植物根系分泌物收集装 置示意图(具体部件包括:出水管(1), 储水管(2), 进水管(3), 储水管内螺纹(4), 阻隔管外螺纹(5), 第一圆环(6), 阻隔管内螺纹(7), 第二圆环(8), 根袋(9), 根系生长管外螺纹(10), 根系生长管(11), 根际取样器(12), 底部通孔(13), 非根际取样器(14), 上通孔(15), 下通孔(16), 阻隔管(17)) Fig.1 Experimental setup used for the collection of macrophyte root exudation (Compositions: outlet valve(1), water storage tube(2), inlet valve(3), internal thread(4), external thread(5), first annulus(6), internal thread(7), second annulus(8), root bag(9), external thread(10), root developing tube(11), rhizosphere sampler(12), bottom hole(13), non-rhizosphere sampler(14), top hole(15), under hole(16), isolated tube(17)) |
选择生长状况相似的6种水生植物幼苗, 预培养14天后进行随机分组分别于不同温度条件(15、25和30℃), 缺磷和高铵态氮水平营养液中进行环境胁迫处理.培养14天后对不同实验处理条件下的各水生植物根系分泌物进行收集并分析LMWOAs的组成和含量变化特征.特别指出, 需在筛选出不同水生植物分泌LMWOAs最适宜温度基础上, 进一步考察缺磷和高铵态氮胁迫实验, 所用营养液均在正常Hoagland's培养液基础上进行调配, 缺磷处理培养液中不含有磷养分(KH2PO4), 以相同摩尔浓度的KCl代替; 而高铵态氮处理组培养液采用NH4Cl进行调配至NH4+-N浓度为14 mg/L; 每组实验设置3组平行并同时设置完全正常培养处理的对照组.
1.3 水生植物根系分泌LMWOAs的收集与测定在水生植物培养过程中, 其茎叶部需要不断充入空气以保证水中溶解氧浓度.开始收集时, 首先利用装置的在线更换根系培养管内的营养液为超纯水, 将受试植物根系用清水轻轻冲洗3遍;然后更换为30 mg/L氯霉素, 并将根系浸泡2 h以消除根系中微生物对根系分泌物过程的影响;随后移除氯霉素溶液并进一步用超纯水轻轻洗去粘附的氯霉素;最后将植物根系浸泡于50 mL 0.5 mmol/L的CaCl2收集液中收集根系分泌物6 h.在根系分泌物收集时, 为避免根系分泌活动受到外界光照条件影响以及分泌物分解, 根系分泌物管外包裹黑色锡箔纸进行避光收集, 而植物地上部分如茎和叶均处于光照环境确保植物维持正常的光合作用.收集完成后, 将分泌液经0.45 μm过滤后, 置于真空冷冻干燥机(Biosafer-10B, 赛飞, 中国)冻干处理, 放置冷冻冰箱保存以供分析.收集到的根系分泌LMWOAs通过HPLC(Waters, Milford, USA)进行测定[15].
HPLC分析条件:色谱分离柱为反相dC18阴离子交换柱(Agilent Zorbax-Aq 4.6×250 mm, 5-Micron, 德国), 进样量10 μL, 柱温30℃, 流动相为35 %超纯水、2 %甲醇、63 % NaH2PO4, 流速1 mL/min.本实验中采样的9种有机酸标准品(植酸、草酸、苹果酸、柠檬酸、甲酸、乙酸、丙酸、丁二酸、乳酸)药品均为色谱纯或优级纯.通过比对、加标的方法确定水生植物根系分泌物中有机酸的种类, 之后使用标准品制作校准曲线确定峰面积和浓度之间的关系.
1.4 统计分析实验结果表示为平均值±标准偏差(Mean ± SD).采用SPSS 17.0软件中One-way ANOVA(Tukey检验)将不同处理组间的数据进行显著性差异分析, 并用Origin 9.0软件进行相关图表绘制.
2 结果与讨论 2.1 不同水生植物根系分泌LMWOAs组成特征由表 1所示, 6种水生植物分泌的LMWOAs主要包括草酸、甲酸、乳酸、苹果酸、柠檬酸、丁二酸、酒石酸7种有机酸, LMWOAs组成和含量具有明显物种差异性.草酸、甲酸、乳酸是6种水生植物分泌的LMWOAs中3种最常见的有机酸; 此外, 在马来眼子菜根系分泌物中还检测到少量酒石酸, 菱角根系分泌物中检测到大量的苹果酸和丁二酸.就分泌量而言, 各水生植物根系分泌的不同种类LMWOAs之间含量具有明显的差异(P < 0.01), 其中甲酸是6种水生植物的根系普遍分泌且分泌量最高的LMWOAs, 平均占总有机酸含量的67.59 %.其次是乳酸和草酸, 平均占总有机酸含量的11.68 %和9.31 %.
| 表 1 六种水生植物根系分泌LMWOAs组成特征 Tab. 1 Compositions and amounts of LMWOAs secreted from six macrophyte species |
6种受试水生植物根系分泌LMWOAs的种类和含量具有明显差异性, 主要是与植物类别及其基因型密切相关.例如, 先前研究证实水稻根系主要分泌酒石酸和草酸, 而小麦根系主要分泌草酸、丙酸和乙酸[16];铝、铅超积累植物钝叶酸模根系主要分泌柠檬酸以促稳定络合物形成, 进而降低铝、铅离子活性[17].羊茅属植物的根系分泌的LMWOAs则主要为草酸、乙酸和乳酸, 三者分泌量占有机酸含量的95 %以上[18].同目前研究较多的水稻、小麦、蚕豆等陆生植物比, 6种水生植物根系分泌的LMWOAs总量和各有机酸含量普遍较低, 进而能检测的LMWOAs种类也相对较少.这可能与受试植物根系欠发达导致的分泌能力较弱有关.
2.2 温度对水生植物根系LMWOAs分泌特征影响由图 2可看出, 温度变化显著影响6种水生植物分泌的LMWOAs含量而对其种类并没有显著影响. 25℃处理马来眼子菜、芦苇和菱角分泌的LMWOAs总量最高;苦草和菖蒲在15℃低温下根系分泌的LMWOAs总量最高且温度升高会明显抑制LMWOAs分泌;而莕菜在30℃时分泌的LMWOAs总量得到明显增加(P < 0.05).

|
图 2 六种水生植物在不同温度下LMWOAs分泌特征(不同小写字母表示处理组间差异显著(P < 0.05)) Fig.2 The characteristics of LMWOAs secreted from six macrophyte roots under different temperatures (Different lowercase letters indicate significant differences among different treatments(P < 0.05)) |
具体而言, 温度变化对苦草分泌的甲酸含量造成显著影响而对草酸分泌影响并不显著(P > 0.05);15℃条件下苦草分泌的甲酸含量最高(48.37± 0.30 mg/L), 表明较低温度可促进苦草甲酸分泌, 这与先前研究发现番茄根系在较低温度时也会分泌较多甲酸结果类似[7].温度变化对马来眼子菜根系LMWOAs分泌草酸量影响不大(P > 0.05), 而马来眼子菜在25℃时分泌较多的甲酸(24.34 ± 0.42 mg/L)、乳酸(4.83 ± 0.43 mg/L)和酒石酸(9.73 ± 0.30 mg/L).菖蒲根系分泌甲酸、草酸和乳酸含量较高, 30℃时分泌量下降了54.97 %、57.35 %和98.03 %.菖蒲在30℃持续经过5天培养后, 叶片出现萎焉、卷曲及叶色变褐, 表明高温胁迫对菖蒲生长发育造成不利影响, 进而影响根系分泌功能.温度对芦苇分泌甲酸含量影响比较明显, 25℃时甲酸分泌量最高(53.34 ± 0.60 mg/L), 分别比15℃和30℃高9 %和57 %, 而对草酸和乳酸分泌影响并不显著(P > 0.05).对浮叶植物如莕菜而言, 30℃时根系分泌草酸和甲酸的含量明显较高, 分别为7.23 ± 0.50和31.59 ± 0.80 mg/L, 乳酸含量最低,为4.45 ± 0.90 mg/L;而菱角根系主要LMWOAs如草酸、甲酸、乳酸、苹果酸、丁二酸在25℃分泌量明显高于15℃和30℃, 分泌量分别为11.04±1.00、64.86±0.30、3.35± 0.30、40.13 ± 0.5和79.56 ± 0.7 mg/L.
温度是影响水生植物生长繁殖和新陈代谢的重要环境因素之一.外界环境温度变化可影响植物叶片光合作用、以及根系生长等活动, 进而影响根系分泌LMWOAs.多数植物在适宜生长的温度范围内, 根系分泌LMWOAs会随着温度升高而增加, 而超出适宜温度范围后, 如高温或低温会明显抑制LMWOAs分泌[19].本研究发现水生植物根系分泌LMWOAs的最佳温度总体上与野外观察到的适宜生长温度一致.例如, 根据前期太湖现场调查结果, 马来眼子菜生长旺盛期为5、6月份, 平均温度约25℃;苦草和菖蒲生长旺盛期在4月份, 温度为15~20℃; 莕菜生长旺盛期为7、8月份, 平均温度约为30℃.潘琦等[20]研究了温度对马来眼子菜生长和酶活性影响, 结果证实25℃是马来眼子菜生物量净积累最佳温度, 而15℃和30℃处理则导致马来眼子菜应激活动强烈, 植物生长明显受到温度胁迫.陈开宁等[21]和梁雪等[22]研究证实苦草和菖蒲等水生植物适合生长在较低温水域(10~20℃), 根系活力较高, 而过高温度(30℃)会对苦草和菖蒲生理活动以及污染物去除能力产生明显抑制, 因此对高温胁迫耐受性较差.
2.3 缺磷胁迫对水生植物根系LMWOAs分泌特征影响由图 3可知, 缺磷胁迫会显著影响水生植物根系LMWOAs分泌量和种类.与磷源充足的对照组相比, 缺磷胁迫可促进苦草、菖蒲和莕菜3种水生植物根系LMWOAs分泌量显著增加(P < 0.01);而马来眼子菜、芦苇和菱角根系LMWOAs分泌量却显著降低(P < 0.01).另外, 缺磷处理的菖蒲和菱角根系分泌的苹果酸量、苦草和莕菜根系分泌的甲酸量均明显高于对照组(P < 0.01).就LMWOAs组成变化特征而言, 对照组和缺磷处理组LMWOAs种类基本一致, 但对照组中苦草、菖蒲、莕菜和菱角根系LMWOAs中并未检出乙酸分泌, 而缺磷胁迫可刺激大量乙酸分泌.此外, 缺磷胁迫显著抑制马来眼子菜、芦苇、莕菜根系乳酸,马来眼子菜根系酒石酸和菱角根系丁二酸的分泌, 导致这些有机酸均未被检出.
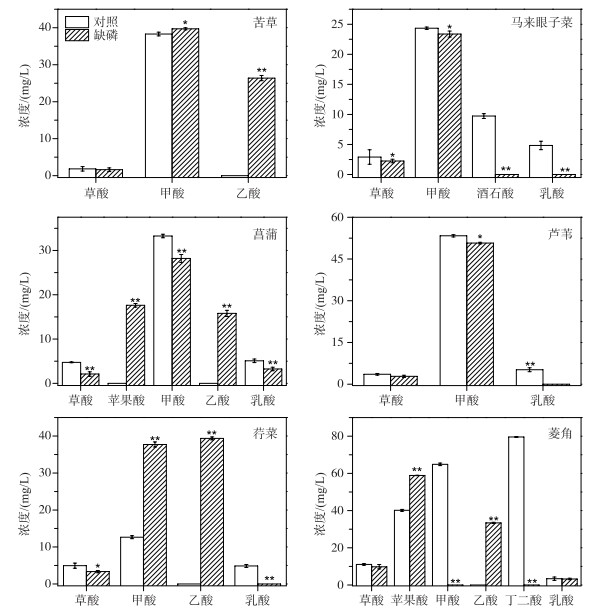
|
图 3 六种水生植物在缺磷胁迫下LMWOAs分泌特征 (*和* *分别表示不同处理间差异显著(P < 0.05)和极显著(P < 0.01)) Fig.3 The characteristics of LMWOAs secreted from six macrophyte roots under phosphorus deficiency (* and * * indicate the significant(P < 0.05) and highly significant(P < 0.01) differences between the control and treatment) |
具体而言, 缺磷胁迫下苦草根系分泌的LMWOAs主要有草酸、甲酸和乙酸;其中, 分泌甲酸浓度最高, 乙酸次之, 草酸浓度最低, 分别为39.71 ± 0.3、26.38 ± 0.7和1.62 ± 0.5 mg/L.缺磷胁迫马来眼子菜根系分泌的草酸与甲酸浓度变化不明显, 但酒石酸和乳酸的分泌均被完全抑制.缺磷胁迫下菖蒲根系分泌大量的苹果酸(17.61±0.4 mg/L)和乙酸(15.78±0.7 mg/L), 而草酸、甲酸和乳酸分泌量分别下降55.6 %、15.3 %和36.4 %.缺磷胁迫会抑制芦苇根系分泌LMWOAs, 其中乳酸分泌被抑制最为显著.缺磷胁迫下莕菜根系分泌甲酸(37.71 ± 0.70 mg/L)、乙酸(39.36 ± 0.40 mg/L)量最高且与对照组相比明显增加;而草酸和乳酸则明显被抑制, 其中草酸分泌量减少32.40 %, 乳酸未检出.缺磷胁迫下菱角根系分泌苹果酸(35.20 ± 0.56 mg/L)和乙酸(33.38 ± 0.30 mg/L)浓度与对照组相比增加显著(P < 0.05);而草酸(9.78 ± 0.4 mg/L)、甲酸(未检出)、丁二酸(未检出)和乳酸(3.22 ± 0.25 mg/L)分泌量明显被抑制(P < 0.05).
不同基因型植物普遍存在耐缺磷胁迫能力差异, 一般认为当缺磷或低磷胁迫时, 磷高效植物可刺激根系分泌大量有机酸以提高植物对土壤/沉积物中难溶解性磷的再活化和吸收, 而有机酸总量分泌较少的植物耐低磷或缺磷胁迫能力也较弱[23-24].众多研究已证实, 缺磷胁迫可刺激羽扇豆、水稻、萝卜、油菜等植物根系分泌大量苹果酸、柠檬酸、草酸和乙酸等LMWOAs, 进而能够促进铁/铝/钙结合态磷的释放, 增加根际土壤中有效磷的含量从而促进植物吸收利用难溶性磷酸盐[1, 5, 25].本实验结果证实苦草、菖蒲和菱角在缺磷胁迫下能够刺激根系苹果酸、乙酸等有机酸含量及LMWOAs分泌总量明显增加, 说明在缺磷胁迫下3种水生植物均具有增加有机酸分泌来适应缺磷胁迫的机制.从侧面可说明苦草、菖蒲和菱角等水生植物应对缺磷环境的适应能力较强, 这对未来低磷或缺磷水域的生态重建和恢复工程中植物选育提供重要依据.
2.4 高铵态氮胁迫对水生植物根系LMWOAs分泌特征的影响由图 4可知, 高铵态氮胁迫会显著影响水生植物分泌LMWOAs的含量和种类.在高铵态氮胁迫下, 受试水生植物除苦草外根系分泌的LMWOAs总量和主要有机酸含量相比对照组明显降低(P < 0.01).具体而言, 高铵态氮胁迫导致马来眼子菜、菖蒲、芦苇、莕菜和菱角根系普遍分泌的草酸的量比常氮组分别降低40.55 %、45.59 %、36.52 %、17.98 %、39.49 %;甲酸的量比常氮组分别降低100 %、34.79 %、41.39 %、72.94 %、43.29 %.少数特异性分泌的LMWOAs如马来眼子菜分泌的酒石酸、菱角分泌的苹果酸在高氮胁迫下均未检测出, 菱角分泌的丁二酸减少84.50 %, 需要指出的是, 苦草在高铵态氮胁迫后不仅促进根系分泌甲酸和草酸量分别明显高于对照组40.74 %和21.08 % (P < 0.01), 而且刺激根系分泌出14.79 ± 0.22 mg/L乙酸和11.93±0.16 mg/L酒石酸2种新的有机酸.

|
图 4 六种水生植物在高铵态氮胁迫下LMWOAs分泌特征 (*和* *分别表示不同处理间差异显著(P < 0.05)和极显著(P < 0.01)) Fig.4 The characteristics of LMWOAs secreted from six macrophyte roots under high level of NH4+-N (* and * * indicate the significant(P < 0.05) and highly significant(P < 0.01) differences between the control and treatment) |
铵态氮是我国水体中关键污染因子, 同是也是水生植物优先直接利用的氮源, 但对大多数植物而言, 植物在吸收高浓度铵态氮后会对自身产生毒害效应(即氨害)[26].高浓度的铵态氮促进水生植物对氮素过量吸收和积累, 导致体内氮代谢过程改变, 进而影响植物细胞正常生理生化活动和个体生长.本研究发现高铵态氮胁迫导致不同水生植物根系分泌LMWOAs特征差异性显著, 说明植物对铵态氮最大耐污能力不同.例如, 高铵态氮胁迫下马来眼子菜、菖蒲、芦苇、莕菜和菱角等水生植物根系分泌有机酸受到抑制, 可能是高铵态氮对根冠具有一定的破坏作用, 导致根系活性降低而不利于根系功能的发挥[22].黄丹萍等[27]研究证实高铵态氮可导致菖蒲根系数量减少, 长度缩短, 进而导致根系分泌有机酸和氧的总量减少.然而, 相同水平高铵态氮处理下, 苦草根系分泌LMWOAs总量和种类却明显增加, 这可能与苦草较强的耐氨氮能力有关[28].周金波等[28]指出适宜的铵态氮会促进植物根内物质合成从而增加根系分泌量, 有利于水生植物适应环境营养盐变化.此外, 在实验中高铵态氮胁迫并未阻碍苦草植株及根系生长特性发生明显变化.该结果说明, 不同水生植物对高铵态氮胁迫的响应特征不尽相同, 较高铵态氮胁迫对水生植物根分泌能力造成不同程度影响, 因此在使用水生植物修复水体时需要考虑实际环境铵态氮浓度水平及其潜在影响.
综上所述, 植物根系分泌的LMWOAs释放和组分变化特征主要取决于自身物种特异性及其生理状态的个体差异性.本研究中受试的6种沉水植物、挺水和浮叶植物基因差异较大导致其分泌的LMWOAs存在显著的种间差异.而过高或过低温度水平、缺磷以及高铵态氮营养条件等外界环境胁迫对多数水生植物而言是一种逆境胁迫, 会显著影响植物正常的生理活动, 进而可能会导致水生植物退化.水生植物通过调节根系LMWOAs分泌活动可增强其对环境适应能力及生理可塑性, 是植物最重要的逆境胁迫生理反应之一.然而水生植物根系LMWOAs分泌规律复杂多变, 且机理尚不清楚, 关于这方面的研究还需要进一步深入.
3 结论1) 不同水生植物根系LMWOAs分泌种类和含量具有显著差异.草酸、甲酸和乳酸是水生植物根系分泌物中最常见的3种LMWOAs, 平均占总LMWOAs分泌量的67.59 %、11.68 %和9.31 %; 此外, 部分受试水生植物中还检测到较高含量的酒石酸、柠檬酸苹果酸和丁二酸的存在.
2) 温度变化不会对水生植物根系分泌LMWOAs的种类造成影响, 但可显著影响LMWOAs分泌量.苦草和菖蒲根系LMWOAs分泌量随温度升高而降低;而莕菜分泌LMWOAs量则随温度升高而增加;25℃处理下马来眼子菜、芦苇和菱角根系分泌LMWOAs量最高, 低温和高温均会抑制其分泌.
3) 缺磷胁迫可显著影响水生植物根系分泌LMWOAs量和种类.缺磷胁迫可显著促进苦草、菖蒲和菱角根系LMWOAs分泌量和种类, 尤其是乙酸、苹果酸增加显著;而马来眼子菜、芦苇和菱角根系LMWOAs分泌量则明显被抑制, 部分植物根系分泌的乳酸、甲酸和丁二酸完全被抑制.
4) 高铵态氮胁迫可显著影响水生植物根系分泌LMWOAs的种类和含量.其中高铵态氮胁迫下促进苦草根系分泌LMWOAs量和种类明显增加; 而其余受试水生植物根系分泌LMWOAs量和种类明显被抑制, 尤其是乳酸、苹果酸和酒石酸等有机酸含量完全被抑制.
| [1] |
Polak F, Urik M, Matus P. Low molecular weight organic acids in soil environment. Chemicke Listy, 2019, 113(5): 307-314. |
| [2] |
Zou XH, Wei D, Wu PF et al. Strategies of organic acid production and exudation in response to low-phosphorus stress in chinese fir genotypes differing in phosphorus-use efficiencies. Trees-Structure and Function, 2018, 32(3): 897-912. DOI:10.1007/s00468-018-1683-2 |
| [3] |
Shi SJ, Richardson AE, O'Callaghan M et al. Effects of selected root exudate components on soil bacterial communities. FEMS Microbiology Ecology, 2011, 77(3): 600-610. DOI:10.1111/j.1574-6941.2011.01150.x |
| [4] |
Taghipour M, Jalali M. Influence of organic acids on kinetic release of chromium in soil contaminated with leather factory waste in the presence of some adsorbents. Chemosphere, 2016, 155: 395-404. DOI:10.1016/j.chemosphere.2016.04.063 |
| [5] |
Gong SG, Wang XX, Zhang TL et al. Release of inorganic phosphorus from soil induced by low molecular weight organic acids. Acta Pedologica Sinica, 2010, 47(4): 692-697. [龚松贵, 王兴祥, 张桃林等. 低分子量有机酸对红壤无机磷活化的作用. 土壤学报, 2010, 47(4): 692-697.] |
| [6] |
Stevens GG, Perez-Fernandez MA, Morcillo RGL et al. Roots and nodules response differently to P starvation in the mediterranean-type legume Virgilia divaricata. Frontiers in Plant Science, 2019, 10: 1-14. DOI:10.3389/fpls.2019.00001 |
| [7] |
Lu HL, Yan ZL. Exudation of low-molecular-weight-organic acids by Kandelia candel (L) Druce roots and implication on heavy metal bioavailability in mangrove sediments. Acta Ecologica Sinica, 2007, 10: 4173-4181. [卢豪良, 严重玲. 秋茄(Kandelia candel L)根系分泌低分子量有机酸及其对重金属生物有效性的影响. 生态学报, 2007, 10: 4173-4181. DOI:10.3321/j.issn:1000-0933.2007.10.026] |
| [8] |
Sivaram AK, Logeshwaran P, Lockington R et al. Low molecular weight organic acids enhance the high molecular weight polycyclic aromatic hydrocarbons degradation by bacteria. Chemosphere, 2019, 202: 132-140. |
| [9] |
Vengavasi K, Pandey R. Root exudation potential in contrasting soybean genotypes in response to low soil phosphorus availability is determined by photo-biochemical processes. Plant Physiology and Biochemistry, 2018, 124: 1-9. DOI:10.1016/j.plaphy.2018.01.002 |
| [10] |
Li HS. Effect of differences between day and night temperature on low molecular weight organic acid secretion of tomato roots and nutrition uptake[Dissertation]. Nanjing: Nanjing University of Information Science & Technology, 2017. [李煜姗.昼夜温差对番茄根系分泌有机酸及养分吸收的影响[学位论文].南京: 南京信息工程大学, 2017. ]
|
| [11] |
Zhang FS, Cao YP. Rhizosphere dynamics and plant nutrition. Acta Pedologica Sinica, 1992, 3: 239-250. [张福锁, 曹一平. 根际动态过程与植物营养. 土壤学报, 1992, 3: 239-250. DOI:10.3321/j.issn:0564-3929.1992.03.012] |
| [12] |
Xu GW, Lu DK, Wang HZ et al. Coupling effect of alternate wetting and drying irrigation and nitrogen rate on organic acid in rice root secretion at heading stage. Chinese Journal of Eco-Agriculture, 2018, 26(4): 516-525. [徐国伟, 陆大克, 王贺正等. 施氮和干湿灌溉对水稻抽穗期根系分泌有机酸的影响. 中国生态农业学报, 2018, 26(4): 516-525.] |
| [13] |
Zhan FD, Qin L, Guo XH et al. Cadmium and lead accumulation and low-molecular-weight organic acids secreted by roots in an intercropping of a cadmium accumulator Sonchus asper L. with Vicia faba L. RSC Advances, 2016, 6: 33240-33248.
|
| [14] |
Yu H, Wang YJ, Song R et al. Bioaccumulation of Cd in different varieties of tobacco and their rhizosphere organic acid secretion characteristics. Journal of Agro-Environment Science, 2018, 37(9): 1827-1832. [余浩, 王幽静, 宋睿等. 不同品种烟草对Cd的富集及根际有机酸的分泌特征. 农业环境科学学报, 2018, 37(9): 1827-1832.] |
| [15] |
Liu X. Arsenic resistant bacteria and root organic acid promoted plant growth and arsenic uptake in As-hyperaccumulator Pteris vittata[Dissertation]. Nanjing: Nanjing University, 2017. [刘雪.抗砷细菌及根系有机酸对砷超富集植物蜈蚣草促生及吸砷机理研究[学位论文].南京: 南京大学, 2017. ]
|
| [16] |
Liu JG, Liang JS, Li KQ et al. Correlations between cadmium and mineral nutrients in absorption and accumulation in various genotypes of rice under cadmium stress. Chemosphere, 2003, 52(9): 1467-1473. DOI:10.1016/S0045-6535(03)00484-3 |
| [17] |
Vondráková S, Száková J, Drábek O et al. Aluminium uptake and translocation in Al hyperaccumulator Rumex obtusifolius is affected by low-molecular-weight organic acids content and soil pH. PLoS ONE, 2015, 10(4): e0123351. DOI:10.1371/journal.pone.0123351 |
| [18] |
Pan SW, Yuan X, Liu C et al. Effects of benzo. Chinese Journal of Plant Ecology, 2016, 40(6): 604-614. [潘声旺, 袁馨, 刘灿等. 苯并. 植物生态学报, 2016, 40(6): 604-614.] |
| [19] |
Wang RH, Zhou BL, Zhang FL et al. Root secretion of eggplant under various temperatures, light intensity and collection time. Plant Physiology Communications, 2005, 2: 175-177. [王茹华, 周宝利, 张凤丽等. 不同温度和光照度下以及收集时间内茄子根系分泌物量. 植物生理学通讯, 2005, 2: 175-177.] |
| [20] |
Pan Q, Song XP, Zou GY et al. Effect of temperature on the activities of antioxidative enzymes of submerged macrophytes. Ecology and Environmental Sciences, 2009, 18(5): 1881-1886. [潘琦, 宋祥甫, 邹国燕等. 不同温度对沉水植物保护酶活性的影响. 生态环境学报, 2009, 18(5): 1881-1886. DOI:10.3969/j.issn.1674-5906.2009.05.053] |
| [21] |
Chen KN, Lan CJ, Shi LX et al. Reproductive ecology of Vallisneria natans. Journal of Plant Ecology, 2006, 3: 487-495. [陈开宁, 兰策介, 史龙新等. 苦草繁殖生态学研究. 植物生态学报, 2006, 3: 487-495.] |
| [22] |
Liang X, He F, Xu H et al. Preliminary study on cold resistance of three kinds of wetland plants. Journal of Agro-Environment Science, 2012, 31(12): 2466-2472. [梁雪, 贺锋, 徐洪等. 三种湿地植物抗寒性的初步研究. 农业环境科学学报, 2012, 31(12): 2466-2472.] |
| [23] |
Hong CQ, Nie YL. Effect of root exudates on plant nutrition. Ecology and Environment, 2003, 4: 508-511. [洪常青, 聂艳丽. 根系分泌物及其在植物营养中的作用. 生态环境, 2003, 4: 508-511. DOI:10.3969/j.issn.1674-5906.2003.04.033] |
| [24] |
Luo Y, Fan WG. Organic acid content, microbial quantity and enzyme activity inrhizosphere soil of four citrus root stocks under different phosphorus levels. Scientia Agricultura Sinica, 2014, 47(5): 955-967. [罗燕, 樊卫国. 不同施磷水平下4种柑橘砧木的根际土壤有机酸、微生物及酶活性. 中国农业科学, 2014, 47(5): 955-967. DOI:10.3864/j.issn.0578-1752.2014.05.012] |
| [25] |
Liu H, L ou, Y G, Zeng GM et al. Mitigation mechanism of Cd-contaminated soils by different levels of exogenous low-molecular-weight organic acids and Phytolacca americana. RSC Advances, 2015, 56(5): 45502-45509. |
| [26] |
Xu S, Li X, Zhong P et al. The uptake of nitrate and ammonium by the root of Vallisneria natans. Ecological Science, 2012, 31(3): 312-317. [徐昇, 李欣, 钟萍等. 苦草根系对硝氮和氨氮的吸收. 生态科学, 2012, 31(3): 312-317. DOI:10.3969/j.issn.1008-8873.2012.03.015] |
| [27] |
Huang DP, He F, Xiao L et al. Response between aerenchyma and radial oxygen loss of Acorus calamus Linn under high nitrogen and phosphorus stress. J Lake Sci, 2012, 24(1): 83-88. [黄丹萍, 贺锋, 肖蕾等. 高氮磷胁迫下菖蒲(Acorus calamus Linn.)通气组织和根系释氧的响应. 湖泊科学, 2012, 24(1): 83-88. DOI:10.18307/2012.0111] |
| [28] |
Zhou JB, Jin SZ, Bao WH et al. Comparison of effects of ammonia-nitrogen concentrations on growth of four kinds of submerged macrophytes. Journal of Agricultural Resources and Environment, 2018, 35(1): 74-81. [周金波, 金树权, 包薇红等. 不同浓度氨氮对4种沉水植物的生长影响比较研究. 农业资源与环境学报, 2018, 35(1): 74-81.] |
 2020, Vol. 32
2020, Vol. 32 

