(2: 中国科学院南京地理与湖泊研究所湖泊科学与环境国家重点实验室, 南京 210008)
(2: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P. R. China)
沉积物是河流的重要组成部分, 是各种人为污染物如重金属、营养物和有机物等[1]的汇.沉积物中污染物的降解消耗大量溶解氧导致厌氧微生物大量繁殖, 厌氧微生物分解有机物, 产生大量的恶臭气体, 并形成一些黑色物质, 最终导致生物多样性锐减和生态功能的退化[2].
淡水沉积物中的细菌群落是有机物和营养物质的生物地球化学循环、污染物的生物降解和转化以及生态系统健康维持的关键参与者之一[3-4].水生态系统中营养盐、环境和污染状况的任何变化都将直接影响细菌群落, 进而影响营养盐循环和其他生物群落, 因此, 细菌群落可作为环境状况的评价指标[5].研究沉积物中细菌多样性和群落结构与其生境的变化关系, 对于开展黑臭河道的生态治理具有重要意义.
添加硝酸钙是沉积物处理的有效手段, 硝酸盐作为电子受体可被大量与有机物氧化相关的微生物还原, 进而促进有机污染物的生物降解[6].与硝酸盐相比, 添加生物促生剂可为微生物提供多种营养物质, 有效促进土著微生物的增殖和活性, 同时抑制有害微生物的代谢和污染物的厌氧分解, 进而刺激和加速自然生化反应[7].种植沉水植物作为控制内源负荷的有效手段, 可提升沉积物的氧化还原电位及其对磷的滞留能力[8], 减少沉积物中磷、铵和硝酸盐向上覆水释放[9].然而, 这些研究通常侧重于沉积物及水体理化性质的变化, 关于沉积物中的污染物与细菌群落之间的相互作用及其在水生态系统功能和服务中的作用研究相对较少[10], 细菌群落对污染物的响应和恢复力方面的研究也较为缺乏[11].
本文应用人工模拟系统, 旨在探究黑臭河道沉积物经添加硝酸钙、生物促生剂以及种植沉水植物处理后, 沉积物中细菌群落结构的变化, 明确不同细菌群落在黑臭河道处理中的作用, 确定导致底泥细菌群落结构产生差异的主要物种, 为城市黑臭河道细菌群落的改善和综合治理提供理论依据.
1 材料与方法 1.1 材料采集苏州市东山镇上的黑臭河道表层(0~20 cm)富含有机质且呈黑臭状态的底泥, 用于后续实验; 实验用水来源于南京地理湖泊研究所东太湖实验站附近的池塘, 呈黑臭状态.生物促生剂由河南华宇环保科技有限公司提供, 富含营养物(氮、碳、磷等)、酶、有机酸、细胞分裂素、维生素和微量元素等物质.
1.2 实验方法本实验共设置4个实验组, 分别为空白对照组(CK组)和3个处理组, 即沉水植物组(MC组)、硝酸钙组(CN组)、生物促生剂组(BE组), 每组设置3个平行组.实验装置为30 cm×100 cm(管内径×高度)的柱状PVC管, 第0天时, 混合所有底泥初始样并将其定义为原泥(CS组).将采集的泥样做均一化处理后, 铺设30 cm厚度的原泥于实验装置中, 注入60 cm上覆水.静置2 d后, 种植1株苦草(Vallisneria natans) (株高:24.0±0.5 cm, 鲜重:2.12±0.10 g/株)于MC组, 一周后开始实验.在CN组沉积物表层往上15 cm处一次性注射45.3 g N/m2的硝酸钙; 在相同位置将2.5 mL/(m3 ·d)的生物促生剂分散注射于BE组; CK组不做任何处理.实验装置置于池塘中不密封, 定期补充黑臭水以保持总体积.实验于2016年8-9月间进行, 鉴于生物促生剂、硝酸钙投加以及沉水植物种植对河流和沉积物的处理的现有相关研究持续时间为10~32 d[7, 12-15], 本实验选取实验周期为28 d, 并于第0天和28天分别采集水样和表层5 cm厚的沉积物样品用于理化性质和细菌指标测试.
实验开始时(第0天), 各实验组主要水质指标为:pH:8.60±0.11, 氧化还原电位(ORP):184±11.75 mV, 溶解氧(DO):6.49±0.93 mg/L, 总氮(TN): 2.25±0.33 mg/L, 总磷(TP):0.21±0.07 mg/L; 底泥中各指标为:pH:6.92±0.03, ORP:18.24±4.08 mV, TN:3.97±0.60 mg/g, TP:3.00±0.83 mg/g, 总有机碳(TOC):36.46±6.43 mg/g.
1.3 样品相关测定方法 1.3.1 沉积物理化指标测定沉积物样品pH、ORP采用FJA-6型氧化还原电位去极化全自动测定仪测定; TN、TP含量采用元素分析仪(EA3000, Italy, Euro Vector)测定, TOC含量通过电感耦合等离子体发射光谱仪(American, Leeman, prodigy)测定.
1.3.2 细菌多样性指数测定沉积物样品经预处理后, 由上海美吉生物医药科技有限公司(简称美吉)的Illumina Miseq平台测序, 利用引物338F/806R扩增细菌16S rRNA基因V3~V4区, 用2%琼脂糖凝胶电泳检测PCR产物.
1.4 生物信息学及统计分析数据分析使用美吉公司提供的I-Sanger平台进行.采用Mothur软件对97%相似水平的OTU进行Alpha多样性分析.采用R语言的vegan包进行样本的热图分析(Heapmap)、非度量多维尺度(NMDS)分析和冗余分析(RDA).采用R语言的stats包和Python的scipy包进行One-way ANOVA分析.
2 结果 2.1 水体及沉积物理化性质分析经过28 d处理后, CN组上覆水中TN含量显著高于CK组(P < 0.05, 表 1), 各处理组DO、ORP均高于CK组, 其中, BE组DO含量显著高于CK组(P < 0.05).沉积物中3组处理组ORP均显著高于CK组(P < 0.05); MC组和CN组TN含量显著低于CK组和BE组(P < 0.05); MC组TP含量比CK组降低了5.80%, 而CN组和BE组TP含量较CK组分别升高了1.90%和4.61%; TOC含量从大到小依次为BE组>CK组>CN组>MC组.此外, 与实验开始时相比, 实验结束时苦草株高(35.83±2.36 cm)、鲜重(4.10±1.13 g/株)和株数(2.67±0.58株)均显著增加(P < 0.05).
| 表 1 实验结束时不同实验组上覆水和沉积物样品的理化性质* Tab. 1 Physicochemical properties of water and sediment samples after 28 days of treatment |
利用Illumina MiSeq测序技术研究不同实验组底泥细菌的多样性.共检测到559332条高质量序列, 平均长度为440 bp, 覆盖度介于95.96% ~96.34%之间; 不同实验组底泥共鉴定出OTU数量6057个, 结果涵盖54门, 128纲, 259目, 445科, 781属.在OTU分析的基础上, 通过计算Shannon-Wiener指数、Simpson指数、PD (Phylogenetic diversity)指数、Sobs指数、Chao 1和ACE丰富度对各实验组样本的多样性和丰富性进行评价(表 2).结果显示:BE组Sobs指数和Chao 1指数均显著高于CK组和CN组(P < 0.05);且BE组Shannon指数和PD指数显著高于CN组(P < 0.05).
| 表 2 不同实验组表层沉积物细菌多样性指数* Tab. 2 Microbial diversity index of surface sediments in different treatment groups |
5组底泥样品中细菌主要包括:Proteobacteria(39.53%~41.68%)、Chloroflexi(17.72%~24.19 %)、Firmicutes(2.1%~12.5%)、Bacteroidetes(4.65%~7.91%)和Spirochaetae(2.55%~3.39%), 除上述5种优势菌门外, OTU平均相对丰度大于1%的还有Acidobacteria、Latescibacteria、Aminicenantes、Nitrospirae、Chlorobi、Actinobacteria、Parcubacteria、TA06、Candidate_division_OP3.有1.54%~2.55%的序列不能在门一级进行分类, 定义为bacteria-unclassified, 将样本中丰度均值占比均小于1%的物种归为others(图 1).Proteobacteria和Chloroflexi是各实验组中最丰富的门, 在各组中无显著差异(P>0.05);在Proteobacteria中, Deltaproteobacteria(14.19%~22.91%)、Betaproteobacteria(7.68%~16.19%)和Gammaproteobacteria(7.72%~13.25%)是所有实验组中最丰富的纲. BE组中Firmicutes显著低于其他组(P < 0.05);相反, BE组Bacteroidetes和Spirochaetae的相对丰度均显著高于其余各组(P < 0.05).

|
图 1 门分类水平上的细菌群落组成 Fig.1 Community composition of bacteria in the phylum level |
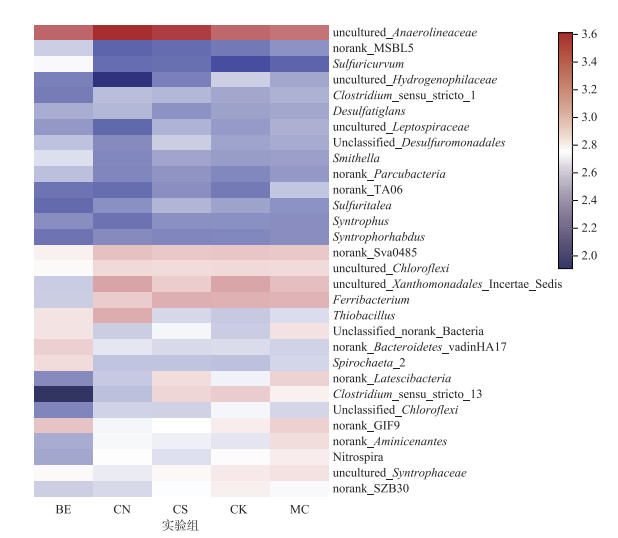
Heatmap图显示了底泥细菌群落前30属的物种组成(图 2).对各实验组最丰富的5属进行组间差异显著性检验分析(one-way ANOVA), 结果表明: uncultured_Anaerolineaceae (P < 0.01)、Ferribacterium (P < 0.01)和uncultured_Xanthomonadales_Incertae_Sedis (P < 0.05)是导致底泥细菌群落变化的主要菌属.
|
图 2 不同实验组中细菌群落前30属的热图分析(右侧颜色梯度(数值)表示各组属水平的平均相对丰度) Fig.2 Heatmap of the top 30 abundant genera in bacterial communities detected from different groups (the color of the spots in the right panel represents the mean relative abundance of the genera in each group) |
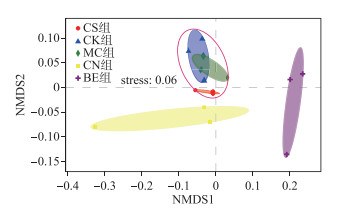
基于Bray-Curtis距离对不同实验组底泥细菌群落组成的OTU分布统计数据进行非度量多维尺度分析(NMDS)和ANOSIM分析, 结果显示:不同生态处理方法显著改变了底泥群落组成(ANOSIM, r=0.4074, P=0.001); CK组和MC组细菌群落结构组成较为类似; 而CN组和BE组与上述2组底泥细菌群落结构组成具有明显差异(图 3).
|
图 3 基于Bray-Curtis距离的NMDS分析 Fig.3 NMDS analysis based on Bray-Curtis distance |
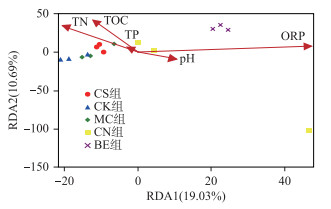
为进一步探究环境变量对底泥细菌群落结构的影响, 对相关参数进行RDA分析.前两个轴分别解释了底泥细菌群落结构变异的19.03%和10.69% (图 4).环境变量包括底泥的pH、ORP、TN、TP、TOC, 其中, ORP是影响底泥细菌群落结构的关键环境因子(P < 0.01).
|
图 4 细菌群落组成和环境变量的冗余分析 Fig.4 Redundancy analysis of bacteria community compositions and environmental variables |
沉积物原位修复技术通常用于控制沉积物中污染物的释放.已有研究表明, 在沉积物中添加硝酸钙可有效提升沉积物的ORP值, 促进沉积物中TOC的降解[6, 13].同时, 硝酸盐钙的加入能固定铁磷和钙磷[13-14, 16], 降低水体中的TP, 增加底泥TP, 并减少底泥磷的释放.另外, 在底泥中注入硝酸钙加速了反硝化作用, 提高了细菌的活性, 使氮以气体形式排出, 进而提高了脱氮效果[6, 13-14, 16].添加生物促生剂也可提升沉积物的ORP值和DO值, 通过细菌活性和多样性持续增加, 促进了其对碳的呼吸以及氮、磷的同化作用, 最终降低底泥TOC含量, 并使得水体中氮、磷元素固定在沉积物中[7, 17].种植沉水植物作为控制内源负荷的有效手段, 可通过根际泌氧提升沉积物的ORP值[8], 并通过生长吸收氮、磷, 进而减少水体和沉积物中的氮、磷[8-9, 18].
本实验中, 经过28 d处理后, 仅BE组上覆水中DO浓度显著高于CK组, CN组TN浓度显著高于CK组, 其他参数改善效果不明显, 这可能是由于处理时间较短所致.但各处理组ORP和DO的平均值均高于CK组, 各处理组TP平均浓度均小于CK组; 除CN组外, MC组和BE组TN平均浓度较CK组相比, 均有不同程度下降, 表现出一定的改善趋势.
沉积物中, 所有处理组的ORP值均显著高于对照组, 且CN组和BE组的ORP值显著高于MC组, MC组和CN组的TN含量显著低于CK组.这些参数表明底泥理化性质得到一定程度的改善. CN组和BE组沉积物TP含量虽然没有显著上升, 但其平均含量均高于对照组, 这两组水体TP平均含量的下降提示了这两个处理组沉积物对水体磷的固定趋势.与实验开始时相比, MC组实验结束时苦草株高、鲜重和株数均显著增加, MC组水体和底泥TN和TP平均含量均有所下降. CN组和MC组沉积物TOC平均含量也有下降, 这与文献报道结果相似[13-14, 19].
3.2 不同生态处理方法改变了底泥细菌多样性基于16S rRNA的Miseq测序表明, 处理组底泥细菌发生了很大的变化.以大于97%相似度OTU作为分类单元计算, BE组Sobs指数和Chao 1指数均显著高于CK组; BE组Shannon指数和PD指数显著高于CN组.这表明黑臭河道底泥细菌对不同生态处理方法的响应不尽相同, 生物促生剂的投加可在一定程度上提升底泥细菌多样性, 这可能是由于生物促生剂中富含多种营养素(如酶、氨基酸、维生素等), 可有效促进细菌的增殖并增加其活性[7].研究发现沉积物注入硝酸钙后, 底泥细菌的多样性随温度升高呈下降趋势; 当沉积物的温度为25或35℃时, 底泥细菌的多样性甚至低于原底泥指标[20].本实验期间, 水温介于23.24~30.26℃之间, 在这一温度条件下, 某些物种的富集可能是导致CN组底泥细菌多样性降低的主要原因.
3.3 不同生态处理方法显著改变了底泥细菌群落组成本研究中各实验组细菌群落结构与以往关于沉积物的研究结果基本一致[4, 21-22]. Proteobacteria和Chloroflexi是各实验组中最丰富的门, 在各组中无显著差异; 本实验中, BE组中Firmicutes显著低于其他组; Firmicutes是粪便污染的重要指标, 它是识别人类粪便的标志之一[23].研究表明, Firmicutes是异养反硝化菌, 常见于废水处理过程的反硝化生物反应器中[24], 其在CN组丰度较高可能是由于添加硝酸钙后反硝化作用增强, 促使其转变为优势菌群.生物促生剂的投加改变了底泥的还原性环境, 从而抑制了反硝化细菌及厌氧氨氧化菌的活性, 这是其在BE组显著低于其他各组的主要原因[12]. Wang等[25]的研究表明城市段河流中Bacteroidetes丰度较高的原因可能与居住区未经处理的排放废水中含有硝酸盐、氨、粪便等污染物有关; BE组中Bacteroidetes丰度较高可能是由于生物促生剂富含多种营养素(如碳、氮、磷等), 可向其提供丰富的营养物质.目前, 关于Spirochaetae菌门的生态生理功能的研究很少, Lee等[26]研究发现Spirochaetae可促进碳水化合物和氨基酸发酵生成乙酸盐、氢气和二氧化碳; BE组中Spirochaetae的相对丰度显著高于其余各组, 这表明底泥投加生物促生剂后可有效促进该菌门的生长和增殖.
细菌属水平的物种组间差异显著性检验分析表明:uncultured_Anaerolineaceae、Ferribacterium和uncultured_Xanthomonadales_Incertae_Sedis是导致底泥细菌群落发生变化的主要菌属. Uncultured_Anaerolineaceae是各样本中最丰富的属, 属于Chloroflexi门, 是典型的异养反硝化细菌, 在反硝化过程中可分解大分子有机物产生甲烷和二氧化碳[27]. Uncultured_Xanthomonadales_Incertae_Sedis属于Gammaproteobacteria菌纲; 其常见于活性污泥中[28].另一个丰富的属Ferribacterium属于Betaproteobacteria菌纲, 是一种铁还原菌; 先前的研究表明, 在厌氧沉积物中, Ferribacterium可将Fe3+还原成Fe2+[29], Fe2+可与河道中有机物分解产生的H2S反应生成FeS, 进而使底泥发黑.因此, 我们推测Ferribacterium丰度降低(图 2), 其代谢产物Fe2+的浓度也会随之降低, 进而有利于消除河道底泥黑臭现象.
基于OTU的NMDS和ANOSIM分析显示:不同生态处理方法显著改变了底泥群落组成, MC组和CK组的细菌群落组成较为相似, 而CN组和BE组与上述2组细菌群落组成具有明显差异.这主要是由于底泥经由硝酸钙和生物促生剂处理后, CN组和BE组ORP值显著高于CK组和MC组所致.
3.4 底泥氧化还原电位的变化是影响细菌群落结构的主要驱动因素RDA分析结果表明, ORP是影响底泥细菌群落组成的最重要因素.有研究表明细菌的生长与ORP的变化直接相关[30].环境中的ORP很大程度上决定了该环境中细菌群落的代谢类型, 因此它们是生物活动的重要参数[31-32].每种类型的微生物适应特定的ORP条件, 如厌氧土壤中微生物和酶活性与ORP呈负相关, 而好氧微生物则需要更高的ORP值[33-34]. Zeng等[35]对富营养化湖泊沉积物中细菌群落空间分布的研究结果也表明, ORP对沉积物中细菌群落组成具有显著影响, 这也与本文的研究结果相一致.
| [1] |
Moreno B, Cañizares R, Macci C et al. Molecular tools to understand the bioremediation effect of plants and earthworms on contaminated marine sediments. Journal of Hazardous Materials, 2015, 300: 398-405. DOI:10.1016/j.jhazmat.2015.07.019 |
| [2] |
Sun Y, Wang S, Niu J. Microbial community evolution of black and stinking rivers during in situ remediation through micro-nano bubble and submerged resin floating bed technology. Bioresource Technology, 2018, 258: 187-194. DOI:10.1016/j.biortech.2018.03.008 |
| [3] |
Ruiz-González C, Niño-García JP, Del Giorgio PA. Terrestrial origin of bacterial communities in complex boreal freshwater networks. Ecology Letters, 2015, 18(11): 1198-1206. DOI:10.1111/ele.12499 |
| [4] |
Cheng W, Zhang J, Wang Z et al. Bacterial communities in sediments of a drinking water reservoir. Annals of Microbiology, 2014, 64(2): 875-878. |
| [5] |
Hale RL, Turnbull L, Earl SR et al. Stormwater infrastructure controls runoff and dissolved material export from arid urban watersheds. Ecosystems, 2015, 18(1): 62-75. DOI:10.1007/s10021-014-9812-2 |
| [6] |
Tang Y, Li M, Zou Y et al. Mechanism of aerobic denitrifiers and calcium nitrate on urban river sediment remediation. International Biodeterioration & Biodegradation, 2018, 126: 119-130. |
| [7] |
Gao H, Xie Y, Hashim S et al. Application of microbial technology used in bioremediation of urban polluted river:A case study of Chengnan river, China. Water, 2018, 10(5): 643. DOI:10.3390/w10050643 |
| [8] |
Jaynes ML, Carpenter SR. Effects of vascular and nonvascular macrophytes on sediment redox and solute dynamics. Ecology, 1986, 67(4): 875-882. |
| [9] |
Chen R, Barko JW. Effects of freshwater macrophytes on sediment chemistry. Journal of Freshwater Ecology, 1988, 4(3): 279-289. DOI:10.1080/02705060.1988.9665177 |
| [10] |
Nogales B, Lanfranconi MP, Piña-Villalonga JM et al. Anthropogenic perturbations in marine microbial communities. FEMS Microbiology Reviews, 2011, 35(2): 275-298. DOI:10.1111/j.1574-6976.2010.00248.x |
| [11] |
Sun MY, Dafforn KA, Johnston EL et al. Core sediment bacteria drive community response to anthropogenic contamination over multiple environmental gradients. Environmental Microbiology, 2013, 15(9): 2517-2531. DOI:10.1111/1462-2920.12133 |
| [12] |
Liu XW, Xie DP, Li KM et al. Influence of application of bio-energizer to sediment microbial community and the content of nitrogen and phosphorus element. China Environmental Science, 2013, 33(S1): 87-92. [刘晓伟, 谢丹平, 李开明等. 投加生物促生剂对底泥微生物群落及氮磷的影响. 中国环境科学, 2013, 33(S1): 87-92.] |
| [13] |
Liu T, Yuan J, Dong W et al. Effects on inorganic nitrogen compounds release of contaminated sediment treatment with in situ calcium nitrate injection. Environmental Science and Pollution Research, 2015, 22(2): 1250-1260. DOI:10.1007/s11356-014-3421-7 |
| [14] |
Liu X, Tao Y, Zhou K et al. Effect of water quality improvement on the remediation of river sediment due to the addition of calcium nitrate. Science of the Total Environment, 2017, 575: 887-894. DOI:10.1016/j.scitotenv.2016.09.149 |
| [15] |
Gao J, Xiong Z, Zhang J et al. Phosphorus removal from water of eutrophic Lake Donghu by five submerged macrophytes. Desalination, 2009, 242(1/2/3): 193-204. |
| [16] |
Lin JW, Zhu ZL, Zhao JF. Effect of calcium nitrate on cycling character of nutrient salt and organic matter between surface water and its sediments. Journal of Agro-environment Science, 2007, 26(1): 58-63. [林建伟, 朱志良, 赵建夫. 硝酸钙对底泥有机物及氮磷迁移循环的影响. 农业环境科学学报, 2007, 26(1): 58-63. DOI:10.3321/j.issn:1672-2043.2007.01.011] |
| [17] |
Lu LJ, Su YJ, Li XP et al. Application of bio-stimulant to the remediation of pollutant sediment. Environmental Science Survey, 2007, 26(6): 49-53. [卢丽君, 孙远军, 李小平等. 用生物促生剂修复受污染底泥的试验研究. 环境科学导刊, 2007, 26(6): 49-53. DOI:10.3969/j.issn.1673-9655.2007.06.015] |
| [18] |
Meagher RB. Phytoremediation of toxic elemental and organic pollutants. Current Opinion in Plant Biology, 2000, 3(2): 153-162. DOI:10.1016/S1369-5266(99)00054-0 |
| [19] |
Huang XL, Guo YM, Wan B et al. Effect of submerged macrophytes restoration on the ecological environment of urban eutrophic lake. Environmental Engineering, 2018, 36(7): 17-21. [黄小龙, 郭艳敏, 万斌等. 沉水植物恢复对城市富营养化湖泊生态环境影响. 环境工程, 2018, 36(7): 17-21.] |
| [20] |
He Z, Long X, Li L et al. Temperature response of sulfide/ferrous oxidation and microbial community in anoxic sediments treated with calcium nitrate addition. Journal of Environmental Management, 2017, 191: 209-218. DOI:10.1016/j.jenvman.2017.01.008 |
| [21] |
Chen Y, Dai Y, Wang Y et al. Distribution of bacterial communities across plateau freshwater lake and upslope soils. Journal of Environmental Sciences, 2016, 43: 61-69. DOI:10.1016/j.jes.2015.08.012 |
| [22] |
Xie Y, Wang J, Wu Y et al. Using in situ bacterial communities to monitor contaminants in river sediments. Environmental Pollution, 2016, 212: 348-357. DOI:10.1016/j.envpol.2016.01.031 |
| [23] |
Zheng G, Yampara-Iquise H, Jones J et al. Development of Faecalibacterium 16S rRNA gene marker for identification of human faeces. Journal of Applied Microbiology, 2009, 106(2): 634-641. DOI:10.1111/j.1365-2672.2008.04037.x |
| [24] |
Knowles R. Denitrification. Microbiological Reviews, 1982, 46(1): 43. DOI:10.1128/MMBR.46.1.43-70.1982 |
| [25] |
Wang L, Zhang J, Li H et al. Shift in the microbial community composition of surface water and sediment along an urban river. Science of the Total Environment, 2018, 627: 600-612. DOI:10.1016/j.scitotenv.2018.01.203 |
| [26] |
Lee SH, Park JH, Kang HJ et al. Distribution and abundance of Spirochaetes in full-scale anaerobic digesters. Bioresource Technology, 2013, 145: 25-32. DOI:10.1016/j.biortech.2013.02.070 |
| [27] |
Jin S, Feng C, Tong S et al. Effect of sawdust dosage and hydraulic retention time (HRT) on nitrate removal in sawdust/pyrite mixotrophic denitrification (SPMD) systems. Environmental Science:Water Research & Technology, 2019, 5(2): 346-357. |
| [28] |
Xu S, Yao J, Ainiwaer M et al. Analysis of bacterial community structure of activated sludge from wastewater treatment plants in winter. BioMed Research International, 2018, 8278970. |
| [29] |
Lovley DR. Dissimilatory Fe (Ⅲ) and Mn (Ⅳ) reduction. Microbiology and Molecular Biology Reviews, 1991, 55(2): 259-287. |
| [30] |
Kimbrough DE, Kouame Y, Moheban P et al. The effect of electrolysis and oxidation-reduction potential on microbial survival, growth, and disinfection. International Journal of Environment and Pollution, 2006, 27(1/2/3): 211-221. DOI:10.1504/IJEP.2006.010464 |
| [31] |
Billen G. Etude de l'écométabolisme du mercure dans un milieu d'eau douce. Hydrobiological Bulletin, 1973, 7(2): 60-68. DOI:10.1007/BF02282199 |
| [32] |
Stumm W. Redox potential as an environmental parameter; conceptual significance and operational limitation//3rd International Conference on Water Pollution Research, Section, 1966, 1: 1-16.
|
| [33] |
Kralova M, Masscheleyn PH, Patrick Jr WH. Redox potential as an indicator of electron availability for microbial activity and nitrogen transformations in aerobic soil. Zentralblatt für Mikrobiologie, 1992, 147(6): 388-399. DOI:10.1016/S0232-4393(11)80348-3 |
| [34] |
Husson O. Redox potential (Eh) and pH as drivers of soil/plant/microorganism systems:A transdisciplinary overview pointing to integrative opportunities for agronomy. Plant and Soil, 2013, 362(1/2): 389-417. |
| [35] |
Zeng J, Yang LY, Liang Y et al. Spatial distribution of bacterial communities in sediment of a eutrophic lake revealed by denaturing gradient gel electrophoresis and multivariate analysis. Canadian Journal of Microbiology, 2008, 54(12): 1053-1063. DOI:10.1139/W08-098 |
 2020, Vol. 32
2020, Vol. 32 

