(2: 中国科学院南京地理与湖泊研究所, 流域地理学重点实验室, 南京 210008)
(2: Key Laboratory of Watershed Geographic Sciences, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P. R. China)
对于不同的湿地类型,诸如湖泊湿地、河口湿地或海岸湿地,水文过程是决定湿地植物区系组成、种群分布格局的关键因子[1].近百年来,气候变化和人类活动干扰,使得湿地生态系统面临不同程度的水位下降、降雨减少等干旱问题[1-3],由此导致湿地植被的演替往往朝着不确定性和复杂性方向发展.就国内外湿地生态研究而言,预测未来水文变化情景下湿地植被的动态与演替,既是一个热点问题,又是一个具有前瞻性的选题.然而,明确湿地植物的水分来源以及水分利用方式是需要解决的首要问题.
从水资源组成而言,降雨、土壤水、地下水、地表水均是植物生长的潜在水源.但植物的主要水源和水分利用方式通常受植被类型、气候条件、季节更替、水分状况等条件影响[4-6],增加了植物水分来源辨析与识别的难度. 18O和D是自然界水体中的两种稳定同位素,研究认为,大多数植物根系从土壤中吸收水分的过程不会发生同位素分馏[6].因此,利用不同水体和植物茎水中稳定同位素组成特征的差异可以分析水分的来源、迁移和混合过程,进而揭示植物的水分利用机制[7-9]. Zhang等在澳大利亚的冲积湿地运用同位素技术研究发现,虽然地下水对土壤水分的补给量很大,但对植物水分利用的贡献率不足20 %,降水和土壤水仍是植物水分利用的主要来源[10].然而,McCole等发现植物水分利用来源存在季节差异,草本植物在夏季优先利用浅层地下水,而冬季则主要利用表层土壤水[11].其他研究发现,浅根系的草本在整个生长期内始终利用浅层土壤水,深根系的灌木在丰水年主要利用浅层土壤水,在枯水年则主要利用深层土壤水和地下水[12-15].总的来说,尽管植物水分利用过程较为复杂,但同位素技术已然成为机理研究的一种重要手段.借助同位素技术有助于提高对水分补给来源的辨识和理解,也可量化不同水源对植被用水的贡献,从而科学、深入的理解湿地水文-土壤-植被的互馈作用机理.
鄱阳湖位于江西省北部,是一个水资源丰富、水循环组分多样、生态系统典型的自然通江湖泊.受流域和长江不同洪水脉冲形式的叠加作用,周期性变化的水位形成了广阔的草洲湿地,植被群落呈现有规律的带状分布[16]. 21世纪以来,受长江上游来水和流域降水减少的双重影响,导致鄱阳湖丰水期水位下降、枯水期延长等水文变化[17-18],直接影响湿地植被的生长和生态系统的稳定性[16, 19].目前关于鄱阳湖湿地植被的研究主要采用遥感、控制实验、数值模拟等方法[19-23],借助遥感影像能够直观发现湿地植被空间分布格局的变化.已有研究显示,水位的降低导致鄱阳湖高位滩地中生、挺水植被群落分布整体呈现向湖区延伸的趋势,部分区域中生植物挤占挺水植物,芦苇(Phragmites australis)群落分布面积出现萎缩[19-20].但遥感方法更侧重景观尺度植被的分布,对过程和机制的解释较为欠缺.也有学者借助控制实验研究水情要素(淹水深度、地下水埋深等)对植物种群生长的影响,发现植物可通过表型可塑性适应不同水情的变化[21-22],但控制实验无法揭示自然条件下植物种对水分变化的适应策略.部分学者利用数值模型模拟鄱阳湖典型湿地土壤-植被-大气系统水循环过程,发现中生和挺水植物在平、枯水年常遭受季节性的干旱胁迫[23],但模型建立所需大量的植物生长、根系吸水、种间竞争参数,目前仍无法实现水分运移与植物生长的双向耦合,结果有较大的不确定性.近年来,有学者分析了鄱阳湖不同水体稳定同位素变化特征,但主要侧重于河水、湖水与地下水作用关系的研究[9, 24-25],缺乏对自然条件下湿地植物水分利用来源及其季节变化特征的全面认识,而且能够量化植物对不同水源利用比例、揭示植物种水分利用策略的研究尚不多见.
茵陈蒿(Artemisia capillaris)是鄱阳湖湿地典型的中生草本植物,主要分布于洲滩湿地的高位滩地及河道两侧堤坝,代表着湿地草洲分布的上缘,与挺水植物芦苇群落、湿生植物灰化薹草(Carex cinerascens)群落等构成条带状的湿地植被格局[16].目前,在湖泊水文情势变化的影响下,湿地系统水分补排过程更为复杂[25-26],不同湿地植被的分布面积和空间格局发生变化[19-20, 27],阐明高位滩地中生植物水分利用方式是揭示植物种间竞争机理的第一步,也是探究变化水文条件下湿地植被生态系统演变的首要问题.鉴于此,本文以鄱阳湖高位滩地典型中生植被群落——茵陈蒿群落为研究对象,通过对降水、湖水、地下水和不同深度土壤水氢氧稳定同位素的测定,研究湿地茵陈蒿植被群落土壤水分的补给来源,揭示优势种茵陈蒿水分利用来源的季节变化规律,以期增加对缺水环境下典型中生植物水分利用策略的认识,为水文与植物生长作用机制研究及生态水文模型的建立提供理论参考和数据支撑.
1 材料与方法 1.1 研究区概况研究区位于鄱阳湖国家级自然保护区,区内设立了中国科学院南京地理与湖泊研究所湿地生态水文观测场,地理坐标为29°14′34″N,116°00′11″E(图 1).该典型湿地属于鄱阳湖分布面积最大、发育最为典型的赣江入湖冲积三角洲洲滩湿地, 整个湿地观测断面的长度近1.2 km,高程差近8 m,地势由高位滩地、低位滩地至湖区逐渐变缓, 受湖水位高度动态的升消变化影响,从远湖区的高地至近湖区洼地,依次发育有中生植被茵陈蒿群落、挺水植被芦苇群落、湿生植被灰化薹草群落和沉水植被(图 2).研究区多年平均降雨量1454 mm,4-6月占年总量的47 %,年蒸发量800~1200 mm,7-9月蒸发量最大,多年平均气温为18.9℃,7-8月气温最高,故形成春季多雨、夏秋干旱的气候特征[16].

|
图 1 研究区位置 Fig.1 Location of study area in Lake Poyang |

|
图 2 研究区湿地断面及生态水观测系统布设 Fig.2 The schematic diagram of the studied delta wetland transect and the eco-hydrological monitoring system |
本研究选择高位滩地生长良好的典型中生植被茵陈蒿群落为研究对象,植被带分布高程17~18.4 m,宽约90 m,土壤主要为砂土和粉砂土[23].历史观测数据发现(图 2),群落地下水埋深范围2.1~8 m,年内几乎不经历淹水.茵陈蒿群落植被覆盖度约70 %,优势种茵陈蒿平均高度56 cm,3月下旬幼苗开始萌发,4-5月为生长初期,6-8月为快速生长期,9-10月为成熟期,主要伴生种为狗牙根(Cynodon dactylon)[23].
1.2 样品采集与测试分析2018年4-10月,每月中旬进行植物、土壤、地下水、湖水样品采集.在茵陈蒿群落中选取地势相对均一、植被长势良好的地方布设3块1 m×1 m的样地,历史植物根系调查显示,93 %的茵陈蒿根系分布于0~80 cm土壤范围[23],因此在每个样地内分别利用带刻度的圆土钻钻取80 cm深的土壤样品.根据茵陈蒿毛细根总长度分布密度在不同土壤深度内的变化,分别采集0~15、15~40、40~60和60~80 cm不同深度的土壤样品.将土样样品分为两组,一组装于8 mL玻璃瓶内用于稳定同位素测定,另一组装于铝盒内用烘干法称量、计算土壤含水量.同时,于各样地内采集茵陈蒿根茎结合处的植物样品,剪成3~4小段装于8 mL玻璃瓶内,共采集土壤同位素样品84个、植物样品21个, 地下水样品通过试验区地下水位观测井抽取收集(图 2),湖水样品在附近大湖面的不同区域采集,每个水样均设3个重复,降雨样品在实验期间主要依托距研究区约11 km的吴城气象站收集.采集到的水样立即装于30 mL塑料瓶内.所有同位素样品采集完毕后立即用Parafilm封口膜密封,置于带冰袋的冷藏箱内迅速运回实验室,植物和土壤样品于-4℃冷冻保存,水样冷藏保存.
土壤和植物样品在清华大学研究生院稳定同位素实验室内先采用低温真空抽提装置提取水分,提取水量在0.2~2 mL内,并将水分装入自动进样瓶中,采用同位素比率质谱仪进行氢氧稳定同位素分析测定(MAT 253,Thermo Fisher Scientific,Inc., USA),18O和D的测试精度分别为±0.5 ‰和±2 ‰.所有样品的测定结果以V-SMOW为标准的千分差进行表示:
| $ {\rm{ \mathsf{ δ} }}R\left( {{‰}} \right) = \left( {{R_{{\rm{sam}}}}/{R_{{\rm{sta}}}} - 1} \right) \times 1000 $ | (1) |
式中, Rsam代表样品中D/H或18O/16O的比值,Rsta为V-SMOW标准物质中D/H或18O/16O的比值.
1.3 数据分析采用数理统计方法分析不同水源的同位素组成特征,并利用直接对比法比较植物水与各潜在水源同位素值,确定不同季节植物的潜在水源和主要的水分利用深度,不同水源对茵陈蒿植物用水的贡献率采用基于同位素质量平衡的多源线性混合模型IsoSource[28]计算.该模型通过设置很小的增量,将所有可能的贡献率组合全部列出,然后与混合水的同位素值进行对比,如果差值小于容差,则认为是可行解.模型计算时增幅设置为1 %,容差设置为0.1 %.考虑到有研究表明,干旱环境下部分植物在吸水过程中氢同位素会发生分馏,而氧同位素不会分馏,采用δ18O计算不同水源对植物的水分贡献率更为准确[29].因此本文仅采用δ18O分析,计算方法如下:
| $ {{{\rm{ \mathsf{ δ} }}^{18}}{{\rm{O}}_{\rm{P}}} = {f_1}{{\rm{ \mathsf{ δ} }}^{18}}{{\rm{O}}_1} + {f_2}{{\rm{ \mathsf{ δ} }}^{18}}{{\rm{O}}_2} + \cdots + {f_n}{{\rm{ \mathsf{ δ} }}^{18}}{{\rm{O}}_n}} $ | (2) |
| $ {{f_1} + {f_2} + \cdots + {f_n} = 1} $ | (3) |
式中, δ18OP为植物水氧同位素,δ18O1、δ18O2、δ18On分别为第1、2和第n种水源中氧同位素值,f1、f2、fn分别为不同水源对植物水的贡献比例.
此外,分别计算各月份不同深度土壤含水量和不同水源氢氧同位素值的平均值和标准差,采用SPSS 12.0中单因素方差分析和LSD多重比较对不同深度土壤含水量数据进行分析,并在0.05水平上检验其显著性差异.
2 结果与分析 2.1 降雨量与土壤含水量变化分析研究区属于湿润季风气候区,雨热不同期. 2018年降雨量为1204 mm,雨季3-6月降雨总量为599 mm,占全年总降雨量的50 %,旱季7-10月降雨量逐渐减少,与多年平均降雨量变化规律基本一致(图 3).茵陈蒿群落根系区0~80 cm土壤平均含水量变化范围为2.9 % ~12.6 %,存在明显的季节变化,4-6月土壤含水量最高,表层0~15 cm和深层60~80 cm土壤含水量变化范围分别为7 % ~15 %和14 % ~16 %,7-10月土壤明显变干,表层和深层土壤含水量分别下降为3 % ~8 %和4 % ~10 %.此外,土壤含水量随土壤深度增加而增大,特别是7、8月,深层土壤含水量极显著高于表层,其他月份差异不显著(图 4).

|
图 3 研究区降雨量和气温季节变化 Fig.3 Seasonal variations of precipitation and air temperature in the study area |

|
图 4 茵陈蒿群落不同深度土壤含水量(均值±标准差)季节变化(不同字母表示存在显著性差异) Fig.4 Seasonal variations of soil water content (mean±SD) at different soil depths for the A. capillaris community (Different letters indicate significant differences in soil water content among different soil depths) |
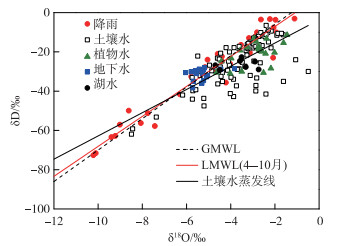
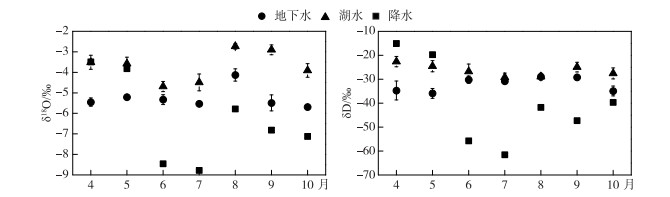
实验期内,降雨δ18O和δD波动较大,变化范围分别为-10.2 ‰ ~-1.11 ‰和-72.9 ‰ ~-3.02 ‰ (图 5),表现出明显的季节效应.其中6、7月份降雨同位素值较其他月份偏小,月加权平均δ18O和δD分别为-8.8 ‰ ~-8.5 ‰和-61.2 ‰ ~-55.7 ‰,这是因为经过雨季前期的多次冷凝,重同位素相对贫化(图 6).降雨δ18O-δD线性拟合得到4-10月大气降水线(LMWL):δD =7.63 δ18O + 8.21 (n=31, R2=0.94) (图 5),其斜率和截距均小于全球大气降水线(GMWL: δD =8 δ18O+10),表明雨滴在降落过程中受到蒸发作用的影响而存在同位素分馏.
|
图 5 大气降水、湖水、地下水、土壤水和植物水的δ18O-δD关系 Fig.5 Relationships between δ18O and δD values for rainfall, lake water, groundwater, soil water and the xylem of A. capillaris water |
|
图 6 降水、湖水、地下水δ18O和δD同位素月变化 Fig.6 Monthly variation of δ18O and δD values for rainfall, lake water and groundwater |
湖水、地下水氢氧同位素样点均分布于大气降水线两侧(图 5),表明所有水体均来源于区域大气降水的补给和转化.湖水分布在大气降水线的右下方,重同位素富集明显,δ18O和δD的变化范围分别为-4.70 ‰ ~-2.74 ‰和-29.2 ‰ ~-22.6 ‰,季节性变化幅度居中(图 5, 图 6).地下水大部分位于大气降水线的左上方,δ18O和δD的变化范围分别为-5.69 ‰ ~-4.10 ‰和-35.9 ‰ ~-28.9 ‰,变化幅度最小,说明地下水很稳定,同位素较少发生分馏(图 5, 图 6).从δ18O和δD月变化来看(图 6),4、5月份湖水与降水同位素值基本接近,湿地地下水同位素值最低, 这说明此阶段湖水主要受大气降水补给,而湿地地下水位大幅抬升的时期为每年汛期的6-8月,此时期大气降水同位素值全年最低,加之地下水更新速度较慢,水体中保留了历史更早期的降水. 6-10月不同水体同位素值排序为:湖水>地下水>降水,且6-8月地下水同位素与湖水同位素值非常接近,由此综合推断,洲滩湿地地下水为历史长期降雨和湖水共同补给形成,且在夏季受湖水补给的影响更大.
2.3 土壤水同位素变化特征分析茵陈蒿群落土壤水同位素大部分位于当地大气降水线的右下方,δ18O和δD变化范围分别为-8.49 ‰ ~-0.49 ‰和-61.9 ‰ ~-6.48 ‰.不同深度土壤水δ18O-δD关系为土壤水蒸发线:δD =5.91 δ18O - 3.66 (n =84, R2 =0.50)(图 5),其斜率和截距均小于当地大气降水线的值,说明土壤水主要来自降水的补给,但经历了强烈蒸发分馏作用的影响.
对比土壤水剖面δ18O同位素与降雨、湖水和地下水δ18O值(图 7),雨季初4、5月,0~40 cm内土壤水δ18O值与降水δ18O接近,略微偏大.说明此阶段茵陈蒿群落土壤层主要接受降水的补给,且因土壤蒸发的影响重同位素有所富集(图 7a, b).雨季末6月,雨水多次冷凝后重同位素贫化,受降雨补给的影响导致表层0~15 cm土壤水δ18O明显减小,而且降雨入渗推动新旧混合水向下移动而引起深层土壤水δ18O值增大(图 7c). 7-8月份,流域降雨逐渐减少、气温达到全年最高,土壤水δ18O随土壤深度增加呈现先略减小而后不断增大的趋势,且深层40~80 cm土壤水δ18O值与湖水δ18O值较接近,但略偏大(图 7d, e).这是因为7、8月份湿地地下水受上涨湖水的集中补给而大幅抬升(图 7d, e),深层土壤水极有可能受到湖水侧向补给和地下水毛细上升水的共同补给,并在蒸发作用下水分自深层逐渐向浅层土壤传输.这种水分传输过程也与该阶段土壤含水量随深度增加的变化规律相符(图 4). 9-10月土壤水δ18O在表层0~15 cm相对富集,且随着深度的增加呈减小的趋势(图 7f, g),这种变化规律主要体现出不同深度土层的土壤水受蒸发作用影响的强度不同,表层土壤蒸发最为强烈,蒸发作用的影响深度可达60~80 cm.

|
图 7 4-10月茵陈蒿植物水δ18O与不同水源δ18O的变化 Fig.7 Variations of δ18O values in different water sources and xylem water for A. capillaris from April to October |
茵陈蒿植物水δ18O、δD变化范围分别为-4.34 ‰ ~-1.88 ‰和-30.5 ‰ ~-15.5 ‰,δ18O-δD关系点主要分布于土壤水蒸发线两侧附近(图 5),部分时期的点据与湖水同位素值接近(图 7d, e).比较δ18O变化范围可知,茵陈蒿植物水δ18O完全落在0~80 cm土壤水δ18O范围之内(-8.49 ‰ ~-0.49 ‰),且与湖水δ18O范围(-4.70 ‰ ~-2.74 ‰)有较大交叉,但与地下水δ18O变化范围(-5.69 ‰ ~-4.10 ‰)差异较大.结果说明:高位滩地茵陈蒿在整个生长期内的直接水源为0~80 cm不同土层的土壤水分,部分时段可能受湖水补给影响.
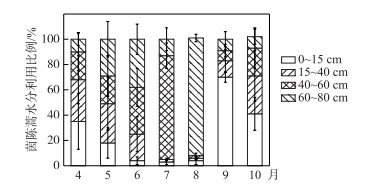
进一步利用直接对比法判断茵陈蒿主要吸水区间的季节变化.在生长初期4、5月份,茵陈蒿δ18O值与0~15 cm的土壤水δ18O值相似,同时与土壤水δ18O剖面在40 cm附近有交点,这说明茵陈蒿生长初期主要利用0~40 cm浅层土壤水(图 7a, b).此外,茵陈蒿δ18O与降雨δ18O值较为接近,茵陈蒿还有可能利用降雨.综合推断,茵陈蒿在生长初期主要利用由降雨补给的浅层土壤水. IsoSource模型计算结果显示,该阶段茵陈蒿对不同深度土壤水分的利用比例大体相当,主要水源为0~40 cm浅层土壤水,利用比例为49 % ~68 % (图 8).
|
图 8 茵陈蒿对不同深度土壤水分利用比例的季节变化 Fig.8 Seasonal variations in proportion of water uptake from different soil layers by A. capillaris |
进入生长旺季6-7月份,茵陈蒿δ18O值与40~60 cm深层土壤水δ18O值相交(图 7c, d),8月份茵陈蒿δ18O与60~80 cm深层土壤水δ18O相似(图 7e).这表明随着植物生长进入旺盛期,茵陈蒿的主要吸水深度由浅层转向40~80 cm的深层土壤.这可能与不同深度土壤含水量的变化有关,此阶段鄱阳湖气温达到全年最高,强烈的蒸发使得表层土壤含水量减小至不足5 %,而深层土壤受湖水和地下水的补给仍维持较高含水量(图 4).因此推断,茵陈蒿可敏锐地响应土壤含水量的变化调整吸水深度,当丰水期6-8月浅表层干旱时,主要利用深层土壤水. IsoSource模型计算结果显示,该阶段茵陈蒿对不同深度土壤水的利用率存在明显差异,主要水源为40~80 cm深层土壤水,利用比为74 % ~95 % (图 8).
成熟期9、10月份,茵陈蒿δ18O与0~15 cm深土壤水δ18O值接近(图 7f, g),表明茵陈蒿生长后期的主要水分来源再次转变为表层土壤水. IsoSource模型计算结果也显示,表层土壤水对茵陈蒿的水分贡献比例最高,为41 % ~70 % (图 8).
3 讨论 3.1 茵陈蒿植物水分利用方式植物的水分利用方式与植物种的类型、根系分布、水分条件和生长阶段等有关[6].茵陈蒿属于中生、多年生草本,同位素研究发现,茵陈蒿的主要水源为0~80 cm土壤水.这与以往的研究结果相近. Ehleringer等在美国荒漠生态系统研究发现,多年生草本植物利用降水和深层土壤水[13];马辉英等在艾比湖湿地研究发现,浅根系植物趋向于利用土壤水[30];Zhang等在蚌湖三角洲湿地研究发现,湿生草本植物主要利用土壤水,而不直接利用降雨[9].然而,茵陈蒿根系吸水深度存在季节差异,表现出先由浅变深、再由深变浅的规律.已有研究发现植物根系深度和毛细根分布是决定植物吸水水源的重要因素,如冷箭竹的吸水深度与土壤剖面毛细根分布相一致[31].苏打猪毛菜体内水分主要来源为表层土壤水,因为其根系主要集中在表层[30], 荆条可同时利用0~40 cm和120 cm以下的土壤水分,与其“二态性”的根系结构直接相关[5].本研究前期调查了茵陈蒿毛细根根长比例的剖面分布(图 9),发现45 %的毛细根集中分布在0~15 cm土壤表层.但茵陈蒿实际根系吸水活性与根长分布表现的并不完全一致,还随不同深度土壤含水量的季节变化而变化.当浅层土壤含水量较高时,0~40 cm土层是根系吸收水分最活跃的区域,当夏季表层土壤含水量降低时,含水量较高的40~80 cm土壤的根系吸水活性显著增强.这说明茵陈蒿根系吸水也可能存在补偿效应,即能够通过增加土壤含水量较高的深层根系的吸水活性来补偿浅层根系吸水的减少[32-33],从而最大限度满足植物能在缺水环境下的水分需求,减少水分胁迫.而当茵陈蒿生长进入成熟期时,根系吸水活性表现出根长密度分布最为一致,可能原因为此阶段植物水分需求量少,不存在水分胁迫的影响.因此,湿地生态水文模型构建中只采用毛细根根长分布来刻画茵陈蒿植物根系吸水模式,可能会导致茵陈蒿群落土壤水分模拟结果产生较大偏差.

|
图 9 茵陈蒿毛细根根长比例的垂向分布 Fig.9 Vertical distribution of the fine roots length ratio for A. capillaris |
茵陈蒿吸水模式显示出较强的可塑性,主要水源由生长初期的0~40 cm土壤水,转移到生长旺季的40~80 cm土壤水,生长末期再次吸收0~10 cm土壤水.这种水分利用方式与干旱半干旱地区植物的吸水方式具有一定的相似性.研究发现芨芨草(Achnatherum splendens)随着表层土壤水分的减少,根系吸水深度转向深层土壤[34];荒漠蒿属植物(Artemisia spp.)、灌木红砂(Reaumuria soongorica)在土壤水分充足时利用浅层土壤水,在表层土壤变干时,主要利用深层土壤水[5, 35-36].这些也侧面说明茵陈蒿对干旱环境具有较强的适应能力.此外,同一生境中的植物种间普遍存在对资源(水分、养分、光照)的竞争[7, 37],茵陈蒿的主要伴生种狗牙根(10 cm深的匍匐根)也有可能从土壤表层吸取水分.因此,茵陈蒿这种灵活的水分利用方式无疑有助于减少种间水分竞争,促进植物共生,增加中生植物群落的物种多样性.事实上,物种间的生态位分化正是植物种长期适应环境的一种生存策略[38-39].
3.2 湖水、湿地水源与植被演替的关系湿地生态系统中降水、湖水、地下水以及土壤水之间转化关系复杂,直接影响土壤生物地球化学循环及植物的生长与演替.尽管已有研究认为,湖泊水位的下降是导致鄱阳湖湿地植被景观格局和群落演替的直接原因[19, 40],但利用氘氧同位素示踪技术探求湿地不同水源与植物水之间传输关系的并不多见.本研究发现,湿地地下水受历史长期降水和湖水共同补给形成,但在丰水期湿地地下水主要来自湖水补给.这与以往野外水文观测结果一致,在涨水期和丰水期,洲滩湿地地下水位与湖水水位基本保持同步变化,而退水期地下水位下降速率更快[23]. Li等利用水化学和水动力学方法研究发现[25-26],鄱阳湖洪泛湿地地下水与湖水在春夏季转换频繁,地下水主要受湖水补给,而秋冬低水位季节,湖水接受地下水系统的补给.
土壤水是地下水-土壤-植被-大气系统水循环过程的连接通道,也是植物水分利用的直接来源, 鄱阳湖不同湿地生态系统土壤水分的补给来源不同,蝶形湖湿地土壤水主要受降水影响,洪泛湿地土壤水受湖水和降水影响[41].这与本研究结果一致,高位滩地中生植物群落虽然地表一般不经历淹水,但夏季深层土壤水与湖水同位素非常接近,表明深层土壤水和湖水、地下水之间仍然存在密切的水力联系,这种水力联系使得湖水能够补给中生植物群落的地下水和深层土壤水,缓解土壤表层干旱的影响.因此,维持较高的湖泊水位对鄱阳湖湿地高位滩地植被生态系统极其重要.
近年来,鄱阳湖水文情势发生显著改变,丰水期高水位不高、枯水期水位过低[17-18].如果未来干旱问题加剧,汛期湖泊水位的持续降低将会直接减少其对湿地地下水和土壤水的补给,而枯水期水位过低则会加大湿地地下水向湖水的排泄强度[26, 42],这无疑会影响湿地生态系统的水分补排过程,加剧湿地土壤水分亏缺.湿地植物将面临不同程度的水分胁迫,考虑到茵陈蒿根系吸水的可塑性,在干旱环境中具有较强的水分利用能力,这将有助于其在种间水分竞争时处于优势地位,长期看来可能有利于中生植物茵陈蒿种群的扩张.当然,植被生长和演替机理复杂,气温、降水、土壤理化因子等对植物的影响同样不可忽视.
4 结论本文应用氢氧稳定同位素技术分析鄱阳湖湿地典型中生植被——茵陈蒿群落地下水、土壤水分的补给来源,阐明优势种茵陈蒿的水分利用来源及其季节变化特征,为鄱阳湖植被生态水文耦合模型的建立和湿地生态系统保护提供理论参考.主要得出以下结论:
1) 鄱阳湖大气降水氢氧同位素季节效应显著,6、7月份最为贫化,湖水同位素最为富集,地下水同位素较为稳定.
2) 湿地生态系统地下水为历史长期降水和湖水共同补给形成,夏季主要受湖水补给.土壤水在雨季受大气降水入渗补给,7-8月份接受湖水侧向补给和地下水毛细上升水的共同补给.
3) 中生植物茵陈蒿生长期内主要水源为0~80 cm不同深度的土壤水,吸水深度呈现由浅变深、再由深变浅的规律.春季4-5月主要利用受降水补给的0~40 cm浅层土壤水,夏季6-8月主要利用40~80 cm深层土壤水分,生长后期主要利用0~15 cm表层土壤水.
4) 茵陈蒿根系吸水模式不仅受根长分布影响,还与土壤水分变化有关,表现出较强的可塑性,有利于应对干旱胁迫.
本研究只考虑了鄱阳湖典型区2018年生长季的情况,数据序列时间较短,而不同年份湖泊水位高低和土壤含水量的变化势必会导致植物水分来源的变化,本研究还不具备区域尺度和长期尺度的代表性.在今后的研究中,为了获取更加系统、更有力的植物水分利用信息,还需要持续积累多年观测数据.同时,结合植物根系生长、叶片水势等指标综合分析,进行不同水文年、不同植物水分利用来源的对比,全面揭示鄱阳湖湿地系统不同生态型植物种的水分利用模式,为预测未来水文情势下湿地植被群落种间竞争和演替趋势提供科学支撑.
| [1] |
Zhang GX, Yin XR, Feng XQ. Review of the issues related to wetland hydrology research. Wetland Science, 2008, 6(2): 105-115. [章光新, 尹雄锐, 冯夏清. 湿地水文研究的若干热点问题. 湿地科学, 2008, 6(2): 105-115.] |
| [2] |
Mortsch LD. Assessing the impact of climate change on the Great Lakes shoreline wetlands. Climatic Change, 1998, 40(2): 391-417. DOI:10.1023/A:1005445709728 |
| [3] |
Pattern DT, Rouse L, Stromberg JC. Isolated spring wetlands in the Great Basin and Mojave Deserts, USA, potential response of vegetation to groundwater withdrawal. Environment Management, 2008, 41(3): 398-413. |
| [4] |
Song LN, Zhu JJ, Li MC et al. Sources of water used by Pinus sylvestris var. mongolica trees based on stable isotope measurements in a semiarid sandy region of Northeast China. Agricultural Water Management, 2016, 164(2): 281-290. |
| [5] |
Wang J, Fu BJ, Lu N et al. Seasonal variation in water uptake patterns of three plant species based on stable isotopes in the semi-arid Loess Plateau. Science of the Total Environment, 2017, 609: 27-37. DOI:10.1016/j.scitotenv.2017.07.133 |
| [6] |
Ehleringer JR, Dawson TE. Water uptake by plants, perspectives from stable isotope composition. Plant Cell Environment, 1992, 15: 1073-1082. DOI:10.1111/j.1365-3040.1992.tb01657.x |
| [7] |
Zhang XC, Li XY, Wu HW et al. Differences in water-use strategies along an aridity gradient between two coexisting desert shrubs (Reaumuria soongorica and Nitraria sphaerocarpa): isotopic approaches with physiological evidence. Plant Soil, 2017, 419(1/2): 169-187. |
| [8] |
Yin L, Zhao LJ, Ruan YF et al. Study of the replenishment sources of typical ecosystems water and dominant plant water in the lower reaches of the Heihe, China. Journal of Glaciology and Geocryology, 2012, 34(6): 1478-1486. [尹力, 赵良菊, 阮云峰等. 黑河下游典型生态系统水分补给源及优势植物水分来源研究. 冰川冻土, 2012, 34(6): 1478-1486.] |
| [9] |
Zhang X, Xiao Y, Wan H et al. Using stable hydrogen and oxygen isotopes to study water movement in soil-plant-atmosphere continuum at Lake Poyang wetland, China. Wetlands Ecology and Management, 2017, 25(2): 221-234. DOI:10.1007/s11273-016-9511-1 |
| [10] |
Zhang L, Dawes WR, Slavich PG et al. Growth and ground water uptake responses of lucerne to changes in groundwater levels and salinity: lysimeter, isotope and modeling studies. Agricultural Water Management, 1999, 39: 265-282. DOI:10.1016/S0378-3774(98)00082-1 |
| [11] |
McCole AA, Stern LA. Seasonal water use patterns of Junipcrus ashci on the Edwards Plateau, Texas, based on stable isotopes in water. Journal of Hydrology, 2007, 342: 238-248. DOI:10.1016/j.jhydrol.2007.05.024 |
| [12] |
Zhou YD, Chen SP, Song WM et al. Water-use strategies of two desert plants along a precipitation gradient in northwestern China. Chinese Journal of Plant Ecology, 2011, 35(8): 789-800. [周雅聃, 陈世苹, 宋维民等. 不同降水条件下两种荒漠植物的水分利用策略. 植物生态学报, 2011, 35(8): 789-800.] |
| [13] |
Ehleringer JR, Phillips SL, Schuster WSF et al. Differential utilization of summer rains by desert plants. Oecologial, 1991, 88(3): 430-434. DOI:10.1007/BF00317589 |
| [14] |
Xing X, Chen H, Zhu JJ et al. Water sources of five dominant desert plant species in Nuomuhong area of Qaidam Basin. Acta Ecologica Sinica, 2014, 34(21): 6277-6286. [邢星, 陈辉, 朱建佳等. 柴达木盆地诺木洪地区5种优势荒漠植物水分来源. 生态学报, 2014, 34(21): 6277-6286.] |
| [15] |
Qian J, Zheng H, Wang PF et al. Water sources of riparian plants during a rainy season in Taihu Lake Basin, China: a stable isotope study. Chemical Speciation and Bioavailability, 2017, 29(1): 153-160. DOI:10.1080/09542299.2017.1373035 |
| [16] |
Ge G, Zhao AN, Zhong YY et al. Patterns of dominant populations of plants in Islets of Lake Poyang. Wetland Science, 2011, 9(1): 19-25. [葛刚, 赵安娜, 钟义勇等. 鄱阳湖洲滩优势植物种群的分布格局. 湿地科学, 2011, 9(1): 19-25.] |
| [17] |
Zhang Q, Ye XC, Werner AD et al. An investigation of enhanced recessions in Lake Poyang, comparison of Yangtze River and local catchment impacts. Journal of Hydrology, 2014, 517: 425-434. DOI:10.1016/j.jhydrol.2014.05.051 |
| [18] |
Liu YB, Zhao XS, Wu GP. A primary investigation of the formation of frequent droughts in the Lake Poyang Basin in recent decade. Resources and Environment in the Yangtze Basin, 2014, 23(1): 131-138. [刘元波, 赵晓松, 吴桂平. 近十年鄱阳湖区极端干旱事件频发现象成因初析. 长江流域资源与环境, 2014, 23(1): 131-138.] |
| [19] |
Tan ZQ, Zhang Q, Li YL et al. Distribution of typical vegetation communities along elevation in Lake Poyang Wetlands. Wetland Science, 2016, 14(4): 506-515. [谭志强, 张奇, 李云良等. 鄱阳湖湿地典型植物群落沿高程分布特征. 湿地科学, 2016, 14(4): 506-515.] |
| [20] |
Han X, Chen X, Feng L. Four decades of winter wetland changes in Lake Poyang based on Landsat observations between 1973 and 2013. Remote Sensing of Environment, 2015, 156: 426-437. DOI:10.1016/j.rse.2014.10.003 |
| [21] |
Li W, Wang X, Pang YW et al. Effects of different water depths on the growth and vegetative reproductive characteristics of wetland vegetation in Lake Poyang. Acta Ecologica Sinica, 2018, 38(9): 3014-3021. [李文, 王鑫, 潘艺雯等. 不同水淹深度对鄱阳湖洲滩湿地植物生长及营养繁殖的影响. 生态学报, 2018, 38(9): 3014-3021.] |
| [22] |
Feng WJ, Xu LG, Wang XL et al. Ecophysiological response of a wetland plant (Carex cinerascens) to different groundwater depths in Lake Poyang wetland. J Lake Sci, 2018, 30(3): 763-769. [冯文娟, 徐力刚, 王晓龙等. 鄱阳湖湿地植物灰化薹草(Carex cinerascens)对不同地下水位的生理生态响应. 湖泊科学, 2018, 30(3): 763-769. DOI:10.18307/2018.0318] |
| [23] |
Xu XL, Zhang Q, Li YL et al. Inner-annual variation of soil water content and groundwater level in a typical islet wetland of Lake Poyang. J Lake Sci, 2014, 26(2): 260-268. [许秀丽, 张奇, 李云良等. 鄱阳湖典型洲滩湿地土壤含水量和地下水位年内变化特征. 湖泊科学, 2014, 26(2): 260-268. DOI:10.18307/2014.0213] |
| [24] |
Zhan LC, Chen JS, Zhang SY et al. Isotopic signatures of precipitation, surface water, and groundwater interactions, Lake Poyang Basin, China. Environmental Earth Science, 2016, 75(19): 1307-1321. DOI:10.1007/s12665-016-6081-8 |
| [25] |
Li YL, Yao J, Zhao GZ et al. Evidences of hydraulic relationships between groundwater and lake water across the large floodplain wetland of Lake Poyang, China. Water Science & Technology: Water Supply, 2018, 18(2): 698-712. |
| [26] |
Li YL, Yao J, Tan ZQ et al. Interactions between typical sub-lakes and groundwater in floodplains of Lake Poyang. Journal of China Hydrology, 2019, 39(5): 1-7. [李云良, 姚静, 谭志强等. 鄱阳湖洪泛区碟形湖域与地下水转化关系分析. 水文, 2019, 39(5): 1-7.] |
| [27] |
Tan ZQ, Xu XL, Li YL et al. Wetland landscape pattern evolution of large Yangtze-connected lakes in the middle reaches of Yangtze River. Resources and Environment in the Yangtze Basin, 2017, 26(10): 1619-1629. [谭志强, 许秀丽, 李云良等. 长江中游大型通江湖泊湿地景观格局演变特征. 长江流域资源与环境, 2017, 26(10): 1619-1629.] |
| [28] |
Phillips DL, Gregg JW. Source partitioning using stable isotopes: coping with too many sources. Oecologia, 2003, 136(2): 261-269. DOI:10.1007/s00442-003-1218-3 |
| [29] |
Ellsworth PZ, Williams DG. Hydrogen isotope fractionation during water uptake by woody xerophytes. Plant and Soil, 2007, 291(1/2): 93-107. |
| [30] |
Ma HY, Yang XD, Lv GH et al. Water sources of dominant desert species in ebinur lake wetland nature reserve, Xinjiang, China. Acta Ecologica Sinica, 2017, 37(3): 829-840. [马辉英, 杨晓东, 吕光辉等. 新疆艾比湖湿地自然保护区荒漠优势种体内的水分来源. 生态学报, 2017, 37(3): 829-840.] |
| [31] |
Xu Q, Li HB, Chen JQ et al. Water use patterns of three species in subalpine forest, Southwest China: The deuterium isotope approach. Ecohydrology, 2011, 4: 236-244. DOI:10.1002/eco.179 |
| [32] |
Xi BY, Wang Y, Jia LM et al. Property of root distribution of triploid Populus tomentosa and its relation to root water uptake under the wide-and-narrow row spacing scheme. Acta Ecological Sinica, 2011, 31(1): 47-57. [席本野, 王烨, 贾黎明等. 宽窄行栽植模式下三倍体毛白杨根系分布特征及其与根系吸水的关系. 生态学报, 2011, 31(1): 47-57.] |
| [33] |
Zhao M, Wang WK, Wang ZF et al. Biomass of Artemisia ordosica in sand land and its root system distribution characteristics in the semiarid regions. Arid Land Geography, 2018, 41(4): 786-792. [赵明, 王文科, 王周锋等. 半干旱区沙地沙蒿生物量及根系分布特征研究. 干旱区地理, 2018, 41(4): 786-792.] |
| [34] |
Wu HW, Li XY, Jiang ZY et al. Variations in water use for Achnatherum splendens in Lake Qinghai watershed, based on δD and δ18O. Acta Ecologica Sinica, 2015, 35(24): 8174-8183. [吴华武, 李小雁, 蒋志云等. 基于D和18O的青海湖流域芨芨草水分利用来源变化研究. 生态学报, 2015, 35(24): 8174-8183.] |
| [35] |
Lv T, Zhao XN, Gao XD et al. Soil water use strategy of dominant species in typical natural and planted shrubs in loess hilly region. Chinese Journal of Plant Ecology, 2017, 41(2): 175-185. [吕婷, 赵西宁, 高晓东等. 黄土丘陵区典型天然灌丛和人工灌丛优势植物土壤水分利用策略. 植物生态学报, 2017, 41(2): 175-185.] |
| [36] |
Zhou H, Zheng XJ, Tang LS et al. Differences and similarities between water sources of Tamarix ramosissima, Nitraria sibirica and Reaumuria soongorica in the southeastern Junggar Basin. Chinese Journal of Plant Ecology, 2013, 37(7): 665-673. [周海, 郑新军, 唐立松等. 准噶尔盆地东南缘多枝柽柳、白刺和红砂水分来源的异同. 植物生态学报, 2013, 37(7): 665-673.] |
| [37] |
Pausas JG, Austin MP. Patterns of plant species richness in relation to different environments: an appraisal. Journal of Vegetation Science, 2001, 12(2): 153-166. DOI:10.2307/3236601 |
| [38] |
Martorell C, Almanza-Celis CAI, Pérez-García EA et al. Co-existence in a species-rich grassland, competition, facilitation and niche structure over a soil depth gradient. Journal of Vegetation Science, 2015, 26(4): 674-685. DOI:10.1111/jvs.12283 |
| [39] |
Chen XL, Chen YN, Chen YP. Relationship among water use of different plants in Heihe River riaparian forests. Chinese Journal of Eco-Agriculture, 2014, 22(8): 972-979. [陈小丽, 陈亚宁, 陈亚鹏. 黑河下游荒漠河岸林植物水分利用关系研究. 中国生态农业学报, 2014, 22(8): 972-979.] |
| [40] |
Tan ZQ, Zhang Q, Li MF et al. A study of the relationship between wetland vegetation communities and water regimes using a combined remote sensing and hydraulic modeling approach. Hydrology Research, 2016, 47(1): 278-292. |
| [41] |
Zhang X, Deng ZM, Pan GY et al. Variation in stable isotope composition in soil water in Lake Poyang Wetland. Acta Ecologica Sinica, 2015, 35(22): 7580-7589. [张翔, 邓志民, 潘国艳等. 鄱阳湖湿地土壤水稳定同位素变化特征. 生态学报, 2015, 35(22): 7580-7589.] |
| [42] |
Li YL, Zhao GZ, Yao J et al. Interactions between groundwater and lake water of riparian zone in the typical area of Lake Poyang. Tropical Geography, 2017, 37(4): 522-529. [李云良, 赵贵章, 姚静等. 湖岸带地下水与湖水作用关系——以鄱阳湖为例. 热带地理, 2017, 37(4): 522-529.] |
 2020, Vol. 32
2020, Vol. 32 
