(2: 广东省水库蓝藻水华防治中心, 广州 510632)
(2: Guangdong Center for Control and Prevention of Reservoir Cyanobacterial Blooms, Guangzhou 510632, P. R. China)
拟柱孢藻(Cylindrospermopsis raciborskii)和角星鼓藻(Staurastrum spp.)是热带和亚热带水体的常见优势种类,2个种类存在演替现象.例如,Ndebele-Murisa等对非洲湖泊研究的综述中指出,丝状蓝藻(拟柱孢藻、长孢藻、假鱼腥藻)常在雨季开始之前成为浮游植物群落的优势类群,鼓藻目种类(鼓藻、角星鼓藻)常在雨季常成为优势种类[1];Barbosa和Padisák在巴西多座湖泊中发现角星鼓藻在分层时期成为浮游植物群落中的绝对优势种,拟柱孢藻在去分层时期常成为优势种[2].对海南的赤田水库、广东的大沙河、高州等多座水库的调查也发现,拟柱孢藻是这些水库的优势种,但通常在水体去分层时期形成优势,而在水体强分层时期浮游植物群落以角星鼓藻为绝对优势种[3-5].拟柱孢藻是热带亚热带水库中常见的水华蓝藻,具有产毒能力,已有研究表明拟柱孢藻对常量元素(N和P)具有较强的竞争能力,尤其能适应低磷环境[6].角星鼓藻为单细胞绿藻,细胞个体大,能耐受资源胁迫,对低磷环境有很好的适应性[3-4].已有的研究主要集中在大量元素对2种藻类生长的影响上,对微量元素的影响尚缺乏充分的认识,而基于常量元素的竞争能力能够解释拟柱孢藻占优势却不能很好地解释其相对生物量受到限制.
铁是浮游植物生长需求最大的微量元素,主要分布于浮游植物细胞的光合系统中[7-10].光合系统中铁含量占整个细胞总铁含量的50%~90%,浮游植物铁需求的种间差异主要由光合系统PSI(含12个Fe原子)和PSII(含2~3个Fe原子)的比例决定[7].蓝藻比绿藻具有更高的PSI:PSII比,因此铁需求更高[8-10].室内实验表明,相对于小球藻、栅藻等绿藻,微囊藻、颤藻等蓝藻的生长更容易受铁浓度影响,在低铁浓度下的比生长速率明显降低[11-13].在铁限制条件下,浮游植物能产生高效鳌合铁离子的铁载体,同时在细胞外膜上产生铁受体蛋白,特异性识别铁离子—铁载体复合物,并将铁离子转运至胞内从而缓解铁限制,因此铁载体产量常用于指示细胞受到铁限制状态[14-16].
在自然水体中,铁是否能成为限制性资源,不仅取决于浮游植物的铁需求,还取决于水体中铁的生物可利用性[17-19].浮游植物生长主要在真光层,调查数据显示,热带水库真光层中总铁浓度常低于0.5 mg/L,溶解性铁浓度常低于0.1 mg/L[20]. Morton等[21]提出,水体中总铁浓度低于0.1 mg/L时,蓝藻生长受到限制.此外,热带水库中磷主要以有机颗粒态形式存在,溶解性活性磷浓度普遍低于0.01 mg/L,有机磷的利用能力对维持浮游植物生长有重要的作用[22].在无机磷不足的环境中,通过产生碱性磷酸酶水解有机磷是浮游植物利用有机磷源的主要途径,这一过程中的能量传递、氮的利用都需要铁的参与[7, 23].基于蓝藻和绿藻的铁需求差异,我们推测在热带水库铁浓度范围内,铁对拟柱孢藻和角星鼓藻生长的限制性作用存在差异,尤其在无机磷缺乏条件下,细胞铁需求可能增加进而导致铁限制作用增强.
为了验证以上推测,本文选择具有拟柱孢藻和角星鼓藻季节演替现象的典型水库(大沙河水库)开展野外调查,分析铁在拟柱孢藻和角星鼓藻生物量和相对生物量季节动态中的作用;并选取分离自热带水库的拟柱孢藻(C. raciborskii, N8)和热带亚热带常见角星鼓藻(Staurastrum sp., FACHB-1449)为实验藻株,分别以无机磷和有机磷为磷源,以热带水库湖上层铁浓度值和Morton等[21]提出的蓝藻生长受限制的铁浓度阈值为参考依据,设置3个铁浓度,开展铁对2种藻生长作用的比较研究.结合野外调查和室内实验结果,分析铁对拟柱孢藻和角星鼓藻生物量季节动态和生长的作用,为进一步阐明热带水库拟柱孢藻和角星鼓藻的演替机制以及为拟柱孢藻水华的防治提供基础数据.
1 材料与方法 1.1 野外调查 1.1.1 水库概况大沙河水库(22°32′N,112°30′E)位于广东省开平市,是开平市区重要的供水水源地.水库流域面积217 km2,总库容2.58×105 m3,正常库容1.57×103 m3,最高水位34 m(珠基),有效最低水位27.4 m(珠基).
1.1.2 采样点设置与采样频率在大沙河水库敞水区设置采样点(图 1),从2016年8月-2017年8月,每月采样1次.
|
图 1 大沙河水库采样点 Fig.1 Sampling sites in Dashahe Reservoir |
用YSI水质仪现场测定水温(T)、pH值,用黑白盘(塞氏盘)测定透明度.采集表层0.5 m的水样按照国家水质监测标准方法(GB 3838—2002)测定总磷(TP)、总氮(TN)、硝态氮(NO3--N)和氨氮(NH3-N)、正磷酸盐(PO43--P)的浓度,用ICP-AES法测定总铁(TFe)和溶解性铁(DFe)浓度.
用采水器采集水样后,取1 L水样现场加入1%鲁哥试剂,带回实验室,取10 mL水样,采用倒置显微镜镜检法对浮游植物进行种类鉴定和计数,每个样品至少计数400个藻类个体.
1.2 室内实验 1.2.1 藻种来源与培养实验所用藻种拟柱孢藻(C. raciborskii, N8)分离自广东省江门市镇海水库;角星鼓藻(Staurastrum sp., FACHB-1449)购自中国科学院武汉水生生物研究所,分离自一座亚热带富营养化水库——湖北赤壁陆水湖水库,为热带亚热带常见种.将N8和FACHB-1449置于BG11培养基中培养,培养条件为:温度25.5±1℃,光强35 μmol/(m2 ·s),光照周期12 h:12 h.
1.2.2 培养条件及实验设计以BG11培养基为基础(Fe3+浓度为0.689 mg/L),以柠檬酸铁铵为铁源,依据热带水库湖上层的铁浓度范围(< 0.3 mg/L)[20],共设置3种铁浓度实验组:0.689 mg/L(IPHFe,即BG11对照组),0.29 mg/L(IPMFe),0.029 mg/L(IPLFe);将BG11磷源替换为有机磷(OP, D-葡萄糖-6-磷酸),以柠檬酸铁铵为铁源设置有机磷源条件下3种铁浓度实验组:0.689 mg/L(OPHFe),0.29 mg/L(OPMFe),0.029 mg/L(OPLFe).每个藻株各有6个实验组(IPLFe、IPMFe、IPHFe、OPLFe、OPMFe和OPHFe),每个实验组设置3个平行.
每天下午5点测定680 nm处的吸光值,确定培养藻细胞处于对数期之后,用离心法收集藻细胞,无菌水洗涤3次后将藻细胞接种至不含铁、磷的BG11培养基,饥饿培养3天,饥饿处理后的藻液分别接种至各实验组培养基中,接种叶绿素a的初始浓度为17.90±1.95 μg/L.培养条件为:温度25.5±1℃,光强35 μmol/(m2 ·s),光照周期12 h:12 h.每隔1天或3天于上午11点取样,测定叶绿素a浓度、碱性磷酸酶活性和铁载体产量,取1 mL藻液加鲁哥试剂保存用于细胞计数.
1.2.3 指标测定1) 生长曲线和比生长速率的计算取样后遮光处理20 min,用TrilogyTM Fluorpmeter荧光仪测定藻液叶绿素a荧光值,根据标准曲线换算成叶绿素a浓度(Chl.a浓度)[24];取100 μL藻液于生物计数框中,采用视野法计数,并计算藻细胞密度.比生长速率计算公式为[25]:
| $ \mu = \frac{{\ln \left( {{C_2}} \right) - \ln \left( {{C_1}} \right)}}{{{t_2} - {t_1}}} $ | (1) |
式中,C1和C2分别代表时间t1和t2时的细胞密度(cells/L).
2) 铁载体的测定参考Schwyn等[27-28]的测定方法,藻液离心后取上清液(s)1 mL,加入1 mL CAS分析溶液和20 μL 0.2 mol/L 5-磺基水杨酸,摇匀,以不含铁的BG11培养基作对照(r).将样品(s)和对照(r)与CAS的混合液在室温下避光放置1 h后,于630 nm处测定吸光值(A).铁载体产量的计算公式为:
| $ 铁载体产量 = \left( {{A_{\rm{r}}} - {A_{\rm{s}}}} \right)/{A_{\rm{r}}} $ | (2) |
铁载体产量低于0.01时被认为是无铁载体产生[29],以单位浓度Chl.a的铁载体产量用于数据分析.
3) 碱性磷酸酶活性的测定碱性磷酸酶活性测定方法为分光光度比色法[26].参考碱性磷酸酶活性检测试剂盒(上海翊圣生物科技有限公司)的步骤,采用酶标仪于405 nm处测定对硝基苯酚的吸光值,计算单位时间内每微克叶绿素a产生的对硝基苯酚的量,以此表示细胞碱性磷酸酶活性(μmol/(μg Chl.a) ·min).
1.3 统计分析水库中拟柱孢藻和角星鼓藻生物量和相对生物量与环境因子的关系,采用多元逐步回归方法分析各因子对生物量和相对生物量变化的解释量及回归关系.
采用单因素方差分析(One-way ANOVA),比较相同磷源条件下3个铁浓度实验组的Chl.a浓度、藻细胞密度以及比生长速率的差异;采用双因素方差分析(Two-way ANOVA),分析磷源、铁浓度以及两者交互作用对比生长速率、碱性磷酸酶活性和铁载体产量的影响.显著性水平均设定为P < 0.05.
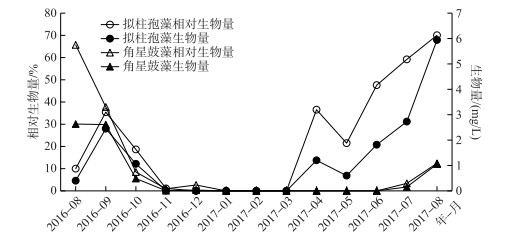
2 结果 2.1 水库中拟柱孢藻和角星鼓藻的季节动态 2.1.1 生物量和相对生物量的季节动态调查期间,拟柱孢藻和角星鼓藻生物量和相对生物量均有明显的季节动态.拟柱孢藻的生物量最大值为5.9 mg/L,相对生物量最大值为70%,出现在2017年的8月;角星鼓藻生物量最大值为2.6 mg/L,相对生物量最大值为66%,出现在2016年8月. 2016年8-10月期间,发生拟柱孢藻取代角星鼓藻的演替现象:拟柱孢藻的相对生物量由8月份的10%上升至9月份的35%,同时角星鼓藻的相对生物量由8月的66%逐渐下降至11月的0.5%. 2017年3-8月期间,拟柱孢藻的生物量和相对生物量逐渐上升,到8月份生物量达到5.9 mg/L,相对生物量达到70%,成为浮游植物群落中的绝对优势种类;角星鼓藻生物量在7-8月期间明显升高,8月份生物量达到1.1 mg/L,相对生物量达到12.4%,与拟柱孢藻共同占浮游植物总生物量的82%.
|
图 2 拟柱孢藻和角星鼓藻生物量和相对生物量的季节动态 Fig.2 Seasonal dynamics of biomass and relative biomass of C. raciborskii and Staurastrum spp. |
调查期间,水体温度在17~32℃之间,pH值在7.6~9.1之间,透明度在0.8~1.4 m之间;TP浓度在0.021~0.047 mg/L之间,TN浓度在0.72~1.7 mg/L之间,TN:TP质量比在25~72之间;溶解性无机氮(DIN)浓度在0.18~0.92 mg/L之间,正磷酸盐浓度在0.004 mg/L以下;总铁浓度在0.067~0.26 mg/L之间,溶解性铁浓度在0.049 mg/L以下.
多元逐步回归分析表明,拟柱孢藻和角星鼓藻生物量均与水温、pH值和SD没有显著的线性回归关系;3种营养元素(N、P、Fe)中,只有溶解性氮和溶解性铁对拟柱孢藻的生物量和相对生物量变化有显著的解释性作用(P < 0.001),拟柱孢藻的生物量与2个因子存在显著的线性回归关系(P < 0.001);角星鼓藻的生物量只与溶解性氮有显著的线性回归关系(P < 0.001,表 1).
| 表 1 拟柱孢藻和角星鼓藻生物量的多元逐步回归分析 Tab. 1 Multiple stepwise regression of C. raciborskii biomass (Bcyl) and Staurastrum spp. biomass (Bstr) |
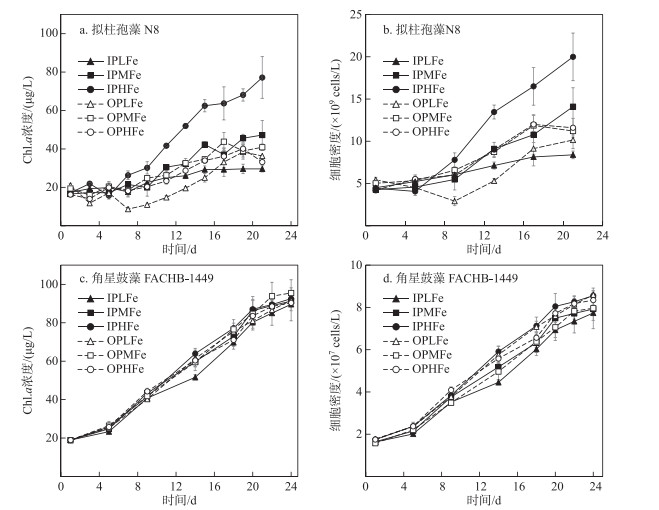
拟柱孢藻N8和角星鼓藻FACHB-1449的Chl.a浓度和细胞密度均呈增长趋势(图 3).无机磷源条件下,拟柱孢藻N8的Chl.a浓度和细胞密度均随铁浓度降低而显著降低(One-way ANOVA, P < 0.05).有机磷条件下,OPLFe组拟柱孢藻N8的Chl.a浓度和细胞密度显著低于OPHFe组和OPMFe组(One-way ANOVA, P < 0.05),但OPHFe组和OPMFe组之间没有显著差异.培养期间,角星鼓藻FACHB-1449的Chl.a浓度差异和藻细胞密度差异均不显著(One-way ANOVA, P > 0.05).
|
图 3 拟柱孢藻N8和角星鼓藻FACHB-1449的生长曲线(拟柱孢藻N8的Chl.a浓度(a)和细胞密度(b);角星鼓藻FACHB-1449的Chl.a浓度(c)和细胞密度(d)) Fig.3 The growth curve for the Chl.a concentration and cell density of C. raciborskii N8 (a and b) and Staurastrum sp. FACHB-1449(c and d) |
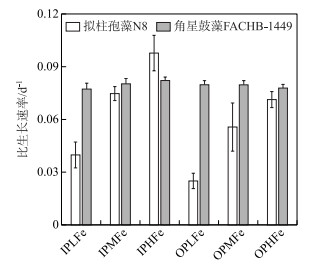
无机磷条件下,IPHFe、IPMFe和IPLFe实验组拟柱孢藻N8的比生长速率分别为0.098±0.01、0.075±0.004、0.04±0.007 d-1,比生长速率随铁浓度的降低而显著降低(One-way ANOVA,P < 0.05;图 2).有机磷源条件下,OPHFe、OPMFe和OPLFe实验组拟柱孢藻N8的比生长速率分别为0.071±0.005、0.056±0.014和0.025±0.004 d-1,比生长速率随铁浓度降低而显著降低(One-way ANOVA,P < 0.05;图 4).双因素方差分析结果表明,磷源和铁浓度对拟柱孢藻N8的比生长速率均有显著作用(Two-way ANOVA, P < 0.05;图 4),但交互作用不显著.
|
图 4 6个实验组中拟柱孢藻N8和角星鼓藻FACHB-1449的比生长速率 Fig.4 The specific growth rate of C. raciborskii N8 and Staurastrum sp. FACHB-1449 in six treatments |
与拟柱孢藻N8组间有明显差异不同,6个实验组中角星鼓藻FACHB-1449的比生长速率约为0.079±0.001 d-1,各组之间无显著差异(Two-way ANOVA,P > 0.05;图 4).
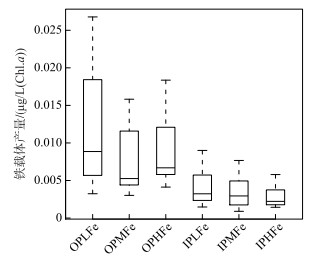
2.2.3 铁载体产量6个实验组的角星鼓藻FACHB-1449均未检出铁载体,而拟柱孢藻N8均检出较高的铁载体产量.无机磷源下,IPLFe、IPMFe和IPHFe组拟柱孢藻N8的铁载体产量均值分别为0.0041、0.0037、0.0028,组间差异不显著.有机磷源下,各实验组拟柱孢藻N8的铁载体产量显著高于无机磷条件各实验组,OPLFe组拟柱孢藻N8的铁载体产量均值明显高于OPMFe组和OPHFe组.双因素方差分析表明,磷源对拟柱孢藻N8铁载体产量具有显著影响,有机磷源条件下的铁载体产量显著高于无机磷源条件.铁浓度及其与磷源的交互作用对拟柱孢藻N8铁载体产量的影响不显著(Two-way ANOVA,P > 0.05;图 5).
|
图 5 6个实验组中拟柱孢藻N8铁载体产量 Fig.5 The siderophore production of C. raciborskii N8 in six treatments |
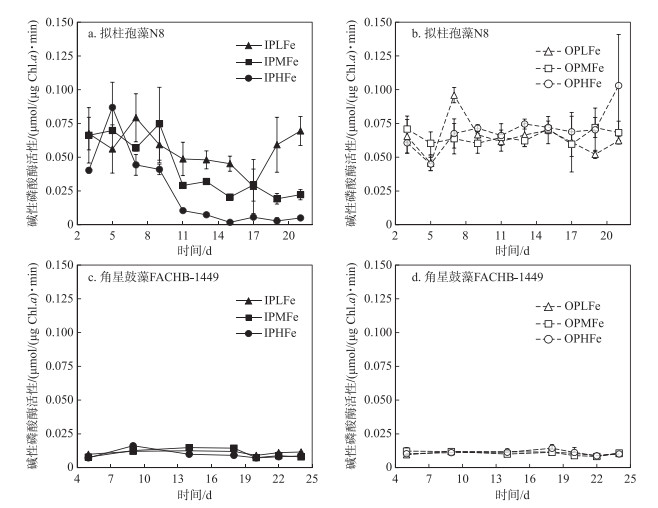
所有实验组角星鼓藻FACHB-1449的碱性磷酸酶活性均较低,且无显著差异(图 6).拟柱孢藻N8的碱性磷酸酶活性显著高于角星鼓藻FACHB-1449(One-way ANOVA,P < 0.05).双因素方差分析表明,磷源和铁浓度对拟柱孢藻N8酶活性均有显著影响.无机磷组的酶活性显著低于有机磷组(P < 0.05).无机磷条件下,3个实验组拟柱孢藻N8的酶活性均呈下降趋势,其中IPHFe组下降幅度最大,实验末期IPHFe组酶活性接近0,显著低于IPMFe组和IPLFe组(One-way ANOVA,P < 0.05);IPLFe组的酶活性下降速度和幅度均最低(图 6).有机磷条件下,3个实验组拟柱孢藻N8的酶活性一直维持在0.05~0.075 μmol/((μg Chl.a) ·min)之间,在实验后期OPHFe组的酶活性显著高于OPMFe组和OPLFe组(One-way ANOVA,P < 0.05).磷源和铁浓度的交互作用对拟柱孢藻N8碱性磷酸酶活性的影响不显著.
|
图 6 6个实验组中拟柱孢藻N8和角星鼓藻FACHB-1449的碱性磷酸酶活性 Fig.6 The alkaline phosphatase activity of C. raciborskii N8 and Staurastrum sp. FACHB-1449 in six treatments |
调查期间,拟柱孢藻和角星鼓藻生物量最高占到浮游植物总生物量的82%,是浮游植物群落中最重要的类群. 2种浮游植物的季节动态有明显的不同,表明其种群对环境条件变化的响应存在差异.环境因子数据表明,调查期间水体TN:TP质量比在25以上,溶解性磷浓度一直在0.004 mg/L以下,该磷浓度条件对大多数浮游植物生长都有限制作用[30].拟柱孢藻和角星鼓藻是典型适应低磷环境的种类[5, 30],该生理特征可能是2种浮游植物能够在大沙河水库成为优势种的重要原因.统计分析表明溶解性磷浓度对拟柱孢藻和角星鼓藻生物量和相对生物量的季节变化没有显著的解释性作用,在长期低无机磷浓度条件下,2种浮游植物的季节动态主要由溶解性氮和溶解性铁浓度变化解释.拟柱孢藻和角星鼓藻生物量均与溶解性氮浓度呈显著的负线性回归关系,但只有拟柱孢藻生物量与溶解性铁浓度有显著的线性回归关系.该结果表明,2种浮游植物生物量对环境因子的响应主要体现在对溶解性铁浓度的响应差异上;铁对拟柱孢藻的季节动态有重要作用,溶解性铁浓度的减少是导致拟柱孢藻竞争优势降低的重要原因.
3.2 铁对拟柱孢藻和角星鼓藻生长的作用比较 3.2.1 无机磷源条件下铁浓度对2种藻生长影响的差异以细胞密度和Chl.a浓度表示生长曲线,两者趋势基本一致.无机磷条件下,拟柱孢藻N8的比生长速率均随铁浓度的降低而显著降低,而各实验组角星鼓藻FACHB-1449比生长速率没有明显差异(图 4).当一定的资源浓度条件下细胞生长速率小于最大生长速率,且该资源浓度小于最大生长速率对应的资源浓度时,藻细胞的生长受到限制,比生长速率随该资源浓度的上升而增加[31]. 0.029 mg/L和0.29 mg/L铁浓度条件下拟柱孢藻生长受到限制作用,但角星鼓藻的生长限制作用不明显.该结果表明,与拟柱孢藻N8相比,角星鼓藻FACHB-1449能在更低的Fe3+浓度条件下正常生长.
为进一步明确铁的限制作用的种间差异,我们对铁载体产量进行了比较.拟柱孢藻N8各组均检出较高的铁载体产量,且各组的铁载体组内方差较大,而角星鼓藻FACHB-1449各实验组均未检出铁载体(图 5).铁载体是藻细胞在铁限制条件下产生的有机小分子物质,为八面体结构的异羟肟酸型和邻苯二酚型小分子物质,对Fe3+具有较强的鳌合作用,同时铁离子—铁载体复合物能被细胞外膜上的铁受体蛋白特异性识别并将铁离子转运至胞内从而缓解铁限制[16, 32].已有研究提出,蓝藻细胞能直接利用Fe2+,而对Fe3+的吸收主要通过铁载体途径完成[33],铁载体产量指示细胞生长受到铁限制及环境Fe2+供应不足.本实验的培养基铁源为Fe3+,通过铁载体获取铁可能是拟柱孢藻利用铁的主要途径,这可能是高铁实验组中拟柱孢藻N8也能检出铁载体产量的重要原因.绿藻能通过多种途径利用铁元素.除了能分泌铁载体途径利用铁外[34-35],绿藻还能直接吸收Fe3+[36],或通过分泌还原酶(FCR),将Fe3+螯合物还原成Fe2+和螯合物配体[35, 37].本实验中所有角星鼓藻FACHB-1449实验组均未检测到铁载体,表明角星鼓藻可能不通过铁载体途径利用铁.
此外,在无机磷源条件下,各实验组拟柱孢藻N8在实验初期均有检到碱性磷酸酶活性,这与接种前进行了磷饥饿处理有关.碱性磷酸酶为一类诱导酶,其产生受一系列生理过程调控.酶活性对胞外磷浓度的响应会呈现滞后现象[38-39].随着实验的进行,高铁组的酶活性逐渐降低,但中铁组和低铁组酶活性降低缓慢(图 6).低铁组胞外无机磷浓度并不限制其生长,但较低的铁浓度可能不利于细胞对磷的吸收.
3.2.2 有机磷源条件下铁对2种藻生长影响的差异有机磷条件下,所有实验组的拟柱孢藻N8比生长速率都低于无机磷高铁组,且随铁浓度降低而降低(图 4).此外,有机磷条件下的铁载体产量和碱性磷酸酶活性均显著高于无机磷条件(图 5和图 6).上述结果表明,有机磷条件下细胞生长同时受磷和铁的限制.与拟柱孢藻N8不同,角星鼓藻FACHB-1449各实验组的比生长速率与无机磷高铁组的差异不显著,且无铁载体产生,碱性磷酸酶活性也较低,3个指标均表明磷源和铁浓度对角星鼓藻FACHB-1449的生长没有明显限制作用.
溶解性无机磷缺乏时,细胞通过产生碱性磷酸酶水解和利用有机磷,满足藻细胞的磷需求[40-41].碱性磷酸酶是一类蛋白酶,其合成需要氮的参与,铁是氮还原酶的组成部分,决定氮同化速率及酶的合成[42].此外,Fe3+是PhoX型碱性磷酸酶活性中心的关键组成部分[43].铁参与碱性磷酸酶的产生和有机磷利用过程中的多个环节.有机磷条件下,拟柱孢藻N8铁载体产量显著高于无机磷条件.表明有机磷条件下细胞对铁的需求高于无机磷条件.低铁组铁载体明显高于其他组,但由于各实验组组内方差较大,不能通过铁载体产量识别藻细胞铁限制程度的组间差异.
大部分浮游植物能够产生碱性磷酸酶,但碱性磷酸酶的产生以及对有机磷的利用能力存在明显的种间差异[44-45].本实验结果也证实,2种藻均能在有机磷环境生长,但碱性磷酸酶活性存在显著差异.所有角星鼓藻FACHB-1449实验组的碱性磷酸酶活性一直维持在较低的水平,且不受铁浓度变化的影响.拟柱孢藻N8的碱性磷酸酶活性远高于角星鼓藻FACHB-1449,且高铁组酶活性显著高于低铁组(图 6).我国热带水库的溶解性无机磷浓度普遍较低,水体磷主要以有机磷形式存在.角星鼓藻和拟柱孢藻均能适应这种低无机磷环境[3, 46],本实验也支持该结论.在这类溶解性无机磷浓度偏低的水体中,铁浓度的降低可能限制拟柱孢藻的生长,而角星鼓藻维持正常生长.野外调查结果显示,在热带水库分层强烈的季节,湖上层常出现高pH值和富氧条件,不利于溶解性铁尤其是Fe2+的存在,此时的水环境即为低无机磷和低铁环境[20].角星鼓藻常在该地区水库处于水体强分层时成为优势种,而拟柱孢藻在该时期的生物量较低.拟柱孢藻和角星鼓藻的演替现象常出现在这类水体[47],这可能与2种藻的限制性铁浓度差异有关.
4 结论在溶解性无机磷长期偏低的大沙河水库中,拟柱孢藻和角星鼓藻是浮游植物群落的主要优势种类,2种浮游植物生物量具有明显的季节动态,其生物量对环境因子的响应的区别主要体现在对溶解性铁浓度的响应差异上.与角星鼓藻相比,拟柱孢藻更易受到铁的限制,有机磷源条件拟柱孢藻的铁需求明显高于无机磷条件,有机磷源条件会增强铁对拟柱孢藻生长的限制作用.
| [1] |
Ndebele-Murisa MR, Musil CF, Raitt L. A review of phytoplankton dynamics in tropical African lakes. South African Journal of Science, 2010, 106(1/2): 13-18. |
| [2] |
Barbosa FAR, Padisák J. The forgotten lake stratification pattern: atelomixis, and its ecological importance. Internationale Vereinigung für theoretische und angewandte Limnologie: Verhandlungen, 2002, 28(3): 1385-1395. |
| [3] |
Xiao LJ. Phytoplankton assemblage and trophic status of seven reservoirs in Hainan province, China[Dissertation]. Guangzhou: Jinan University, 2008. [肖利娟.海南省7座大中型水库浮游植物群落特征和富营养化分析[学位论文].广州: 暨南大学, 2008. http://cdmd.cnki.com.cn/article/cdmd-10559-2009010191.htm ]
|
| [4] |
Xiao LJ. Comparative analysis of phytoplankton communities and their succession in two large reservoirs, South China[Dissertation]. Guangzhou: Jinan University, 2011. [肖利娟.华南地区两座大型水库浮游植物群落与演替机制比较[学位论文].广州: 暨南大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10559-1011129053.htm ]
|
| [5] |
Lei L, Peng L, Huang X et al. Occurrence and dominance of Cylindrospermopsis raciborskii and dissolved cylindrospermopsin in urban reservoirs used for drinking water supply, South China. Environmental Monitoring and Assessment, 2014, 186(5): 3079-3090. |
| [6] |
Dufour P, Sarazin G, Quiblier C et al. Cascading nutrient limitation of the cyanobacterium Cylindrospermopsis raciborskii in a Sahelian lake (North Senegal). Aquatic Microbial Ecology, 2006, 44(3): 219-230. |
| [7] |
Borowitzka, Michael A, Beardall J et al. The physiology of microalgae. New York: Springer, 2016.
|
| [8] |
Raven JA. The iron and molybdenum use efficiencies of plant growth with different energy, carbon and nitrogen sources. New Phytologist, 1988, 109(3): 279-287. DOI:10.1111/j.1469-8137.1988.tb04196.x |
| [9] |
Strzepek RF, Harrison PJ. Photosynthetic architecture differs in coastal and oceanic diatoms. Nature, 2004, 431(7009): 689. DOI:10.1038/nature02954 |
| [10] |
Melis A. Spectroscopic methods in photosynthesis: photosystem stoichiometry and chlorophyll antenna size. Philosophical Transactions of the Royal Society of London B, Biological Sciences, 1989, 323(1216): 397-409. DOI:10.1098/rstb.1989.0019 |
| [11] |
Yan F, Chu ZS, Jin XC et al. Effect of Fe(Ⅲ) on the growth competition of Microcystis aeruginosa and Scenedesmus quadricauda. Research of Environmental Sciences, 2007, 20(5): 61-65. [阎峰, 储昭升, 金相灿等. Fe(Ⅲ)对太湖铜绿微囊藻和四尾栅藻竞争的影响. 环境科学研究, 2007, 20(5): 61-65.] |
| [12] |
Liu J, Zhao HT, Sheng HJ et al. Effects of Fe3+ on growth and calcium/magnesium Ions uptakes of three common algae in Taihu lake. Environmental Science & Technology, 2011, 34(1): 59-64. [刘静, 赵海涛, 盛海君等. 铁对太湖常见藻类生长及Ca2+, Mg2+离子吸收的影响. 环境科学与技术, 2011, 34(1): 59-64.] |
| [13] |
Wang XQ, Jiang HB, Qiu BS. Effects of iron availability on competition between Microcystis and Pseudanabaena or Chlorella species. European Journal of Phycology, 2015, 50(3): 260-270. DOI:10.1080/09670262.2015.1020516 |
| [14] |
Gress CD, Treble RG, Matz CJ et al. Biological availability of iron to the freshwater Cyanobacterium Anabaena flos-aquae. Journal of Phycology, 2004, 40(5): 879-886. DOI:10.1111/j.1529-8817.2004.03165.x |
| [15] |
Matz CJ, Christensen MR, Bone AD et al. Only iron-limited cells of the cyanobacterium Anabaena flos-aquae inhibit growth of the green alga Chlamydomonas reinhardtii. Canadian Journal of Botany, 2004, 82(4): 436-442. |
| [16] |
Neilands JB. Siderophores: structure and function of microbial iron transport compounds. Journal of Biological Chemistry, 1995, 270(45): 26723-26726. DOI:10.1074/jbc.270.45.26723 |
| [17] |
Martin JH, Gordon RM. Northeast Pacific iron distributions in relation to phytoplankton productivity. Deep Sea Research Part A Oceanographic Research Papers, 1988, 35(2): 177-196. DOI:10.1016/0198-0149(88)90035-0 |
| [18] |
Sunda WG, Huntsman SA. Interrelated influence of iron, light and cell size on marine phytoplankton growth. Nature, 1997, 390(6658): 389. DOI:10.1038/37093 |
| [19] |
Hyenstrand P, Rydin E, Gunnerhed M. Response of pelagic cyanobacteria to iron additions-enclosure experiments from Lake Erken. Journal of Plankton Research, 2000, 22(6): 1113-1126. DOI:10.1093/plankt/22.6.1113 |
| [20] |
Yang SY, Zhao J, Yu HZ et al. Vertical distribution characteristics of Fe and Mn in subtropical reservoirs during Summer. Environment Science, 2017, 38(11): 4546-4552. [杨思远, 赵剑, 余华章等. 南亚热带地区水库夏季铁, 锰垂直分布特征. 环境科学, 2017, 38(11): 4546-4552.] |
| [21] |
Morton SD, Lee TH. Algal blooms. Possible effects of iron. Environmental Science & Technology, 1974, 8(7): 673-674. |
| [22] |
Han BP, Liu ZW. Tropical and sub-tropical reservoir limnology in China: theory and practice. New York: Springer Science & Business Media, 2011.
|
| [23] |
Geider RJ, La Roche J. The role of iron in phytoplankton photosynthesis, and the potential for iron-limitation of primary productivity in the sea. Photosynthesis Research, 1994, 39(3): 275-301. |
| [24] |
Brand L, Guillard RRL, Murphy LS. A method for the rapid and precise determination of acclimated phytoplankton reproduction rates. Journal of Plankton Research, 1981, 3(2): 193-201. DOI:10.1093/plankt/3.2.193 |
| [25] |
Stein JR, Hellebust JA, Craigie JS. Handbook of phycological methods: culture methods and growth measurements. Cambridge: Cambridge University Press, 1973.
|
| [26] |
Berman T. Alkaline phosphatases and phosphorus availability in Lake Kinneret. Limnology and Oceanography, 1970, 15(5): 663-674. DOI:10.4319/lo.1970.15.5.0663 |
| [27] |
Schwyn B, Neilands JB. Universal chemical assay for the detection and determination of siderophores. Analytical Biochemistry, 1987, 160(1): 47-56. |
| [28] |
Payne SM. Detection, isolation, and characterization of siderophores. Methods in enzymology. Academic Press, 1994, 235: 329-344. |
| [29] |
Machuca A, Milagres AMF. Use of CAS-agar plate modified to study the effect of different variables on the siderophore production by Aspergillus. Letters in Applied Microbiology, 2003, 36(3): 177-181. DOI:10.1046/j.1472-765X.2003.01290.x |
| [30] |
Reynolds CS. The ecology of phytoplankton. London: Cambridge University Press, 2006.
|
| [31] |
Monod J. The growth of bacterial cultures. Annual Review of Microbiology, 1949, 3(1): 371-394. DOI:10.1146/annurev.mi.03.100149.002103 |
| [32] |
Ollinger J, Song KB, Antelmann H et al. Role of the Fur regulon in iron transport in Bacillus subtilis. Journal of Bacteriology, 2006, 188(10): 3664-3673. DOI:10.1128/JB.188.10.3664-3673.2006 |
| [33] |
Molot LA, Watson SB, Creed IF et al. A novel model for cyanobacteria bloom formation: the critical role of anoxia and ferrous iron. Freshwater Biology, 2014, 59(6): 1323-1340. DOI:10.1111/fwb.12334 |
| [34] |
Benderliev KM, Ivanova NI. High-affinity siderophore-mediated iron-transport system in the green alga Scenedesmus incrassatulus. Planta, 1994, 193(2): 163-166. |
| [35] |
Weger HG, Matz CJ, Magnus RS et al. Differences between two green algae in biological availability of iron bound to strong chelators. Botany, 2006, 84(3): 400-411. |
| [36] |
Hudson RJM, Morel F. Iron transport in marine phytoplankton: Kinetics of cellular and medium coordination reactions. Limnology and Oceanography, 1990, 35(5): 1002-1020. DOI:10.4319/lo.1990.35.5.1002 |
| [37] |
Lynnes JA, Derzaph TLM, Weger HG. Iron limitation results in induction of ferricyanide reductase and ferric chelate reductase activities in Chlamydomonas reinhardtii. Planta, 1998, 204(3): 360-365. DOI:10.1007/s004250050267 |
| [38] |
Berger J, Hauber J, Hauber R et al. Secreted placental alkaline phosphatase: a powerful new quantitative indicator of gene expression in eukaryotic cells. Gene (Amsterdam), 1988, 66(1): 1-10. DOI:10.1016/0378-1119(88)90219-3 |
| [39] |
Cao XY. Role of extracellular phosphatase produced by phytoplankton in the processes of phosphorus cycling in eutrophic lakes[Dissertation]. Wuhan: Institute of Hydrobiology, Chinese Academic of Sciences, 2005. [曹秀云.浮游植物胞外磷酸酶在富营养化湖泊磷循环过程中的作用[学位论文].武汉: 中国科学院水生生物研究所, 2005. http://cdmd.cnki.com.cn/article/cdmd-80119-2005152006.htm ]
|
| [40] |
Spijkerman E, Coesel PFM. Alkaline phosphatase activity in two planktonic desmid species and the possible role of an extracellular envelope. Freshwater Biology, 1998, 39(3): 503-513. DOI:10.1046/j.1365-2427.1998.00299.x |
| [41] |
Bai F, Liu R, Yang Y et al. Dissolved organic phosphorus use by the invasive freshwater diazotroph cyanobacterium, Cylindrospermopsis raciborskii. Harmful Algae, 2014, 39: 112-120. DOI:10.1016/j.hal.2014.06.015 |
| [42] |
Milligan AJ, Harrison PJ. Effects of non-steady-state iron limitation on nitrogen assimilatory enzymes in the marine diatom Thalassiosira weissflogii (Bacillariophyceae). Journal of Phycology, 2000, 36(1): 78-86. DOI:10.1046/j.1529-8817.2000.99013.x |
| [43] |
Yong SC, Roversi P, Lillington J et al. A complex iron-calcium cofactor catalyzing phosphotransfer chemistry. Science, 2014, 345(6201): 1170-1173. DOI:10.1126/science.1254237 |
| [44] |
Ranhofer ML, Lawrenz E, Pinckney JL et al. Cell-specific alkaline phosphatase expression by phytoplankton from Winyah Bay, South Carolina, USA. Estuaries and Coasts, 2009, 32(5): 943-957. DOI:10.1007/s12237-009-9180-x |
| [45] |
Rengefors K, Ruttenberg KC, Haupert CL et al. Experimental investigation of taxon-specific response of alkaline phosphatase activity in natural freshwater phytoplankton. Limnology and Oceanography, 2003, 48. |
| [46] |
Xiao LJ, Hu R, Peng L et al. Dissimilarity of phytoplankton assemblages in two connected tropical reservoirs: effects of water transportation and environmental filtering. Hydrobiologia, 2016, 764(1): 127-138. DOI:10.1007/s10750-015-2400-4 |
 2020, Vol. 32
2020, Vol. 32 

