碳(C)、氮(N)和磷(P)是生物体的三种必需元素,在植物的各项生理活动中起着重要作用[1-2]. C元素组成植物体内的干物质,是植物的结构性元素[3]. N、P元素组成植物体内的各种蛋白质和遗传物质[4],是生态系统植物生长的主要限制元素[5-6].然而,植物需要所有养分以一个合适的生态化学计量比存在时才能健康、稳定的发展.从生态学的研究角度来看,生态化学计量学(ecological stoichiometry)正是在生态系统尺度上平衡多个关键元素的一门科学,近年来已成为研究的热点.
目前,关于C、N、P元素生态化学计量特征的研究主要包括草原、森林等生态系统[7-8],同时大多涉及到植物地上部分(叶片)[9-14],且由于植物细根分布复杂、周转迅速、难获取等情况[15-16],对细根以及将叶片与细根C、N、P化学计量特征联系起来的研究却相对较少[16-17],尤其是在不同淹水胁迫下植物叶片与细根C、N、P化学计量特征关系的研究鲜有报道.研究叶片与细根间的关联有利于理解植物各性状之间的相互作用机制、植物生长过程中对营养元素等资源的分配与吸收以及对环境变化的响应等过程[18-20].有研究表明,植物叶片和细根(d≤2 mm)分别作为地上与地下部分最为活跃的器官,对周围环境的变化比较敏感,在功能上也联系的非常紧密[21].植物叶片是营养元素利用的主要场所(利用端),而细根是植物直接从土壤中吸收营养元素的主要器官(汲取端),两者在很多性状上表现出相关性[22].关于细根和叶片生态化学计量特征的关系,两者主要保持正相关关系[23-24],原因与它们都是新陈代谢活跃的器官有关[25].此外,研究还发现根系和叶片之间N/P比值保持一致时,表明植物具有较好的内稳性,这种内稳性有效地保持了植物生命体内部的动态平衡[21].当某种元素限制植物的生长时,植物可通过多种生理生化机制改变该元素的可利用性和利用效率,从而维持机体的养分含量以及相关性状的稳定.因此,根系和叶片的N/P比值可反映植物是否适应其所在的生态系统而良好生长.然而,在三峡消落带的水文变动条件下,适生植物面对水淹逆境胁迫,是否能够稳定保持这种化学计量特征以及植物叶片与细根化学计量特征之间的内稳性关系,对于植物的适应性而言至关重要.
三峡工程作为世界上规模最大的水利工程,在蓄水发电、航运、防洪等方面发挥举足轻重作用[26],但是其形成了水位落差达30 m,面积达350 km2的消落带[27].由于绝大部分原有植物不能忍受消落带长时间高强度的反季节淹水胁迫[28-29],造成了库区植物大量消失、生物多样性降低以及生态系统退化等生态环境问题[30-31].研究表明,落羽杉(Taxodium distichum)对水淹胁迫环境有较好的耐受能力,在三峡库区消落带植被恢复重建方面具有重要的作用,是三峡库区消落带植被重建的优良树种之一[32].因此,本文以三峡库区消落带落羽杉叶片-细根为研究对象,探究叶片与细根C、N、P元素化学计量特征及其在两构件之间的关系,试图验证以下科学假设:1)三峡库区消落带水文节律下,不同水淹处理落羽杉叶片与细根的N/P比值具有一致性. 2)落羽杉叶片与细根间的生态化学计量特征具有显著相关性.旨在阐明落羽杉对水淹胁迫环境的生态适应机制.
1 材料与方法 1.1 试验地概况研究区域位于重庆市忠县石宝镇共和村汝溪河消落带植被修复示范基地,地理位置为30°03′~30°35′N, 107°32′~108°14′E,面积13.3 hm2,是三峡水库的腹心地带,属于长江一级支流. ≥10℃年积温5787℃,年均温18.2℃,年降雨量1200 mm,相对湿度80 %,无霜期341 d,日照时数1327.5 h,太阳总辐射能350 kJ/cm2,日照率29 %,属亚热带东南季风气候.示范基地原为弃耕梯田,2012年3~4月课题组利用前期研究筛选出适合在三峡库区消落带生长的木本植物落羽杉(Taxodium distichum)和池杉(Taxodium ascendens)进行人工林的重建.考虑到木本植物的耐受能力(165 m以下存活率较差),所有2年生落羽杉和池杉幼苗按照1 m×1 m的行间距交替种植于165~175 m海拔高程之间,树苗栽好后及时进行浇水1次,并在当年6月中旬进行人工除草,此后无人为干扰,自然生长.截止2018年7月试验开展采样时,落羽杉幼林已经历6个水位波动周期,且存活率为100 %,长势良好.
1.2 叶片和细根样品采集于2018年7月在三峡库区消落带试验样地165~175 m海拔进行实地数据测定,并基于三峡库区现行水位调度节律进行165 m(深度水淹组,淹水时间约170 d,DS)、170 m(中度水淹组,淹水时间约110 d,MS)和175 m(浅淹组,即对照,蓄水期间几乎无水淹,SS)3个海拔的采样.取样时,用测高杆测量落羽杉株高,用卷尺测量冠幅,用游标卡尺测量基径、胸径,见表 1.
| 表 1 不同水淹处理落羽杉生长特征* Tab. 1 Growth characteristic parameters of T. distichum under different submergence treatments |
在每个海拔高程内分别随机选取5株长势相近且健康的落羽杉进行标记取样.植物叶片的采集是分别设置东、西、南、北4个方向,选取每株植物中上部位健康成熟全展叶片,然后将所采下的叶片(约200 g)混匀后装入自封袋[33];细根的采集是用平板利铲在样方内以0.25 m半径等距离挖取落羽杉的细根,小心清理根系表面的土壤和杂质,最后将收集的根系混匀,四分法取足200 g装入自封袋[34].
1.3 叶片和细根样品指标测定所有植物样品冷藏保存并立刻带回实验室,用自来水和超纯水轻轻清洗干净,并置于烘箱,先105℃杀青30 min,然后65℃烘干(48~72 h)至恒重,将叶片和细根样品用莱驰MM400型球磨仪(Ball Mill, Germany)粉碎,装袋做好标记后,用于测定C、N、P元素含量.
叶片和细根样品的C和N元素含量采用元素分析仪(Elementar Vario EL, Germany)测定,即准确称量植物干样5 mg,用锡舟进行封装上机测定[35]. P元素含量采用电感耦合等离子体发射光谱仪(ICP-OES, Thermo Fisher iCAP 6300, UK)测定,即准确称量干样0.05 g于消解罐,分别加入硝酸8 mL、过氧化氢2 mL,微波消解仪(SpeedWave MWS-4, Germany)进行消解后定容至50 mL上机测定[36].
1.4 数据处理分析方法用Excel 2003和SPSS 22.0软件对测定的原始数据进行处理,采用单因素方差(One-way ANOVA)统计分析水淹处理对落羽杉叶片和细根C、N、P化学计量特征的影响,并用Duncan多重比较(Duncan’s multiple range test)进行显著性检验(α=0.05);采用独立样本T检验(Independent-samples t-test)统计分析同一水淹处理条件下落羽杉叶片与细根C、N、P化学计量特征之间的差异显著性;采用Pearson相关系数法分析叶片与细根C、N、P元素化学计量特征间的相关性;采用回归分析(Regression analysis)方程拟合叶片与细根C、N、P元素化学计量特征间的关系;最后用Origin 9.0软件制图.
2 结果 2.1 水淹处理对落羽杉叶片和细根C、N、P含量及化学计量比的影响单因素方差分析表明,水淹处理对落羽杉叶片与细根生态化学计量特征造成的影响不同(表 2).其中,叶片中的C、N、P含量及化学计量比均不受水淹处理的显著影响,细根中仅有N元素和C/N比值受到水淹处理的显著影响(P < 0.05).
| 表 2 水淹处理对落羽杉叶片和细根生态化学计量特征的影响 Tab. 2 Effects of submergence treatment on ecological stoichiometry in leaves and fine roots of T. distichum |
在不同的水淹处理条件下,落羽杉叶片与细根的C、N、P含量表现出不同的变化规律及差异显著性(图 1).落羽杉叶片C含量表现为SS组>DS组>MS组,且SS组叶片C含量比MS组显著提高1.90 % (P < 0.05,图 1a);细根C含量在不同水淹处理组之间均无显著性差异.叶片N含量表现为DS组>MS组>SS组的趋势,但各组之间均无显著性差异存在;而细根N含量表现为SS组>MS组>DS组,且SS组细根N含量比MS组和DS组分别显著提高32.84 %和39.44 % (P < 0.05,图 1b).叶片与细根P含量在不同水淹处理组之间均无显著性差异(图 1c),但细根N、P含量表现为DS组 < MS组 < SS组的协同增长趋势,叶片则表现为DS组>MS组>SS组的协同降低趋势.
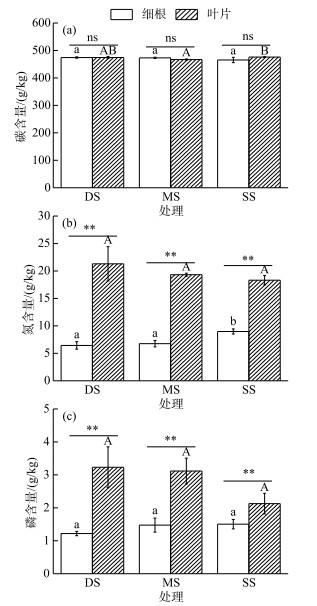
|
图 1 不同水淹处理落羽杉叶片和细根C、N、P含量
(图中的数据为平均值±标准误(n=5); 不同小写字母表示细根在不同水淹处理组间存在显著性差异(P < 0.05); 不同大写字母表示叶片在不同水淹处理组间存在显著性差异(P < 0.05); *表示同一水淹处理条件下不同构件之间有显著性差异(P < 0.05); **表示同一水淹处理条件下不同构件之间有极显著性差异(P < 0.01)) Fig.1 The C, N, and P contents in leaves and fine roots of T. distichum under different submergence treatments |
各水淹处理组叶片与细根C含量相比,均无显著性差异(图 1a).叶片N、P含量均极显著高于细根(各组P < 0.01,图 1b和1c),且N、P含量在叶片和细根有相似的变化趋势,叶片N、P含量分别约为细根N、P含量的3倍和2倍.
2.3 不同水淹处理对落羽杉叶片和细根C、N、P化学计量比的影响落羽杉叶片C/N比值在各水淹处理组之间的变化无显著性差异,细根C/N比值表现为DS组>MS组>SS组,且DS组和MS组细根C/N比值分别比SS组显著提高46.19 %和37.30 % (P < 0.05,图 2a).叶片C/P比值表现为SS组>DS组>MS组,且MS组叶片C/P比值比SS组显著降低35.24 % (P < 0.05,图 2b);细根C/P比值在各水淹处理组之间均无显著性差异,表现为DS组>MS组>SS组的趋势.叶片和细根N/P比值表现为SS组>DS组>MS组的趋势,且MS组叶片N/P比值比SS组显著降低29.13 % (P < 0.05,图 2c).
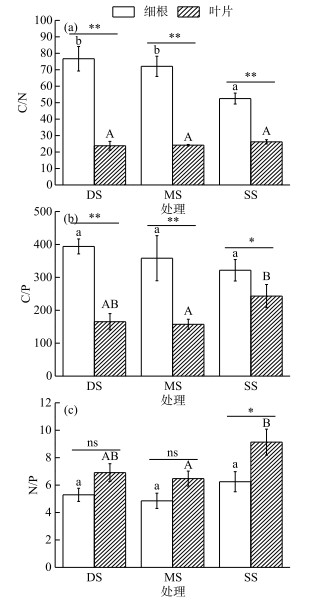
|
图 2 不同水淹处理落羽杉叶片与细根C、N、P化学计量比
(图中的数据为平均值±标准误(n=5); 不同小写字母表示细根在不同水淹处理组间存在显著性差异(P < 0.05); 不同大写字母表示叶片在不同水淹处理组间存在显著性差异(P < 0.05); *表示同一水淹处理条件下不同构件之间有显著性差异(P < 0.05); **表示同一水淹处理条件下不同构件之间有极显著性差异(P < 0.01)) Fig.2 The C, N, and P ratios in leaves and fine roots of T. distichum under different submergence treatments |
各水淹处理组的叶片C/N、C/P比值均显著或极显著低于细根(除SS组C/P比值P < 0.05外,其余P < 0.01,图 2a和2b).与之相反,叶片N/P比值均高于细根,但仅在SS对照组内有显著性差异(P < 0.05,图 2c),且其N/P比值相对恒定,均表现为SS组>DS组>MS组的趋势.
2.4 叶片和细根C、N、P含量及其化学计量比间的关系相关性分析表明,落羽杉叶片N含量与细根C/N比值呈显著正相关关系;叶片P含量与细根N含量、N/P比值呈显著负相关关系,与C/N比值呈极显著正相关关系;叶片C/P比值与细根N含量、N/P比值呈显著正相关关系,与C/N比值呈显著负相关关系;叶片N/P比值与细根N/P比值呈显著正相关关系(表 3).
| 表 3 落羽杉叶片与细根C、N、P化学计量特征间的相关性分析 Tab. 3 Correlation analysis of leaves and fine roots of T. distichum in C, N, and P contents and their ratios |
对具有显著相关关系的变量进一步拟合发现,落羽杉叶片P含量与细根N含量、N/P比值(图 3a和3f);叶片C/P比值与细根N含量、C/N比值(图 3b和3e)均能用非线性模型幂函数方程较好地拟合.而叶片N、P含量与细根C/N比值(图 3c和3d);叶片C/P、N/P比值与细根N/P比值(图 3g和3h)均能用线性方程较好地拟合.
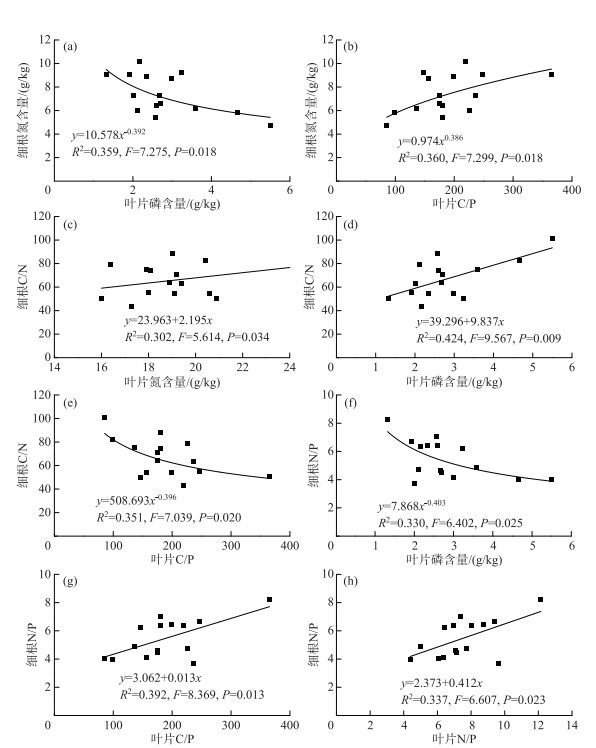
|
图 3 落羽杉叶片与细根C、N、P含量及其化学计量比的拟合方程 (R2表示决定系数;F值表示方差分析统计量;P值表示检验水平) Fig.3 The fitted equations of C, N, and P content and their ratios in leaves and fine roots of T. distichum |
在植物的生长过程中,细根吸收的C、N、P等营养物质会被输送到叶片等植物器官,而叶片利用这些营养物质合成ATP、光合器官及相应的酶等来进行光合作用,通过光合作用将固定的物质和能量又输送给细根等植物器官,从而保证植物正常的生理过程[19].因此,对三峡库区消落带落羽杉叶片与细根C、N、P生态化学计量特征以及二者之间生态化学计量的关联(内稳平衡)研究至关重要.
3.1 水淹对落羽杉叶片和细根C、N、P含量的影响总体来看,落羽杉叶片与细根中的元素含量均表现为C>N>P,主要原因是植物叶片与细根受相应器官组织结构及功能分化的影响[37],从而导致不同器官对营养元素的需求不同,这与大多数木本植物叶片和细根中的规律相似.叶片与细根C含量无显著性差异,比值约为1:1,说明落羽杉中C元素在叶片和细根中分配相对均衡,具有相对稳定性,不直接参与代谢等活动,主要参与植物的形态构建(结构性碳水化合物),是植物的结构性元素[3, 24].而对于植物非结构性碳水化合物中的C元素,其主要构成淀粉、葡萄糖等,参与植物生长及代谢过程中能量的供应过程[38].叶片N、P元素含量与落羽杉的光合作用密切相关,在一定的范围内,叶片N、P元素含量越高,其最大净光合速率就越高[39].本研究中叶片N、P元素含量均表现为DS组>MS组>SS组的趋势,这表明叶片的光合潜力未因淹水胁迫而降低,相反,淹水对其光能合成有一定的生态补偿作用[40],以此光合生态补偿来适应来年的淹水胁迫,这与贺燕燕等[41]研究不同水淹强度下池杉与落羽杉光合生理特性的结果相一致.然而,细根N、P元素含量趋势恰恰与叶片相反,表现为DS组 < MS组 < SS组的协同增长特征,表明冬季淹水胁迫对恢复期落羽杉细根N、P元素的吸收有一定的抑制作用,但由于落羽杉处于生长旺盛期,细根吸收的N、P元素主要输送到叶片内来进行光合作用所致[42],与“中等胁迫理论”[43]相符,即植物在自身耐性胁迫范围下会诱导生物体产生最大程度的耐受能力,这对其正常的生理活动有一定的促进效应.
研究表明,植物组织中的养分浓度可随植物的大小而被稀释[19].由于胁迫等极端的环境,根部的生物量会明显高于其他器官[44],稀释作用可能导致根部的N和P含量低于叶片.由于叶片主要与植物的光合作用有关,因此需要较高的N和P含量以增强植物的光合作用能力[45],本研究也得到了相似的结果.此外,叶片N、P元素含量分别约为细根N、P含量的3倍和2倍,与徐冰等[16]研究内蒙古锡林河流域65种植物叶片与细根N、P元素含量的结果有所差异,这主要是由于植物种类以及器官组织结构和功能分化的差异所致[37, 46].本文研究的实验对象是落羽杉乔木树种,耐水淹胁迫的能力较强,而徐冰等研究的内蒙古锡林河流域65种植物主要是草本植物.表明三峡库区消落带落羽杉叶片与细根的N、P元素含量差异较大,即在三峡库区消落带生态系统中,落羽杉细根吸收N、P等养分后对其养分的分配更倾向于叶片(地上部分),维持较高的叶片N、P元素含量,以完成植物正常的生理活动(生长和代谢)[1, 47],这可能是落羽杉为了适应淹水胁迫而表现出的生态策略.
3.2 水淹对落羽杉叶片和细根C、N、P化学计量比的影响植物的C、N、P化学计量比能够反映其在长期进化过程中对环境变化的适应[48]. C/N、C/P比值反映了植物N、P的养分利用效率[3],本研究中各水淹处理组落羽杉叶片C/N、C/P比值均显著或极显著低于细根,表明该消落带地区落羽杉细根具有较大的N、P养分利用率.一般来说,植物N、P元素在各种生物功能上紧密耦合,协同变化,导致N/P比值相对恒定[6, 49],本实验也得到了类似的结果.叶片和细根的N/P比值保持一致,相对恒定(维持在6左右),表明落羽杉的生命体内部特征相对稳定,以维持营养的动态平衡[21, 50].由此验证了我们前面提出的“三峡库区消落带水文节律下,不同水淹处理落羽杉叶片与细根的N/P比值具有一致性”这一科学假设.
植物组织中的N/P比值可以作为确定生态系统中养分限制的指标. Koerselman和Meuleman[51]、Niklas等[52]提出的N/P阈值理论认为植物N/P < 14表示受N元素限制;N/P>16表示受P元素限制;14 < N/P < 16之间时表示受N、P元素共同限制或2种元素都不缺少.本研究中,叶片N/P比值均高于细根,但仅有SS对照组内有显著性差异,且两者的变化趋势保持一致,比值相对恒定,均低于14,表明三峡库区消落带落羽杉的生长主要受N元素限制,且细根受影响较大.一般来说,植物细根的化学计量特征更直接地受到土壤养分的影响[25, 53],因为营养元素限制首先会在细根中表现,然后才在叶片中表现出来[21],本研究结果与之一致.虽然落羽杉受N元素的限制,但植物可能通过多种生理生化机制改变限制元素的有效性和利用效率,以维持自身的营养含量和相关性状的稳定性[48].
3.3 水淹条件下落羽杉叶片和细根C、N、P含量及其化学计量比间的关系叶片P含量与细根N含量呈显著负相关关系,并且两者的关系能通过幂函数较好地拟合,这是因为落羽杉处于生长旺盛期,细根除进行正常的生长和代谢外,大量的N、P元素需要输送到叶片来增加植物的光合能力[17],为接下来的冬季淹水和来年的退水恢复储存物质和能量,所以在植物生长旺盛期细根较叶片中的N、P元素含量会相对较低,与前面3个水淹处理组的叶片N、P含量均显著高于细根的结果相一致.反之,在冬季淹水期间落羽杉细根N含量高,叶片P含量低,原因是大量的N、P元素输送到细根中,从而降低植物的光合能力,表明落羽杉具有保守的生长策略,从而更好地适应水淹逆境.类似的,这也较好地解释了落羽杉叶片与细根其他N、P元素及其比值之间的相关性.
值得注意的是,叶片N/P比值与细根N/P比值呈显著正相关关系,且通过线性方程能很好地拟合,反映了落羽杉在生长和代谢过程中具有整体性,养分和光合产物在地上与地下部分之间的分配权衡,这应是落羽杉能够稳定生长的适应策略[19, 21].本研究结果与Kerkhoff等[19]、Liu等[23]的研究结果有所差异,主要原因在于落羽杉有不同的进化历史(生活型)和代谢方式[54],以及植物在种内水平上变异较小,具有较好的保守性[55],因此落羽杉叶片与细根间仅有N/P比值有显著正相关关系.虽然落羽杉叶片与细根某两种元素间可能无显著的相关性,但是植物两器官元素间可以通过相互耦合后而表现出显著相关性,表明落羽杉叶片与细根元素间有高度的协同关系.这在一定程度上较好地验证了我们前面提出的“落羽杉叶片与细根间的生态化学计量特征具有显著相关性”这一科学假设.
与N或P元素相比,叶片和细根N/P比值的化学计量动态平衡更适合评估植物的动态平衡状况,因为化学计量的动态平衡反映了生物体在生长期间对养分的消耗和养分的储存能力[56].对于植物的生长发育来说,在多变的环境中保持体内元素的稳定有利于生存[56]. N、P含量在叶片和细根中有相似的变化趋势,即N含量增减通常伴随着P含量的增减,这是由于各种生化成分和细胞成分中主要元素的耦合作用,使得这2种元素的N/P比值保持相对恒定[2],从而维持机体的养分含量以及相关性状的稳定,保证了落羽杉能够更快地对不同的营养状况作出反应[57].综上所述,叶片与细根N、P元素间相似的变化趋势和N/P比值化学计量平衡的结果表明,落羽杉能够积极响应和适应三峡消落带的水淹胁迫,是三峡库区消落带植被恢复与重建的优势树种之一.
4 结论1) 各水淹处理组落羽杉叶片与细根C含量无显著性差异,比值约为1:1;叶片N、P元素含量表现为DS组>MS组>SS组的趋势,细根N、P元素含量趋势恰恰与叶片相反.
2) 各水淹处理组落羽杉叶片C/N、C/P比值均显著低于细根;叶片N/P比值均高于细根,且叶片与细根N/P比值趋势保持一致,相对恒定.
3) 落羽杉的生长主要受N元素限制,但植株生长良好,与其生命体内部有较强的内稳性有关.
4) 叶片P含量与细根N含量呈显著负相关关系,且能通过幂函数较好地拟合;叶片与细根N/P比值呈显著正相关关系,且通过线性方程能很好地拟合.
综上所述,落羽杉光合产物和养分在叶片与细根之间的分配权衡,通过均衡叶片和细根C元素,保持N、P元素协同变化以及N/P比值的化学计量平衡等方式来保持植物体的内稳性,以此来适应和响应三峡消落带的水位变化.
| [1] |
Elser JJ, Bracken MES, Cleland EE et al. Global analysis of nitrogen and phosphorus limitation of primary producers in freshwater, marine and terrestrial ecosystems. Ecology Letters, 2007, 10(12): 1135-1142. DOI:10.1111/j.1461-0248.2007.01113.x |
| [2] |
Sterner RW, Elser JJ. Ecological stoichiometry:The biology of elements from molecules to the biosphere. Princeton:Princeton University Press, 2002. |
| [3] |
Ågren GI. Stoichiometry and nutrition of plant growth in natural communities. Annual Review of Ecology Evolution and Systematics, 2008, 39: 153-170. DOI:10.1146/annurev.ecolsys.39.110707.173515 |
| [4] |
Marklein AR, Houlton BZ. Nitrogen inputs accelerate phosphorus cycling rates across a wide variety of terrestrial ecosystems. New Phytologist, 2012, 193(3): 696-704. DOI:10.1111/j.1469-8137.2011.03967.x |
| [5] |
Zhang K, He MZ, Li XR et al. Foliar carbon, nitrogen and phosphorus stoichiometry of typical desert plants across the Alashan Desert. Acta Ecologica Sinica, 2014, 34(22): 6538-6547. [张珂, 何明珠, 李新荣等. 阿拉善荒漠典型植物叶片碳、氮、磷化学计量特征研究. 生态学报, 2014, 34(22): 6538-6547.] |
| [6] |
Güsewell S. N:P ratios in terrestrial plants:variation and functional significance. New Phytologist, 2010, 164(2): 243-266. |
| [7] |
Elser JJ, Sterner RW, Gorokhova E et al. Biological stoichiometry from genes to ecosystems. Ecology Letters, 2000, 3(6): 540-550. DOI:10.1046/j.1461-0248.2000.00185.x |
| [8] |
Fan HB, Wu JP, Liu WF et al. Linkages of plant and soil C:N:P stoichiometry and their relationships to forest growth in subtropical plantations. Plant and Soil, 2015, 392(1/2): 127-138. |
| [9] |
Han WX, Fang JY, Guo DL et al. Leaf nitrogen and phosphorus stoichiometry across 753 terrestrial plant species in China. New Phytologist, 2005, 168(2): 377-385. DOI:10.1111/j.1469-8137.2005.01530.x |
| [10] |
He JS, Wang L, Flynn DFB et al. Leaf nitrogen:phosphorus stoichiometry across Chinese grassland biomes. Oecologia, 2008, 155(2): 301-310. DOI:10.1007/s00442-007-0912-y |
| [11] |
Qi DH, Wen ZM, Wang HX et al. Stoichiometry traits of carbon, nitrogen, and phosphorus in plants of different functional groups and their responses to micro-topographical variations in the hilly and gully region of the Loess Plateau, China. Acta Ecologica Sinica, 2016, 36(20): 6420-6430. [戚德辉, 温仲明, 王红霞等. 黄土丘陵区不同功能群植物碳氮磷生态化学计量特征及其对微地形的响应. 生态学报, 2016, 36(20): 6420-6430.] |
| [12] |
Chen YH, Han WX, Tang LY et al. Leaf nitrogen and phosphorus concentrations of woody plants differ in responses to climate, soil and plant growth form. Ecography, 2013, 36(2): 178-184. DOI:10.1111/j.1600-0587.2011.06833.x |
| [13] |
Song YT, Zhou DW, Li Q et al. Leaf nitrogen and phosphorus stoichiometry in 80 herbaceous plant species of Songnen grassland in Northeast China. Chinese Journal of Plant Ecology, 2012, 36(3): 222-230. [宋彦涛, 周道玮, 李强等. 松嫩草地80种草本植物叶片氮磷化学计量特征. 植物生态学报, 2012, 36(3): 222-230.] |
| [14] |
Yang K, Huang JH, Dong D et al. Canopy leaf N and P stoichiometry in grassland communities of Qinghai-Tibetan Plateau, China. Chinese Journal of Plant Ecology, 2010, 34(1): 17-22. [杨阔, 黄建辉, 董丹等. 青藏高原草地植物群落冠层叶片氮磷化学计量学分析. 植物生态学报, 2010, 34(1): 17-22.] |
| [15] |
Xu LY, Tian DL, Wang GJ et al. N and P stoichiometry of Koelreuteria paniculata leaf and soil in Xiangtan Manganese Mine wasteland. Acta Ecologica Sinica, 2014, 34(9): 2316-2322. [徐露燕, 田大伦, 王光军等. 湘潭锰矿栾树叶片和土壤N、P化学计量特征. 生态学报, 2014, 34(9): 2316-2322.] |
| [16] |
Xu B, Chen YX, Gan HJ et al. Correlations between leaf and fine root traits among and within species of typical temperate grassland in Xilin River Basin, Inner Mongolia, China. Chinese Journal of Plant Ecology, 2010, 34(1): 29-38. [徐冰, 程雨曦, 甘慧洁等. 内蒙古锡林河流域典型草原植物叶片与细根性状在种间及种内水平上的关联. 植物生态学报, 2010, 34(1): 29-38.] |
| [17] |
Wang XJ, Xiao D, Zhang K et al. Leaf and root N:P stoichiometry for common plants in a natural broadleaved Korean pine forest in Northeast China. Chinese Journal of Ecology, 2015, 34(12): 3283-3288. [王晓洁, 肖迪, 张凯等. 凉水天然阔叶红松林植物叶片与细根的N:P化学计量特征. 生态学杂志, 2015, 34(12): 3283-3288.] |
| [18] |
Eviner VT, Chapin FS Ⅲ. Functional matrix:a conceptual framework for predicting multiple plant effects on ecosystem processes. Annual Review of Ecology, Evolution and Systematics, 2003, 34: 455-485. DOI:10.1146/annurev.ecolsys.34.011802.132342 |
| [19] |
Kerkhoff AJ, Fagan WF, Elser JJ et al. Phylogenetic and growth form variation in the scaling of nitrogen and phosphorus in the seed plants. American Naturalist, 2006, 168(4). |
| [20] |
Norby RJ, Jackson RB. Root dynamics and global change:seeking an ecosystem perspective. The New Phytologist, 2000, 147(1): 3-12. DOI:10.1046/j.1469-8137.2000.00676.x |
| [21] |
Liu XZ, Zhou GY, Zhang DQ et al. N and P stoichiometry of plant and soil in lower subtropical forest successional series in southern China. Chinese Journal of Plant Ecology, 2010, 34(1): 64-71. [刘兴诏, 周国逸, 张德强等. 南亚热带森林不同演替阶段植物与土壤中N、P的化学计量特征. 植物生态学报, 2010, 34(1): 64-71.] |
| [22] |
Withington JM, Reich PB, Oleksyn J et al. Comparisons of structure and life span in roots and leaves among temperate trees. Ecological Monographs, 2006, 76(3): 381-397. DOI:10.1890/0012-9615(2006)076[0381:COSALS]2.0.CO;2 |
| [23] |
Liu GF, Freschet GT, Pan X et al. Coordinated variation in leaf and root traits across multiple spatial scales in Chinese semi-arid and arid ecosystems. New Phytologist, 2010, 188(2): 543-553. DOI:10.1111/j.1469-8137.2010.03388.x |
| [24] |
Ning ZY, Li YL, Yang HL et al. Carbon, nitrogen and phosphorus stoichiometry in leaves and fine roots of dominant plants in Horqin Sandy Land. Chinese Journal of Plant Ecology, 2017, 41(10): 1069-1080. [宁志英, 李玉霖, 杨红玲等. 科尔沁沙地主要植物细根和叶片碳、氮、磷化学计量特征. 植物生态学报, 2017, 41(10): 1069-1080.] |
| [25] |
Yuan ZY, Chenhan YH, Reich PB. Global-scale latitudinal patterns of plant fine-root nitrogen and phosphorus. Nature Communications, 2011, 2: 344. DOI:10.1038/ncomms1346 |
| [26] |
Zhu NN, Qin AL, Guo QS et al. Spatial heterogeneity of plant community in Zigui and Wushan typical hydro-fluctuation belt of Three Gorges Reservoir areas. Forest Research, 2015, 28(1): 109-115. [朱妮妮, 秦爱丽, 郭泉水等. 三峡水库巫山-秭归段典型消落带植被空间分异研究. 林业科学研究, 2015, 28(1): 109-115.] |
| [27] |
Chen FQ, Xie ZQ. Reproductive allocation, seed dispersal and germination of Myricaria laxiflora, an endangered species in the Three Gorges Reservoir area. Plant Ecology, 2007, 191(1): 67-75. |
| [28] |
Zhang QF, Lou ZP. The environmental changes and mitigation actions in the Three Gorges Reservoir region, China. Environmental Science and Policy, 2011, 14(8): 1132-1138. DOI:10.1016/j.envsci.2011.07.008 |
| [29] |
Fan DY, Xiong GM, Zhang AY et al. Effect of water-lever regulation on species selection for ecological restoration practice in the water-level fluctuation zone of Three Gorges Reservoir. Chinese Journal of Plant Ecology, 2015, 39(4): 416-432. [樊大勇, 熊高明, 张爱英等. 三峡库区水位调度对消落带生态修复中物种筛选实践的影响. 植物生态学报, 2015, 39(4): 416-432.] |
| [30] |
Wu JG, Huang JH, Han XG et al. The Three Gorges Dam:an ecological perspective. Frontiers in Ecology and the Environment, 2004, 2(5): 241-248. DOI:10.1890/1540-9295(2004)002[0241:TTGDAE]2.0.CO;2 |
| [31] |
Tan SD, Wang Y, Zhang QF. Environmental challenges and countermeasures of the water-level-fluctuation zone (WLFZ) of Three Gorges Reservoir. Resources and Environment in the Yangtze Basin, 2008, 17(S1): 101-105. [谭淑端, 王勇, 张全发. 三峡水库消落带生态环境问题及综合防治. 长江流域资源与环境, 2008, 17(S1): 101-105.] |
| [32] |
Li CX. Studies on the physiological adaptability of suitable tree species under simulation of soil dynamic submergence of the hydro-fluctuation belt in the Three Gorges Reservoir area[Dissertation]. Chongqing: Southwest University, 2006. [李昌晓.三峡库区消落带适生树种在淹水变化条件下的生理生化适应性研究[学位论文].重庆: 西南大学, 2006. ]
|
| [33] |
Yan ER, Wang XH, Zhou W. N:P stoichiometry in secondary succession in evergreen broad-leaved forest, Tiantong, east China. Journal of Plant Ecology, 2008, 32(1): 13-22. |
| [34] |
Guo DL, Mitchell RJ, Hendricks JJ. Fine root branch orders respond differentially to carbon source-sink manipulations in a longleaf pine forest. Oecologia, 2004, 140(3): 50-57. |
| [35] |
Ma WC, Liu Y, Zhou C et al. Effect of water-level change on nutritional characteristics of Taxodium distichum in the hydro-fluctuation belt of the Three Gorges Reservoir. Acta Ecologica Sinica, 2017, 37(4): 1128-1136. [马文超, 刘媛, 周翠等. 水位变化对三峡库区消落带落羽杉营养特征的影响. 生态学报, 2017, 37(4): 1128-1136.] |
| [36] |
Spohn M, Widdig M. Turnover of carbon and phosphorus in the microbial biomass depending on phosphorus availability. Soil Biology and Biochemistry, 2017, 113: 53-59. DOI:10.1016/j.soilbio.2017.05.017 |
| [37] |
Minden V, Kleyer M. Internal and external regulation of plant organ stoichiometry. Plant Biology, 2014, 16(5): 897-907. DOI:10.1111/plb.12155 |
| [38] |
Li MH, Xiao WF, Wang SG et al. Mobile carbohydrates in Himalayan treeline trees I. Evidence for carbon gain limitation but not for growth limitation. Tree Physiology, 2008, 28(8): 1287-1296. DOI:10.1093/treephys/28.8.1287 |
| [39] |
Domingues TF, Meir P, Feldpausch TR et al. Co-limitation of photosynthetic capacity by nitrogen and phosphorus in West Africa woodlands. Plant Cell and Environment, 2010, 33(6): 959-980. DOI:10.1111/j.1365-3040.2010.02119.x |
| [40] |
Ling ZR. The growth and photosynthetic physiological recovery of Taxodium 'Zhongshansha' and their parents after different submergence[Dissertation]. Nanjing: Nanjing University, 2016. [凌子然.不同程度水淹对中山杉及亲本生长与光合生理恢复的影响[学位论文].南京: 南京大学, 2016. ]
|
| [41] |
He YY, Wang CY, Yuan ZX et al. Photosynthetic characteristics of Taxodium ascendens and Taxodium distichum under different submergence in the hydro-fluctuation belt of the Three Gorges Reservoir. Acta Ecologica Sinica, 2018, 38(8): 2722-2731. [贺燕燕, 王朝英, 袁中勋等. 三峡库区消落带不同水淹强度下池杉与落羽杉的光合生理特性. 生态学报, 2018, 38(8): 2722-2731.] |
| [42] |
Tian D, Li P, Fang WJ et al. Growth responses of trees and understory plants to nitrogen fertilization in a subtropical forest in China. Biogeosciences, 2017, 14(14): 1-19. |
| [43] |
Chang J, Ge Y eds. Ecology. Hangzhou: Zhejiang University Press, 2001. [常杰, 葛滢. 生态学. 杭州: 浙江大学出版社, 2001.]
|
| [44] |
Hong JT, Wang XD, Wu JB. Variation in carbon, nitrogen and phosphorus partitioning between above- and belowground biomass along a precipitation gradient at Tibetan Plateau. Journal of Mountain Science, 2016, 13(4): 661-671. DOI:10.1007/s11629-014-3117-y |
| [45] |
Ma XX, Hong JT, Wang XD. C:N:P stoichiometry of perennial herbs' organs in the alpine steppe of the northern Tibetan Plateau. Journal of Mountain Science, 2019, 16(9): 2039-2047. DOI:10.1007/s11629-018-5299-1 |
| [46] |
Zeng CS, Zhang LH, Tong C. Seasonal dynamics of nitrogen and phosphorus in Phragmites australis and Spartina alterniflora in the wetlands of Min River Estuary. Wetland Science, 2009, 7(1): 16-24. [曾从盛, 张林海, 仝川. 闽江河口湿地芦苇和互花米草氮、磷养分季节动态. 湿地科学, 2009, 7(1): 16-24.] |
| [47] |
Chapin FS. The mineral nutrition of wild plants. Annual Review of Ecology and Systematics, 1980, 11(1): 233-260. DOI:10.1146/annurev.es.11.110180.001313 |
| [48] |
Hessen DO, Ågren GI, Anderson TR et al. Carbon, sequestration in ecosystems:the role of stoichiometry. Ecology, 2004, 85(5): 1179-1192. DOI:10.1890/02-0251 |
| [49] |
Yu Q, Elser JJ, He NP et al. Stoichiometric homeostasis of vascular plants in the Inner Mongolia grassland. Oecologia, 2011, 166(1): 1-10. DOI:10.1007/s00442-010-1902-z |
| [50] |
Chen LL, Deng Q, Yuan ZY et al. Age-related C:N:P stoichiometry in two plantation forests in the Loess Plateau of China. Ecological Engineering, 2018, 120: 14-22. DOI:10.1016/j.ecoleng.2018.05.021 |
| [51] |
Koerselman W, Meuleman AFM. The vegetation N:P ratio:a new tool to detect the nature of nutrient limitation. Journal of Applied Ecology, 1996, 33(6): 1441-1450. DOI:10.2307/2404783 |
| [52] |
Niklas KJ, Owens T, Reich PB et al. Nitrogen/phosphorus leaf stoichiometry and the scaling of plant growth. Ecology Letters, 2005, 8(6): 636-642. DOI:10.1111/j.1461-0248.2005.00759.x |
| [53] |
Gordon WS, Jackson RB. Nutrient concentrations in fine roots. Ecology, 2000, 81(1): 275-280. DOI:10.1890/0012-9658(2000)081[0275:NCIFR]2.0.CO;2 |
| [54] |
Novotny AM, Schade JD, Hobbie SE et al. Stoichiometric response of nitrogen-fixing and non-fixing dicots to manipulations of CO2, nitrogen, and diversity. Oecologia, 2007, 151(4): 687-696. DOI:10.1007/s00442-006-0599-5 |
| [55] |
Mccarthy MC, Enquist BJ. Consistency between an allometric approach and optimal partitioning theory in global patterns of plant biomass allocation. Functional Ecology, 2007, 21(4): 713-720. DOI:10.1111/j.1365-2435.2007.01276.x |
| [56] |
Blouin M, Mathieu JM, Leadley PW. Plant homeostasis, growth and development in natural and artificial soils. Ecological Complexity, 2012, 9: 10-15. DOI:10.1016/j.ecocom.2011.11.001 |
| [57] |
Bai XJ, Wang BR, An SS et al. Response of forest species to C:N:P in the plant-litter-soil system and stoichiometric homeostasis of plant tissues during afforestation on the Loess Plateau, China. Catena, 2019, 183: 104186. DOI:10.1016/j.catena.2019.104186 |
 2020, Vol. 32
2020, Vol. 32 

