(2: 农业农村部珠江中下游渔业资源环境科学观测实验站, 广州 510380)
(2: Scientific Observing and Experimental Station of Fishery Resources and Environment in Middle and Lower Reaches of Pearl River, Ministry of Agriculture and Rural Affairs, Guangzhou 510380, P. R. China)
广东鲂(Megalobrama terminalis)属鲤科(Cyprinidea),鲌亚科(Cultrinae),鲂属(Megalobrama),是我国重要食用经济鱼类之一,为大型江河洄游性鱼类,生活于水体的中下层,杂食性,产粘性卵,主要分布于珠江中下游、海南万泉河以及部分陆河河流[1-2].广东鲂作为珠江中下游江段主要渔业捕捞对象之一,在渔获数量比例可达44.1 % [3].历史资料表明,1960s仅封开境内鱼汛期广东鲂捕捞量达20 t,但是由于水利工程、航道疏浚、水体污染、过度捕捞等多重人类活动因素的叠加影响,1980s,广东鲂资源量衰退至5 t左右[4].目前,珠江干流已进行了11级的水利梯级开发,珠江干流最下游一级的水电站长洲水利枢纽于2007年实现截流蓄水.由于长洲坝水利枢纽修建阻隔了广东鲂的洄游通道,导致其在水坝上游江段数量急剧下降[2].而广东鲂生殖洄游行为作为其生活史中关键的环节之一,受到水温、涨水条件等因素影响.目前,研究发现广东鲂在珠江最大的产卵场分布在郁南罗旁江段和封开青皮塘两个江段位于长洲水利枢纽下游约30 km处[1, 5].每年大量广东鲂亲鱼在性成熟后会洄游至产卵场进行产卵繁殖,随着长洲水利枢纽截流蓄水,导致下游产卵场江段的水文节律发生改变,必定会对广东鲂产卵场的功能及广东鲂产卵繁殖造成负面影响[3].近年来,广东省航道局对西江航道进行通航能力整治,工程主要对丁坝进行加长、加高,并对阻碍航行的一些礁石进行了清除,施工水域也集中在两个重要的广东鲂产卵场水域,直接导致广东鲂产卵场生境被迫改变.同样人类活动增强导致的西江水体污染也是影响广东鲂栖息生境的重要因素之一.农业部于2007年在青皮塘下游江段建立了西江广东鲂国家级水产种质资源保护区,并于2011年起在珠江水系实施禁渔期制度调整,扩大珠江水系禁渔水域范围并延长禁渔期时间,广东鲂资源衰退趋势有所减缓.因此,广东鲂种群资源的养护努力与人类活动的干扰胁迫一直处于持续并存状态.
据历史资料记载,广东鲂生殖群体4月进入繁殖高峰,形成渔汛,4-8月为其产卵繁殖期[6].目前,对广东鲂的研究多在早期资源、资源捕捞量、食性、产卵场生态调查、性腺发育等方面[6-9].而对长洲水利枢纽建成后,广东鲂繁殖策略的研究很少.其繁殖现状如何以及繁殖特性是否发生适应性改变尚不清楚.因此本研究以广东鲂为对象,通过对其繁殖群体特征以及繁殖策略进行研究,结合自身和外在的影响因素,探究广东鲂对于日益增强的人为干扰的繁殖生态学响应机制,以期为今后开展其资源的保护以及可持续利用提供必要的提供科学依据和理论支撑.
1 材料与方法 1.1 样本采集 1.1.1 渔获物采样2017年4月-2018年3月,每月通过向渔民购买以及流刺网捕捞等方式,共获得广东鲂渔获物443尾标本.采样点如图 1所示.对其体长进行测量(精度1 mm),用电子天平称量体重(精度1 g).根据刘亚秋等[9]对广东鲂性腺发育研究以及已有的部分鱼类性腺分期方法[10-11],同时结合广东鲂性腺形态、大小、色泽及性细胞的成熟情况,对其性腺发育进行分期.

|
图 1 西江广东鲂采样点位置 Fig.1 Location of sampling sites of M. terminalis in Xijiang River |
2017年4-10月在肇庆江段利用定量弶网定点进行连续鱼苗样品采集(参照《河流漂流性鱼卵、仔鱼采样技术规范》(SC/T 9407-2012)水产行业标准),采样点位于肇庆市高要区禄步镇(23°9′53″N, 112°16′57″E,图 1).固定点连续采样参照李跃飞等[12]的方法进行.利用LS45-2型旋杯式流速仪(重庆华正水文仪器有限公司)测量网口流速,鱼苗样品用5 %甲醛溶液固定后,带回实验室进行鉴定.鱼苗鉴定依据广东鲂胚后发育特征[13]和实验室对野生广东鲂鱼苗的观察图谱资料.径流量数据来自水利部全国水雨情信息网站(http://xxfb.Hydroinfo.gov.cn/ssIndex.html).
1.2 初次性成熟体长、体重以及年龄鱼类性腺发育至IV期及以上为性成熟个体,根据Tafur等[14]的研究,对鱼类的初次性成熟体长为该鱼类50 %个体达到性成熟时的体长,通过Logistics方程Pi= 100/[1+e(a+bLi)]分别对雌雄个体进行统计拟合,雌雄鱼初次性成熟体长L50 % =-a/b,式中Pi为第i组成熟个体占组内样本的相对频率,Li 为第 i组体长组中值(mm),a和b为常数.初次性成熟体重根据体长(L)与体重(W)的关系式W = c Ld推算,其中c和d为常数.根据何美峰等[15]的研究,广东鲂初次性成熟年龄根据Lt =420.175(1-e-0.217(t+0.371)),进行推算,其中t为年龄,Lt为对应下体长.
1.3 性比分别将所有个体以每20 mm体长间距一组,并统计每组内雌雄个体各占百分比,分析不同体长组下雌雄鱼的性别比例.
1.4 繁殖季节性腺成熟指数和肥满度比较广东鲂性腺成熟指数和肥满度的周年变化趋势.性腺成熟指数(gonadosomatic index,GSI) % =(W1/W0)×100,肥满度(Fulton's condition factor, K)=W/L3×100.式中,W为鱼体体重,W1为鱼体性腺重,W0为鱼体空壳重.采用Pearson's correlation coefficients对广东鲂L、W、W1、GSI、K各项指数进行相关性分析[16].
1.5 繁殖力绝对繁殖力F(粒)为每克卵巢卵粒数与卵巢重(g)的乘积,相对繁殖力Fw(粒/g)=F/W0,其中W0为鱼体空壳重, g.
1.6 鱼苗量的计算方法每次采集时间内流经采样断面的鱼苗总量根据M=Q ·m/(S ·V)求得.式中,M为采集时间内流经采样断面的鱼苗总量,ind.;Q为采样点断面的平均流量, m3/s;m为采集时间内采集到的鱼卵、仔鱼数量, ind.;S为弶网网口面积, m2;V为弶网网口处水流速度, m/s.采样时间内每小时流经采样断面的鱼苗数量乘以24 h,求得当天鱼苗总量;鱼苗月平均密度由各月采集的所有样品鱼苗密度求平均值获得;根据每月各天鱼苗总量求平均值乘以当月天数,求得月鱼苗总量[17].
1.7 数据分析利用SPSS 19.0软件对数据进行相关统计分析,同一年龄组的雌雄群体体长、体重平均值差异用T 检验来分析,雌雄群体曲线关系通过协方差分析(ANCOVA)来比较,采用χ2检验来判断雌雄性比是否符合1 :1.
2 结果分析 2.1 广东鲂繁殖群体特征 2.1.1 体长和体重分布情况共采集广东鲂443尾,其中可鉴别雌性的个体419尾,雌鱼220尾,雄鱼199尾,此部分个体的体长范围为160~360 mm,平均体长245 mm,优势体长集中在260~280 mm,占样本量的45.1 %;体重范围为52~1149 g,平均体重为347 g,优势体重集中在320~480 g之间,占样本量的46.9 % (图 2).

|
图 2 西江广东鲂体长和体重组成(n=419) Fig.2 The body length and weight of M. terminalis in Xijiang River (n=419) |
对广东鲂雌雄个体分布做体长-体重曲线,拟合生长曲线呈幂函数关系,如图 3所示,雌性群体的回归方程为W=0.000007L3.2152 (R2=0.9527),雄性群体的回归方程为W=0.00001L3.0597(R2=0.9219).将雌、雄群体曲线关系进行协方差分析(ANCOVA),雌、雄繁殖群体间存在显著差异(F=21.469,P < 0.001).
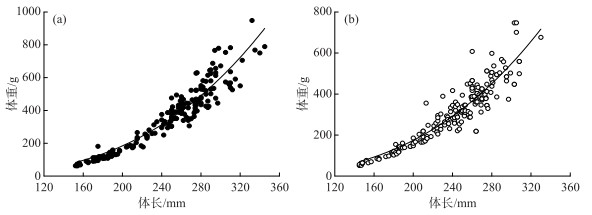
|
图 3 西江广东鲂体长与体重的关系(a:雌性;b:雄性) Fig.3 Relationships between body length and body weight of M. terminalis (a: female; b: male) |
获得标本443尾,其中24尾性别无法确定.获得220尾雌性和199尾雄性可识别广东鲂标本,雌雄性比为1.105 :1(χ2=3.74,P>0.05).大多数雄性广东鲂的体长都集中在200~240 mm(图 4).在体长160~320 mm范围内,随着体长增加,雌雄比例呈现出先下降后上升的变化趋势.
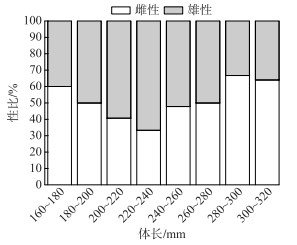
|
图 4 不同体长组广东鲂雌雄性比 Fig.4 Sex ratios of M. terminalis in different body length groups |
广东鲂雌性性成熟体长的Logistic曲线分别为Pi=100/[1+e(15.89-0.06499x)](R2=0.9856),雄性为Pi=100/[1+e(15.12-0.06514x)] (R2=0.9564)(图 5),雌性初次性成熟体长L50 % =244.5 mm,根据体长-体重关系推算体重为334.3 g,雄性初次性成熟体长L50 % =232.2 mm,根据体长-体重关系推算体重为173.3 g,根据体长与年龄之间的关系推算雌性初次性成熟年龄为3.6龄,雄性初次性成熟年龄为3.3龄.
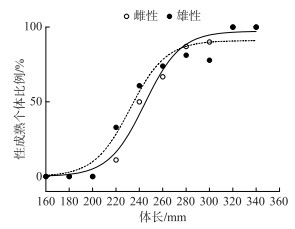
|
图 5 西江广东鲂初次性成熟体长 Fig.5 Body length at first maturity of M. terminalis in Xijiang River |
广东鲂的性腺发育周年变化如图 6所示. 1-3月广东鲂卵巢发育期主要为Ⅱ和Ⅲ期;4-5月广东鲂迅速成熟以Ⅳ和Ⅴ期卵巢为主;6月Ⅳ期卵巢占比下降而Ⅵ期卵巢占比上升至33.3 %;7-8月Ⅳ期卵巢占比上升;9和10月广东鲂卵巢发育期均为Ⅱ~Ⅲ期,Ⅱ期卵巢占比分别达到84.2 %和68.8 %;11和12月广东鲂基本以Ⅱ期卵巢为主(图 6a). 1-3月广东鲂精巢以Ⅱ和Ⅲ期为主,并在3月出现少量Ⅳ期;Ⅳ期精巢在4月最为突出,占85.7 %;5-6月,Ⅳ精巢占比显著下降,而Ⅵ精巢占比逐渐增高;6月达到峰值50.0 %;随后7-9月Ⅵ精巢占比显著下降,Ⅱ和Ⅲ期精巢占比显著升高. 9-12月广东鲂卵巢发育期大部分为Ⅱ~Ⅲ期精巢(图 6b);总体可以看出,4-8月为广东鲂主要的繁殖季节,6-7月为其繁殖产卵高峰期.
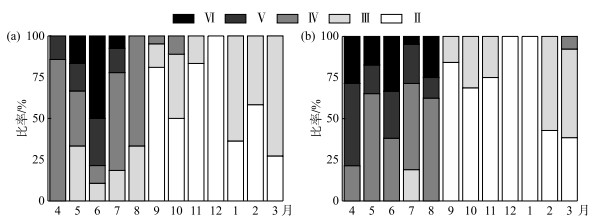
|
图 6 西江广东鲂雌性(a)和雄性(b)个体每月不同发育期占比变化 Fig.6 Maturity stage frequency by month for female (a) and male (b) of M. terminalis in Xijiang River |
广东鲂雌性群体在4月GSI达到最高,随后逐渐下降并在6-8月出现小幅度波动,8月后广东鲂雌性群体GSI快速下降,10月至次年1月广东鲂雌性个体GSI均处于较低水平,1月后呈现逐渐上升趋势(图 7a). 4-10月,雌性广东鲂K均呈现逐渐下降的变化趋势,并在10月降至最低水平后逐渐上升至次年3月(图 7a).雄性广东鲂群体GSI和K的变化趋势与雌性类似(图 7b).

|
图 7 西江广东鲂雌性(a)和雄性(b)个体性腺成熟指数和肥满度的周年变化 Fig.7 Monthly variation for females (a) and males (b) of the mean and standard error of gonadosomatic index and Fulton's condition factor for M. terminalis in Xijiang River |
广东鲂卵巢成熟系数与性腺重呈极显著相关(P < 0.01),与肥满度以及体重显著相关(P < 0.05),而与体长的相关性不强;肥满度与体重、性腺重也呈极显著相关(P < 0.01),而与体长的相关性不强(P>0.05,表 1).这说明广东鲂卵巢成熟系数与卵巢发育显著相关,而与鱼个体生长发育的相关性不强.广东鲂精巢成熟系数与体重及肥满度显著相关(P < 0.05),与性腺重极显著相关(P < 0.01),与体长的相关性不强;肥满度与体重呈显著相关(P < 0.05),与性腺重的相关性不强,与体长呈显著负相关(P < 0.05,表 2).这说明广东鲂精巢在发育过程中,性腺成熟系数及肥满度变化与精巢及鱼体自身的发育情况紧密相关.
| 表 1 广东鲂卵巢各指数的相关性分析(n=40) Tab. 1 Correlation coefficients of each index in the ovary of M. hoffmanni(n=40) |
| 表 2 广东鲂精巢各指数的相关性分析(n=40) Tab. 2 Correlation coefficients of each index in the testis of M. hoffmanni(n=40) |
计算87尾雌鱼的繁殖力,其中绝对繁殖力为30665~148937粒,平均为73069粒.相对繁殖力为82.6~226.9粒/g,平均为118.7粒/g.广东鲂绝对繁殖力随体长和体重的增加而增加,均呈线性相关(图 8).绝对繁殖力F与体长L的相关方程为F=721.01L-144063.38(R2=0.4502),绝对繁殖力F与体重W的相关方程为F=104.6W -50.78(R2=0.5601).
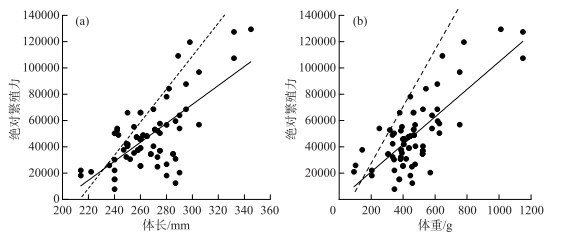
|
图 8 西江广东鲂绝对繁殖力与体长(a)和体重(b)的关系(虚线表示1980s历史记录[7]) Fig.8 The relationship between fecundity and body length (a), body weight (b) for M. terminalis in Xijiang River (The dotted line shows the historical records of the 1980s[7]) |
珠江中下游肇庆江段4月平均水温已达到22.3℃,4-10月水温呈现出先上升后下降的变化趋势,变化范围为22.3~30.1℃.广东鲂鱼苗最早发生在4月中旬,最晚发生在10月中旬.珠江中下游广东鲂鱼苗呈现明显季节变化规律,集中出现再5-8月,密度呈现出先上升后下降的变化趋势,并在6和7月出现大规模鱼苗量,广东鲂鱼苗总量分别占当月鱼苗总量的14.9 %和10.1 %. 4-10月肇庆江段径流量变化呈现先上升后下降的趋势,6月达到最高,与广东鲂鱼苗平均密度的变化趋势存在显著正相关关系(P < 0.05,图 9).
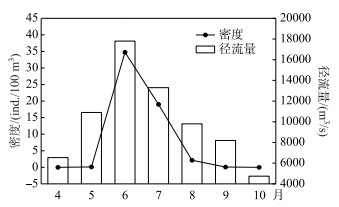
|
图 9 西江广东鲂鱼繁殖期每月鱼苗平均密度与径流量 Fig.9 Discharge and density of M. terminalis larvae by month in Xijiang River |
鱼类性成熟的一般受到物种繁殖潜力、繁育期和繁殖规模等因素影响,而其种群遗传学特征以及外界环境因子直接决定了其初次性成熟年龄和大小[18-20].有研究发现,不同区域鱼类种群性成熟年龄以及产卵模式随其所处的气候、栖息地环境的变化而发生适应性改变[21-23].广东鲂初次性成熟年龄为3~4龄,且雄性成熟早于雌性.不同鱼类初次性成熟年龄存在差异显著,有的物种需要十年或更长时间才能成熟.有国外学者研究发现,鱼类初次性成熟年龄是物种繁殖潜力的决定因素,其影响因素包括生育期的长短和再生产种群的大小[23]. Trippel等[24]研究发现在外界环境压力不断变化的情况下对于鱼体成熟体长具有高度可塑性.随着外界捕捞压力、食物来源、捕食者的丰富度等因素的改变,鱼类初次性成熟体长也随之改变[25-26].有学者认为,对于诱导精子发生,外界激素较自身遗传有更强的干预效果[27].与历史资料比较[6],本研究发现广东鲂雌性初次性成熟体长明显减小.这可能是由于广东鲂为了适应过渡捕捞等人类活动而对其繁殖行为做出了适应性调整.有研究发现捕捞压力、捕食者的丰度、饵料食物供应和种群构成等生物因素和非生物因素都是影响鱼类种群的年龄和性成熟的典型代表[21, 28].
3.2 产卵模式与繁殖策略鱼类通过进化出属于自己特有的繁殖策略以适应环境变化.这些繁殖策略主要是为了保证繁殖群体在有限的能量和寿命下最大化繁殖可用的后代[29].鱼类繁殖力作为对外界环境的一种适应性补偿,被广泛用于评估繁殖群体繁殖能力大小[29].研究中发现,西江广东鲂的平均绝对繁殖力为73069粒,较历史记录的131024粒[6]下降了44.2 %.有研究发现饵料丰度、捕捞压力、水文节律等环境因子易导致鱼类繁殖力发生改变[28, 30-31].鱼体的生长是性腺生长发育的前提和基础,但是性腺的生长发育会影响鱼体的生长[16].对广东鲂雌鱼来说,成熟系数与性腺重、肥满度以及体重密切相关,而与体长相关性不强.这可能是由于在卵巢发育过程中其摄食增加,体重上升,营养物质不断积累,为以后发育做准备.广东鲂雄鱼精巢也类似的特点.广东鲂雄鱼肥满度与体长呈现出负相关的趋势,这是由于生长中的广东鲂体重增长的趋势放缓,由于体长增加,所以肥满度略有下降.解剖时发现,在2月份已成熟的广东鲂的脂肪含量较高,而到4月时,脂肪含量显著降低,这与能量的贮备和分解有关.广东鲂繁殖群体这一现象也验证了其性腺发育需要耗大量能量.本研究发现,广东鲂的GSI在4月显著升高,达到全年峰值.这可能是由于4月,随着水温升高,大量达到Ⅲ期性腺的广东鲂迅速成熟,并洄游至罗盘和青皮塘产卵场集群. Reichard等[32]对鲤科鱼类繁殖的研究发现,鱼类性腺成熟主要受到水温影响. GSI在6月快速下降,而广东鲂鱼苗发生量出现高峰.这是由于6月径流量显著升高,大量Ⅳ和V期广东鲂受到洪水刺激,产卵繁殖形成苗讯.这与李跃飞等[12]对珠江禁渔期延长后广东鲂鱼苗量变化趋势相符.有研究发现,四大家鱼、黄尾鲴、鱤等鲤科鱼类的产卵繁殖对水文环境有一定的要求,需要洪水的刺激才能产卵繁殖[17, 33-35].
3.3 广东鲂的资源保护这项研究通过更新广东鲂主要生殖特征,对其繁殖群体生殖潜力的估计以及生产力的评估,有助于了解广东鲂的生活史现状.近年来,西江建设新的水电站,受到挖沙采石、航道疏浚、过度捕捞等人类活动干扰,鱼类产卵繁殖栖息地减少,性成熟群体数量下降[36]. Chen等[2]对珠江水系广东鲂种群遗传多样性进行研究发现,西江广东鲂种群遗传多样性出现一定程度的下降.随着珠江流域禁捕的严格执行,广东鲂资源下降趋势减缓,但较历史时期仍然有明显的下降[4].刘亚秋等[9]发现广东鲂为一次性产卵江河洄游性鱼类.本研究发现广东鲂主要繁殖期集中在4-8月,产卵高峰出现在6-7月,这与历史上报道的西江广东鲂在4和7月存在两个产卵高峰期不一致[1, 6]. 1980s珠江干流仅有1座大中型水电站,1990s建成水电站已增加至6座,截止2010年已有包括长洲水利枢纽在内的10座大中型梯级水坝建成,西江干流肇庆江段洪峰数量逐渐减少,且主要集中在6-7月之间[17],这与本研究对肇庆江段径流量的监测结果吻合.西江干流长州水利枢纽梯级水利工程等建成,加剧了干流水文节律改变,导致了刺激广东鲂繁殖产卵的洪峰时间滞后以及次数减少. 2014年广东省航道制定了航道扩能升级项目建议,西江航道将由2000 t扩至3000 t级的规模,航道宽度和深度都将扩大,施工水域集中在广东鲂产卵场水域,工程改变产卵场主要水流方向及流速的变化,礁石清除后紊流环境的减少也会对产卵场功能造成一定的影响.李跃飞等[37]的研究发现西江广东鲂种群资源已过度开发, 处于补充型捕捞过度和生长型捕捞过度状态, 且可能存在幼鱼补充失败的危险.有研究发现西江广东鲂的产卵场及珠江三角洲水质污染状况日益加重,这可能是导致西江广东鲂自然死亡系数增大的原因之一[37-39].水利工程、航道整治、过度捕捞以及水体污染等多重因素的叠加影响胁迫广东鲂为适外界环境而改变其繁殖策略.有学者研究发现高强度人为干扰会导致鱼类生态对策发生演变[40-41].鉴于广东鲂的资源现状,加强监管,限制针对幼鱼和繁殖亲鱼的捕捞,根据广东鲂雌性初次性成熟体长限制广东鲂开捕体长,以保障广东鲂繁殖群体数量.同时在广东鲂繁殖高峰期,释放生态流量,确保产卵的水文需求,加强产卵场的修复和栖息地的保护,切实有效地增加资源量,保护广东鲂性成熟群体.
| [1] |
Feng QX, Wang JX, You BZ et al. Investigation report of spawing site of Megalobrama terminalis. Freshwater Fishery, 1986, 6: 1-5. [冯启新, 王金潮, 尤炳赞等. 广东鲂产卵场调查报告. 淡水渔业, 1986, 6: 1-5.] |
| [2] |
Chen WT, Chen FC, Li YF et al. Phylogeographic analyses of a migratory freshwater fish (Megalobrama terminalis) reveal a shallow genetic structure and pronounced effects of sea level changes. Gene, 2020, 737: 1-10. |
| [3] |
Tang XC, Tao JP, Huang DM et al. A preliminary assessment of fish migration through the Changzhou Fishway. Journal of Hydroecology, 2013, 34(4): 58-62. [谭细畅, 陶江平, 黄道明等. 长洲水利枢纽鱼道功能的初步研究. 水生态学杂志, 2013, 34(4): 58-62.] |
| [4] |
Wang JC, Huang YW. The age and growth of Guangdong Bream (Megalobrama hoffmanni) in the Pearl River with reference to its maximum sustaining yield. Journal of Fisheries of China, 1990, 14(4): 313-320. [王金潮, 黄毅文. 珠江广东鲂的年龄、生长及其最大持续渔获量. 水产学报, 1990, 14(4): 313-320.] |
| [5] |
Tang XC, Li XH, Lin JZ et al. Ecological differentiation between two breeding populations of Megalobrama hoffmanni in the Pearl River based on hydro-acoustic research. Acta Ecologica Sinica, 2009, 29(4): 1756-1762. [谭细畅, 李新辉, 林建志等. 基于水声学探测的两个广东鲂产卵群体繁殖生态的差异性. 生态学报, 2009, 29(4): 1756-1762. DOI:10.3321/j.issn:1000-0933.2009.04.016] |
| [6] |
You BZ, Feng QX, Wang JX et al. A study on reproductive biology of Megalobrama terminalis in Xijiang River. Freshwater Fishery, 1987, 5: 7-11. [尤炳赞, 冯启新, 王金潮等. 西江广东鲂繁殖生物学的初步研究. 淡水渔业, 1987, 5: 7-11.] |
| [7] |
Wang C, Li XH, Lai ZN et al. The study on community structure difference of phytoplankton in two Megalobrama hoffmannispawning grounds of Xijiang River. Guangdong Agricultural Sciences, 2010, 37(4): 156-160. [王超, 李新辉, 赖子尼等. 西江两个广东鲂产卵场浮游植物群落差异分析. 广东农业科学, 2010, 37(4): 156-160. DOI:10.3969/j.issn.1004-874X.2010.04.051] |
| [8] |
Xia Y, Li J, Li Y et al. Small-subunit ribosomal DNA sequencing analysis of dietary shifts during gonad maturation in wild black Amur bream (Megalobrama terminalis) in the lower reaches of the Pearl River. Fisheries Science, 2017, 83(6): 955-965. DOI:10.1007/s12562-017-1123-z |
| [9] |
Liu YQ, Li XH, Li YF et al. A histological study on gonadal development of black amur bream (Megalobrama terminalis). South China Fisheries Science, 2019, 15(1): 113-118. [刘亚秋, 李新辉, 李跃飞等. 广东鲂性腺发育组织学研究. 南方水产科学, 2019, 15(1): 113-118.] |
| [10] |
Liu J. Reproductive physiology of farmed fish in China. Beijing: Agriculture Press, 1993. [刘筠. 中国养殖鱼类繁殖生理学. 北京: 农业出版社, 1993.]
|
| [11] |
Zhang Y, Luo Q, He XF. Studies the development and annul change in the ovary and breeding habits of a freshwater catfish. Zoological Research, 1994, 15(2): 42-48. [张耀光, 罗泉笙, 何学福. 长吻鮠的卵巢发育和周年变化及繁殖习性研究. 动物学研究, 1994, 15(2): 42-48.] |
| [12] |
Li YF, Li XH, Yang JP et al. Effect of Pearl River closed fishing on Megalobrama hoffmanni recruitment stock. Journal of Fisheries of China, 2014, 38(4): 502-508. [李跃飞, 李新辉, 杨计平等. 珠江禁渔对广东鲂资源补充群体的影响分析. 水产学报, 2014, 38(4): 502-508.] |
| [13] |
Tan XC, Li YF, Pang SX et al. Post embryonic development of Megalobrama hoffmanni. Journal of Zoology, 2008, 43(2): 111-115. [谭细畅, 李跃飞, 庞世勋等. 广东鲂的胚后发育. 动物学杂志, 2008, 43(2): 111-115.] |
| [14] |
Tafur R, Villegas P, Rabi M et al. Dynamics of maturation, seasonality of reproduction and spawning grounds of the jumbo squid Dosidicus gigas (Cephalopoda:Ommastrephidae) in Peruvian waters. Fisheries Research, 2001, 54(1): 33-50. |
| [15] |
He MF, Li XH, Tan XC et al. Age determination and the grow of Megalobrama hoffmanni in Xijiang River. Freshwater Fishery, 淡水渔业, 2016, 37(3): 54-58.
|
| [16] |
Zhao JR. Study on reproductive biology of Discogobio yunnanensis[Dissertation].Chongqing: Southwest University, 2018. [赵健蓉.云南盘鮈繁殖生物学研究[学位论文].重庆: 西南大学, 2018. ]
|
| [17] |
Li YF, Li XH, Tan XC et al. Occurrence and interannual variability of larval Xenocyprininae in the mid and lower reaches of the Pearl River. Journal of Fishery Sciences of China, 2013, 20(4): 128-135. [李跃飞, 李新辉, 谭细畅等. 珠江中下游鲴亚科鱼苗发生规律与年际变化. 中国水产科学, 2013, 20(4): 128-135.] |
| [18] |
Schreibman MP, Kallman KD. The genetic control of the pituitary-gonadal axis in the platyfish, Xiphophorus maculatus. Journal of Experiment Zoology, 1977, 200: 277-293. |
| [19] |
Wild V, Simianer H, Gjoen H et al. Genetic-parameters and genotypes environment interaction for early sexual maturity in Atlantic salmon (Salmo salar). Aquaculture, 1994, 128: 51-65. |
| [20] |
Sinovcic G, Kec VC, Zorica B. Population structure, size at maturity and condition of sardine, Sardina pilchardus (Walb., 1792), in the nursery ground of the eastern Adriatic Sea (Krka River Estuary, Croatia).. Estuarine Coastal and Shelf Science, 2008, 76(4): 739-744. |
| [21] |
Neves A, Vieira AR, Sequeira V et al. Insight on reproductive strategy in Portuguese waters of a commercial protogynous species, the black seabream, Spondyliosoma cantharus, (Sparidae). Fisheries Research, 2018, 206: 85-95. |
| [22] |
Liu HP, Liu YC, Liu S et al. Fecundity and reproductive strategy of Ptychobarbus dipogon populations from the middle reaches of the Yarlung Zangbo River. Acta Hydrobiologica Sinica, 2018, 42(6): 1169-1179. |
| [23] |
Vieira AR, Sequeira V, Neves A et al. Reproductive strategy of forkbeard, Phycis phycis, from the Portuguese coast. Helgoland Marine Research, 2016, 70(1): 1-15. DOI:10.1186/s10152-016-0455-x |
| [24] |
Trippel EA. Age at maturity as a stress indicator in fisheries. Bioscience, 1995, 45: 759-771. |
| [25] |
Wootton RJ. Ecology of Teleost fishes. Landon: Champman and Hall, 1990.
|
| [26] |
Zhou XJ. Study on the biology and population dynamics of Schizothorax waltoni[Dissertation]. Wuhan: Huazhong Agricultural University. 2014. [周贤俊.拉萨裂腹鱼个体生物学和种群动态研究[学位论文].武汉: 华中农业大学, 2014. ]
|
| [27] |
Zanuy S, Carrillo M, Mateos J et al. Effects of sustained administration of testosterone in pre-pubertal sea bass (Dicentrarchus labrax L.). Aquaculture, 1999, 177: 21-35. |
| [28] |
Gao XC, Wei J, Bai YQ et al. Reproductive Biology of Hypophthalmichthys molitrix in the Yichang of the Yangtze River. Journal of Zoology, 2018, 53(2): 198-206. [郜星晨, 姜伟, 白云钦等. 长江宜昌段鲢的繁殖生物学特征. 动物学杂志, 2018, 53(2): 198-206.] |
| [29] |
Roff DA. Evolution of life histories:Theory and analysis. New York: Chapman & Hall, 1992.
|
| [30] |
Kennedy J, Nash R, Slotte A et al. The role of fecundity regulation and abortive maturation in the reproductive strategy of Norwegian spring-spawning herring (Clupea harengus). Marine Biology (Berlin), 2011, 158(6): 1287-1299. DOI:10.1007/s00227-011-1648-0 |
| [31] |
Yi BL, Yu ZT, Liang Y. Distribution, size and natural conditions of spawning grounds of grass, silver, silver and bighead in the Yangtze river. Wuhan:Hubei Publishers of Science and Technology, 1988, 1-46. [易伯鲁, 余志堂, 梁秩燊. 长江干流草、青、鲢、鳙四大家鱼产卵场的分布、规模和自然条件. 武汉:湖北科学技术出版社, 1988, 1-46.] |
| [32] |
Reichard M, Jurajda P. Seasonal dynamics and age structure of drifting cyprinid fishes:an inter specific comparison. Ecology of Freshwater Fish, 2007, 16(4): 482-492. |
| [33] |
Xie WX, Huang DM, Xie S et al. The early evolution of the four major Chinese carps resources in the middle and lower reaches of Hanjiang River after the construction and operation of Danjiangkou Reservoir. Journal of Hydroecology, 2009, 2(2): 44-49. [谢文星, 黄道明, 谢山等. 丹江口水利枢纽兴建后汉江中下游四大家鱼等早期资源及其演变. 水生态学杂志, 2009, 2(2): 44-49.] |
| [34] |
Duan X, Liu S, Huang M et al. Changes in abundance of larvae of the four domestic Chinese carps in the middle reach of the Yangtze River, China, before and after closing of the Three Gorges Dam. Chinese Fishes, 2009, 86(1): 13-22. |
| [35] |
Li YF, Li XH, Yang JP et al. Status of Elopichthys bambusa recruitment stock after the impoundment of Changzhou Hydro-junction in Pearl River. J Lake Sci, 2015, 27(5): 917-924. [李跃飞, 李新辉, 杨计平等. 珠江干流长洲水利枢纽蓄水后珠江鳡鱼(Elopichthys bambusa)早期资源现状. 湖泊科学, 2015, 27(5): 917-924. DOI:10.18307/2015.0519] |
| [36] |
Li J, Li XH, Tan XC et al. Species diversity of fish community of Provincial Xijiang River Rare Fishes Natural Reserve in Zhaoqing City, Guangdong Province. J Lake Sci, 2009, 21(4): 556-562. [李捷, 李新辉, 谭细畅等. 广东肇庆西江珍稀鱼类省级自然保护区鱼类多样性. 湖泊科学, 2009, 21(4): 556-562. DOI:10.18307/2009.0415] |
| [37] |
Li YF, Li C, Zhu SL et al. Exploitation status of Megalobrama terminalis based on analysis of SBR and YPR models in Xijiang River. Acta Hydrobiologica Sinica, 2018, 42(5): 975-983. [李跃飞, 李策, 朱书礼等. 基于单位补充量模型的西江广东鲂种群资源利用现状评价. 水生生物学报, 2018, 42(5): 975-983.] |
| [38] |
Yang WL, Lai ZN, Wei TL et al. Water environment situation of natural spawning grounds of Megalobrama hoffmanniin Xijiang River. Reservoir Fisheries, 2004, 24(5): 59-61. [杨婉玲, 赖子尼, 魏泰莉等. 西江广东鲂天然产卵场的水环境现状. 水利渔业, 2004, 24(5): 59-61.] |
| [39] |
Zeng YY, Lai ZN, Yang WL et al. Multivariate statistical analysis of heavy metals in water from the Pearl River watershed, South China. Fresenius Environmental Bulletin, 2017, 26(5): 3350-3357. |
| [40] |
Zhu XG, Fang YY, Yan LJ et al. The ecological strategy evolution of marine fishes under high intensity fishing environment. Bulletin Science and Technology, 2009, 25(1): 51-55. [朱晓光, 房元勇, 严力蛟等. 高捕捞强度环境下海洋鱼类生态对策的演变. 科技通报, 2009, 25(1): 51-55.] |
| [41] |
Tan XC, Li YF, Li XH et al. The status of fish spawning ground in the East River with cascade dams' duress. J Lake Sci, 2012, 24(3): 443-449. [谭细畅, 李跃飞, 李新辉等. 梯级水坝胁迫下东江鱼类产卵场现状分析. 湖泊科学, 2012, 24(3): 443-449. DOI:10.18307/2012.0317] |
 2021, Vol. 33
2021, Vol. 33 

