(2: 中国科学院大学中国-丹麦科教中心, 北京 100049)
(3: 河海大学水文水资源学院, 南京 210098)
(4: 武汉市规划设计有限公司, 武汉 430000)
(2: Sino-Danish Centre for Education and Research (SDC), University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
(3: Hydrology and Water Resources College, Hohai University, Nanjing 210098, P. R. China)
(4: Wuhan Planning and Design Co., LTD., Wuhan 430000, P. R. China)
贫营养深水湖泊的沿岸带通常都很窄,沉水植物难以分布到很宽的范围;但高的透明度和强烈变化的水深梯度营造出的多样化小生境,又为沉水植物群落发展提供了良好的基础,因此常常具有非常高的物种丰富度和生物量. 当水体营养盐浓度稍微提高时,沉水植物群落就能够迅速发展并不断发生结构变化[1-2].
抚仙湖位于云南省中部,水域面积211 km2,最大水深155 m,是我国第二深的淡水湖泊,也是我国I类优质水储量最大的湖泊,目前整体上依然处于贫营养状态,仅沿岸带局部水域呈现中营养状态[3]. 抚仙湖是地堑式断陷构造形成的深水湖泊,水深10 m以内的水域仅占全湖面积的4.1 %,其余湖床坡度陡峭且为坚硬的岩石,植物无法扎根. 因此,在理论上,适合大型水生植物分布的最大沿岸带面积仅有8.65 km2[4].
1957年黎尚豪等[5]对抚仙湖进行调查时,发现抚仙湖沿岸带透明度高达7.8~8.5 m,但沉水植物分布零星且面积极小,苦草为优势种,马来眼子菜、穗花狐尾藻和黑藻等为主要伴生种. 1978-1980年,中国科学院南京地理与湖泊研究所[4]对抚仙湖进行全湖调查,发现沉水植物9种,在沿岸带仍呈零星分布状态,分布面积不超过0.2 km2,总生物量约400 t. 自1980s开始,抚仙湖沿岸带氮、磷营养盐浓度大幅度上升;2000年开始控制外源污染之后上覆水氮、磷营养盐浓度出现下降的趋势[3]. 但在此期间,沉水植物的调查比较缺乏. 2000年以后的多次调查显示,抚仙湖沉水植物分布面积和生物量有显著的增加,其中2003-2005年[6],全湖沉水植物分布面积为3.19 km2,总生物量为1.95×104 t,物种数目也增加到了12种;2012年物种数在9~11种之间[7];2015年沉水植物分布区面积约为5.07 km2[8],全湖生物量约为1.3×104 t,沉水植物在原有种类的基础上,出现了外来物种伊乐藻. 以上研究表明,抚仙湖沉水植被在1980s之前发展缓慢,2000年之后迅猛发展,分布面积、物种丰富度、生物量和群落结构都呈现出显著的年际变化. 以往相隔几年才进行一次的调查频率显然不能满足对抚仙湖沉水植物群落动态的掌握,需要进行密集的追踪调查.
以往的调查是不同研究者单独进行的,缺少对长期群落动态的趋势分析;也基本采用小样方调查的传统方法,对全湖植物分布情况掌握不足. 为了深入了解抚仙湖沉水植物群落现状和发展趋势,于2016年7月10-20日,依托中国科学院南京地理与湖泊研究所抚仙湖高原深水湖泊研究站,对抚仙湖沉水植物进行了详细的调查,并结合以往的研究结果,对其群落结构和变化趋势进行分析. 本研究在样方调查的基础上,结合遥感图像反演沉水植物分布面积;在表征沉水植物群落特征时增加了多样性指数的计算. 此外,相比以往的研究,增加了对沉水植物影响较大的丝状附着藻的分布和生物量的调查,以期更为精确和全面地反映沉水植物群落现状. 本研究将有助于深入了解抚仙湖沉水植物群落动态变化及其影响因素,为深水湖泊沉水植被保护和管理提供理论参考.
1 材料与方法 1.1 调查方法2016年7月围绕抚仙湖沿岸带,每隔2 km左右布设一个垂直于岸线的采样带,一共布设36条样带. 沿每条采样带从沿岸向湖心每隔10 m布设1个样点,如果植被区宽度低于10 m,则选择岸边沉水植物群落的中心位置,即群落生物量和多样性都最高的地方进行采样(图 1). 由于抚仙湖沉水植物分布带狭窄,大部分采样带宽度低于30 m,最宽也不超过100 m,部分样带甚至无沉水植物分布,因此全湖仅采集41个样点. 跟以往的采样相比,样点较少,但样带更多,以期更连续地了解环抚仙湖沿岸带沉水植被状况. 在植冠未达到水面的样点,使用重锤和绳尺测量水深和沉水植物冠层高度;使用手柄可延长的双刀片水下镰刀采集深水区沉水植物(镰刀直径0.5 m,采样面积约0.196 m2). 在岸边水深不超过1 m的样点,快艇无法靠近,采样人员跳入水中使用面积为0.5 m×0.5 m的铝制样方框确定采样区域,徒手采集样方框内所有的植物. 采集到的沉水植物洗去泥沙,装进塑料袋,封口后做好标记带回实验室.
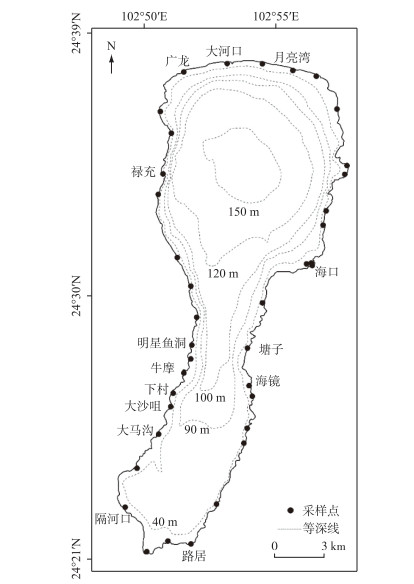
|
图 1 抚仙湖沉水植物采样点分布示意 Fig.1 Distribution diagram of submerged macrophytes sampling sites in Lake Fuxian |
另外随机调查了沿岸带丝状附着藻(下文简称丝状藻)的生物量分布情况,分别在无植被区(无沉水植物,丝状藻附着在石头或沙子等基质上)取6个样、稀疏植被区(1~2 m水域,丝状藻附着在沉水植物及其下的基质上)取6个样、稠密植被区(2~4 m水域,丝状藻附着在沉水植物植冠上,下面的基质上因缺少光照而没有丝状藻)取4个样.
同时测定抚仙湖沿岸带湖水理化指标,其中总氮(TN)浓度用过硫酸钾氧化法测得,平均值为(0.439±0.220) mg/L;总磷(TP)浓度用钼酸铵分光光度法测得,均值为(0.059±0.028) mg/L;使用透明度盘测得透明度,平均值为(4.1±1.2) m.
1.2 实验室处理采集的沉水植物样品带回实验室,用自来水洗去沉水植物上附着的泥沙、底栖动物、附着藻类和其他杂物,沥干浮水,分类后称取鲜重,并分别计算不同种类沉水植物的生物量. 采集到的丝状藻样品,带回实验室后先将丝状藻从沉水植物表面以及基质上分离后,再冲洗干净,沥干水分,称取鲜重,并分别计算3种类型取样区域内丝状藻的生物量. 本研究还将深水区沉水植物从冠层开始向下垂直分割,每隔20 cm分割成一段,获取丝状藻生物量沿沉水植物垂直高度的分布规律.
1.3 数据获取及分析基于2016年8月18日资源一号卫星04星(CBERS-04)的20 m空间分辨率的多光谱相机(MUX)数据,选择波段7(0.63~0.69 μm)和波段8(0.77~0.89 μm)计算归一化植被指数NDVI(normalized difference of vegetation index)指数[9],即:
| $ N D V I=(N I R-R) /(N I R+R) $ | (1) |
式中, NIR为近红外波段,R为红光波段.
根据野外实测数据获取NDVI判断阈值,获取抚仙湖水生植被分布区域,从而计算抚仙湖全湖沉水植物分布面积. 统计每个样点各种植物的鲜重及总重,与样方面积相除,获得沉水植物单个物种和每个样点的生物量,并计算整个沉水植物分布区平均生物量,与植物全湖分布面积相乘,获得全湖沉水植物总生物量. 计算每种植物在所有样点的出现频率百分比(频度).
陆生植物常常使用数量密度计算多样性指数,但沉水植物绝大部分是克隆植物,多通过分枝而不是增加株数的方式来扩大种群生物量. 因此,在本文中依据Jeppesen等[10]的方法,使用生物量计算沉水植物的优势度和多样性指数. 用相对生物量(RB)与相对频度(RF)来计算物种的优势度(DV),即:
| $ D V=\left(R_{\mathrm{B}}+R_{\mathrm{F}}\right) / 2 \times 100 \% $ | (2) |
用香农-威纳多样性指数(H′)计算沉水植物多样性,即:
| $ H^{\prime}=-\sum\limits_{i=1}^{s} \frac{b_{i}}{b} \ln \frac{b_{i}}{b} $ | (3) |
式中,bi为群落中i种沉水植物的生物量;b为群落中所有沉水植物的生物量之和;S为该群落总物种数.
在ArcGIS软件中绘制抚仙湖沉水植物分布范围图,在Excel软件中分析数据并作图.
2 结果 2.1 抚仙湖沉水植物群落现状 2.1.1 沉水植物分布面积与现存量2016年7月,抚仙湖沿岸带沉水植物分布面积为5.14 km2,占湖泊总面积的2.4 %,占理论上适合大型水生植物分布的最大沿岸带面积的59.4 %. 其中,抚仙湖北岸、东北部到海口镇、西南部从胡家湾到秦家山、西部明星鱼洞和牛摩等区域的沉水植物分布带较宽.
抚仙湖沿岸带沉水植物生物量平均为9.8 kg/m2,最高生物量出现在西岸大马沟附近,高达48.7 kg/m2(表 1). 西岸明星鱼洞和牛摩、西北岸广龙、大河口和东南部沿岸区域生物量也较高. 东北部沿岸区域沉水植物生物量最低. 抚仙湖沿岸带沉水植物总现存量(鲜重)为5.02×104 t.
| 表 1 抚仙湖各区域沉水植物群落生物量、Shannon-Wiener多样性指数和优势物种 Tab. 1 The biomass, Shannon-Wiener diversity index and dominant species of submerged macrophyte communities in Lake Fuxian |
抚仙湖各样点沉水植物H′介于0.05~1.28之间,全湖沉水植物H′平均值为0.75(表 1);西岸的H′普遍高于东、南和北岸,H′最大值也出现在西岸. 此次共调查到沉水植物13种,包括:金鱼藻(Ceratophyllum demersum L.)、黑藻(Hydrilla verticillata (Linn. f.) Royle)、穗花狐尾藻(Myriophyllum spicatum L.)、微齿眼子菜(Potamogeton maackianus A. Benn.)、伊乐藻(Elodea nuttallii (Planch.) H.St. John)、轮藻类(Characeae)、苦草(Vallisneria natans (Lour.) H. Hara)、篦齿眼子菜(Potamogeton pectinatus L.)、光叶眼子菜(Potamogeton lucens L.)、小眼子菜(Potamogeton pusillus L.)、穿叶眼子菜(Potamogeton perfoliatus L.)、马来眼子菜(P. malaianus Miq.)和菹草(Potamogeton crispus L.). 其中,平均生物量最大的物种是金鱼藻,高达7.13 kg/m2,最小的是菹草,仅0.004 kg/m2(图 2). 在41个样点中,出现频率最高的是穗花狐尾藻,频度为78 %;最低的是菹草,仅2.44 %. 13个物种中,穗花狐尾藻的优势度最高,达29 %;菹草的优势度最低,不足1 %.
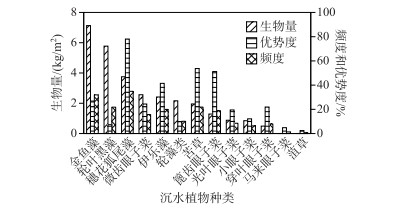
|
图 2 抚仙湖沉水植物生物量、优势度与频度 Fig.2 The biomass, dominance index and frequency of submerged macrophytes in Lake Fuxian |
抚仙湖苦草平均冠层高度达1.2 m,穗花狐尾藻、穿叶眼子菜、伊乐藻和金鱼藻等群丛平均冠层高度均在3~4 m之间(图 3).
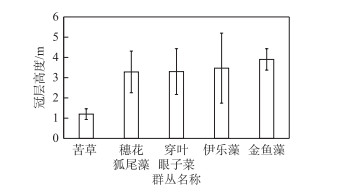
|
图 3 抚仙湖主要沉水植物群丛冠层高度 Fig.3 Canopy height of main submerged macrophyte groups in Lake Fuxian |
本次调查发现,丝状藻在抚仙湖沿岸带水深4 m以内的水域中大量分布. 丝状藻生物量呈现深水植被区>浅水植被区>浅水植被区基质>无植被区基质的规律. 相对于基质,附着在沉水植物上的丝状藻生物量更大(表 2). 在无植被区,丝状藻附着在石头和沙子上;在浅水植被区,丝状藻在植物冠层和基质上均有分布,被附着的植物包括光叶眼子菜、穗花狐尾藻、篦齿眼子菜、轮藻类、苦草和伊乐藻等;在2~4 m的较深植被区,丝状藻附着在植物冠层,被附着的植物主要是穗花狐尾藻.
| 表 2 抚仙湖沿岸带丝状附着藻生物量分布 Tab. 2 Biomass distribution of filamentous algae in the littoral zone of Lake Fuxian |
在较深水域的植被区,沿穗花狐尾藻植冠的垂直方向上,丝状藻生物量呈现从上到下递减的趋势(图 4). 在顶端的20 cm植冠内,丝状藻的生物量占附着在植物体上的总生物量的38.7 %,约为此段植冠内穗花狐尾藻生物量的2.7倍. 在40 cm植冠内,丝状藻的生物量占附着在植物体上的总生物量的57.9 %. 但随着植冠垂直深度增加,丝状藻附着在植物体上的生物量迅速下降,120 cm以下不再有丝状藻附着.

|
图 4 丝状附着藻沿沉水植物植冠垂直高度的分布 Fig.4 Distribution of filamentous algae along apical height of submerged macrophytes |
抚仙湖沉水植物群落在1957-1980年处于发育初期阶段,物种少、生物量和分布面积都极低[4-5]. 20世纪的后20年缺乏沉水植物调查数据. 自2000年开始,沉水植物物种数、生物量和分布面积开始逐渐增加(图 5)[11-13]. 到2005年,沉水植物物种数达到12种,跟1980年相比,全湖总生物量增加近48倍,分布面积增加近15倍[6, 14]. 2010年之后,沉水植物物种数变化不大,但生物量和分布面积却大幅度增加[6-7],2016年的分布面积和全湖总生物量分别是2005年的1.6和2.6倍.
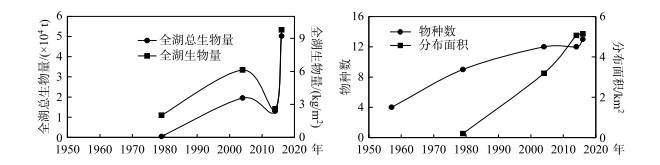
|
图 5 抚仙湖沉水植物生物量、物种数和分布面积多年变化 Fig.5 Changes of the biomass, species number and distribution area of submerged macrophyte in Lake Fuxian over years |
在1957-2005年间,抚仙湖的沉水植物优势种以苦草、穗花狐尾藻和眼子菜科植物为主(表 3)[11-15]. 2005-2015年间,轮藻类的优势度不断增加,金鱼藻和黑藻也逐渐成为优势种[11-15]. 但至2016年,沉水植物群落结构发生较大变化,优势种演变为黑藻、金鱼藻、苦草、穗花狐尾藻和伊乐藻等植物,轮藻类已经失去优势地位. 眼子菜科的沉水植物种类变化显著. 最早仅发现1种(马来眼子菜),之后出现了微齿眼子菜、篦齿眼子菜、光叶眼子菜、小眼子菜、穿叶眼子菜、扭叶眼子菜和菹草7种眼子菜科的沉水植物[7-8]. 多年来,抚仙湖沉水植物的最优势种类沿着苦草-眼子菜科植物-轮藻类-金鱼藻+穗花狐尾藻的趋势演变,总体从低矮的草甸型植物为主演变成以高大的冠层型植物为主. 此外,外来物种伊乐藻自从2014年第一次调查发现后,到2016年已经成为次优势种.
| 表 3 1957-2016年抚仙湖沉水植物群落结构变化 Tab. 3 Community structure changes of submerged macrophytes in Lake Fuxian during 1957-2016 |
对抚仙湖沉水植物历年的调查是不同的研究者所为,所使用的采样工具也有差别,采样时节的差异也会导致结果出现很大偏差. 如赵海光等[8]的调查是在2015年冬、春季(4月)进行,沉水植物尚处于营养生长初期,因此全湖生物量数据低于其他夏季调查获得的数据. 我们在调查中也发现,抚仙湖大部分沿岸带宽度不超过30 m,生物量和多样性最高的地方往往在水深2~4 m的水域,宽度不超过10 m,因此即使在样带上每隔10 m采集一个样点,也有可能错过群落最高生物量和多样性的地点,导致评估出的群落生物量数据偏低;虽然我们在宽度不足10 m的地方仅仅采集生物量和多样性最高的地方,以平衡其他样点低估的生物量,但很可能对全湖生物量的评估依然存在较大误差. 然而,现有的资料足以表明,60年来抚仙湖沉水植物分布面积、生物量、物种数和群落冠层高度都呈现明显的增加趋势.
沉水植物群落在湖泊中的发展深受水下光照的影响[10, 16-17]. 以往的研究表明,沉水植物可以生长的水深一般为透明度的2~2.5倍[11]. 在2000年之前,抚仙湖平均透明度在6~8 m之间,沉水植物可以分布到水深20 m处[4, 15];最近的20年,抚仙湖透明度下降,沿岸带透明度维持在3~6 m之间,沉水植物主要分布在6 m以内的沿岸带[4, 18]. 2016年抚仙湖沿岸带透明度平均为4.1 m,沿岸沉积物也得到了较好的发育,从理论上来说,抚仙湖沿岸带水深低于10 m的8.65 km2水域内都是沉水植物拓殖的潜在区域. 然而,本次调查显示沉水植物实际分布面积为5.14 km2,仅占理论上适合大型水生植物分布的最大沿岸带面积的59.42 %.
湖泊中营养盐浓度的提高会促进沉水植物生物量的增加. 1980s以前,抚仙湖平均磷浓度不超过0.005 mg/L,氮浓度不超过0.1 mg/L,沿岸带沉积物瘠薄,沉水植物生物量低[5, 15, 19]. 1980s-2000年间,平均磷浓度在0.01~0.02 mg/L,氮浓度也持续增加;2000年后氮浓度最高达0.4 mg/L,磷浓度维持在0.02 mg/L左右,水体透明度仍较高,介于4.9~12.5 m之间. 因此,沉水植物在南部和中部地势平坦、沉积物积聚的沿岸带区域开始发育,生物量不断提高[4, 15]. 从2002年开始流域治理之后,虽然入湖氮、磷负荷以及全湖整体氮、磷浓度下降,但沿岸带水体中的营养盐浓度依然较高[3-8, 18, 20]. 营养盐的增加也促进沉水植物长得更加高大. 在1980s之前,抚仙湖中的沉水植物植株矮小,很少超过1 m[11];2012年的调查发现沉水植物高度在1.0~3.2 m之间[7],2016年的调查显示,抚仙湖沉水植物群丛冠层高度已经普遍高于3 m. 然而,随着沿岸带营养盐浓度近一步的增加,也会促进浮游植物的生长,从而引起透明度下降[15, 18-19],削弱到达沉水植物冠层的光照,这是不利于沉水植物进一步扩大分布面积的一个因素.
全球气候变化也会影响沉水植物群落发展. 2008年后的干旱气候造成抚仙湖水位明显下降[21],原本底质适宜但光照不足的深水区域由此可能被沉水植物所占据,从而导致沉水植物分布面积扩大;水位下降允许更多有效光辐射到达沉水植物植冠层,也刺激了群落生物量的增加.
以上的种种因素,激发抚仙湖沉水植物在最近几年迅猛增长. 但同时也促进了丝状附着藻的增殖,如果上覆水中的营养盐浓度进一步增加,还可能会引发浮游植物增殖,导致水体透明度进一步下降,限制抚仙湖沉水植物群落发展.
3.2 抚仙湖沉水植物群落变化趋势分析 3.2.1 冠层型沉水植物越来越占据优势根据不同种类的沉水植物在群落中的层次地位以及其对光和空间的竞争能力,沉水植物可以粗分为草甸型和冠层型两类[22]. 草甸型沉水植物的茎或分枝短,植冠低矮,生长较慢,绝大部分生物量贴近沉积物附近分布,对光和空间的竞争能力相对较弱,如轮藻类、苦草、篦齿眼子菜和微齿眼子菜等物种;冠层型沉水植物的茎或分枝长,植冠高大,生长迅速,绝大部分生物量被托举到水面附近,对光和空间的竞争能力强,如穗花狐尾藻、黑藻和金鱼藻等物种[23]. 抚仙湖沉水植物群落在发育过程中,冠层型植物如穗花狐尾藻、金鱼藻和黑藻等越来越占据优势.
草甸型沉水植物比冠层型沉水植物有利于维持湖泊的清水稳态[24-27]. 因为草甸型沉水植物的生物量集中在沉积物附近,能有效覆盖沉积物以阻止其向上覆水中释放营养盐,且草甸型沉水植物多具有相对稠密的须根,释放的氧气也较多,能显著提升沉积物滞留营养盐的能力[22, 28-29]. 而冠层型沉水植物的生物量集中分布在水柱的上层,形成的须根相对较少或无根,对沉积物的覆盖作用弱且向沉积物释放氧气的能力低[30-32];此外,冠层型沉水植物极易过度生长,营养体衰败分解时快速释放大量颗粒物和营养盐进入上覆水,引发浮游植物生长,导致透明度下降[33-35]. 因此,当沉水植物从低矮的草甸型转变成高大的冠层型时,将预示着沉水植物向富营养化湖泊的群落结构方向发展,上覆水也相应地呈现富营养化的趋势[1-2, 10, 36].
3.2.2 外来物种伊乐藻发展迅速外来物种伊乐藻于2014年在抚仙湖首次发现,在2016年的调查中已成为优势度较高的物种之一. 伊乐藻有耐寒的特性,于冬春季至初夏生长,生长迅速,能快速占据冬春季生态位,很可能会在春末对抚仙湖本土物种形成遮蔽,影响本土沉水植物的萌发和生长[37-38];但也可能刚好填补了抚仙湖沿岸带沉水植被区的冬季生态位空档,有助于抚仙湖沉水植物的发育. 外来物种伊乐藻对抚仙湖沉水植被的影响值得进一步观察研究.
3.2.3 丝状藻大量增殖在2016年之前的调查中,抚仙湖丝状藻的生物量尚不大,只附着在水深1 m以内的砾石上生长[4, 12],未引起大部分调查者的注意. 但本调查中发现丝状藻的存量已经非常大,而且在沉水植物植冠上的生物量远远大于赤裸基质(表 2,图 4). 同时,丝状藻覆盖的水域,沉水植物的种类仅1~3种,低于无丝状藻水域的物种丰富度. 大量丝状藻附着在沉水植物上,会影响沉水植物获得光资源;丝状藻死亡分解后也会迅速释放可溶性营养盐进入上覆水上层,引起浮游植物生长,导致水体浑浊,影响中下层沉水植物的生长. 绝大部分丝状藻需要高光照环境,因此,丝状藻主要附着在穗花狐尾藻、黑藻和金鱼藻等高大的沉水植物植冠上. 同时,这些沉水植物细碎的叶片和多分枝的结构也有利于丝状藻的附着[30]. 目前,抚仙湖占据优势的正是这些高大的沉水植物种类,如果这些种类的优势度进一步扩大,丝状藻也将会继续增殖. 丝状藻对抚仙湖沉水植被和沿岸带水质的影响同样值得进一步调查研究.
3.3 抚仙湖沉水植物保护的重要性和建议目前,抚仙湖沿岸带营养盐浓度较高、水体透明度降低,植被稠密,沉水植物群落以高大的冠层型沉水植物为主,同时,还面临外来物种扩张和丝状藻暴发的风险. 过去60年间,抚仙湖的营养盐浓度变化和沉水植物群落发展趋势与欧洲的Fure湖[1]和Constance湖[2]沉水植物消失前的情况非常相像. 这两个湖泊都在20世纪初开始接纳较多的外源污染,水体营养盐浓度增加,沉水植物生物量和物种丰富度均呈现爆发式增长. 但随着外源污染负荷的持续增加,水体磷和氮浓度增加,水体透明度从4 m以上下降到2~4 m,丝状藻暴发,沉水植物大量消失. 1970s开始,两个湖泊的外源磷负荷开始受到控制,沉水植物逐渐自然恢复,但恢复过程非常缓慢,且恢复后的沉水植物物种多样性远远低于消失前. 日本的琵琶湖也是在控制入水氮磷负荷约15年之后,沉水植物才开始逐渐恢复[16]. 有研究显示,即使是在小型的浅水湖泊,沉水植物生物量和覆盖度的恢复也需要10年以上的时间才能稳定[21];而物种多样性的恢复则更慢,需要40~50年以上的时间[1].
撇开低等植物轮藻类,当前抚仙湖有高等沉水植物12种,物种丰富度是有记录以来最高的. 但相比于国外类似的深水湖泊,抚仙湖高等植物的物种丰富度其实非常低. 欧洲的Fure湖高等植物物种丰富度最高时是23种[1],Constance湖最高时超过30种[2]. 抚仙湖沉水植物Shannon-Wiener多样性指数在以往的研究中并没有涉及,无法分析历史趋势. 但抚仙湖目前的多样性指数并不算高,均值仅为0.75,而欧洲类似的湖泊物种多样性指数可达2以上[10, 36];国内一些修复后的湖泊或者野外调查中,沉水植物多样性指数也超过1[37-39]. 抚仙湖沉水植物多样性指数较低与群落中冠层型植物优势度高而草甸型植物优势度低,导致群落的均匀度较低有关. 如果抚仙湖的冠层型植物继续快速发展,挤压低矮的草甸型沉水植物的生长空间,未来的物种多样性指数还可能进一步降低.
2016年的调查显示,抚仙湖沿岸带的水质状况和沉水植物群落状态已经接近国际上类似湖泊沉水植物大量消失前的程度,加之抚仙湖沉水植物物种丰富度本身就较低,因此面临着群落衰退的风险. 为了避免前车之鉴,对抚仙湖沉水植物的保护和管理需要引起高度重视. 我们建议:(1)控制沿岸带入水营养盐负荷并清除部分黑臭沉积物,特别是在西岸和南岸人口较集中的区域;(2)鉴于丝状藻主要附着在高大的冠层型沉水植物植冠上,而且分布深度不超过100 cm,因此建议在夏末秋初(8-9月)对高密度的冠层型沉水植物进行上层100 cm的冠层收割,这将有利于控制冠层型沉水植物和附着藻的进一步发展,允许光照更多地进入水柱下层,为低矮的草甸型植物如苦草和轮藻类的生长提供条件,从而引导沉水植物群落向贫营养化的群落结构发展,但其可行性需要进行研究;(3)加强对外来物种伊乐藻种群动态的监测,并分析其对抚仙湖沉水植物群落的影响,为后续管理提供理论指导.
| [1] |
Sand-Jensen K, Bruun HH, Baastrup-Spohr L. Decade-long time delays in nutrient and plant species dynamics during eutrophication and re-oligotrophication of Lake Fure 1900-2015. Journal of Ecology, 2017, 105(3): 690-700. DOI:10.1111/1365-2745.12715 |
| [2] |
Murphy F, Schmieder K, Baastrup-Spohr L et al. Five decades of dramatic changes in submerged vegetation in Lake Constance. Aquatic Botany, 2018, 144: 31-37. DOI:10.1016/j.aquabot.2017.10.006 |
| [3] |
Gao W, Chen Y, Xu M et al. Trend and driving factors of water quality change in Lake Fuxian(1980-2011). J Lake Sci, 2013, 25(5): 635-642. [高伟, 陈岩, 徐敏等. 抚仙湖水质变化(1980-2011年)趋势与驱动力分析. 湖泊科学, 2013, 25(5): 635-642. DOI:10.18307/2013.0503] |
| [4] |
Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences. Lake Fuxian. Beijing: Ocean Press, 1990: 281-285. [中国科学院南京地理与湖泊研究所. 抚仙湖. 北京: 海洋出版社, 1990: 281-285.]
|
| [5] |
Li SH, Yu MJ, Li GZ et al. Limnological survey of the lakes of Yunnan plateau. Oceanologia et Limnologia Sinica, 1963, 5: 5. [黎尚豪, 俞敏娟, 李光正等. 云南高原湖泊调查. 海洋与湖沼, 1963, 5(2): 87-114.] |
| [6] |
Xiong F, Li WC, Pan JZ et al. Distribution and community structure characteristics of submerged macrophytes in Lake Fuxian, Yunnan Province. Acta Botanica Yunnanica, 2006, 28(3): 277-282. [熊飞, 李文朝, 潘继征等. 云南抚仙湖沉水植物分布及群落结构特征. 云南植物研究, 2006, 28(3): 277-282. DOI:10.3969/j.issn.2095-0845.2006.03.010] |
| [7] |
Li W, Fu H, Cao T et al. Distribution and carbon, nitrogen and phosphorus stoichiometric characteristics of sub-mersed macrophytes in Lake Fuxian. J Lake Sci, 2017, 29(2): 448-457. [李威, 符辉, 曹特等. 抚仙湖沉水植物分布及其碳、氮和磷化学计量学特征. 湖泊科学, 2017, 29(2): 448-457. DOI:10.18307/2017.0221] |
| [8] |
Zhao HG, Kong DP, Fan YN et al. Current status of macrophyte and analysis of its variation trend in Fuxian Lake. Environmental Science Survey, 2017, 36(3): 53-58. [赵海光, 孔德平, 范亦农等. 抚仙湖大型水生植物现状及其变化趋势分析. 环境科学导刊, 2017, 36(3): 53-58.] |
| [9] |
Rouse JWJ, Haas RH, Schell JA et al. Monitoring vegetation systems in the great Plains with ERTS. Third ERTS Symposium, 1973, NASA SP 351 I: 309-317.
|
| [10] |
Jeppesen E, Peder Jensen J, Søndergaard M et al. Trophic structure, species richness and biodiversity in Danish lakes: Changes along a phosphorus gradient. Freshwater Biology, 2000, 45(2): 201-218. DOI:10.1046/j.1365-2427.2000.00675.x |
| [11] |
Li H. Astady on the lake vegetation of Yunnan plateau. Acta Botanica Yunnanica, 1980, 2(2): 113-139, 141. [李恒. 云南高原湖泊水生植被的研究. 云南植物研究, 1980, 2(2): 113-139, 141.] |
| [12] |
Dai QY. The ecological characteristics of the aquaticvegetations in the lakes of Fuxianhu, Er Hai and Dian Chi in Yunnan planteau. Acta Ecologica Sinica, 1985, 5(4): 324-335. [戴全裕. 云南抚仙湖、洱海、滇池水生植被的生态特征. 生态学报, 1985, 5(4): 324-335.] |
| [13] |
Deng XY, Xu JH. Studies on algae of Fu-Xian Lake in Cheng-Jiang County, Yunnan. Journal of Yunnan University: Natural Sciences, 1996, 18(2): 139-145. [邓新晏, 许继宏. 澄江抚仙湖藻类植物研究. 云南大学学报: 自然科学版, 1996, 18(2): 139-145.] |
| [14] |
Xiong F, Liu HY, Dong YH et al. Spatial-temporal pattern of charophyte in Fuxian Lake. Journal of Jianghan University: Natural Science Edition, 2011, 39(3): 102-107. [熊飞, 刘红艳, 董元火等. 抚仙湖轮藻植物的时空格局. 江汉大学学报: 自然科学版, 2011, 39(3): 102-107.] |
| [15] |
Li YX, Liu H, Lu Y et al. Preliminary studies on eutrophication in Fuxian lake. J Lake Sci, 2003, 15(3): 285-288. [李荫玺, 刘红, 陆娅等. 抚仙湖富营养化初探. 湖泊科学, 2003, 15(3): 285-288. DOI:10.18307/2003.0315] |
| [16] |
Ishikawa K, Haga H. Ecological regime shift in the south basin of Lake Biwa: Focus on algal blooms and submerged macrophyte overgrowth. In: Proceedings of the UNESCO international symposium on scientific. Technological and policy innovations for improved water quality monitoring in the post-2015 SDGs framework. Kyoto, Japan, 2015: 15-18.
|
| [17] |
Bakker ES, van Donk E, Declerck SAJ et al. Effect of macrophyte community composition and nutrient enrichment on plant biomass and algal blooms. Basic and Applied Ecology, 2010, 11(5): 432-439. DOI:10.1016/j.baae.2010.06.005 |
| [18] |
Pan JZ, Xiong F, Li W et al. Spatial-temporal dynamic changes of the water transparency and their influencing factors in Lake Fuxian, Yunnan Province. J Lake Sci, 2008, 20(5): 681-686. [潘继征, 熊飞, 李文朝等. 云南抚仙湖透明度的时空变化及影响因子分析. 湖泊科学, 2008, 20(5): 681-686. DOI:10.18307/2008.0519] |
| [19] |
Xiao L, Jin BX, Li SH et al. Analysis on the change of total phosphorus concentration in Fuxian Lake from 2002 to 2015. Journal of Zhejiang Agricultural Sciences, 2017, 58(2): 335-337. [肖蕾, 金宝轩, 李石华等. 2002-2015年抚仙湖总磷浓度变化分析. 浙江农业科学, 2017, 58(2): 335-337.] |
| [20] |
Chen JX, Lv Y, Zhao ZF et al. Using the multidimensional synthesis methods with non-parameter test, multiple time scales analysis to assess water quality trend and its characteristics over the past 25-years in the Fuxian Lake, China. Science of the Total Environment, 2019, 655: 242-254. DOI:10.1016/j.scitotenv.2018.11.144 |
| [21] |
He KD, Gao W, Duan CQ et al. Water level variation and its driving factors in Lake Dianchi, Fuxian and Yangzong during 1988-2015. J Lake Sci, 2019, 31(5): 1379-1390. [贺克雕, 高伟, 段昌群等. 滇池、抚仙湖、阳宗海长期水位变化(1988-2015年)及驱动因子. 湖泊科学, 2019, 31(5): 1379-1390. DOI:10.18307/2019.0504] |
| [22] |
James WF, Barko JW, Butler MG. Shear stress and sediment resuspension in relation to submersed macrophyte biomass. Hydrobiologia, 2004, 515(1/2/3): 181-191. DOI:10.1023/B:HYDR.0000027329.67391.c6 |
| [23] |
Gopal B, Goel U. Competition and allelopathy in aquatic plant communities. The Botanical Review, 1993, 59(3): 155-210. DOI:10.1007/BF02856599 |
| [24] |
Carpenter SR, Lodge DM. Effects of submersedmacrophytes on ecosystem processes. Aquatic Botany, 1986, 26: 341-370. DOI:10.1016/0304-3770(86)90031-8 |
| [25] |
Jeppesen E, Lauridsen TL, Kairesalo T et al. Impact of submerged macrophytes on fish-zooplankton interactions in lakes. The structuring role of submerged macrophytes in lakes. New York: Springer, 1998: 91-114. DOI:10.1007/978-1-4612-0695-8_5
|
| [26] |
Kosten S, Kamarainen A, Jeppesen E et al. Climate-related differences in the dominance of submerged macrophytes in shallow lakes. Global Change Biology, 2009, 15(10): 2503-2517. DOI:10.1111/j.1365-2486.2009.01969.x |
| [27] |
Rehman F, Pervez A, Khattak BN et al. Constructed wetlands: Perspectives of the oxygen released in the rhizosphere of macrophytes. CLEAN-Soil, Air, Water, 2017, 45(1). DOI:10.1002/clen.201600054 |
| [28] |
van den Berg MS, Coops H, Meijer ML et al. Clear water associated with a dense Chara vegetation in the shallow and turbid lake veluwemeer, the Netherlands. The structuring role of submerged macrophytes in lakes. New York: Springer, 1998: 339-352. DOI:10.1007/978-1-4612-0695-8_25
|
| [29] |
Kufel L, Kufel I. Chara beds acting as nutrient sinks in shallow lakes—a review. Aquatic Botany, 2002, 72(3/4): 249-260. DOI:10.1016/S0304-3770(01)00204-2 |
| [30] |
Zhang XF, Tang YL, Jeppesen E et al. Biomanipulation-induced reduction of sediment phosphorus release in a tropical shallow lake. Hydrobiologia, 2017, 794(1): 49-57. DOI:10.1007/s10750-016-3079-x |
| [31] |
Scheffer M, Jeppesen E. Regime shifts in shallow lakes. Ecosystems, 2007, 10(1): 1-3. DOI:10.1007/s10021-006-9002-y |
| [32] |
vanNes EH, Scheffer M, van den Berg MS et al. Dominance of charophytes in eutrophic shallow lakes—when should we expect it to be an alternative stable state?. Aquatic Botany, 2002, 72(3/4): 275-296. DOI:10.1016/S0304-3770(01)00206-6 |
| [33] |
van den Berg MS, Scheffer M, Coops H et al. The role of characean algae in the management of eutrophic shallow lakes. Journal of Phycology, 1998, 34(5): 750-756. DOI:10.1046/j.1529-8817.1998.340750.x |
| [34] |
Hilt S, Gross EM, Hupfer M et al. Restoration of submerged vegetation in shallow eutrophic lakes—A guideline and state of the art in Germany. Limnologica, 2006, 36(3): 155-171. DOI:10.1016/j.limno.2006.06.001 |
| [35] |
Engelhardt KAM, Ritchie ME. Effects of macrophyte species richness on wetland ecosystem functioning and services. Nature, 2001, 411(6838): 687-689. DOI:10.1038/35079573 |
| [36] |
Silva SCAD, Cervi AC, Bona C et al. Aquatic macrophyte community varies in urban reservoirs with different degrees of eutrophication. Acta Limnologica Brasiliensia, 2014, 26(2): 129-142. DOI:10.1590/s2179-975x2014000200004 |
| [37] |
Li WC. Construction and purification efficiency test of an ever green aquatic vegetation in an eutrophic lake. China Environmental Science, 1997, 17(1): 53-57. [李文朝. 富营养水体中常绿水生植被组建及净化效果研究. 中国环境科学, 1997, 17(1): 53-57.] |
| [38] |
Wang GX, Pu PM, Zhang SZ et al. The purification ability of aquatic macrophytes for eutrophic lake water in winter. China Environmental Science, 1999, 19(2): 106-109. [王国祥, 濮培民, 张圣照等. 冬季水生高等植物对富营养化湖水的净化作用. 中国环境科学, 1999, 19(2): 106-109.] |
| [39] |
Hilt S, Alirangues NMM, Bakker ES et al. Response of submerged macrophyte communities to external and internal restoration measures in north temperate shallow lakes. Frontiers in Plant Science, 2018, 9: 194. DOI:10.3389/fpls.2018.00194 |
 2021, Vol. 33
2021, Vol. 33 

