(2: 上海海洋大学上海水产养殖工程技术研究中心, 上海 201306)
(3: 中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室, 南京 210008)
(4: 江西省水资源监测中心, 南昌 330009)
(5: 鄱阳湖水文生态监测研究重点实验室, 南昌 330009)
(6: 江西省农业科学院农产品质量安全与标准研究所, 南昌 330009)
(2: Shanghai Engineering Research Center of Aquaculture, Shanghai Ocean University, Shanghai 201306, P. R. China)
(3: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P. R. China)
(4: Water Resources Monitoring Center of Water Resources of Jiangxi Province, Nanchang 330009, P. R. China)
(5: Research Key Laboratory of Hydrology and Ecology Monitoring of Poyang Lake, Nanchang 330009, P. R. China)
(6: Institute for Quality & Safety and Standards of Agricultural Products Research, Jiangxi Academy of Agricultural Science, Nanchang 330009, P. R. China)
湿地植物作为湿地生态系统的主要初级生产者,维持着整个生态系统的结构和功能. 在生长发育过程中,湿地植物吸收和富集水体中氮、磷等营养元素,改善水质,调节营养物质平衡,在湿地生态系统中发挥着不可忽视的重要作用[1-2]. 然而,植物经历萌发-生长-衰亡的周期,湿地植物衰亡凋落后腐烂分解,向水环境释放氮、磷等营养物质[3],造成水体的污染. 目前,关于通江湖泊洲滩湿地植被的研究主要集中于群落结构、分布格局及对水位的响应等[4-7],部分研究者开始关注淹水对洲滩湿地的分解过程及其对水环境的影响[2, 8].
鄱阳湖是我国长江流域最大的通江湖泊,其年内水位不断变化,引起湖泊水域与洲滩湿地之间相互转化,造成湿地植物周期性淹没和出露[9]. 淹水期,大量处于生长旺盛期的湿地植物被淹没,其死亡分解对水环境产生一定的影响. 如基于室内微宇宙实验,徐金英等研究了不同温度下植物分解对水体营养盐的影响,表明不同温度对植物腐烂释放营养盐含量有显著影响[2]. 以白沙湖为监测对象,张广帅等[8]结合灰化薹草原位分解实验和湖泊水位监测,研究水位变化和植物分解对水体营养盐浓度的交互作用,结果表明植物分解过程明显影响湖泊水体总氮(TN)、氨氮(NH3-N)和总有机碳(TOC)浓度变化,水位变化对湖泊水体硝态氮(NO3--N)浓度变化最明显. 此外,高敏敏等[10]探究了水淹条件下湿地活体植物和自然枯落后植物的分解差异,表明植物分解规律具有阶段性,且分解速率因植物种类而异. 目前,水域生态系统中的植物分解主要发生在春、秋、冬季节[3, 11-12],但是洪泛性湿地的湿生或沼生植被基本均在气温较高的雨季被淹没,进而发生腐烂分解,相关研究仅关注营养盐的释放,而未涉及藻类生长. 目前,虽然鄱阳湖浮游植物仍以硅藻为主[13],但高温条件下植物腐烂分解所释放的营养盐势必增加蓝藻水华发生风险,其如何影响局部乃至整个湖区的水环境状况目前还不得而知,特别是在鄱阳湖未来水文形势可能发生变化的情景下. 浮游植物作为生态系统的初级生产者,其分布广泛、生活周期短,对水环境因子的变化敏感,其生物量变化能够反映水环境的变化,一直是学者们关注的焦点[14-16]. 目前,从鄱阳湖湿地植物淹没分解角度出发,阐述其对浮游植物生物量影响的研究鲜有报道.
因此,本研究依据鄱阳湖特殊的水文变化,选取典型洲滩湿地植物灰化薹草(Carex cinerascens)、蒌蒿(Artemisia selengensis)和虉草(Phalaris arundinacea)为研究对象. 实验前,基于野外调查,确定淹水前植物的实际生物量. 根据自然淹水状态和实验装置确定添加植物的生物量,调节实验水体的营养盐,使其与鄱阳湖水体保持一致. 最后,在中国科学院鄱阳湖湖泊湿地观测研究站湿地附近水域采集与实验装置等体积的浮游植物并加入实验装置中,实验期间固定时间搅拌水体. 本文探究湿地植物茎、叶腐烂分解对水环境及浮游植物生长的影响,以期完善鄱阳湖水质安全预警,并为未来水文形势改变情景下的生态风险评估提供科学依据.
1 材料与方法 1.1 研究区概况鄱阳湖(28°22′~29°45′N,115°47′~116°45′E)位于长江中游,江西省北部,属于典型的亚热带季风气候. 受鄱阳湖水文节律季节性变化的影响,鄱阳湖湿地表现出典型的水陆相交错变化,丰水期,湿地处于淹水状态,随着水位的降低,处于不同高程的洲滩湿地相继出露,湿地植物开始发育,呈现出河、湖、滩交错的湿地景观格局[8]. 整个洲滩地势较为平缓,分布的主要植物有灰化薹草、蒌蒿、虉草、芦苇(Phragmites australis)和南荻(Triarrhena lutarioriparia)等[2]. 本实验采用室外模拟分解培养法进行,在江西省九江市星子县中国科学院鄱阳湖湖泊湿地观测研究站实验平台完成.
1.2 实验设计本实验于2019年6月28日-9月5日进行,共持续69 d. 在中国科学院鄱阳湖湖泊湿地观测研究站附近洲滩采集植物的茎和叶,带回实验室. 植物样品先用自来水将表面冲洗干净,再用纯净水冲洗,晾干水分,置于60℃烘箱烘干至恒重(测量3次重量变化小于0.001 g),剪成1 cm长的小段装入分解袋. 根据该洲滩实际淹水状况和实验装置等估算实验添加的植物生物量(每个实验桶内添加490 g湿地植物的茎、叶,400 g装入1个大分解袋(孔径为0.15 mm,规格为20 cm×30 cm);90 g均匀分装在18个小分解袋(孔径为0.15 mm,规格为8 cm×10 cm),即每个小分解袋装5 g确定茎叶比例、混合均匀的植物).
利用112 μm孔径(13#)和64 μm孔径(25#)的浮游生物网分别过滤中国科学院鄱阳湖湖泊湿地观测研究站附近水域水体120 L,将浮游植物装入50 mL小白瓶,重复12次,并统一浮游植物体积. 选用160 L聚乙烯塑料桶作为实验装置,每个桶内加入120 L自来水,调节水体的初始营养盐浓度(TN平均浓度为1.5 mg/L,TP平均浓度为0.05 mg/L,氮源为KNO3,磷源为KH2PO3),保证各个实验组初始水环境保持一致. 将12瓶浮游植物样混合,等体积加入各个实验桶中. 实验共设4个处理,分别为空白组、加灰化薹草组、加蒌蒿组、加虉草组,每个处理3组重复,共计12个处理.
实验期间在每次采样后补充蒸馏水以保证水位恒定. 水体中叶绿素a(Chl.a)浓度能反映浮游植物生物量高低[17],Lamon等[18]对佛罗里达地区165个湖泊的数据进行分析表明,浮游植物生物量与Chl.a浓度之间存在密切关系. 由于易测性等,众多学者以Chl.a浓度开展浮游植物的相关研究. 因此,本研究中采用Chl.a浓度表征浮游植物的生物量.
1.3 水质指标测定实验期间,水化指标如温度(WT)、pH、溶解氧(DO)、浊度(Tur)每3天测1次,水体TN、总磷(TP)、总溶解氮(TDN)、总溶解磷(TDP)、NH3-N、高锰酸盐指数(CODMn)、Chl.a浓度前1个月每3天测1次,后期每6天测1次. 植物分解袋每6天采集1次.
采样前将桶内水体混匀,用柱状有机玻璃管(直径为10 cm,高度100 cm)采集混合水样,用500 mL经酸浸泡处理的塑料瓶储存水样,带回实验室进行分析. WT、pH、DO浓度使用多参数水质监测仪YSI现场测定. 每次采样时间为18:00—19:00. Tur用1900C型便携式浊度计测定. 参照《水和废水监测分析方法》[19]测定水样的TN、TP、TDN、TDP、NH3-N、CODMn浓度. 用热乙醇法测定Chl.a浓度.
1.4 数据计算与分析采用Excel 2010、SPSS 19.0软件对数据进行统计分析,用广义线性混合模型的统计方法分析不同处理组整个实验周期的水环境变化. 用Origin 2018软件进行图形绘制.
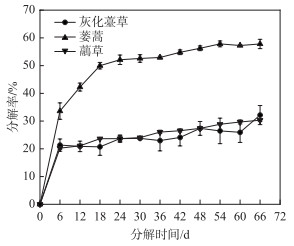
2 结果与分析 2.1 植物组织分解速率3种湿地植物的分解过程相似,有明显的阶段性,均呈前期快速分解,后期缓慢分解的趋势(图 1). 蒌蒿在第6天分解率为33.61 %,第18天分解率达49.97 %,第66天分解率达57.82 %;灰化薹草和虉草在前6天内快速分解,分解率分别为21.34 % 和20.22 %,第66天分解率分别为32.17 % 和30.30 %. 蒌蒿的分解率显著大于灰化薹草和虉草(P<0.05).
|
图 1 3种湿地植物腐烂分解过程中植物分解率的时间变化 Fig.1 Temporal variation of decomposition rate during decomposition of three plants decay |
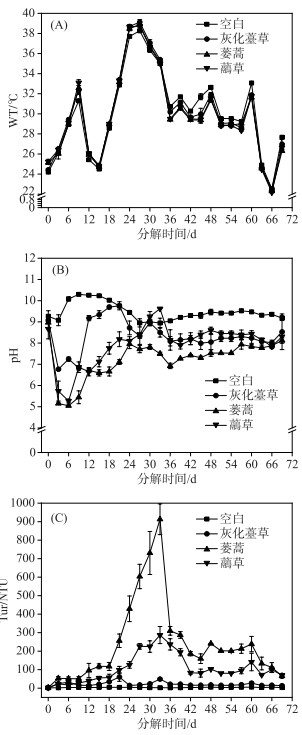
本研究中,空白组与实验组WT变化趋势一致(图 2A). 植物分解过程中,各实验组水体pH变化相似,均呈先降低后升高再逐渐稳定的趋势. 实验结束后各实验组的pH保持在7.8~9.6之间,表明系统进入相对稳定状态. 灰化薹草组水体pH在第3天降至最低(6.77),第21天上升至最大(9.76). 在第6天蒌蒿组和虉草组水体pH降至最低(分别为5.05和5.27),蒌蒿组在实验结束时达到最大(8.17),虉草组在第33天时上升至最大(9.62)(图 2B),蒌蒿组pH显著低于灰化薹草组与虉草组(表 1).
|
图 2 3种湿地植物腐烂分解过程中水体WT、pH和Tur的时间变化 Fig.2 Temporal variation of water temperature, pH and turbidity in water during decomposition of three plants decay |
| 表 1 3个试验组与对照组的水环境变化(平均值±标准偏差)* Tab. 1 Water environmental variation between three experiment groups and blank groups (the mean ± standard deviation) |
各实验组水体Tur变化均呈先升高后降低再逐渐稳定的趋势. 灰化薹草组水体Tur在植物分解第21天达到最大(60.30 NTU),蒌蒿组和虉草组均在分解第33天达到最大,分别为913和287 NTU(图 2C),显著高于空白组(P<0.05)(表 1).
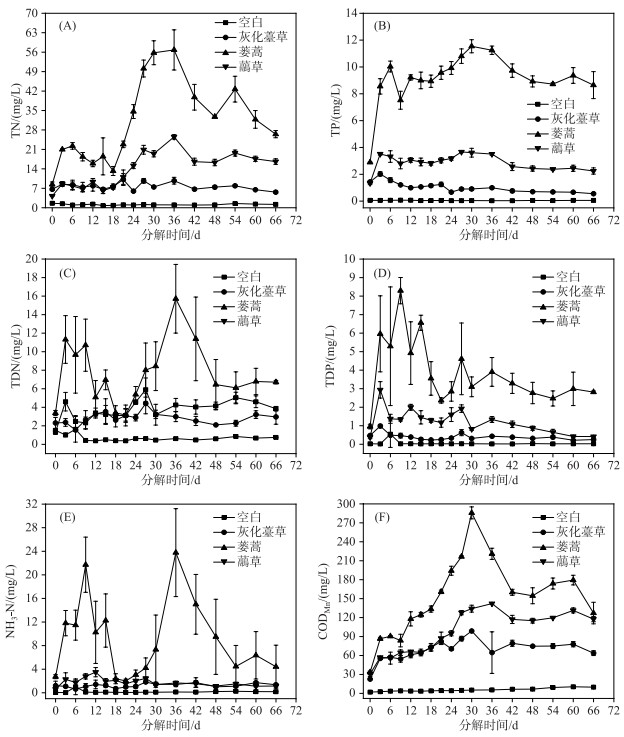
2.2.2 水体营养盐和CODMn的时间变化灰化薹草、蒌蒿和虉草腐烂分解释放大量的营养盐,水体中TN、TP、TDP、CODMn浓度的动态变化均呈先升高后跳跃式降低最后趋于稳定的状态,TDN、NH3-N浓度整体呈先升高后降低,再升高再降低最后趋于稳定的变化. 不同植物实验组间营养盐浓度变化差异显著(表 1).
TN方面,灰化薹草组在第21天浓度达到最大(10.16 mg/L),蒌蒿组和虉草组均在第36天达到最大(分别为56.81和26.52 mg/L)(图 3A). 各实验组水体TP浓度在第3天迅速升高,在第36天后逐渐下降. 灰化薹草组在第3天达到最大(2.03 mg/L),蒌蒿组和虉草组浓度分别在第30和27天达到最大(分别为11.54和3.67 mg/L)(图 3B). 灰化薹草组水体TDN浓度在第27天达到最大(4.40 mg/L),蒌蒿组和虉草组最大浓度分别出现在第36和27天(分别为15.72和5.90 mg/L)(图 3C). TDP方面,灰化薹草组和虉草组均在第3天浓度达到最大(分别0.98和2.94 mg/L),蒌蒿组在第9天达到最大(8.30 mg/L)(图 3D). 灰化薹草组水体的NH3-N浓度在腐烂分解第27天达到最大(1.82 mg/L). 蒌蒿组水体NH3-N浓度在腐烂分解第9天达到第1个峰值,随后开始下降,在第36天达到第2个峰值(浓度为23.77 mg/L),虉草组在第12天达到最大(3.49 mg/L) (图 3E). 灰化薹草组和蒌蒿组CODMn浓度均在第30天达到最大(分别为98.80和285.77 mg/L),虉草组则在第36天达到最大(142.13 mg/L)(图 3F). 腐烂分解过程中,蒌蒿组TN、TP、TDN、TDP、NH3-N和CODMn平均浓度最高,虉草组和灰化薹草组次之,空白组最低.
|
图 3 3种湿地植物腐烂分解过程中水体TN、TP、TDN、TDP、NH3-N和CODMn浓度的时间变化 Fig.3 Temporal variation of TN, TP, TDN, TDP, NH3-N and CODMn concentrations in water during decomposition of three plants decay |
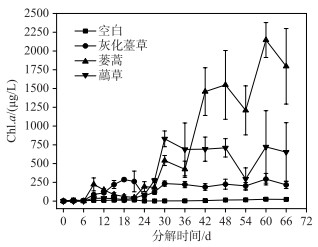
灰化薹草组Chl.a浓度呈前期上升、后期逐渐稳定的趋势,第18天出现第1个峰值(287.21 μg/L),第60天出现第2个峰值(292.62 μg/L). 蒌蒿组Chl.a浓度整体呈逐渐上升的趋势,第60天达到最大(2146.19 μg/L). 与灰化薹草组相似,虉草组Chl.a浓度前期上升,后期逐渐稳定,第30天达到最大(829.62 μg/L)(图 4). 各实验组间Chl.a浓度存在显著差异,加草组显著高于空白组(P<0.05)(表 1).
|
图 4 3种湿地植物腐烂分解过程中Chl.a浓度的时间变化 Fig.4 Temporal variation of Chl.a concentration during decomposition of three plants decay |
植物腐烂分解是一个复杂的生物、物理和化学过程,受多种因素(包括植物自身组成、环境因素和生物因素)综合影响. 湿地植物腐烂分解包括植物组织的水解、矿质成分和可溶性有机物的溶解、各类有机成分的酶解(植物细胞内的酶),以及生物降解、微小颗粒的逸散等[20-21].
本研究通过室外模拟实验发现,3种湿地植物质量在短时间内迅速衰减,之后逐步趋于稳定,说明其分解过程与多数湿地植物一致,均呈前期快速分解、后期缓慢分解两个阶段. 植物残体中营养元素氮(N)、磷(P)、钙(Ca)、镁(Mg)、钾(K)、钠(Na)、硫(S)等的含量以及物质元素之间的计量关系(C∶N、C∶P、木质素∶N、N∶P等)决定着植物残体的可分解性,能够显著影响植物残体的分解特征. N、P含量很高且C∶N、C∶P和N∶P值较低的植物残体,通常具有比较高的分解速率,难分解物质与植物残体的分解速率呈显著的负相关关系,对湿地植物残体的分解具有明显的调控和指示作用,如,木质素∶N比值常常被用作评价植物可分解性和预测分解速率. 与其他相关研究相比,水环境温度较高时促使植物的分解速率加快,如在探究灰化薹草和虉草腐烂过程中高敏敏等[10]发现,植物在最初30天中分解较快,本研究仅在实验开始第6天分解速率达到较大值. 研究表明,温度的升高会促进真菌活动并提高分解速率[22]. 蒌蒿在实验开始18天内快速分解,灰化薹草和虉草在实验开始6天内快速分解. 高敏敏等[10]研究灰化薹草和虉草活体和自然枯落物(风干处理)的分解差异发现,灰化薹草和虉草活体和自然枯落物在腐烂分解第30天时分解率最大,且活体植物和自然枯落物腐烂分解率变化规律一致,均为腐烂分解前期较快,后期缓慢. 同时,张广帅等[8]在探究鄱阳湖碟形湖泊植物分解规律中发现,灰化薹草(烘干处理)在前30天分解最快,分解变化规律与高敏敏等[10]的研究结果一致,均为前期较快,后期缓慢. 由于烘干植物会改变角质层,植物受微生物的影响更大,增加可溶性化合物的流失[2],从而加快植物的分解. 因此,与其他相关研究相比,本研究中植物腐烂分解速率在前期较快,但整体分解规律与其他保持一致. 这种较快的前期分解主要和前期水溶性物质及易分解的碳水化合物的快速降解有关[10]. 同时有研究表明,植物体内碳氮磷含量、木质素含量和纤维素含量以及相互之间的比值会影响植物的腐烂分解速率[3]. 植物组织初始有机氮浓度和无机盐类含量较高时,分解速率较快[23-24]. 此外,水体中大量的有机物为微生物提供了丰富碳源,微生物的种类和生物量增加,加速了植物腐烂分解[11]. 随着不断的分解,植物所释放的营养物质有限,微生物种类和生物量发生了变化[25],且植物残体中难分解物质和难溶占比增加,植物分解由快变慢[26]. 此外,有研究表明,在植物分解后期,木质素含量对于植物分解速率影响较大[25, 27-28],因此木质素等难分解物质不断积累,植物分解受到抑制,导致植物分解速率减慢[28-29]. 研究表明,难分解物质(木质素等)与植物残体的分解速率呈显著的负相关[30]. 3种植物的分解速率具有差异,可能是由于植物种类、耐水淹能力以及植物体内物质形态及含量不同,决定了分解微生物的喜好程度,造成植物腐烂分解的差异[31]. 同时植物分解速率与植物本身有关,如蒌蒿,与灰化薹草相比,其体内通气组织发达,有大量扩裂性通气组织和髓腔,有助于植物在低氧和缺氧环境下对氧气的存储以及运输,因此在相同条件下蒌蒿分解较快,造成了三者之间分解的差异[32-34].
3.2 水环境因子的变化 3.2.1 植物腐烂分解对水体pH的影响植物腐烂分解过程中,水体pH均呈先降低后升高的趋势,最终各实验组的pH维持在7.8~9.6之间,系统处于相对稳定状态. 水体pH变化与植物腐烂分解过程有密切联系,实验初期水体pH下降,一方面是因为植物大量分解,光合作用逐渐减弱,水中CO2含量增多,水环境中原有的碳酸盐平衡被打破,如池塘水环境pH主要受水体中碳酸盐平衡系统(CO2+H2O↔H2CO3↔H++HCO3-↔2H++CO32-)的影响[35]. 袁元等[36]通过探究水生植物对水体pH值的影响原因,表明CO2的含量破坏水体碳酸盐平衡系统. 另一方面,植物体内部分不稳定有机物释放到水体,在微生物作用下分解并释放出CH4和CO2[25],以及氨氮的硝化作用,导致pH降低. 实验后期,植物腐烂分解趋于平稳,水中的碳源不足等造成微生物种类发生变化,生物量减少,释放的CO2减少,水体pH逐渐回升,同时pH作为浮游植物生长环境的重要理化指标,它可以通过改变环境酸碱度和酸碱盐平衡系统及不同形态无机碳分配关系来影响浮游植物的生长[37],在实验前期,植物大量分解,水环境处于厌氧状态,水体pH较低,此环境不利于浮游植物的生长,因此浮游植物生物量较低,随着实验的进行,水体pH逐渐回升,较高的pH能促进浮游植物的细胞增殖,浮游植物光合作用消耗水体中的CO2,破坏水体中H2CO3原有的平衡,促使水环境pH上升并逐渐趋于稳定[35]. 徐金英等[2]研究灰化薹草、蒌蒿和芦苇的茎和叶残体降解中发现,实验初期植物残体溶液pH减小,后期pH又上升. 与其他实验组相比,空白组水体pH变化较小,表明水体pH的变化主要是由植物腐烂分解引起的.
3.2.2 植物腐烂分解对水体营养盐和CODMn浓度的影响本实验中,水体营养盐和CODMn浓度变化均呈先升高后跳跃式降低最后趋于稳定的状态. 唐金艳等[38]在芦苇、荇菜(Nymphoides peltatum)和狐尾藻(Myriophyllum verticillatum)等6种水生植物腐烂分解对水质影响的研究中也得出了一致的结论. 植物分解过程中,蒌蒿向水体释放的营养盐和CODMn均显著高于灰化薹草和虉草,可能是由植物自身基质引起的营养盐释放量不同[2, 11]. 在分解前期,植物体内可溶性物质中的元素大量流失,氮、磷元素在植物腐烂分解前期损失较大,植物组织中可溶性蛋白质快速损失导致N大量释放[11, 39]. 分解后期N含量降低,植物残体及大颗粒有机物的沉降及微生物的硝化和反硝化作用使水体N生成N2、N2O等气体逸出. 湿地植物的腐烂分解会影响磷的生物循环、滞留和释放,使得水体中磷浓度升高. 实验前期,植物腐烂分解释放颗粒磷及有机磷,如以磷酸根离子或化合物的形态存在,引起水体磷浓度升高. 同时植物体可溶性有机物的溶解损失、易分解有机物的分解及颗粒性难分解有机物的散失过程也会影响水体磷浓度[10]. 此外微生物新陈代谢产生的酸与水体中铁、铝、钙、镁等离子结合,使难溶性无机磷被溶解. 后期水体磷浓度降低,可能是由于部分磷元素向底部残体迁移. 此外,微生物能将分解的部分有机磷转化为自身所需要的营养物质,也降低了水体磷浓度. 在高磷营养环境中,部分浮游植物可以大量吸收水体中的磷,以聚磷酸盐的形式储存在体内,以便在低磷浓度时期生长[40-41],造成水体磷浓度下降.
3.2.3 植物腐烂分解对水体Chl.a浓度的影响浮游植物的生长受到生物因素(如浮游动物和鱼类摄食)和非生物因素(如营养盐、水温、光照等)的综合影响. 本研究采用室外模拟实验,明确了植物腐烂分解对浮游植物生物量的影响及种间差异,各实验组间Chl.a浓度均存在显著差异.
光照和营养盐作为浮游植物生长的基础,其变化能直接影响浮游植物生长[42]. 光为浮游植物进行光合作用提供能量,与热带湖泊相比而言,温带湖泊中光对浮游植物的影响尤其重要,甚至超过了营养盐的作用. 在浑浊的水体中,悬浮物质影响光在水下的传递,从而改变了光谱组成[13]. 营养盐浓度过高会抑制浮游植物的生长[43],当营养盐输入降低时,浮游植物的优势种、生物量会出现一定的响应[44-45]. 植物腐烂分解过程中不仅会释放大量的营养盐,还会产生具有吸光性的溶解性有机物(氨基酸、腐殖酸、脂肪族及芳香烃类物质等),降低水下光照条件,间接影响浮游植物光合作用效率[46-47]. 研究表明,在贫营养但富含有色物质的湖泊中,限制浮游植物初级生产量的因素为光照而非营养盐[48]. 同时,光照和营养盐的交互作用能显著影响浮游植物生物量[49-51]. 本研究中,灰化薹草组和虉草组的Chl.a浓度均呈前期上下波动、中期上升并达到较高水平、后期逐渐稳定的变化趋势. 前期浮游植物变化较小,主要是由于植物腐烂分解导致水体浊度逐渐增大,抑制了浮游植物的生长. 中期浊度和营养盐浓度达到最大后开始下降,此时浮游植物开始大幅度生长. 后期Chl.a浓度逐渐稳定,研究发现化感物质会抑制某些浮游植物的生长[52-53]. 蒌蒿组Chl.a浓度整体呈跳跃式上升的变化,前期变化趋势与其他两组相似,浮游植物生长主要受水体浊度的影响. 中后期水体浊度下降,浮游植物大幅度生长. 实验后期不同实验组Chl.a浓度变化出现差异可能是由植物的物种差异引起的. 综上,不同湿地植物分解造成水体环境因子和浮游植物生长差异较大,后续将深入研究浮游植物群落结构的变化特征,进一步探究浮游植物在植物腐烂过程中的响应.
4 结论1) 鄱阳湖典型湿地植物灰化薹草、蒌蒿和虉草在水淹胁迫下的分解均具有明显的阶段性,在实验前期分解较快,后期分解缓慢. 蒌蒿分解率最大,虉草次之,灰化薹草最小,同时高温环境下加剧植物的分解.
2) 腐烂分解过程中,水体理化因子基本均发生了显著变化,如水体pH呈先降低后升高的趋势,且空白组pH显著高于其他实验组. 浊度、营养盐浓度和CODMn浓度均呈先升高后降低并逐渐稳定的变化趋势,蒌蒿腐烂分解对水体pH、浊度、营养盐浓度和CODMn浓度影响最大.
3) 灰化薹草组和虉草组Chl.a浓度变化均呈前期波浪式上升、后期逐渐稳定的变化趋势;蒌蒿组Chl.a浓度整体呈逐渐上升的趋势. 水体浊度和营养盐浓度是影响浮游植物生长的主要因素.
本研究是在160 L聚乙烯塑料桶中开展的,虽然在实验过程中模拟自然环境进行了人力搅拌,但是水位及水流变化远不及鄱阳湖自然水体. 同时由于无脊椎动物啃食等压力作用,湿地植物分解速度更快. 此外,本研究中未考虑底泥,与鄱阳湖相比,水-植物-底泥三者进行营养元素的转移、转化过程较少. 因此,进一步实施原位的模拟实验才能更加真实地研究自然分解过程及浮游植物的响应.
| [1] |
Gronk JK, Fennessy MS. Wetland plants: Biology and ecology. Florida: CRC Press LLC, 2001.
|
| [2] |
Xu JY, Wang XL. Changes of contents of nitrogen and phosphorus in the water during decomposition process of shoot and leaf residues of three kinds of typical plants in Poyang Lake under two kinds of temperatures. Wetland Science, 2018, 16(2): 266-272. [徐金英, 王晓龙. 两种温度下鄱阳湖3种典型植物茎和叶残体降解过程中水中的氮和磷含量变化. 湿地科学, 2018, 16(2): 266-272.] |
| [3] |
Qi MX, Wang HP, Chen J. Decomposition of Phragmites australis and Typha angustifolia and their effects on the water quality in winter and spring. J Lake Sci, 2017, 29(2): 420-429. [戚美侠, 王红萍, 陈杰. 冬、春季芦苇(Phragmites australis)和狭叶香蒲(Typha angustifolia)的腐解过程及其对水质的影响. 湖泊科学, 2017, 29(2): 420-429. DOI:10.18307/2017.0218] |
| [4] |
Feng WJ, Xu LG, Wang XL et al. Response of Carex cinerascens populations to groundwater level gradients in the Poyang Lake wetland. Acta Ecologica Sinica, 2016, 36(16): 5109-5115. [冯文娟, 徐力刚, 王晓龙等. 鄱阳湖洲滩湿地地下水位对灰化薹草种群的影响. 生态学报, 2016, 36(16): 5109-5115. DOI:10.5846/stxb201501220180] |
| [5] |
Gu J, Qin Y, Wang X et al. Changes in inundation frequency in Poyang Lake and the response of wetland vegetation. Acta Ecologica Sinica, 2018, 38(21): 7718-7726. [谷娟, 秦怡, 王鑫等. 鄱阳湖水体淹没频率变化及其湿地植被的响应. 生态学报, 2018, 38(21): 7718-7726.] |
| [6] |
Yu L, He LH, Zhang Q et al. Effects of the Three Gorges Project on the typical wetland vegetations of Poyang Lake. Geographical Research, 2011, 30(1): 134-144. [余莉, 何隆华, 张奇等. 三峡工程蓄水运行对鄱阳湖典型湿地植被的影响. 地理研究, 2011, 30(1): 134-144.] |
| [7] |
Xu XL, Zhang Q, Tan ZQ et al. Effects of water-table depth and soil moisture on plant biomass, diversity, and distribution at a seasonally flooded wetland of Poyang Lake, China. Chinese Geographical Science, 2015, 25(6): 739-756. DOI:10.1007/s11769-015-0774-x |
| [8] |
Zhang GS, Yu XB, Liu Y et al. Accumulation effect of litter decomposition and water level on carbon and nitrogen in shallow lake water of Lake Poyang. J Lake Sci, 2018, 30(3): 668-679. [张广帅, 于秀波, 刘宇等. 鄱阳湖碟形湖泊植物分解和水位变化对水体碳、氮浓度的叠加效应. 湖泊科学, 2018, 30(3): 668-679. DOI:10.18307/2018.0309] |
| [9] |
Hu ZP, Ge G, Liu CL et al. Structure of Poyang Lake wetland plants ecosystem and influence of lake water level for the structure. Resources and Environment in the Yangtze Basin, 2010, 19(6): 597-605. [胡振鹏, 葛刚, 刘成林等. 鄱阳湖湿地植物生态系统结构及湖水位对其影响研究. 长江流域资源与环境, 2010, 19(6): 597-605.] |
| [10] |
Gao MM, Wan LF, Ma YT et al. A comparative study on the underwater decomposition of live and dried Carex cinerascens and Phalaris arundinacea. Acta Ecologica Sinica, 2018, 38(21): 7679-7687. [高敏敏, 万凌凡, 马燕天等. 水淹条件下灰化薹草和虉草活体、枯落物分解过程的比较. 生态学报, 2018, 38(21): 7679-7687. DOI:10.5846/stxb201801160125] |
| [11] |
Zhou LF, Zhao YW, Lu XF. Effects of aquatic plant decomposition on water quality in constructed wetland. Ecology and Environmental Sciences, 2016, 25(4): 664-670. [周林飞, 赵言稳, 芦晓峰. 不同生活型植物腐解过程对人工湿地水质的影响研究. 生态环境学报, 2016, 25(4): 664-670.] |
| [12] |
Zhang LJ, Ye C, Li CH et al. The effect of submerged macrophytes decomposition on water quality. Research of Environmental Sciences, 2013, 26(2): 145-151. [张来甲, 叶春, 李春华等. 沉水植物腐解对水体水质的影响. 环境科学研究, 2013, 26(2): 145-151. DOI:10.13198/j.res.2013.02.34.zhanglj.001] |
| [13] |
Wu ZS. Studies of algae community structure and its relationships with hydrological conditions in Lake Poyang[Dissertation]. Beijing: University of Chinese Academy of Sciences, 2014. [吴召仕. 鄱阳湖藻类群落结构及其与水文条件关系研究[学位论文]. 北京: 中国科学院大学, 2014. ]
|
| [14] |
Yang JR, Lv H, Isabwe A et al. Disturbance-induced phytoplankton regime shifts and recovery of cyanobacteria dominance in two subtropical reservoirs. Water Research, 2017, 120: 52-63. DOI:10.1016/j.watres.2017.04.062 |
| [15] |
Köhler J, Wang L, Guislain A et al. Influence of vertical mixing on light-dependency of phytoplankton growth. Limnology and Oceanography, 2018, 63(3): 1156-1167. DOI:10.1002/lno.10761 |
| [16] |
Li CC, Feng WY, Chen HY et al. Temporal variation in zooplankton and phytoplankton community species composition and the affecting factors in Lake Taihu—a large freshwater lake in China. Environmental Pollution, 2019, 245: 1050-1057. DOI:10.1016/j.envpol.2018.11.007 |
| [17] |
Wu ZS, He H, Cai YJ et al. Spatial distribution of chlorophyll a and its relationship with the environment during summer in Lake Poyang: A Yangtze-connected lake. Hydrobiologia, 2014, 732(1): 61-70. DOI:10.1007/s10750-014-1844-2 |
| [18] |
Lamon Ⅲ EC, Reckhow KH, Havens KE. Using generalized additive models for prediction of chlorophyll a in Lake Okeechobee, Florida. Lakes & Reservoirs: Research & Management, 1996, 2(1/2): 37-46. DOI:10.1111/j.1440-1770.1996.tb00046.x |
| [19] |
Editorial Board of "Monitoring and analysis methods of water and wastewater", Ministry of Environmental Protection of the People's Republic of China. Monitoring and analysis methods of water and wastewater. fourth edition. Beijing: China Environmental Science Press, 2002. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法: 第4版. 北京: 中国环境科学出版社, 2002.]
|
| [20] |
Bernhard-Reversat F, Main G, Holl K et al. Fast disappearance of the water-soluble phenolic fraction in eucalypt leaf litter during laboratory and field experiments. Applied Soil Ecology, 2003, 23(3): 273-278. DOI:10.1016/S0929-1393(03)00061-1 |
| [21] |
Brinson MM, Lugo AE, Brown S. Primary productivity, decomposition and consumer activity in freshwater wetlands. Annual Review of Ecology and Systematics, 1981, 12(1): 123-161. DOI:10.1146/annurev.es.12.110181.001011 |
| [22] |
Ferreira V, Chauvet E. Synergistic effects of water temperature and dissolved nutrients on litter decomposition and associated fungi. Global Change Biology, 2011, 17(1): 551-564. DOI:10.1111/j.1365-2486.2010.02185.x |
| [23] |
Lu SY, Zhang PY, Yu G et al. The contaminants release rule of Zizania caduciflora, Phragmites austrails and Eichhornia crassipes. China Environmental Science, 2005, 25(5): 554-557. [卢少勇, 张彭义, 余刚等. 茭草、芦苇与水葫芦的污染物释放规律. 中国环境科学, 2005, 25(5): 554-557. DOI:10.3321/j.issn:1000-6923.2005.05.011] |
| [24] |
Liu BG, Tong C, Luo RT. Litter decomposition of three main plants in winter and spring in the marsh of Minjiang River estuary. Journal of Fujian Normal University: Natural Science Edition, 2008, 24(2): 80-85. [刘白贵, 仝川, 罗榕婷. 闽江河口湿地3种主要植物冬春季枯落物分解特征. 福建师范大学学报: 自然科学版, 2008, 24(2): 80-85.] |
| [25] |
Melillo JM, Aber JD, Muratore JF. Nitrogen and lignin control of hardwood leaf litter decomposition dynamics. Ecology, 1982, 63(3): 621-626. DOI:10.2307/1936780 |
| [26] |
König R, Hepp LU, Santos S. Colonisation of low- and high-quality detritus by benthic macroinvertebrates during leaf breakdown in a subtropical stream. Limnologica, 2014, 45: 61-68. DOI:10.1016/j.limno.2013.11.001 |
| [27] |
Bradford MA, Berg B, Maynard DS et al. Understanding the dominant controls on litter decomposition. Journal of Ecology, 2016, 104(1): 229-238. DOI:10.1111/1365-2745.12507 |
| [28] |
Berg B, Staaf H. Decomposition rate and chemical changes of Scots pine needle litterⅡ. Influence of stand of chemical composition.. Ecological Bulletins, 1980, 32: 373-390. |
| [29] |
Wu HT, Lu XG, Yang Q. Factors affecting litter decomposition of wetland herbaceous macrophytes. Chinese Journal of Ecology, 2006, 25(1): 1405-1411. [武海涛, 吕宪国, 杨青. 湿地草本植物枯落物分解的影响因素. 生态学杂志, 2006, 25(1): 1405-1411.] |
| [30] |
Güsewell S, Freeman C. Nutrient limitation and enzyme activities during litter decomposition of nine wetland species in relation to litter N ∶P ratios. Functional Ecology, 2005, 19(4): 582-593. DOI:10.1111/j.1365-2435.2005.01002.x |
| [31] |
Strickland MS, Osburn E, Lauber C et al. Litter quality is in the eye of the beholder: Initial decomposition rates as a function of inoculum characteristics. Functional Ecology, 2009, 23(3): 627-636. DOI:10.1111/j.1365-2435.2008.01515.x |
| [32] |
Justin SHFW, Armstrong W. The anatomical characteristics of roots and plant response to soil flooding. New Phytologist, 1987, 106(3): 465-495. DOI:10.1111/j.1469-8137.1987.tb00153.x |
| [33] |
Armstrong W, Cousins D, Armstrong J et al. Oxygen distribution in wetland plant roots and permeability barriers to gas-exchange with the rhizosphere: A microelectrode and modelling study with Phragmites australis. Annals of Botany, 2000, 86(3): 687-703. DOI:10.1006/anbo.2000.1236 |
| [34] |
Colmer TD. Long-distance transport of gases in plants: A perspective on internal aeration and radial oxygen loss from roots. Plant, Cell & Environment, 2003, 26(1): 17-36. DOI:10.1046/j.1365-3040.2003.00846.x |
| [35] |
Zhanjiang Fisheries Highschool. Freshwater chemistry for aquaculture. Beijing: Agriculture Press, 1993: 43-52. [湛江水产专科学校. 淡水养殖水化学. 北京: 农业出版社, 1993: 43-52.]
|
| [36] |
Yuan Y, Zhong HY. Study on the influence of aquatic plants on pH value of water. Jiangxi Chemical Industry, 2008(2): 62-64. [袁元, 钟鸿雁. 水生植物对水体pH值影响的原因探究. 江西化工, 2008(2): 62-64. DOI:10.3969/j.issn.1008-3103.2008.02.017] |
| [37] |
Wojewodzic MW, Kyle M, Elser JJ et al. Joint effect of phosphorus limitation and temperature on alkaline phosphatase activity and somatic growth in Daphnia magna. Oecologia, 2011, 165(4): 837-846. DOI:10.1007/s00442-010-1863-2 |
| [38] |
Tang JY, Cao PP, Xu C et al. Effects of aquatic plants during their decay and decomposition on water quality. Chinese Journal of Applied Ecology, 2013, 24(1): 83-89. [唐金艳, 曹培培, 徐驰等. 水生植物腐烂分解对水质的影响. 应用生态学报, 2013, 24(1): 83-89. DOI:10.13287/j.1001-9332.2013.0128] |
| [39] |
Li FF, Chu SY, Cui LZ et al. Research advances on the influence mechanisms of submerged plants growth and decomposition on nitrogen and phosphorus in eutrophic water. Ecological Science, 2018, 37(4): 225-230. [李菲菲, 褚淑祎, 崔灵周等. 沉水植物生长和腐解对富营养化水体氮磷的影响机制研究进展. 生态科学, 2018, 37(4): 225-230.] |
| [40] |
Han XB, Kong FX, Yan R. Several key parameters of dynamics of phosphorus uptake involved with competition for resources of Microcystis aerugionosa in Lake Taihu. J Lake Sci, 2004, 16(3): 252-257. [韩小波, 孔繁翔, 阎荣. 太湖铜绿微囊藻磷摄取动力学若干重要参数与其竞争优势相关研究. 湖泊科学, 2004, 16(3): 252-257. DOI:10.18307/2004.0310] |
| [41] |
Yang LY, Wang Q, Shi XL et al. Phosphorus metabolism of Microcystis aeruginosa during its growth process. Journal of Agro-Environment Science, 2005, 24(4): 686-689. [杨柳燕, 王勤, 史小丽等. 铜绿微囊藻磷代谢过程研究. 农业环境科学学报, 2005, 24(4): 686-689. DOI:10.3321/j.issn:1672-2043.2005.04.015] |
| [42] |
Xu S. Spatiotemporal responses of phytoplankton to nutrient limitation in Lake Taihu[Dissertation]. Nanjing: Nanjing University, 2013. [许帅. 太湖中浮游植物受营养盐限制的时空变化规律研究[学位论文]. 南京: 南京大学, 2013. ]
|
| [43] |
Jin XC, Liu HL, Tu QY et al. Chinese lake eutrophication. Beijing: China Environmental Science Press, 1990: 15-16. [金相灿, 刘鸿亮, 屠清瑛等. 中国湖泊富营养化. 北京: 中国环境科学出版社, 1990: 15-16.]
|
| [44] |
Köhler J, Behrendt H, Hoeg S. Long-term response of phytoplankton to reduced nutrient load in the flushed Lake Muggelsee (Spree system, Germany). Archiv fur Hydrobiologie, 2000, 148(2): 209-229. DOI:10.1127/archiv-hydrobiol/148/2000/209 |
| [45] |
Lee KH, Jeong HJ, Lee K et al. Effects of warming and eutrophication on coastal phytoplankton production. Harmful Algae, 2019, 81: 106-118. DOI:10.1016/j.hal.2018.11.017 |
| [46] |
Gu YL. Study the characteristics of cyanobacteria and DOM in Taihu Lake[Dissertation]. Beijing: University of Chinese Academy of Sciences, 2015. [谷依露. 太湖浮游蓝藻和水体DOM的特征研究[学位论文]. 北京: 中国科学院大学, 2015. ]
|
| [47] |
Traving SJ, Rowe O, Jakobsen NM et al. The effect of increased loads of dissolved organic matter on estuarine microbial community composition and function. Frontiers in Microbiology, 2017, 8: 351. DOI:10.3389/fmicb.2017.00351 |
| [48] |
Karlsson J, Byström P, Ask J et al. Light limitation of nutrient-poor lake ecosystems. Nature, 2009, 460(7254): 506-509. DOI:10.1038/nature08179 |
| [49] |
Mette EM, Vanni MJ, Newell JM et al. Phytoplankton communities and stoichiometry are interactively affected by light, nutrients, and fish. Limnology and Oceanography, 2011, 56(6): 1959-1975. DOI:10.4319/lo.2011.56.6.1959 |
| [50] |
Dickman EM, Vanni MJ, Horgan MJ. Interactive effects of light and nutrients on phytoplankton stoichiometry. Oecologia, 2006, 149(4): 676-689. DOI:10.1007/s00442-006-0473-5 |
| [51] |
Zhang M, Yu Y, Yang Z et al. The distribution of phytoplankton along trophic gradients and its mediation by available light in the pelagic zone of large eutrophic lakes. Canadian Journal of Fisheries and Aquatic Sciences, 2012, 69(12): 1935-1946. DOI:10.1139/f2012-113 |
| [52] |
Li L, Chen F, Zhao RF. Effects of submerged height on allelopathic inhibition of Carex cinerascens to Microcystis aeruginosa in Poyang Lake marshland. Pratacultural Science, 2015, 32(11): 1832-1837. [李林, 陈峰, 赵荣芳. 淹没对鄱阳湖洲滩灰化苔草化感抑藻的影响. 草业科学, 2015, 32(11): 1832-1837. DOI:10.11829/j.issn.1001-0629.2015-0077] |
| [53] |
Lu Q, Li L, Shu CL et al. Allelopathy effects of Carex cinerascens soaking on Microcystis aeruginosa under different concentrations of nitrogen and phosphorus. Research of Environmental Sciences, 2018, 31(7): 1316-1321. [陆琴, 李林, 舒长莉等. 氮磷营养盐水平对灰化薹草浸泡液化感抑藻的影响. 环境科学研究, 2018, 31(7): 1316-1321.] |
 2021, Vol. 33
2021, Vol. 33 

