轮虫是淡水浮游动物的主要类群之一,广泛分布于水库、湖泊、池塘等自然水体,其个体小、发育快、世代周期短,对环境变化敏感,是淡水湖泊与水库生态系统的重要监测对象[1]. 对于轮虫群落的研究,人们通常是基于轮虫物种的数量及丰度(多度)信息来分析其群落结构,如物种组成、生物量及优势种等. 由于不同的物种在形态、生理、生态特征上存在差异,以物种为单元的数量组成难以有效地表达具有特定性状的物种的生态功能与作用[2]. 在生态系统中,生物群落的生态功能依赖于物种及其多度,更取决于优势物种的功能性状[3-4]. 功能性状是指影响一个物种的生态位和竞争能力的形态或生理性状[5-6]. 单个物种在群落中的功能主要由其获取和保存资源的能力、承受竞争压力和环境胁迫的能力所决定[7]. 基于功能性状的研究已广泛应用于高等植物与动物群落的分析,目前开始应用于浮游植物、枝角类、桡足类以及鱼类群落的分析[8-11],也有不少学者开始关注轮虫的功能性状[12].
对轮虫而言,有关食物获取及逃避捕食的功能是影响一个水体中轮虫群落组成的主要因素. 轮虫能以浮游植物、细菌、碎屑等为食,同时与枝角类、桡足类及鱼类等其他水生动物存在竞争或捕食关系[13-15]. 由于水体中作为轮虫食物的浮游植物与细菌等在形态与可食性上的多样化,轮虫发展出具有灵活、复杂结构的口器,称为咀嚼器. 咀嚼器的基本结构由7块骨片组成,包括由一块砧基、一对砧枝组成的砧板和由一对槌钩、一对槌柄组成的槌板[16]. 根据淡水轮虫咀嚼器的形状和构造特点,可将其分为8种类型:槌型、槌枝型、枝型、砧型、钩型、杖型、梳型和钳型. 咀嚼器类型决定了轮虫摄取食物的方式与可摄食食物的粒径大小,如具有槌枝型咀嚼器的轮虫一般只能滤食粒径小于20 μm的颗粒,而杖型咀嚼器轮虫具有发达的腹咽肌肉,其槌钩有一个或二个齿,可以伸出口外攫取食物并将其咬碎,因此杖型咀嚼器轮虫可以选择粒径更大的食物. 捕食者是影响轮虫生存及种群多度的关键选择压力,当面对较高的捕食压力时,轮虫会采取多样化的反捕食策略,例如通过快速运动或形成反捕食的结构如背甲、棘刺等策略来防御捕食. 通过群落中物种功能性状的分析,可以进一步揭示群落的构成机制及其生态功能[17]. Oh等[18]根据轮虫咀嚼器类型将轮虫划分为8个功能群,并基于物种组成和咀嚼器功能群探讨了轮虫对水质变化的指示作用. Obertegger和Flaim[19]基于轮虫食性功能群和防御功能群探讨了环境因子对轮虫群落的影响.
我国南亚热带地区处于热带与亚热带的过渡区域,该地区水体的水温较高,以杂食性鱼类为主,对浮游动物的捕食压力大且持续时间长,枝角类的丰度和多样性相对较低,导致轮虫具有较高的多度和多样性. 水库敞水区透明度较高,生境相对简单且稳定,食物和水温直接控制轮虫种群的生长速率,但由于持续存在视觉引导的潜在捕食压力,鱼类捕食、小型无脊椎动物与来自枝角类的竞争均有可能决定群落组成. 春季水温开始上升,浮游植物大量生长,轮虫的食物资源较丰富,同时轮虫休眠卵的孵化率也提高,导致轮虫的丰度与多样性均较高,但捕食者的种群数量在此时也相应地增加,捕食压力以及来自枝角类的竞争均存在上升的趋势,这些因素都能够影响轮虫群落的结构. 为了解春季南亚热带地区水库敞水区的轮虫群落组成特征及可能的影响因素,本文以南亚热带地区43座水库为例,对其敞水区轮虫群落进行系统的调查,基于轮虫种类组成和功能性状(个体大小、摄食性状和防御性状)结构分析了春季该地区水库敞水区轮虫多样性与群落组成特征,探讨轮虫群落对水温、食物资源、竞争及捕食等因素的响应.
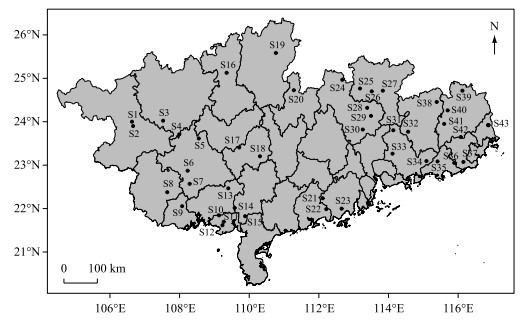
1 材料和方法 1.1 采样时间与地点于2018年3-5月对我国南亚热带地区43座代表性水库进行浮游动物样品采集,其中23座水库位于广东省,20座水库位于广西壮族自治区(图 1),水库名与对应代号见附表 Ⅰ. 水库总库容为0.14 × 108~ 138.96 × 108 m3,除天雹水库、清水江水库和牛尾岭水库为中型水库外,其余均为大型水库.
|
图 1 43座采样水库在广东与广西省的空间分布(水库(S1~S43)名称详见附表 Ⅰ) Fig.1 Locations of the forty-three investigated reservoirs in Guangdong and Guangxi provinces (all reservoirs (S1-S43) were listed in the Attached Tab.Ⅰ) |
在每座水库的大坝前或库中设置一个采样点,代表敞水区的生境样本. 浮游动物的定性样品使用孔径38 μm浮游生物网在垂直和水平方向多次拖网采集,定量样品使用5 L有机玻璃采水器从采样点的表层0.5 m处开始至底部均匀间隔采水,根据每个采样点的深度,共计采水25 L或50 L, 现场使用孔径38 μm的浮游生物网过滤浓缩,所有样品均使用5 % 甲醛溶液固定. 参考Koste[20]分类系统对轮虫样品进行种类鉴定和计数. 测定每个轮虫个体的体长和体宽,根据浮游动物形状与体积的近似计算公式计算轮虫个体体积,以近似密度1 g/cm3计算生物量[21]. 根据任晶晶等[22]的研究,将轮虫个体大小分为3个等级,即体长≤150 μm、150~300 μm以及≥300 μm的轮虫. 这种个体大小分组考虑了小型枝角类的大小以及常用浮游动物采样的网径大小,能够较直观地反映轮虫个体大小的组成特点. 现场使用YSI 6600 II型多参数水质检测仪测定采样点表层0.5 m处的水温(Temp)、叶绿素a(Chl.a)浓度,用塞氏黑白盘测定水体透明度(SD).
1.3 轮虫功能性状划分根据Obertegger和Flaim[23]对轮虫功能性状的划分方法,本文采用轮虫咀嚼器类型与防御结构作为轮虫功能性状划分依据,这两类性状涉及轮虫的食物获取、逃避和防御捕食,并且在形态学上容易识别,性状分类可靠. 其中咀嚼器类型包括:1)槌型咀嚼器(malleate trophi)、2)槌枝型咀嚼器(malleoramate trophi)、3)杖型咀嚼器(virgate trophi)、4)砧型咀嚼器(incudate trophi)、5)钩型咀嚼器(uncinate trophi)、6)枝型咀嚼器(ramate trophi)、7)钳型咀嚼器(forcipate trophi)、8)梳型咀嚼器(cardate trophi). 其中槌型咀嚼器、槌枝型咀嚼器、枝型咀嚼器轮虫为滤食性;杖型咀嚼器轮虫为掠食性;砧型咀嚼器、钩型咀嚼器、钳型咀嚼器轮虫为肉食性;梳型咀嚼器轮虫为吮吸性[24]. 防御结构包括:1)具背甲与棘刺、2)具背甲、3)无背甲.
1.4 统计分析本文中所收集和调查的非生物因子包括水库总库容、水深(Depth)、水温(Temp)、透明度(SD)、Chl.a浓度,生物因子包括竞争压力(Comp)与捕食压力(Pre). 浮游动物中,长额象鼻溞(Bosmina longirostris)等枝角类、舌状叶镖水蚤等植食性桡足类成体、无节幼体、剑水蚤幼体、哲水蚤幼体与轮虫存在竞争关系,以这些物种的丰度表征竞争压力;温中剑水蚤(Mesocyclops thermocyclopoides)、台湾温剑水蚤(Thermocyclops taihokuensis)、理查德薄皮溞(Leptodora richardi)等肉食性浮游动物与轮虫存在捕食关系,以这些物种的丰度表征捕食压力. 对轮虫群落的物种和功能性状结构进行DCA分析,排序轴最大梯度的长度分别为2.35和1.17,使用冗余分析(redundancy analysis,RDA)分析轮虫群落与环境因子的关系,并使用前向选择方法筛选显著性解释变量. 分析前剔除稀有物种(在所有采样点上累计丰度低于5 ind./L的物种)以及采样点(石榴潭水库、锦江水库、孟洲坝水库、天雹水库(缺失Chl.a浓度数据)以及龙颈水库、枫树坝水库、天堂山水库、新丰江水库、白盆珠水库、大隆洞水库、小坑水库、南水水库、白石窑水库、大龙湖水库(其轮虫总丰度均低于10 ind./L,随机误差可能较大)). 对轮虫丰度数据和功能性状数据进行lg(x+1)转换,对水库环境数据中的水库总库容进行lg(x)转换,对Chl.a浓度进行平方根转换;基于Bray-Curtis距离进行非参数多维尺度分析(non-metric multidimensional scaling,nMDS),分析轮虫群落的种类组成与咀嚼器功能性状的排序分布.
2 结果 2.1 南亚热带水库理化环境特征本文所调查的43座水库的水温范围为18.26~ 29.74℃,Chl.a浓度范围为1.88~ 63.28 μg/L,水深范围为5.5~ 80.0 m;透明度范围为0.16~ 4.50 m(附表 Ⅰ).
2.2 轮虫种类组成在调查的43座水库样品中,共检测到轮虫19属45种(附表 Ⅱ). 由于水样采集于水库敞水区,营浮游生活的异尾轮属(Trichocerca)和臂尾轮属(Brachionus)检出的种类最多,分别为10和7种;个体最大的种类是前节晶囊轮虫(Asplanchna priodonta). 出现频次最高的种类是螺形龟甲轮虫(Keratella cochlearis)和无棘龟甲轮虫(K. tecta),出现频次最低的种类是敞水胶鞘轮虫(Collotheca pelagica)、蒲达臂尾轮虫(Brachionus budapestinensis)、小镜轮虫(Testudinella parva)和长足轮虫(Rotaria neptunia),这些种类仅在1座水库出现. 轮虫种类最多的水库是百色水库(22种),最少的是天堂山水库(4种),平均每座水库13种.
新丰江水库是华南地区最大的水库,也是本次调查中透明度最高的水库,共检出轮虫7种,主要是龟甲轮属的种类;透明度最低的水库是位于广西的老虎头水库,共检出轮虫18种,主要来自臂尾轮属;3座中型水库:天雹水库、清水江水库和牛尾岭水库(牛尾岭水库还是本次调查中纬度最低的水库),分别检出轮虫8、16和15种,其中天雹水库的轮虫种类主要来自龟甲轮属和臂尾轮属,而清水江水库和牛尾岭水库的轮虫种类主要来自异尾轮属和臂尾轮属;五里峡水库是纬度最高的水库,共检出轮虫9种,主要来自臂尾轮属.
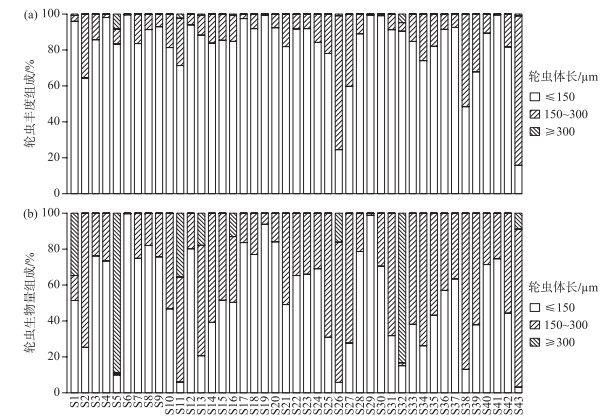
2.3 轮虫的丰度与生物量43座水库的轮虫平均丰度为133.78 ind./L,其中清水江水库(S11)的轮虫丰度最高(1842 ind./L),主要由无棘龟甲轮虫(1086 ind./L)贡献. 公平水库(S35)、新丰江水库(S32)、天堂山水库(S31)、大龙湖水库(S5)轮虫丰度较低,均低于2 ind./L,这些水库为贫营养或高强度养殖水体,较低的丰度说明这些样本可能存在较强的随机误差. 从基于轮虫体长的丰度组成来看,以体长≤150 μm的个体占优势(相对丰度为83.11 %),其次是体长为150~300 μm的个体(相对丰度为16.43 %),体长≥300 μm的个体在水库中所占比例最小,其相对丰度为0.46 % (图 2a).
|
图 2 基于个体体长的轮虫丰度组成(a)与生物量组成(b) Fig.2 Community composition of rotifers grouped with body length: (a) abundance and (b) biomass |
所调查水库的轮虫平均生物量为37.91 μg/L. 其中清水江水库的轮虫生物量最高(983.14 μg/L),主要由前节晶嚢轮虫(795.6 μg/L)贡献. 天堂山水库的轮虫生物量最低,为0.17 μg/L. 轮虫生物量组成与轮虫丰度组成较相似,以体长≤150 μm的个体占优势(相对生物量为53.10 %),其次是体长为150~300 μm的个体(相对生物量为39.96 %),体长≥300 μm的个体所占比例最低,其相对生物量为6.94 % (图 2b).
2.4 功能群组成在基于轮虫咀嚼器类型的丰度组成中,槌型咀嚼器轮虫占最大优势(相对丰度为57.78 %),其次是杖型咀嚼器轮虫(相对丰度为33.14 %),槌枝型咀嚼器轮虫的相对丰度为6.68 %;砧型咀嚼器轮虫、枝型咀嚼器轮虫和钩型咀嚼器轮虫的相对丰度均低于3 % (图 3a).

|
图 3 基于咀嚼器类型(a)和防御结构(b)的轮虫丰度组成 Fig.3 Composition of rotifers based on trophi types (a) and defensing structures (b) |
在基于轮虫防御结构的丰度组成中,具背甲与棘刺轮虫的相对丰度为66.59 %,无背甲轮虫的相对丰度为25.27 %,具背甲轮虫的相对丰度为8.12 % (图 3b).
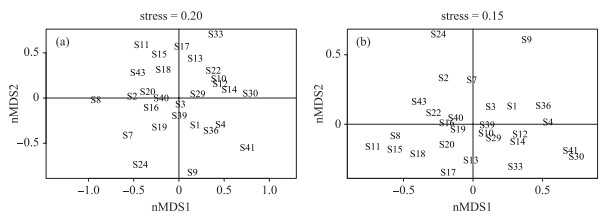
2.5 影响轮虫群落的主要因素基于轮虫种类丰度和咀嚼器类型的nMDS分析的压力值(stress)分别为0.20和0.15,表明轮虫群落结构可以由少数主轴进行排序. 在基于轮虫种类丰度的nMDS排序图中,Chl.a浓度较高的水库主要分布于第1轴上侧,Chl.a浓度较低的水库主要分布于第1轴下侧(图 4a);在基于咀嚼器类型的nMDS排序图中,Chl.a浓度较高的水库主要分布于第1轴下侧,Chl.a浓度较低的水库主要分布于第1轴上侧,反映了食物资源对轮虫群落结构的影响(图 4b). 相比基于轮虫种类丰度的nMDS排序,采样点在基于咀嚼器类型的nMDS排序图中主要分布在第1轴的附近,体现了较强的结构性.
|
图 4 基于轮虫种类丰度(a)和咀嚼器类型(b)的nMDS分析 Fig.4 Biplots of rotifer communities in non-metric multidimensional scaling (nMDS) with species (a) and trophi types (b) |
在以轮虫种类丰度为响应变量的群落RDA分析中,前向选择筛选出水温、Chl.a浓度和竞争压力为显著的解释变量(图 5a),这些环境因子显著地解释了群落变化的25.17 %. 无棘龟甲轮虫、尾突臂尾轮虫(B. caudatus)、前节晶囊轮虫、剪形臂尾轮虫(B. forficula)的丰度与水温、Chl.a浓度及竞争压力呈正相关,分布在第1轴上侧;螺形龟甲轮虫、广生多肢轮虫(Polyarthra vulgaris)、萼花臂尾轮虫(B. calyciflorus)、尖尾疣毛轮虫(Synchaeta stylata)、没尾无柄轮虫(A. ecaudis)、裂足臂尾轮虫(B. diversicornis)、沟痕泡轮虫(Pompholyx sulcata)、对棘异尾轮虫(T. stylata)的丰度与水温、Chl.a浓度及竞争压力呈正相关,分布在第1轴下侧.

|
图 5 基于轮虫种类丰度(a)和咀嚼器类型(b)的冗余分析(malleate trophi:槌型咀嚼器,malleoramate trophi:槌枝型咀嚼器,virgate trophi:杖型咀嚼器,incudate trophi:砧型咀嚼器,uncinate trophi:钩型咀嚼器,ramate trophi:枝型咀嚼器. 均以Chl.a浓度、水温(Temp)和竞争压力(Comp)为显著解释变量,性状结构具有更高的解释量) Fig.5 Biplots of rotifer communities in redundancy analysis with abundance (a) and trophi types (b) |
在以轮虫咀嚼器类型为响应变量的RDA分析中,前向选择筛选出水温、Chl.a浓度和竞争压力为显著的解释变量(图 5b),这些环境因子显著地解释群落变化的27.88 %. 砧型、杖型咀嚼器轮虫的丰度与水温、Chl.a浓度及竞争压力呈正相关,分布在第1轴上侧;槌型、槌枝型咀嚼器轮虫的丰度与Chl.a浓度、水温及竞争压力呈正相关,分布在第1轴下侧;而钩型和枝型咀嚼器轮虫分布在排序图原点附近,群落性状结构主要由优势种类的性状所主导.
3 讨论 3.1 轮虫群落的种类组成热带、亚热带地区与温带地区轮虫种类组成的差异主要是腔轮属、臂尾轮属和异尾轮属种类数量的差异,这3个属的种类主要分布在热带、亚热带地区,并成为这两个地区的常见种和优势种[25-26]. 在本次调查的水库中,异尾轮属和臂尾轮属是种类最多的两个属,共检出17种,占总种类数的38 %,与其他亚热带水库的轮虫种类组成基本一致,体现出了热带、亚热带水体轮虫种类组成的一般特征[27-29]. 腔轮属的大部分种类营着生生活,由于采样点位于敞水区,腔轮虫检出的频次不高,只在8座水库中检出.
Paine[30]的捕食假说认为热带、亚热带水体中捕食者比其他地区多,浮游动物常年处于较高的捕食压力下. 鱼类的选择压力导致轮虫以小型热带种为主,如螺形龟甲轮虫和热带龟甲轮虫等[31]. 李慧明等[32]对海南7座水库浮游动物群落的研究表明,随着水温降低和鱼类被捕捞,鱼类对浮游动物的捕食压力减弱,大个体浮游动物逐渐占优势. 在基于个体体长的轮虫丰度和生物量组成中,体长≤150 μm的轮虫丰度占有绝对优势,其生物量也占有优势;体长≥300 μm的轮虫主要是晶嚢轮虫,仅在个别水库出现且丰度不高,因而对水库轮虫丰度的贡献较小,但由于晶嚢轮虫个体重量远大于其他轮虫,在晶嚢轮虫出现的水库中,晶囊轮虫对该水库的轮虫生物量有很大贡献. Stemberger和Gilbert[33]的研究表明,小个体轮虫在贫营养水体中比较常见,而个体较大的轮虫在富营养水体比较常见. 本文中大个体轮虫主要为前节晶囊轮虫和卜氏晶囊轮虫,晶囊轮虫是较为广布性和肉食性的种类,并且是典型的机会型捕食者,在贫营养型水体的种群数量较低,而富营养水体中维持高的种群数量[34]. 本文中位于广西壮族自治区的老虎头水库(中型水库)和清水江水库(小型水库)的营养水平较高,这两座水库中的晶嚢轮虫丰度相对高.
3.2 环境因子对轮虫群落的影响 3.2.1 水温水温被认为是影响轮虫群落的重要非生物因子[35],主要由气温与水体大小、水深所决定. 尽管本次调查时间跨度较小,水温整体变幅相对较小,处于水温上升期,同时纬度较高的水库位于北部山区,水温相对较低,这也导致了43座水库之间存在水温梯度. 多元分析表明水温对轮虫群落结构的变化仍具有较大影响. 在基于轮虫种类丰度、咀嚼器功能性状的RDA分析中,均筛选出水温为显著的解释变量. 轮虫对水温有一定的耐受范围,当水温达到轮虫最适温度时,轮虫的种群增长率增加. 水温可影响轮虫的个体大小,如褶皱臂尾轮虫(Brachionus plicatilis)个体大小随水温上升而减小[36],在季节群落变化中将影响群落中种类个体大小的分组. 针对多个水库,在同一季节采样,轮虫个体大小主要由种类本身及捕食压力所决定. 针对多个水库的群落分析,本文中把轮虫个体大小分为3类,个体体长为300 μm的轮虫与小型枝角类相当,150 μm的个体与枝角类的幼体相当,这样的划分具有可比性. 另一方面,水温不仅能直接影响轮虫的生长繁殖,还可以影响作为轮虫食物资源之一的浮游植物的种类组成和丰度,进而影响轮虫的群落结构.
3.2.2 食物食物资源是影响轮虫群落结构的重要生态因子[37]. 食物浓度通常由Chl.a浓度来表征,食物浓度改变会导致轮虫群落组成的变化. 当达到某种轮虫所需的食物浓度时,该轮虫能迅速繁殖并成为群落的优势种. 在自然水体中,轮虫可利用的食物资源是多样的,但由于不同种类的轮虫在咀嚼器结构上存在差异,轮虫对食物具有选择性,因此食物的种类、粒径大小以及营养价值等都能影响轮虫的生长发育. 在基于轮虫咀嚼器功能性状的RDA分析中,槌型、槌枝型、杖型咀嚼器轮虫丰度均与Chl.a浓度及水温呈正相关. 随着水温升高,轮虫个体发育时间缩短,种群数量增加. 槌枝型咀嚼器轮虫一般摄食有机碎屑、细菌和小型浮游植物,南亚热带水库春季浮游植物以小型的硅藻为主要优势类群,为轮虫生长发育提供了食物来源. Obertegger和Flaim[19]对Tovel湖轮虫群落的研究中发现,食物在水体不同水层的分布也影响轮虫群落结构,水体表层的浮游植物丰度较高,小型轮虫也主要分布在水体上层.
3.2.3 竞争压力枝角类与轮虫在食物生态位上存在部分重叠,在食物资源净利用方面存在竞争关系[38]. 基于大小效率假说,浮游动物的滤食效率随个体增大而增大[39]. 枝角类的滤食效率较轮虫高,可以摄食粒径更大的食物,轮虫与枝角类竞争食物资源时,往往受到枝角类的抑制,特别是在鱼类捕食压力较低的情况下. 另外,轮虫之间也存在食物资源的竞争. 一般认为,小个体的轮虫具有比大个体的轮虫更低的食物浓度阈值,能在食物资源缺乏的环境中占据优势[33]. 本次调查的水库以槌型咀嚼器轮虫占优势,槌型咀嚼器轮虫个体小,食物浓度阈值低,能在食物资源短缺或食物竞争压力高时维持优势. 在对基于物种丰度和咀嚼器类型的群落结构进行RDA分析中,均筛选出以枝角类及植食性的桡足类所表征的竞争压力为显著解释变量,说明在敞水区,由于鱼类密度低,小型枝角类以及植食性的桡足类导致的竞争能够显著地影响轮虫群落,这在由咀嚼器功能性状所表征的群落结构上更为显著.
3.2.4 捕食压力捕食压力能更直接地影响轮虫群落结构,水体中轮虫的捕食者主要为浮游动物食性鱼类、大型枝角类、桡足类以及大型肉食性轮虫等. 枝角类、桡足类既是轮虫的捕食者也是竞争者,当水体中枝角类、桡足类丰度较高时,即使轮虫可利用的食物资源很丰富,其丰度也不会占优势[40]. 另外,轮虫在高捕食压力的环境下会出现诱导性防御行为,其形态和行为都会发生变化,如通过形成较长的棘刺、加快跳跃速度等方式来防御捕食. 萼花臂尾轮虫在捕食者存在时,其后棘刺明显增长,从而增强对捕食者的防御[41]. 游泳能力强的轮虫在被捕获的瞬间可通过快速运动来逃避捕食,而游泳能力弱的轮虫则较难通过游泳来逃避捕食,如多肢轮虫在将被捕食时,能迅速摆动附肢逃离,而游泳速度慢的螺形龟甲轮虫、疣毛轮虫容易被成功捕食[42-43]. 当环境中捕食压力过高时,轮虫会调整生活史策略以应对生存和繁殖压力,如提高或者降低种群增长率. 在基于轮虫种类丰度、咀嚼器功能性状的群落结构的RDA分析中,我们以肉食性的枝角类和桡足类丰度作为捕食压力,在全局模型中均为显著变量,但与其他变量(如植食性的桡足类)自相关,在进一步的显著变量筛选中被剔除,但间接说明了捕食压力的重要性.
Oh等[18]和Wen等[44]的研究表明,基于轮虫功能性状方法比基于轮虫种类丰度方法在分析轮虫对水体环境的响应中所解释方差大,功能性状与环境因子的关系更明显,强调基于功能性状的群落分组提供了轮虫群落结构分析的合理途径. 在本研究中,基于轮虫咀嚼器功能性状的RDA分析所解释的方差也是高于轮虫种类丰度的RDA分析所解释的方差,说明轮虫群落构建符合生态位原理. 需要指出的是,在我们所测定的环境变量中,缺少以浮游植物种类组成所反映食物结构的数据,仅以Chl.a浓度粗略地表示轮虫食物资源总量;同时,由于我们缺少鱼类捕食压力的量化数据,鱼类对轮虫形成的捕食压力没有直接进入数据分析,只是以水体透明度间接地反映鱼类视觉的情况,但透明度低与Chl.a浓度水平等存在相关性. 在水库中,鱼类对主要枝角类和桡足类等大型浮游动物的捕食压力高于轮虫,但与鱼类种类及水体透明度有关. 因此还不能就鱼类对轮虫的捕食压力进行有效的解析. 在现有的数据条件下,基于轮虫种类丰度和咀嚼器功能性状的群落分析均筛选出枝角类和植食性的桡足类所导致的竞争压力作为显著影响变量,说明在我国南亚热带地区水库敞水区中,竞争依然是影响轮虫群落构建的关键生态因素. 因此,在对轮虫群落功能性状结构进行分析时,需要有针对性地测定与轮虫功能性状相关的食物等环境因子,从而在多元统计中更好地反映影响轮虫群落结构的主要因素. 目前对功能性状的划分还比较粗糙,只是简单地以咀嚼器类型作为轮虫群落的分组,今后需要对功能群的划分进一步探讨. 在热带地区,有不少水库敞水区的轮虫丰度极低但具有较高的物种多样性,也反映了南亚热带地区轮虫群落构建可能存在较强的随机过程,这有待于进一步的调查与数据分析.
4 附录附表 Ⅰ~Ⅱ见电子版(DOI: 10.18307/2021.0517).
| 附表Ⅰ 采样水库的理化参数 Appendix Ⅰ Abbreviation and main environment factors of the sampling reservoirs |
| 附表Ⅱ 采样水库轮虫种类组成和功能性状组成* Appendix Ⅱ The composition of rotifer species and functional traits of the sampling reservoirs |
| [1] |
Yoshida T. Toward the understanding of complex population dynamics: Planktonic community as a model system. Ecological Research, 2005, 20(5): 511-518. DOI:10.1007/s11284-005-0074-5 |
| [2] |
Kneitel JM, Chase JM. Trade-offs in community ecology: Linking spatial scales and species coexistence. Ecology Letters, 2004, 7(1): 69-80. DOI:10.1046/j.1461-0248.2003.00551.x |
| [3] |
Hooper DU. The effects of plant composition and diversity on ecosystem processes. Science, 1997, 277(5330): 1302-1305. DOI:10.1126/science.277.5330.1302 |
| [4] |
Diaz S, Hodgson JG, Thompson K et al. The plant traits that drive ecosystems: Evidence from three continents. Journal of Vegetation Science, 2004, 15(3): 295-304. DOI:10.1111/j.1654-1103.2004.tb02266.x |
| [5] |
Geber MA, Griffen LR. Inheritance and natural selection on functional traits. International Journal of Plant Sciences, 2003, 164(S3): S21-S42. DOI:10.1086/368233 |
| [6] |
Violle C, Navas ML, Vile D et al. Let the concept of trait be functional!. Oikos, 2007, 116(5): 882-892. DOI:10.1111/j.0030-1299.2007.15559.x |
| [7] |
Grime JP ed. Plant strategies, vegetation processes and ecosystem properties. Chichester UK: John Wiley & Sons, 2001.
|
| [8] |
Abonyi A, Horváth Z, Ptacnik R. Functional richness outperforms taxonomic richness in predicting ecosystem functioning in natural phytoplankton communities. Freshwater Biology, 2018, 63(2): 178-186. DOI:10.1111/fwb.13051 |
| [9] |
Nevalainen L, Brown M, Manca M. Sedimentary record of cladoceran functionality under eutrophication and re-oligotrophication in Lake Maggiore, northern Italy. Water, 2018, 10(1): 86. DOI:10.3390/w10010086 |
| [10] |
Veríssimo H, Patrício J, Gonçalves É et al. Functional diversity of zooplankton communities in two tropical estuaries (NE Brazil) with different degrees of human-induced disturbance. Marine Environmental Research, 2017, 129: 46-56. DOI:10.1016/j.marenvres.2017.04.011 |
| [11] |
Wang C, Zhou LZ, Dai BG et al. The impacts of water level fluctuations between wet and dry seasons on taxonomic and functional diversity of fish communities in the ecotone floodplain of Lake Caizi. J Lake Sci, 2019, 31(5): 1403-1414. [王朝, 周立志, 戴秉国等. 水位洪枯变化对菜子湖江湖过渡带鱼类物种和功能多样性的影响. 湖泊科学, 2019, 31(5): 1403-1414. DOI:10.18307/2019.0501] |
| [12] |
Gomes LF, Pereira HR, Gomes ACAM et al. Zooplankton functional-approach studies in continental aquatic environments: A systematic review. Aquatic Ecology, 2019, 53(2): 191-203. DOI:10.1007/s10452-019-09682-8 |
| [13] |
Bernardi R, Giussani G, Manca M. Cladocera: Predators and prey. Hydrobiologia, 1987, 145(1): 225-243. DOI:10.1007/BF02530284 |
| [14] |
Brandl Z. Freshwater copepods and rotifers: Predators and their prey. Hydrobiologia, 2005, 546(1): 475-489. DOI:10.1007/s10750-005-4290-3 |
| [15] |
Stenson JAE. Fish impact on rotifer community structure. Hydrobiologia, 1982, 87(1): 57-64. DOI:10.1007/BF00016662 |
| [16] |
Wang JJ ed. Freshwater rotifers of China. Beijing: Science Press, 1961. [王家楫. 中国淡水轮虫志. 北京: 科学出版社, 1961.]
|
| [17] |
McGill BJ, Enquist BJ, Weiher E et al. Rebuilding community ecology from functional traits. Trends in Ecology & Evolution, 2006, 21(4): 178-185. DOI:10.1016/j.tree.2006.02.002 |
| [18] |
Oh HJ, Jeong HG, Nam GS et al. Comparison of taxon-based and trophi-based response patterns of rotifer community to water quality: Applicability of the rotifer functional group as an indicator of water quality. Animal Cells and Systems, 2017, 21(2): 133-140. DOI:10.1080/19768354.2017.1292952 |
| [19] |
Obertegger U, Flaim G. Taxonomic and functional diversity of rotifers, what do they tell us about community assembly?. Hydrobiologia, 2018, 823(1): 79-91. DOI:10.1007/s10750-018-3697-6 |
| [20] |
Koste W ed. Rotatoria. Berlin: GebrVder Borntraege, 1978.
|
| [21] |
Zhang ZS, Huang XF eds. Freshwater plankton research method. Beijing: Science Press, 1991. [章宗涉, 黄祥飞. 淡水浮游生物研究方法. 北京: 科学出版社, 1991.]
|
| [22] |
Ren JJ, Lin QQ, Han BP. Species diversity and community structure of rotifers in pelagic zones of seven reservoirs, Hainan Province. J Lake Sci, 2010, 22(2): 272-280. [任晶晶, 林秋奇, 韩博平. 热带水库敞水区轮虫种类组成与数量结构——基于海南7座典型水库的分析. 湖泊科学, 2010, 22(2): 272-280. DOI:10.18307/2010.0218] |
| [23] |
Obertegger U, Flaim G. Community assembly of rotifers based on morphological traits. Hydrobiologia, 2015, 753(1): 31-45. DOI:10.1007/s10750-015-2191-7 |
| [24] |
Virro T, Haberman J, Haldna M et al. Diversity and structure of the winter rotifer assemblage in a shallow eutrophic northern temperate Lake Võrtsjärv. Aquatic Ecology, 2009, 43(3): 755-764. DOI:10.1007/s10452-009-9276-1 |
| [25] |
Lin QQ, Zhao SY, Han BP. Rotifer distribution in tropical reservoirs, Guangdong Province, China. Acta Ecologica Sinica, 2005, 25(5): 1123-1131. [林秋奇, 赵帅营, 韩博平. 广东省水库轮虫分布特征. 生态学报, 2005, 25(5): 1123-1131. DOI:10.3321/j.issn:1000-0933.2005.05.026] |
| [26] |
Segers H ed. Zoogeography of the southeast Asian Rotifera. Rotifera IX. Dordrecht: Springer Netherlands, 2001, 233-246. DOI:10.1007/978-94-010-0756-6_32 |
| [27] |
Wang XH, Wang T, Lin QQ et al. Species composition and quantitative dynamics of rotifers in a pumped storage, eutrophic reservoir in South China. J Lake Sci, 2009, 21(1): 101-109. [王晓辉, 望甜, 林秋奇等. 南亚热带富营养化抽水型水库轮虫的组成与动态. 湖泊科学, 2009, 21(1): 101-109. DOI:10.18307/2009.0113] |
| [28] |
Wang XH, Wang T, Lin QQ et al. Specific composition and structure of meta-zooplankton community in a pumped storage reservoir, South China. Acta Ecologica Sinica, 2009, 29(1): 456-465. [王晓辉, 望甜, 林秋奇等. 华南地区典型抽水型水库后生浮游动物群落的种类组成与结构. 生态学报, 2009, 29(1): 456-465. DOI:10.3321/j.issn:1000-0933.2009.01.054] |
| [29] |
Huang K, Li HM, Xu SL et al. Comparative analysis of rotifer community structures in two pumped-storage reservoirs with different retention times. J Lake Sci, 2019, 31(3): 853-861. [黄珂, 李慧明, 徐少林等. 不同水力调度模式的两座调水型水库轮虫群落结构的比较. 湖泊科学, 2019, 31(3): 853-861. DOI:10.18307/2019.0323] |
| [30] |
Paine RT. Food web complexity and species diversity. The American Naturalist, 1966, 100(910): 65-75. DOI:10.1086/282400 |
| [31] |
Zhao SY, Han BP. Structural analysis of zooplankton community in a large deep oligotrophic reservoir—Xinfengjiang Reservoir, South China. J Lake Sci, 2007, 19(3): 305-314. [赵帅营, 韩博平. 大型深水贫营养水库——新丰江水库浮游动物群落分析. 湖泊科学, 2007, 19(3): 305-314. DOI:10.18307/2007.0312] |
| [32] |
Li HM, Chen H, Han XY et al. Characters of community structure of planktonic crustaceans in open water of tropical reservoirs, Hainan Province of China. J Lake Sci, 2011, 23(2): 251-256. [李慧明, 陈花, 韩小玉等. 海南热带水库敞水区浮游甲壳动物群落结构特征. 湖泊科学, 2011, 23(2): 251-256. DOI:10.18307/2011.0214] |
| [33] |
Stemberger RS, Gilbert JJ. Body size, food concentration, and population growth in planktonic rotifers. Ecology, 1985, 66(4): 1151-1159. DOI:10.2307/1939167 |
| [34] |
Kappes H, Mechenich C, Sinsch U. Long-term dynamics of Asplanchna priodonta in Lake Windsborn with comments on the diet. Hydrobiologia, 2000, 432(1/2/3): 91-100. DOI:10.1023/A:1004022020346 |
| [35] |
Bērzinš B, Pejler B. Rotifer occurrence in relation to temperature. Hydrobiologia, 1989, 175(3): 223-231. DOI:10.1007/BF00006092 |
| [36] |
Walczyńska A, Franch-Gras L, Serra M. Empirical evidence for fast temperature-dependent body size evolution in rotifers. Hydrobiologia, 2017, 796(1): 191-200. DOI:10.1007/s10750-017-3206-3 |
| [37] |
Hessen DO, Faafeng BA, Smith VH et al. Extrinsic and intrinsic controls of zooplankton diversity in lakes. Ecology, 2006, 87(2): 433-443. DOI:10.1890/05-0352 |
| [38] |
Gilbert JJ. Suppression of rotifer populations by Daphnia: A review of the evidence, the mechanisms, and the effects on zooplankton community structure1. Limnology and Oceanography, 1988, 33(6): 1286-1303. DOI:10.4319/lo.1988.33.6.1286 |
| [39] |
Hall DJ, Threlkeld ST, Burns CW et al. The size-efficiency hypothesis and the size structure of zooplankton communities. Annual Review of Ecology and Systematics, 1976, 7(1): 177-208. DOI:10.1146/annurev.es.07.110176.001141 |
| [40] |
Lair N. Effects of invertebrate predation on the seasonal succession of a zooplankton community: A two year study in Lake Aydat, France. Hydrobiologia, 1990, 198(1): 1-12. DOI:10.1007/BF00048618 |
| [41] |
Sarma SSS, Resendiz RAL, Nandini S. Morphometric and demographic responses of brachionid prey (Brachionus calyciflorus Pallas and Plationus macracanthus (Daday)) in the presence of different densities of the predator Asplanchna brightwellii (rotifera: Asplanchnidae). Hydrobiologia, 2011, 662(1): 179-187. DOI:10.1007/s10750-010-0494-2 |
| [42] |
Gilbert JJ. Escape response of the rotifer Polyarthra: A high-speed cinematographic analysis. Oecologia, 1985, 66(3): 322-331. DOI:10.1007/BF00378293 |
| [43] |
Gilbert JJ. The Polyarthra escape from response: Defense against interference from Daphnia. Hydrobiologia, 1987, 147(1): 235-238. DOI:10.1007/BF00025748 |
| [44] |
Wen XL, Zhai P, Feng RN et al. Comparative analysis of the spatio-temporal dynamics of rotifer community structure based on taxonomic indices and functional groups in two subtropical lakes. Scientific Reports, 2017, 7: 578. DOI:10.1038/s41598-017-00666-y |
 2021, Vol. 33
2021, Vol. 33 

