(2: 中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室, 南京 210008)
(3: 中国科学院南京土壤研究所土壤与农业可持续发展国家重点实验室, 南京 210008)
(2: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P. R. China)
(3: State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, P. R. China)
在夏季湖泊暴发的蓝藻水华中,微囊藻(Microcystis spp.)是主要优势种. 当气象和水文条件适宜时,微囊藻会迅速繁殖并聚集,形成微囊藻水华[1-2]. 微囊藻能产生毒素、消耗氧气及释放气味化合物等,从而带来一系列生态问题和健康风险[3-4]. 微囊藻在自然界中普遍以群体形态存在,这也是微囊藻属能在淡水生态系统中占据独特生态位,形成优势的重要原因之一[5-6]. 在富营养化湖泊中,微囊藻的生长繁殖除了受环境因素,例如温度、光照和氮磷供应水平等的影响[7-9],还与大量定殖在藻群体上的或者游离在藻细胞周围的异养细菌关系密切[1]. 研究表明细菌能够影响微囊藻的形态和群体形成[10],并且微囊藻与其附生细菌之间具有密切的代谢偶联关系[11]. Zhang等[12]发现,藻际细菌群落促进了不同水华蓝藻之间的演替,表明了附生细菌在微囊藻生长及其水华发生发展中起到了重要作用.
同时,微囊藻水华也会影响水体细菌群落结构组成[13-14]. 藻类通过分泌胞外多糖等代谢产物影响藻周围生境中的物质组成[15-17],从而影响周围细菌的群落结构. 不同藻的胞外多糖含量和组成不同[9],故特定藻的附生细菌相对于其他的藻具有特异性[18-19]. 虽然在不同湖泊生境下同种微囊藻群体上的细菌群落组成趋于相似[19],但细菌群落多样性会随着微囊藻水华的发展产生波动[20]. 此外,微囊藻群体的附生细菌组成不同于游离细菌或其他沉降颗粒附生细菌的,具有明显的特异性[21]. 细菌群落组成除了因不同水华阶段和优势蓝藻种类的不同而发生变化外,也会受到温度等环境因素的影响[22]. Wang等[23]发现环境因素对洱海藻类附生细菌和游离细菌群落组成的影响要大于浮游植物群落组成的影响,其中温度是主要的环境影响因素之一. 有研究报道,附生细菌和游离细菌由于受到温度等环境因素的影响,两者群落组成之间共享的OTUs占59 % (占总reads的96 %),部分细菌会在附生状态和游离状态之间发生转变[24]. 因此,藻的附生菌中存在稳定附着和随机附着的类型,探讨环境条件变化下的稳定附着细菌群落组成是进一步深入研究藻-菌关系的重要方面.
由于在野外微囊藻水华中多种蓝藻种属经常共存,因此,细菌群落组成往往受到多种因素综合的影响,揭示其影响规律较为困难. 而关于微囊藻附生菌的室内研究,大都以单细胞微囊藻作为研究对象[22].单细胞微囊藻与群体微囊藻在形态和生理上有很大差异,比如微囊藻群体株系细胞壁表面相比单细胞株系具有更厚的表层蛋白(S-layer)[25]. 对于单一微囊藻群体附生细菌群落组成对温度的响应目前仍不清楚. 为了进一步探究在温度变化下,微囊藻群体上细菌群落组成及其在温度波动下的核心微生物类群,本研究以从太湖分离的一株群体铜绿微囊藻为材料,揭示了在4种温度下附生与游离细菌群落组成的相对稳定性和动态变化规律,从而有助于了解藻-菌相互关系对微囊藻水华生消的影响.
1 材料与方法 1.1 实验材料 1.1.1 藻种培养和采样本研究采用的铜绿微囊藻(Microcystis aeruginosa)群体D2,下文简称“D2群体”,由蔡元锋博士在2011年从太湖分离纯化得到. 将扩大培养后的D2群体,接种到含250 mL BG-11培养基的500 mL灭菌玻璃三角瓶中,并放置在设定不同温度的光照培养箱中进行培养,初始接种浓度为5×104 cells/mL. 综合文献报道[7, 26]及对太湖湖水温度的调查,本实验将温度梯度设置为15、20、25和30℃,来模拟野外微囊藻所处的温度. 实验每组设置3个平行,光暗周期为12 h ∶12 h,光照强度为50 μmol photons/(m2 ·s). 根据预实验结果,分别在第15、35、45和65天取样. 取样前轻轻摇匀,使D2群体均匀分布. 微囊藻单个细胞大小一般为3~5 μm,而微囊藻群体一般含4个以上微囊藻细胞,因此,取适量体积藻液(10 mL)后,依次过滤在20、3和0.2 μm的滤膜(47 mm直径,Millipore,Germany)上,则分别代表微囊藻群体(>20 μm)、单细胞-小群体(3~20 μm)和游离(0.2~3 μm)等3种不同粒径中的细菌群落,滤膜保存在-80℃,直至分析使用.
1.1.2 主要仪器与试剂光照培养箱和PCR仪(ABI GeneAmp® 9700型)等. 乙基黄原酸钾、乙酸铵、EDTA、Tris-HCl、10 % SDS、RNase A、异丙醇、70 % 乙醇和无菌水等.
1.2 实验方法 1.2.1 DNA提取DNA提取采用乙基黄原酸钾(XS)法[27-28],处理过程如下:取出过滤样品得到的3种梯度滤膜,用干净灭菌剪刀剪碎后,置于1.5 mL的离心管中,加入50 μL的TER(10 mmmol/L Tris-HCl,pH=7.4;1 mmol/L EDTA,pH=8;100 mg/mL RNase A)溶液. 随后加入新制的XS缓冲液(1 % XS;100 mmmol/L Tris-HCl,pH=7.4;20 mmmol/L EDTA,pH=8;1 % SDS;800 mmmol/L ammonium acetate),前后摇晃,混合. 将混合后的细胞裂解液在70℃下水浴60 min,期间每隔10 min摇晃一次. 之后,将试管剧烈涡流10 s,再置于冰上30 min. 将细胞裂解液以14000 r/min,在4℃下离心10 min,去除细胞碎片. 随后将上清液小心地转移到含有750 μL异丙醇的离心管中,在室温下放置10 min. 在12000×g,4℃下离心10 min,使得DNA沉淀. 之后加入70 % 乙醇,在12000×g,4℃下离心10 min洗涤沉淀,并风干. 最后将DNA溶解在50 μL的无菌水中.
1.2.2 PCR扩增用338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)引物对V3-V4可变区进行PCR扩增[29],并添加barcode序列,程序如下:95℃预变性3 min,27个循环(95℃变性30 s,55℃退火30 s,72℃延伸30 s),最后72℃延伸10 min. 采用TransGen AP221-02:TransStart Fastpfu DNA Polymerase,20 μL扩增体系:10 ng DNA模板,0.8 μL BSA,0.4 μL FastPfu聚合酶,0.8 μL的正向引物(5 μmol/L)和反向引物(5 μmol/L),2 μL 2.5 mmol/L dNTPs和4 μL 5×FastPfu缓冲液,最后加ddH2O至20 μL.
1.2.3 Illumina MiSeq测序用2 % 琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA)进行纯化,Tris-HCl洗脱,2 % 琼脂糖电泳检测. 利用QuantiFluorTM-ST(Promega,USA)进行检测定量. 根据Illumina MiSeq平台(Illumina,San Diego,USA)标准操作规程将纯化后的扩增片段构建PE 2*300的文库. 利用Illumina公司的Miseq PE 300平台进行测序,由上海美吉生物医药科技有限公司完成. 原始序列提交到NCBI数据库,BioProject序列号为PRJNA700808.
1.3 数据处理原始测序序列使用Trimmomatic软件质控,使用FLASH软件[30]进行拼接. 使用UPARSE软件[31](version7.1 http://drive5.com/uparse/),根据97 % 的相似度对序列进行OTU聚类,并在聚类的过程中去除单序列和嵌合体. 利用RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释[32],比对Silva数据库(SSU123),设置比对阈值为70 %. 利用mothur软件(version 1.30.1)进行Alpha多样性分析(http://www.mothur.org/wiki/Schloss_SOP#Alpha_diversity),包括物种丰富度Chao1指数,Shannon-Wiener多样性指数(以下简称Shannon指数)和谱系多样性PD指数(以下简称PD指数)[33],指数组间差异采用Wilcoxon秩和检验(Wilcoxon rank-sum test)确定. 统计分析和相关绘图利用Origin 9.1、GraphPad Prism 9和R语言平台实现:R语言‘vegan’软件包进行NMDS和PERMANOVA分析和作图;‘stats’软件包进行组间差异显著性检验;并利用R完成群落组成分析和Venn图分析. 单因素相关性网络分析使用Python语言‘Networkx’工具包确定,筛选条件为:选取属分类水平上总丰度前50的物种,并计算物种之间的斯皮尔曼(Spearman)等级相关系数(|R|≥0.5,P < 0.05). 除了单因素相关性网络分析包含蓝藻序列外,以上其它分析均去除蓝藻序列.
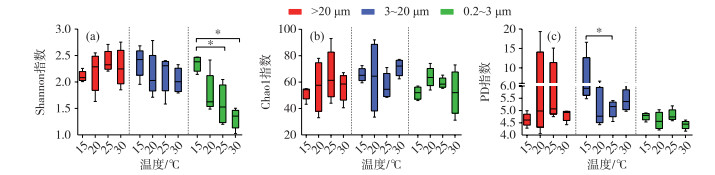
2 结果分析 2.1 D2群体培养体系中不同粒径细菌群落的多样性受温度的影响Alpha多样性分析显示,在微囊藻群体附生细菌群落中,不同温度下的细菌群落多样性指数和丰富度指数均没有显著性差异(图 1a~c),但15℃下,单细胞-小群体附生细菌群落的群落多样性PD指数要显著高于25℃下的(P < 0.05)(图 1c),且在游离细菌群落中,15℃下细菌群落Shannon多样性指数显著高于25℃和30℃(P < 0.05)(图 1a),表明单细胞-小群体附生细菌群落和游离细菌群落在温度较低时组成更为多样.
|
图 1 D2群体培养体系中群体(>20 μm)附生细菌、单细胞-小群体(3~20 μm)附生细菌和游离(0.2~3 μm)细菌群落在15、20、25和30℃下Alpha多样性比较分析(Wilcoxon秩和检验,*P < 0.05,去除蓝藻序列) Fig.1 Comparative analysis of alpha diversity of bacteria communities in colonial D2 culture systems at 15, 20, 25 and 30℃ attached with Microcystis colony (>20 μm), single cell-small colony (3-20 μm) and free-living (0.2-3 μm) bacterial community, respectively (Wilcoxon rank-sum test, *P < 0.05, after removing cyanobacteria sequences) |
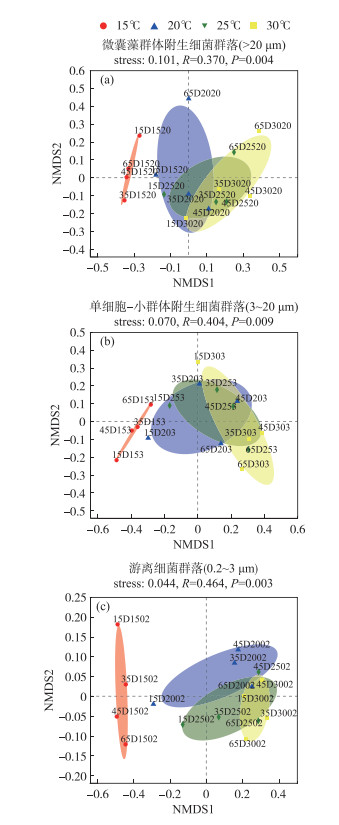
对于Beta多样性,基于Bray-Curtis距离的NMDS分析表明,温度均显著影响微囊藻群体(图 2a)、单细胞-小群体附生(图 2b)和游离细菌(图 2c)群落分布(PERMANOVA,P < 0.01);PERMANOVA分析揭示,温度能分别单独解释3组细菌群落组成总体差异的44.38 %、45.97 % 和65.35 %,则表明相比微囊藻群体附生细菌和单细胞-小群体附生细菌,温度变化对游离细菌群落组成影响要大(P < 0.01).
|
图 2 D2群体培养体系中不同粒径下的细菌群落基于Bray-Curtis距离的非度量多维尺度(NMDS)分析(OTU水平,去除蓝藻序列) (注:以15D1520为例,其表示第15天时,D2群体在15℃、>20 μm粒径细菌群落样本) Fig.2 Non-metric Multidimensional Scaling (NMDS) ordination based on Bray-Curtis distances of bacterial communities of different particles at OTU level (after removing cyanobacteria sequences) |
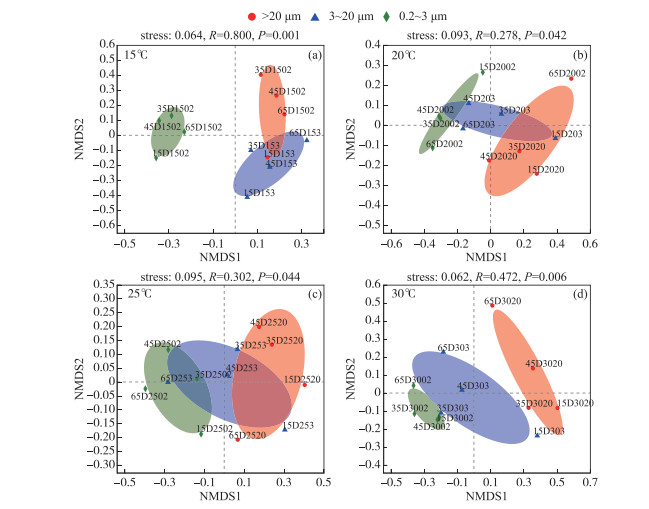
而同一温度下,微囊藻群体、单细胞-小群体附生和游离细菌群落分布也具有差异性(图 3). PERMANOVA分析揭示,粒径大小能分别单独解释15、20、25和30℃下样本群落组成总体差异的60.87 %、37.29 %、35.74 % 和48.22 %. 在15℃和30℃下,3种粒径大小下的细菌群落具有极显著差异(P < 0.01),20和25℃下不同粒径细菌群落组成具有显著性差异(P < 0.05). 这些结果表明,不同粒径大小能够显著影响D2铜绿微囊藻群体的细菌群落组成,且在15℃和30℃下,细菌群落组成差异性更大(P < 0.01).
|
图 3 不同温度下的D2群体培养体系中细菌群落基于布雷柯蒂斯(Bray-Curtis)距离的非度量多维尺度(NMDS)分析(OTU水平)(a~d分别代表 15、20、25和30℃下细菌群落组成差异(去除蓝藻序列)) Fig.3 Non-metric Multidimensional Scaling (NMDS) ordination based on Bray-Curtis distances of bacteria communities at different temperatures at OTU level (a-d represent the composition differences of bacterial communities at 15, 20, 25 and 30℃, respectively (after removing cyanobacteria sequences)) |
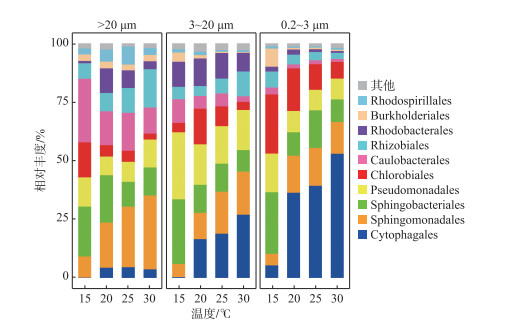
综合4次时间点取样的平均值,由温度对D2群体细菌群落组成影响的分析结果表明,在微囊藻群体附生细菌群落中,Sphingomonadales、Caulobacterales和Sphingobacteriales是优势菌目,分别占总相对丰度的21.35 %、17.18 % 和15.99 %;而单细胞-小群体附生细菌群落中,有19.74 % 是Pseudomonadales,其次是Cytophagales和Sphingobacteriales,分别占总相对丰度的15.65 % 和15.14 %;Cytophagales、Sphingobacteriales和Chlorobiales则在游离的细菌群落中相对丰富,分别占总相对丰度的33.44 %、15.48 % 和15.32 % (图 4).
|
图 4 D2群体培养体系中不同粒径包括微囊藻群体(>20 μm)附生细菌、单细胞-小群体(3~20 μm) 附生细菌和游离(0.2~3 μm)细菌在15、20、25和30℃下的目水平群落组成(去除蓝藻序列) Fig.4 At order level, composition of bacteria communities attached with Microcystis colony (>20 μm), single cell-small colony (3-20 μm) and free-living (0.2-3 μm) bacterial community in colonial D2 culture systems level at 15, 20, 25 and 30℃ (after removing cyanobacteria sequences) |
随着温度的变化,这些不同粒径下的优势菌目,呈现不同的变化趋势(图 4). 在微囊藻群体附生细菌群落中,Sphingomonadales相对丰度在15℃下最低,占8.97 %,当在30℃时相对丰度增加至31.45 %,总体呈现上升趋势;Caulobacterales和Sphingobacteriales在15℃时,相对丰度相近,分别是27.04 % 和21.26 %,但不同的是,Caulobacterales相对丰度在20℃时降至14.42 %,随后在25℃和30℃下波动较小;而Sphingobacteriales相对丰度在20℃下占20.17 %,基本与15℃下持平,随后在25℃下降至10.61 %,再在30℃下基本保持稳定.
在单细胞-小群体附生细菌群落中,Pseudomonadales和Sphingobacteriales相对丰度变化趋势接近,两者都在15℃下最高,分别占28.63 % 和27.53 %,且在20℃下均开始下降,分别降至17.29 % 和11.94 %;不同的是,Pseudomonadales相对丰度在25℃时,有略微下降后(占15.94 %),在30℃下又回到接近20℃下的值,为17.09 %,而Sphingobacteriales在20℃和25℃下,相对丰度先保持稳定,在30℃下又略微下降. Cytophagales则在15℃时相对丰度极低,仅占0.31 %,随后在其它3个温度下,依次增加,在30℃下,增加至26.93 %.
在游离细菌群落中,Cytophagales在4个温度下整体有较大的增长幅度,在15℃下,其相对丰度占5.32 %,当在30℃下相对丰度占比增加至52.90 %;Sphingobacteriales的相对丰度在15℃下与Chlorobiales的相对丰度接近,分别为26.22 % 和25.17 %. 随后,Sphingobacteriales相对丰度下降幅度较Chlorobiales的大,在20℃时,两者的相对丰度分别是9.96 % 和18.11 %,但之后Sphingobacteriales基本保持稳定,而Chlorobiales持续下降,到30℃时两者的相对丰度占比分别是9.66 % 和7.09 %.
在目水平上(图 5),微囊藻群体附生细菌群落中,Sphingomonadales在15℃下的相对丰度要显著低于25℃和30℃下的(P < 0.05),Chlorobiales相对丰度在15℃下要显著高于其余3个温度下的(P < 0.05),而Rhodobacterales相对丰度在15℃下要显著低于20℃和25℃下的(P < 0.05). 在单细胞-小群体附生细菌群落中,Sphingobacteriales相对丰度在15℃下显著高于20℃和25℃下的(P < 0.05),极显著高于30℃下的(P < 0.01),而Rhodospirillales在15℃下的相对丰度,分别与25℃和30℃下的相对丰度,有极显著(P < 0.01)和显著差异(P < 0.05);而游离细菌群落中的Cytophagales相对丰度,在15℃下要显著低于20℃和25℃下的(P < 0.05),极显著低于30℃下的(P < 0.001),Sphingomonadales相对丰度在15℃下要显著高于其在20℃下的(P < 0.05),Chlorobiales相对丰度在15℃下要显著高于25℃和30℃下的值(P < 0.05),且在20℃下的相对丰度显著高于30℃下的(P < 0.05),Burkholderiales在15℃下占优势,相对丰度极显著高于其余3个温度下的值(P < 0.01),Caulobacterales相对丰度在15℃下要极显著高于30℃下的(P < 0.01). 结果表明,在微囊藻群体附生细菌群落中,Sphingomonadales和Rhodobacterales在15℃下相对丰度较低,而Chlorobiales相反,其在15℃下具有较高的相对丰度;在单细胞-小群体附生细菌群落中,Sphingobacteriales更能适应15℃环境;而在游离细菌群落中,Cytophagales在温度高的环境占据优势,Chlorobiales和Burkholderiales更能适应15℃环境.

|
图 5 D2群体培养体系中不同粒径包括微囊藻群体(>20 μm)附生细菌、单细胞-小群体(3~20 μm) 附生细菌和游离(0.2~3 μm)细菌群落在15、20、25和30℃下目水平的丰度差异(去除蓝藻序列,One-way ANOVA,*P < 0.05,* *P < 0.01,* * *P < 0.001) Fig.5 At order level, differential abundance of bacterial communities attached with Microcystis colony (>20 μm), single cell-small colony (3-20 μm) and free-living (0.2-3 μm) bacterial community in colonial D2 culture systems at 15, 20, 25 and 30℃ (after removing cyanobacteria sequences, One-way ANOVA, *P < 0.05, * *P < 0.01, * * *P < 0.001) |
在属水平上,微囊藻群体、单细胞-小群体附生和游离细菌群落,在不同温度下均存在的微生物(以下称为核心物种)数量分别是34、37和28个(图 6). 在微囊藻群体附生细菌群落核心物种中,Porphyrobacter、Brevundimonas、Chitinophaga和OPB56相对丰度占比较高,分别占到22.45 %、13.20 %、12.20 % 和6.88 %;其中,Porphyrobacter相对丰度从15℃的7.04 %,增加到30℃的34.23 %;Brevundimonas和OPB56相对丰度变化总体趋势则相反,在15~30℃下的占比变化范围分别为5.27 % ~28.01 % 和1.63 % ~17.01 %,而Chitinophaga在15℃和20℃下相对丰度不变,之后随着温度升高而降低,占比变化范围是2.44 % ~21.64 %. 在单细胞-小群体附生细菌群落核心物种中,Mariniradius、Porphyrobacter、Gemmobacter和Chitinophaga是优势属,分别占物种总相对丰度的19.75 %、13.99 %、12.73 % 和11.71 %;从15~30℃,Mariniradius呈先增后减的趋势,在25℃下相对丰度达到最高,波动范围为0.32 % ~30.49 %,但在20℃到30℃下的变化相对稳定,为30.49 % ~32.70 %;Porphyrobacter相对丰度随着温度的升高而增加,占比变化范围是3.38 % ~21.38 %,而Chitinophaga则相反,相对丰度随着温度的升高而降低,在1.52 % ~31.10 % 范围内变化;Gemmobacter相对丰度在不同温度下变化幅度相对较小,为11.04 % ~11.41 %. 在游离细菌群落核心物种中,Mariniradius、Porphyrobacter、OPB56和unclassified Sphingobacteriales相对丰度最高,分别占到40.97 %、13.43 %、13.01 % 和11.26 %. Mariniradius丰度整体随着温度升高而增加,但在20℃和25℃下的相对丰度占比相近,总体占比变化范围为5.47 % ~63.44 %;Porphyrobacter在20℃温度时,相对丰度增加到最高值,随后在25℃和30℃下较为稳定,总体占比变化范围是2.39 % ~15.45 %;OPB56在15~30℃的变化下,相对丰度逐渐降低,占比在2.83 % ~26.73 % 范围内变化;unclassified Sphingobacteriales在20℃下丰度很低,总体呈先减后增的趋势,占比变化范围是9.20 % ~17.27 %. 由结果可见,在微囊藻群体附生细菌群落中,Brevundimonas和OPB56的相对丰度在温度20~30℃之间相对稳定;在单细胞-小群体附生细菌群落中的核心优势菌属中,Mariniradius相对丰度在20~30℃之间较为稳定,且在4种温度下Gemmobacter相对丰度均较为一致;在游离细菌群落中的核心优势菌属,Porphyrobacter相对丰度在温度20~30℃之间保持相对稳定.

|
图 6 D2群体培养体系中不同粒径包括微囊藻群体(>20 μm)附生细菌、单细胞-小群体(3~20 μm) 附生细菌和游离(0.2~3 μm)细菌群落在15、20、25和30℃下属水平的核心微生物组分析(去除蓝藻序列) Fig.6 At genus level, analysis of core microbiomein bacterial communities attached with Microcystis colony (>20 μm), single cell-small colony (3-20 μm) and free-living (0.2-3 μm) bacterial community in colonial D2 culture systems at 15, 20, 25 and 30℃ (after removing cyanobacteria sequences) |
图 7显示了在属水平上,不同温度下的D2群体培养体系中,藻-菌及菌-菌等细菌群落间的相互关系网络,并在门水平上以不同颜色对节点进行区分,绿色连线表示正相关,红色连线表示负相关,线越多,表示该物种与其他物种之间的联系越密切. 在15℃下的物种相关性网络节点数虽然仅略高于25℃下的(表 1),但前者连线数最高,有296条连线,其中正相关155条,负相关141条,后者连线数最低,有166条显著相关的边,其中正相关131条,负相关35条;20℃和30℃下物种相关性网络节点数相等,均为49个,但30℃下网络连线数有216条,其中正相关145条,负相关71条,而20℃下连接数有185条,其中正相关122条,负相关63条. 结果表明(表 1),在15℃和30℃下,不同粒径细菌群落间的交流作用相对紧密,其次是20℃和25℃下的,且不同温度下,D2群体物种间正负相关连线数比均大于1,说明当温度发生变化时,物种间的合作关系仍占主要地位;此外,25℃下D2群体物种间的连线数虽然是最少的,但正负相关连线数比是最高的,为3.74,而15℃则相反,细菌不同物种间联系最为密切,但正负相关连线数比最低,为1.10,说明温度升高促进了细菌之间的合作关系.
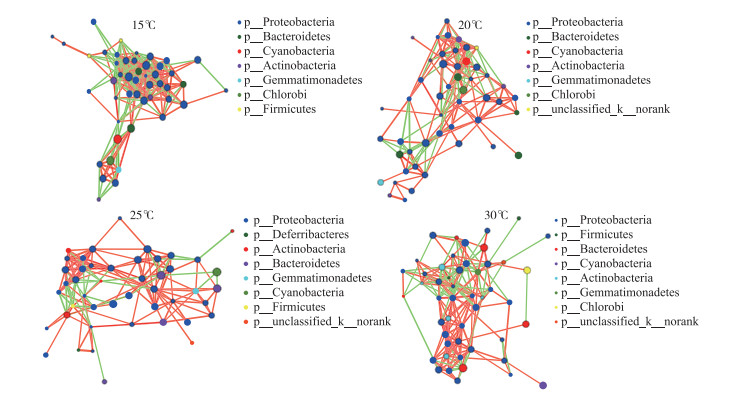
|
图 7 D2群体培养体系中细菌群落在15、20、25和30℃下物种相关性网络复杂度分析(包含蓝藻序列) Fig.7 Complexity analysis of species-related network of bacteria communities in colonial D2 culture systems at 15, 20, 25 and 30℃(including cyanobacteria sequences) |
| 表 1 D2群体培养体系中细菌群落在15、20、25和30℃下物种相关网络特征参数(含蓝藻序列) Tab. 1 Key parameters of species-related network in bacterial community in colonial D2 culture systems at different temperatures (including cyanobacteria sequences) |
在物种相关性网络图中,一个物种节点(species-node)连接的节点数目越多,表示该节点的连通性(degree)越高,一个节点的连通性越高就意味着该节点的度中心性(degree centrality)越高,利用这种方法可找到Hub节点,确定关键物种(keystone taxa)[34]. 此外,紧密中心性(closeness centrality)和介数中心性(betweenness centrality)也能作为关键物种的确定条件[35]. 综合高度中心性、高紧密中心性和低介数中心性这3个指标(图 8),本研究确定了D2群体细菌群落在不同温度下相关网络关键物种. 结果发现,在15、20、25和30℃下,D2群体细菌群落相关性网络的关键物种分别是Hydrogenophaga、FukuN57、Alphaproteobacteria和Sphingomonas(表 2).
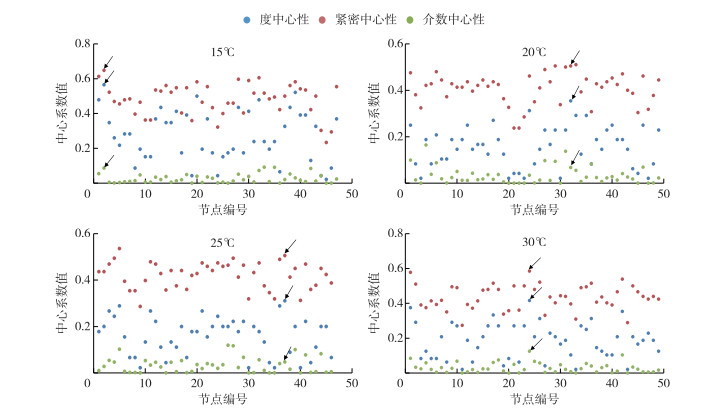
|
图 8 D2群体培养体系中细菌群落在15、20、25和30℃下物种相关性网络中心性分析(含蓝藻序列, 箭头所示为关键物种) Fig.8 Centrality analysis of species-related network of bacterial communities in colonial D2 culture systems at 15, 20, 25 and 30℃ (including cyanobacteria sequences, the arrows showed the keystone taxa) |
| 表 2 D2群体培养体系中细菌群落在15、20、25和30℃下相关网络关键物种分布情况(含蓝藻序列) Tab. 2 Key parameters of species-related network in bacterial community in colonial D2 culture systems at 15, 20, 25 and 30℃ (including cyanobacteria sequence) |
水体环境条件(如温度、营养盐等)是影响细菌群落结构的重要因素[36],探讨在不同环境条件下特定藻的藻际细菌群落组成变化,对于深入认识藻菌关系及其在藻类水华中的影响具有重要的意义. 本研究中铜绿微囊藻群体D2,从太湖分离得到后,在室内培养条件下一直保持着很好的群体形态,从生长及聚集情况上来看,和野外暴发的水华蓝藻状态很相似(部分群体颗粒粒径可超过100 μm),可以作为野外水华蓝藻与细菌关系研究的重要补充材料. 有研究发现,相比群体微囊藻,单细胞微囊藻附生细菌多样性较低[37],本研究则分析了D2群体在15、20、25和30℃下培养时,3种粒径(>20、3~20、0.2~3 μm)中的细菌群落多样性变化. 由于过滤体积较小,因此由滤膜堵塞造成的3种粒径中细菌群落的重叠基本上可以忽略,且在使用20 μm滤膜时,选用的负压较低(0.01 MPa),所需的过滤时间也短(3~5 s),不会打散微囊藻群体. 多样性分析结果表明,在微囊藻群体附生细菌群落的多样性指数和丰富度指数在不同温度下均没有显著性差异,而单细胞-小群体附生细菌群落的PD多样性指数和游离细菌群落的Shannon指数,在15℃下分别均显著高于25℃和30℃下的,说明单细胞-小群体附生和游离的细菌群落在温度较低时组成更为多样.
微囊藻群体附生细菌的群落组成与游离细菌群落组成不同,不同大小的微囊藻群体附生细菌的群落组成也具有差异性[38]. PERMANOVA分析表明,温度能分别单独解释微囊藻群体附生、单细胞-小群体附生和游离细菌群落组成总体差异的44.38 %、45.97 % 和65.35 %,说明温度对细菌群落组成的影响随群体粒径的增加而减弱,即相比附着在大群体上的细菌群落对温度变化的响应,游离菌对温度变化的响应更为强烈. PERMANOVA分析揭示,粒径大小能分别单独解释15、20、25和30℃下样本群落组成总体差异的60.87 %、37.29 %、35.74 % 和48.22 %,表明同一温度下,粒径大小对细菌群落组成的影响程度也具有差异性,差异性从低到高依次是:25℃ < 20℃ < 30℃ < 15℃. 这说明在较高温度(30℃)和较低温度(15℃)下,不同粒径细菌群落组成差异增大,表明温度影响了附生细菌与游离细菌群落组成之间的交流.
Shi等[18]发现Sphingomonadales是微囊藻附生细菌中常见的一类,该目下物种的典型特征是能产出鞘磷脂(glycosphingolipids,GSLs)[39],而GSLs是在细菌的外膜上,具有类似于脂多糖功能的物质[40],在微囊藻群体附生细菌群落中,Sphingomonadales相对丰度最高,其分泌的鞘磷脂可能也在群体维持中发挥作用,此外Sphingomonadales相对丰度在30℃下最高,说明高温下更利于该菌在微囊藻藻际中生长. 其次是Caulobacterales,据文献报道[41],Caulobacterales能够在海洋或者淡水环境下,产生粘附素(holdfast adhesin). 在微囊藻群体附生细菌群落中,Caulobacterales相对丰度在15℃下最高,其它3个温度下总体相对稳定,这也解释了15℃下D2能较好保持群体形态,可能与产生粘附素的细菌增加有关. 研究表明Sphingobacteriales对N、P营养元素变化非常敏感[42-43]. 另一个可能与固氮过程有关的Pseudomonadales[44]在单细胞-小群体附生细菌群落中相对丰度很高,其相对丰度除在15℃下较高,在另外3个温度下基本保持稳定. 这意味着与该菌有关的N、P营养元素的利用率可能也受到温度的影响. 在单细胞-小群体附生和游离细菌群落中,Cytophagales相对丰度分别位于第二和第一,分别占15.65 % 和33.44 %,而且在这2种粒径的细菌群落组成受不同温度影响的整体变化趋势相同:15℃下相对丰度保持在较低水平,20℃和25℃下持续增加,直至在30℃下相对丰度最高. Cytophagales是能够溶解蓝藻细胞的一类细菌[45-46],说明随着温度升高,该菌在裂解转化部分死亡蓝藻中起到重要的作用,从而可能加速了营养盐的循环,更有利于蓝藻的生长. 在野外发生蓝藻水华的湖泊水柱下部(水深25 cm处),Chlorobiales这一类硫化细菌[47-48]的相对丰度最高[49],本研究发现,Chlorobiales只在游离细菌群落中相对丰度较高,并且其丰度随温度升高而降低,说明此类菌可能在藻释放到水体的胞外产物的转化中起到重要作用.
3.2 D2群培养体系中不同粒径细菌群落在4种温度下核心微生物多样性差异Kim等[50]发现,对比初始野外微囊藻样品细菌群落组成,在室内继代培养一年后的微囊藻培养体系细菌群落中,Brevundimonas和Pseudomonas成为与铜绿微囊藻建立长期共生关系的优势菌种,能够促进铜绿微囊藻的生长,这与本研究结果相一致. Porphyrobacter在微囊藻群体附生细菌群落中的相对丰度最高,说明Porphyrobacter可能是具有促进微囊藻群体生长作用的一类特殊细菌[10]. 但值得注意的是,Porphyrobacter在3种粒径下,相对丰度在20~30℃时都比15℃要高,且20~30℃时,其相对丰度在游离细菌群落中不再有较大变化,这表明较高温度可能更有利于Porphyrobacter的生长,Hanada等也曾从温泉中分离出该属一个新的嗜热细菌[51]. 在4种温度下,Brevundimonas均只存在于微囊藻群体附生细菌群落中,其相对丰度在15℃下最高,20~30℃时降低且在该温度范围内基本保持稳定,表明该菌可能在低温下的微囊藻群体生长中起到重要作用. 而在微囊藻群体附生细菌群落中,Porphyrobacter相对丰度最高,其次是Brevundimonas,这一点与Kim等[50]的报道有所不同,可能是由于藻种不同所产生的差异. Bhumika等[52]在2013年发现Cyclobacteriaceae科里一个新属——Mariniradius. 本研究发现Mariniradius只存在于单细胞-小群体附生和游离细菌群落的核心物种中,且在20~30℃相对丰度很高并相对稳定,同时只包含Saccharolyticus AK6一个种,该菌可能与高温下D2群体与单细胞微囊藻之间的转变过程中有关. 此外,在单细胞-小群体附生细菌的核心优势菌属中,Gemmobacter相对丰度在4种温度下均较为平稳,作为重要的反硝化细菌[53],Shi等[54]发现该属细菌与碳分解有关,当在高大气CO2浓度条件下,富营养化水体中的Gemmobacter相对丰度也会升高,这类细菌对温度变化不敏感,能稳定存在单细胞-小群体附生细菌群落中,表明其作为核心优势菌属,对群落碳氮等物质循环可能发挥着重要作用.
3.3 D2群体培养体系中细菌群落在4种温度下物种相关性网络复杂度分析Zhao等[55]通过全年调查6个城市淡水湖泊并结合网络分析发现,其浮游细菌群落网络会随季节的变化存在明显的差异,而温度是影响蓝藻菌群的重要因素之一. Lin等[56]对太湖水体细菌群落进行了网络分析研究,发现野外不同季节细菌群落之间的相互作用存在显著差异,秋季细菌网络是最大和最复杂的,而春季细菌相关网络是最简单的. 但不同的是,Jiao等[57]发现浮游细菌群落网络在冬季具有较高的复杂性,形成了高度稳定的群落结构,Kara等[58]调查富营养化淡水湖的浮游细菌群落十年间季节动态和共生现象,发现春季条件类群丰度会减少,但总体上导致类群(特别是丰度最高的类群)间有更密切的联系. 本研究通过模拟温度变化,发现15℃下的细菌群落组成最为复杂,其次是30℃下的,说明低温(15℃)和高温(30℃)有利于加强细菌之间的联系. 尽管温度发生变化,但物种间的合作关系仍占主要地位,本研究发现,25℃下细菌之间的连线数虽然最少,但正负相关连线数比是最高的,而15℃下细菌物种间联系最为密切,但正负相关连线数比是最低的,说明温度升高促进了细菌之间的合作关系,细菌之间合作关系的增加可能促进营养盐循环,从而有利于蓝藻水华的发生.
4 结论1) 温度显著影响微囊藻群体附生细菌、单细胞-小群体附生细菌和游离细菌群落组成,单细胞-小群体附生细菌群落和游离细菌群落在温度较低时,组成更为多样.
2) 从不同粒径下的优势菌目,对温度的响应来看:Sphingobacteriales在微囊藻群体附生细菌群落、单细胞-小群体附生细菌群落和游离细菌群落中均具有相对稳定性;当温度在20~30℃间变化时,Caulobacterales和Pseudomonadales相对丰度分别在微囊藻群体附生细菌群落和单细胞-小群体附生细菌群落中保持稳定.
3) 微囊藻群体附生细菌的核心优势菌属Brevundimonas和OPB56的相对丰度在温度20~30℃之间相对稳定;单细胞-小群体附生细菌群落中的核心优势菌属Mariniradius相对丰度也是在该温度范围也较为稳定,而Gemmobacter相对丰度在4种温度下均较为一致;游离细菌群落的核心优势菌属Porphyrobacter的相对丰度在温度20~30℃之间相对稳定.
4) 温度影响微囊藻群体培养体系中细菌群落物种相关性网络的复杂度,影响细菌之间的网络关联和关键物种组成,温度升高促进了物种间的合作关系.
| [1] |
Xiao M, Li M, Reynolds CS. Colony formation in the cyanobacterium Microcystis. Biological Reviews, 2018, 93(3): 1399-1420. DOI:10.1111/brv.12401 |
| [2] |
Kong FX, Gao G. Hypothesis on cyanobacteria bloom-forming mechanism in large shallow eutrophic lakes. Acta Ecologica Sinica, 2005, 25(3): 589-595. [孔繁翔, 高光. 大型浅水富营养化湖泊中蓝藻水华形成机理的思考. 生态学报, 2005, 25(3): 589-595.] |
| [3] |
Pope PB, Patel BKC. Metagenomic analysis of a freshwater toxic cyanobacteria bloom. FEMS Microbiology Ecology, 2008, 64(1): 9-27. DOI:10.1111/j.1574-6941.2008.00448.x |
| [4] |
Guo L. Ecology. Doing battle with the green monster of Taihu Lake. Science, 2007, 317(5842): 1166. DOI:10.1126/science.317.5842.1166 |
| [5] |
Yamamoto Y, Shiah FK, Chen YL. Importance of large colony formation in bloom-forming cyanobacteria to dominate in eutrophic ponds. Annales De Limnologie-International Journal of Limnology, 2011, 47(2): 167-173. DOI:10.1051/limn/2011013 |
| [6] |
Walsby AE, Hayes PK, Boje R. The gas vesicles, buoyancy and vertical distribution of cyanobacteria in the Baltic Sea. European Journal of Phycology, 1995, 30(2): 87-94. DOI:10.1080/09670269500650851 |
| [7] |
Duan ZP, Tan X, Parajuli K et al. Colony formation in two Microcystis morphotypes: Effects of temperature and nutrient availability. Harmful Algae, 2018, 72: 14-24. DOI:10.1016/j.hal.2017.12.006 |
| [8] |
Qu Z, Zhao MM, Duan PF et al. Effects of nitrogen forms and supply modes on colony formation in Microcystis aeruginosa. Journal of Applied Phycology, 2018, 30(2): 831-837. DOI:10.1007/s10811-017-1327-8 |
| [9] |
Xu F, Zhu W, Xiao M et al. Interspecific variation in extracellular polysaccharide content and colony formation of Microcystis spp. cultured under different light intensities and temperatures. Journal of Applied Phycology, 2016, 28(3): 1533-1541. DOI:10.1007/s10811-015-0707-1 |
| [10] |
Shen H, Niu Y, Xie P et al. Morphological and physiological changes in Microcystis aeruginosa as a result of interactions with heterotrophic bacteria. Freshwater Biology, 2011, 56(6): 1065-1080. DOI:10.1111/j.1365-2427.2010.02551.x |
| [11] |
Li Q, Lin FB, Yang C et al. A large-scale comparative metagenomic study reveals the functional interactions in six bloom-forming Microcystis-epibiont communities. Frontiers in Microbiology, 2018, 9: 746. DOI:10.3389/fmicb.2018.00746 |
| [12] |
Zhang ZY, Fan XJ, Peijnenburg WJGM et al. Alteration of dominant cyanobacteria in different bloom periods caused by abiotic factors and species interactions. Journal of Environmental Sciences, 2021, 99: 1-9. DOI:10.1016/j.jes.2020.06.001 |
| [13] |
Li HB, Xing P, Chen MJ et al. Short-term bacterial community composition dynamics in response to accumulation and breakdown of Microcystis blooms. Water Research, 2011, 45(4): 1702-1710. DOI:10.1016/j.watres.2010.11.011 |
| [14] |
Berry MA, Davis TW, Cory RM et al. Cyanobacterial harmful algal blooms are a biological disturbance to Western Lake Erie bacterial communities. Environmental Microbiology, 2017, 19(3): 1149-1162. DOI:10.1111/1462-2920.13640 |
| [15] |
Casamatta DA, Wickstrom CE. Sensitivity of two disjunct bacterioplankton communities to exudates from the cyanobacterium Microcystis aeruginosa Kützing. Microbial Ecology, 2000, 40(1): 64-73. DOI:10.1007/s002480000035 |
| [16] |
González JM, Simó R, Massana R et al. Bacterial community structure associated with a dimethylsulfoniopropionate-producing North Atlantic algal bloom. Applied and Environmental Microbiology, 2000, 66(10): 4237-4246. DOI:10.1128/AEM.66.10.4237-4246.2000 |
| [17] |
Sarmento H, Gasol JM. Use of phytoplankton-derived dissolved organic carbon by different types of bacterioplankton. Environmental Microbiology, 2012, 14(9): 2348-2360. DOI:10.1111/j.1462-2920.2012.02787.x |
| [18] |
Shi LM, Cai YF, Yang HL et al. Phylogenetic diversity and specificity of bacteria associated with Microcystis aeruginosa and other cyanobacteria. Journal of Environmental Sciences, 2009, 21(11): 1581-1590. DOI:10.1016/S1001-0742(08)62459-6 |
| [19] |
Shia LM, Cai YF, Wang XY et al. Community structure of bacteria associated with Microcystis colonies from cyanobacterial blooms. Journal of Freshwater Ecology, 2010, 25(2): 193. DOI:10.1080/02705060.2010.9665068 |
| [20] |
Xing P, Kong FX, Cao HS et al. Variations of bacterioplankton community composition during Microcystis spp. blooms in a shallow eutrophic lake. Journal of Freshwater Ecology, 2007, 22(1): 61-67. DOI:10.1080/02705060.2007.9664146 |
| [21] |
Shi L, Cai Y, Kong F et al. Specific association between bacteria and buoyant Microcystis colonies compared with other bulk bacterial communities in the eutrophic Lake Taihu, China. Environmental Microbiology Reports, 2012, 4(6): 669-678. DOI:10.1111/1758-2229.12001 |
| [22] |
Dziallas C, Grossart HP. Temperature and biotic factors influence bacterial communities associated with the cyanobacterium Microcystis sp.. Environmental Microbiology, 2011, 13(6): 1632-1641. DOI:10.1111/j.1462-2920.2011.02479.x |
| [23] |
Wang H, Zhu R, Zhang XL et al. Abiotic environmental factors override phytoplankton succession in shaping both free-living and attached bacterial communities in a highland lake. AMB Express, 2019, 9(1): 1-13. DOI:10.1186/s13568-019-0889-z |
| [24] |
Tang XM, Chao JY, Gong Y et al. Spatiotemporal dynamics of bacterial community composition in large shallow eutrophic Lake Taihu: High overlap between free-living and particle-attached assemblages. Limnology and Oceanography, 2017, 62(4): 1366-1382. DOI:10.1002/lno.10502 |
| [25] |
Zu Y, Hong SJ, Xu CX et al. Cell wall surface layer (S-layer) promotes colony formation in Microcystis: Comparison of S-layer characteristics between colonial and unicellular forms of Microcystis and function conformation. Environmental Science and Pollution Research, 2020, 27(34): 42254-42263. DOI:10.1007/s11356-020-08254-w |
| [26] |
Zhu W, Zhou XH, Chen HM et al. High nutrient concentration and temperature alleviated formation of large colonies of Microcystis: Evidence from field investigations and laboratory experiments. Water Research, 2016, 101: 167-175. DOI:10.1016/j.watres.2016.05.080 |
| [27] |
Tillett D, Neilan BA. Xanthogenate nucleic acid isolation from cultured and environmental cyanobacteria. Journal of Phycology, 2000, 36(1): 251-258. DOI:10.1046/j.1529-8817.2000.99079.x |
| [28] |
Kataoka T, Homma T, Nakano SI et al. PCR primers for selective detection of intra-species variations in the bloom-forming cyanobacterium, Microcystis. Harmful Algae, 2013, 23: 46-54. DOI:10.1016/j.hal.2012.12.003 |
| [29] |
Duan XZ, Sun JT, Wang LT et al. Recent infection by Wolbachia alters microbial communities in wild Laodelphax striatellus populations. Microbiome, 2020, 8(1): 1-15. DOI:10.1186/s40168-020-00878-x |
| [30] |
Magoč T, Salzberg SL. FLASH: fast length adjustment of short reads to improve genome assemblies. Bioinformatics, 2011, 27(21): 2957-2963. DOI:10.1093/bioinformatics/btr507 |
| [31] |
Edgar RC. UPARSE: highly accurate OTU sequences from microbial amplicon reads. Nature Methods, 2013, 10(10): 996-998. DOI:10.1038/nmeth.2604 |
| [32] |
DeSantis TZ, Hugenholtz P, Larsen N et al. Greengenes, a chimera-checked 16S rRNA gene database and workbench compatible with ARB. Applied and Environmental Microbiology, 2006, 72(7): 5069-5072. DOI:10.1128/aem.03006-05 |
| [33] |
Jurasinski G, Retzer V, Beierkuhnlein C. Inventory, differentiation, and proportional diversity: A consistent terminology for quantifying species diversity. Oecologia, 2009, 159(1): 15-26. DOI:10.1007/s00442-008-1190-z |
| [34] |
Banerjee S, Schlaeppi K, van der Heijden MGA. Keystone taxa as drivers of microbiome structure and functioning. Nature Reviews Microbiology, 2018, 16(9): 567-576. DOI:10.1038/s41579-018-0024-1 |
| [35] |
Berry D, Widder S. Deciphering microbial interactions and detecting keystone species with co-occurrence networks. Frontiers in Microbiology, 2014, 5: 219. DOI:10.3389/fmicb.2014.00219 |
| [36] |
Schweitzer-Natan O, Ofek-Lalzar M, Sher D et al. Particle-associated microbial community in a subtropical lake during thermal mixing and phytoplankton succession. Frontiers in Microbiology, 2019, 10: 2142. DOI:10.3389/fmicb.2019.02142 |
| [37] |
Wang WJ, Zhang YL, Shen H et al. Changes in the bacterial community and extracellular compounds associated with the disaggregation of Microcystis colonies. Biochemical Systematics and Ecology, 2015, 61: 62-66. DOI:10.1016/j.bse.2015.04.016 |
| [38] |
Wu Q, Zhang YP, Li YM et al. Comparison of community composition between Microcystis colony-attached and free-living bacteria, and among bacteria attached with Microcystis colonies of various sizes in culture. Aquatic Ecology, 2019, 53(3): 465-481. DOI:10.1007/s10452-019-09702-7 |
| [39] |
Glaeser SP, Kämpfer P. The family Sphingomonadaceae. In: Rosenberg E, Delong EF, Lory S et al eds. The Prokaryotes: Alphaproteobacteria and Betaproteobacteria. Berlin: Springer, 2014: 641-707.
|
| [40] |
Kawasaki S, Moriguchi R, Sekiya K et al. The cell envelope structure of the lipopolysaccharide-lacking gram-negative bacterium Sphingomonas paucimobilis. Journal of Bacteriology, 1994, 176(2): 284-290. DOI:10.1128/jb.176.2.284-290.1994 |
| [41] |
Chepkwony NK, Berne C, Brun YV et al. Comparative analysis of Ionic strength tolerance between freshwater and marine Caulobacterales adhesins. Journal of Bacteriology, 2019, 201(18). DOI:10.1128/JB.00061-19 |
| [42] |
Dennis PG, Seymour J, Kumbun K et al. Diverse populations of lake water bacteria exhibit chemotaxis towards inorganic nutrients. The ISME Journal, 2013, 7(8): 1661-1664. DOI:10.1038/ismej.2013.47 |
| [43] |
Hester ER, Harpenslager SF, van Diggelen J et al. Linking nitrogen load to the structure and function of Wetland soil and rhizosphere microbial communities. mSystems, 2018, 3(1). DOI:10.1128/mSystems.00214-17 |
| [44] |
Gupta RS. The natural evolutionary relationships among prokaryotes. Critical reviews in microbiology, 2008, 26(2): 111-131. DOI:10.1080/10408410091154219 |
| [45] |
Rashidan KK, Bird DF. Role of predatory bacteria in the termination of a cyanobacterial bloom. Microbial Ecology, 2001, 41(2): 97-105. DOI:10.1007/s002480000074 |
| [46] |
Imai I, Ishida Y, Hata Y. Killing of marine phytoplankton by a gliding bacterium Cytophaga sp., isolated from the coastal sea of Japan. Marine Biology, 1993, 116(4): 527-532. DOI:10.1007/BF00355470 |
| [47] |
Overmann J. Ecology of phototrophic sulfur bacteria. In: Hell R, Dahl C, Knaff D et al eds. Dordrecht: Springer Netherlands, 2008: 375-396.
|
| [48] |
Marnocha CL, Levy AT, Powell DH et al. Mechanisms of extracellular S0 globule production and degradation in Chlorobaculum tepidum via dynamic cell-globule interactions. Microbiology, 2016, 162(7): 1125-1134. DOI:10.1099/mic.0.000294 |
| [49] |
Bhatnagar S, Cowley ES, Kopf SH et al. Microbial community dynamics and coexistence in a sulfide-driven phototrophic bloom. Environmental Microbiome, 2020, 15(1): 1-17. DOI:10.1186/s40793-019-0348-0 |
| [50] |
Kim M, Lee J, Yang D et al. Seasonal dynamics of the bacterial communities associated with cyanobacterial blooms in the Han River. Environmental Pollution, 2020, 266. DOI:10.1016/j.envpol.2020.115198 |
| [51] |
Hanada S, Kawase Y, Hiraishi A et al. Porphyrobacter tepidarius sp. nov., a moderately thermophilic aerobic photosynthetic bacterium isolated from a hot spring. International Journal of Systematic Bacteriology, 1997, 47(2): 408-413. DOI:10.1099/00207713-47-2-408 |
| [52] |
Bhumika V, Srinivas TNR, Ravinder K et al. Mariniradius saccharolyticus gen. nov., sp. nov., a member of the family Cyclobacteriaceae isolated from marine aquaculture pond water, and emended descriptions of the genus Aquiflexum and Aquiflexum balticum. International Journal of Systematic and Evolutionary Microbiology, 2013, 63(Pt_6): 2088-2094. DOI:10.1099/ijs.0.043919-0 |
| [53] |
Wang XJ, Wang WQ, Zhang J et al. Dominance of Candidatus saccharibacteria in SBRs achieving partial denitrification: Effects of sludge acclimating methods on microbial communities and nitrite accumulation. RSC Advances, 2019, 9(20): 11263-11271. DOI:10.1039/C8RA09518C |
| [54] |
Shi M, Li JY, Zhou Q et al. Interactions between elevated CO2 levels and floating aquatic plants on the alteration of bacterial function in carbon assimilation and decomposition in eutrophic waters. Water Research, 2020, 171. DOI:10.1016/j.watres.2019.115398 |
| [55] |
Zhao DY, Shen F, Zeng J et al. Network analysis reveals seasonal variation of co-occurrence correlations between Cyanobacteria and other bacterioplankton. Science of the Total Environment, 2016, 573: 817-825. DOI:10.1016/j.scitotenv.2016.08.150 |
| [56] |
Lin YQ, Zhao DY, Zeng J et al. Network analysis reveals seasonal patterns of bacterial community networks in Lake Taihu under aquaculture conditions. Water, 2019, 11(9): 1868. DOI:10.3390/w11091868 |
| [57] |
Jiao C, Zhao D, Zeng J et al. Disentangling the seasonal co-occurrence patterns and ecological stochasticity of planktonic and benthic bacterial communities within multiple lakes. Science of the Total Environment, 2020, 740. DOI:10.1016/j.scitotenv.2020.140010 |
| [58] |
Kara EL, Hanson PC, Hu YH et al. A decade of seasonal dynamics and co-occurrences within freshwater bacterioplankton communities from eutrophic Lake Mendota, WI, USA. The ISME Journal, 2013, 7(3): 680-684. DOI:10.1038/ismej.2012.118 |
 2021, Vol. 33
2021, Vol. 33 

