(2: 内蒙古自治区河流与湖泊生态重点实验室, 呼和浩特 010021)
(3: 蒙古高原生态学与资源利用教育部重点实验室, 呼和浩特 010021)
(2: Inner Mongolia Key Laboratory of River and Lake Ecology, Hohhot 010021, P. R. China)
(3: Mongolian Plateau Key Laboratory of Ecology and Resource Utilization, Ministry of Education, Hohhot 010021, P. R. China)
湖泊有机碳作为生态系统中有机质的主要组成部分,参与了水生环境中多种生物地球化学循环过程. 有机质是各类碳水化合物、类脂物、蛋白质等组成的复杂混合体,大量存在于湖泊内的悬浮物和沉积物中,一般认为其有两种自然来源,一种是外源输入,一种是内源生成[1]. 由于人类活动使大量营养物质进入湖泊,引起藻类及其他浮游生物迅速繁殖,其死亡后的生物残体被微生物分解和氧化,导致有机质增加后进一步消耗溶解氧,从而使水质恶化,富营养化加剧. 悬浮颗粒物是营养盐的载体,很大程度上决定着营养盐的迁移转化和循环归宿,在湖泊内源释放和水环境变化中扮演着重要的角色[2]. 沉积物是水生环境中有机碳转化、沉积、埋藏的主要场所,记录着湖泊的生产力水平、水生植物更替、物质来源及营养水平转变等重要历史信息,可间接反映人类活动对流域生态环境的影响,沉积物中的有机碳主要来自于水生生物的降解和水体中颗粒碳的沉降. 悬浮颗粒物和沉积物均为水体中有机质存在的主要场所,二者关系密切,一定物理化学条件下可经过沉积和再悬浮过程实现相互转化[3]. 为尽早明确湖泊富营养化的根源,有效遏制有机污染,提高对有机碳生物地球化学循环过程的理解,识别有机质来源成为当务之急,目前,有机碳稳定同位素(δ13C)结合碳氮比(C/N)被广泛用于湖泊有机质来源指示及其影响因素分析[4].
稳定同位素技术为水域悬浮颗粒物及沉积物有机质来源以及湖泊碳循环研究提供了重要的方法[5]. Bouillon等[6]对肯尼亚塔纳河流域旱季水体有机碳的研究表明,浮游植物对POC的贡献较土壤有机质小;王毛兰等[7]对鄱阳湖及其入湖河流悬浮颗粒有机质碳同位素时空分布的分析表明,鄱阳湖区及其入湖河流水体POC主要是C3植物的贡献. Sakai等[8]采用稳定同位素技术对日本Lake Biwa表层沉积物中有机质来源的定量分析发现外源输入的贡献较大;Aichner等[9]对青藏高原表层沉积物的研究表明,大型水生植物强烈影响着有机碳稳定同位素特征值,对总有机碳贡献达60 %;巩俊成等[10]通过对青藏高原可可西里湖泊中的表层沉积物中总有机碳(TOC)、碳氮比(TOC/TON)和有机碳同素(δ13CTOC)的测定,探讨了TOC和δ13CTOC的变化及其影响因素,初步判识了有机碳来源于水生沉水植物与陆生植物的混合. 同时,在湖泊碳循环领域,碳同位素的研究已经开展的相当广泛,尤其是在示踪碳源以及碳循环过程中各个环节产物的迁移转化过程方面的研究. 目前相关研究均是单独对悬浮颗粒物或沉积物进行有机质来源识别,缺乏将两种物质结合起来共同判别湖泊有机质来源的研究.
乌梁素海是世界范围内半荒漠地区典型的草藻型富营养化湖泊,在黄河流域独特的地理位置而具有重要的生态功能[11],目前对该湖的研究主要集中于富营养化成因及来源[12],但对富营养化具有重要贡献的有机质来源及分布尚不明晰. 鉴于此,本文分析了乌梁素海水体悬浮颗粒和沉积物中有机碳稳定同位素组成,结合C/N比、TOC和POC时空分布特征,借助端元混合模型,对湖泊悬浮颗粒和沉积物中有机碳的来源进行定量分析,继而判别内、外源所占比例,并深入分析其影响因子,旨在明晰湖泊水体和底泥中有机质的来源,从源头上加以控制进而减缓富营养化趋势,为研究有机碳生物地球化学循环过程、湖泊生态环境变化以及富营养化防治提供参考.
1 材料与方法 1.1 研究区概况乌梁素海(40°36′~41°03′N,108°43′~108°57′E)位于内蒙古自治区巴彦淖尔市乌拉特前旗境内,湖泊总面积约为341.67 km2(据2018年卫星数据统计),是黄河流域内面积最大的淡水湖泊,也是全球同纬度最大的湿地. 乌梁素海属于典型的温带大陆性气候,年均气温7.3℃,四季温差较大;年均降水量为224 mm,主要集中于夏季;年均蒸发量1502 mm,为降水量的6倍[13]. 乌梁素海有6个主要的入湖渠道,枯水期个别渠道水量较少,其中总排干是灌区排水的主要通道,其退水占农田退水的90 % 以上,由于地处河套灌区排灌尾端,乌梁素海接纳了引黄灌溉后几乎整个河套地区的农田退水、工业废水和生活污水,加之地处干旱、半干旱地区,蒸发量和降雨量比例严重失衡,导致湖泊严重富营养化[14]. 乌梁素海水质恶化严重,已进入重度富营养化状态,目前湖泊内大量腐烂的水草正以每年9~13 mm的速度在湖底堆积,成为世界上沼泽化速度最快的湖泊之一[15].
1.2 样品采集与分析本研究分别于2019年4月(融冰期)、7月(夏灌期)和10月(秋灌期)按照湖泊地形空间分布及污染特征,在湖区和各支流共设置14个采样点,其中,湖区布设8个样点(G1~G8),分别位于湖的东北区、入湖区、湖心、西部区、黄苔区、养殖区以及退水渠;主要入湖渠道布设6个采样点(G9~G14),分别位于总排干、通济渠、八排干、长济渠、九排干、塔布渠等(图 1).
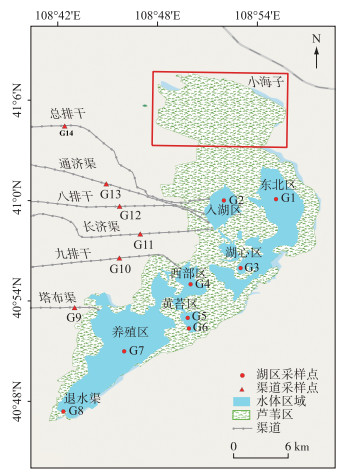
|
图 1 研究区及采样点示意 Fig.1 Study area and distribution of sampling sites |
以上14个采样点同步采集约20 cm的表层水样和5 cm的表层沉积物样,利用多参数水质分析仪(WTW)现场测定电导率(EC)、溶解氧(DO)等参数. 使用采水器在各样点采集5 L水样,取200 mL滴加3~4滴碳酸镁溶液,过滤后滤膜用锡纸包好放入液氮罐中保存,用于后续悬浮颗粒物指标测定;使用活塞式沉积物采样器采集3个沉积物平行样,聚乙烯塑料袋内均匀混合,作为该采样点表层沉积物样品. 水样带回实验室后当天用事先经马弗炉450℃高温灼烧4 h的玻璃纤维膜(GF/F Whatman, 47 mm)过滤并收集悬浮颗粒物,之后将其置于盛放浓盐酸的干燥器中熏蒸48 h,除去样品中无机碳,再用去离子水反复冲洗至滤液呈中性后冷冻干燥保存;沉积物样品带回实验室后及时风干,拣去碎屑,研磨并加入10 % 的盐酸去除无机碳,再用超纯水洗至中性后过149 μm筛子,之后样品用锡杯包好分类保存.
水样中氨氮(NH3-N)、硝态氮(NO3--N)、亚硝态氮(NO2--N)、总磷(TP)和叶绿素a(Chl.a)浓度采用分光光度法(HJ 535--2009)分别进行测定,溶解性有机碳(DOC)浓度使用TOC分析仪(Elementar,high TOC Ⅱ)测定,仪器检出限0.1 mg/L. 悬浮颗粒物(SPM)浓度根据膜过滤前后的质量差计算得出,悬浮颗粒和沉积物的碳氮含量采用元素分析仪(Elementar-vario MACRO cube)测定,TOC分析误差≤1 %、TN分析误差≤3 %. 由于湖泊内固体颗粒中无机氮含量低,因此将TN含量近似为TON含量,根据TOC、TON含量以及碳氮原子量计算得到C/N比值.
1.3 数据处理 1.3.1 稳定同位素值计算水体悬浮颗粒物和表层沉积物样品有机碳同位素比值使用ECS-CRDS(Picarro, USA)联合Picarro 13C燃烧模块进行测定,同时借助δ13C值为-34.22 ‰和-8.02 ‰的尿素标样进行校正,误差≤ ±0.3 ‰. 碳同位素组成的国际参考标准物质为VPDB,测量精度为±0.2 ‰,其稳定同位素比值采用国际通用的δ值表示,计算过程如下:
| ${{\rm{ \mathsf{ δ} }}^{13}}{{\rm{C}}_{{\rm{sample}}}} = ({R_{{\rm{sample}}}}/{R_{{\rm{standard}}}} - 1) \times 1000$ | (1) |
式中,R=13C/12C, Rsample为样品同位素值,Rstandard为标准物质的同位素值[16].
1.3.2 同位素多元混合模型本研究采用同位素多元混合模型定量计算有机质潜在来源的相对贡献,基于质量守恒定律的端元贡献率计算公式如下[17]:
| ${{\rm{ \mathsf{ δ} }}^{13}}{{\rm{C}}_{{\rm{SA}}}} = \sum\limits_{i = 1}^n {{{\rm{ \mathsf{ δ} }}^{13}}{{\rm{C}}_i}\cdot{f_i}} $ | (2) |
| ${1/{{\left( {{\rm{C}}/{\rm{N}}} \right)}_{{\rm{SA}}}} = \sum\limits_{i = 1}^n {1/{{\left( {{\rm{C}}/{\rm{N}}} \right)}_i}\cdot{f_i}} }$ | (3) |
| ${\sum\limits_{i = 1}^n {{\rm{ }}{f_i} = 1} }$ | (4) |
式中,δ13C是样品(SA)和端元(i)的稳定碳同位素值,C/N比是有机质的碳、氮原子比,f表示不同端元的贡献率[17].
2 结果 2.1 理化指标的时空分布分析本研究所测定的物理指标为悬浮颗粒物(SPM)浓度,化学指标包括Chl.a、NH3-N、NO3--N、NO2--N、TP等,各指标在2019年4月、7月、10月的变化趋势见图 2.
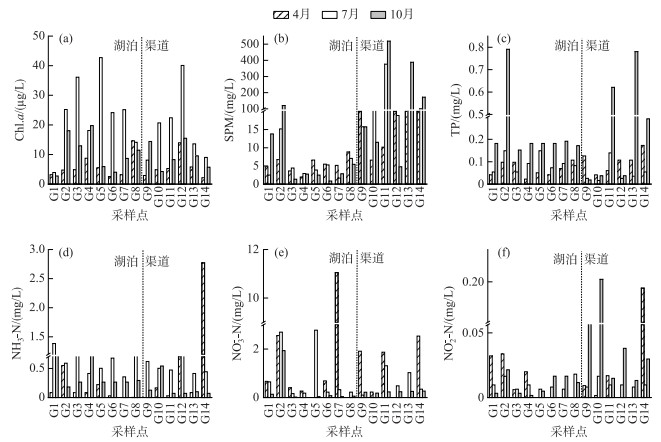
|
图 2 乌梁素海水体基本理化性质 Fig.2 General physicochemical characteristics of water samples in Lake Wuliangsuhai |
叶绿素a是湖泊初级生产力水平的反映,其浓度介于5.82~23.69 μg/L之间,时间上,7月Chl.a浓度远高于10月、4月;空间上,湖区东北区的平均浓度最低,湖心区最高,渠道上八排干的Chl.a浓度显著高于其余渠道,除4月以外,7、10月湖区的Chl.a浓度均低于渠道,且最大与最小值均出现在渠道,其中,7月最高,为23.69 μg/L,4月最低,为5.82 μg/L. SPM浓度区间为5.37~184.93 mg/L,跨度大,季节变化显著,随着时间推移,SPM浓度递增,且7月、10月入湖渠道SPM浓度均远高于湖区,尤其在10月SPM浓度为184.93 mg/L,达到全年最高水平,而4月却相反;湖区SPM浓度略高于渠道,其中湖区内位于入湖区的G2点平均水平最高,SPM在湖内其它区域分布较均匀,各渠道的SPM浓度平均水平差异较小. TP浓度的变化范围是0.05~0.30 mg/L,4月、7月TP浓度较低,10月较高;空间上总体趋势为:入湖渠道<湖区,湖区内TP浓度最小值出现在4月份的G4点处,为0.07 mg/L,入湖区的TP浓度在10月份显著高于整体水平,与湖区不同,入湖渠道上最小值出现在7月份九排干上的G10点. NH3-N浓度介于0.03~2.77 mg/L之间,时间上呈现7月>10月>4月的趋势,其中,4月平均最低,为0.13 mg/L,而7月平均达到最高,为0.72 mg/L;从空间上来看,湖区内NH3-N浓度水平整体较低,养殖区以及退水渠区域4月份的NH3-N浓度几乎为0,渠道上总排干的NH3-N浓度在4月份达到整体最高水平,湖区的NH3-N浓度高于入湖渠道. NO3--N浓度介于0.23~1.95 mg/L之间,随着时间推移,浓度逐渐降低;空间分布表现为: 入湖渠道<湖区,其中,10月湖区和入湖渠道最为接近,分别为0.29和0.23 mg/L,其中位于总排干的G14点在4月份浓度达到最高. NO2--N浓度整体偏低,介于0.01~0.07 mg/L之间,时间上,7月>10月>4月;空间上,湖区<入湖渠道,湖区平均浓度为0.01 mg/L,入湖渠道为0.04 mg/L,入湖渠道NO2--N浓度最高值为0.07 mg/L,最大浓度值出现在10月,各区域分布不均匀. 整体上来说,各个形态氮盐在研究区内的分布表现为:NH3-N>NO3--N>NO2--N.
2.2 水体悬浮颗粒有机质含量及碳同位素组成乌梁素海悬浮颗粒物有机碳含量及其同位素的分布如图 3所示. POC含量变化范围介于0.31 % ~14.65 % 之间,呈现7月>4月>10月的趋势,其中,7月POC平均含量最高且波动程度最大,10月离散程度较小;空间上,4月、10月渠道POC平均含量高于湖区,7月则相反,但无论哪个月份,湖区POC波动程度均大于入湖渠道. PON含量介于0.03 % ~3.40 % 范围内,随着时间推移,PON含量逐渐降低,其中,10月平均值最低且波动程度最小,而4月PON值最高且波动程度最大;空间上,各月份湖区均高于入湖渠道,且湖区波动程度随着月份增加而递减. POC/PON比变化范围介于4.10~21.35之间,呈现4月<7月<10月的季节变化规律,但7月POC/PON比离散程度最大;空间上,湖区POC/PON的平均值小于入湖渠道,波动范围明显要大于入湖渠道. δ13CPOC变化范围为-23.29 ‰ ~-29.75 ‰,呈现10月>4月>7月的变化趋势;空间上,渠道(-26.13 ‰)略高于湖区(-27.13 ‰),4月湖区和入湖渠道的δ13CPOC平均水平较为接近,7、10月湖区的δ13CPOC要低于入湖渠道,整体上空间分布差异较明显,时间上不存在显著差异.
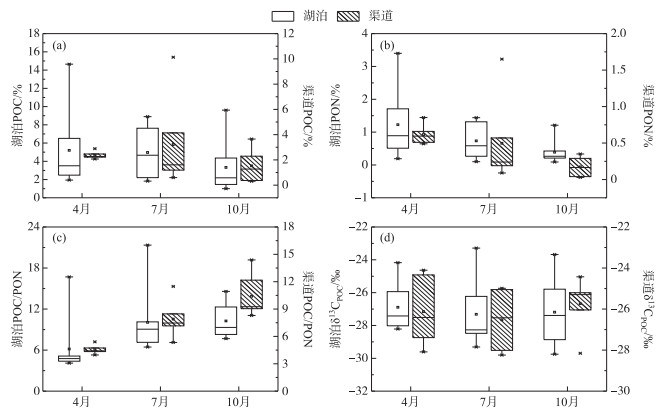
|
图 3 乌梁素海水体悬浮颗粒物POC、PON含量、POC/PON、δ13CPOC的时空分布 Fig.3 Spatiotemporal distribution of POC, PON contents, POC/PON, δ13CPOC in Lake Wuliangsuhai |
乌梁素海表层沉积物TOC含量分布在0.06 % ~10.24 % 之间(图 4a),时间上呈现7月(3.68 %)>10月(1.47 %)>4月(1.32 %)的规律,7月波动最大,10月最小;湖区和入湖渠道差别尤为明显,湖区TOC含量的平均值为4.06 % (n=24),最高值出现在7月,达到10.24 %,最低值出现在4月,为0.06 %;入湖渠道TOC的平均值为0.25 % (n=18),4、10月湖区均低于入湖渠道,7月则相反. 整体上看,湖区的离散程度要小于各入湖渠道,TOC含量季节变化明显,空间上也呈现出较显著的差异. 相对来说,湖区TON含量呈现7月(0.46 %)>10月(0.20 %)>4月(0.19 %)的变化,季节差异不大,4月的离散程度最大;空间上,各季节TON含量及其离散程度均呈现湖区高于入湖渠道的规律,且湖区和入湖渠道的最高值均出现在4月,分别为0.82 %、0.16 % (图 4b).

|
图 4 乌梁素海沉积物TOC、TON含量、TOC/TON、δ13CTOC的季节变化 Fig.4 Seasonal variation of TOC, TON contents, TOC/TON and δ13CTOC in sediments in Lake Wuliangsuhai |
C/N比是简单有效区分有机质来源的指标,亦可作为有机质分解程度的指示剂,通常随分解程度的增加而减小[18]. 乌梁素海TOC/TON比介于3.06~23.77之内,表现出较为明显的时空异质性. 7月湖区TOC/TON比的平均值明显高于4月、10月,10月的TOC/TON比变化幅度较小,最高为10.50,最低为3.06;空间而言,湖区内TOC/TON比的平均值为13.01,入湖渠道为9.25,湖区4月、10月TOC/TON比要低于入湖渠道,7月则湖区高于入湖渠道,总体而言,湖区的离散程度要低于入湖渠道(图 4c).
碳同位素组成可反映不同生物体光合作用过程中碳同化作用的动力学过程[19],其值可用以判别沉积物有机质的来源. 乌梁素海各采样点的δ13CTOC时空变化范围较大,整体分布在-27.58 ‰ ~-22.68 ‰之间,呈现7月>10月>4月的变化. 除4月外,入湖渠道相较于湖区偏负,湖区有机碳同位素比值平均值为-24.99 ‰,呈先偏正后偏负的趋势,而渠道内则呈现先偏负后偏正的变化,平均值为-25.55 ‰,湖区沉积物有机碳同位素及其变化幅度均大于入湖渠道(图 4d).
3 讨论地处干旱、半干旱地区的湖泊陆源植被发育不好,有机质主要来源于湖泊内的水生植物,陆生植物较少[20]. C/N比可以反映有机质的降解程度,可大致判断湖泊沉积物有机质源于自生(内源水生植物)还是外源(陆源碎屑),当C/N>10时,以外源为主,C/N<10时,以内源为主,当C/N≈10时,内源与外源贡献相当[21]. 湖泊有机质稳定同位素的大小能反映各种水生生物的比例,进而可以指示湖区气候环境的演化以及湖泊生产力的变化[22],其值的变化也与湖泊的营养状态有关,贫中营养湖泊δ13C的变化幅度较小,而富营养化湖泊有机质δ13C的变化幅度较大[23].
3.1 悬浮颗粒物有机碳来源分析湖泊有机质来源可分为外源有机质和湖泊自身产生的有机质,外源有机质包括陆生植物碎屑和土壤有机质,表现为下垫面及植物生长环境的变化,而湖泊自身的有机质则主要包括浮游生物、藻类和水生维管束植物,可反映湖泊水体的环境信息. 乌梁素海位于村镇边缘,有机质来源差异较大,虽然稳定同位素在物理混合中呈现保守行为,但其在参与生物地球化学循环中会产生同位素分馏现象. 因此,单一指标尚不足以准确辨析湖泊有机质来源. 为提高来源识别的精准性,本研究采用δ13C和C/N比结合的方法来定量分析湖泊有机质来源[24]. 根据已有湖泊同位素相关研究以及乌梁素海的环境背景,将乌梁素海端元物质确定为以下6种,所对应的端元值见表 1.
| 表 1 悬浮颗粒物和沉积物有机质端元的δ13C和C/N比 Tab. 1 δ13C and C/N of end-members of suspended particulates and sedimentary organic matter |
由图 5a可知,乌梁素海4、7、10月悬浮颗粒有机质来源集中分布在浮游植物和渠道泥沙附近,不同水文时期(枯水期、丰水期、平水期)悬浮颗粒有机质落入的端元范围所表现出的差异主要在于外源输入贡献的季节性差异,其次就是湖泊初级生产力水平的变化. 在以内源藻类作为主要物质来源的富营养化湖泊中,CO2的来源会受到湖泊环境的制约而产生变化,在富营养化初期,湖泊初级生产力水平较低,藻类吸收的CO2大部分来源于大气,随着营养水平的提高,藻类大量繁殖,水体中溶解的CO2很难彻底满足藻类生长的需要,而有机质降解作用产生的CO2逐渐被藻类吸收,导致有机质碳同位素组成偏负,故在富营养化严重的湖泊中,内源有机质在悬浮颗粒中占主导地位[33]. 4月,湖内水量较小,悬浮颗粒有机碳δ13CPOC值均低于-24.00 ‰,部分采样点的POC/PON在4左右波动,没有落在浮游藻类的范围内,表明枯水期有机质来源为湖区内的浮游生物,如细菌和古菌等,其具有较低的POC/PON比,其余样点受降水量少和水生植物死亡的影响,有机碳主要源自水生大型植物分解和藻源性有机质的混合来源[34]. 7月,乌梁素海POC/PON比集中于7~10之间,Sigleo等的研究表明,当C/N≤10时,悬浮颗粒有机质可认为来源于单细胞生物(浮游植物)[35],加之,该月Chl.a浓度最高(图 2),说明藻类是最大贡献者;此外,部分样点亦落在土壤泥沙的范围内,原因在于,7月降雨多,较强的冲刷作用会引起沉积的泥土再悬浮[36],加之处于灌溉期,携带着大量泥沙的黄河水通过河套灌区输入乌梁素海. 至10月,湖区悬浮颗粒有机质外源贡献相对较大,整体分布较7月份增加大型水生植物来源的影响,多数样点落在渠道泥沙特征值范围,原因在于秋灌期黄河水随着灌溉冲刷将泥沙带入湖区,导致入湖渠道的河水水质浑浊且颗粒物含量较高,故渠道泥沙有机质的贡献较大[37]. 综上,乌梁素海悬浮颗粒物落主要来源于浮游植物、渠道泥沙以及大型水生植物有机质.
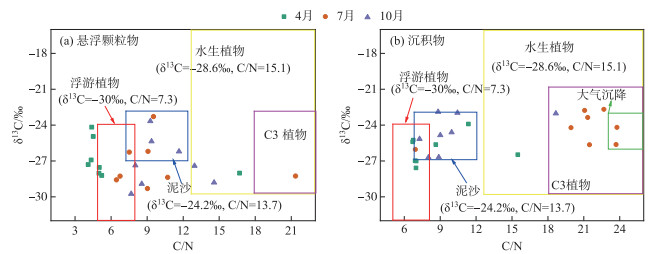
|
图 5 C/N比和δ13C相结合判别有机质不同来源方式 Fig.5 Different sources of organic matter using C/N ratios and δ13C values |
由图 5a不难看出,个别样点超出了所选定端元的范围,原因可能在于选定端元数量不足,或δ13C和C/N组合判别悬浮颗粒物有机质来源存在缺陷等[38]. 为弥补以上缺陷,本研究进一步采用端元混合模型,从不同端元贡献率的角度,对有机质来源进行定量分析. 该模型是以不同端元有机质的C/N比和δ13C值在有机质形成过程中所遵循的质量守恒定律及其本身的保守性为依据而进行的量化过程[39]. 基于前述有机质来源倾向于内源的判断,认为C4植物对研究区悬浮颗粒和沉积物有机质的贡献相对较小,而C3植物部分包含于水生植物范畴内,故在定量分析中忽略这2个端元,将用于定量计算的端元物质及对应的端元值选定为:(1)浮游植物(δ13C=-30.0 ‰,C/N=7.3)、(2)水生植物(δ13C=-28.6 ‰,C/N=15.1)、(3)渠道泥沙(δ13C= -24.2 ‰,C/N=13.7)(图 5b)[40].
根据同位素多元混合模型定量计算结果(图 6a)可知,所有潜在来源中浮游植物是湖区内悬浮颗粒物有机质的主要来源,表 2中Chl.a唯独与悬浮颗粒物的浮游植物贡献率呈正相关,验证了该判断的可靠性. 其中,G3点以浮游植物为主导,相对贡献率将近90 %,水生植物和泥沙的贡献量较小;G2、G3、G4、G6和G7采样点中各端元的贡献率均呈现浮游植物>泥沙>水生植物,浮游植物占比介于59 % ~87 % 之间,其中,G2采样点泥沙贡献相对较大,G6点处水生植物的贡献较高;G8样点的悬浮颗粒物有机质大多来源自大型水生植物,原因在于该点位于退水渠,水域生产力较好[41],故大型水生植物的贡献尤为显著,其次全部为泥沙的贡献;G1点则完全没有水生植物的贡献. 综上,悬浮颗粒有机质主要源于浮游植物和泥沙,而浮游植物(51.59 %)在湖区内的贡献是最主要的,其次是渠道泥沙(34.60 %). 内源污染增加指示出人类活动造成的营养物质输入一定程度上加剧了乌梁素海富营养化进程,导致藻类水华频繁暴发.
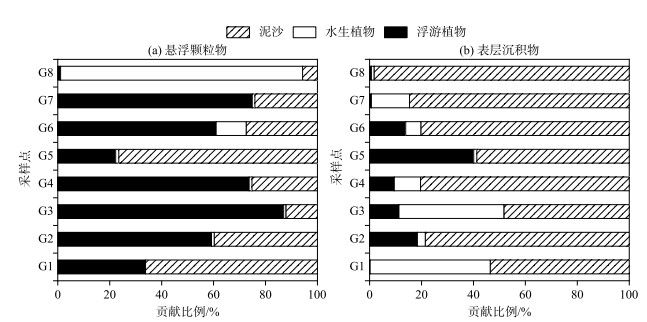
|
图 6 乌梁素海悬浮颗粒物和沉积物有机质来源的贡献比例 Fig.6 Contribution ratios of suspended particulates and sediment organic matter sources in Lake Wuliangsuhai |
| 表 2 乌梁素海理化指标与有机质来源之间的Pearson相关性 Tab. 2 Pearson correlation between physicochemical indicators and organic matter sources in Lake Wuliangsuhai |
沉积物是水生环境中有机污染的汇,其内源释放是影响湖泊营养水平的重要因素,故可以通过监测沉积物中有机碳的分布,来评估水生环境受污染程度,湖泊沉积物有机质受水体理化性质、初级生产力水平、流域水文特征以及沉积物储存环境等多种环境因素的影响,且各因素间亦存在相互作用,因此,探讨沉积物有机质来源时需考虑环境条件. 乌梁素海水体偏碱性[42],大量的水生植物和藻类死亡后会沉积于湖底,导致有机质含量较高,湖泊的生产力水平上升,引起湖泊富营养化. 有机质沉积在底泥后,其碳同位素组成变化很小,C/N比有一定差别[43]. 沉积物的C/N比不但直接与有机质来源的数量和种类有关,还与有机质的降解程度有关,而沉积物的降解不足以抵消水生植物原始的C/N,乌梁素海表层沉积物的C/N介于7~24之间,说明了浮游植物、水生大型植物和渠道泥沙对沉积物中有机质均有一定的贡献量. 由图 5b可以看出,湖泊表层沉积物在不同月份所属端元范围较单一,这也间接说明沉积物中δ13CTOC能够在较长时间内稳定地反映出有机质来源[44]. 4月,δ13CTOC介于-27.01 ‰ ~-23.50 ‰之间,表明沉积物有机质受到外源和湖泊自生共同作用;TOC/TON比小于8的采样点则说明有机质倾向于内源生成,加之δ13CTOC离散程度较低(图 4),说明4月份有机质来源较为单一. 7月,乌梁素海生长的水生植物繁茂,较高的初级生产力对湖区的有机碳贡献量较大,TOC/TON比高达24,已有研究表明[45],沉积物有机质C/N比大于8时,被认为受2种以上物源的影响,而内源有机质所占的比例越高,C/N比就越大,基于此,判断7月表层沉积物有机质主要源自水生大型植物(部分C3植物也属于水生大型植物),值得注意的是,7月份湖内个别采样点落在了大气沉降的范围内,这表明除了自然过程的影响,人为活动在沉积物有机碳的组成中有重要作用. 10月,沉积物δ13C介于-26.69 ‰ ~-20.19 ‰之间,有机质倾向来源于渠道泥沙或浮游植物,加之10月正值秋灌,携带了大量泥沙的黄河水从各入湖渠道流入乌梁素海,综合判断该月份沉积物有机质的主要物源为泥沙有机质.
根据同位素多元混合模型定量计算结果(图 6b)可知,除G3点外,湖区内其他沉积物样点有机质均有一半以上的贡献源自泥沙有机质,浮游植物和水生维管束植物的贡献相对较小. 沉积物再悬浮还会影响悬浮粒子OM的来源,因为沉积物释放的污染物可以作为浮游植物生长的养分. G5点位于黄苔暴发区,故该点有40.1 % 的沉积物有机质来自于浮游植物;G1和G3点分别位于湖的东北区和湖心区,是全湖水草最多的2个区域,说明此处水域生产力旺盛,水生植物的贡献较高,分别为46.3 % 和40.5 %;G8点的沉积物有机质贡献占98.20 % 以上,且G8点浮游植物和水生大型植物的贡献极小,原因在于G8位于退水渠,冲刷作用显著;G2、G4、G6、G7的泥沙贡献也达78.50 % 以上,G4和G7点经过一定时间的沉积,陆源输入的影响明显减弱,而水生维管束植物的贡献增加,G2和G6点位于入湖区及黄苔区,除了泥沙有机质的贡献,浮游植物的贡献也不可忽视. 不难看出,定量分析表明乌梁素海沉积物有机质主要来源于渠道内泥沙有机质,说明大部分外源有机质在输入湖泊时会沉积到底泥中,这与定性分析的结果相一致.
3.3 悬浮颗粒物有机碳和沉积物有机碳的关系湖泊悬浮颗粒物是土壤侵蚀或水体内光合作用的近期产物,乌梁素海POC含量季节变化明显,呈现夏季>春季>秋季的变化趋势(图 3),夏季乌梁素海水温((25.54±0.11)℃)较高且稳定,光照时间和强度较其它季节有所增加,浮游植物大量繁殖是夏季乌梁素海POC含量显著高于其他季节的原因;春季藻类还没有大量生长,是POC含量低于夏季的主要原因,此时乌梁素海盛行西北风且风速较大,湖底的沉积物在风浪的扰动下易发生再悬浮,故POC含量要明显高于秋季;浮游生物和水生植物大量死亡是秋季悬浮颗粒有机碳的主要来源,综上,乌梁素海POC含量变化较大的原因是受浮游植物生长的影响较大. 而沉积物更倾向于长期物理侵蚀沉积的结果,乌梁素海TOC的季节变化趋势为夏季>秋季>春季(图 4),由于乌梁素海沉积物主要受外源影响,夏季正值乌梁素海的夏灌期,渠道携带的泥沙量大且水生植物生长旺盛,故TOC的含量最高;秋季虽然水生植物大量死亡,而此时会进行秋灌,故将再次汇入大量的渠道泥沙;春季沉积物TOC含量降低则归因于藻类等水生生物还未复活以及外源输入的有机碳较少. 由以上分析可知,乌梁素海TOC含量受渠道泥沙的影响较大.
虽然沉积物与悬浮颗粒物二者的结构和组成各有特点,但它们之间相互影响、相互联系,共同构成水体内固态物质的储存体系,沉积物若再悬浮可能导致水体悬浮颗粒物有机质组成发生变化,反过来水体中的悬浮颗粒物下沉于湖底,也会影响表层沉积物有机质的组成,而有研究认为悬浮颗粒中有机质的沉积速率要高于沉积物中有机质的再悬浮速率[46]. 通过分析这两种物质中有机碳的来源,可以反映有机质在湖泊内不同介质中的迁移转化过程,进一步揭示流域的侵蚀状况和人类活动的影响[47]. 由上述分析可知,乌梁素海悬浮颗粒物有机碳大部分来源于浮游植物,即内源,而沉积物有机碳却主要来源于渠道挟带的泥沙,即外源,在同一个湖区,主要来源截然不同,为揭示其中的原理,对悬浮颗粒物和沉积物有机碳同位素、碳氮比进行了相关性分析(图 7),发现二者之间显著性较小. 原因可能在于,渠道挟带的泥沙进入湖泊后很快沉积,并未滞留于湖水中,部分悬浮颗粒最终会沉积到湖底[48],一般悬浮颗粒物有机质输入到沉积物的过程中受到迁移、转化、降解等因素的影响. 同时也表明,表层沉积物更倾向于来自物理侵蚀的粗糙颗粒产物以及长期稳定沉积的一小部分悬浮颗粒.
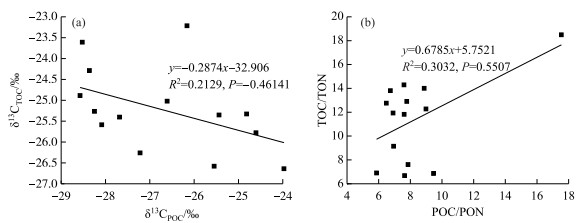
|
图 7 悬浮颗粒物和沉积物有机碳δ13C、C/N比之间的相关性 Fig.7 Correlation between suspended particulate matter and sediment organic carbon δ13C and C/N |
本研究采用δ13C和C/N比结合的方法来定性分析了2019年4月、7月、10月乌梁素海悬浮颗粒物和沉积物的潜在有机质来源,并利用多元混合模型对其相对贡献进行量化,悬浮颗粒物的主要有机质来源为内源有机质(浮游植物=51.59 %),而沉积物有机质则由外源(渠道泥沙=72.79 %)主导,悬浮颗粒物有机碳和沉积物有机碳之间存在一定相关关系,但并不显著,悬浮颗粒物和沉积物在短期内无空间上的承接性,悬浮物的沉积作用和沉积物的再悬浮作用并不明显,目前对于乌梁素海沉积物再悬浮和悬浮颗粒沉积的具体过程尚不清楚,还需要进一步研究悬浮颗粒物和沉积物中有机质的转移. 本研究揭示了入湖渠道泥沙为乌梁素海沉积物有机质的主要来源,这为灌区毗邻湖泊有机质来源研究提供了新思路,同时凸显了乌梁素海在半干旱湖泊有机质来源研究中的独特性及其价值.
| [1] |
Wu H, Chang FQ, Zhang HC et al. Changes of organic C and N stable isotope and their environmental implication during the past 100 years of Lake Yilong. Chinese Journal of Ecology, 2020, 39(8): 2478-2487. [吴汉, 常凤琴, 张虎才等. 异龙湖近百年来湖泊沉积物有机碳、氮稳定同位素变化及其环境指示意义. 生态学杂志, 2020, 39(8): 2478-2487. DOI:10.13292/j.1000-4890.202008.010] |
| [2] |
Tengberg A, Almroth E, Hall P. Resuspension and its effects on organic carbon recycling and nutrient exchange in coastal sediments: in situ measurements using new experimental technology. Journal of Experimental Marine Biology & Ecology, 2003, 285: 119-142. DOI:10.1016/S0022-0981(02)00523-3 |
| [3] |
Zhou ZH, Li J, Zhu ZZ. Environmental evolution of Longgan Lake sediments recorded by carbon and nitrogen isotopes. Chinese Journal of Ecology, 2007, 26(5): 693-699. [周志华, 李军, 朱兆洲. 龙感湖沉积物碳、氮同位素记录的环境演化. 生态学杂志, 2007, 26(5): 693-699. DOI:10.13292/j.1000-4890.2007.0126] |
| [4] |
Liu W, Li X, Wang Z et al. Carbon isotope and environmental changes in lakes in arid Northwest China. Science China Earth Sciences, 2018, 62(8): 1193-1206. DOI:10.1007/s11430-018-9232-4 |
| [5] |
Zhang S, Lu XX, Sun H et al. Geochemical characteristics and fluxes of organic carbon in a human-disturbed mountainous river (the Luodingjiang River) of the Zhujiang (Pearl River), China. Science of the Total Environment, 2009, 407(2): 815-825. DOI:10.1016/j.scitotenv.2008.09.022 |
| [6] |
Bouillon S, Abril G, Borges AV et al. Distribution, origin and cycling of carbon in the Tana River (Kenya): a dry season basin-scale survey from headwaters to the delta. Biogeosciences, 2009, 6(11): 2475-2493. DOI:10.5194/bg-6-2475-2009 |
| [7] |
Wang ML, Zhang DL, Lai JP et al. Distribution and sources of stable organic carbon and nitrogen isotopes in suspended particulate organic matter of Poyang Lake. Chinese Environmental Science, 2014, 34(9): 2342-2350. [王毛兰, 张丁苓, 赖建平等. 鄱阳湖水体悬浮有机质碳氮同位素分布特征及来源探讨. 中国环境科学, 2014, 34(9): 2342-2350.] |
| [8] |
Sakai Y, Takeyama T, Kohzu A et al. Seasonal and site-specific variability in terrigenous particulate organic carbon concentration in near-shore waters of Lake Biwa, Japan. Limnology, 2013, 14(2): 167-177. DOI:10.1007/s10201-012-0394-4 |
| [9] |
Aichner B, Herzschuh U, Wilkes H. Influence of aquatic macrophytes on the stable carbon isotopic signatures of sedimentary organic matter in lakes on the Tibetan Plateau. Organic Geochemistry, 2010, 41(7): 706-718. DOI:10.1016/j.orggeochem.2010.02.002 |
| [10] |
Gong JC, Zhang GY, Zhang CJ et al. Distribution characteristics of n-Alkanes in surface sediments on Lake Bottom in Koh Xil Area, Qinghai-Xizang (Tibet) Plateau. Geological Review, 2012, 58(4): 636-642. [巩俊成, 张菀漪, 张成君等. 青藏高原可可西里地区湖泊沉积物中有机质正构烷烃分布特征. 地质论评, 2012, 58(4): 636-642. DOI:10.16509/j.georeview.2012.04.001] |
| [11] |
Zhang CY, Yu CS, Pan GW et al. Assessment of ecosystem health in lake-for example to Wuliangsuhai. Environment and Development, 2011, 23(8): 38-39. [张春媛, 于长水, 潘高娃等. 湖泊生态系统健康评估初探——以乌梁素海为例. 环境与发展, 2011, 23(8): 38-39. DOI:10.3969/j.issn.1007-0370.2011.08.031] |
| [12] |
Fan YY, Li X, Chun X. Research progress of eutrophication in Wuliangsuhai Sea. Environmental Protection Science, 2018, 44(4): 83-88. [范元元, 李兴, 春喜. 乌梁素海水体富营养化研究进展. 环境保护科学, 2018, 44(4): 83-88.] |
| [13] |
Zhang Q, Yu R, Jin Y et al. Temporal and spatial variation trends in water quality based on the WPI index in the shallow lake of an arid area: A case study of Lake Ulansuhai, China. Water, 2019, 11(7): 1410. DOI:10.3390/w11071410 |
| [14] |
Li CY, Yang F, Shi XH et al. Impact of seasonal ice cover on nutrient distribution in Ulansuhai Lake. Journal of Hydroelectric Engineering, 2016, 35(11): 1-8. [李畅游, 杨芳, 史小红等. 乌梁素海覆冰特征及其对营养盐分布的影响分析. 水力发电学报, 2016, 35(11): 1-8. DOI:10.11660/slfdxb.20161101] |
| [15] |
Yu RH, Liu TX, Xu YP et al. The impacts of human activities on the Wuliangsuhai wetland environment. J Lake Sci, 2007, 19(4): 465-472. [于瑞宏, 刘廷玺, 许有鹏等. 人类活动对乌梁素海湿地环境演变的影响分析. 湖泊科学, 2007, 19(4): 465-472. DOI:10.18307/2007.0416] |
| [16] |
Guo Q, Wang C, Wei R et al. Qualitative and quantitative analysis of source for organic carbon and nitrogen in sediments of rivers and lakes based on stable isotopes. Ecotoxicology and Environmental Safety, 2020, 195: 110436. DOI:10.1016/j.ecoenv.2020.110436 |
| [17] |
Liu Y, Wang X, Wen Q et al. Identifying sources and variations of organic matter in an urban river in Beijing, China using stable isotope analysis. Ecological Indicators, 2019, 102: 783-790. DOI:10.1016/j.ecolind.2019.03.023 |
| [18] |
Zou J, Yang Y, Jia S et al. The sources and biogeochemical cycling of carbon in the Wudalianchi UNESCO Geopark volcanic system in Northeast China. Environmental Science and Pollution Research, 2018, 26(3): 2918-2928. DOI:10.1007/s11356-018-3840-y |
| [19] |
Erdenetsogt BO, Lee I, Ko YJ. Carbon isotope analysis and a solid state 13C NMR study of Mongolian lignite: Changes in stable carbon isotopic composition during diagenesis. Organic Geochemistry, 2017, 113: 293-302. DOI:10.1016/j.orggeochem.2017.07.014 |
| [20] |
Gu B. Variations and controls of nitrogen stable isotopes in particulate organic matter of lakes. Oecologia, 2009, 160(3): 421-431. DOI:10.1007/s00442-009-1323-z |
| [21] |
Liu X, Li CY, Jia KL et al. Spatial distribution and storage characteristic of organic carbon in sediments of lake wetland in northern arid areas: a case study of Wuliangsuhai Lake. Ecology and Environmental Sciences, 2013, 22(2): 319-324. [刘旭, 李畅游, 贾克力等. 北方干旱区湖泊湿地沉积物有机碳分布及碳储量特征研究——以乌梁素海为例. 生态环境学报, 2013, 22(2): 319-324. DOI:10.3969/j.issn.1674-5906.2013.02.024] |
| [22] |
Tian QC, Yang TB, Shi PH. Variation characteristics and influencing factors of organic carbon isotope from palaeolake sediments in Hoh Xil Area. Acta Sedimentologica Sinica, 2016, 34(2): 260-267. [田庆春, 杨太保, 石培宏. 可可西里古湖泊沉积物有机碳δ13C变化特征及其影响因素. 沉积学报, 2016, 34(2): 260-267.] |
| [23] |
Gu B, Schelske CL, Waters MN. Patterns and controls of seasonal variability of carbon stable isotopes of particulate organic matter in lakes. Oecologia, 2011, 165(4): 1083-1094. DOI:10.1007/s00442-010-1888-6 |
| [24] |
Ni ZK, Li YJ, Wang SR et al. The sources of organic carbon and nitrogen in sediment of Taihu Lake. Acta Ecologica Sinica, 2011, 31(16): 4661-4670. [倪兆奎, 李跃进, 王圣瑞等. 太湖沉积物有机碳与氮的来源. 生态学报, 2011, 31(16): 4661-4670.] |
| [25] |
Ogrinc N, Markovics R, Kandu T et al. Sources and transport of carbon and nitrogen in the River Sava watershed, a major tributary of the River Danube. Applied Geochemistry, 2008, 23(12): 3685-3698. DOI:10.1016/j.apgeochem.2008.09.003 |
| [26] |
Ma L, Wu JL. Environmental significance from organic carbon and its isotope of Angulinao Lake Sediment. Journal of Natural Resources, 2009, 24(6): 1099-1104. [马龙, 吴敬禄. 安固里淖湖积物中总有机碳含量及其碳同位素的环境意义. 自然资源学报, 2009, 24(6): 1099-1104. DOI:10.11849/zrzyxb.2009.06.017] |
| [27] |
Thornton SF, Mcmanus J. Application of organic carbon and nitrogen stable isotope and C/N ratios as source indicators of organic matter provenance in estuarine systems: evidence from the Tay Estuary, Scotland. Estuar Coast Shelf Sci, 1994, 38(3): 219-233. DOI:10.1006/ecss.1994.1015 |
| [28] |
Liu KK, Kao SJ, Wen LS et al. Carbon and nitrogen isotopic compositions of particulate organic matter and biogeochemical processes in the eutrophic Danshuei Estuary in northern Taiwan. Science of the Total Environment, 2007, 382(1): 103-120. DOI:10.1016/j.scitotenv.2007.04.019 |
| [29] |
Thanomsak B. Combined stable carbon isotope and C/N ratios as indicators of source and fate of organic matter in the Bangpakong River Estuary, Thailand. Environment Asia, 2008, 1(1): 28-36. |
| [30] |
Machiwa JF. Stable carbon and nitrogen isotopic signatures of organic matter sources in near-shore areas of Lake Victoria, East Africa. Journal of Great Lakes Research, 2010, 36(1): 1-8. DOI:10.1016/j.Jglr.2009.11.005 |
| [31] |
Luo Z. Different hydrodynamic conditions on the deposition of organic carbon in sediment of two reservoirs. Hydrobiologia, 2016, 765(1): 15-26. DOI:10.1007/s10750-015-2410-2 |
| [32] |
Liu H, Wu Z, Huang X et al. Carbon isotopic fractionation during biodegradation of phthalate esters in anoxic condition. Chemosphere, 2015, 138: 1021-1027. DOI:10.1016/j.chemosphere.2014.12.063 |
| [33] |
Goi MA, Teixeira MJ, Perkey DW. Sources and distribution of organic matter in a river-dominated estuary (Winyah Bay, SC, USA). Estuarine, Coastal and Shelf Science, 2003, 57(5/6): 1023-1048. DOI:10.1016/S0272-7714(03)00008-8 |
| [34] |
Dalu T, Richoux NB, Froneman PW. Nature and source of suspended particulate matter and detritus along an austral temperate river-estuary continuum, assessed using stable isotope analysis. Hydrobiologia, 2016, 767(1): 95-110. DOI:10.1007/s10750-015-2480-1 |
| [35] |
Sigleo AC, Macko SA. Carbon and nitrogen isotopes in suspended particles and colloids, Chesapeake and San Francisco Estuaries, U.S.A. Estuarine, Coastal and Shelf Science, 2002, 54(4): 701-711. DOI:10.1006/ecss.2001.0853 |
| [36] |
Shao L, Wu D, Zhang D et al. Using isotopes to identify the sources of organic carbon and nitrogen in surface sediment in shallow lakes alongside Poyang Lake. Wetlands, 2018, 39(S1): 25-33. DOI:10.1007/s13157-017-0988-z |
| [37] |
Yu J, Zhang H. Seasonal variations and sources of carbon and nitrogen isotopes in suspended particulate matter in inflow rivers of the Bohai Sea and the North Yellow Sea. Marine Sciences, 2017, 41(5): 93-102. [于靖, 张华. 渤海及北黄海河流悬浮颗粒碳氮同位素时空分布及源解析. 海洋科学, 2017, 41(5): 93-102. DOI:10.11759/hykx20160914003] |
| [38] |
Liu WG, Li XZ, Wang Z et al. Carbon isotope and environmental changes in lakes in arid Northwest China. Scientia Sinica Terrae, 2019, 49(8): 1182-1196. [刘卫国, 李祥忠, 王政等. 西北干旱区湖泊碳同位素与环境变化. 中国科学: 地球科学, 2019, 49(8): 1182-1196. DOI:10.1360/N072018-00026] |
| [39] |
Wang CY, Guo QJ, Zhu GX et al. Applying stable carbon isotope techniques to detect different sources of organic matters in lake sediments from Beijing parks. Chinese Journal of Ecology, 2014, 33(3): 778-785. [王春雨, 郭庆军, 朱光旭等. 稳定碳同位素技术在北京市公园湖泊沉积物有机质来源分析与评价中的应用. 生态学杂志, 2014, 33(3): 778-785. DOI:10.13292/j.1000-4890.2014.0072] |
| [40] |
Lu FY, Liu ZQ, Ji HB. Carbon and nitrogen isotopes analysis and sources of organic matter in the upper reaches of the Chaobai River near Beijing, China. Science China: Earth Sciences, 2012, 42(12): 1912-1922. [卢凤云, 刘竹青, 季宏兵. 潮白河上游有机质的碳、氮稳定同位素分析及来源探讨. 中国科学: 地球科学, 2012, 42(12): 1912-1922. DOI:10.1007/s11430-012-4525-x] |
| [41] |
Wang ML, Hu CH, Zhou WB. Concentration variations of N and P in Poyang Lake during high water period with analysis on their sources. Resources and Environment in the Yangtze Basin, 2008, 17(1): 138-142. [王毛兰, 胡春华, 周文斌. 丰水期鄱阳湖氮磷含量变化及来源分析. 长江流域资源与环境, 2008, 17(1): 138-142. DOI:10.3969/j.issn.1004-8227.2008.01.027] |
| [42] |
Li X, Li CY, Li WP et al. Temporal and spatial distribution of different species of nitrogen in Lake Wuliangsuhai, Inner Mongolia. J Lake Sci, 2009, 21(6): 885-890. [李兴, 李畅游, 李卫平等. 内蒙古乌梁素海不同形态氮的时空分布. 湖泊科学, 2009, 21(6): 885-890. DOI:10.18307/2009.0620] |
| [43] |
Wang ML, Lai JP, Hu KT et al. Compositions and sources of stable organic carbon and nitrogen isotopes in surface sediments of Poyang Lake. China Environmental Science, 2014, 34(4): 1019-1025. [王毛兰, 赖建平, 胡珂图等. 鄱阳湖表层沉积物有机碳、氮同位素特征及其来源分析. 中国环境科学, 2014, 34(4): 1019-1025.] |
| [44] |
Wei XG, Zhuo MN, Guo ZX et al. Particulate organic carbon-isotope composition and its spatio-temporal variability of suspended sediment in the Xijiang River, South China. Ecology and Environmental Sciences, 2008, 17(6): 2127-2131. [魏秀国, 卓慕宁, 郭治兴等. 西江水体悬浮物颗粒有机碳稳定同位素组成及时空变化. 生态环境, 2008, 17(6): 2127-2131. DOI:10.3969/j.issn.1674-5906.2008.06.002] |
| [45] |
Yin C, Yang HQ, Chen JA et al. Tracing nitrate sources with dual isotopes and hydrochemical characteristics during wet season in Lake Caohai, Guizhou Province. J Lake Sci, 2020, 32(4): 989-998. [殷超, 杨海全, 陈敬安等. 基于水化学和氮氧同位素的贵州草海丰水期水体硝酸盐来源辨析. 湖泊科学, 2020, 32(4): 989-998. DOI:10.18307/2020.0408] |
| [46] |
Wang ML, Lai JP, Hu KT et al. Compositions of stable organic carbon and nitrogen isotopes in wetland soil of Poyang Lake and its environmental implications. China Environmental Science, 2016, 36(2): 500-505. [王毛兰, 赖建平, 胡珂图等. 鄱阳湖湿地土壤有机碳氮同位素特征及其环境意义. 中国环境科学, 2016, 36(2): 500-505. DOI:10.3969/j.issn.1000-6923.2016.02.029] |
| [47] |
McEachran MC, Trapp RS, Zimmer KD et al. Stable isotopes indicate that zebra mussels (Dreissena polymorpha) increase dependence of lake food webs on littoral energy sources. Freshwater Biology, 2019, 64(1): 183-196. DOI:10.1111/fwb.13206 |
| [48] |
Liu J, Yin M, Luo X et al. The mobility of thallium in sediments and source apportionment by lead isotopes. Chemosphere, 2019, 219: 864-874. DOI:10.1016/j.chemosphere.2018.12.041 |
 2021, Vol. 33
2021, Vol. 33 

