(2: 长江流域水生态监测中心, 武汉 430079)
(2: Changjiang River Basin Hydroecological Monitoring Center, Wuhan 430079, P. R. China)
作为水生态系统中有机化合物的重要分解者之一,水体细菌在地球物质化学循环中起到非常重要的作用[1]。水体细菌在直接或间接地参与大部分物质和能量的循环过程中,其丰度和群落结构对其功能发挥起到决定性作用。目前,在水生态监测工作中,生物监测对象主要为浮游动植物、底栖动物和着生藻类,针对微生物(细菌、真菌等)的运用在国外有一些报道[2],但是在国内还较少[3]。水环境监测和评价的内容是监测物种或群落对环境变化的真实响应,并不包含空间结构等随机过程的影响。然而,水体细菌的群落结构和动态变化受多方面因素影响[4],因此,研究水体细菌的空间分布规律及群落构建驱动机制,摸清环境和空间对其群落组成影响的相对贡献,分离不同作用主导下的类群,准确筛选环境指示性物种或类群,对广泛地将水体细菌运用于水生态监测具有重要意义。
生态学家们普遍认为群落的分布机制受随机性过程和确定性过程两方面的共同影响,其影响的主次依据不同的生物类群或其所处的不同生态系统而定[5]。随机性过程主要与空间因子相关,表征群落扩散等作用方式;确定性过程主要与环境因子相关,如水体理化和生境特征指标[6],表征环境对特定物种的选择作用。目前研究多关注细菌群落动态变化[7-8]或其环境影响因子[9-11],如湖北梁子湖和后官湖浮游细菌研究表明,总氮、pH和总磷是其群落结构的主要影响因子[8],忽视了空间因素对其分布格局和群落构建机制的作用。然而研究表明,随水流的扩散作用是浮游生物类群群落构建的重要影响因素[12]。
洞庭湖位于长江中游,是我国第二大淡水湖,由于人类活动的影响,已经明显被分为东、西、南3个湖区[13];鄱阳湖位于长江中下游,是我国第一大淡水湖泊,年内水位落差巨大(变幅为9.59~15.36 m)[14],两者均为过水型浅水湖泊。与静水型湖泊相比,过水型湖泊受单向水体流动影响,水体细菌的分布受水体扩散影响较为明显,一定程度上可以减小环境对物种的选择作用。因此,同期联合调查洞庭湖和鄱阳湖,比较两湖在水体细菌组成和生境空间差异,全面了解湖泊生态系统中水体细菌空间分布特征和驱动机制,对于更好地保护和修复湖泊生态环境具有深远的意义[10]。
本研究拟从两湖水体细菌群落组成、理化指标和调查样点空间关系的基础上,探索过水型湖泊生态系统中水体细菌的空间分布特征及其影响因素,揭示水体细菌群落构建内在机理,为了解两湖水生态系统的生物群落构建及其健康管理提供理论依据。
1 材料与方法 1.1 样品采集与处理2017年9月对洞庭湖和鄱阳湖湖区水体细菌分别进行了调查,其中洞庭湖33个采样点,鄱阳湖24个采样点,共57个采样点(图 1)。采样前对采水器进行灭菌处理,采样人员全程佩戴一次性手套,收集表层以下0.5 m水样1 L,经直径47 mm、孔径0.22 μm生物滤膜(Millipore,PVDF材质)过滤后,回收膜上的细菌群落,每个样品3个重复,冷冻并运回实验室超低温(-80℃)保存。采用YSI水质分析仪(美国,YSI ProQuatro便携式多参数水质分析仪)现场测定水温(WT)、pH、溶解氧(DO)、电导率(EC)、盐度(Sal)等指标,另采集1 L水样带回实验室进行叶绿素a(Chl.a)、总氮(TN)、氨氮(NH3-N)、硝态氮(NO3--N)、总磷(TP)、正磷酸盐(PO43--P)和高锰酸盐指数(CODMn)等指标分析,测定方法参照《地表水环境质量标准》(GB 3838—2002)等标准。
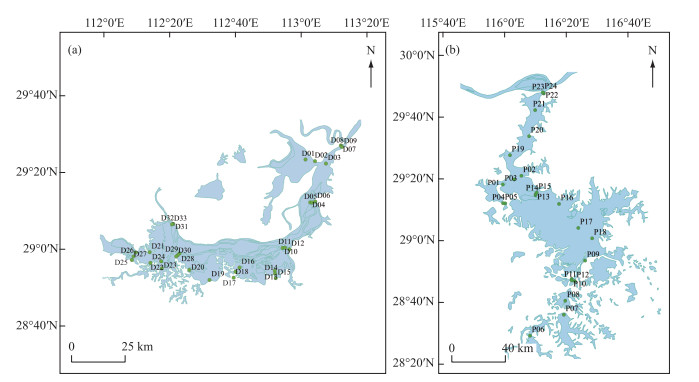
|
图 1 洞庭湖(a)与鄱阳湖(b)采样点分布 Fig.1 Distribution of sampling sites in Lake Dongting (a) and Lake Poyang (b) |
有研究认为过水型湖泊存在对流性强的特点,其富营养化评估应与河流一致,在流速不均匀的大型湖泊,还应分区域进行研究[15]。根据洞庭湖和鄱阳湖过水型湖泊的特定,按其水流方向,将采样点各分为上游(DU或PU)、中游(DM或PM)、下游(DD或PD)3组,其中洞庭湖分为DU(D01~12)、DM(D13~20,D28~30)、DD(D21~27,D31~33),鄱阳湖分为PU(P06~08,P10~12)、PM(P09,P13~18)、PD(P01~05,P19~24),如图 1所示。
1.2 细菌DNA的提取和16S rRNA高通量测序两湖水体微生物样品全DNA的提取采用试剂盒(Axygen)的方法,通过1%凝胶电泳检测提取效果,并使用Nanodrop(Nanodrop,美国)测试其浓度,确保提取到足够浓度的DNA。每个样点分3个重复样提取完后充分混合,后采用Hiseq 250平台(深圳瑞奥康晨生物科技有限公司)进行高通量测序。测序引物选用16S rRNA通用引物341F:5′-CCTAYGGGRBGCASCAG-3′和806R:5′-GGACTACNNGGGTATCTAAT-3′,PCR扩增区域为水体细菌16S rRNA基因V3-V4高变片段。
1.3 数据分析对原始数据进行拼接、过滤等处理后得到有效OTUs(Operational taxonomic units)序列。将具有97%以上相似性的序列归为一类,经与Silva数据库(V13.2)比对注释后得到各位点的细菌种类组成和丰度分布。通过对洞庭湖和鄱阳湖共57个样点的水体细菌16s r RNA V3~V4区进行高通量测序检测分析,经注释后检测出OTU序列27134~70515条,归一化后为27134条,作进一步分析用。
本研究的环境数据可视化由R语言ggplot2包进行,均值差异性检验采用PERMANOVA方差检验;物种组成和多元分析在线(https://www.bioincloud.tech)完成;方差分解分析(Variation partitioning analysis,VPA)由vegan包进行:首先,通过前向选择(forward selection,adespatial包),筛选出对细菌群落影响显著的环境因子;然后,基于邻体矩阵主坐标分析(principal coordinates of neighbor matrices,PCNM)计算采样点之间的空间关系,同样通过前向选择筛选细菌群落潜在的空间影响因子;最后,通过vegan包的varpart函数对已筛选的环境因子和空间因子进行方差分解分析;零模型分析通过picante包进行:通过计算β最接近分类指数(βNTI)和Raup-Crick指数(RC)对水体细菌群落的群落构建过程进行了分析。βNTI < -2的为同质选择,βNTI>2则为异质选择,|βNTI|≤2的部分均为随机性过程,并依据RC的大小进行分类:其中RC < 0.95表示同质扩散,RC>0.95表示扩散限制,|RC|≤0.95表示漂变。
2 结果与分析 2.1 两湖水质特征洞庭湖和鄱阳湖各采样点的环境因子主成分分析(PCA)结果如图 2所示,洞庭湖和鄱阳湖呈现出显著的环境异质性(PERMANOVA, R2=0.62, P < 0.001)。从各指标来看,在此次调查期间洞庭湖TN、TP、NO3--N、PO43--P浓度显著高于鄱阳湖,NH3-N浓度没有显著性差异;其他指标中,Chl.a浓度表现为洞庭湖显著低于鄱阳湖,而pH、EC和Sal表现为洞庭湖显著高于鄱阳湖,DO、WT和CODMn则在两湖之间没有显著性差异(图 3)。
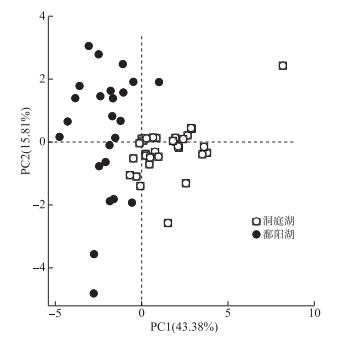
|
图 2 洞庭湖和鄱阳湖环境因子主成分分析 Fig.2 PCA of environmental factors in Lake Dongting and Lake Poyang |
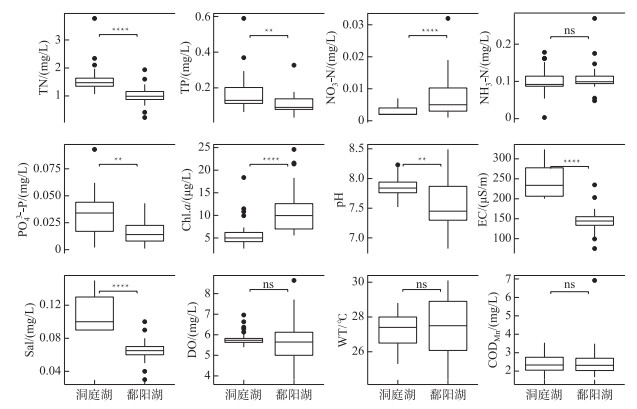
|
图 3 洞庭湖和鄱阳湖环境因子 Fig.3 Environmental factors in Lake Dongting and Lake Poyang |
两湖水体细菌一共检测出20门(平均丰度低于0.1%的门归为“其他”),其中洞庭湖优势的门类有放线菌门(Acitinobacteria)、蓝细菌门(Cyanobacteria)和变形菌门(Proteobacteria),D10~12位点变形菌门相对丰度较高,而D01、D18、D31~33位点拟杆菌门(Bacteroidetes) 相对丰度较高;鄱阳湖优势的门类与洞庭湖相似,有放线菌门、蓝细菌门和变形菌门,其中P05号与P04位点距离近,但是其群落组成差别较大,P05位点壁厚菌门(Firmicutes)相对丰度高于其他位点;在门水平上,洞庭湖和鄱阳湖组不同位点之间差异较小,但是两湖之间水体细菌组成存在一定差异(图 4)。
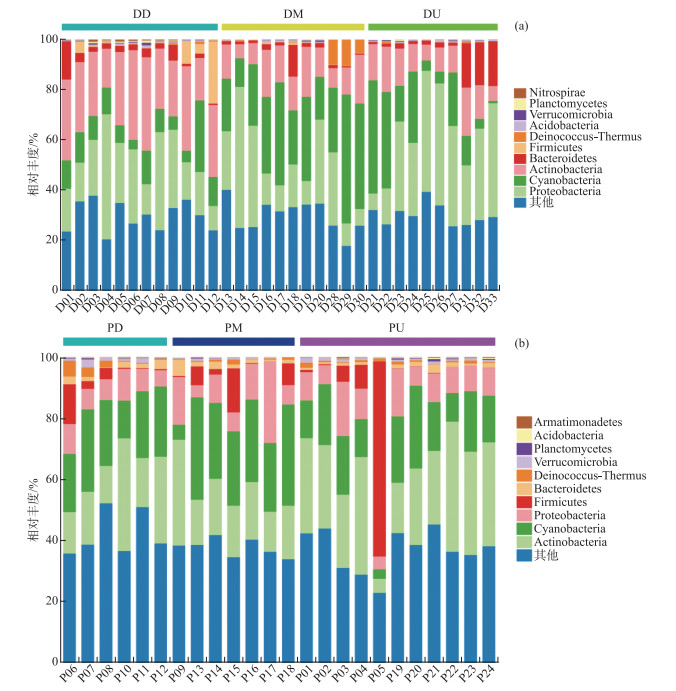
|
图 4 洞庭湖(a)和鄱阳湖(b)水体细菌门水平物种组成 Fig.4 Bacteria community composition in Lake Dongting (a) and Lake Poyang (b) |
通过比较各组水体细菌组成在门水平上的相对丰度,可知洞庭湖上游组(DU)中放线菌门相对丰度较其他两组高,而蓝细菌门相对丰度较低;鄱阳湖各组之间,水体细菌优势门相对丰度差异较小。水体细菌组成中,蓝细菌门的种类一直被广泛关注,主要是因为蓝细菌在富营养化水体中极易形成水华,危害水生态健康[13]。从两湖内部样点群落组成比较来看,洞庭湖各样点的蓝细菌门相对丰度分布不均匀,各样点平均相对丰度为18.76%,分布范围为0.93%~51.31%,最高值出现在D29位点。具体分组上,在下游组(DD)样点中相对丰度较低,平均为12.25%,上游组(DU)次之,平均为17.28%,在中游组(DM)最高,平均为32.84%;在鄱阳湖中,蓝细菌门在各样点的相对丰度分布较为均匀,离长江入口(湖口)距离较近的下游组(PD)样点平均丰度最低,为16.02%,中游组(PM)样点最高,为24.29%,上游组(PU)样点处于中间水平,为20.81%,全湖各样点均值为19.63%(图 5)。

|
图 5 洞庭湖和鄱阳湖各组水体细菌门水平物种组成 Fig.5 Bacteria community composition of different groups in Lake Dongting and Lake Poyang |
通过冗余分析(RDA)两湖水体细菌OTU水平组成及其影响因子,其中环境因子经共线性分析后去掉TDS指标。结果显示RDA第1轴解释率为23.53%,第2轴解释率为12.70%,共36.23%(图 6)。两湖的样点沿第1轴明显分开,主要影响因子为NO3--N、EC、TN和Chl.a,经Adonis检验后,可知洞庭湖与鄱阳湖组间差异显著(P < 0.001)。洞庭湖不同区域之间的样点分布较为分散,显示出一定的空间差异性,主要影响因子为WT、TP和EC等;鄱阳湖不同区域之间的位点较为聚集,差异性较小。

|
图 6 洞庭湖(DU、DM和DD)和鄱阳湖(PU、PM和PD)水体细菌群落组成的冗余分析 Fig.6 Similarity analysis of bacterioplankton community composition in Lake Dongting (DU, DM and DD) and Lake Poyang (PU, PM and PD) |
采用Mantel分析分别研究两湖水体细菌中蓝细菌和其他类群的组成与环境因子的关系,结果表明:洞庭湖中,对蓝细菌类群有显著影响的因子有NH3-N、NO3--N、TN、PO43--P、TP、WT、EC和Sal(P < 0.05),而对其他类群有显著影响的因子有PO43--P、TP、WT、EC和Sal(P < 0.05);鄱阳湖中,对蓝细菌类群和其他类群有显著影响的因子均为PO43--P、WT、EC和Sal(P < 0.05)(图 7)。
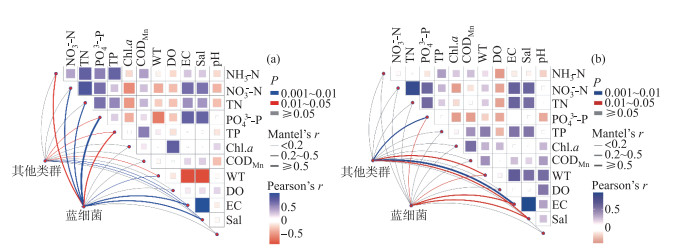
|
图 7 洞庭湖(a)和鄱阳湖(b)水体细菌中蓝细菌和其他类群与环境因子之间的相关性 Fig.7 The relationship (Mantel rest) between cyanobacteria and other bacterioplankton with environmental factors in Lake Dongting (a) and Lake Poyang (b) |
采用方差分解的方法对环境因子和空间因子进行分析,解析两者对两湖水体细菌群落结构形成的贡献差异,推断不同湖泊水体细菌群落的构建机制[14]。结果表明:洞庭湖水体细菌群落影响因素中纯环境因子解释度为2.0%,纯空间因子为15.0%,两者共同解释度为27.0%;而鄱阳湖水体细菌群落影响因素中纯环境因子解释度为19.0%,空间因子为13.0%,两者共同解释度为6.0%(图 8)。零模型分析结果表明,随机性过程是洞庭湖和鄱阳湖水体细菌分布的主要作用方式,分别占58.5%和79.7%,主要由同质扩散和漂变组成,扩散限制均为0;在两湖中,确定性过程的作用占比低于随机性过程,分别为41.5%和20.3%,由同质选择和异质选择组成,且占比差异较大,前者分别为36.8%和15.6%,而后者均低于5%,占比较小(图 8)。
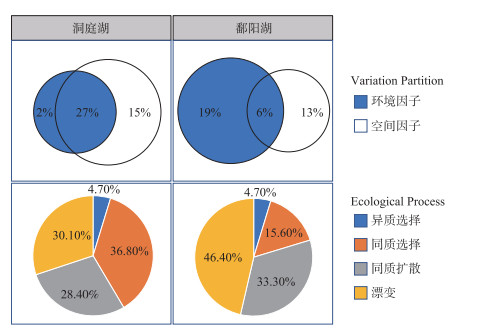
|
图 8 洞庭湖和鄱阳湖水体细菌群落构建方差分解和零模型分析 Fig.8 Analysis of variation partitioning and null model analysis for the assembly mechanisms of planktonic bacterial communities in Lake Dongting and Lake Poyang |
本研究以水体细菌作为研究对象,同期调查洞庭湖和鄱阳湖,获取两湖不同区域水体细菌组成和环境因子及空间因子数据,运用多元分析的方法探讨水环境的空间异质性、物种组成差异及影响因子,采用方差分解和零模型的方法分析水体细菌群落构建的机制,加强了对过水型湖泊的生态过程的理解,同时也为湖泊生态健康的监测和评价拓宽领域。
3.1 两湖水环境异质性在本次调查期间,洞庭湖与鄱阳湖在水环境条件上差异显著,且鄱阳湖内部各样点之间空间异质性较洞庭湖更高。研究表明,高坝水库中调水口的浮游植物丰度较其他位置低,且与其调水口流速和调水量呈显著负相关[16],李哲等的研究同样表明,三峡水库季节性的调蓄变化导致的生境条件变化是藻类生物多样性改变的重要原因[17]。在本研究调查期间,洞庭湖和鄱阳湖受上游河流来水和长江干流水位变化的双重影响,通过水位波动对湖泊水生境和营养状态产生一定影响[18]。通过比较两湖水环境参数,洞庭湖水体营养物质浓度较高、Chl.a浓度却较低,可以推测其水体交换、流速等水动力和扩散条件较好,抑制了Chl.a的增长。较好的扩散条件使得TN、TP等营养物质在各样点之间分布更为均匀,因此,洞庭湖水环境异质性较低,而鄱阳湖水环境异质性较高。
3.2 两湖水体细菌群落组成的空间分布格局及影响因子蓝细菌已成为目前世界范围内湖泊生态环境的重要威胁对象,在条件适宜时,极易发生水华等危害水生态健康的事件[19-21]。目前,除较为常见的微囊藻水华外[22-24],鱼腥藻[25]、气丝藻[26]等水华也逐渐在鄱阳湖不同区域暴发。鄱阳湖第二次科考结果显示,部分湖区已经出现了明显的水华现象,蓝藻(也称蓝细菌)已成为各受控湖汊和碟形湖的主要优势类群之一[27]。本次调查结果中,蓝细菌门在两湖各样点均有一定程度的分布,并且呈现出相似的空间分布格局。在洞庭湖中,蓝细菌门种类的分布不均匀,其中中游湖区相对丰度较高,达到32.84%,而下游湖区较低;在鄱阳湖中,蓝细菌门相对丰度总体分布相对均匀,但是中部湖区样点仍最高。文献记载,洞庭湖水华主要发生在东部和西部湖湾区等水流较缓、水体交换率低的区域,过水河道区域则零星分布[28]。两湖中部湖区较上游和下游区域,湖面宽,流速缓,这也可能是蓝藻相对丰度较高的原因。张民等关于太湖蓝藻水华空间扩张的研究结果显示,水华由西北区梅梁湾区域逐渐扩张至中部湖区,营养盐的空间分布和水文气象是最主要的驱动因子[29]。近年来随着上游水利设施的建设和流域内工农业的发展,氮、磷浓度逐渐上升,两湖富营养化日益严重[30]。因此,过水河道,尤其是中部湖区蓝藻水华的潜在风险较大。有关部门应加强藻类监测和管理,减缓或避免进一步扩张。
对于水体细菌群落,两湖分布呈现出不同的空间格局(图 6)。在环境影响因子方面,洞庭湖主要受NO3--N、NH3-N、NO2--N、TN、PO43--P、TP、WT、EC和Sal显著影响,而鄱阳湖受EC、PO43--P、Sal和WT显著影响。换言之,在鄱阳湖,除PO43--P以外,对其他氮、磷营养物质浓度响应并不敏感(Mantel's P>0.05)(图 7)。李胜男等[31]在研究洞庭湖丰水期超微浮游植物群落丰度变化时,发现透明度、水位等因子影响最大,而与TN、TP等营养指标的相关性不显著。在过水型湖泊中,水体理化条件,如EC和WT等,受水位波动直接或间接的影响较大,因此可认为,洞庭湖水体细菌受物理因子和营养盐因子的共同影响,而鄱阳湖主要受物理因子的影响。
3.3 两湖水体细菌群落构建机制通过了解微生物群落变化的生态过程和影响因素,推断群落稳定性及其与生态系统功能之间的关系,有利于了解湖泊生态系统的变化过程及健康动态[1]。因此,探究湖泊水体细菌群落的构建机制是一项重要内容。洞庭湖和鄱阳湖属于典型的过水型湖泊,其水量主要由上游河流汇集,经湖区入长江,水体的流动对水体细菌的扩散分布影响较大,但是近年来两湖污染情况加剧,环境影响同样不容忽视。环境因子和空间因子是影响物种分布的两类关键因子,前者指示了环境条件的差异对群落中不同物种的选择作用,是一种确定性过程;而空间因子主要通过扩散等作用影响物种在空间上的分布,是一种随机性过程。越来越多的研究表明,两者同时对物种的分布产生重要影响,研究的焦点在于哪种过程占主导地位以及如何量化两者贡献的大小[32]。
本次调查方差分解结果显示,洞庭湖以空间影响为主(42.0%),但其中有27.0%与环境影响重叠,而鄱阳湖则以环境影响为主(25.0%),仅6.0%与空间影响重叠。值得注意的是,两湖分别有55.0%和62.0%的变异不能被解释。零模型分析结果显示,随机性过程(包括漂变和同质扩散)主导了两湖水体细菌的空间分布(分别为58.5%和79.7%)。鄱阳湖的环境空间异质性较洞庭湖高(图 2),若确定性过程主导,其物种组成相似度应该较低,但其物种组成分析结果显示较为聚集,即相似度较高(图 6),说明鄱阳湖受到的随机过程影响高于洞庭湖,这与零模型分析结果一致。在确定性过程影响方面,洞庭湖受确定性影响相对比例较鄱阳湖大,且主要体现在同质选择作用上,同样与洞庭湖环境的空间异质性较低一致。零模型分析是基于群落中各物种的谱系关系和丰度信息,通过建立“随机群落”的方式,比较“观测群落”与“随机群落”之间的谱系组成关系,判断不同群落构建过程的比例[33],而方差分解则是基于典范分析或冗余分析通过排序得到[34],依赖于实测的环境因子和位点空间关系,在实际操作过程中,会有一部分方差无法解释,即残差。因此,本次研究中,零模型分析结果更好地解释了两湖水体细菌的群落构建机制。
综上所述,洞庭湖和鄱阳湖等过水型湖泊中生物群落的构建受到随机过程的重要影响,所观测群落特征与真实水生态健康状况之间存在较大的不确定性。因此,在水生态监测工作开展过程中,探究监测对象群落构建模式非常重要。
| [1] |
Zhou L, Wang PF, Huang SH et al. Environmental filtering dominates bacterioplankton community assembly in a highly urbanized estuarine ecosystem. Environmental Research, 2021, 196: 110934. DOI:10.1016/j.envres.2021.110934 |
| [2] |
Sagova-Mareckova M, Boenigk J, Bouchez A et al. Expanding ecological assessment by integrating microorganisms into routine freshwater biomonitoring. Water Research, 2021, 191: 116767. DOI:10.1016/j.watres.2020.116767 |
| [3] |
Ji Y, Wu YM, Xu QJ. Biological monitoring method of water environment and its application. Journal of Environmental Engineering Technology, 2019, 9(5): 616-622. [计叶, 吴雨蒙, 许秋瑾. 水环境的生物监测方法及其应用. 环境工程技术学报, 2019, 9(5): 616-622.] |
| [4] |
Zhang JX, Chen Y, Huo Y et al. Eutrophication increases deterministic processes and heterogeneity of co-occurrence networks of bacterioplankton metacommunity assembly at a regional scale in tropical coastal reservoirs. Water Research, 2021, 202: 117460. DOI:10.1016/j.watres.2021.117460 |
| [5] |
Tilman D. Niche tradeoffs, neutrality, and community structure: A stochastic theory of resource competition, invasion, and community assembly. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(30): 10854-10861. DOI:10.1073/pnas.0403458101 |
| [6] |
Vellend M. Conceptual synthesis in community ecology. The Quarterly Review of Biology, 2010, 85(2): 183-206. DOI:10.1086/652373 |
| [7] |
Kou WB, Huang ZY, Zhang J et al. Bacterial community structure and composition in Lake Poyang: a case study in the Songmenshan Region, China. Acta Ecologica Sinica, 2015, 35(23): 7608-7614. [寇文伯, 黄正云, 张杰等. 鄱阳湖湖泊细菌群落组成及结构——以松门山为例. 生态学报, 2015, 35(23): 7608-7614.] |
| [8] |
Zou SJ, Yin LQ, Zhao BL et al. Bacterioplankton community structure characteristics in Liangzi Lake and Houguan Lake, Wuhan. Journal of Hydroecology, 2021, 42(2): 33-41. [邹沈娟, 尹立强, 赵博礼等. 梁子湖与后官湖浮游细菌的群落结构特征. 水生态学杂志, 2021, 42(2): 33-41. DOI:10.15928/j.1674-3075.201905180125] |
| [9] |
李勇. 三岔湖微生物群落结构及其在磷素迁移转化中的作用[学位论文]. 成都: 西南交通大学, 2020.
|
| [10] |
Ren LJ, He D, Xing P et al. Bacterial diversity and ecological function in lake water bodies. Biodiversity Science, 2013, 21(4): 422-433. [任丽娟, 何聃, 邢鹏等. 湖泊水体细菌多样性及其生态功能研究进展. 生物多样性, 2013, 21(4): 422-433.] |
| [11] |
Tan HX, Hu YA, Mei ZP. Main factors influencing the growth of planktonic bacteria in fish pond ecosystem. Chinese Journal of Applied Ecology, 2002, 13(1): 95-100. [谭洪新, 胡煜昂, 梅志平. 鱼池生态系统中影响浮游细菌生长制约因素的研究. 应用生态学报, 2002, 13(1): 95-100.] |
| [12] |
Zhao ZL, Li HJ, Sun Y et al. Bacteria versus fungi for predicting anthropogenic pollution in subtropical coastal sediments: Assembly process and environmental response. Ecological Indicators, 2022, 134: 108484. DOI:10.1016/j.ecolind.2021.108484 |
| [13] |
Yin YY, Peng GZ, Xie YN et al. Characteristics and risk assessment of nutrients and heavy metals pollution in sediments of Dongting Lake. Environmental Chemistry, 2021, 40(8): 2399-2409. [尹宇莹, 彭高卓, 谢意南等. 洞庭湖表层沉积物中营养元素、重金属的污染特征与评价分析. 环境化学, 2021, 40(8): 2399-2409.] |
| [14] |
Zou LH, Zou W, Zhang QJ et al. Characteristics and driving factors of spatiotemporal succession of macrozoobenthos in Poyang Lake. China Environmental Science, 2021, 41(6): 2881-2892. [邹亮华, 邹伟, 张庆吉等. 鄱阳湖大型底栖动物时空演变特征及驱动因素. 中国环境科学, 2021, 41(6): 2881-2892.] |
| [15] |
Luo YP, Liao YH, Pan MT. The control standard of total phosphorus in overflowed lakes should be treated differently. Environmental Economy, 2017(8): 60-61. [罗岳平, 廖岳华, 潘海婷. 过水型湖泊总磷控制标准要区别对待. 环境经济, 2017(8): 60-61.] |
| [16] |
Yan XY, Zhang Y, Li YY et al. Hydrologic and physicochemical factors co-drive seasonal changes of phytoplankton during dynamic water diversion processes in the Danjiangkou Reservoir. J Lake Sci, 2021, 33(5): 1350-1363. [闫雪燕, 张鋆, 李玉英等. 动态调水过程水文和理化因子共同驱动丹江口水库库湾浮游植物季节变化. 湖泊科学, 2021, 33(5): 1350-1363. DOI:10.18307/2021.0505] |
| [17] |
Li Z, Wang S, Guo JS et al. Phytoplankton diversity in backwater area of the Pengxi River in the Three Gorges Reservoir before and after 156 m impoundment. J Lake Sci, 2012, 24(2): 227-231. [李哲, 王胜, 郭劲松等. 三峡水库156m蓄水前后澎溪河回水区藻类多样性变化特征. 湖泊科学, 2012, 24(2): 227-231. DOI:10.18307/2012.0209] |
| [18] |
Qian KM, Liu BG, Chen YW. Long term dynamics of phytoplankton functional groups in Lake Poyang during 2009-2016. J Lake Sci, 2019, 31(4): 1035-1044. [钱奎梅, 刘宝贵, 陈宇炜. 鄱阳湖浮游植物功能群的长期变化特征(2009—2016年). 湖泊科学, 2019, 31(4): 1035-1044. DOI:10.18307/2019.0402] |
| [19] |
Guo HL, Liu HQ, Lv H et al. Is there any difference on cyanobacterial blooms patterns between Lake Chaohu and Lake Taihu over the last 20 years?. Environmental Science and Pollution Research, 2022, 29(27): 40941-40953. DOI:10.1007/s11356-021-18094-x |
| [20] |
Xue YY, Chen HH, Yang JR et al. Distinct patterns and processes of abundant and rare eukaryotic plankton communities following a reservoir cyanobacterial bloom. The ISME Journal, 2018, 12(9): 2263-2277. DOI:10.1038/s41396-018-0159-0 |
| [21] |
Qin BQ, Li W, Zhu GW et al. Cyanobacterial bloom management through integrated monitoring and forecasting in large shallow eutrophic Lake Taihu (China). Journal of Hazardous Materials, 2015, 287: 356-363. DOI:10.1016/j.jhazmat.2015.01.047 |
| [22] |
Qian KM, Liu X, Duan M et al. Distribution and its influencing factors of bloom-forming cyanobacteria in Poyang Lake. China Environmental Science, 2016, 36(1): 261-267. [钱奎梅, 刘霞, 段明等. 鄱阳湖蓝藻分布及其影响因素分析. 中国环境科学, 2016, 36(1): 261-267.] |
| [23] |
Yang P, Chai WB, Huang J et al. Study on morphological diversity of Microcystis (Cyanopthyta) from Poyang Lake, China. Journal of Jiangxi Normal University: Natural Science Edition, 2014, 38(5): 496-500. [杨平, 柴文波, 黄静等. 鄱阳湖微囊藻属形态多样性研究. 江西师范大学学报: 自然科学版, 2014, 38(5): 496-500.] |
| [24] |
Zhang JM, Zhang M, Kuang WM et al. Characteristics of stable carbon and nitrogen isotope signatures of aquatic plants to algal blooms in Poyang Lake. Research of Environmental Sciences, 2016, 29(5): 708-715. [张金美, 张萌, 匡武名等. 水华条件下鄱阳湖区植物叶片碳氮同位素特性. 环境科学研究, 2016, 29(5): 708-715.] |
| [25] |
Qian KM, Liu X, Qi LY et al. Variations of Anabaena in the transition levels between river-and lake-type of Lake Poyang. J Lake Sci, 2016, 28(3): 566-574. [钱奎梅, 刘霞, 齐凌艳等. 鄱阳湖河湖转换期间鱼腥藻(Anabaena)的变化. 湖泊科学, 2016, 28(3): 566-574. DOI:10.18307/2016.0312] |
| [26] |
Li SC, Huang J, Yu GL et al. Aerosakkonema, a newly reported genus of water bloom forming cyanobacteria in the Poyang Lake of China. Acta Hydrobiologica Sinica, 2014, 38(6): 1071-1075. [李守淳, 黄静, 虞功亮等. 鄱阳湖的中国水华蓝藻新记录属——气丝藻属. 水生生物学报, 2014, 38(6): 1071-1075. DOI:10.7541/2014.157] |
| [27] |
Peng NY, Dai GF, Zhang W et al. Differences in nutrition condition and algae population in different areas of Poyang Lake. J Lake Sci, 2018, 30(5): 1295-1308. [彭宁彦, 戴国飞, 张伟等. 鄱阳湖不同湖区营养盐状态及藻类种群对比. 湖泊科学, 2018, 30(5): 1295-1308. DOI:10.18307/2018.0512] |
| [28] |
Wu KF, Ou FP, Wang CM. Nitrogen and phosphorus nutrient structure characteristic and risk analysis of cyanobacterial bloom in East Dongting Lake in autumn. Yangtze River, 2018, 49(23): 21-26, 73. [吴可方, 欧伏平, 王丑明. 东洞庭湖秋季氮磷营养盐结构及水华风险分析. 人民长江, 2018, 49(23): 21-26, 73.] |
| [29] |
Zhang M, Yang Z, Shi XL. Expansion and drivers of cyanobacterial blooms in Lake Taihu. J Lake Sci, 2019, 31(2): 336-344. [张民, 阳振, 史小丽. 太湖蓝藻水华的扩张与驱动因素. 湖泊科学, 2019, 31(2): 336-344. DOI:10.18307/2019.0203] |
| [30] |
Xiong J, Yu FQ, Tian Q et al. The evolution of water quality and nutrient condition in Lake Dongting in recent 30 years. J Lake Sci, 2016, 28(6): 1217-1225. [熊剑, 喻方琴, 田琪等. 近30年来洞庭湖水质营养状况演变特征分析. 湖泊科学, 2016, 28(6): 1217-1225. DOI:10.18307/2016.0607] |
| [31] |
Li SN, Chen HY, Peng H et al. Temporal and spatial variation patterns of picophytoplankton and their correlations with environmental factors during the wet season in East Lake Dongting. Environmental Science, 2020, 41(6): 2679-2687. [李胜男, 陈豪宇, 彭华等. 丰水期东洞庭湖超微型浮游藻类时空分布特征及其影响因子. 环境科学, 2020, 41(6): 2679-2687. DOI:10.13227/j.hjkx.201912223] |
| [32] |
Zhou JZ, Ning DL. Stochastic community assembly: Does it matter in microbial ecology?. Microbiology and Molecular Biology Reviews: MMBR, 2017, 81(4): e00002-e00017. DOI:10.1128/MMBR.00002-17 |
| [33] |
Stegen JC, Lin XJ, Fredrickson JK et al. Quantifying community assembly processes and identifying features that impose them. The ISME Journal, 2013, 7(11): 2069-2079. DOI:10.1038/ismej.2013.93 |
| [34] |
Lai JS, Zou Y, Zhang JL et al. Generalizing hierarchical and variation partitioning in multiple regression and canonical analyses using the rdacca.hp R package. Methods in Ecology and Evolution, 2022, 13(4): 782-788. DOI:10.1111/2041-210x.13800 |
 2023, Vol. 35
2023, Vol. 35 

