(2: 中国环境科学研究院, 国家环境保护化学品生态效应与风险评估重点实验室, 北京 100012)
(2: State Environmental Protection Key Laboratory of Ecological Effect and Risk Assessment of Chemicals, Chinese Research Academy of Environmental Sciences, Beijing 100012, P.R.China)
新烟碱类杀虫剂(neonicotinoid insecticides,NEOs)作为一类新型内吸性农药, 目前已经成为杀虫剂市场使用量最大的一类产品[1]。2014年全球农药市场销售额为186亿美元,新烟碱类农药的占有率为四分之一[2]。中国新烟碱类农药的生产量和出口量居世界之首,且需求量近年来进一步增加[3]。新烟碱类和烟碱类农药的作用机制大体相同,均对害虫中枢神经系统的乙酰胆碱受体表现出抑制作用,从而阻断害虫中枢神经系统的正常传导而起到杀虫效果。但与烟碱类相比,NEOs具有选择性强、高效且对哺乳动物安全的特点,并且与传统的农药(有机氯类、氨基甲酸酯类、拟除虫菊酯类等)不发生交互抗性[4]。然而,NEOs施用后仅有5 % 的有效成分被植物吸收,大部分直接进入土壤环境,再经雨水冲刷随地表径流进入水环境中。NEOs的分子量小、水溶性高且具有稳定性和持久性,很容易通过农业区的径流和排水转移到水生生态系统中[5-6]。毒理学和流行病学研究表明,与其他部分传统农药相同,NEOs的暴露会对水生生物产生急性(0.65~320000 μg/L)或慢性(0.12~9500 μg/L)毒性,并对水生生态系统和人类造成潜在的生态风险[7-12]。目前,加拿大和欧盟委员会已经出台相关政策限制或停止使用噻虫胺(clothianidin,CLO)、吡虫啉(imidacloprid,IMI)和噻虫嗪(thiamethoxam,THIA)等新烟碱农药。包括加拿大、美国、瑞典和荷兰在内的数个国家已经制定了IMI的水质指南。
新烟碱类杀虫剂被广泛大量使用,目前已在全球范围内地表水径流、地下水、湿地等环境水体中被频繁检出[13]。2009-2010年间日本大阪的河流及入海口水体中的新烟碱类杀虫剂监测结果显示,吡虫啉、呋虫胺、噻虫胺和噻虫嗪的检出率均为100 % [14]。美国地质调查局对五大湖开展了长达一年的新烟碱类农药监测,结果显示在每月一次的监测中,74 % 的样品被检出至少存在一种新烟碱类杀虫剂污染,其中IMI检出率最高(53 %),其次是CLO(44 %)、THIA(22 %)、啶虫脒(acetamiprid,ACE)(2 %)和呋虫胺(dinotefuran,DIN)(1 %)[15]。在加拿大萨斯喀彻温省的湿地及融雪中,噻虫胺和噻虫嗪的检出率在95 % ~100 % 之间[16]。Morrissey等[6]调查了全球范围内包括瑞典、美国、澳大利亚、日本、加拿大、巴西、荷兰、越南以及德国9个国家的29项研究数据,发现大部分水体中均能检测到新烟碱类杀虫剂,且在地表水中的新烟碱类杀虫剂的几何平均值和峰值几何平均值分别为0.13和0.63 μg/L。我国的环境水体中也有新烟碱类杀虫剂检出,其浓度大多在μg/L水平[17-20]。在珠江流域的3条河流中噻虫嗪、噻虫胺和啶虫脒的检出率都是100 %,吡虫啉的检出率为96 % ~100 %,噻虫啉的检出率为39 % ~91 % [19]。在广州城市河流中检出了4种新烟碱类杀虫剂,其中,吡虫啉、噻虫胺和啶虫脒的检出率都是100 %,噻虫嗪的检出率是71 % [20]。在我国福建九龙江河口沉积物中,发现IMI和ACE浓度分别为0.31和0.43 ng/g(沉积物,干重)[21]。一项我国饮用水中NEOs及其代谢产物的监测结果显示,在全国各地884个饮用水样品中(含789个自来水样品,95个地下水样品),7种主要的新烟碱类杀虫剂均有检出,其中检出率最高的IMI平均浓度为24.5 ng/L[22]。长江流域覆盖了我国广泛的农业区域,NEOs总浓度水平与季节相关,雨季NEOs总浓度均值为390 ng/L,而旱季高达990 ng/L[23]。上述研究表明,新烟碱类杀虫剂不仅检出率较高,且通常能够同时检测出多种新烟碱类杀虫剂,我国水环境中NEOs的污染也较为严峻。环境中新烟碱类农药的潜在生态风险和健康风险近几年来受到公众的广泛关注。经过长达8年的现场监测,研究人员发现,即使IMI浓度低至13~67 ng/L,也会对地表水中约28 % ~59 % 的大型无脊椎动物产生不利影响[24]。另一项研究表明,IMI(2~8 mg/(kg ·d))通过诱导DNA断裂、抗氧化失衡和细胞凋亡对雄性大鼠的生殖系统造成不良影响[25]。此外,30天的THIA(112.5 mg/kg)暴露下,大鼠游离甲状腺素和三碘甲状腺原氨酸的血清水平显著升高,这表明NEOs具有潜在的内分泌干扰效应[26]。另外,新烟碱类杀虫剂在离体实验中被证明能够通过主动运输的形式被人类肠道细胞吸收[27-28]。基于大鼠的活体实验,NEOs及其代谢产物能够通过血脑屏障,其中部分代谢产物与烟碱型乙酰胆碱受体(nicotinic acetylcholine receptor,nAChRs)的结合能力更强,并且比母体毒性更强[29]。
鄱阳湖作为中国第一大淡水湖,是长江流域重要的过水性、吞吐型、季节性湖泊,有着极其丰富的生物资源。近年来,鄱阳湖及其五条汇水河流(赣江、抚河、饶河、信江及修水)受农业、渔业、采砂、矿山开采、化工制造等各种生产生活活动的影响,生态环境健康问题备受关注[30-34]。鄱阳湖流域农业发达,农药使用量较大,从1980s以前广泛使用的六六六、滴滴涕、六氯苯等有机氯农药,到目前广泛使用的NEOs,都会对鄱阳湖水生态系统构成潜在的威胁[35-37]。NEOs因其用量大和水溶性高引起我国学者关注,目前已有大尺度研究调查了我国主要流域中NEOs的空间分布特征和生态风险,但关于NEOs在鄱阳湖流域的污染水平、分布特征和生态风险尚无相关报道。因此本研究采集了鄱阳湖五大出入湖河流及湖中的地表水样品,阐述了9种广泛商业化使用的NEOs的浓度水平和在不同区域的相对浓度贡献,计算水生生物NEOs急性毒性危害阈值并评估相应的生态风险。
1 材料与方法 1.1 试剂与仪器DIN、ACE、氟啶虫酰胺(flonicamid,FLO)、CLO、噻虫啉(thiacloprid,THI)、IMI、氯噻啉(imidaclothiz,IMID)、烯啶虫胺(nitenpyram,NIT)和THIA(理化性质见表 1)与内标物噻虫胺-氘3(clothianidin-D3,CLO-D3)均购自美国Cerilliant公司。浓盐酸(分析纯)购自国药集团化学试剂有限公司(北京),色谱纯甲醇、乙腈购自Fisher公司,实验用超纯水由Milli-Q系统制备。固相萃取柱Poly-Sery HLB购自Waters公司,玻璃纤维滤膜(GF/FTM filters,直径47 mm,孔径0.45 μm)购自Whatman公司。各代新烟碱类杀虫剂优缺点及适用范围见表 2[4, 38-41]。
| 表 1 新烟碱类杀虫剂的理化性质 Tab. 1 Physicochemical properties of neonicotinoids |
| 表 2 各代新烟碱类杀虫剂优缺点及适用范围[4, 38-41] Tab. 2 Advantages, disadvantages and application scope of different generations of NEOs[4, 38-41] |
实验样品于2019年9月(平水期)在鄱阳湖入湖河流采集。在网格布点的基础上考虑鄱阳湖五大主要进出湖河流的河口位置以及湖区和河流的汇水状况,共设置35个采样点,其中采样点S01~S08位于鄱阳湖北部湖区,修水河以北至湖口县长江汇入口;S09~S14除S11分布在修水河支流,其余均位于修水河干流;S15~S19主要分布在赣江干流,以及赣江中支(S15)和南支(S16);同时在鄱阳湖其他主要河流及湖汊如抚河(S20~S22)、池溪水(S23~S24)、余干县湖汊(S25~S26)、信江干流(S27)及东支(S28)、饶河(S29)、昌江(S30~S31)、西河(S32)等分别设置采样点,在鄱阳湖南部湖区设置S33~S35 3个采样点,上述采样点位分布如图 1所示。每个采样点取水样1 L,置于用甲醇和Milli-Q水洗净并烘干的棕色玻璃瓶中。采样结束后立即运回实验室于4℃冷藏。全部样品在48 h内处理完毕。

|
图 1 鄱阳湖采样点位分布 Fig.1 Distribution of sampling sites in Lake Poyang |
取1 L地表水样经0.45 μm玻璃纤维滤膜过滤,0.1 mol/L盐酸调节pH至3。水样以1 mL/min的流速过Poly-Sery HLB(500 mg,6 mL)萃取柱(经8 mL甲醇和10 mL超纯水活化平衡)富集。然后用10 mL超纯水淋洗,抽干多余水分。萃取柱用8 mL甲醇进行洗脱;收集洗脱液至10 mL离心管中,在40℃水浴中弱氮气流吹至近干,用1 mL乙腈重构样品,经0.22 μm尼龙膜过滤,-20℃保存待测。
1.3 样品分析方法验证与质量控制:采用内标法定量(内标物质:CLO-D3,加标量:5 ng),线性范围为0.01~10 μg/L,R2>0.99。检测限(LOD)为信噪比3 ∶1,定量限(LOQ)为信噪比10 ∶1,目标物在地表水中的LOD在0.0015~0.0981 ng/L之间,LOQ在0.0018~0.1449 ng/L之间。目标物质谱参数见表 3。
| 表 3 目标物离子对及相应质谱参数 Tab. 3 Target ion pairs and corresponding mass spectrometric parameters |
通过构建鄱阳湖新烟碱类杀虫剂的物种敏感分布曲线(SSD)来计算PNEC,从而评估NEOs对鄱阳湖水生生物的毒性效应。NEOs的毒性数据均来自于USEPA的ECOTOX数据库,生物物种选择了具有代表性的水生生物物种,包括两栖动物、鱼类、昆虫、甲壳类动物、蠕虫、爬行动物、软体动物、藻类等水生动植物。SSD曲线的绘制采用USEPA提供的SSD模型以及生成软件进行模拟计算(CADDIS SSD generator v.1 software, http://www.epa.gov/caddis-vol4)。使用荷兰国家公共卫生与环境研究院(RIVM)开发的ETX2.0软件包[42]对毒性数据分布进行Anderson-Darling检验,验证其是否符合log-normal分布模型,并推导50 % 置信度的HC5。考虑到非本地物种数据、物种种类、野外实际暴露等影响因素,以2~5作为评价因子(AF),根据公式(1)计算PNECs值[43]。
| $ P N E C=H C_5 / A F $ | (1) |
式中,PNEC为物质毒性的预测无效应浓度,ng/L;HC5为最大环境许可浓度阈值,ng/L;AF为评价因子,采用欧盟水框架指令的推荐值(5)。
使用联合概率分布曲线(joint probability distributions,JPCs)[44]进行NEOs概率生态风险评价。JPCs能够反映各损害水平下暴露浓度超过相应NEOs急性临界浓度值的概率,体现暴露状况和暴露风险之间的关系,并明确对某一特定百分比物种引起不利影响的浓度在地表水中出现的概率。将鄱阳湖地表水中5种NEOs的浓度与基于不同测试终点的水生生物急性毒性数据分别进行对数整体分布检验,以毒性数据的累积函数和污染物暴露浓度的反累计函数作图,即得到NEOs的联合概率分布曲线。
2 结果与讨论 2.1 环鄱阳湖河流及湖体中新烟碱类杀虫剂的浓度及组成环鄱阳湖河流及湖体中9种NEOs检出浓度和检出率如表 4所示。9种NEOs在鄱阳湖水体中均有不同程度检出,总浓度为8.8~88.9 ng/L。这与前期报道的鄱阳湖中旱季总新烟碱类杀虫剂的检出浓度一致(ND~27.8 ng/L)[45],较雨季检出浓度高,其可能原因是雨季由于稀释效应或NEOs在农业活动中使用量的减少导致NEOs的浓度较低。本研究鄱阳湖流域中NEOs的浓度远低于长江(1863 ng/L)、珠江(1456 ng/L)和黄河(128 ng/L)水环境中总新烟碱类杀虫剂的浓度[46],可能是由于长江、珠江和黄河流域沿岸覆盖了较大的农业区域,流域沿岸农业活动中相关农药的使用情况直接影响了NEOs的赋存浓度[45]。鄱阳湖流域检出总浓度稍高于江西省地表水中总新烟碱类杀虫剂浓度(20 ng/L),而与其他省份相比[47],远低于海南省(350 ng/L),其次是上海市(150 ng/L)和广东省(110 ng/L),与四川省(80 ng/L)、湖北省(80 ng/L)、江苏省(80 ng/L)、河北省(70 ng/L)、山东省(70 ng/L)和福建省(60 ng/L)相差不大,稍高于浙江省(40 ng/L)、重庆市(30 ng/L)和辽宁省(20 ng/L)。
| 表 4 新烟碱类杀虫剂的检测限(LOD)、定量限(LOQ)、检出率以及各采样点浓度 Tab. 4 The detection limit (LOD), limit of quantification (LOQ), detection rate and concentration of neonicotinoid pesticides of the 35 monitoring sites |
在35个采样点中DIN、THI、IMI及THIA的检出率均为100 %,其中IMI有最高检出浓度,范围为2.1~42.7 ng/L。IMI是目前农业生产中使用最为广泛的杀虫剂,属于高温农药,其杀虫效果和温度呈正相关,且适用于绝大多数种植果树。中国农药信息网显示,有效成分为IMI的农药可使用于61种农作物,有效成分为THIA、ACE和CLO的农药可分别使用于49、31和25种农作物[48]。与国内外河流中NEOs浓度相比,ACE(比利时,贝宁水库:7700 ng/L)[20]、CLO(威斯康星州中部:1330 ng/L)[49]、THIA(中部农业区溪流:2828 ng/L)[50]、IMI(安大略省河流:10400 ng/L)[51]、THI(悉尼市河流:1370 ng/L)[52]均在国外河流中有较高浓度检出,而DIN(1730 ng/L)[23]和NIT(1250 ng/L)[23]在长江流域中有较高浓度检出。NIT和DIN属于第三代NEOs,主要作为在IMI产生抗性以后的替代杀虫剂,可以在水稻、小麦、蔬菜、果树、茶叶、棉花、烟草等多种作物上的使用,相比第一、二代杀虫剂,杀虫谱更广,使用更方便,能够克服一二代杀虫剂带来的抗性风险[39]。联合国粮农组织(FAO)发布的最新报告显示,亚洲约占世界水稻总产的86 %,其中水稻产量最多的国家是中国和印度,分别占全球水稻总产的28.5 % 和21.7 % [53]。而我国水稻信息网显示,我国水稻种植主要产区分布在东北地区、长江流域、珠江流域。因此DIN和NIT在长江流域有最高检出[48]。
2.2 环鄱阳湖河流及湖体中新烟碱农药的分布特征鄱阳湖地区作为我国南方地区水稻种植优势区,水稻种植面积约占江西省粮食作物播种面积的86 %,占农作物总耕种面积的50 % 以上[54]。IMI主要用于防治水稻害虫攻击,在鄱阳湖流域各采样点位均有检出,平均浓度(19.4 ng/L)在9种NEOs中最高,且对各采样点总NEOs浓度的贡献在50 % 以上(图 2)。从整个湖区来看,鄱阳湖湖区单、双季稻混合种植,南北水稻熟制差异显著,南部以双季稻种植为主,北部以单季稻种植为主,这也与本次采样检测结果相一致,即南部主要双季稻产区信江流域、抚河流域、余干县湖汊等的IMI平均浓度(22.22、25.56和26.28 ng/L)明显高于上游北部湖区IMI浓度(S1~S8平均浓度20.92 ng/L)。抚河流域是鄱阳湖周围主要河流中IMI平均浓度(25.56 ng/L)最高的区域,主要是因为抚河流域以单、双季稻混合种植,流域内双季稻面积大于单季稻,流域内熟制差异较小,流域内IMI均值(S20~S22)约为以单季稻种植为主的饶河流域(S29,IMI为11.75 ng/L)的2倍;赣江流域河口三角洲双季稻种植密集,这可能是位于赣江南支近河口处(S16)IMI浓度(27.86 ng/L)显著高于流域IMI平均浓度(20.12 ng/L)的主要原因。

|
图 2 环鄱阳湖河流及湖体中新烟碱类杀虫剂的组成特征 Fig.2 Composition characteristics of neonicotinoid pesticides in rivers and lakes around Lake Poyang |
除IMI类农药,第一代NEOs的NIT,第二代NEOs的IMID、CLO以及第三代的DIN等也多用于防治水稻害虫。在鄱阳湖流域,DIN和NIT的检出率较高,分别为100 % 和97.1 %,但其检出的平均浓度(0.28和2.16 ng/L)远低于IMI,对鄱阳湖流域NEOs总平均浓度的贡献率仅占1.08 % 和6.85 %。NIT和DIN均是在IMI产生抗性后用于替代IMI的一种新型新烟碱类杀虫剂,尽管近几年有较多的使用,但其用量仍然普遍低于IMI。另外两种用于水稻害虫防治的NEOs农药IMID和CLO对总NEOs的浓度贡献率分别为0.85 % 和4.98 %,其中IMID的平均浓度为0.17 ng/L,为9种NEOs检出浓度最低,且在鄱阳湖南部的抚河、池溪水湖汊以及余干县湖汊均未检出,这可能与该农药在鄱阳湖流域的施用量较小有关。THIA作为一类广谱性NEOs,常用于防治玉米、棉花、水稻等的害虫[40],THIA在池溪水湖汊点位的平均检出浓度达11.96 ng/L,池溪水位于鄱阳湖南部的进贤县,是江西省玉米种植大县,玉米种植面积近40 km2,这可能是导致池溪水THIA浓度是流域THIA平均浓度(6.35 ng/L)近2倍的主要原因。鄱阳湖地区也是我国长江流域重要的产棉区域[55],THI作为常用于防治棉花害虫的一类NEOs在本次35个采样点中均有检出,且平均浓度(3.67 ng/L)仅次于IMI(19.48 ng/L)和THIA(6.35 ng/L),对NEOs总平均浓度的贡献率为17.73 %。鄱阳湖的北部是棉花生长种植的适宜区,主要包括湖口、星子、都昌、九江、永修、德安等大部分地区,棉花种植密度高于鄱阳湖中部及南部,这也是上游北部湖区THI平均浓度(S1~S8,5.33 ng/L)显著高于流域THI平均浓度3.67 ng/L的主要原因。从总体上看,鄱阳湖流域由于种植结构复杂多样,田块分布较为破碎[56],不同种类NEOs检出浓度的变化与采样点周边农业区的分布及种植作物的种类息息相关。
2.3 新烟碱农药的来源及相关性分析鄱阳湖作为汇入长江的湖泊,流域内新烟碱类农药通过地表径流汇入长江干流中,最终进入临近海域(东海)。研究表明长江中NEOs的输入来源主要由3部分组成,包括上游输入、支流和湖泊输入和非点源排放输入,其中非点源排放的输入占比最高,达59 % ~98 % [45]。鄱阳湖作为汇入长江的湖泊,是我国南方水稻种植主产区和商品粮基地,因此来自农业活动非点源排放是鄱阳湖流域NEOs的主要来源,约占NEOs总量的60 % [57]。由NEOs在鄱阳湖流域的分布特征可知,不同的新烟碱类农药使用量与作物种类及种植区域相关。对鄱阳湖不同监测断面表层水中检出的9种NEOs单体浓度进行相关性分析,结果表明,NIT与IMI浓度呈显著负相关,相关系数为-0.33(P < 0.05)(表 5),这可能是因为NIT和IMI目前均为鄱阳湖流域水稻种植中使用的农药,而NIT是第一代杀虫剂IMI的替代物,因此不存在同时施用的情况,而呈现负相关关系,即NIT的浓度越高则IMI的浓度相对降低。IMI与THI呈现正相关,相关系数0.45(P < 0.05),IMI主要用于大田食用作物(小麦、水稻、高粱、玉米和棉花等)害虫的防治,而THI主要作为昆虫类杀虫剂,因此在进行农业种植时,IMI和THI一般会伴随性同时施用。THI与CLO呈现正相关,相关系数为0.57(P < 0.05),两者均用于蔬菜、果蔬的害虫防治,其中THI对果树常见的潜叶蛾、苹果蠹蛾等害虫具有良好防治效果,但对蔬菜常见的鳞翅目、双翅目等害虫效果不佳,而CLO对半翅目、鳞翅目、双翅目、蓟马木害虫均有较好的防效[4, 39],二者常搭配混合施用于蔬菜、果树,因此呈现正相关性。
| 表 5 鄱阳湖中新烟碱类杀虫剂的相关性 Tab. 5 Relevance of neonicotinoid insecticides in Lake Poyang |
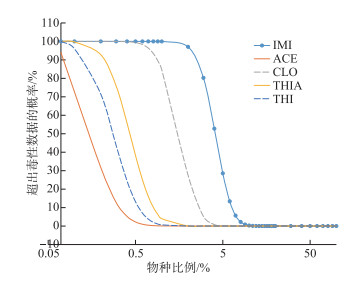
已有研究证明了河流中新烟碱类化合物污染会对水生生物(尤其是水生动物)构成生态风险,并且会对水生生态系统的多样性和功能造成不利影响[23, 58-59]。在SSD Generator中采用Log-Normal对收集到的毒性数据进行曲线拟合,得到5种NEOs(IMI、ACE、THI、CLO和THIA)的急性曲线(其余4种NEOs由于缺少足够数量的毒性数据,未能根据SSD曲线进行推导PNEC值)。经Anderson-Darling检验,不同物种毒性数据符合对数正态分布(P>0.05)。考虑到毒理数据存在一定不确定性,PNEC值由HC5除以不确定系数(AF= 5)得到。基于SSD曲线提出保护水生生物安全的毒性数据推导出5种NEOs的HC5和PNEC,当作此类化合物对水生生物的生态阈值,如表 6所示。基于SSD法评价的各新烟碱类杀虫剂的生态风险大小顺序为IMI>CLO> THI > THIA >ACE,杀虫剂IMI存在较高的急性毒性风险。为了说明NEOs对物种的毒性效应,假设所有的NEOs具有相同的作用机制和相近的毒性效应,将每种NEOs的所有毒性数据,基于分子量加权并归一化为IMI等效毒性,并绘制NEOs(归一化为IMI)的急性SSD曲线(图 3)[23, 45-46]。由图 3可知水生生物暴露于新烟碱类杀虫剂污染的急性毒性阈值(HC5)为244.69 ng/L,相应的PNEC为48.94 ng/L。通过分析NEOs对水生生物的毒性效应发现,一些物种暴露于NEOs表现出较为敏感的急性毒性。物种Epeorus longimanus(节肢动物门蜉蝣的一种)对NEOs最敏感,水体中NEOs农药达到650 ng/L即会对该物种产生急性毒性;物种黑斑侧褶蛙(Pelophylax nigromaculatus)在NEOs浓度达到129 mg/L时才产生急性毒性。SSD曲线中,左下方的物种主要是昆虫,由此可知昆虫类对NEOs最敏感,而右上方物种以鱼类居多。这也说明新烟碱类农药的施用应在进行风险效益评估的基础上科学确定用量,以最大程度减少对生态环境的不利影响。
| 表 6 5种新烟碱类杀虫剂的HC5和PNEC值 Tab. 6 HC5 and PNEC values of 5 neonicotinoid insecticides |

|
图 3 新烟碱类杀虫剂的急性物种敏感度分布曲线 Fig.3 Acute species sensitivity distributions of neonicotinoids pesticides |
由于概率风险评价方法能够更好地描述地表水中NEOs浓度超出毒性效应阈值的可能性和不利影响的风险大小,在本研究中使用JPCs方法绘制了5种NEOs的联合概率分布曲线(图 4)。根据NEOs在鄱阳湖中的暴露浓度和水生生物急性毒性数据进行概率风险评估,得出每种NEOs的联合概率分布曲线。由于NIT、IMID、FLO和DIN的毒性数据缺失,本研究中仅做了IMI、ACE、THI、CLO和THIA 5种NEOs的JPCs。5种NEOs的急性JPCs曲线均靠近y坐标轴,说明鄱阳湖流域在当前NEOs浓度水平下发生不利影响的可能性较小。5种NEOs的相对风险为IMI> CLO > THIA > THI > ACE,这与使用SSD曲线得到的结果相一致。对水生态系统产生不利影响最大的IMI,其对5 % 和10 % 物种的不利影响概率分别为28.55 % 和0.3 %;其余4种NEOs对5 % 的物种产生不利影响的概率均小于0.2 %,其中ACE产生的不利影响最低,对1 % 的物种产生不利影响的概率仅为0.05 %。上述结果表明鄱阳湖NEOs对水生生物的急性生态风险较小,但随着农药长期持续的施用,尤其是IMI类杀虫剂,由此带来的慢性生态风险值得进一步关注。
|
图 4 鄱阳湖流域5种新烟碱类杀虫剂单一急性联合概率分布曲线 Fig.4 Single acute joint probability curves of five neonicotinoid pesticides in Lake Poyang |
鄱阳湖流域NEOs生态风险评估的结论只能反映现有数据条件下的结果,由于目前数据信息资料有限,该方法存在一些不确定因素。首先,毒性数据较少,尤其缺乏慢性毒性效应的数据,因此,可认为基于急性毒性数据的评价是一种初步定量评估,若要更加合理精确定量风险评估,需进一步搜集NEOs的慢性毒性数据。考虑到物种的地理分布和生物多样性,所收集的参数尚不能完全真实地代表鄱阳湖流域生物物种的参数,也导致风险评估结果具有一定的不确定性;其次,鄱阳湖水体中NEOs暴露评估也具有一定不确定性,影响了生态风险评价结果。已有研究表明,长江流域的NEOs随着季节与径流量的变化发生变化,NEOs暴露的最高浓度多在枯水期被观测到[45],继续深入在不同季节对鄱阳湖流域NEOs开展污水水平调查,才能进一步准确评价NEOs对鄱阳湖水生生物的影响;最后,生态风险评价过程中,构建敏感度分布曲线的方法较多,目前大部分研究采用线性对数正态分布法,另一部分采用基于对数逻辑斯蒂的非参数方法。由于数据的随机性以及评价过程和模型选择所造成的的误差,导致风险评价结果具有一定不确定性。
3 结论1) 鄱阳湖流域水体中普遍存在NEOs污染,9种NEOs均有一定程度检出,检出率为100 %。其中IMI检出浓度最高,浓度范围为2.1~42.7 ng/L(中值,19.4 ng/L)。∑NEOs的检出浓度范围为8.8~88.9 ng/L,与国内外其它淡水湖库和地表水相比,处于中等污染水平。
2) 鄱阳湖流域不同采样点NEOs浓度与不同地区的种植结构息息相关。对总NEOs浓度贡献最大(50 % 以上)的IMI在鄱阳湖南部湖区平均浓度高于北部湖区,以南部湖区双季稻种植面积较大的抚河流域IMI平均浓度最高。THIA和THI等作为防治玉米、棉花害虫的常用杀虫剂,在这两种作物种植面积较大的进贤县和鄱阳湖北部区域有较高检出。鄱阳湖流域的NEOs主要来自于农业活动的非点源排放。
3) 鄱阳湖流域生态风险评估结果显示,水生生物中昆虫对NEOs最为敏感,5种NEOs的相对风险由大到小分别为IMI> CLO > THIA > THI > ACE。鄱阳湖NEOs对水生生物急性风险较小,但长期施用带来的慢性风险未来仍需关注。
| [1] |
Jeschke P, Nauen R. Neonicotinoids-from zero to hero in insecticide chemistry. Pest Management Science, 2008, 64(11): 1084-1098. DOI:10.1002/ps.1631 |
| [2] |
Bass C, Denholm I, Williamson MS et al. The global status of insect resistance to neonicotinoid insecticides. Pesticide Biochemistry and Physiology, 2015, 121: 78-87. DOI:10.1016/j.pestbp.2015.04.004 |
| [3] |
Shao XS, Liu ZW, Xu XY et al. Overall status of neonicotinoid insecticides in China: Production, application and innovation. Journal of Pesticide Science, 2013, 38(1): 1-9. DOI:10.1584/jpestics.d12-037 |
| [4] |
Yang JC, Li M, Chai BS et al. Recent research advances in new neonicotinoids insecticides. Agrochemicals, 2007, 46(7): 433-438. [杨吉春, 李淼, 柴宝山等. 新烟碱类杀虫剂最新研究进展. 农药, 2007, 46(7): 433-438. DOI:10.3969/j.issn.1006-0413.2007.07.001] |
| [5] |
Hopwood J, Vaugham M, Shepherd M et al. Are Neonicotinoids killing bees? A review of research into the effects of neonicotinoid insecticides on bees, with recommendations for action. The Xerces Society for Invertebrate Conservation, 2012, 44. |
| [6] |
Morrissey C, Mineau P, Devries J et al. Neonicotinoid contamination of global surface waters and associated risk to aquatic invertebrates: A review. Environment International, 2015, 74: 291-303. DOI:10.1016/j.envint.2014.10.024 |
| [7] |
Zhang Q, Li Z, Chang CH et al. Potential human exposures to neonicotinoid insecticides: A review. Environmental Pollution: Barking, Essex: 1987, 2018, 236: 71-81. DOI:10.1016/j.envpol.2017.12.101 |
| [8] |
Armbrust KL, Peeler HB. Effects of formulation on the run-off of imidacloprid from turf. Pest Management Science, 2002, 58(7): 702-706. DOI:10.1002/ps.518 |
| [9] |
Stehle S, Bub S, Schulz R. Compilation and analysis of global surface water concentrations for individual insecticide compounds. Science of the Total Environment, 2018, 639: 516-525. DOI:10.1016/j.scitotenv.2018.05.158 |
| [10] |
Hernández AF, Casado I, Pena G et al. Low level of exposure to pesticides leads to lung dysfunction in occupationally exposed subjects. Inhalation Toxicology, 2008, 20(9): 839-849. DOI:10.1080/08958370801905524 |
| [11] |
Koureas M, Tsezou A, Tsakalof A et al. Increased levels of oxidative DNA damage in pesticide sprayers in Thessaly Region (Greece). Implications of pesticide exposure. Science of the Total Environment, 2014, 496: 358-364. DOI:10.1016/j.scitotenv.2014.07.062 |
| [12] |
Wan Y, Tran TM, Nguyen VT et al. Neonicotinoids, fipronil, chlorpyrifos, carbendazim, chlorotriazines, chlorophenoxy herbicides, bentazon, and selected pesticide transformation products in surface water and drinking water from northern Vietnam. Science of the Total Environment, 2021, 750: 141507. DOI:10.1016/j.scitotenv.2020.141507 |
| [13] |
Moschet C, Wittmer I, Simovic J et al. How a complete pesticide screening changes the assessment of surface water quality. Environmental Science & Technology, 2014, 48(10): 5423-5432. DOI:10.1021/es500371t |
| [14] |
Yamamoto A, Terao T, Hisatomi H et al. Evaluation of river pollution of neonicotinoids in Osaka City (Japan) by LC/MS with dopant-assisted photoionisation. Journal of Environmental Monitoring: JEM, 2012, 14(8): 2189-2194. DOI:10.1039/c2em30296a |
| [15] |
Hladik ML, Corsi SR, Kolpin DW et al. Year-round presence of neonicotinoid insecticides in tributaries to the great lakes, USA. Environmental Pollution: Barking, Essex: 1987, 2018, 235: 1022-1029. DOI:10.1016/j.envpol.2018.01.013 |
| [16] |
Main AR, Michel NL, Cavallaro MC et al. Snowmelt transport of neonicotinoid insecticides to Canadian prairie wetlands. Agriculture, Ecosystems & Environment, 2016, 215: 76-84. DOI:10.1016/j.agee.2015.09.011 |
| [17] |
Wang B, Yi D, Jin L et al. Organochlorine pesticide levels in maternal serum and risk of neural tube defects in offspring in Shanxi Province, China: A case-control study. Science of the Total Environment, 2014, 490: 1037-1043. DOI:10.1016/j.scitotenv.2014.05.075 |
| [18] |
Fu Z, Han F, Huang K et al. Impact of imidacloprid exposure on the biochemical responses, transcriptome, gut microbiota and growth performance of the Pacific white shrimp Litopenaeus vannamei. Journal of Hazardous Materials, 2022, 424: 127513. DOI:10.1016/j.jhazmat.2021.127513 |
| [19] |
Zhang C, Tian D, Yi XH et al. Occurrence, distribution and seasonal variation of five neonicotinoid insecticides in surface water and sediment of the Pearl Rivers, South China. Chemosphere, 2019, 217: 437-446. DOI:10.1016/j.chemosphere.2018.11.024 |
| [20] |
Xiong JJ, Wang Z, Ma X et al. Occurrence and risk of neonicotinoid insecticides in surface water in a rapidly developing region: Application of polar organic chemical integrative samplers. Science of the Total Environment, 2019, 648: 1305-1312. DOI:10.1016/j.scitotenv.2018.08.256 |
| [21] |
Chen M, Yi QT, Hong JJ et al. Simultaneous determination of 32 antibiotics and 12 pesticides in sediment using ultrasonic-assisted extraction and high performance liquid chromatography-tandem mass spectrometry. Analytical Methods, 2015, 7(5): 1896-1905. DOI:10.1039/C4AY02895C |
| [22] |
Mahai G, Wan YJ, Xia W et al. A nationwide study of occurrence and exposure assessment of neonicotinoid insecticides and their metabolites in drinking water of China. Water Research, 2021, 189: 116630. DOI:10.1016/j.watres.2020.116630 |
| [23] |
Chen YC, Zang L, Shen GF et al. Resolution of the ongoing challenge of estimating nonpoint source neonicotinoid pollution in the Yangtze River Basin using a modified mass balance approach. Environmental Science & Technology, 2019, 53(5): 2539-2548. DOI:10.1021/acs.est.8b06096 |
| [24] |
Van Dijk TC, Van Staalduinen MA, Van der Sluijs JP. Macro-invertebrate decline in surface water polluted with imidacloprid: A rebuttal and some new analyses. PLoS One, 2014, 9(2): e89837. DOI:10.1371/journal.pone.0089837 |
| [25] |
Bal R, Naziroǧlu M, Türk G et al. Insecticide imidacloprid induces morphological and DNA damage through oxidative toxicity on the reproductive organs of developing male rats. Cell Biochemistry and Function, 2012, 30(6): 492-499. DOI:10.1002/cbf.2826 |
| [26] |
Sekeroglu V, Sekeroglu ZA, Demirhan E. Effects of commercial formulations of deltamethrin and/or thiacloprid on thyroid hormone levels in rat serum. Toxicology and Industrial Health, 2014, 30(1): 40-46. DOI:10.1177/0748233712448114 |
| [27] |
Brunet JL, Maresca M, Fantini J et al. Human intestinal absorption of imidacloprid with Caco-2 cells as enterocyte model. Toxicology and Applied Pharmacology, 2004, 194(1): 1-9. DOI:10.1016/j.taap.2003.08.018 |
| [28] |
Brunet JL, Maresca M, Fantini J et al. Intestinal absorption of the acetamiprid neonicotinoid by Caco-2 cells: Transepithelial transport, cellular uptake and efflux. Journal of Environmental Science and Health, Part B, 2008, 43(3): 261-270. DOI:10.1080/03601230701771446 |
| [29] |
Ford KA, Casida JE. Chloropyridinyl neonicotinoid insecticides: Diverse molecular substituents contribute to facile metabolism in mice. Chemical Research in Toxicology, 2006, 19(7): 944-951. DOI:10.1021/tx0600696 |
| [30] |
Wang ML, Xiong X, Liu JJ et al. Carbon and nitrogen stable isotopes evidence for the environmental impact of the cage fish farm in Poyang Lake, China. Bulletin of Environmental Contamination and Toxicology, 2020, 105(6): 860-867. DOI:10.1007/s00128-020-03042-1 |
| [31] |
Zhao JK, Li LX, Li JF et al. The analysis on the response of the water level change trend to human activities in Poyang Lake. Journal of Jiangxi Normal University: Natural Science Edition, 2019, 43(5): 532-544. [赵军凯, 李立现, 李九发等. 鄱阳湖水位变化趋势性对人类活动响应分析. 江西师范大学学报: 自然科学版, 2019, 43(5): 532-544.] |
| [32] |
Ye JM, Yu HP, Jian MF et al. The ecological risk assessment of the heavy metals pollution on the typical wetland and farmland of Poyang Lake. Journal of Jiangxi Normal University: Natural Science Edition, 2016, 40(4): 429-436. [叶嘉敏, 余厚平, 简敏菲等. 鄱阳湖流域农田重金属污染的生态风险评估. 江西师范大学学报: 自然科学版, 2016, 40(4): 429-436.] |
| [33] |
Xu SH, Wu D. Analysis on the "industry-economy-resources" simulated system of Poyang Lake eco-industrial clusters based on systematic dynamics. Resources Science, 2016, 38(5): 871-887. [徐升华, 吴丹. 基于系统动力学的鄱阳湖生态产业集群"产业-经济-资源"系统模拟分析. 资源科学, 2016, 38(5): 871-887.] |
| [34] |
You QH, Liu LL, Fang N et al. Assessing ecological health of Poyang Lake wetland, using benthic macroinvertebrate-based index of biotic integrity (B-IBI). Acta Ecologica Sinica, 2019, 39(18): 6631-6641. [游清徽, 刘玲玲, 方娜等. 基于大型底栖无脊椎动物完整性指数的鄱阳湖湿地生态健康评价. 生态学报, 2019, 39(18): 6631-6641. DOI:10.5846/stxb201806041248] |
| [35] |
Hallmann CA, Foppen RPB, van Turnhout CAM et al. Declines in insectivorous birds are associated with high neonicotinoid concentrations. Nature, 2014, 511(7509): 341-343. DOI:10.1038/nature13531 |
| [36] |
DiPrisco G, Cavaliere V, Annoscia D et al. Neonicotinoid clothianidin adversely affects insect immunity and promotes replication of a viral pathogen in honey bees. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(46): 18466-18471. DOI:10.1073/pnas.1314923110 |
| [37] |
Sánchez-Bayo F. The trouble with neonicotinoids. Science, 2014, 346(6211): 806-807. DOI:10.1126/science.1259159 |
| [38] |
Li TT, Zheng SS, Wang J et al. A review on occurrence and transformation behaviors of neonicotinoid pesticides. Asian Journal of Ecotoxicology, 2018, 13(4): 9-21. [李田田, 郑珊珊, 王晶等. 新烟碱类农药的污染现状及转化行为研究进展. 生态毒理学报, 2018, 13(4): 9-21. DOI:10.7524/AJE.1673-5897.20180615003] |
| [39] |
Mo JC, Cheng JA. Adavance on the study of pest resistance to chloronicotinyl insecticides. Journal of Plant Protection, 2003, 30(1): 91-96. [莫建初, 程家安. 新烟碱类杀虫剂抗药性研究进展. 植物保护学报, 2003, 30(1): 91-96. DOI:10.3321/j.issn:0577-7518.2003.01.017] |
| [40] |
Mao LG, Xu DM, Yuan SK et al. Analysis on the status of neonicotinoids insecticides registered in China based on the recommended dosage. Plant Protection, 2020, 46(5): 200-210. [毛连纲, 徐冬梅, 袁善奎等. 基于推荐用量分析我国新烟碱类杀虫剂的登记现状. 植物保护, 2020, 46(5): 200-210. DOI:10.16688/j.zwbh.2019297] |
| [41] |
Liu ZQ, Yuan LF, Liao XJ et al. Research progress of neonicotinoid insecticide dinotefuran. Modern Agrochemicals, 2021, 20(1): 7-12. [刘子琪, 袁龙飞, 廖先骏等. 新烟碱类杀虫剂呋虫胺的研究进展. 现代农药, 2021, 20(1): 7-12. DOI:10.3969/j.issn.1671-5284.2021.01.002] |
| [42] |
van Vlaardingen PLA, Traas TP, Wintersen AM et al. ETX 2.0. A program to calculate hazardous concentrations and fraction affected, based on mornally distributed toxicity Data. RIVM: Netherlands, 2004, 1-45. |
| [43] |
Jin XW, Wang YY, Jin W et al. Ecological risk of nonylphenol in China surface waters based on reproductive fitness. Environmental Science & Technology, 2014, 48(2): 1256-1262. DOI:10.1021/es403781z |
| [44] |
Solomon K, Giesy J, Jones P. Probabilistic risk assessment of agrochemicals in the environment. Crop Protection, 2000, 19(8/9/10): 649-655. DOI:10.1016/S0261-2194(00)00086-7 |
| [45] |
臧路. 我国主要流域新烟碱类农药时空分布、来源及生态风险[学位论文]. 杭州: 浙江工业大学, 2019.
|
| [46] |
Chen YC, Zang L, Liu MD et al. Ecological risk assessment of the increasing use of the neonicotinoid insecticides along the east coast of China. Environment International, 2019, 127: 550-557. DOI:10.1016/j.envint.2019.04.010 |
| [47] |
Fan DD, Liu HL, Yang LY. Neonicotinoid insecticides threaten surface waters at the national scale in China. Environmental Science, 2021, 11: 1-21. [范丹丹, 刘红玲, 杨柳燕. 我国地表水新烟碱类杀虫剂对水生生物安全的威胁. 环境科学, 2021, 11: 1-21. DOI:10.13227/j.hjkx.202109064] |
| [48] |
中华人民共和国农业农村部农药检定所. 中国农药信息网[EB/OL]. http://www.chinapesticide.org.cn/yxcftozw.jhtml, 2021-08-19.
|
| [49] |
Anderson JC, Dubetz C, Palace VP. Neonicotinoids in the Canadian aquatic environment: A literature review on current use products with a focus on fate, exposure, and biological effects. Science of the Total Environment, 2015, 505: 409-422. DOI:10.1016/j.scitotenv.2014.09.090 |
| [50] |
Casida JE, Durkin KA. Neuroactive insecticides: Targets, selectivity, resistance, and secondary effects. Annual Review of Entomology, 2013, 58: 99-117. DOI:10.1146/annurev-ento-120811-153645 |
| [51] |
Alexander AC, Culp JM, Liber K et al. Effects of insecticide exposure on feeding inhibition in mayflies and oligochaetes. Environmental Toxicology and Chemistry, 2007, 26(8): 1726-1732. DOI:10.1897/07-015r.1 |
| [52] |
Osaka A, Ueyama J, Kondo T et al. Exposure characterization of three major insecticide lines in urine of young children in Japan—Neonicotinoids, organophosphates, and pyrethroids. Environmental Research, 2016, 147: 89-96. DOI:10.1016/j.envres.2016.01.028 |
| [53] |
Hu XY, Wang B, Zhang AY. Spatial and temporal characteristics of daytime/nighttime temperature and precipitation during crop growing season in Poyang Lake basin in recent 60 years and their impacts on agricultural production. Anhui Agriculture Science Bulletin, 2021, 27(6): 152-160. [胡洵瑀, 王斌, 张爱英. 近60年鄱阳湖流域作物生长季昼夜温度和降水时空变化特征及其对农业生产的影响. 安徽农学通报, 2021, 27(6): 152-160.] |
| [54] |
Wang JY, Xin LJ. Spatial-temporal variations of cultivated land and grain production in China based on GlobeLand30. Transactions of the Chinese Society of Agricultural Engineering, 2017, 33(22): 1-8. [王佳月, 辛良杰. 基于GlobeLand30数据的中国耕地与粮食生产的时空变化分析. 农业工程学报, 2017, 33(22): 1-8.] |
| [55] |
Lin C, Gu XQ, Zhu BQ. Analysis of climate division for cotton production in Poyang Lake area. Meteorology and Disaster Reduction Research, 2010, 33(1): 58-62. [林春, 辜晓青, 祝必琴. 鄱阳湖区棉花种植气候区划. 气象与减灾研究, 2010, 33(1): 58-62.] |
| [56] |
Li P, Feng ZM, Jiang LG et al. Changes in rice cropping systems in the Poyang Lake Region, China during 2004-2010. Journal of Geographical Sciences, 2012, 22(4): 653-668. DOI:10.1007/s11442-012-0954-x |
| [57] |
吕正标. 新烟碱类杀虫剂在水环境中的残留特征及潜在风险[学位论文]. 杭州: 浙江工业大学, 2020.
|
| [58] |
Beketov MA, Liess M. Potential of 11 pesticides to initiate downstream drift of stream macroinvertebrates. Archives of Environmental Contamination and Toxicology, 2008, 55(2): 247-253. DOI:10.1007/s00244-007-9104-3 |
| [59] |
Roessink I, Merga LB, Zweers HJ et al. The neonicotinoid imidacloprid shows high chronic toxicity to mayfly nymphs. Environmental Toxicology and Chemistry, 2013, 32(5): 1096-1100. DOI:10.1002/etc.2201 |
 2023, Vol. 35
2023, Vol. 35 

