(2: 中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室, 南京 210008)
(2: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P.R.China)
湖泊作为地表相对封闭可蓄水的天然洼池,是陆地水圈的重要组成部分,为区域生态系统提供调节气候、补给水源和维持生物多样性等功能[1]。自改革开放以来,人类活动和农业污染导致的湖泊富营养化成为我国较为突出的水环境问题之一[2]。洱海是云南地区典型富营养化湖泊,北部湖区主要受到农业污染,南部湖区则主要受到生活污水的污染[3],湖泊整体营养化水平从1950s的贫营养过渡到1990s的中营养级别,近年来转变为富营养化初期[4-5]。湖泊生态系统的结构也随之发生了根本性的变化,由“草型”向“藻型”稳态转变,藻类优势种属从隐藻门和硅藻门演变为指示中-富营养化水平的蓝藻门[6-8]。分析洱海藻类的空间分布特征及其对营养盐输入和气候水文条件的响应,有助于理解云南高原湖区富营养化的机制和生态效应。
硅藻作为广泛存在于湖泊中的重要初级生产者之一,在沉积物中易于保存,且其物种组合对湖泊的许多环境指标响应敏感,是研究湖泊生态变化的重要指示器[9-13]。洱海水体中硅藻优势种包括Aulacoseira ambigua、Aulacoseira granulata、Cyclostephanos dubius和Stephanodiscus hantzschii,以耐营养种为主[14]。目前,硅藻已经成功应用于洱海生态系统演化的研究之中。例如,Wang等[15]指出硅藻群落发生变化的时间点要早于湖泊显著富营养化约10-30年,可以作为洱海富营养化的早期预警信号。同时,也有季节尺度的研究表明,影响洱海现代硅藻群落变化的最主要因子是气象条件,其次为营养盐输入[14]。综上所述,硅藻在研究湖泊生态系统变化方面具有一定的潜力和应用价值,但仍需对硅藻在洱海不同湖区的生物地球化学意义进行进一步的限定。
随着有机地球化学理论和技术的发展,生物标志物被广泛应用于指示湖泊沉积物中有机质的生物来源。其中,C25高支链类异戊烯烃化合物(C25 highly branched isoprenoids,C25HBIs)是以2, 6, 10, 14-四甲基-7-(3-甲基戊基)-十五烷为骨架的一系列烃类化合物。其最早被识别于墨西哥湾的近代沉积物中[16],随后在南极洲和北大洋硅藻发育区的海水中、含硅藻的底栖微生物群落以及实验培养的硅藻中都有检出。C25HBIs往往具有非常重的碳同位素值,通常大于-20 ‰,与硅藻的碳同位素信号相近,因此C25HBIs被普遍认为是硅藻的专属生物标志化合物。目前,海洋环境中富集C25HBIs的硅藻主要为Haslea、Rhizosolenia、Navicula和Pleurosigma这四个属的底栖藻和浮游藻[17],而其对湖泊环境的指示尚未明晰。C25HBIs可含有0~5个不饱和键,同时不饱和C25HBIs存在多种同分异构体[18],不同化合物组合潜在指示了不同硅藻群落组合及其对不同生态因素(如盐度、辐照度和温度等)的响应。C25HBIs因具有指示环境特征的潜质[19]而受到国内学者的广泛关注。其中,国内学者利用北极地区冰藻产生的C25HBIs(包括IP25和HBI-Ⅱ),结合浮游植物生物标志物和陆源甾醇,探讨了楚科奇海的海冰覆盖状况和陆源物质特征[20-21]。此外,20世纪90年代,李景贵等[22]在青海湖沉积物中检出C25:2HBI,并指出水体中的硅藻可能是这类化合物的生物来源[22],随后张永东等[17]在柴达木盆地湖相沉积岩中也检出了C25:2HBI。近年来,长江下游湖泊的表层沉积物(包括淀山湖、澄湖、阳澄湖、昆承湖、漕湖、滆湖、固城湖、石臼湖、南漪湖、东巢湖和西巢湖等)中广泛存在C25HBIs[23]。长江下游湖泊C25HBIs存在不同饱和度的多种同分异构体,包括6种C25:2HBI、2种C25:1HBI以及1种C25:3HBI。C25HBIs化合物的浓度表现出显著的异质性,且在寡营养化湖泊的浓度更高[23]。尽管云南地区湖泊资源丰富,湖泊内存在大量硅藻,但至今尚未在这些湖泊中检出过C25HBIs。
基于此,本研究于2018年采集并分析了洱海不同湖区的38个表层沉积物,首次报道了C25:1HBI和C25:2HBI这两种C25HBIs化合物在洱海表层沉积物的检出。随后,结合其他地球化学指标(总氮和总有机碳含量)以及环境因素参数(水深),通过分析C25HBIs含量和不饱和度的空间分布差异,解析C25HBIs在云南地区富营养化湖泊中潜在的生物地球化学意义,为C25HBIs在云南湖泊的应用提供了理论基础和依据。
1 材料与方法 1.1 研究区域概况和样品采集洱海(25°36′~25°55′N,100°00′~100°17′E)位于云南省大理白族自治州境内,是云贵高原第二大淡水湖泊,是大理市和洱源县人民生活、工业用水和灌溉的主要水源地,属国家重点保护水域。洱海南北长42.5 km,东西最大宽度9.0 km,湖泊面积249.8 km2,流域面积2565 km2,属澜沧江流域黑惠江支流的构造断陷湖泊,故呈现出湖心处水深、湖岸处水浅的现象,全湖最大水深21.0 m,平均水深10.5 m。洱海共有117条入湖河流,主要河流23条,东承凤尾阱,南纳波落江,西汇苍山十八溪,北接永安江、罗时江和弥苴河(主要入湖河流,占洱海总汇水面积的54 %),唯有一条出湖河流——西洱河,全长23 km,最终汇入沧澜江。洱海流域属中亚热带高原季风气候,年均气温15℃,年均降水量1057 mm,径流量主要受气候影响,5-10月(雨季)径流总量占年径流量的65 % 以上[6, 24]。
洱海流域涉及大理洱源两市县,流域主要的土地利用形式有林地、灌丛、水域、农田和城镇,近年来随着人口的增长和城市化的发展,城镇和农田用地的比例逐年增加。流域农田多沿河溪分布,北部农田面积215 km2,南部农田面积18 km2,东部农田面积19 km2,西部农田面积103 km2,其中洱海湖西是农业生产生活最集中的区域,该地区自西向东为苍山—缓坡过渡带—洱海,并建设了多条用于农业灌排水的沟渠[25]。以上情况导致大量营养盐输入洱海,从而引发藻类水华。洱海藻华主要发生期为7月至次年1月,冬季(12月至次年1月)藻华频率高于其他时段,与中国东部的富营养化湖泊在水华发生期上有所差异(例如,太湖和巢湖水华主要发生期为5-9月),其原因不仅与水质特征有关,还与气象特征(温度、降水和风速风向等)有关[26]。
本研究根据湖底地形可将洱海分为北部(康廊海舌以北)、中部(挖色湖心为中心,龙龛海舌)和南部(龙龛以南)3个湖区(图 1)。于2018年7月在洱海不同湖区按水深梯度利用抓斗式采泥器采集表层沉积物,包括北部浅水区沉积物6个(S1~S6,水深2.8~12.1 m),中部深水区沉积物24个(S7~S30,水深4.5~20.6 m)和南部浅水区沉积物8个(S31~S38,水深5.8~13.1 m)。采集的表层沉积物迅速装至黑色自封袋内,并用-20℃冰箱低温避光保存。样品带回实验室后去除植物碎屑、碎石和贝壳等,放冷冻干燥机中真空冷干,研磨过筛(100目)备用。
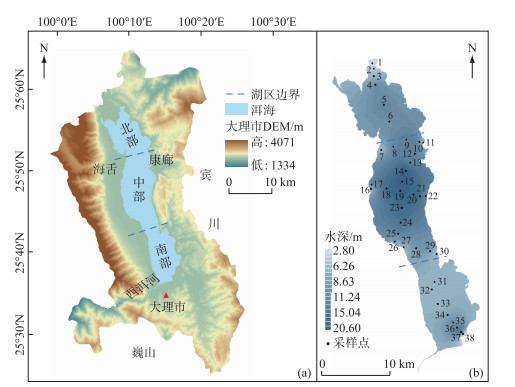
|
图 1 洱海地理信息(a)和表层沉积物采样点位(b) Fig.1 Location and geographic information of Lake Erhai (a) and sampling sites of surface sediments (b) |
首先,取适量研磨过筛后的沉积物样品,通过Euro EA 3000元素分析仪测总氮(TN)含量。随后,另称取约0.3 g的沉积物样品,加入过量4 mol/L的盐酸,置于60℃的水浴加热12 h,以充分除去样品中的碳酸盐矿物。随后,用超纯水多次清洗样品,并用高速离心机离心后除去上清液,反复处理直至溶液的pH值调节至7。处理过的样品放于烘箱低温烘干,并计算沉积物中去除的碳酸盐含量。将经酸处理过的沉积物研磨均匀后,通过元素分析仪测量残余物中的总有机碳(TOC)和总有机氮(TON)含量,换算得到沉积物中的TOC和TON含量。元素分析误差控制在≤0.02 %。
另取2~5 g的沉积物样品,加入二氯甲烷和甲醇的有机溶剂混合液(9 ∶1,V/V)超声震荡抽提后,获得的抽提液用氮气低温吹干。往吹干的抽提液中加入KOH的甲醇溶液(质量分数6 %),超声震荡后静置隔夜完成皂化。随后加入NaCl的水溶液(质量分数5 %),并用正己烷萃取获得中性组分。将中性组分载于80~100目经活化的硅胶柱上,用正己烷和甲醇作为洗脱液分别获得非极性组分和极性组分。非极性组分利用Agilent-7890A气相色谱(GC)-氢火焰离子化检测器(FID)进行定性和定量分析。采用不分流模式和DB-1MS(60 m×320 μm×0.25 μm)色谱柱检测,载气为高纯氮气,流速1 mL/min,进样口和检测器温度分别为290和300℃。检测升温程序为:初始温度60℃,保留2 min,3℃/min升至300℃并恒温保持30 min。随后,进一步采用气相色谱质谱仪分析(Agilent-7890B-5977A,GC-MS)对C25HBIs进行鉴定。仪器同样采用不分流模式和DB-1MS(60 m×320 μm×0.25 μm)色谱柱检测,载气为高纯氦气,流速1 mL/min。色谱端进样口温度290℃,辅助加热器温度为280℃;质谱端离子源为电子轰击源(EI,70 eV),离子源温度230℃,四极杆温度180℃,扫描速率500 amu/s,质谱扫描范围30~650 amu。检测升温程序为:初始温度80℃,保持2 min,3℃/min升至220℃,再2℃/min升至295℃并恒温保持30 min。C25HBIs化合物的鉴定基于前人整理的保留指数和鉴定质谱图的数据库[27-28]。C25HBIs化合物的定量数据通过已知浓度的正构烷烃混标,用外标法计算获得。其中,绝对浓度是指C25HBIs含量(μg)在样品总质量(g)的占比,均一化浓度指示C25HBIs对样品TOC的贡献。
数据生成的相关图件采用ArcGIS 10.2软件进行径向基函数(radial basis function)空间插值。径向基函数空间插值属于地统计学空间插值的精确性插值法,即采样点处的插值结果会与采样点处测量值保持一致; 考虑到空间最值可能不出现在采样点,径向基插值会基于采样点的值模拟最大值和最小值所在位置。
2 结果与讨论 2.1 表层沉积物的基本地球化学特征洱海表层沉积物TOC含量的范围为2.18 %~4.82 % (附表Ⅰ),平均值为3.40 %,高于同处于云贵高原的中营养湖泊的程海(2.76 %),但低于贫营养的泸沽湖(6.61 %)和富营养化程度较高的杞麓湖(9.23 %)[29]。样品中的TOC含量相较于2000年以来洱海沉积物中的TOC含量(在4 % ~12 % 之间)有所下降,但仍高于1990-2000年的沉积物水平(在2 % ~3 % 之间)[30-32],可能与近年来洱海流域的环境治理工程实施控制了营养盐输入,导致湖泊沉积物有机碳下降有关[33]。北部湖区沉积物中TOC含量范围为2.61 % ~3.17 %,均值为2.86 %;中部湖区沉积物中TOC含量范围为2.30 % ~4.82 %,均值为3.62 %;南部湖区沉积物中TOC含量范围为2.18 % ~3.50 %,均值为3.16 % (附表Ⅰ,图 2)。洱海中南部湖区TOC含量高于北部湖区,相较于过去研究报道的TOC高值区有向南发生偏移的趋势[30],此外,前人研究发现2008-2018年的洱海叶绿素浓度表现为湖岸>湖心以及中北部>南部[34],与沉积物TOC含量分布具有相似性[30]。因此,尽管沉积物中的有机质是不同来源有机质的输入和保存综合效应的结果,但洱海表层沉积物的TOC含量主要表征了湖泊内源生产力的输入。
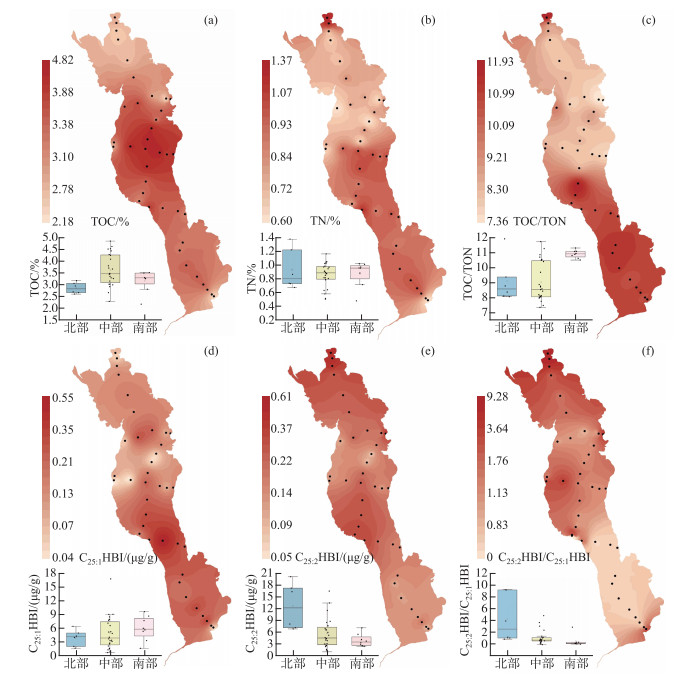
|
图 2 洱海表层沉积物中TOC、TN、TOC/TON和C25HBIs浓度和比值的空间分布和不同湖区对比 Fig.2 Spatial distribution patterns for TOC, TN, TOC/TON, concentration and ratio of C25HBIs from surface sediments of Lake Erhai |
洱海表层沉积物中的TON含量的范围为0.20 % ~0.60 %,平均值为0.37 % (附表Ⅰ)。北部湖区表层沉积物中TON含量范围为0.26 % ~0.38 %,平均值为0.32 %;中部湖区表层沉积物中TON范围为0.28 % ~0.60 %,平均值为0.41 %;南部湖区表层沉积物中TON含量范围为0.20 % ~0.33 %,平均值为0.29 %,整体表现为中部高、北部和南部偏低的特点。湖区TON与TOC含量呈现较强的线性正相关关系(R2=0.76,n=38,P < 0.01,图 3a),表明洱海表层沉积物中的有机质主要以内源为主。TOC/TON值范围为7.36~11.93,通常指示了具有较高蛋白质含量的浮游藻类[35]。刘会基等[30]发现2012年和2014年洱海表层沉积物的TOC/TON值范围为9.0~11.2,1982年以来洱海不同湖区沉积物中TOC/TON值范围为9.2~10.6;Zhang等[36]通过对2010-2011年采集的洱海不同湖区10根沉积岩心进行研究,指出洱海历史时期TOC/TON值范围为8.5~11.4。这些结果均与本研究结果相似,均说明洱海内源有机质的空间差异较小。洱海表层沉积物中TOC/TON值的空间差异表现为中北部低中南部高的特征(图 2),指示中南部湖区沉积物中水生植物的贡献少,而外源输入多。
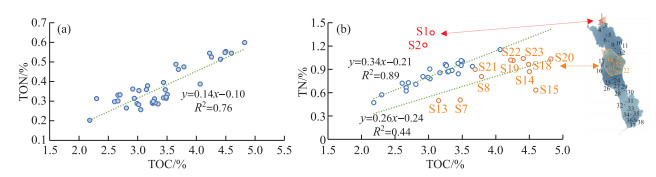
|
图 3 洱海表层沉积物(a) TOC vs. TON,(b) TOC vs. TN相关关系 Fig.3 Plots of (a) TOC vs. TON and (b) TOC vs. TN from surface sediments for Lake Erhai |
洱海表层沉积物样品中,沉积物中TN含量范围为0.20 % ~0.60 %,均值为0.37 % (附表Ⅰ)。Zhang等[36]于2010-2011年在洱海不同湖区采集的10根沉积岩心的TN含量范围为0.47 % ~1.37 %,均值为0.86 %,因此,本研究2018年采集的洱海表层沉积物的TN含量与历史时期相当。洱海表层沉积物TN含量出现两个高值区,分别位于中南部湖区和最北部入湖口(图 2)。前人研究已经指出沉积物中TN含量可以作为湖泊营养盐输入和富营养化的参考指标,沉积物TN含量在2000年前后呈现上升趋势[30],与洱海近代两次藻华事件相吻合(1996年和2003年)。中南部沿湖地区是洱海旅游业的主要发展区域和大理市区所在地,同时是本研究表层沉积物TN高值区,指示了旅游活动和城市生活对该地区产生了污染。此外,北部入湖口两个点位(S1和S2)的TN含量较高,这与该区域大部分地区的土地利用方式相吻合:洱海北部大部分地区为农业用地,是洱海最主要的营养盐来源地,输入的氮和磷约占入湖总量的50 % 左右,该地区主要通过弥苴河、罗时江和永安江等向洱海输送物质,S1和S2点位最靠近入湖口,故其累积的营养物质要远高于其他点位。
表层沉积物中TOC与TN含量的关系比较复杂,主要分为3种模式。其中S1和S2点位受北部农田的氮肥输入影响,沉积物中TN含量迅速升高。近岸环境中较强的水动力条件加速了有机质的降解,可能是该区域TOC含量没有与TN含量同步升高的主要原因。剩余沉积物可以分为湖泊中部深水区(S19及周边部分点位,图 3b中橙色点)和其他区域(图 3b中蓝色点)两部分,这两区域表层沉积物的TOC与TN含量均呈现一定的线性相关(中部深水区,R2=0.44,n=11,P < 0.01;其他区域R2=0.89,n=25,P < 0.01)。该现象说明,洱海TOC含量主要受营养盐输入的控制,不同区域(北部浅水区,中部深水区和其他区域)TOC含量对营养盐输入的响应存在一定的区别,但整体都表现为与TN含量呈正相关。
2.2 洱海表层沉积物中C25HBIs特征本研究采集的38个洱海表层沉积物中都检出了C25HBIs,包括C25:1HBI和C25:2HBI化合物各1种(图 4)。C25:1HBI分子(M+=350)保留时间在n-C21正构烷烃之前,以m/z 210、238和266为主要特征碎片离子(图 4a,c),C25:2HBI分子(M+=348)保留时间在n-C21正构烷烃之后,以m/z 207、266和320为主要特征碎片离子(图 4b,d)。根据前人的鉴定结果,参考保留时间和特征离子碎片,本研究判定其可能的双键位置(图 4c,d)[27-28]。所有洱海表层沉积物中均未检测到C25:1HBI和C25:2HBI的同分异构体,这一现象与长江下游湖泊沉积物的结果差异明显。长江下游10个不同营养级湖泊沉积物中共检出6种C25:2HBI、2种C25:1HBI以及1种C25:3HBI[23]。因此,不同地域的湖泊中硅藻来源不同导致C25HBIs的种类和同分异构体丰富程度不同,洱海的C25HBIs生源硅藻相较于长江下游湖区可能具有更强的专属性。

|
图 4 典型洱海表层沉积物中非极性组分的总离子流色谱(a, b),以及沉积物中C25:1HBI(c)和C25:2HBI(d)的质谱信息和结构 Fig.4 The total ion current of non-polar fractions of typical surface sediments from Lake Erhai (a, b), and the mass spectrums and structures of C25:1HBI (c) and C25:2HBI (d) |
洱海沉积物中的C25:1HBI绝对浓度范围为0.04~0.55 μg/g,平均值为0.17 μg/g,C25:2HBI绝对浓度范围为0.05~0.61 μg/g,平均值为0.22 μg/g,C25HBIs绝对浓度范围为0.10~0.75 μg/g,平均值为0.38 μg/g(附表Ⅰ)。洱海沉积物中的C25:1HBI有机碳均一化浓度范围为0.80~16.70 μg/g(TOC),平均值为5.44 μg/g(TOC),C25:2HBI有机碳均一化浓度范围为1.20~17.10 μg/g(TOC),平均值为6.03 μg/g(TOC),C25HBIs有机碳均一化浓度范围为2.22~22.76 μg/g(TOC),平均值为11.18 μg/g(TOC)。绝对浓度和有机碳均一化浓度的相关性强(R2=0.95和0.92,n=38,P < 0.01,图 5),说明C25HBIs绝对浓度和有机碳均一化浓度均可表征C25HBIs生源硅藻对湖泊内源生产力的贡献情况。洱海的C25HBIs绝对浓度远高于太湖(0.023 μg/g)[37],有机碳均一化浓度高于长江下游湖泊C25HBIs检出的最低水平(淀山湖,6.8 μg/g(TOC)),但远低于最高水平(固城湖,69.5 μg/g(TOC)),与澄湖(10.9 μg/g(TOC))相当[23]。
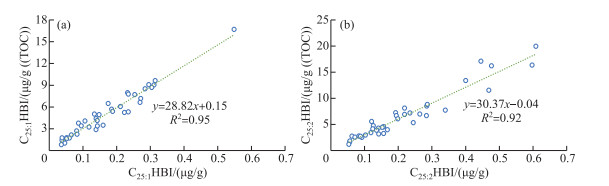
|
图 5 C25:1HBI(a)和C25:2HBI(b)绝对浓度与有机碳均一化浓度对比 Fig.5 Cross-plots of absolute concentration vs. TOC-normalized concentration of C25:1HBI (a) and C25:2HBI (b) |
洱海表层沉积物中C25:2HBI占C25HBIs烯烃的比例为26.6 % ~90.3 %,平均值为54.5 %。前人研究表明,长江下游10个湖泊的沉积物中C25:2HBI占C25HBIs烯烃的70.6 % ~93.9 % [23]。因此,不论是长江下游湖泊还是洱海,C25:2HBI都是C25HBIs的主要组成。然而,洱海南部表层沉积物中C25:2HBI占C25HBIs的比例相较于其他区域更少,说明洱海的C25HBIs所指示的硅藻信息在南部湖区存在一定的特殊性。综上所述,尽管C25HBIs被广泛认为是硅藻的产物,但不同湖泊存在C25HBIs种类、分布模式和浓度上的区别。整体而言,洱海C25HBIs烯烃不存在同分异构体,但C25:2HBI和C25:1HBI的浓度空间分布差异比其他湖泊更大,表明其生源具有地域特殊性。
2.3 洱海C25HBIs的空间分布特征及来源解析洱海不同湖区C25HBIs在沉积物中的浓度存在差异(图 2)。北部湖区表层沉积物中C25HBIs的浓度为0.47 μg/g,中部湖区为0.39 μg/g,南部湖区为0.33 μg/g,整体呈现出北部>中部>南部的变化特征。前人研究发现,沉水植物覆盖度较高的区域中C25HBIs的丰度也较高[23],而作者进一步研究发现,洱海沉水植物生物量[38]与C25HBIs丰度的空间变化没有相关性。就不同饱和度的C25HBIs而言,C25:1HBI和C25:2HBI分布特征存在差异。北部湖区C25:1HBI浓度范围为0.05~0.17 μg/g,平均值为0.11 μg/g,C25:2HBI浓度范围为0.19~0.61 μg/g,平均值为0.36 μg/g;中部湖区C25:1HBI浓度范围为0.04~0.55 μg/g,平均值为0.18 μg/g,C25:2HBI浓度范围为0.05~0.60 μg/g,平均值为0.21 μg/g;南部湖区C25:1HBI浓度范围为0.04~0.31 μg/g,平均值为0.20 μg/g,C25:2HBI浓度范围为0.07~0.24 μg/g,平均值为0.13 μg/g。整体而言,C25:1HBI浓度在空间分布上表现为北部 < 中部 < 南部,C25:2HBI浓度在空间分布上表现为北部>中部>南部,表明不同饱和度的C25HBIs受影响因素存在差异。C25:2HBI与C25:1HBI的浓度比值范围为0.36~9.29,同样表现出湖区北部较高而南部较低的特点。蔡燕凤[39]通过对三个湖区典型沉积物中的硅藻进行密度统计,发现南部湖区相较于其它湖区具有更适于物种栖息的生境,优势硅藻主要在南部湖区,该特征与C25:1HBI浓度的空间分布特征整体相似,表明洱海表层沉积物中C25:1HBI可能表征了洱海某些优势硅藻。遗憾的是,前人暂未对洱海硅藻不同种属空间分布丰度和生物量展开研究,无法确定C25:1HBI指示的硅藻种属,未来有待进一步的详实佐证。
全湖C25:1HBI浓度与C25:2HBI浓度呈两端低中间高的拱形关系(图 6)。在C25:2HBI浓度较低时,C25:1HBI浓度和C25:2HBI浓度呈微弱的正相关关系(R2=0.29,n=32,P < 0.01),而在C25:2HBI浓度较高(>0.4 μg/g,S1、S2、S3、S11、S26和S27)时,C25:1HBI浓度整体较低,C25:1HBI浓度和C25:2HBI浓度不存在相关关系(R2=0.11,n=6,P < 0.01)。C25:2HBI浓度较高的点位(S1、S2、S3、S11、S26和S27)皆位于浅水近岸区,可见全湖C25:1HBI浓度和C25:2HBI浓度呈拱形关系可能是不同水深环境下C25:1HBI和C25:2HBI的差异性降解[40-41]或者浅水环境更有利于产生C25:2HBI的硅藻栖息致使C25:2HBI浓度骤增导致。前人研究发现单不饱和C25HBIs比多不饱和C25HBIs更耐生物降解[42-43]。浅水区的溶解氧浓度和氧气曝气程度都较高,有利于C25:2HBI的降解。然而,洱海近岸浅水区C25:2HBI与C25:1HBI的比值明显高于其他湖区(图 2),间接说明水深导致的C25:2HBI降解不是C25:2HBI/C25:1HBI变化的主导因素。故本研究认为浅水环境有利于C25:2HBI生源硅藻的生长,可能是这些洱海沉积物样品呈现出高C25:2HBI和低C25:1HBI特征的原因。除去这些近岸的高C25:2HBI浓度的样品之后(S1、S2、S3、S11、S26和S27),剩余表层沉积物C25:2HBI和C25:1HBI存在一定的正相关关系(R2=0.29,n=32,P < 0.01,图 6a),表明在湖区大部分C25:2HBI和C25:1HBI生源存在相似性。这些表层沉积物也表现出C25:2HBI与水深的微弱正相关(R2=0.14,n=32,P < 0.01,图 6b),与浅水近岸区的强烈负相关不同(R2=0.64,n=6,P < 0.01,图 6b)。综上,洱海表层沉积物中C25:2HBI可能有较多来源,除了和C25:1HBI相似来源的硅藻以外,还包含了某些适于生存在浅水环境的硅藻。
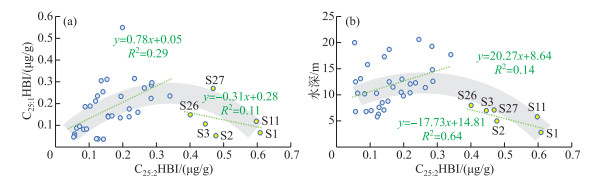
|
图 6 洱海表层沉积物C25:2HBI浓度与C25:1HBI浓度(a)和C25:2HBI浓度与水深(b)的关系(绿色虚线为样品以C25:2HBI浓度0.4 μg/g为界分别做线性拟合,灰色阴影为所有样品的二次拟合曲线) Fig.6 Plots of C25:2HBI concentration vs. C25:1HBI concentration (a), and C25:2HBI concentration vs. water depth (b) for surface sediments of Lake Erhai (Green dash lines are linear regression lines for concentration higher and lower than 0.4 μg/g, gray shadings are secondary polynomial curve fitting lines for all samples) |
为了进一步理解C25HBIs空间分布的控制因素及其地球化学指示意义,本研究分析了全湖和不同湖区C25HBIs与TOC(表征湖泊内源总生产力)、TN(表征营养盐输入)浓度的关系(图 7)。洱海全湖C25HBIs浓度与TOC整体不存在相关性(R2=0.01,n=38,P < 0.01)。就不同湖区而言,仅C25:1HBI与TOC在南部有较强相关性,主要原因在于南部C25:1HBI硅藻生产力与湖泊内源生产力的控制因素可能较为单一,而C25:2HBI浓度与湖泊总生产力相关性较弱。对于中部和北部湖区,C25HBIs与TOC的浓度基本没有相关性,且与叶绿素浓度存在空间差异[34],说明C25HBIs的生源硅藻受控因素与湖泊内总生产力存在显著差异,且较为复杂。
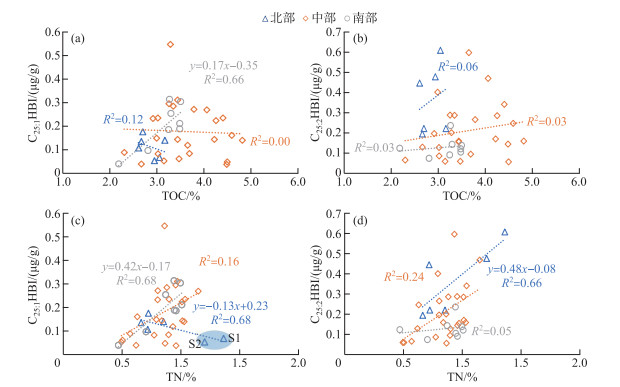
|
图 7 洱海表层沉积物中C25HBIs与TOC、TN的关系: (a)TOC vs. C25:1HBI浓度; (b)TOC vs. C25:2HBI浓度; (c)TN vs. C25:1HBI浓度; (d)TN vs. C25:2HBI浓度 Fig.7 Plots of (a) TOC vs. C25:1HBI concentration, (b) TOC vs. C25:2HBI concentration, (c) TN vs. C25:1 HBI concentration, and (d) TN vs. C25:2HBI concentration for surface sediments from Lake Erhai |
洱海全湖C25HBIs浓度与TN呈现正相关关系(R2=0.31,n=38,P < 0.01),说明C25HBIs浓度的变化和营养盐输入有一定相关性。TN和C25HBIs浓度以及TOC均具有一定的正相关关系,说明营养盐输入对硅藻的生产力和湖泊内源的总生产力都起到了一定的促进作用[44],但不同类型生产力之间的关系较为复杂。就不同湖区而言,湖泊的富营养化水平对北部湖区C25HBIs的影响模式较为复杂,C25:2HBI浓度与TN呈现出较好的正相关关系(R2=0.66,n=6,P < 0.01,图 7d),C25:1HBI浓度与TN呈现负相关关系(R2=0.68,n=6,P < 0.01,图 7c),主要系S1、S2的沉积物中TN含量高但C25:1HBI浓度低导致。这两个点位的TN为全湖最高水平,这与北部地区大多数为农业用地且是洱海氮磷最大的来源有关。而这两个点位的C25:1HBI浓度却处于较低水平,说明洱海北部农业活动可能抑制了C25:1HBI相应生源硅藻生长,导致了北部湖区硅藻群落演替[45-47]。前文提到浅水环境(S1、S2、S3、S11、S26和S27)有利于C25:2HBI的生源硅藻的发育导致C25:2HBI浓度较高,S1和S2点位C25:2HBI浓度较高最终导致了C25:2HBI浓度与TN呈现出较好的正相关关系,故不能直接说明营养盐输入对C25:2HBI生源硅藻的生产力的促进作用。由于北部湖区的样品数量较少(仅有6个),北部离岸最近的两个点对北部数据分析的影响较大,故未来需要通过高密度采样对北部湖区进一步解析。中部湖区C25:1HBI浓度和C25:2HBI浓度均与TN含量呈现一定的正相关关系,但相关性(R2=0.16,n=24,P < 0.01;R2=0.24,n=24,P < 0.01)为三个湖区中最弱,也表明中部湖区C25HBIs的生源硅藻影响因素较为复杂。胡竹君等[20]通过对洱海12个采样点的环境因子做冗余分析,发现除了湖泊的营养盐条件,空间上气象条件的变化(气温、日照时数、降水和风速)也会对洱海水体硅藻群落演替产生较大影响。基于此,C25HBIs的生源硅藻受控因素可能还包括气象等其它因素。南部湖区C25:2HBI浓度变化幅度较小且与TN含量相关性很弱(R2=0.05,n=8,P < 0.01),可能原因在于C25:2HBI浓度受营养盐输入和水深的双重控制,与湖泊内源总生产力和富营养化水平的相关性均较弱。相对而言,C25:1HBI浓度受到营养盐输入的促进作用而与TN含量呈现较好的正相关关系(R2=0.68,n=8,P < 0.01),表明C25:1HBI在南部湖区可以指示湖区富营养化程度。基于长江下游湖泊的研究表明,C25HBIs在长江下游的贫营养湖泊中含量较高,在富营养化的太湖梅梁湾中几乎未检测出,因此认为贫营养条件下生长的硅藻可能是C25HBIs的主要贡献者[23]。这进一步说明洱海C25:1HBI的生物地球化学指示意义具有一定的特殊性。
3 结论1) 洱海表层沉积物中只检测到1种C25:1HBI和1种C25:2HBI,与长江下游湖泊沉积物中C25HBIs存在多种同分异构体的现象不同,故洱海的C25HBIs生源硅藻相较于长江下游湖区更为单一。洱海的C25HBIs绝对浓度和有机碳均一化浓度范围分别为0.10~0.75 μg/g和2.22~22.76 μg/g,平均值分别为0.38和11.18 μg/g,远高于富营养化的太湖。C25:1HBI浓度空间分布表现为北部 < 中部 < 南部,而C25:2HBI浓度则表现为北部>中部>南部,因此C25:1HBI可能表征了洱海南部湖区的优势硅藻。
2) 在C25:2HBI浓度较低(< 0.4 μg/g)的沉积物中,C25:1HBI和C25:2HBI呈现微弱正相关,而部分浅水区域的沉积物则表现出C25:2HBI浓度高(>0.4 μg/g)但C25:1HBI浓度低的现象。因此,C25:2HBI可能有较多来源,除了和C25:1HBI相似来源的硅藻以外,还包含某些适于生存在浅水环境的硅藻。未来若有洱海硅藻不同种属空间分布丰度和生物量相关研究,有望进一步探明C25HBIs生源的硅藻种属。
3) 在农业活动和氮磷肥持续输入的影响下,洱海北部湖区C25:1HBI生源硅藻的生长受到抑制。中部湖区C25:1HBI和C25:2HBI浓度均与湖泊富营养化水平呈微弱正相关,但与总有机碳不存在相关性,说明C25HBIs的生源硅藻受控因素相对复杂,可能还包括气象等其它因素。南部湖区C25:1HBI浓度和湖泊总有机质含量变化一致,和总氮呈较强的正相关关系,可以指示洱海南部湖区的富营养化程度,这与长江下游湖泊高C25HBIs浓度指示寡营养湖泊的现象不同。此外,南部湖区C25:2HBI浓度与湖泊总生产力和湖泊富营养化水平的相关性均较弱。
综上所述,本研究对洱海C25HBIs的生源和生物地球化学指示意义有了新的认知,且发现C25:1HBI对湖泊某些区域的富营养化程度(例如,洱海南部湖区)具有指示意义,这为C25HBIs未来应用于云南地区湖泊的研究提供重要支持。
4 附录附表Ⅰ见电子版(DOI: 10.18307/2023.0312)。
| 附表Ⅰ 洱海表层沉积物总体特征和C25高支链类异戊烯烃数据 Appendix Ⅰ Bulk characteristics and C25HBIs from surface sediments of Lake Erhai |
| [1] |
Hao ST, Zhou AF, Zhang XN et al. Progress of research on the burial efficiency of organic carbon and its influencing factors in lacustrine sediments. Journal of Earth Environment, 2017, 8(4): 292-306. [郝盛吞, 周爱锋, 张晓楠等. 湖泊沉积有机碳埋藏效率及其影响要素研究进展. 地球环境学报, 2017, 8(4): 292-306. DOI:10.7515/JEE201704002] |
| [2] |
Bai XY, Hu XZ, Pang Y. Pollution load, distribution and characteristics of low-polluted water in Lake Erhai watershed. J Lake Sci, 2015, 27(2): 200-207. [白献宇, 胡小贞, 庞燕. 洱海流域低污染水类型、污染负荷及分布. 湖泊科学, 2015, 27(2): 200-207. DOI:10.18307/2015.0202] |
| [3] |
Pan HX, Wang YF, Dong YS. Factor analysis of eutrophication in Erhai Lake. J Lake Sci, 1999, 11(2): 184-188. [潘红玺, 王云飞, 董云生. 洱海富营养化影响因素分析. 湖泊科学, 1999, 11(2): 184-188. DOI:10.18307/1999.0217] |
| [4] |
金相灿. 中国湖泊环境. 北京: 海洋出版社, 1995.
|
| [5] |
Yang GS, Ma RH, Zhang L et al. Lake status, major problems and protection strategy in China. J Lake Sci, 2010, 22(6): 799-810. [杨桂山, 马荣华, 张路等. 中国湖泊现状及面临的重大问题与保护策略. 湖泊科学, 2010, 22(6): 799-810. DOI:10.18307/2010.060] |
| [6] |
Fu H, Yuan GX, Cao T et al. Succession of submerged macrophyte communities in relation to environmental change in Lake Erhai over the past 50 years. J Lake Sci, 2013, 25(6): 854-861. [符辉, 袁桂香, 曹特等. 洱海近50a来沉水植物演替及其主要驱动要素. 湖泊科学, 2013, 25(6): 854-861. DOI:10.18307/2013.0609] |
| [7] |
Hu XZ, Jin XC, Du BH et al. Submerged macrophyte of Lake Erhai and its dynamic change. Research of Environmental Sciences, 2005, 18(1): 1-4. |
| [8] |
Li EH, Wang XL, Cai XB et al. Features of aquatic vegetation and the influence factors in Erhai lakeshore wetland. J Lake Sci, 2011, 23(5): 738-746. [厉恩华, 王学雷, 蔡晓斌等. 洱海湖滨带植被特征及其影响因素分析. 湖泊科学, 2011, 23(5): 738-746. DOI:10.18307/2011.0511] |
| [9] |
Hall RI, Smol JP. A weighted-averaging regression and calibration model for inferring total phosphorus concentration from diatoms in British Columbia (Canada) lakes. Freshwater Biology, 1992, 27: 417-434. DOI:10.1111/j.1365-2427.1992.tb00551.x |
| [10] |
Bennion H. A diatom-phosphorus transfer function for shallow, eutrophic ponds in southeast England. Hydrobiologia, 1994, 27: 391-410. DOI:10.1007/BF00026729 |
| [11] |
Lotter AF, Birks HJ, Hofmann W et al. Modern diatom, cladocera, chironomid, and chrysophyte cyst assemblages as quantitative indicators for the reconstruction of past environmental conditions in the Alps. Ⅱ. Nutrients. Journal of Paleolimnology, 1998, 19: 443-463. DOI:10.1023/A:1007994206432 |
| [12] |
Bradshaw EG, Anderson NJ. Validation of a diatom-phosphorus calibration set for Sweden. Freshwater Biology, 2001, 46: 1035-1048. DOI:10.1046/j.1365-2427.2001.00732.x |
| [13] |
Yang XD, Anderson NJ, Doug XH et al. Surface sediment diatom assemblages and epilimnetic total phosphorus in large, shallow lakes of the Yangtze floodplain: their relationships and implications for assessing long-term eutrophication. Freshwater Biology, 2008, 53: 1273-1290. DOI:10.1111/j.1365-2427.2007.01921.x |
| [14] |
Hu ZJ, Li YL, Li SX. Spatial and temporal distributions of diatom communities and their relationships with environmental factors in Lake Erhai. J Lake Sci, 2012, 24(3): 400-408. [胡竹君, 李艳玲, 李嗣新. 洱海硅藻群落结构的时空分布及其与环境因子间的关系. 湖泊科学, 2012, 24(3): 400-408. DOI:10.18307/2012.0311] |
| [15] |
Wang R, Dearing JA, Landon PG et al. Flickering gives early warning signals of a critical transition to a eutrophic lake state. Nature, 2012, 429: 419-422. DOI:10.1038/nature11655 |
| [16] |
Gearing PJ, Gearing JN, Lytle TF et al. Hydrocarbons in 60 northeast Gulf of Mexico shelf sediments: a preliminary study. Geochimica et Cosmochimica Acta, 1976, 40(9): 1005-1017. DOI:10.1016/0016-7037(76)90043-0 |
| [17] |
Zhang YD, Sun YG, Xie LJ et al. The occurrence and significance of C25HBI in Cenozoic saline lacustrine source rocks from the Western Qaidam Basin, NW China. Chinese Science Bulletin, 2011, 56(13): 1390-1398. [张永东, 孙永革, 谢柳娟等. 柴达木盆地西部新生代盐湖相烃源岩中高支链类异戊二烯烃(C25HBI)的检出及其地质地球化学意义. 科学通报, 2011, 56(13): 1032-1041. DOI:10.1007/s11434-011-4430-2] |
| [18] |
Belt ST, Massé G, Rowland SJ et al. A novel chemical fossil of palaeo sea ice: IP25. Organic Geochemistry, 2007, 38(1): 16-27. DOI:10.1016/j.orggeochem.2006.09.013 |
| [19] |
Belt ST, Müller J. The Arctic sea ice biomarker IP25: a review of current understanding, recommendations for future research and applications in palaeo sea ice reconstructions. Quaternary Science Reviews, 2013, 79: 9-25. DOI:10.1016/j.quascirev.2012.12.001 |
| [20] |
Bai YC, Sicre MA, Ren J et al. Centennial-scale variability of sea-ice cover in the chukchi sea since ad 1850 based on biomarker reconstruction. Environmental Research Letters, 2022, 17(4): 044058. DOI:10.1088/1748-9326/ac5f92 |
| [21] |
Su L, Ren J, Sicre MA et al. HBIs and Sterols in surface sediments across the East Siberian Sea: Implications for Palaeo Sea-Ice Reconstructions. Geochemistry, Geophysics, Geosystems, 2022, 23(2): e2021GC009940. DOI:10.1029/2021GC009940 |
| [22] |
Li JG, Fan P, Cui MZ et al. C20, C25 and C30 highly branched isoprenoid alkenes in the branched and cyclic hydrocarbon fractions of Qinghai Lake sediments. Acta Sedimentologica Sinica, 1995, 4: 82-92. [李景贵, 范璞, 崔明中等. 青海湖沉积物支链和环烷烃组分中C20, C25和C30高度支链类异戊二烯烯烃. 沉积学报, 1995, 4: 82-92.] |
| [23] |
Zhang YD, Su YL, Liu ZW et al. Aliphatic hydrocarbon biomarkers as indicators of organic matter source and composition in surface sediments from shallow lakes along the lower Yangtze River, Eastern China. Organic Geochemistry, 2018, 122: 29-40. DOI:10.1016/j.orggeochem.2018.04.009 |
| [24] |
Lu SY, Zhang WT, Xing Y et al. Spatial distribution of water quality of Erhai Lake during the dry and rainy seasons. Environmental Earth Sciences, 2015, 74(11): 7423-7430. DOI:10.1007/s12665-015-4725-8 |
| [25] |
Li J, Bai Y, Alatalo JM. Impacts of rural tourism-driven land use change on ecosystems services provision in Erhai Lake Basin, China. Ecosystem Services, 2020, 42: 101081. DOI:10.1016/j.ecoser.2020.101081 |
| [26] |
Ho JC, Michalak AM. Exploring temperature and precipitation impacts on harmful algal blooms across continental U.S. lakes. Limnology and Oceanography, 2019, 65(5): 992-1009. DOI:10.1002/lno.11365 |
| [27] |
Xu YP, Jaffé R, Wachnicka A et al. Occurrence of C25 highly branched isoprenoids (HBIs) in Florida Bay: Paleoenvironmental indicators of diatom-derived organic matter inputs. Organic Geochemistry, 2006, 37(7): 847-859. DOI:10.1016/j.orggeochem.2006.02.001 |
| [28] |
Johns L, Wraige EJ, Belt ST et al. Identification of a C25 highly branched isoprenoid (HBI) diene in Antarctic sediments, Antarctic sea-ice diatoms and cultured diatoms. Organic Geochemistry, 1999, 30: 1471-1475. DOI:10.1016/S0146-6380(99)00112-6 |
| [29] |
Li QQ, Huo SL, Zan FY et al. The distribution of nutrients and particle size, their correlations in surface sediments of different lakes, China. Journal of Agro-Environment & Science, 2010, 29(12): 2390-2397. |
| [30] |
Liu HJ, Liu EF, Yu ZZ et al. Spatio-temporal patterns of organic carbon burial in the sediment of Lake Erhai in China during the past 100 years. J Lake Sci, 2019, 31(1): 282-292. [刘会基, 刘恩峰, 于真真等. 近百年来洱海沉积物有机碳埋藏时空变化. 湖泊科学, 2019, 31(1): 282-292. DOI:10.18307/2019.0126] |
| [31] |
Wan GJ, Bai ZG, Qing H et al. Geochemical records in recent sediments of Lake Erhai: Implications for environmental changes in a low latitude-high altitude lake in southwest China. Journal of Asian Earth Sciences, 2003, 21(5): 489-502. DOI:10.1016/S1367-9120(02)00076-7 |
| [32] |
Li K, Liu EF, Zhang EL et al. Historical variations of atmospheric trace metal pollution in Southwest China: Reconstruction from a 150-year lacustrine sediment record in the Erhai Lake. Journal of Geochemical Exploration, 2017, 172: 62-70. DOI:10.1016/j.gexplo.2016.10.009 |
| [33] |
Anderson NJ, Heathcote AJ, Engstrom DR. Anthropogenic alteration of nutrient supply increases the global fresh water carbon sink. Science Advances, 2020, 6(16): 2145. DOI:10.1126/sciadv.aaw2145 |
| [34] |
Wang XM, Deng Y, Tuo YC et al. Study on the temporal and spatial distribution of chlorophyll a in Erhai Lake based on multispectral data from environmental satellites. Ecological Informatics, 2021, 61: 101201. DOI:10.1016/j.ecoinf.2020.101201 |
| [35] |
Hedges JI, Keil RG, Benner R. What happens to terrestrial organic matter in the ocean?. Organic Geochemistry, 1997, 27(5): 195-212. DOI:10.1016/S0146-6380(97)00066-1 |
| [36] |
Zhang L, Wang SR, Imai A. Spatial and temporal variations in sediment enzyme activities and their relationship with the trophic status of Erhai Lake. Ecological Engineering, 2015, 75: 365-369. DOI:10.1016/j.ecoleng.2014.11.043 |
| [37] |
Zhang YD, Su YL, Liu ZW et al. Lipid biomarker evidence for determining the origin and distribution of organic matter in surface sediments of Lake Taihu, Eastern China. Ecological Indicators, 2017, 77: 397-408. DOI:10.1016/j.ecolind.2017.02.031 |
| [38] |
Yang SK, Jin L, Gao DC et al. Community structure characteristics and the maximum biomass estimation of submerged macrophytes in Erhai Lake. Environmental Science Survey, 2020, 39(6): 11-17. [杨四坤, 金玲, 高登成等. 洱海沉水植物群落结构特征及最大生物量估算. 环境科学导刊, 2020, 39(6): 11-17.] |
| [39] |
蔡燕凤. 近百年来洱海富营养化历史与硅藻群落变化的时空特征研究[学位论文]. 云南: 云南师范大学, 2013.
|
| [40] |
Zhang L, Wang SR, Li YP et al. Spatial and temporal distributions of microorganisms and their role in the evolution of Erhai Lake eutrophication. Environmental Earth Sciences, 2015, 74: 3887-3896. |
| [41] |
Wakeham SG, Peterson ML, Hedges JI et al. Lipid biomarker fluxes in the Arabian Sea, with a comparison to the equatorial Pacific Ocean. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 2002, 49(12): 2265-2301. DOI:10.1016/S0967-0645(02)00037-1 |
| [42] |
Robson JN, Rowland SJ. Synthesis of a highly branched C30 sedimentary hydrocarbon. Tetrahedron Letters, 1988, 29(31): 3837-3840. DOI:10.1016/S0040-4039(00)82128-0 |
| [43] |
Rowland SJ, Robson JN. The widespread occurrence of highly branched acyclic C20, C25 and C30 hydrocarbons in recent sediments and biota-A review. Marine Environmental Research, 1990, 30: 191-216. DOI:10.1016/0141-1136(90)90019-K |
| [44] |
Liu B, Chen S, Liu H et al. Changes in the ratio of benthic to planktonic diatoms to eutrophication status of Muskegon Lake through time: Implications for a valuable indicator on water quality. Ecological Indicators, 2020, 114: 106284. DOI:10.1016/j.ecolind.2020.106284 |
| [45] |
Cao J, Hou ZY, Li ZK et al. Succession of phytoplankton functional groups and their driving factors in a subtropical plateau lake. Science of the Total Environment, 2018, 631/632: 1127-1137. DOI:10.1016/j.scitotenv.2018.03.026 |
| [46] |
Xu M, Wang R, Yang XD. Combining paleolimnological proxies to understand the long-term social-ecological interactions: A case study in the Erhai basin, Southwest China. Quaternary International, 2021, 592: 60-66. DOI:10.1016/j.quaint.2021.03.040 |
| [47] |
Lin SS, Shen SL, Zhou A et al. Assessment and management of lake eutrophication: A case study in Lake Erhai, China. Science of the Total Environment, 2021, 751: 141618. DOI:10.1016/j.scitotenv.2020.141618 |
 2023, Vol. 35
2023, Vol. 35 

