(2: 三峡大学湖北省鱼类过坝技术国际科技合作基地, 宜昌 443002)
(3: 河海大学水利水电学院, 南京 210098)
(4: 上海勘测设计研究院有限公司, 上海 200434)
(5: 中国电建集团贵阳勘测设计研究院有限公司, 贵阳 550081)
(6: 中国三峡建工(集团)有限公司, 成都 610041)
(2: Hubei International Science and Technology Cooperation Base of Fish Passage, China Three Gorges University, Yichang 443002, P. R. China)
(3: College of Water Conservancy and Hydropower Engineering, Hohai University, Nanjing 210098, P. R. China)
(4: Shanghai Investigation, Design and Research Institute Corporation Limited, Shanghai 200434, P. R. China)
(5: Power China Guiyang Engineering Co., Ltd, Guiyang 550081, P. R. China)
(6: China Three Gorges Construction (Group) Co., Ltd, Chengdu 610041, P. R. China)
黑水河流域是金沙江下游白鹤滩库区干流鱼类的重要替代生境和优先保护支流[1]。黑水河干流原修建4座梯级拦河闸坝工程,从上游至下游依次为苏家湾、公德房、松新和老木河水电站(引水式电站),构成了梯级小水电群,在电站上下游已形了局部减脱水河段,破坏了河流连通性,阻隔了鱼类上下行洄游通道[2]。2019年在松新坝址修建了松新鱼道并以短须裂腹鱼(Schizothorax wangchiachii)作为主要过鱼对象以辅助鱼类过坝。松新鱼道的修建对上游苏家湾和公德房水电站过鱼工程建设具有重要的示范效应,对整个黑水河流域鱼类资源恢复具有重要的借鉴意义。然而,恢复鱼类洄游通道连通性不止是修建鱼道以满足成鱼上行产卵的需求,也需要满足产卵后的成鱼和寻找育肥场所的幼鱼下行洄游需求[3]。目前,松新电站过鱼对象下行过坝研究鲜有报道,亟需开展相应研究。
辅助鱼类下行过坝的关键在于识别引发目标鱼发生下行行为的驱动因素[4]。国外相关学者早期通过在室内及野外开展鱼类下行行为学实验,发现影响鱼类下行效率的因素包括生物因素和环境因素,其中生物因素包括物种特异性、鱼类生物学等相关的特征,而环境因素包括流量、流速、水温、水体透明度、昼夜节律等环境因子[5]。Knott等[6]在4条河流上监测了39种鱼的下行过坝情况,发现鱼类下行运动与水体透明度、水温和流量呈正相关,其中鳃鱼(Polybranchiaspis)和梭鲈(Sander lucioperca)主要在夜间下行过坝。相关学者研究鲑鱼(Oncorhynchus keta)通过筑坝河流的下行效率,发现鱼类的下行效率与光周期、水温呈现正相关趋势,且与鱼类自身的游泳能力也有一定关系[7-8]。国内关于鱼类下行研究起步较晚,现阶段主要模仿国外鱼类下行装置,在室内开展四大家鱼下行行为实验,主要聚焦于描述鱼类的下行行为特征,分析单个变量对鱼类下行通过率的影响。如鲢(Hypophthalmichthys molitrix)、鳙(Aristichthys noblis)幼鱼在应对流速梯度为0.2~0.6 m/s2的加速流时,下行率高达45.83 %,且主要以头部朝向下游(主动)的方式下行[9-10]。然而,室内单因素控制变量实验往往不能真实反映鱼类在野外实际工程中受多因素协同作用的下行游泳规律。尤其针对无调节性的梯级小水电(如松新水电站),水文情势(流量、流速、水位、水温和水体透明度等因素)受上游电站泄水和本电站发电引水的影响变化幅度较大,可能影响鱼类下行的通过效率[11]。目前,国内在野外工程现场探究目标鱼响应多因素综合作用的下行过坝研究仍缺乏深入认知。
上行洄游成鱼繁殖的幼鱼通常需要在下游栖息地进行发育成熟,倘若幼鱼的下行通道被阻隔,其可能在上游无法顺利生存。成鱼上溯的决定性因素是鱼的克流能力,而幼鱼下行与成鱼上溯不同,幼鱼下行过坝的过程中会因为被动卷吸而受到生存威胁,因此幼鱼下行的关键性在于安全过坝。鉴于此,本研究以金沙江下游梯级小水电开发下的黑水河松新电站为实验场,选取松新鱼道的补水通道作为幼鱼安全下行过坝设施,通过在松新坝址上游开展鱼类资源调查,确定了以棒花鱼(Abbottina rivularis)、短须裂腹鱼、短体副鳅(Paracobitis potanini)、红尾副鳅(Paracobitis variegatus)为下行研究对象,通过构建二元Logistic回归模型识别影响鱼类下行效率的关键因子,为梯级小水电背景下的河流连通性修复、水库调度方案和下行过鱼设施优化设计提供理论依据。
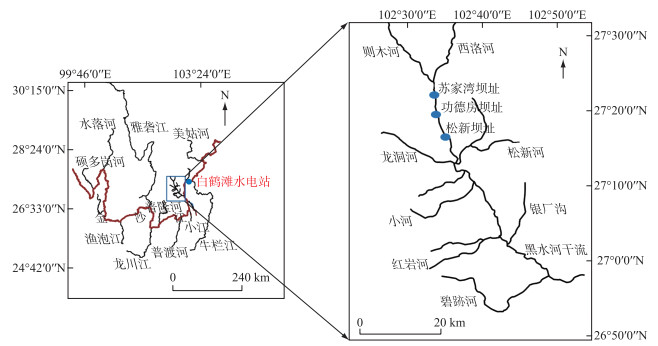
1 材料与方法 1.1 研究区域本实验研究区域位于金沙江下游黑水河流域梯级小水电中的松新坝址(图 1)。松新闸坝左岸修建有鱼道并配备有补水通道。鱼道的主要作用是帮助成鱼上行;补水通道的主要作用有两个:①鱼道进口进行补水,增强水流诱鱼效果[12];②作为本研究下行的主要过鱼设施,辅助鱼类下行。补水通道紧挨鱼道西侧,呈弯折状布置,通道内无任何消能设施设置且对下行的幼鱼不会产生威胁或伤害,水流流速保持在0.92~1.28 m/s;补水通道全长106.45 m,其中闸室段长度5.00 m,斜坡段长度47.67 m(坡率为6 %),平坡段长度为53.78 m,直线段净宽为1.60 m,转弯段净宽为3.00 m。
|
图 1 研究区域地理位置 Fig.1 Regional geographic location of study area |
2021年3—5月根据河段的流量及地势分布情况,在黑水河松新坝址上游1.8 km河段内设置10个采样点,并每个月选取5天进行近坝区鱼类资源调查(图 2),每个采样点布置长×宽×高为5.00 m×0.25 m×0.20 m的地笼网一个,前一天上午8:00—10:00布置地笼网,第二天上午8:00—10:00取样,再放回地笼网,采用温度计测量采样点附近水域的水温,取样点附近的水温维持在(20.3±2.6)℃。鱼种类鉴定主要依据《四川鱼类志》[13]。本次资源调查共统计鱼类1999尾,隶属于2目3科18种(图 3)。其中鲤科鱼类为9种932尾,占总渔获物数量的46.62 %;鳅科鱼类为8种1064尾,占总渔获物数量的53.23 %;鮡科鱼类仅为1种3尾,占总渔获物数量的0.15 %;鲤科棒花鱼774尾,占总渔获物数量的38.72 %;短须裂腹鱼22尾,占总渔获物数量的1.1 %;鳅科短体副鳅184尾,占总渔获物数量的9.2 %;红尾副鳅654尾,占总渔获物数量的32.72 %。

|
图 2 上游河段采样点位置分布 (图中P1~P10为上游河段10个采样点;本次鱼类资源调查为作者本人及本文合著者共同调查结果) Fig.2 Distribution of sampling sites in upstream reach |

|
图 3 松新大坝上游鱼类资源量分布 Fig.3 Distribution of fish resources in the upstream of Songxin Dam |
主要过鱼对象的选取是借鉴有关文献[14]中建立的以洄游习性、栖息地适应性、保护等级、经济价值、历史地位为评分标准,每种标准的等级评分是0、1、2(表 1),将评分≥7的设为主要过鱼对象[15]。本研究中短须裂腹鱼及棒花鱼评分均达到7(表 2),故先选取这两种鱼类为下行过鱼对象。由于这两种鱼类均属于鲤科鱼类,为验证下行过鱼设施是否能够满足不同科鱼类的下行需求,且考虑到历年的鱼类资源调查中鳅科鱼类均为黑水河流域的常见鱼种[16],本研究结合评分及资源量的标准增加了红尾副鳅及短体副鳅两个研究对象,以进一步对比分析不同科鱼种之间下行行为的差异性,因此选取短须裂腹鱼、棒花鱼、红尾副鳅和短体副鳅为研究对象。
| 表 1 过鱼对象选择标准 Tab. 1 Selection criteria of objects of fish for fish pass |
| 表 2 过鱼对象评分 Tab. 2 Fish object score |
考虑幼鱼具有下行洄游需求,本研究下行过鱼对象为幼鱼阶段的棒花鱼、短须裂腹鱼、短体副鳅和红尾副鳅。正式实验前,为了验证补水通道可作为鱼类下行通道的可能性,对4种鱼类(棒花鱼、短须裂腹鱼、短体副鳅、红尾副鳅)幼鱼均进行了下行预实验,其中棒花鱼、短体副鳅、红尾副鳅各放鱼20尾,短须裂腹鱼放鱼19尾。放鱼后连续监测3天,监测结果表明4种鱼均可以通过补水通道下行,下行的幼鱼存活率为100 % 且未见明显损伤,棒花鱼、短须裂腹鱼、短体副鳅和红尾副鳅的下行率分别为20.00 %、26.31 %、10.00 % 和15.00 %,且下行成功的鱼类均在第一天内被监测到。由于棒花鱼、短体副鳅和红尾副鳅的资源量充足,正式实验所用的棒花鱼、短体副鳅和红尾副鳅均来源于野外鱼类资源调查中捕获的鱼类。然而,短须裂腹鱼幼鱼因野外捕获仅有19尾,为保证实验的样本数量,正式实验所用的短须裂腹鱼均购买于四川省凉山彝族自治州宁南县幸福镇幸福鱼庄(27°9′26.828″N,102°39′54.094″E)。幸福鱼庄的养殖水域位于黑水河的支流(小河流域),成鱼产卵后在自然河流环境中,慢慢生长发育形成幼鱼,培育的环境条件与自然条件基本一致,游泳行为可能更接近野生短须裂腹鱼。实验前,将所需的所有实验鱼均暂养于松新闸坝下游河流流水环境中,实验期间水温变化范围为(20.2±1.1)℃,流速变化范围为0.010~0.057 m/s,利用天然流水暂养3 d,保持实验鱼的活性,暂养结束后,挑选活性较强的鱼作为实验对象。
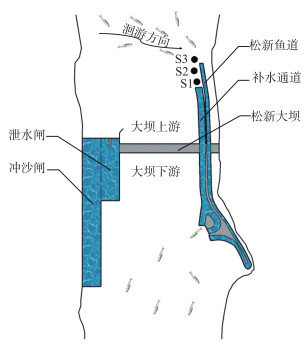
1.5 实验方法黑水河松新鱼道进水口位于补水通道进水口上游,当河道上游鱼类下行洄游时,必然先经过鱼道进水口附近水域再抵达补水通道进水口,故鱼类下行过程中可能会受到鱼道进水口的干扰无法快速下行,基于此,为了验证实验鱼感知的补水通道进口加速流的范围以及鱼在下行过程中是否受到鱼道干扰,本研究沿程设置S1(距补水通道进水口5 m)、S2(距补水通道进水口10 m)和S3(距补水通道进水口29 m,鱼道进水口上游侧)3个放鱼点(图 4),分析不同放鱼位置下鱼类下行效率及其差异的原因。每个放鱼点进行6次放鱼实验,每次放4种鱼且每种鱼各放5尾,即每次放实验鱼20尾,3个放鱼点总共开展18次放鱼实验,共计放鱼360尾。正式放鱼实验前,需对每尾实验鱼进行全长、体长、体高、体宽及体重的测量,测量结果见表 3。为精准识别每次实验3个放鱼点每尾鱼的下行过坝情况,每次实验同一种鱼均采用不同体长的实验鱼。本实验在补水通道出水口处设置了透水网箱以捕获所有成功下行的实验鱼,网箱内放置有石块制造低流速区,为目标鱼提供休息区。考虑实验鱼可能通过鱼道下行至坝下,在鱼道出水口也布置了相同的透水网箱,以评估目标鱼通过鱼道下行的可能性。根据预实验结果设定每次实验时间为24 h,若实验鱼在24 h内进入透水网箱,即为下行成功;若实验鱼未进入网箱或超过24 h进入网箱,即为下行失败。为了区分放流鱼类和天然河道中的鱼类,监测24 h后将透水网箱中的实验鱼捞出,再次测量网箱中鱼类的生理指标信息(误差±1 mm或±0.1 g)以逐一匹配放鱼的5项生理指标信息。实验期间采用黑水河生态流量自动监测系统实时获取上游河道流量、补水通道流量和水温等数据;采用BDP型透明度盘(萨式盘)测量水体透明度,并分成3个等级,分别为可视距离≤10 cm(高度浑浊)、10~20 cm(中度浑浊)、≥20 cm(低度浑浊)[17]。本研究中补水通道闸门开度为0.85 m,其流量随上游河道流量的变化而变化。
|
图 4 放鱼点位置示意图 (图中S1、S2、S3分别为距离补水通道进水口5、10、29 m的3个放鱼点位置) Fig.4 Illustration of fish releasing sites |
| 表 3 4种鱼在3个放鱼点的生理指标 Tab. 3 Physiological indexes of four fishes at three release sites |
本文采用下行率(R)量化目标鱼下行过坝效果,其定义为实验鱼通过补水通道出水口被捕捞到的目标鱼占此鱼种放鱼总数的百分比,计算公式如下:
| $ R=\frac{A_{\mathrm{m}}}{A_{\mathrm{n}}} \times 100 \% $ | (1) |
式中,Am表示补水通道出水口捕捞到的目标鱼数量;An表示此鱼种放鱼总尾数。
为识别影响目标鱼下行过坝的关键因素,本文构建了以鱼种、目标鱼体长、放鱼位置、水体透明度、上游河道流量、补水通道流量、上游河道水温、上游河道水位作为自变量,以是否下行成功为因变量的Logistic回归模型,其中是否下行成功(0:失败;1:成功)、鱼种(1:棒花鱼;2:短须裂腹鱼;3:短体副鳅;4:红尾副鳅)、放鱼位置(1:S1;2:S2;3:S3)、水体透明度(1:≤10 cm;2:10~20 cm;3:≥20 cm)为分类变量;上游河道流量、补水通道流量、上游河道水温、上游河道水位为连续变量。其模型表达式如下:
| $ \operatorname{logit}\left(p_i\right)=\ln \left(\frac{p_i}{1-p_i}\right)=a_0+a_1 x_1+\cdots+a_m x_m=a_0+\sum\limits_{j=1}^m a_i x_j $ | (2) |
式中,ai表示自变量xj改变一个单位时,logit(pi)的改变量,代表各影响因素的权重系数;x1, x2, …, xm表示因变量有m个影响因素;pi表示事件发生的条件概率。
为避免Logistic回归模型中自变量可能存在多重共线性问题,提高模型精度,模型采用逐步回归法进行迭代,选择赤池信息量准则(Akaike Information Criterion,AIC)筛选出最优模型。AIC准则是衡量统计模型拟合优良性的一种标准,从一组可供选择的模型中选择最佳模型时,通常选择AIC最小的模型[18]。
| $ A I C=2 k-2 \ln L(\theta) $ | (3) |
式中,k是模型参数个数;L(θ)表示似然函数。
本研究根据Logistic回归模型的最优模型结果构建幼鱼下行成功概率预测列线图,列线图的基本原理是根据多因素回归模型中各个影响因素对结局变量的贡献程度,对各个影响因素进行赋分,再计算个体的总评分,由此得到该个体结局事件的预测值。
本研究所有实验数据采用Microsoft Excel 2016软件进行处理,SPSS 25软件进行卡方检验(chi-square test)检验不同鱼种之间下行率的差异性,P < 0.05代表显著性差异;R语言3.6.3构建Logistic回归模型预测识别影响鱼类下行效率的关键因子及绘制列线图;Origin 2021软件进行绘图;统计值均以平均值±标准差(Mean±SD)表示。
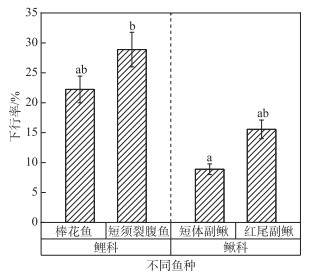
2 结果 2.1 不同种鱼的下行率分析本研究共放鱼360尾,4种鱼各90尾,对不同种鱼的下行率进行卡方检验后发现,短须裂腹鱼的下行率最高(28.89 %),其次棒花鱼的下行率为22.22 %,短体副鳅的下行率为8.89 %,红尾副鳅的下行率为15.56 %;鲤科鱼类的下行率为25.56 %,鳅科鱼类的下行率为12.22 %,鲤科鱼类下行率高于鳅科鱼类下行率;除短须裂腹鱼下行率显著性高于短体副鳅外(P < 0.05),其余各鱼种之间不存在显著性差异(P>0.05)(图 5)。
|
图 5 不同种鱼的下行率分布(组间不同小写字母表示有显著性差异(P < 0.05)) Fig.5 Distribution of descending rate of different species of fishes |
本研究在3个放鱼位置S1、S2、S3分别进行6次放鱼实验,每次放鱼实验均在同一时间进行且每个位置的放鱼总数为120尾。从图 6可以发现,放鱼位置S1和S2的幼鱼下行尾数均为31尾,并无明显差别,而在放鱼位置S3放鱼时,4种鱼的下行尾数明显减少,下行成功的尾数为6尾,仅占S3总放鱼尾数的5.00 %,下行失败的幼鱼高达114尾,放鱼位置S1和S2的成功下行尾数高于放鱼位置S3之间的成功下行尾数。

|
图 6 不同放鱼位置的下行鱼类分布 Fig.6 Distribution of downward fish number affected by different fish releasing sites |
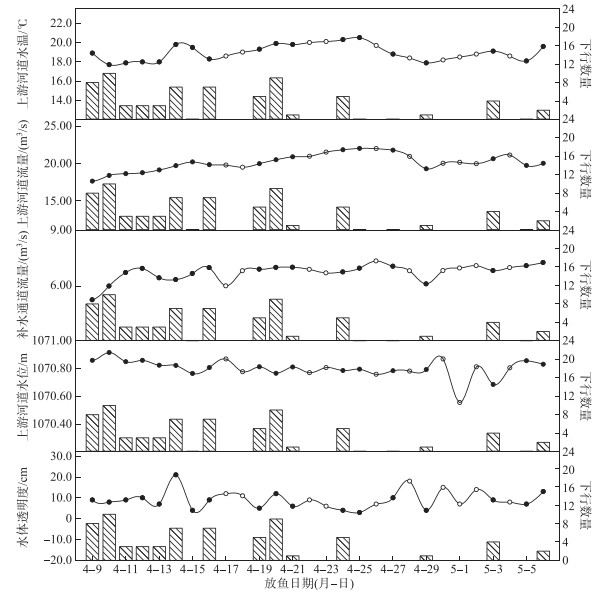
本研究统计了监测实验期间上游河道水温、流量、水位、补水通道流量及水体透明度变化下鱼类下行尾数(图 7),对于本实验工况而言,实验期间下行尾数数据较密集而后期下行尾数数据较少,此现象是由于前几天连续进行放鱼实验监测,而后期电站检修和维护等原因导致未进行放鱼实验,使得后期下行数据不明显。本研究结果表明:监测期间水温呈先上升后降低的变化趋势,上游河道流量呈先增加后降低再缓慢上升的趋势,补水通道流量整体变幅较小,其中上游河道水位在4月9日-30日期间变幅较小而后几天的波动较大,水体透明度同样处于8~12 cm范围内波动,其在4月14日达到最大值。值得注意的是本实验监测期间,4月9、10、14、16及20日幼鱼下行尾数相对较多,其对应的环境因子总体变化趋势为:水温相对较高而流量相对较低,补水通道流量变化不显著,其中上游河道水位及水体透明度分别在1070.80~1070.90 m及8~12 cm范围内波动。
|
图 7 影响幼鱼下行规律的环境因子分布 (●表示当天进行了鱼类下行实验,○表示当天未进行鱼类下行实验;折线图对应左纵坐标,柱状图对应右纵坐标) Fig.7 Distribution of environmental factors affecting descending of juvenile fish |
本文以鱼种、目标鱼体长、放鱼位置、水体透明度、上游河道流量、补水通道流量、上游河道水温、上游河道水位作为自变量,以是否下行作为因变量构建了Logistic回归模型,运用AIC准则筛选出最优模型(表 4)。结果表明:以鱼种、放鱼位置、上游河道水温和上游河道流量为自变量的模型AIC值最小,模型最优。根据Logistic回归预测模型中各因子的系数估计值(图 8),发现放鱼位置、鱼种、上游河道水温和流量均对鱼类下行成功率有显著影响(P < 0.05),且鱼类下行成功率与上游河道水温呈正相关趋势,放鱼位置和上游河道流量与鱼类下行成功率呈负相关趋势。
| 表 4 基于赤池信息准则(AIC)的模型选择* Tab. 4 Model selection based on AIC |

|
图 8 P+S+T+RQ模型参数评估森林图 Fig.8 Forest map for parameter evaluation of P+S+T+RQ model |
本研究基于AIC准则筛选及Logistic回归模型建立了幼鱼下行成功概率预测列线图(图 9),通过评分的形式预测受各因素影响的幼鱼下行成功率。在列线图总分部分确定得分所在位置并做垂直线,垂直线与下行成功概率交点处数值即为鱼类在各环境因素变化下的成功概率。为了检验模型的准确性,本研究综合考虑放鱼位置、上游河道水温及流量对鱼类下行率的影响,选取3种因素在监测期间变化平均值作为下行成功概率预测模型的参数,以棒花鱼为例,本研究中棒花鱼的平均下行率为22.22 %,当鱼种为棒花鱼(得分:23.5分),放鱼位置对应总分的平均分数为S2(得分:18.7分),上游河道平均水温为18.90℃(得分:32.0分),上游河道平均流量为19.96 m3/s(得分:52.5分)时,此时下行成功概率预测列线图的总得分为126.7分,由列线图可预测棒花鱼的下行成功概率约为23.4 %,此结果与本研究结论基本一致,即该模型可以较好地预测幼鱼在多种因素影响下的下行成功概率,为下行过坝设施优化设计提供理论依据。

|
图 9 幼鱼下行成功概率预测列线图 Fig.9 Prediction nomogram of juvenile fish descending success probability |
黑水河流域分布有10科44种鱼,各鱼种之间的栖息生境、游泳行为和生理指标等必然存在区别,尤其在不同科之间差异显著[16]。本研究选取的4种过鱼对象中的2种为鲤科鱼(棒花鱼和短须裂腹鱼)幼鱼,2种为鳅科鱼(短体副鳅和红尾副鳅)幼鱼,其中鲤科鱼类属于短距离洄游物种,而鳅科鱼类无洄游习性(表 2),通过对比鲤科和鳅科鱼的下行率,发现鲤科鱼下行率普遍高于鳅科,其中短须裂腹鱼的下行率显著高于短体副鳅(图 5)。对于本实验而言,发生此现象的原因可能是松新大坝上游河道河床分布有大量尺寸不一的卵石群[19],鳅科鱼作为底层鱼类的代表,在由卵石形成的加糙性河床中借助底部形成低流速区[20],可能在补水通道附近维持长时间的顶流游泳,难以找到下行通道入口,导致下行率较低,其次鳅科鱼类的洄游性需求不大可能也是导致其下行率较低的原因之一。本研究中的两种鲤科鱼为表中层鱼[21],易感知补水通道附近的流速梯度变化而受到吸引,当目标鱼接近补水通道入口时,补水通道局部区域的高速水流(1.68 m/s)可能超过了鱼的最大游泳速度(1.43 m/s)[22],导致目标鱼迅速疲劳,快速下行,这可能是鲤科鱼相较于鳅科鱼下行率高的原因。
3.2 不同放鱼位置对幼鱼下行率的影响松新电站的鱼道和补水通道的进水口是紧邻且前后排列。S1、S2和S3放鱼点位置分别位于补水通道进水口附近、鱼道进水口与补水通道进水口之间和鱼道进水口附近。本研究发现在S1和S2位置的下行成功尾数大于S3放鱼点(图 6)。不同放鱼点鱼类下行率存在差异的主要原因可能是鱼类感知不同位置加速流的行为反应不一样。放鱼位置S1和S2位于补水通道进水口附近,鱼类能有效地感知到进水口前的吸引流并准确定位下行通道入口顺利下行,相反放鱼位置S3远离补水通道进水口且临近鱼道进水口,具有下行需求的幼鱼因体长范围小,感知流速范围有限[23],作为鱼类在河流中下行过程中的必经之路,鱼类受鱼道进水口流场干扰难以准确定位下行通道入口,导致在放鱼位置S3放鱼时,4种鱼的下行尾数明显减少。对于本实验工况而言,由幼鱼下行成功概率预测列线图得知放鱼位置S2(得分为18.7分)的得分超出S3(得分为0分)18.7分,对应的下行成功概率将增加14.4 %。综上所述,鱼类能否准确定位下行通道入口是鱼类能否下行的关键因素,工程中可以适当采用声、光及气泡幕等诱趋鱼手段辅助鱼类定位下行通道入口以增加幼鱼下行成功概率。与此同时,在补水通道进水口前布置物理导鱼栅设施,该设施不影响水电站的运行,水头损失较小,并且不会对通道进水口的水流条件产生影响[24]。此设施主要利用水流遇到导鱼栅产生次生流[25],引导幼鱼沿着导鱼栅的栅条移动,顺利找到下行通道的入口。
3.3 河道流量对幼鱼下行率的影响流量常被认为是天然河流中影响幼鱼下行行为的主导因素[26]。本研究发现河道流量对目标鱼下行率有显著影响(P < 0.05),且目标鱼的下行率随着河道流量的增大而降低,此结果与Raymond等[27]发现大鳞大麻哈鱼(Oncorhynchus tshawytscha)幼鱼下行效率与流量呈正相关趋势的结论不一致。导致结果产生差异的主要原因可能是实验区域的工程布置方式存在差异性。大鳞大麻哈鱼幼鱼只有一个下行通道口,障碍物上游来流量增加,下行通道的流量也会同步增加。松新电站为日调节引水式电站,坝址上游河道右岸为引水渠,而补水通道和鱼道位于河道左岸。为了同时满足生态效益及经济效益,通过闸门控制补水通道下泄的日平均生态流量为5.27~7.34 m3/s,而上游来流流量最大可达23.39 m3/s,基于不漫坝的原则,当上游河道流量增加时,河道大部分流量进入引水渠用于发电,其发电流量随上游河道流量的增大而增大,补水通道进水口流量虽有增多,但占河道总流量的比例反而减小。当更高比例的水流被分配至引水渠时,幼鱼易被主流挟带进入引水渠,对补水通道进水口的感知能力也会减弱[28];Calles等也发现相似的现象,当上游河道来流增大、更高比例的水流被分配到主流区时,鳗鲡(Anguilla japonica)幼鱼会对主流区的感知能力提高,以更快的速度挟带进入主流区[29],这导致目标鱼下行率并没有随着流量的增加而增加。对于本实验工况而言,由幼鱼下行成功概率预测列线图得知,当上游河道流量每减小0.5 m3/s时,其下行成功概率将增加8.0 %,故河道流量调控同样是促使幼鱼成功下行的关键因素。因此在满足梯级水电站运行以及水生生物生存的情况下,可以适当加强松新电站上游的公德房水电站下泄流量监控,在保证经济效益与生态效益均满足的条件下提高幼鱼下行过坝的效率。
3.4 水温对幼鱼下行率的影响水温是影响鱼类游泳行为的重要环境因子[30]。小鲑鱼在水温梯度为3.50~19.58℃范围内下行洄游时,其下行数量与水温呈正相关趋势[31],本研究结果与该结论相吻合。水温主要是通过代谢率影响鱼类的游泳能力[32],如齐口裂腹鱼(Schizothorax prenanti)幼鱼的游泳能力在水温区间为15~23℃时呈上升趋势,24℃之后,其游泳能力显著下降[33],在适宜的水温区间内,水温升高鱼的活性及游泳能力均会增加,从而促使鱼类快速下行[34-35]。本研究监测期间的水温梯度为17.5~20.5℃,在此温度区间内,幼鱼下行成功率与水温呈正相关趋势,若水温超过适宜鱼类生长发育的温度范围,鱼类对水温的敏感性也会增加,如拉萨裂腹鱼(Racoma waltoni)幼鱼在水温低于25℃的条件下,活动正常,当水温每增加1℃时,部分鱼反应激烈,频繁游动[36]。超过最适水温后,水温继续升高使幼鱼产生较强的敏感反应,这可能导致幼鱼逃离下行通道,产生延迟效应[37],因此本研究的水温区间可能比较适宜鱼类下行。
辅助鱼类下行过坝的关键在于解析鱼类下行过程中应对河道复杂水流环境的游泳机理,这是一个复杂且系统性的研究工作。本文是研究工作的第一步,旨在解决了幼鱼是否可以通过补水通道顺利下行的问题,未来仍需要关注河道及补水通道内部水文情势变化下,鱼类下行过程中响应复杂流场和环境场如何游泳的问题,这将为梯级小水电背景下的河流连通性修复、水库调度方案和下行过鱼设施优化设计提供理论依据。
4 结论与建议本研究在金沙江下游支流黑水河松新水电站补水通道针对两种鲤科鱼类(棒花鱼、短须裂腹鱼)幼鱼和两种鳅科鱼类(短体副鳅、红尾副鳅)幼鱼各放鱼90尾,定量分析鱼种、目标与体长、水体透明度、放鱼位置、流量、水温、水位等因素对鱼类下行效率的影响。研究结论及建议如下:
1) 棒花鱼、短须裂腹鱼、短体副鳅、红尾副鳅的下行率依次为22.22 % (20尾)、28.89 % (26尾)、8.89 % (8尾)、15.56 % (14尾)。
2) 通过构建二元Logistic回归模型识别出影响鱼类下行效率的关键因子,并基于AIC准则筛选出最优模型,以放鱼位置、鱼种、上游河道水温和上游河道流量为自变量的模型最优。
3) 基于模型结果得知,鱼类下行成功率与上游河道水温呈正相关趋势,放鱼点距离补水通道入口的距离和上游河道流量与鱼类下行成功率呈负相关趋势。
4) 由幼鱼下行成功概率预测列线图得知放鱼位置S2(得分为18.7分)的得分超出S3(得分为0分)18.7分,对应的下行成功概率将增加14.4 %;上游河道流量每减小0.5 m3/s时,其下行成功概率将增加8.0 %。
对于本实验而言,为了避免幼鱼进入引水渠发生大量伤亡及幼鱼迷失方向,建议在补水通道进水口前布置导鱼栅、声、光及气泡幕等对鱼类不造成损伤的非结构性诱趋鱼措施,引导幼鱼顺利且快速定位下行通道的入口,提高幼鱼的下行效率。其次在鱼道进水口附近布置驱鱼措施以防止下行鱼类误入鱼道,辅助鱼类顺利下行。最后,在满足梯级水电站运行以及水生生物生存的情况下,建议加强松新电站上游的公德房水电站以及补水通道下泄流量监控,在保证经济效益与生态效益均满足的条件下提高幼鱼下行过坝的效率。
致谢: 感谢三峡大学水利与环境学院湖北省鱼类过坝技术国际科技合作基地提供技术支撑;感谢中国三峡建工(集团)有限公司提供黑水河鱼类栖息地修复场地;感谢团队的老师和博士们对文章提供的建议。
| [1] |
Yang Z, Gong Y, Dong C et al. Fish resource status of the lower reaches of the Heishui River and the measures for their conservation. Resources and Environment in the Yangtze Basin, 2017, 26(6): 847-855. [杨志, 龚云, 董纯等. 黑水河下游鱼类资源现状及其保护措施. 长江流域资源与环境, 2017, 26(6): 847-855. DOI:10.11870/cjlyzyyhj201706007] |
| [2] |
Zhou LZ, Wang WL, Xu XL et al. Optimal scheduling of cascaded multi-hydropower stations based on ecological punishment. Journal of Hydroelectric Engineering, 2015, 34(7): 45-56. [周李智, 王万良, 徐新黎等. 基于生态惩罚的混联梯级小水电群优化调度. 水力发电学报, 2015, 34(7): 45-56. DOI:10.11660/slfdxb.20150706] |
| [3] |
Aarestrup K, Baktoft H, Thorstad EB et al. Survival and progression rates of anadromous brown trout kelts Salmo trutta during downstream migration in freshwater and at sea. Marine Ecology Progress Series, 2015, 535: 185-195. DOI:10.3354/meps11407 |
| [4] |
Shane KD, Page KS, Pritt JJ et al. Season and discharge predict downstream emigration rates for reservoir sport fish populations. North American Journal of Fisheries Management, 2021, 41(6): 1798-1811. DOI:10.1002/nafm.10700 |
| [5] |
Pavlov DS, Mikheev VN. Downstream migration and mechanisms of dispersal of young fish in rivers. Canadian Journal of Fisheries and Aquatic Sciences, 2017, 74(8): 1312-1323. DOI:10.1139/cjfas-2016-0298 |
| [6] |
Knott J, Mueller M, Pander J et al. Seasonal and diurnal variation of downstream fish movement at four small-scale hydropower plants. Ecology of Freshwater Fish, 2020, 29(1): 74-88. DOI:10.1111/eff.12489 |
| [7] |
Huusko R, Hyvärinen P, Jaukkuri M et al. Survival and migration speed of radio-tagged Atlantic salmon (Salmo salar) smolts in two large rivers: One without and one with dams. Canadian Journal of Fisheries and Aquatic Sciences, 2017, 75(8): 1177-1184. |
| [8] |
Otero J, Labee Lund JH, Castro-Santos T et al. Basin-scale phenology and effects of climate variability on global timing of initial seaward migration of Atlantic salmon (Salmo salar). Global Change Biology, 2014, 20(1): 61-75. DOI:10.1111/gcb.12363 |
| [9] |
Li M, Zhu HF, Jin ZJ et al. The effect of accelerating flow on swimming behavior of juvenile aristichthys nobilis and Hypophthalmichthys molitrix during downstream migration. Acta Hydrobiologica Sinica, 2018, 42(3): 571-577. [李敏讷, 朱海峰, 金志军等. 加速流对鲢、鳙幼鱼下行过程中游泳行为的影响. 水生生物学报, 2018, 42(3): 571-577. DOI:10.7541/2018.071] |
| [10] |
Wang L, Wang Y, Lin CY et al. Effect of accelerating flow on downstream migration behaviors of juvenile grass carps of different body lengths. Journal of Hydroelectric Engineering, 2019, 38(12): 40-48. [望磊, 王煜, 林晨宇等. 加速流对不同体长草鱼幼鱼下行行为的影响. 水力发电学报, 2019, 38(12): 40-48.] |
| [11] |
Yang Z, Tang HY, Tao JP et al. The effect of cascaded huge dams on the downstream movement of Coreius guichenoti (Sauvage & Dabry de Thiersant, 1874) in the upper Yangtze River. Environmental Biology of Fishes, 2017, 100(11): 1507-1516. DOI:10.1007/s10641-017-0661-7 |
| [12] |
Li ZM, Zhu DZ, Yang SR. Design of fishway for Songxin hydropower station on Heishui River. Small Hydro Power, 2020(4): 33-37. [李志敏, 朱冬舟, 杨少荣. 黑水河松新电站鱼道设计. 小水电, 2020(4): 33-37. DOI:10.3969/j.issn.1007-7642.2020.04.011] |
| [13] |
丁瑞华. 四川鱼类志. 成都: 四川科学技术出版社, 1994.
|
| [14] |
Wang YM, Ke SF, Lin CY et al. Investigation of the swimming ability of typical fish in the Red River (Yuanjiang) basin and its application to the design of fish passage facilities. J Lake Sci, 2021, 33(6): 1820-1831. [王永猛, 柯森繁, 林晨宇等. 红河(元江)流域的典型鱼类游泳能力探究及在过鱼设施流速设计中的应用. 湖泊科学, 2021, 33(6): 1820-1831. DOI:10.18307/2021.0620] |
| [15] |
Cai L, Katopodis C, Johnson D et al. Case study: Targeting species and applying swimming performance data to fish lift design for the Huangdeng Dam on the upper Mekong River. Ecological Engineering, 2018, 122: 32-38. DOI:10.1016/j.ecoleng.2018.07.023 |
| [16] |
Teng H, Tian HW, Liu HW et al. Fish resources status in Heishui River, a tributary of the lower reaches of Jinsha River. Chinese Journal of Ecology, 2021, 40(5): 1499-1511. [滕航, 田辉伍, 刘寒文等. 金沙江下游支流黑水河鱼类资源现状. 生态学杂志, 2021, 40(5): 1499-1511. DOI:10.13292/j.1000-4890.202105.016] |
| [17] |
Han MS. Transparency of freshwater aquaculture water body and its reference significance in production. Fisheries Sicence & Technology Information, 1985, 12(5): 9-10. [韩茂森. 淡水养殖水体的透明度及其在生产上的参考意义. 水产科技情报, 1985, 12(5): 9-10.] |
| [18] |
Tao Y, Shi XT, Zhang J et al. Monitoring and analysis of fish passage efficiency by full duplex RFID technology. Journal of Hydroecology, 2021, 42(4): 84-90. [陶宇, 石小涛, 张健等. 全双工射频识别技术的过鱼效果监测与分析. 水生态学杂志, 2021, 42(4): 84-90. DOI:10.15928/j.1674-3075.202008280246] |
| [19] |
Song YQ, Cheng BX, Hu W. Quantitative analysis of conservation priority for fish species in Heishui River. Journal of Hydroecology, 2018, 39(6): 65-72. [宋一清, 成必新, 胡伟. 黑水河鱼类优先保护次序的定量分析. 水生态学杂志, 2018, 39(6): 65-72. DOI:10.15928/j.1674-3075.2018.06.010] |
| [20] |
Johnson K, Wait LE, Monk SK et al. Effects of substrate on movement patterns and behavior of stream fish through culverts: An experimental approach. Sustainability, 2019, 11(2): 470. DOI:10.3390/su11020470 |
| [21] |
危起伟. 长江上游珍稀特有鱼类国家级自然保护区科学考察报告. 北京: 科学出版社, 2012.
|
| [22] |
Chen MX, Kang ZJ. Experimental study on swimming ability of endemic fish in the upper reaches of Yangtze River. Gansu Water Resources and Hydropower Technology, 2020, 56(7): 58-61. [陈明曦, 康昭君. 长江上游特有鱼类的游泳能力实验研究. 甘肃水利水电技术, 2020, 56(7): 58-61. DOI:10.19645/j.issn2095-0144.2020.07.016] |
| [23] |
Boulogne LH, Wolf BJ, Wiering MA et al. Performance of neural networks for localizing moving objects with an artificial lateral line. Bioinspiration & Biomimetics, 2017, 12(5): 056009. DOI:10.1088/1748-3190/aa7fcb |
| [24] |
Rose BP, Mesa MG, Barbin-Zydlewski G. Field-based evaluations of horizontal flat-plate fish screens. North American Journal of Fisheries Management, 2008, 28(6): 1702-1713. DOI:10.1577/M07-073.1 |
| [25] |
Zhu HF, Liu L, Lu B et al. A review of fish passage facilities for downstream migrants. Journal of Yangtze River Scientific Research Institute, 2015, 32(10): 33-37. [朱海峰, 刘流, 路波等. 鱼类下行过坝相关工程措施综述. 长江科学院院报, 2015, 32(10): 33-37.] |
| [26] |
Rochard E, Lepage M, Dumont P et al. Downstream migration of juvenile European sturgeon Acipenser sturio L. Estuaries, 2001, 24(1): 108-115. DOI:10.2307/1352817 |
| [27] |
Raymond HL. Migration rates of yearling Chinook salmon in relation to flows and impoundments in the Columbia and snake rivers. Transactions of the American Fisheries Society, 1968, 97(4): 356-359. DOI:10.1577/1548-8659(1968)97[356:MROYCS]2.0.CO;2 |
| [28] |
Haro A, Odeh M, Noreika J et al. Effect of water acceleration on downstream migratory behavior and passage of Atlantic salmon smolts and juvenile American shad at surface bypasses. Transactions of the American Fisheries Society, 1998, 127(1): 118-127. DOI:10.1577/1548-8659(1998)127<0118:EOWAOD>2.0.CO;2 |
| [29] |
Calles O, Elghagen J, Nyqvist D et al. Efficient and timely downstream passage solutions for European silver eels at hydropower dams. Ecological Engineering, 2021, 170: 106350. DOI:10.1016/j.ecoleng.2021.106350 |
| [30] |
Nathanailides C, Paschos I, Tsoumani M et al. Capacity for thermal acclimation and winter mortality of sea bass Dicentrarchus labrax in freshwater earthen ponds. Italian Journal of Zoology, 2010, 77(1): 23-28. DOI:10.1080/11250000802676423 |
| [31] |
Orell P, Erkinaro J, Svenning MA et al. Synchrony in the downstream migration of smolts and upstream migration of adult Atlantic salmon in the subarctic River Utsjoki. Journal of Fish Biology, 2007, 71(6): 1735-1750. DOI:10.1111/j.1095-8649.2007.01641.x |
| [32] |
Lehman B, Huff DD, Hayes SA et al. Relationships between Chinook salmon swimming performance and water quality in the San Joaquin River, California. Transactions of the American Fisheries Society, 2017, 146(2): 349-358. DOI:10.1080/00028487.2016.1271827 |
| [33] |
Cai L, Liu GY, Taupier R et al. Effect of temperature on swimming performance of juvenile Schizothorax prenanti. Fish Physiology and Biochemistry, 2014, 40(2): 491-498. DOI:10.1007/s10695-013-9860-0 |
| [34] |
Cooke SJ, Grant EC, Schreer JF et al. Low temperature cardiac response to exhaustive exercise in fish with different levels of winter quiescence. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2003, 134(1): 157-165. DOI:10.1016/S1095-6433(02)00240-4 |
| [35] |
Hasler CT, Suski CD, Hanson KC et al. Effect of water temperature on laboratory swimming performance and natural activity levels of adult largemouth bass. Canadian Journal of Zoology, 2009, 87(7): 589-596. DOI:10.1139/z09-044 |
| [36] |
He LQ, Wang WL, Zeng BH et al. The study on the temperature tolerance of different sizes of Schizothorax waltoni. Acta Hydrobiologica Sinica, 2020, 44(6): 1230-1238. [何林强, 王万良, 曾本和等. 不同规格拉萨裂腹鱼温度耐受性研究. 水生生物学报, 2020, 44(6): 1230-1238.] |
| [37] |
Venditti DA, Rondorf DW, Kraut JM. Migratory behavior and forebay delay of radio-tagged juvenile fall Chinook salmon in a lower snake river impoundment. North American Journal of Fisheries Management, 2000, 20(1): 41-52. DOI:10.1577/1548-8675(2000)0200041:MBAFDO>2.0.CO;2 |
 2023, Vol. 35
2023, Vol. 35 


 (Hemiculter leucisculus)
(Hemiculter leucisculus)