(2: 中国科学院大学, 北京 100049)
(2: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
浮游植物作为初级生产者,在湖泊生态系统中扮演着非常重要的角色,其生长量和群落结构受到水环境的直接影响,对所处环境变化十分敏感[1],以浮游植物作为评价水质污染及营养水平的生物监测指标方法在国内外均已被广泛采用且有成效[2-3]。浮游植物的生长繁殖和群落结构受到多种环境因素的综合影响,其中营养、水温和光照强度是浮游植物群落演替的主要驱动因子[4-5]。同时浮游植物群落的动态变化也受到浮游动物牧食和鱼类捕食的影响[6-7]。据此,探讨生物因素和非生物因素对浮游植物群落演替的影响,以期更好地预测浮游植物对环境变化的响应。
浮游植物功能群是由具有相似功能特征的物种组成的,它们对环境变化做出反应,并对水生生态系统功能产生类似的影响[8-10]。与传统的分类方法相比,功能群分类法更容易评估浮游植物对环境变化的潜在响应[8, 11-12]。一方面,浮游植物功能群与环境因子间的关系很明显[13],从具有某些功能特征的优势藻类可以预测与浮游植物群落分布显著相关的环境因子[14]。另一方面,功能群分类法是将具有相似生态关系的多个物种划分成具有明确功能特征的一个组,可以简化对浮游植物的分类[11]。这种方法被广泛用于评估温带、热带和亚热带湖泊中环境因子与浮游植物功能群演替之间的关系[15-18]。因此,浮游植物功能群对了解水生态系统的水质、食物网结构和功能具有重要意义。
洱海是中国西南高原第二大淡水湖, 湖泊海拔高,太阳辐射大[19]。1990s以前该湖水质较好,污染较少,是个大型寡营养湖。1990s随着水质恶化,浮游植物群落结构发生了较大的变化,在夏秋季,蓝藻成为浮游植物群落的主要组成类群。2000年以来,微囊藻成为夏秋季优势种[20-21]。近年来,该湖浮游植物以蓝藻门(如鱼腥藻、颤藻和微囊藻等)和硅藻门(脆杆藻和星杆藻等)为主[22]。此外,洱海中最常见的浮游动物为大型枝角类(如盔形溞Daphnia galeata)、小型枝角类(如长额象鼻溞Bomina longirostris、圆形盘肠溞Chydorus sphaericus和方形网纹溞Cerioaphnia quadrangula),桡足类主要为无节幼体和剑水蚤幼体[23]。其中,在冬季和春季,大型枝角类是浮游动物的优势种,而在夏季和秋季,浮游动物优势类群为小型枝角类和桡足类[23-24]。
尽管此前在洱海研究了浮游植物功能群的演替规律及其影响因素[15-16, 22, 25]。但是,浮游动物牧食(下行效应)在浮游植物群落演替中的重要性一直被忽视。目前为止,洱海浮游动物对浮游植物功能群的作用尚不清楚。因此,本研究的目的是研究浮游植物功能群的演替模式及其与生物因素和非生物因素间的关系,并确定水温、营养盐和浮游动物对浮游植物功能群的影响。
1 材料与方法 1.1 研究区概况及采样点设置洱海(25°36′~25°38′N,100°5′~100°18′E)位于云南省大理白族自治州境内,是云南省第二大高原淡水湖泊,湖面面积为252 km2,最大湖深为21.3 m,平均湖深10.6 m[26]。在1981年以前,洱海水质较好,污染程度较轻,属于贫-中营养型湖泊[26]。但随着经济社会的发展,洱海富营养化在1990s后急剧发展[27],1996年首次大规模暴发螺旋鱼腥藻水华,1998年再次发生以卷曲鱼腥藻为主的蓝藻水华[28],此后蓝藻水华在局部湖区时有发生。洱海水体的氮磷营养盐浓度逐年增加,湖泊调查显示,2008年洱海已处于富营养化水平[29]。总氮、总磷和化学需氧量上升,藻类密度增加,最终导致蓝藻水华的多次发生[28]。洱海水质受到社会经济高速发展和气候变暖的双重压力,较长的雨季(5-10月)导致洱海暴雨径流污染严重,而夏季的风速最小也有利于蓝藻水华的暴发[30]。
本研究从2018年1月2020年12月对洱海全湖进行逐月采样,逐月对浮游动植物样品进行采集并同时监测水体理化指标。将全湖分成北、中、南3个区域,分别设置3个样点,为S1~S3、S4~S6、S7~S9(图 1)。

|
图 1 洱海采样点示意 Fig.1 The schematic of Lake Erhai sampling sites |
使用Patalas's采水器(5 L)分别采集离表层0.5 m,中层和离底层0.5 m处的水样,随后混合均匀用于后续测定。取1 L混合水样加入10~15 mL鲁哥试剂固定,静置48 h抽出上清液,浓缩至50 mL作为浮游植物定量样品。现场使用YSI Professional Plus水质分析仪测定的指标有:水温(WT)、酸碱度(pH)、溶解氧(DO)、电导率(EC)、总溶解性固体(TDS)、氧化还原电位(ORP)。透明度(SD)使用塞氏盘法测定,塞氏盘直径为20 cm。实验室内测定的理化指标有:总氮(TN)、可溶性总氮(TDN)、总磷(TP)、可溶性总磷(TDP)、硝态氮(NO3--N)、氨氮(NH3-N)、正磷酸盐(PO43--P)及叶绿素a(Chl.a),测定方法参考《水和废水监测分析方法(第四版)》[31];N/P为总氮与总磷的比值。
为了确定洱海富营养化程度,用TP、Chl.a和SD的数据来计算卡尔森营养状态指数(TSI),计算公式为:
| $ { TSI }(\text { Chl. } a)=9.81 \ln (\text { Chl. } a)+30.6 $ | (1) |
| $ {TSI}(\mathrm{TP})=14.42 \ln (\mathrm{TP})+4.15 $ | (2) |
| $ {TSI}(\mathrm{SD})=60-14.41 \ln (\mathrm{SD}) $ | (3) |
TSI(Σ)指数范围为0~100,0~30为贫营养,30~50为中营养,50~70为富营养,70~100为高富营养。同一营养状态下,TSI值越高,其营养程度越重。
1.3 浮游动植物鉴定与功能群划分浮游植物密度(phytoplankton abundance, PA)和生物量(phytoplankton biomass, PB)的测定方法参照《淡水浮游生物研究方法》[32]。浮游植物种类鉴定参照《中国淡水藻类—系统、分类及生态》[33],并按照FG功能群系统[11-12]中的分类对样品进行浮游植物功能群划分。在本研究中,由于浮游植物功能群分类较多,部分功能群只含有一种浮游植物,且只在少数点位或月份出现,密度和生物量也较低,不足以代表整个功能群,也不便分析统计,故将各月相对生物量>5 % 的功能群定义为优势功能群[34-36],其中优势功能群在采样中的出现频率>10 % 则定义为主要优势功能群。
浮游甲壳动物密度(zooplankton abundance, ZA)和生物量(zooplankton biomass, ZB)的测定方法参照《中国动物志(淡水桡足类)》[37]和《中国动物志(淡水枝角类)》[38]。在显微镜下用测微尺量出浮游动物的大小,根据体积公式求得体积并计算出生物量[32]。同时以浮游动物生物量与密度的比值(ZB/ZA)来对浮游动物的体型大小进行比较。
1.4 数据处理使用Canoco for Windows 5.0软件对浮游生物数据和环境数据进行排序分析。浮游植物功能群数据采用生物量数据。根据去趋势对应分析(detrended correspondence analysis,DCA)结果:排序轴 < 3.0,选择冗余分析(redundancy analysis,RDA)分析浮游植物功能群与环境因子间的关系,并对所选环境因子进行置换检验,以保证环境因子对浮游植物有较好的解释,分析结果采用功能群—环境因子双序图表示。在R 4.2.1软件(vegan包“varpart”函数)中使用变差分解分析(variance partitioning analysis,VPA)探明水体理化因子(上行效应)和浮游动物丰度(下行效应)对浮游植物功能群的影响。在SPSS 25.0软件中应用单因素方差分析(ANOVA)方法、聚类分析对数据进行分析。所有数据除pH外均经过log(x+1)转换后进行后续分析。
2 结果 2.1 浮游植物功能群划分调查期间,在洱海共镜检鉴定出浮游植物7门96属,包括蓝藻门、绿藻门、硅藻门、甲藻门、隐藻门、裸藻门和金藻门。根据FG功能群分类法,洱海浮游植物可划分出27个功能群,其中B、H1、Lo、M、P、S1、T、Y 8个功能群为主要优势功能群(附表Ⅰ)。
2.2 浮游植物功能群密度及生物量的时间变化浮游植物功能群相对密度和生物量的变化趋势如图 2所示。功能群S1、H1、M和P是影响洱海浮游植物密度的主要因子。其中,功能群S1、H1的代表藻均为丝状蓝藻,如假鱼腥藻、浮丝藻和长孢藻等;功能群M的代表藻为微囊藻,而功能群P的代表藻为脆杆藻。洱海的浮游植物生物量主要由功能群P和其他功能群(B、C、D、T、Y、Lo)贡献,其中代表藻如小环藻、脆杆藻、星杆藻、沟链藻等,均属于硅藻门。
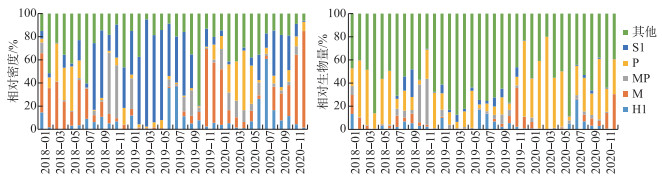
|
图 2 洱海浮游植物功能群相对密度及生物量的时间变化 Fig.2 Temporal variation of the abundance and biomass of phytoplankton functional groups in Lake Erhai |
对洱海浮游植物优势功能群密度数据进行聚类分析,可将整个演替过程划分成3个由不同功能群主导的时期(S期、M期和P期)(图 3)。其中,S期是以S1+H1功能群(假鱼腥藻、浮丝藻、长孢藻等丝状蓝藻)为优势藻的阶段,为期18个月;M期是以M功能群(微囊藻)为优势藻的阶段,为期10个月;P期是以P+M功能群(脆杆藻和微囊藻)为优势藻的阶段,为期8个月。

|
图 3 浮游植物群落结构聚类图 Fig.3 Cluster analysis of the abundance of phytoplankton functional groups in Lake Erhai |
研究期间,除NO3--N、NH3-N、ORP、N/P外,3个时期的其余理化因子均表现出一定差异(附图Ⅰ)。WT、TP、PO43--P、TDS、pH、DO和TSI指数在3个时期之间均显著差异(P < 0.05);SD和TN指标在S期和M期无明显差异(P>0.05),而与P期有显著差异(P < 0.05);TDN指标在M期和P期无明显差异(P>0.05),而在M期和S期有显著差异(P < 0.05);EC在S期和P期无明显差异(P>0.05),而在S期和M期有显著差异(P < 0.05);TDP在S期和M期有显著差异(P < 0.05)。从氮磷营养水平来看,S期富营养程度最高,其次为M期,P期的水质最好。
单因素方差分析结果显示(图 4),3个时期的Chl.a浓度和浮游植物密度(PA)均有显著差异(P < 0.05),且S期>M期>P期;浮游动植物生物量(PB、ZB)在3个时期均无差异(P>0.05);S期、M期的浮游动物密度显著高于P期(P < 0.05)。此外,浮游动物个体大小指标(ZB/ZA)在3个时期均有差异(P < 0.05),且P期>M期>S期。

|
图 4 洱海3个时期浮游生物指标的差异比较(不同字母表示差异显著(P < 0.05)) Fig.4 Analysis of differences in biological variables over three periods in Lake Erhai (Different letters indicate different significances (P < 0.05)) |
运用RDA方法分别对3个时期的浮游植物生物量与环境和生物变量间的关系进行分析(图 5)。在S期,与优势功能群生物量相关的因子主要有TSI、ZA、ZB/ZA、WT和pH。功能群S1、H1和M与TSI、ZA、WT和pH呈显著正相关,与ZB/ZA呈显著负相关。在M期,优势功能群生物量主要受WT、TP、TDP和TSI的影响。功能群M与TP、TDP和TSI呈显著正相关;功能群H1和S1与WT呈显著正相关。在P期,WT、EC、ZA、ZB、ZB/ZA、TSI是影响优势功能群生物量的主要因子。功能群P、M与ZA、ZB和ZB/ZA呈显著正相关,与WT、EC和TSI呈显著负相关。

|
图 5 浮游植物优势功能群与主要环境因子的RDA分析 Fig.5 RDA analysis of phytoplankton functional groups with environmental and biological variables |
进一步对浮游植物数据和环境因子进行变差分解(VPA)(图 6)显示,总体上看,洱海上行效应因子(如WT、TP、TSI等)单独对浮游植物群落变化的解释率显著高于下行效应因子(如枝角类、桡足类),其中,在M期和P期,下行作用几乎可以忽略。

|
图 6 上、下行效应对浮游植物群落影响的变差分解 Fig.6 The Venn figures for variation partitioning of phytoplankton community affected by Bottom-up and top-down effects |
浮游植物群落结构的演替是众多环境因子相互影响的结果[39],水温、氮、磷、DO、电导率、TDS等多种水体理化指标以及浮游动物牧食都会对浮游植物群落结构产生直接或间接的影响[16, 39-40]。研究发现洱海常见的浮游植物功能群主要为M、P、H1和S1,表明洱海为混合水体且营养水平较高[11, 40-41]。此外,根据浮游植物功能群密度数据的聚类分析结果,可将洱海浮游植物群落结构划分为3个由不同优势功能群主导的时期(S期、P期、M期)。
S期是以功能群S1、H1占优势的时期,功能群的代表性藻类为假鱼腥藻、浮丝藻及长孢藻等丝状蓝藻,主要生活在中-富营养化水体,在强光、高温及营养盐充足的情况下能大量繁殖[42]。M期是以功能群M占优势的时期,功能群的代表性藻类为微囊藻。P期是以功能群P、M占优势的时期,功能群的代表性藻类为脆杆藻及微囊藻。从RDA结果看,TSI、WT、TP和pH是影响这3个时期优势功能群演替的关键因子。
水温通过影响浮游藻类的新陈代谢对浮游植物群落结构产生影响,是影响浮游植物密度及生物量的关键因子[43]。通过对影响浮游植物功能群的环境因子分析可以得知,水温在整个演替过程中(包括S期、M期、P期)均为显著环境因子,因此水温是促进洱海浮游植物生长的最关键因素,这在前人的研究中也得到验证[43-44]。不同的浮游植物的最适生长温度不同,与硅藻和绿藻相比,蓝藻更喜高温[12, 45]。水温差异为功能群的季节性变化提供了条件,以蓝藻为主的功能群能在整个演替过程均占一定优势;以硅藻为主的功能群P在水温更低的春、冬季成为优势功能群。有研究表明,丝状蓝藻的最适生长温度要低于微囊藻。而张涛等[46]调查发现,微囊藻的暴发发生在温度较低的滇中地区湖泊,但温度更高的滇南地区湖泊的优势种为丝状蓝藻,其认为水温不是导致以蓝藻占据绝对优势的湖泊中浮游植物组成差异的原因。研究期间,S期水温((19.5±4.6)℃)显著高于M期((16.9±5.0)℃)(P < 0.05),因此水温是促进浮游植物生长的关键因子,但不是导致S期以丝状蓝藻占优和M期以微囊藻占优现象差异的主要原因。
营养也是影响浮游植物功能群生长的关键因素。氮、磷作为浮游植物生长的重要营养元素[47],其利用有效性通常会影响浮游植物的数量[48]。RDA分析显示,多数优势功能群与TP呈显著正相关,且TP的相关性强于TN,表明TP是洱海浮游植物生长的限制因子。这与洱海为磷限制湖泊的研究结果一致[49]。因此,水体营养物质的增加导致偏好高营养物质的功能群(S1、H1和M等)数量大幅增加,这与杨洪允等[49]的发现一致。此外,RDA结果也表明,TSI在3个时期都是浮游植物优势功能群的关键驱动因素,TSI指数是根据TP、SD和Chl.a计算的,反映了水体的富营养化,其与优势功能群的显著正相关在一定程度上反映了TP和SD对浮游植物生长的影响。
对3个时期的浮游动物指标进行差异比较可知,以丝状蓝藻为主的S期的浮游动物密度最高且体型最小(图 4),同时RDA分析结果显示,浮游动物与S期的浮游植物生物量呈显著负作用。此前大量研究表明,大多数浮游动物以丝状藻类为食[50-52],Fulton[50]的摄食实验证明浮游动物对丝状藻类的选择在很大程度上与浮游动物的体型大小无关,其中,体型较小的枝角类(Bosmina longirostris)对丝状藻类的选择性最强。这与本研究的结果一致。Leitão等[52]也证明桡足类能将丝状蓝藻的长度缩短约70 %,因此浮游动物可能在洱海丝状蓝藻水华期间发挥着缩短丝状蓝藻长度的重要作用,但由于浮游动物的密度很低[53],其对浮游植物生物量降低的作用很弱(图 6)。此外,在本研究中,浮游动物对M期(以微囊藻群体为主)浮游植物功能群生物量的作用不明显。通常情况下,蓝藻会产生一种或多种的毒性或抑制性代谢物(如微囊藻毒素),它可以强烈地改变浮游动物的生理耐受性,从而使浮游动物牧食微囊藻的能力受到影响[54]。因此,这可以解释为什么浮游动物对以微囊藻群体为主的浮游植物功能群没有统计学影响。
4 结论1) 在洱海为期3年的调查中共发现27种浮游植物功能群,其中15种为优势浮游植物功能群。根据优势浮游植物功能群密度数据,可以将演替过程划分为3个由不同优势功能群主导的时期:S期(以S1和H1为优势功能群)、M期(以M为绝对优势功能群)和P期(以P和M为绝对优势功能群)。
2) 营养物质(主要是TP)和水温是洱海浮游植物群落变化的主要驱动因素,养分可利用性驱动了偏好高营养的浮游植物功能群的增加。
3) 在富营养化初期湖泊中,降低湖泊营养负荷是首要任务。同时可以考虑增加浮游动物丰度的策略,以增强浮游动物在削减丝状蓝藻或微囊藻生物量(下行效应)中的作用和重要性。
5 附录附表Ⅰ和附图Ⅰ见电子版(DOI: 10.18307/2023.0413)。
| 附表Ⅰ 洱海浮游植物功能群 Appendix Ⅰ Phytoplankton functional groups in Lake Erhai |

|
附图Ⅰ 洱海3个时期水环境指标的差异分析(不同字母表示差异显著(P < 0.05)) AttachedFig1 Analysis of differences in water environmental variables over three periods in Lake Erhai (Different letters indicate different significances (P < 0.05)) |
致谢: 本文的样品采集工作得到中国科学院水生生物研究所洱海实验基地龙德火、李鑫崎等师傅的帮助,浮游植物鉴定工作得到中国科学院水生生物研究所杨姣姣的指导,在此表示衷心感谢。
| [1] |
Jiang Y, Peng QZ, Liao JY et al. Advances and prospects for research into phytoplankton and river habitats. Resources Science, 2013, 35(3): 461-472. [江源, 彭秋志, 廖剑宇等. 浮游藻类与河流生境关系研究进展与展望. 资源科学, 2013, 35(3): 461-472.] |
| [2] |
Kofoid CA. The plankton of the Illinois River, 1894-1899, with introductory notes upon the hydrography of the Illinois River and its basin. Illinois Natural History Survey Bulletin, 1908, 8(1/2/3/4/5): 2-360. DOI:10.21900/j.inhs.v8.391 |
| [3] |
Gao SR, Pan LJ, Sun FY et al. Assessment on the pollution and eutrophication of environmental water by HydrobIologica. Environmental Science and Management, 2006, 31(6): 174-176. [高世荣, 潘力军, 孙凤英等. 用水生生物评价环境水体的污染和富营养化. 环境科学与管理, 2006, 31(6): 174-176. DOI:10.3969/j.issn.1673-1212.2006.06.053] |
| [4] |
Tian C, Pei HY, Hu WR et al. Variation of phytoplankton functional groups modulated by hydraulic controls in Hongze Lake, China. Environmental Science and Pollution Research, 2015, 22(22): 18163-18175. DOI:10.1007/s11356-015-4830-y |
| [5] |
Bohnenberger JE, Rodrigues LR, Da Motta-Marques D et al. Environmental dissimilarity over time in a large subtropical shallow lake is differently represented by phytoplankton functional approaches. Marine and Freshwater Research, 2018, 69(1): 95-104. DOI:10.1071/MF16417 |
| [6] |
Mao ZG, Gu XH, Cao Y et al. The role of top-down and bottom-up control for phytoplankton in a subtropical shallow eutrophic lake: Evidence based on long-term monitoring and modeling. Ecosystems, 2020, 23(7): 1449-1463. DOI:10.1007/s10021-020-00480-0 |
| [7] |
Rettig JE, Smith GR. Relative strength of top-down effects of an invasive fish and bottom-up effects of nutrient addition in a simple aquatic food web. Environmental Science and Pollution Research, 2021, 28(5): 5845-5853. DOI:10.1007/s11356-020-10933-7 |
| [8] |
Reynolds CS, Huszar V, Kruk C et al. Towards a functional classification of the freshwater phytoplankton. Journal of Plankton Research, 2002, 24(5): 417-428. DOI:10.1093/plankt/24.5.417 |
| [9] |
Salmaso N, Naselli-Flores L, Padisák J. Functional classifications and their application in phytoplankton ecology. Freshwater Biology, 2015, 60(4): 603-619. DOI:10.1111/fwb.12520 |
| [10] |
Kruk C, Devercelli M, Huszar VL. Reynolds functional groups: A trait-based pathway from patterns to predictions. Hydrobiologia, 2021, 848(1): 113-129. DOI:10.1007/s10750-020-04340-9 |
| [11] |
Padisák J, Crossetti LO, Naselli-Flores L. Use and misuse in the application of the phytoplankton functional classification: A critical review with updates. Hydrobiologia, 2009, 621(1): 1-19. DOI:10.1007/s10750-008-9645-0 |
| [12] |
Hu R, Lan YQ, Xiao LJ et al. The concepts, classification and application of freshwater phytoplankton functional groups. J Lake Sci, 2015, 27(1): 11-23. [胡韧, 蓝于倩, 肖利娟等. 淡水浮游植物功能群的概念、划分方法和应用. 湖泊科学, 2015, 27(1): 11-23. DOI:10.18307/2015.0102] |
| [13] |
Becker V, Huszar VLM, Crossetti LO. Responses of phytoplankton functional groups to the mixing regime in a deep subtropical reservoir. Hydrobiologia, 2009, 628(1): 137-151. DOI:10.1007/s10750-009-9751-7 |
| [14] |
Barrow J. Functional and taxonomic phytoplankton community responses to macrophyte abundance and nutrient loading in experimental ponds[Dissertation]. Montreal: McGill University, 2017.
|
| [15] |
Degefu F, Schagerl M. The phytoplankton community of tropical high-mountain crater Lake Wonchi, Ethiopia. Hydrobiologia, 2015, 755(1): 197-208. DOI:10.1007/s10750-015-2233-1 |
| [16] |
Cao J, Hou Z, Li Z et al. Succession of phytoplankton functional groups and their driving factors in a subtropical plateau lake. Science of the Total Environment, 2018, 631(631/632): 1127-1137. DOI:10.1016/j.scitotenv.2018.03.026 |
| [17] |
Wang H, Zhao DD, Chen L et al. Light, but not nutrients, drives seasonal congruence of taxonomic and functional diversity of phytoplankton in a eutrophic highland lake in China. Frontiers in Plant Science, 2020, 11: 179. DOI:10.3389/fpls.2020.00179 |
| [18] |
Estifanos GB, Gebre-Meskel DK, Hailu TF. Water quality parameters affect dynamics of phytoplankton functional groups in Lake Hawassa, Ethiopia. Limnologica, 2022, 94: 125968. DOI:10.1016/j.limno.2022.125968 |
| [19] |
Hu CL, Wang SR, Guo LG et al. Effects of the proximal factors on the diel vertical migration of zooplankton in a plateau meso-eutrophic Lake Erhai, China. Journal of Limnology, 2014, 73(2): 375-386. DOI:10.4081/jlimnol.2014.684 |
| [20] |
Zhen W, Wang YC, Hu MM et al. Succession of the phytoplankton community in response to environmental factors in north Lake Erhai during 2009-2010. Fresenius Environmental Bulletin, 2011, 20(9): 2221-2231. |
| [21] |
Yang JJ, Guo LG, Yin CJ et al. Preliminary evaluation of ecological effects of silver and bighead carps to control cyanobacterial blooms in the early eutrophication lakes. J Lake Sci, 2019, 31(2): 386-396. [杨姣姣, 过龙根, 尹成杰等. 富营养化初期湖泊放养鲢(Hypophthalmichthys molitrix)、鳙(Aristichthys nobilis)控藻生态效果的初步评估. 湖泊科学, 2019, 31(2): 386-396. DOI:10.18307/2019.0208] |
| [22] |
Yang YL, Guo LG, Yin CJ et al. Study on the seasonal succession of phytoplankton functional groups in the West Lake of Eryuan, Dali, Yunnan Province. Journal of Environmental Engineering Technology, 2023, 13(2): 625-631. [杨雅兰, 过龙根, 尹成杰等. 云南大理洱源西湖浮游植物功能群季节演替研究. 环境工程技术学报, 2023, 13(2): 625-631.] |
| [23] |
Yin CJ, He WC, Guo LG et al. Can top-down effects of planktivorous fish removal be used to mitigate cyanobacterial blooms in large subtropical highland lakes. Water Research, 2022, 218: 118483. DOI:10.1016/j.watres.2022.118483 |
| [24] |
Yang W, Deng DG, Zhang S et al. Seasonal dynamics of crustacean zooplankton community structure in Erhai Lake, a plateau lake, with reference to phytoplankton and environmental factors. Chinese Journal of Oceanology and Limnology, 2014, 32(5): 1074-1082. DOI:10.1007/s00343-014-3204-5 |
| [25] |
Dong J, Li GB, Song LR. Historical changes of phytoplankton functional groups in Lake Fuxian, Lake Erhai and Lake Dianchi since 1960s. J Lake Sci, 2014, 26(5): 735-742. [董静, 李根保, 宋立荣. 抚仙湖、洱海、滇池浮游藻类功能群1960s以来演变特征. 湖泊科学, 2014, 26(5): 735-742. DOI:10.18307/2014.0511] |
| [26] |
Pan HX, Wang YF, Dong YS. Factor analysis of eutrophication in Erhai Lake. J Lake Sci, 1999, 11(2): 184-188. [潘玺, 王云飞, 董云生. 洱海富营养化影响因素分析. 湖泊科学, 1999, 11(2): 184-188. DOI:10.18307/1999.021710.18307/1999.0217] |
| [27] |
Wang YF, Pan HX, Wu QL et al. Impacts of human activity on Erhai Lake and countermeasures. J Lake Sci, 1999, 11(2): 123-128. [王云飞, 潘红玺, 吴庆龙等. 人类活动对洱海的影响及对策分析. 湖泊科学, 1999, 11(2): 123-128. DOI:10.18307/1999.0206] |
| [28] |
张态. 洱海氮磷时空分布特征及其外源负荷研究[学位论文]. 云南: 大理学院, 2011.
|
| [29] |
Yang GS, Ma RH, Zhang L et al. Lake status, major problems and protection strategy in China. J Lake Sci, 2010, 22(6): 799-810. [杨桂山, 马荣华, 张路等. 中国湖泊现状及面临的重大问题与保护策略. 湖泊科学, 2010, 22(6): 799-810. DOI:10.18307/2010.0601] |
| [30] |
陈小华. 富营养化初期湖泊(洱海)的环境演变及营养物基准/标准研究[学位论文]. 上海: 华东师范大学, 2015.
|
| [31] |
国家环境保护总局, 水和废水监测分析方法编委会. 水和废水监测分析方法(第四版). 北京: 中国环境出版社, 2002: 88-284.
|
| [32] |
章宗涉, 黄祥飞. 淡水浮游生物研究方法. 北京: 科学出版社, 1991.
|
| [33] |
胡鸿钧, 魏印心. 中国淡水藻类: 系统、分类及生态. 北京: 科学出版社, 2006.
|
| [34] |
Du HC, Wang XN, Wu H et al. Community structure and functional groups of phytoplankton and water quality evaluation in the middle and lower Hanjiang River. Resources and Environment in the Yangtze Basin, 2021, 30(8): 1839-1847. [杜红春, 王晓宁, 吴虎等. 汉江中下游浮游植物群落结构、功能群特征及水质评价. 长江流域资源与环境, 2021, 30(8): 1839-1847. DOI:10.11870/cjlyzyyhj202108006] |
| [35] |
Zhang H, Peng YQ, Zou XN et al. Characteristics of phytoplankton functional groups and their relationships with environmental factors in Xinfengjiang Reservoir. China Environmental Science, 2022, 42(1): 380-392. [张辉, 彭宇琼, 邹贤妮等. 新丰江水库浮游植物功能分组特征及其与环境因子的关系. 中国环境科学, 2022, 42(1): 380-392. DOI:10.3969/j.issn.1000-6923.2022.01.040] |
| [36] |
Tang HJ, Liu PQ, Wu JL et al. Functional groups of phytoplankton and their responses to environmental factors in Hongchao River Reservoir, Guangxi. Journal of Hydroecology, 2022, 43(6): 85-91. [唐汇娟, 刘培钦, 伍洁丽等. 广西洪潮江水库浮游植物功能类群及其对环境因子响应. 水生态学杂志, 2022, 43(6): 85-91. DOI:10.15928/j.1674-3075.202105120145] |
| [37] |
沈嘉瑞. 中国动物志—节肢动物门甲壳纲桡足类. 北京: 科学出版社, 1979.
|
| [38] |
蒋燮治, 堵南山. 中国动物志(淡水枝角类). 北京: 科学出版社, 1979.
|
| [39] |
Jun S, Wang DB, Zhou JH et al. Community structures of phytoplankton and its relationship with environmental factors in the Lhasa River. Acta Ecologica Sinica, 2019, 39(3): 787-798. [君珊, 王东波, 周健华等. 拉萨河流域浮游植物群落结构特征及与环境因子的关系. 生态学报, 2019, 39(3): 787-798.] |
| [40] |
Li L, Li QH, Jiao SL et al. Spatial and temporal distribution characteristics of phytoplankton functional groups in aha reservoir and their influencing factors. Acta Scientiae Circumstantiae, 2015, 35(11): 3604-3611. [李磊, 李秋华, 焦树林等. 阿哈水库浮游植物功能群时空分布特征及其影响因子分析. 环境科学学报, 2015, 35(11): 3604-3611. DOI:10.13671/j.hjkxxb.2015.0031] |
| [41] |
Yang MZ, Xia JH, Cai WW et al. Phytoplankton functional groups and their correlation with environmental driving factors in a reservoir-type freshwater resource. Journal of Hydroecology, 2021. [杨萌卓, 夏继红, 蔡旺炜等. 饮用水源水库浮游植物功能群分布特征及环境驱动因子. 水生态学杂志, 2021.] |
| [42] |
Ge Y, Zhou YF, Wang CH et al. Succession patterns of phytoplankton functional groups in western area of Yangcheng Lake and their relationship with environmental factors. China Environmental Science, 2019, 39(7): 3027-3039. [葛优, 周彦锋, 王晨赫等. 阳澄西湖浮游藻类功能群演替特征及其与环境因子的关系. 中国环境科学, 2019, 39(7): 3027-3039. DOI:10.3969/j.issn.1000-6923.2019.07.040] |
| [43] |
Temponeras M, Kristiansen J, Moustaka-Gouni M. Seasonal variation in phytoplankton composition and physical-chemical features of the shallow Lake Doïrani, Macedonia, Greece. The Trophic Spectrum Revisited. Dordrecht: Springer Netherlands, 2000: 109-122. DOI:10.1007/978-94-017-3488-2_10
|
| [44] |
Wu WJ, Li GB, Li DH et al. Temperature may be the dominating factor on the alternant succession of aphanizomenon flos-aquae and Microcystis aeruginosa in Dianchi Lake. Fresenius Environmental Bulletin, 2010, 19(5): 846-853. |
| [45] |
Li Y, Zhou SL, Zhu Q et al. One-century sedimentary record of heavy metal pollution in western Taihu Lake, China. Environmental Pollution, 2018, 240: 709-716. DOI:10.1016/j.envpol.2018.05.006 |
| [46] |
Zhang T, Li YZ, Cai WT et al. The variation characteristics of water electronic conductivity and influence factors in Niyang River Basin. Journal of Arid Land Resources and Environment, 2018, 32(4): 126-131. [张涛, 李颖智, 蔡五田等. 尼洋河流域不同水体电导率变化特征及影响因素. 干旱区资源与环境, 2018, 32(4): 126-131.] |
| [47] |
Gou T, Xu ZC, Li J et al. Phytoplankton community structure and water quality assessment of Hejiang River, a branch of Xijiang River, Pearl River drainage basin. J Lake Sci, 2015, 27(3): 412-420. [苟婷, 许振成, 李杰等. 珠江流域西江支流贺江浮游藻类群落特征及水质分析. 湖泊科学, 2015, 27(3): 412-420. DOI:10.18307/2015.0307] |
| [48] |
Wang L, Wei W, Zhou P et al. Phytoplankton's community structure and its relationships with environmental factors in the rivers of Tongling City, Anhui Province of East China in winter. Chinese Journal of Applied Ecology, 2013, 24(1): 243-250. [王丽, 魏伟, 周平等. 铜陵市河流冬季浮游植物群落结构及其与环境因子的关系. 应用生态学报, 2013, 24(1): 243-250. DOI:10.13287/j.1001-9332.2013.0159] |
| [49] |
Yang HY, Zhou W, Qiao YM et al. Community structure of phytoplankton and its relationship with environmental factors in Erhai Lake. Environmental Science & Technology, 2021, 44(7): 123-132. [杨洪允, 周雯, 乔永民等. 洱海浮游植物群落结构及其与环境因子分析. 环境科学与技术, 2021, 44(7): 123-132.] |
| [50] |
Fulton RSI. Grazing on filamentous algae by herbivorous zooplankton. Freshwater Biology, 1988, 20(2): 263-271. DOI:10.1111/j.1365-2427.1988.tb00450.x |
| [51] |
Boyer J, Rollwagen BG, Bollens SM. Microzooplankton grazing before, during and after a cyanobacterial bloom in Vancouver Lake, Washington, USA. Aquatic Microbial Ecology, 2011, 64(2): 163-174. DOI:10.3354/ame01514 |
| [52] |
Leitão E, Panosso R, Molica R et al. Top-down regulation of filamentous cyanobacteria varies among a raptorial versus current feeding copepod across multiple prey generations. Freshwater Biology, 2021, 66(1): 142-156. DOI:10.1111/fwb.13625 |
| [53] |
Gao DC, Lv XJ, Yang SK et al. Study on the seasonal variation and current status of zooplankton in Erhai Lake. Environmental Science Survey, 2021, 40(2): 1-6. [高登成, 吕兴菊, 杨四坤等. 洱海浮游动物季节变化及现状研究. 环境科学导刊, 2021, 40(2): 1-6.] |
| [54] |
Ger KA, Hansson LA, Lürling M. Understanding cyanobacteria-zooplankton interactions in a more eutrophic world. Freshwater Biology, 2014, 59(9): 1783-1798. DOI:10.1111/fwb.12393 |
 2023, Vol. 35
2023, Vol. 35 

