近几十年来,湖泊富营养化已成为世界范围内一个突出的环境问题[1-3],其造成最大的问题是水华的大量暴发和水生植物群落的衰退乃至消亡,从而导致水体由草型清水态转变为藻型浊水态。大型水生植物,特别是沉水植物,不仅能吸收利用从而有效降低水体中氮、磷等营养盐水平,同时与藻类竞争营养盐进而抑制“藻华”的暴发[3-5]。沉水植物群落对维持湖泊清水稳态起关键作用,其盛衰直接影响湖泊生态系统功能,在控制湖泊富营化方面发挥着重要作用[4-5]。因此,恢复沉水植物来改善湖泊水环境也被认为是富营养化湖泊治理最有效的途径之一而被广泛使用[4-7],例如在洪湖湖滨带长期监测结果显示完整的沉水、挺水、浮叶植物群落提高了湖泊的自净能力,缓解了湖泊富营养化趋势[8];在滇池、洱海湖滨带水生植物控制水体氮磷,抑制了藻类活动等[9],如何快速、有效地恢复和重建沉水植被,也已成为我国湖泊和水库治理的重大科技需求之一。
沉水植物恢复一般是原位种植[10-11]、生态床[12-14]、创建软围格系统[15-16]等生物修复技术,原位种植投放种子幼苗的主要方式有扦插法、沉栽法、播种法、半浮式载体移栽法、渐沉式沉床移栽法等[10-11],生态床技术恢复沉水植物群落主要有生态悬床[12]、生态沉床[13]、可调节式网床[14]等。创建软围格系统是利用围格系统减缓水的流速和降低风浪,同时可以将藻类阻断在围格外减少藻类聚集来提高沉水植物成活率,殷雪妍等[15]和胡旭等[16]在大型湖泊中相关研究证实此技术有利于沉水植被修复。然而目前大部分修复沉水群落的方法为直接沉放沉水植物的繁殖体或者低水位直接种植,成活率易受水深、风浪等环境条件的影响[13],不易形成沉水植物群落,难以持续高效发挥沉水植物作用。物种丰度是影响沉水植物恢复关键因素,不同沉水植物生长特性差异大,生长形态、最适生长条件、不良条件下生长策略等均有较大差别[17-18]。一般来说,物种丰度越高,物种间相互作用往往越激烈[19-21],而不同物种混合种植,物种间的相互作用也有较大差异。李宽意[19]研究表明苦草(Vallisneria natans (Lour.) Hara)与伊乐藻(Elodea nuttallii (Planch.) H.St.John)混合种植时,伊乐藻对苦草高密度生长的抑制作用显著,而苦草对伊乐藻高密度生长的抑制作用显著。鉴于物种丰度的生态效应取决于选取修复物种之间的种间相互作用强度[17-21],故探索出适合沉水植被修复的物种丰度是相关技术关键步骤。
此外,大量研究表明沉水植物的生长与基质类型密切相关[17-18, 22-26],基质是沉水植物生长所需矿物质成分的主要来源之一,其营养盐含量和类型直接影响沉水植物群落的生长与分布[22, 25-28]。Xie等[29]关于影响苦草根系生长的研究中发现基质类型对生物量积累、根系形态、根系分布和植物N、P浓度等均有显著影响,其中,在混合基质中根更多分布在表层(0~4 cm),在黏土基质中根更多分布在深层(4~8 cm)。此外,不同基质营养水平也会改变根的生长模式,在低营养情况下的沉水植物出现高根叶比、细根等适应特性[29-30],Wang等[31]相关研究也表明苦草通过改变株高、分枝数、叶片数来适应不同基质类型,李宽意[19]关于苦草和伊乐藻的相关研究中发现基质类型对于不同种植密度的伊乐藻生长速率均有显著影响。因此为实现沉水植物群落水平的恢复与稳定,搭配出适应其生长以及根系发育的基质亦极其重要。
本研究旨在探讨不同物种丰度、不同基质类型对苦草、微齿眼子菜(Potamogeton maackianus A. Bennett)、穗状狐尾藻(Myriophyllum spicatum L.)、伊乐藻这4种沉水植物生长及根系发育的影响,为沉水植物筛选、扩繁、定植和沉水植物群落构建、调控、管理等技术研发提供思路,为水生态系统恢复工程提供技术支撑,助力实现“水下森林”。
1 材料与方法 1.1 研究区概况本实验在湖南农业大学耘园实验基地(28°11′N, 113°4′E)开展,该区域属亚热带季风气候区,夏季高温多雨,冬季寒冷干燥,年平均降水量为1361.6 mm,年平均气温17.2℃。实验期间室外最高温度是37℃,最低温度是11℃,水温为15.3~33.2℃。
1.2 实验设计本研究采用双因素控制实验,设置不同基质类型和物种丰度2个因素,基质由园土(有机质、总氮、总磷、速效磷、总钾、速效钾含量分别为10.17 g/kg、1.44 g/kg、0.97 g/kg、34.87 mg/kg、16.16 g/kg、105.79 mg/kg)、椰丝、棕榈片、塑料网布、粗沙、沙、椰糠土、椰丝土、丝瓜瓤等不同比例搭配组合而成为4种厚度均为4 cm的不同类型的基质,各基质组成及比例如表 1所示。将每种基质做成36 cm×27 cm的矩形模块,并将基质模块划分为等大的12个小块,每个小块上随机种植1种植物(图 1),实验选择苦草、微齿眼子菜、穗状狐尾藻、伊乐藻4种植物,其中苦草、微齿眼子菜、穗状狐尾藻是长江中下游广布种,伊乐藻是我国引进种,4种植物均是长江中下游湖泊中常见优势物种。苦草属于莲座型植物,其叶形为线性或带型,光饱和点较低,可耐低光;微齿眼子菜属于直立型植物,叶形为条形,光谱适应范围广;穗状狐尾藻属于冠层型植物,叶形为丝状全细裂,光饱和点较高;伊乐藻是直立型植物,叶形为线性,耐低温且生长迅速[32-34]。4种物种随机组合为11个物种组合(图 1),构成物种丰度分别为1、2、3、4种的物种丰度梯度;本研究共设置4种基质×11个物种组合共44个实验处理,每个处理3个重复。
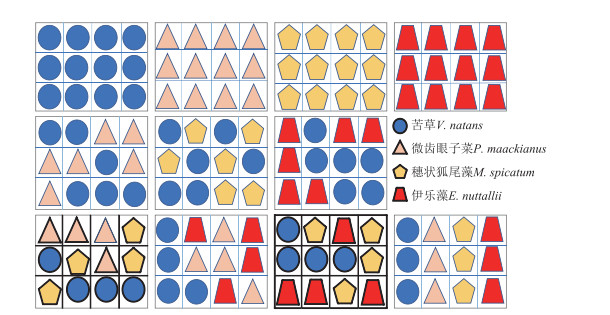
|
图 1 同一基质类型上沉水植物配置示意 Fig.1 The species configuration of submerged macrophyte for the specific sediments type |
| 表 1 不同基质类型及其组成 Tab. 1 Different sediments types and composition |
2021年4月中旬,进行预培养2周后,将鲜重总计均为5 g且长势相似的苦草整株(8 cm),微齿眼子菜茎尖(15 cm)、穗状狐尾藻茎尖(20 cm)、伊乐藻茎尖(15 cm)用清水洗净,除苦草外,其余3种植物均采用茎尖扦插种植,用千分之二浓度的高锰酸钾消毒后,按实验设计,单株随机种植于不同类型基质模块的小块上,然后将种植好植物的基质模块放入容积为500 L的塑胶桶内,底部铺有一层直径约为4 cm鹅卵石,上口直径为100 cm, 底部直径为85 cm。并用井水将放置植物后的水深调整为50 cm(放置植物前,桶内事先加入适量的水),继续培养70天。实验塑胶桶共计44个,不同实验处理的3个重复放置于一个实验塑胶桶中。实验处理所用井水,pH初始值9.68,总氮、总磷、硝态氮、铵态氮、正磷酸盐磷、化学需氧量初始数据分别为5.758、0.063、4.190、0.451、0.043、0.16 mg/L,实验过程中pH范围为7.47~10.64,随实验进行pH显著降低(P < 0.05, 附图Ⅰ),实验过程中总氮、总磷、硝态氮、铵态氮、正磷酸盐磷、化学需氧量范围分别为3.448~6.164、0.036~0.140、0.013~1.010、0.064~1.084、0.010~0.049、0.96~5.44 mg/L。实验经过70天的培育,所有实验模块盖度达到75%~100%。实验总周期里,在不同植物组合中,苦草和穗状狐尾藻生长状况好于微齿眼子菜和伊乐藻。苦草生长迅速,通过匍匐茎生长快速占据空间,长势良好;穗状狐尾藻通过快速增长的地上部分,占据了更多地上空间,长势良好;伊乐藻在实验前20天生长迅速,地上生物量快速增长,但是其根系发育较差,在实验后期生长状况不如苦草和穗状狐尾藻;微齿眼子菜生长缓慢,生长状况较差。
1.4 沉水植物功能性状测定实验进行收获采样,每个处理采集每种植物3~7株,用清水洗净晾干水分后,用直尺测量株高和最大根长,WinRHIZO根系分析仪测定植物根系的总根长、总根表面积、总根体积、根平均直径、总根尖数、根分枝数、根交叉数指标,105℃下杀青半小时后、75℃烘干至恒重,采用天平测定植株干重,地上部分干重为地上生物量,地下部分干重为地下生物量,总生物量为地上生物量和地下生物量之和,根冠比是植物根系与植物地上部分总生物量之比,根比表面积是通过植物平均表面积除以植物生物量得出,测定指标共计14个。
1.5 数据分析处理采用SPSS 18.0、R语言等数据分析软件进行数据整理及分析。将11种植物组合以植物功能模块中植物物种丰度不同,划分成1、2、3、4种4个梯度的植物组合,多重比较分析指出大多数植物功能性状指标在2种无疏松层基质(a1和a2)或者2种有疏松层基质(b1和b2)之间无显著差异(附图Ⅱ),故后续结果将4种基质根据基质层数不同划分为无疏松层基质(a)和有疏松层基质(b)两类进行数据分析。应用R语言stat包对不同物种丰度、不同基质类型下各指标进行方差分析,分析前均用对数化的数据进行正态性和方差齐性检验,对数据成正态分布的指标进行单因素和双因素方差分析,对数据方差不齐或不成正态分布的指标进行非参数(kruskal.test和scheirer-Ray-Hare)方差分析。应用相对产量(relative yield,RY)、相对竞争强度(relative competition intensity,RCI)、相对拥挤系数(relative crowding coefficient,RCC)3个竞争指标探讨特定沉水植物在植物模块生长及根系发育中的竞争能力,相对产量指特定物种混种时单株平均生物量与该物种单种时单株平均生物量之比[35-36],计算方式为公式1,当RYij值>1时,代表物种i与物种j混种时,物种i生长情况好于其单种,种内竞争强于种间竞争,当RYij值< 1,则相反;竞争强度指不同群落功能性状关于特定物种在单种时单株平均值与混种时单株平均值之差[36-37],再与单种时单株平均值的比值,计算方式为公式(2),当RCI>0,植物单种生长状况好于混种,混种竞争强度大于单种,当RCI < 0,则相反;相对拥挤系数指混种物种组合中不同物种的单株平均生物量之比与该不同物种在单种时单株平均生物量之比的比值[38-39],计算方式为公式(3),RCCij值越大表明物种i竞争优势越强,越小则相反。应用R语言ggplot2包进行数据可视化。
| $ \begin{gathered} R Y_{i j}=Y_{i j} / Y_{i i} \end{gathered} $ | (1) |
| $ R C I=\left(Y_{\text {mono }}-Y_{\text {mix }}\right) / Y_{\text {mono }} $ | (2) |
| $ R C C_{i j}=\left(Y_{i j} / Y_{j i}\right) /\left(Y_{i i} / Y_{i j}\right) $ | (3) |
式中,RYij表示物种i在物种i与物种j混种中的相对产量,Yij表示物种i在物种i与j混种中的单株生物量,Yii表示物种i单种时单株生物量;Ymono表示不同功能性状在特定物种单种时单株平均值,Ymix表示不同功能性状在特定物种混种时单株平均值;RCCij表示物种i在物种i与j混种时的相对拥挤系数,Yji表示物种j在物种i与j混种中的单株生物量,Yjj表示物种j单种时单株生物量。
2 结果分析 2.1 物种丰度对沉水植物生长及根系发育的影响群落功能性状指标在不同物种丰度的变化不同,总生物量在1~4个物种丰度中分别为10.78、9.20、5.55、4.57 g,随着物种丰度增加下降了57.59%;地下生物量在1~4个物种丰度中分别为1.78、1.97、1.03、0.86 g,4个物种比1个物种下降51.56%;物种丰度分别为1、2、3、4时株高对应41.2、33.7、29.3、28.2 cm,随着物种丰度增加下降了31.58%;最大根长、总根体积、总根尖数、根分枝数和根交叉数等功能性状指标4个物种比1个物种分别下降12.07%、7.52%、19.08%、9.75%、9.83%;物种丰度分别为1、2、3、4时总根长和总根表面积在4个物种跟1个物种基本一致,但是3个物种比1个物种下降了21.46%和23.26%。
多重比较结果表明,在物种丰度为2的3个物种组合(苦草+微齿眼子菜、苦草+穗状狐尾藻、苦草+伊乐藻)中,除了最大根长、地上生物量、地下生物量、总生物量、根比表面积外,其他9个群落功能性状差异显著,苦草+穗状狐尾藻物种组合生长情况最好。而在物种丰度为3的3个物种组合(苦草+微齿眼子菜+穗状狐尾藻、苦草+微齿眼子菜+伊乐藻、苦草+穗状狐尾藻+伊乐藻)中,除了总根长、根平均直径、地下生物量、地上生物量、总生物量、根冠比、根比表面积外,其他7个群落功能性状差异显著,有穗状狐尾藻的物种组合生长状况较好(附图Ⅲ和附图Ⅳ)。
线性模型结果表明,随着沉水植物模块中物种丰度的增加,总生物量、地下生物量、株高、最大根长、总根长、总根表面积、总根体积、总根尖数、根分枝数、根交叉数等功能性状显著降低(图 2、附图Ⅴ和表 2, P < 0.05),其他指标无显著变化(表 2, P>0.05)。
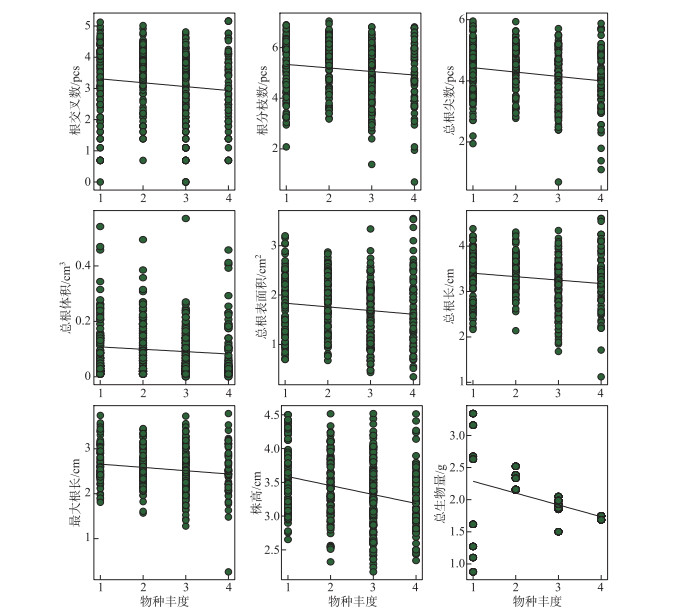
|
图 2 不同物种丰度对沉水植物群落功能性状指标的影响 (图中群落功能指标随物种丰度变化显著(P < 0.05)) Fig.2 Effect of different species abundance on community functional trait index of submerged macrophytes (The functionaltrait index of community in the figure changed significantly with species abundance (P < 0.05)) |
| 表 2 沉水植物群落功能性状指标对基质类型、物种丰度及其交互的方差分析结果 Tab. 2 Anova results of community functional trait indicators of submerged macrophytes on sediments types, species abundance and their interaction |
在物种丰度为2的3个物种组合中,只有苦草+微齿眼子菜这一物种组合关于不同基质,总根长、总根表面积和根分枝数3个群落功能性状有显著差异,其他物种组合关于各项群落功能性状指标均无显著差异,在物种丰度为3的3个物种组合中,3个物种组合关于各项群落功能性状指标均无显著差异(附表Ⅰ和附表Ⅱ)。
总根表面积在有疏松层、无疏松层的基质类型中分别为6.61、5.11 cm2,无疏松层比有疏松层降低了22.66%;总根尖数在有疏松层、无疏松层的基质类型中分别为102、85个,无疏松层比有疏松层降低了16.97%。线性模型分析结果表明(表 2),含有疏松层的基质类型,总根表面积、总根尖2个功能性状指标较不含疏松层的基质类型显著增加,对其他指标无显著影响。
2.3 特定物种竞争能力对植物功能性状指标的影响苦草、微齿眼子菜、穗状狐尾藻和伊乐藻单种时,单株生物量分别为0.143、0.089、0.168和0.162 g,总生物量分别为24.903、2.288、2.724和13.201 g。相对产量结果表明(表 3),苦草与微齿眼子菜在100%和75%混种组合中竞争能力较差,穗状狐尾藻在75%混种组合中竞争能力较强,伊乐藻在不同混种组合中无明显竞争优势。苦草在不同混种组合中相对产量均小于1,表明其单种生物量高于混种,在混种物种组合中竞争能力差;微齿眼子菜除了在苦草+微齿眼子菜物种组合中,其他混种组合相对产量均小于1,表明其在大多数混种组合中单种生物量高于混种,在大多数混种组合中竞争能力差;穗状狐尾藻除了在苦草+微齿眼子菜+穗状狐尾藻组合中,其他混种组合相对产量均大于1,表明其在大多数混种组合中混种生物量高于单种,在大多数混种组合中竞争能力强;伊乐藻在2个物种组合中相对产量小于1,2个物种组合中相对产量大于1,表明其混种或单种生长情况在不同物种组合中无显著差异,其在不同物种组合中竞争能力不确定。相对拥挤系数结果表明(表 3),穗状狐尾藻竞争优势是4个物种中最强,苦草竞争优势最弱。穗状狐尾藻在苦草+穗状狐尾藻、苦草+穗状狐尾藻+伊乐藻和苦草+微齿眼子菜+穗状狐尾藻+伊乐藻3个物种组合中竞争优势最高,苦草在苦草+微齿眼子菜、苦草+穗状狐尾藻、苦草+伊乐藻、苦草+微齿眼子菜+伊乐藻和苦草+穗状狐尾藻+伊乐藻等5个物种组合中竞争优势最低。
| 表 3 特定沉水植物在不同物种组合中相对产量与相对拥挤系数的结果 Tab. 3 Results of relative yields and relative crowding coefficients of submerged macrophyte in different species combinations |
相对竞争强度结果表明(表 4),苦草、微齿眼子菜和穗状狐尾藻在6/7、11/14和5/7的群落功能性状中,单种情况好于混种,物种间存在竞争性相互利用,种间竞争激烈,伊乐藻差异不显著。苦草在总根表面积和根冠比混种好于单种(根比表面积越低生长情况越好),其他功能指标相反;微齿眼子菜在株高、总根体积和总根表面积混种好于单种,其他功能指标相反;穗状狐尾藻在总根尖数、根冠比、地下生物量和根比表面积混种好于单种,其他功能指标相反;伊乐藻在最大根长、总根长、根平均直径、根分枝数、根交叉数、根冠比和地下生物量混种好于单种,其他功能指标相反。
| 表 4 沉水植物功能性状对于特定沉水植物相对竞争强度的影响 Tab. 4 Effect of functional traits of submerged macrophyte on theire relative competitive intensity |
沉水植物间相互作用是影响其生长发育的关键因素,不仅直接影响植物个体的生长发育和形态特征,也影响植物群落的分布[40-45]。本研究结果指出物种丰度的增加显著不利于沉水植物群落的模块化生长及根系发育,地下生物量、总生物量、株高和根系形态指标均显著降低,说明这4种沉水植物对资源(如底质、光、营养盐等)的竞争性利用而非协同性利用占主导作用。在陆地生态系统,尤其是草地生态系统的相关研究结果中,物种丰度增加促进群落生产力、群落结构稳定性和生态系统功能,群落内不同物种占据着不同的生态位,对资源的协同性利用发挥主导作用[46-48],然而在本研究中,相对较高的物种丰度并未增加沉水植物的生长与根系发育,这可能与两种生态系统(水域vs.陆地)不同的资源分配水平(光、水、矿物质营养)有关[49]。草地生态系统的资源异质化更高,提供了更高的资源利用空间与水平,然而水生生态系统的资源同质化更高,降低了资源的利用互补性[49-51],同时在草地生态系统中物种间生活型的不同,植物种间互补效应更强[46-48],沉水植物在资源利用和功能作用方面更相似,对于生长空间以及营养物种的竞争更为激烈[52],形成强烈的种间竞争从而导致竞争效应占主导作用。在野外研究中,Wang等[53]研究表明沉水植物群落中物种丰度对生物量的正效应低于均匀度的负效应,选择效应对物种丰度与生物量关系有更重要的影响,说明在特定沉水植物群落中竞争大于协同效应,Fu等[44-45]关于水生植物群落多样性驱动生态系统过程研究表明,物种丰度对生态系统功能的生态效应主要归因于选择效应(优势种亦即竞争占主导作用)和互补效应(生态位互补亦即协同占主导作用)的协同作用。野外研究和控制实验关于物种丰度与生态效应关系的研究结果不同,说明了其二者关系的复杂性,本研究出现随着物种丰度增加竞争效应强于协同效应具有合理性。鉴于以往研究大多数集中在植物生长与基质类型相互关系[19, 21-28],而本研究丰富了物种丰度与沉水植物根系性状关系的探索,为沉水植物根系发育研究提供了一定的科学理论基础。
沉水植物根系发育跟生长基质密切相关[21, 54-57],有研究表明基质结构、基质密度、基质有效营养盐含量都会显著影响植物生长[21, 28-29, 57]。本研究结果指出基质中增加疏松层促进了沉水植物根系发育,显著增加了根系的总根表面积和总根尖,这与Barko等[27]、Xie等[29]和张俊[56]关于沉水植物在适合的基质密度中生长状况会产生相应的改变,如生物量、分枝数、根系活力、存活率等生长指标的增加相似。因此,在沉水植物修复过程,在基质添加适合的疏松材料,提高基质的透气性与疏松性,使得沉水植物根系发育情况更好,更加有利于沉水植物的模块化生长。对于基质类型和物种丰度2个因素,沉水植物模块化生长以及根系发育受后者影响较大,这可能是因为本实验中基质类型均能较好提供沉水植物模块化生长所需营养物质[27-29],从而物种间相互关系成为影响沉水植物模块化生长以及根系发育的主要因素。
物种竞争能力的相关分析结果表明(表 3),在混种组合中,穗状狐尾藻生长状况优于其他3种物种,穗状狐尾藻显著增强了沉水植物群落生长和根系发育,而其他3个物种在混种情况下受到的种间竞争大,竞争优势不明显,因此减弱了沉水植物模块化生长和根系发育,说明在4种沉水植物组成的7个混种组合中,穗状狐尾藻竞争能力更强。在实验设计的11个物种组合中,苦草单种时总生物量最大,在其他物种组合中,苦草总生物量也较大,生长状况较好(附表Ⅲ)。在研究中微齿眼子菜和伊乐藻生长发育状况较差,原因可能是苦草较其他3种植物耐低光能力更强[32, 34, 58],同时其发达的匍匐茎,使其在根系竞争中优势明显,穗状狐尾藻属于冠层型植物且针状叶片,增大了吸收光的表面积[32, 59],使得微齿眼子菜和伊乐藻在地下部分竞争能力弱于苦草、而地上部分竞争能力弱于穗状狐尾藻,导致有这2种植物的植物群落生长较差,而有其他2种植物的植物群落生长较好,这与Liu等[60]关于长江中下游湖泊研究结果相似,苦草和穗状狐尾藻植物组合更有利于富营养化湖泊修复。然而,李宽意[19]、段德龙等[61]和Silveira等[62]研究结果与本实验结论相异,其结论为入侵植物(如中国的伊乐藻、南美洲的轮叶黒藻)竞争力强于本土植物(如中国的苦草、南美洲的柱蕊水蕴草(Elodea najas (Planch.) Casp.)),入侵物种会对本土物种造成较大威胁,原因可能是物种丰度、基质营养以及种植密度的改变[17, 20-21, 29]。
3.2 结论本研究结果表明在沉水植物生长过程中随着物种丰度的增加竞争效应起主导作用,因此,在进行沉水植物修复工程的早期,应该选择单一或两种沉水植物作为先锋物种进行修复,不适宜多种沉水植物物种同时培育繁殖,避免其过度竞争,苦草和穗状狐尾藻可以作为水体修复理想材料。此外,对于沉水植物的基质选择上,可以考虑增加疏松层来促进沉水植物生长与根系发育,提高其恢复能力。然而本研究没有进行野外原位实验,后续研究可针对自然环境的湖泊中风浪强、营养盐高、水体透明度低等问题开展实验工作。
4 附录附图Ⅰ~Ⅴ和附表Ⅰ~Ⅲ见电子版(DOI: 10.18307/2023.0515)。

|
附图Ⅰ 实验pH随着时间的变化趋势图(1.P <0.05,2.横坐标为测定日期) AttachedFigureI Trend graph of experimental pH over time (1.P <0.05, 2. The horizontal coordinate is the date of measurement) |

|
附图Ⅱ 四类基质的群落功能性状指标多重比较结果 AttachedFigureII Results of multiple comparisons of community functional trait index of four sediments types |

|
附图Ⅲ 物种丰度为2的不同物种组合关于群落功能性状指标的多重比较结果(1. 图中不同小写字母表示不同物种组合差异显著, 2.横坐标AW、AS和AL分别表示苦草+微齿眼子菜、苦草+穗状狐尾藻、苦草+ 伊乐藻三个物种组合) AttachedFigureIII Result of multiple of different species combinations with species abundance of 2 regarding community functional trait indicators(1. Different lowercase letters in the figure indicate significant differences among species combinations, 2. The horizontal coordinates AW, AS and AL indicate three species combinations of V. natans and P. maackianus, V. natans and M. spicatum, V. natans and E. nuttallii) |

|
附图Ⅳ 物种丰度为3的不同物种组合关于群落功能性状指标的多重比较结果(1. 图中不同小写字母表示不同物种组合差异显著, 2.横坐标AWS、AWL和ASL分别表示苦草+微齿眼子菜+穗状狐尾藻、苦草+微齿眼子菜+伊乐藻、苦草+穗状狐尾藻+伊乐藻三个物种组合) AttachedFigureIV Result of multiple of different species combinations with species abundance of 3 regarding community functional trait indicators (1. Different lowercase letters in the figure indicate significant differences between different species combinations, 2. The horizontal coordinates AWS, AWL and ASL indicate three species combinations of V.natans and P. maackianus and M. spicatum, V. natans and P. maackianus and E. nuttallii, V. natans and M. spicatum and E. nuttallii) |
|
附图Ⅴ 物种丰度对沉水植物群落功能性状指标的影响(1. 地上生物量随物种丰度变化显著(P <0.05), 2.横坐标1、2、3、4表示物种丰度1-4) AttachedFigureV Effect of species abundance on community functional trait index of submerged macrophytes(1. Bblow ground biomass did vary significantly with species abundance (P <0.05). 2. Horizontal coordinates 1, 2, 3, 4 indicate species abundance 1-4) |
| 附表Ⅰ 物种丰度为2的不同物种组合关于基质类型和群落功能性状指标方差分析结果 Appendix Ⅰ Anova results for different species combinations with species abundance of 2 on substrate type and community functional trait indicators |
| 附表Ⅱ 物种丰度为3的不同物种组合关于基质类型和群落功能性状指标方差分析结果 Appendix Ⅱ Anova results for different species combinations with species abundance of 3 on substrate type and community functional trait indicators |
| 附表Ⅲ 特定沉水植物在不同物种组合中总生物量百分比 Appendix Ⅲ Percentage of total biomass of specific submerged macrophyte in different species combinations |
| [1] |
Qin BQ. Lake eutrophication: Control countermeasures and recycling exploitation. Ecological Engineering, 2009, 35(11): 1569-1573. DOI:10.1016/j.ecoleng.2009.04.003 |
| [2] |
Smith VH, Schindler DW. Eutrophication science: Where do we go from here?. Trends in Ecology & Evolution, 2009, 24(4): 201-207. DOI:10.1016/j.tree.2008.11.009 |
| [3] |
Le C, Zha Y, Li Y et al. Eutrophication of lake waters in China: Cost, causes, and control. Environmental Management, 2010, 45(4): 662-668. DOI:10.1007/s00267-010-9440-3 |
| [4] |
Ye C, Yu HC, Kong HN et al. Community collocation of four submerged macrophytes on two kinds of sediments in Lake Taihu, China. Ecological Engineering, 2008, 35(11): 1656-1663. DOI:10.1016/j.ecoleng.2008.05.008 |
| [5] |
Qin BQ. Approaches to mechanisms and control of eutrophication of shallow lakes in the middle and lower reaches of the Yangtze River. J Lake Sci, 2002, 14(3): 193-202. [秦伯强. 长江中下游浅水湖泊富营养化发生机制与控制途径初探. 湖泊科学, 2002, 14(3): 193-202. DOI:10.18307/2002.0301] |
| [6] |
Qin BQ. Mechanisms of eutrophication in lakes in the middle and lower reaches of the Yangtze River and control measures. Bulletin of Chinese Academy of Sciences, 2007(6): 503-505. [秦伯强. 长江中下游湖泊富营养化发生机制与控制对策. 中国科学院院刊, 2007(6): 503-505. DOI:10.3969/j.issn.1000-3045.2007.06.013] |
| [7] |
Wang XL, Wu XC, Wang CY et al. Research progress on ecological remediation of heavy metal polluted water by aquatic plants. Environmental Pollution & Control, 2020, 42(1): 107-112. [王兴利, 吴晓晨, 王晨野等. 水生植物生态修复重金属污染水体研究进展. 环境污染与防治, 2020, 42(1): 107-112.] |
| [8] |
Zhang YY, Cai XB, Yang C et al. Driving force analysis of landscape pattern changes in Honghu Wetland Nature Reserve in recent 40 years. J Lake Sci, 2019, 31(1): 171-182. [张莹莹, 蔡晓斌, 杨超等. 1974—2017年洪湖湿地自然保护区景观格局演变及驱动力分析. 湖泊科学, 2019, 31(1): 171-182. DOI:10.18307/2019.0116] |
| [9] |
Xie J, Wu DY, Chen XC et al. Relationship between aquatic vegetation and water quality in littoral zones of Lake Dianchi and Lake Erhai. Environmental Science & Technology, 2013, 36(2): 55-59. [谢杰, 吴德意, 陈雪初等. 滇池和洱海湖滨带水生植被状况与水质的关系研究. 环境科学与技术, 2013, 36(2): 55-59.] |
| [10] |
赵风斌. 异龙湖沉水植物群落恢复影响因子与恢复技术研究[学位论文]. 上海: 上海海洋大学, 2017.
|
| [11] |
张聪. 杭州西湖湖西区沉水植物群落结构优化研究[学位论文]. 武汉: 武汉理工大学, 2012.
|
| [12] |
Jiang H, Zhu B, Geng HF et al. Purification of slightly polluted river-type water source with ecological suspended plant bed. Journal of Anhui Agricultural Sciences, 2014, 42(8): 2432-2433, 2504. [蒋欢, 朱斌, 耿海峰等. 生态悬床技术对河道型微污染水源地水质净化效果研究. 安徽农业科学, 2014, 42(8): 2432-2433, 2504. DOI:10.3969/j.issn.0517-6611.2014.08.080] |
| [13] |
Guo YQ, Xue JH, Wu YB et al. Research progress on purification effects and restoration technologies of submerged macrophytes on eutrophic water. Journal of Plant Resources and Environment, 2020, 29(3): 58-68. [郭雅倩, 薛建辉, 吴永波等. 沉水植物对富营养化水体的净化作用及修复技术研究进展. 植物资源与环境学报, 2020, 29(3): 58-68. DOI:10.3969/j.issn.1674-7895.2020.03.08] |
| [14] |
Wu HL, Huo YZ, Shao L et al. Bioremediation of river water quality by consecutively adjustable submerged vegetation net. Chinese Journal of Applied Ecology, 2012, 23(9): 2580-2586. [吴海龙, 霍元子, 邵留等. 连续可调式沉水植物网床对河道水质的修复. 应用生态学报, 2012, 23(9): 2580-2586. DOI:10.13287/j.1001-9332.2012.0354] |
| [15] |
Yin XY, Yan GH, Wang X. Research on the integration and application of aquatic vegetation restoration technology in the lakeshorezone of Taihu Lake. Journal of East China Normal University: Natural Science, 2021(4): 26-38. [殷雪妍, 严广寒, 汪星. 太湖湖滨带水生植被恢复技术集成与应用浅析. 华东师范大学学报: 自然科学版, 2021(4): 26-38. DOI:10.3969/j.issn.1000-5641.2021.04.004] |
| [16] |
Hu X, He L, Cao T et al. Restoration of aquatic vegetation and its ecological effects in the enclosure of an eutrophic lake. J Lake Sci, 2014, 26(3): 349-357. [胡旭, 何亮, 曹特等. 富营养化湖泊围隔中重建水生植被及其生态效应. 湖泊科学, 2014, 26(3): 349-357. DOI:10.18307/2014.0303] |
| [17] |
Liu WL, Hu WP, Chen Q. The phenotypic plasticity of Potamogeton malaianus Miq. on the effect of sediment shift and Secchi depth variation in Taihu Lake. Ecology and Environmental Sciences, 2007(2): 363-368. [刘伟龙, 胡维平, 陈桥. 不同底质和透明度下马来眼子菜的表型可塑性研究. 生态环境, 2007(2): 363-368. DOI:10.3969/j.issn.1674-5906.2007.02.019] |
| [18] |
Lu J, Wang ZX, Xing W et al. Effects of substrate and shading on the growth of two submerged macrophytes. Hydrobiologia, 2013, 700(1): 157-167. DOI:10.1007/s10750-012-1227-5 |
| [19] |
Li KY. Effects of sediment nutrition level on the interspecific relationship between two submerged macrophytes. Chinese Journal of Ecology, 2009, 28(12): 2624-2627. [李宽意. 基质类型对两种沉水植物种间关系的影响. 生态学杂志, 2009, 28(12): 2624-2627.] |
| [20] |
Cheng H, Han CM, Lin C et al. Effect of planting density on the growth and reproduction of two submerged plants. Journal of Anhui Agricultural Sciences, 2021, 49(19): 50-54. [程花, 韩翠敏, 林超等. 种植密度对2种沉水植物生长繁殖的影响. 安徽农业科学, 2021, 49(19): 50-54. DOI:10.3969/j.issn.0517-6611.2021.19.013] |
| [21] |
Li F, Zhu LL, Xie YH et al. Colonization by fragments of the submerged macrophyte Myriophyllum spicatum under different sediment type and density conditions. Scientific Reports, 2015, 5: 11821. DOI:10.1038/srep11821 |
| [22] |
Zhai SJ, Hu WP, Deng JC et al. Effects of different water depths and sediments on Potamogeton malaianus in Lake Taihu. Acta Ecologica Sinica, 2008, 28(7): 3035-3041. [翟水晶, 胡维平, 邓建才等. 不同水深和底质对太湖马来眼子菜(Potamogeton malaianus)生长的影响. 生态学报, 2008, 28(7): 3035-3041.] |
| [23] |
Tao H, Pan JZ, Shen YL et al. Effects of substrate character of Lake Gehu on the growth of Potamogeton crispus and Elodea nattalii. J Lake Sci, 2011, 23(3): 383-388. [陶花, 潘继征, 沈耀良等. 滆湖底质特性对菹草(Potamogeton crispus)和伊乐藻(Elodea nattalii)生长的影响. 湖泊科学, 2011, 23(3): 383-388. DOI:10.18307/2011.0310] |
| [24] |
Xie YF, Hu YH, Liu ZW et al. Effects of sediment resuspension on the growth of submerged plants. Acta Scientiae Circumstantiae, 2007(1): 18-22. [谢贻发, 胡耀辉, 刘正文等. 沉积物再悬浮对沉水植物生长的影响研究. 环境科学学报, 2007(1): 18-22.] |
| [25] |
Xu WW, Hu WP, Deng JC et al. Impacts of water depth and substrate type on Vallisneria natans at wave-exposed and sheltered sites in a eutrophic large lake. Ecological Engineering, 2016, 97: 344-354. DOI:10.1016/j.ecoleng.2016.10.029 |
| [26] |
Zhu W, Zhang J, Zhao LF. Effects of ammonia nitrogen in substrate on the growth of submerged plants. Ecology and Environmental Sciences, 2006(5): 914-920. [朱伟, 张俊, 赵联芳. 底质中氨氮对沉水植物生长的影响. 生态环境, 2006(5): 914-920.] |
| [27] |
Barko JW, Gunnison D, Carpenter SR. Sediment interactions with submersed macrophyte growth and community dynamics. Aquatic Botany, 1991, 41(1/2/3): 41-65. DOI:10.1016/0304-3770(91)90038-7 |
| [28] |
He WK, Cao T, Ni LY et al. Growth of seven submersed macrophytes cultured on five sediment mixtures from the Lake Erhai. Acta Hydrobiologica Sinica, 2017, 41(2): 428-436. [何文凯, 曹特, 倪乐意等. 洱海底泥特性对七种沉水植物生长的影响. 水生生物学报, 2017, 41(2): 428-436. DOI:10.7541/2017.53] |
| [29] |
Xie YH, An SQ, Wu BF et al. Density-dependent root morphology and root distribution in the submerged plant Vallisneria natans. Environmental and Experimental Botany, 2006, 57(1/2): 195-200. DOI:10.1016/j.envexpbot.2005.06.001 |
| [30] |
Bai X, Chen KN, Zhao HG et al. Impact of water depth and sediment type on root morphology of the submerged plant Vallisneria natans. Journal of Freshwater Ecology, 2015, 30(1): 75-84. DOI:10.1080/02705060.2014.970672 |
| [31] |
Wang L, Hu XQ, Zhang ZL et al. Physiological and ecological adaptation strategies of Vallisneria natans to different water depths and sediments. Chinese Journal of Ecology, 2021, 40(8): 2421-2430. [王磊, 胡效卿, 张卓伦等. 不同水深和基质下苦草(Vallisneria natans)的生理生态适应策略. 生态学杂志, 2021, 40(8): 2421-2430. DOI:10.13292/j.1000-4890.202108.003] |
| [32] |
Li QS, Huang Q, Li YJ et al. Effects of water depth on growth of submerged macrophytes Vallisneria natans and Myriophyllum spicatum. J Lake Sci, 2019, 31(4): 1045-1054. [李启升, 黄强, 李永吉等. 水深对沉水植物苦草(Vallisneria natans)和穗花狐尾藻(Myriophyllum spicatum)生长的影响. 湖泊科学, 2019, 31(4): 1045-1054. DOI:10.18307/2019.0404] |
| [33] |
Gao YM, Yin CY, Zhao Y et al. Effects of diversity, coverage and biomass of submerged macrophytes on nutrient concentrations, water clarity and phytoplankton biomass in two restored shallow lakes. Water, 2020, 12(5): 1425. DOI:10.3390/w12051425 |
| [34] |
Chen JF, Cao T, Zhang XL et al. Differential photosynthetic and morphological adaptations to low light affect depth distribution of two submersed macrophytes in lakes. Scientific Reports, 2016, 6(1): 34028. DOI:10.1038/srep34028 |
| [35] |
Zhai LC, Xie RZ, Ma DL et al. Evaluation of individual competitiveness and the relationship between competitiveness and yield in maize. Crop Science, 2015, 55(5): 2307-2318. DOI:10.2135/cropsci2015.01.0033 |
| [36] |
Thiébaut G, Rodriguez-Perez H, Jambon O. Reciprocal interactions between the native Mentha aquatica and the invasive Ludwigia hexapetala in an outdoor experiment. Aquatic Botany, 2019, 157: 17-23. DOI:10.1016/j.aquabot.2019.05.005 |
| [37] |
Navas ML, Garnier E, Austin MP et al. Seeking a sound index of competitive intensity: Application to the study of biomass production under elevated CO2 along a nitrogen gradient. Austral Ecology, 2002, 27(4): 463-473. DOI:10.1046/j.1442-9993.2002.01201.x |
| [38] |
McGraw JB, Chapin Ⅲ FS. Competitive ability and adaptation to fertile and infertile soils in two Eriophorum species. Ecology, 1989, 70(3): 736-749. DOI:10.2307/1940224 |
| [39] |
Connolly J, Wayne P, Bazzaz FA. Interspecific competition in plants: How well do current methods answer fundamental questions?. The American Naturalist, 2001, 157(2): 107-125. DOI:10.1086/318631 |
| [40] |
Fu H, Yuan GX, Li W et al. Environmental effects on community productivity of aquatic macrophytes are mediated by species and functional composition. Ecohydrology, 2019, 12(8): e2147. DOI:10.1002/eco.2147 |
| [41] |
Zhang WP, Pan S, Jia X et al. Effects of positive plant interactions on population dynamics and community structures: A review based on individual-based simulation models. Chinese Journal of Plant Ecology, 2013, 37(6): 571-582. [张炜平, 潘莎, 贾昕等. 植物间正相互作用对种群动态和群落结构的影响: 基于个体模型的研究进展. 植物生态学报, 2013, 37(6): 571-582. DOI:10.3724/SP.J.1258.2013.00059] |
| [42] |
Cai JF, Sun K, Zhang Y et al. Effects of invasion intensity of Eichhornia crassipes and water depth on growth and interspecific relationships of submerged plants. Acta Scientiae Circumstantiae, 2022, 42(1): 36-46. [蔡竟芳, 孙凯, 张羽等. 凤眼莲入侵强度和水深对沉水植物生长及种间关系的影响. 环境科学学报, 2022, 42(1): 36-46. DOI:10.13671/j.hjkxxb.2021.0499] |
| [43] |
袁素强. 浅水通江湖泊水生植被恢复模式研究——以升金湖为例[学位论文]. 合肥: 安徽大学, 2020.
|
| [44] |
Fu H, Yuan GX, Özkan K et al. Patterns of seasonal stability of lake phytoplankton mediated by resource and grazer control during two decades of re-oligotrophication. Ecosystems, 2021, 24(4): 911-925. DOI:10.1007/s10021-020-00557-w |
| [45] |
Fu H, Zhong JY, Yuan GX et al. Functional traits composition predict macrophytes community productivity along a water depth gradient in a freshwater lake. Ecology and Evolution, 2014, 4(9): 1516-1523. DOI:10.1002/ece3.1022 |
| [46] |
HectorA, Schmid B, Beierkuhnlein C et al. Plant diversity and productivity experiments in European grasslands. Science, 1999, 286(5442): 1123-1127. DOI:10.1126/science.286.5442.1123 |
| [47] |
Mueller KE, Tilman D, Fornara DA et al. Root depth distribution and the diversity-productivity relationship in a long-term grassland experiment. Ecology, 2013, 94(4): 787-793. DOI:10.1890/12-1399.1 |
| [48] |
Brown CS, Rice KJ. Effects of belowground resource use comlementarity on invasion of constructed grassland plant communities. Biological Invasions, 2010, 12(5): 1319-1334. DOI:10.1007/s10530-009-9549-6 |
| [49] |
Zhang Q, Liu YP, Luo FL et al. Does species richness affect the growth and water quality of submerged macrophyte assemblages?. Aquatic Botany, 2019, 153: 51-57. DOI:10.1016/j.aquabot.2018.11.006 |
| [50] |
Turner TF, Krabbenhoft TJ, Collyer ML et al. Retrospective stable isotope analysis reveals ecosystem responses to river regulation over the last century. Ecology, 2015, 96(12): 3213-3226. DOI:10.1890/14-1666.1 |
| [51] |
Von FS, Hector A, Buchmann N et al. Belowground nitrogen partitioning in experimental grassland plant communities of varying species richness. Ecology, 2009, 90(5): 1389-1399. DOI:10.1890/08-0802.1 |
| [52] |
Mo Y, Deng ZH, Gao JQ et al. Does richness of emergent plants affect CO2 and CH4 emissions in experimental wetlands?. Freshwater Biology, 2015, 60(8): 1537-1544. DOI:10.1111/fwb.12586 |
| [53] |
Wang H, Wen Z, Ren W et al. What is the mechanism of submerged macrophyte biodiversity affecting biomass productivity along water depth: Niche complementarity or selection effect?. Ecological Indicators, 2022, 138: 108858. DOI:10.1016/j.ecolind.2022.108858 |
| [54] |
Wang H, Pang Y, Liu SB et al. Research progress on influencing of environmental factors on the growth of submersed macrophytes. Acta Ecologica Sinica, 2008, 28(8): 3958-3968. [王华, 逄勇, 刘申宝等. 沉水植物生长影响因子研究进展. 生态学报, 2008, 28(8): 3958-3968. DOI:10.3321/j.issn:1000-0933.2008.08.056] |
| [55] |
袁龙义. 环境因子对沉水植物生活史对策的影响研究[学位论文]. 武汉: 中国科学院研究生院(武汉植物园), 2007.
|
| [56] |
张俊. 底质性质对沉水植物生长的影响[学位论文]. 南京: 河海大学, 2006.
|
| [57] |
Dainez-Filho MS, Michelan TS, Louback-Franco N et al. Role of sediment structuring by detritus on colonization and interspecific competition of one native and one invasive submerged macrophyte. Hydrobiologia, 2019, 834(1): 63-74. DOI:10.1007/s10750-019-3909-8 |
| [58] |
薛蕊. 光照条件对两种沉水植物生长特性的影响研究[学位论文]. 重庆: 重庆大学, 2018.
|
| [59] |
苏睿丽, 李伟. 沉水植物光合作用的特点与研究进展. 植物学通报, 2005(S1): 128-138. |
| [60] |
Liu H, Zhou W, Liu XW et al. How many submerged macrophyte species are needed to improve water clarity and quality in Yangtze floodplain lakes?. Science of the Total Environment, 2020, 724: 138267. DOI:10.1016/j.scitotenv.2020.138267 |
| [61] |
段德龙, 于金金, 杨静等. 伊乐藻与狐尾藻、苦草和金鱼藻的竞争研究. 河南农业科学, 2011, 40(8): 149-152, 155. |
| [62] |
Silveira MJ, Alves DC, Thomaz SM. Effects of the density of the invasive macrophyte Hydrilla verticillata and root competition on growth of one native macrophyte in different sediment fertilities. Ecological Research, 2018, 33(5): 927-934. DOI:10.1007/s11284-018-1602-4 |
 2023, Vol. 35
2023, Vol. 35 

