(2: 昆明市滇池高原湖泊研究院, 昆明 650228)
(2: Kunming Dianchi and Plateau Lakes Institute, Kunming 650228, P.R. China)
自工业革命开始,化石燃料的使用快速增加,同时伴随着乱砍滥伐、过度开垦等环境问题的发生,使得大气中的CO2浓度以前所未有的速度持续增加,预计将在21世纪末超过0.08%(V/V)[1]。CO2作为光合作用的主要原料,在藻类的繁殖和生长中发挥着重要作用[2]。而大气中CO2浓度的升高会影响海洋和湖泊等水体表面的CO2气体交换,使得水体环境发生变化,影响水体中浮游植物细胞的新陈代谢过程,进而对水生生态系统和生物地球化学循环产生深远影响[3]。因而,关于浮游植物应对大气CO2浓度升高的生理和生态响应一直是热点问题[4-6],但是目前的相关研究较多集中于海洋浮游植物,而关于大气CO2浓度升高对淡水藻类生长的具体作用研究甚少[7]。
蓝藻作为最古老的原核生物之一,由于世代时间短和高种群密度,所以有充足的时间和能力快速进化以适应外界环境的变化[8]。面对环境CO2浓度的变化,蓝藻经过长期进化,形成了一套高效的CO2浓缩机制(CO2-concentrating mechanisms, CCM)。Shapiro[9]的研究结果表明与真核藻类相比,水华蓝藻CCM更能适应低CO2和高pH值环境,使其容易形成水华。迄今为止,在蓝藻CCM的结构研究中发现了5个不同的碳吸收系统,其中2个为CO2吸收系统,3个为碳酸氢盐吸收系统[10]。2个CO2吸收系统分别是NDH-13 CO2吸收系统和NDH-14 CO2吸收系统,前者表现出对CO2高亲力(K0.5=1~2 μmol/L CO2)和低通量率,后者对CO2低亲和力(K0.5=10~15 μmol/L CO2)和高通量率。3个碳酸氢盐吸收系统分别为2个依赖Na+-碳酸氢盐运输系统(bicA和sbtA)和1个依赖ATP-碳酸氢盐运输系统(BCT1),其中bicA表现为碳酸氢盐低亲和力(K0.5=70~350 μmol/L HCO3-)和高通量率,sbtA为碳酸氢盐高亲和力(K0.5 < 5 μmol/L HCO3-)和低通量率,而BCT1则为碳酸氢盐中等亲和力(K0.5=10~15 μmol/L HCO3-)和低通量率。研究表明,NDH-13 CO2吸收系统、NDH-14 CO2吸收系统和BCT1存在于大多数淡水蓝藻中,而bicA和sbtA 2种碳酸氢盐吸收系统则存在着明显的个体差异[10]。根据sbtA和bicA基因是否存在,可以将蓝藻划分为sbtA型、bicA型以及bicA+sbtA 3种不同的CCM基因型。不同微囊藻个体CCM差异可能影响其竞争策略和优势的形成。目前,对于微囊藻CCM机制及其对CO2的响应,主要集中在碳酸酐酶和Rubisco酶等相关研究,而对微囊藻CCM基因型的多样性以及微进化对CO2的响应关注较少。
因此,本研究在云南滇池对微囊藻水华过程进行跟踪采样,分析微囊藻水华前、中、后和末期CCM基因型的动态变化特征,并在室内模拟低、中和高3种CO2浓度条件,分析不同CCM基因型的微囊藻对外界环境中CO2浓度变化的适应策略,旨在探究自然水体条件下CCM微进化与微囊藻种群演替的关系,进而为揭示环境CO2升高对微囊藻水华演替和发展以及水华形成机制提供重要的理论和实验依据。
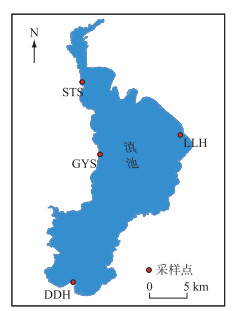
1 材料与方法 1.1 研究区域概况与样品采集滇池(24°40′~25°02′N,102°36′~102°40′E) 位于云贵高原,属亚热带高原季风气候。年平均气温15℃。平均水域面积310 km2,平均水深4.7 m,流域面积2920 km2。滇池被海埂大堤划分为草海和外海两部分。其中外海占湖区总面积的96.7%。本研究分别在外海的4个方位设置了4个采样点(图 1)。分别是东大河(DDH)、观音山(GYS)、洛龙河(LLH)和生态所(STS)。于2021年5—11月的每月采集水样1~2次。使用水样采集器采集表层水样(距水面0.5 m),重复采样3次,混合后立即放入冰盒中于当天带回实验室做进一步分析。
|
图 1 滇池采样点分布示意 Fig.1 Distributions of sampling sites at Lake Dianchi |
使用多参数水质分析仪DS5 /DS5X(Hydrolab,美国)现场测定表层水体的水温(WT)、pH及溶解氧(DO)。采用钼酸铵分光光度法测定总磷(TP),采用紫外分光光度法测定总氮(TN)。用酸性滴定法测定高锰酸盐指数(CODMn),采用丙酮浸提分光光度法测定叶绿素a的含量。采用酸碱指示剂滴定法测定水样总碱度(ALK)。总碱度=[HCO3-]+2[CO32-]+[OH-]-[H+],根据温度查表得到H2CO3的化学平衡常数K1、K2,结合pH值计算水体中的碳酸盐、碳酸氢盐以及CO2(aq)含量。总溶解性无机碳CT=[HCO3-]+[CO32-]+[CO2(aq)]。
1.3 基因组DNA的提取取250 mL混匀后的水样经0.22 μm滤膜抽滤,含藻滤膜于-80℃冰箱中冻存。滤膜剪碎后采用改良CTAB法提取DNA[11]。
1.4 扩增引物及荧光定量PCR标准曲线的构建本研究所选用的引物如表 1所示。其中引物对16S-F/16S-R和引物对sbtA-F2/sbtA-R2由Giovanni等设计[12-13],分别用于特异性扩增微囊藻的16S rDNA基因和sbtA基因。引物对bicA-F/bicA/R通过软件DNAMAN设计,用于特异性扩增微囊藻bicA基因。所有引物由生工生物技术有限公司合成。3个基因片段的PCR扩增产物经琼脂糖凝胶电泳后,对目的条带进行胶回收。纯化后的产物通过TA克隆与PMD-19T载体连接,并转入感受态E.coli 细胞DH5α中。挑取阳性克隆过夜摇菌,采用质粒小体试剂盒(天根,北京)提取质粒。将质粒线性化片段溶于ddH2O制备成标准品。采用微量分光光度计NanoDrop 1000(Thermo,美国)测定标准品中的质粒浓度。标准品基因拷贝数(copies/mL)=质粒浓度×10-9×6.02×1023/[质粒长度(bp)+目的片段(bp)×660]。将制备的标准品10倍梯度稀释构建标准曲线。3条标准曲线扩增效率分别为85.71%、94.61%和89.34%。
| 表 1 本研究所用引物序列 Tab. 1 Primer sequences used in this study |
定量PCR反应体系为20 μL,其中含有TB GreenPremix Ex TaqII 10 μL、ROX Reference Dye II 0.4 μL,上下游引物各0.8 μL、DNA模板2 μL,超纯水6 μL。反应程序如下:95℃预变性2 min,95℃变性10 s,52℃退火30 s,72℃ 15 s,40个循环。每个样品重复测定3次。将得到的Ct值代入标准曲线计算样品中16S rDNA、bicA和sbtA基因的拷贝数。以微囊藻16S rDNA基因的拷贝数表征水体微囊藻总量,以bicA和sbtA基因拷贝数与16S rDNA拷贝数的比值表征两种基因型微囊藻的相对丰度。
1.6 藻种培养与室内实验设计实验所用微囊藻藻株FACHB-908(sbtA型)来自中国科学院淡水藻种库,A5(bicA型)分离自三峡水库,纯化后的微囊藻藻种于MA培养基中进行扩大培养。培养温度(25±1)℃,光照强度30 μmol protons /(m2 ·s),光照周期12 h ∶12 h(光照∶黑暗)。
实验将等生物量的两种CCM基因型的微囊藻分别在浓度为0.02%、0.04%和0.08%的CO2条件下进行混合培养。培养体积为400 mL,初始藻细胞接入量为OD680=0.07,每个处理设置3个重复。不同浓度的CO2通过空气及纯氮气以一定比例的流量混合实现。所有气体进入之前均经过0.22 μm无菌滤膜过滤,经复合气体分析仪检测校正CO2浓度后用于实验。第0、3、7、11和15天对各处理进行了取样,样品的DNA提取及定量PCR方法同前。
1.7 数据处理及分析采用Excel和SPSS 24(IBM Inc., Chicago, IL, 美国)进行数据的统计分析,P < 0.05被认为具有统计学意义,并使用Origin 2021(Origin Lab Inc.,Northampton, MA, 美国)进行绘图。不同基因型微囊藻和环境因子Mantel检验分析在R 4.2.2中使用linkET包和dplyr包进行分析和绘制[14],其中Bray-curtis距离用于物种分析,欧几里得距离(Euclidean distance)用于环境因子分析。
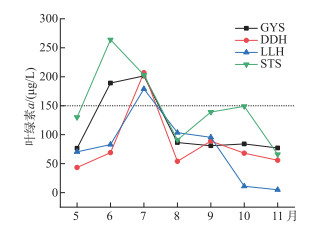
2 结果 2.1 滇池各样点叶绿素a浓度的动态变化为确定滇池水华的发生状况,测定了4个样点5—11月份的叶绿素a浓度。结果显示,滇池的叶绿素a浓度在时间上变化较大,且不同样点的变化不一致(图 2)。根据叶绿素a浓度的变化,发现各样点均有水华的发生,其发生的时间和程度在不同样点间有着一定的差异,但最大值都超过了150 μg/L(图 2)。根据Wu[15]的研究,将叶绿素浓度高于150 μg/L的月份划定为水华中期,8—9月为水华后期,10—11月为水华末期。
|
图 2 不同时期滇池各采样点的叶绿素a浓度 Fig.2 Chl.a concentration at different sampling points in Lake Dianchi at different periods |
通过测定滇池的无机碳发现,各无机碳浓度在时空上的变化趋势并不完全相同。各样点中的CT和HCO3-浓度相对较高,两者具有相似的变化趋势,基本表现出水华前期和末期高于中、后期的趋势,在LLH中更加明显(图 3c)。整体上,滇池中的CO2(aq)浓度的最小值出现在水华的中期或者后期,但在水华前、末期有所升高,在GYS和DDH中尤其明显,而LLH中CO2(aq)浓度的变化相对比较稳定(图 3)。相比于其它形态的无机碳,滇池的CO32-浓度的时空变化较大,尤其是在空间上,各样点没有明显一致的变化趋势,DDH和GYS中的CO32-浓度相对较低,而LLH和STS中的CO32-浓度相对较高(图 3)。在整个水华过程中,DDH和GYS中的CO32-浓度变化趋势较为一致,均是先升高后降低,在水华中、后期达到了最大值;LLH中的CO32-浓度则表现出先升高后降低的趋势,在水华后期达到了最大值;而STS中的CO32-浓度逐渐升高,并在水华末期达到最大值(图 3)。总之,在水华过程中CO2(aq)浓度变化较为平缓,CO32-的起伏较大,CT和HCO3-同步性较强,并且在空间上都表现出了一定的差异性。

|
图 3 水华过程中滇池各样点的无机碳浓度变化 (a: 东大河(DDH); b: 观音山(GYS); c: 洛龙河(LLH); d: 生态所(STS)) Fig.3 Changes in inorganic carbon concentration at different locations in Lake Dianchi during bloom |
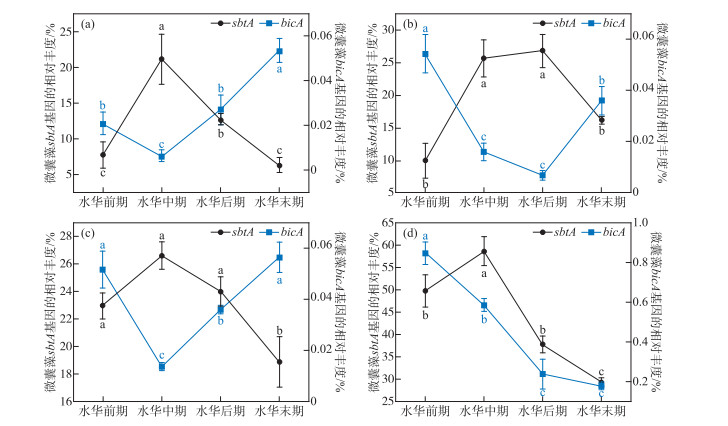
对滇池中不同基因型微囊藻鉴定的结果显示。在滇池的各样点中,不同基因型微囊藻的相对丰度在空间上具有一定的差异,并且在整个水华过程中sbtA基因型微囊藻和bicA基因型微囊藻的变化趋势相反。相同的是,sbtA基因型微囊藻在各样点中始终占据绝对优势,相对丰度远远高于bicA基因型微囊藻(图 4)。在整个水华过程中,除STS外,滇池的bicA基因型微囊藻的相对丰度表现出了先降低后升高的趋势,DDH与LLH的结果相一致,最小值均出现在水华中期,且显著低于其它3个时期,水华后期显著低于末期(P < 0.05,图 4a和c);GYS的最小值出现在水华后期,与水华中期无显著差异,但显著低于水华前和末期(P < 0.05,图 4b);STS的变化趋势与其他样点不同,bicA基因型微囊藻的相对丰度逐渐降低,水华后、末期具有最小值,且显著低于前、中期(P < 0.05,图 4d)。对于sbtA基因型微囊藻,其相对丰度表现出的趋势则恰恰相反,DDH和STS表现一致,在水华中期达到最大并显著高于另外3个时期(P < 0.05,图 4a和d);GYS则表现为水华中、后期显著高于水华末期(P < 0.05,图 4b);LLH同样也是在水华中期达到最大值,且显著高于水华后期(P < 0.05,图 4c)。
|
图 4 微囊藻水华过程中滇池微囊藻不同基因型的相对丰度变化: (a)东大河(DDH); (b)观音山(GYS); (c)洛龙河(LLH); (d)生态所(STS)(不同的小写字母表示有显著性差异, P < 0.05) Fig.4 Variation in the relative abundance of different Microcystis genotypes in Lake Dianchi during Microcystis bloom |
为探究水体理化因子与bicA基因型和sbtA基因型微囊藻之间的关系,经Mantel检验分析发现,在不同的水华时期,与两种基因型微囊藻显著相关的理化因子并不一致,且多表现出与sbtA基因型微囊藻显著相关(图 5)。结果显示,在水华前期,bicA基因型微囊藻与Chl.a和TP的相关性系数较高,分别为0.59和-0.41,但并无显著性差异(图 5a),sbtA基因型微囊藻则与Chl.a呈显著正相关(r=0.57,P < 0.05,图 5a);水华中期的bicA基因型微囊藻仅与Alk相关性较高但不显著(r=0.36,图 5b),sbtA基因型微囊藻则与Alk呈显著正相关(P < 0.05,图 5b);在水华后期,bicA基因型微囊藻与TN显著正相关(P < 0.05,图 5c),而无理化因子与sbtA基因型微囊藻显著相关(图 5c);水华末期与sbtA基因型微囊藻显著相关的理化因子有pH和CO2(aq)(P < 0.05,图 5d),并无与bicA基因型微囊藻显著相关的理化因子。对整个水华期两种基因型微囊藻和理化因子的Mantel检验分析结果显示sbtA基因型微囊藻与pH和CO2(aq)显著正相关,bicA基因型微囊藻与Chl.a显著正相关(P < 0.05,图 5e);结果还表明CT与sbtA基因型微囊藻负相关,与bicA基因型微囊藻正相关。

|
图 5 在不同水华期理化因子与两种基因型微囊藻的相关性分析(a、b、c、d、e分别代表水华前、中、后、末期、整个水华时期) Fig.5 Correlation analysis between physicochemical factors and two genotypes of Microcystis at different bloom stages |
为了进一步探究不同基因型微囊藻对CO2的响应,使用针对微囊藻的特异性引物对不同组合微囊藻的DNA进行荧光定量PCR。结果显示,在不同浓度CO2处理下bicA和sbtA两种基因型微囊藻的基因拷贝数在培养过程中均出现了明显分异(图 6)。在低浓度CO2处理组中,sbtA型的微囊藻基因拷贝数从共培养开始至结束逐渐升高且始终显著高于bicA基因型微囊藻(P < 0.001),具有绝对优势,而bicA基因型微囊藻一直保持比较低的数量(图 6);在中浓度CO2处理组中,sbtA型的微囊藻随着共培养时间的增加,其基因拷贝数也增加,同样显著高于bicA基因型微囊藻(P < 0.001)(图 6);在高浓度CO2处理组中,两种基因型微囊藻的基因拷贝数均随着共培养时间的增加而增加,并且从第3天开始发生明显的分异,第3天以前是sbtA型微囊藻占多数,第3天以后则是bicA基因型微囊藻占绝对优势,其基因拷贝数要显著高于sbtA型微囊藻(P < 0.05)。因此,随着CO2浓度的降低,处于竞争中的不同基因型微囊藻会发生从bicA基因型占优势到sbtA基因型占优势的转变。

|
图 6 bicA 和sbtA 基因型微囊藻在不同浓度CO2处理下的竞争响应 (a、b、c分别为两种基因型藻株在0.08%、0.04%、0.02% CO2浓度下的竞争;*表示0.01 < P < 0.05;* *表示0.001 < P < 0.01;* * *表示P < 0.001) Fig.6 Competitive reaction of Microcystis with bicA and sbtA genotypes at different CO2 concentrations |
CO2作为蓝藻光合作用的重要原料,对蓝藻尤其是具有不同CCM机制的微囊藻水华的形成具有重要的影响。滇池作为云南省内最大的淡水湖频繁暴发蓝藻水华[16-17],已经引起了广泛的关注。
3.1 滇池不同水华期CCM基因型微囊藻的动态变化李原等[18]和代龚圆等[19]的研究发现滇池水华期常出现在6、7月份,并且以微囊藻水华为主,通过对滇池4个采样点7个月的监测结果发现(图 2),虽然各个观测点蓝藻水华暴发的时间有所不同,但都集中在6和7月份,而且位于滇池北部的生态所的水华程度最高,这与先前的研究结果基本一致[19]。CO2是藻类进行光合作用的重要原料[2],由于CO2易溶于水且溶解后的离子形态也受到pH的调节[16],伴随着藻类的繁殖,水体中的无机碳浓度往往会发生变化。滇池水体中溶解的CT和HCO3-在水华前期和末期高于水华中期和后期(图 3),这和蓝藻水华暴发的程度正好相反,说明藻类的大量繁殖可能会在水体中发生碳限制的现象。
不同水华期滇池CCM微囊藻特异性引物荧光定量PCR结果显示(图 4),滇池中所有采样点的sbtA基因型相对丰度均高于bicA基因型微囊藻,占绝对优势。这与曾佳颖等[20]对滇池不同CCM基因型微囊藻的研究结果一致。产生这种现象的原因可能与水体中低CO2浓度有关,已有研究发现低浓度CO2条件下更有利于sbtA基因型微囊藻获得竞争优势[21],促使bicA基因型向sbtA基因型微囊藻的转化[22]。
滇池4个采样点sbtA基因型和bicA基因型微囊藻在不同水华期相对丰度的变化趋势说明,除生态所bicA基因型微囊藻以外,所有点位的bicA基因型微囊藻均出现了水华中、后期高于初期和末期的现象,在洛龙河和观音山还产生了显著性差异,这和HCO3-在这些采样点的浓度变化趋势相反,而与CO2浓度的变化趋势一致。进一步说明bicA基因型微囊藻能在高无机碳和CO2浓度的条件下表现出竞争优势[21, 23]。另外,在所有样点我们都发现sbtA基因型微囊藻相对丰度在中后期高于后期和末期,特别是在东大河和观音山这种现象更为明显。这和sbtA基因型微囊藻在低无机碳的条件下具有竞争优势的结果一致[21, 23],也说明在水华中后期蓝藻水华的暴发程度较高,蓝藻大量繁殖促使水体中出现了碳限制现象[24-26]。为了在水体中获得种群竞争优势,微囊藻类群发生了从bicA基因型向sbtA基因型的转变。随着蓝藻水华强度的降低,在水华末期碳限制减弱,微囊藻类群又发生了从sbtA基因型向bicA基因型的转变,使微囊藻始终能够在浮游植物的竞争中处于优势[18],显示出了微囊藻的快速进化适应能力[12]。
3.2 环境因子对不同CCM基因型微囊藻的影响滇池水华前中后末期理化因素对不同CCM基因型微囊藻的相关性分析结果显示(图 5),在野外条件下微囊藻的生长受到除无机碳外的其他理化因素的影响。在水华早期,Chl.a与bicA基因型正相关,与sbtA基因型显著正相关。由于Chl.a浓度能反映浮游植物的生物量[27],说明滇池中的浮游植物以微囊藻为主,尤其是sbtA基因型微囊藻(图 5a),这与2.3节的结果中滇池sbtA基因型微囊藻在微囊藻中占绝对优势一致。
sbtA基因型微囊藻在水华中期与Alk显著正相关,bicA基因型微囊藻在水华中后期也与Alk相关程度很高,并且与TN显著正相关(图 5b和5c)。偏碱性的环境和充足的氮源更有利于微囊藻的生长[19, 28]。浮游植物在水华中期的大量生长导致了CO2浓度的大幅下降,CO2和氮磷营养盐等营养物质的同化增加了水华发展过程中的碱度和pH值[29-30]。pH值和碱度的增加使无机碳成分向碳酸氢盐转移[31],由于sbtA基因型微囊藻对碳酸氢盐具有高亲和力,因此在水华中后期sbtA基因型微囊藻的相对丰度高于水华早期和末期。
pH能够影响微囊藻的生长[25]和水体中的无机碳[26],曾佳颖等[20]对滇池的研究发现,pH与sbtA基因型的相对优势度呈正比,而与bicA基因型呈反比。而本研究发现这种现象出现在滇池水华末期,并且pH与sbtA基因型微囊藻呈正比(图 5d)。在滇池水华末期水体中的pH均值(8.6)低于水华中后期(8.7和8.8),CO2浓度的增加引起了水体pH的下降[32],使水华末期sbtA基因型微囊藻丰度降低(图 4)。同样的现象也出现在对滇微囊藻和理化因子的整体Mantel检验分析中。同时在对滇池整体的分析中还发现CT的浓度和sbtA基因型微囊藻负相关,与bicA基因型微囊藻正相关(图 5e)。这和先前研究发现sbtA基因型微囊藻在低CT条件下会更好的生长,但在较高的CT环境中则生长较差;反之,bicA基因型微囊藻在低CT环境下生长较差,但在高CT条件下表现良好的实验结果一致[20]。同时在研究中还发现水体中CO2浓度的升高同样也有利于sbtA基因型微囊藻的生长,可能的原因是CO2作为光合作用的重要原料,其浓度的升高对微囊藻的生长和繁殖具有促进作用。通过对两种基因型微囊藻和环境变量之间的相关性分析结果可知,不同CCM基因型微囊藻对不同无机碳的利用相对复杂,基本和先前的研究结果一致[12, 21],但也出现像bicA基因型在生态所的4个水华时期比较特殊的情况,本研究认为这可能和环境因子、物种之间的交互作用有关。
3.3 不同CCM基因型微囊藻对不同CO2浓度响应对bicA和sbtA基因型微囊藻竞争培养的结果表明,在高CO2浓度条件下bicA基因型相较于sbtA基因型微囊藻形成明显的竞争优势,而在低CO2浓度条件下则相反,sbtA基因型微囊藻具有竞争优势(图 6)。Price[33]曾指出bicA基因型藻株对HCO3-亲和力低,表现为低浓度下对碳酸氢盐转运的有效性不高;而sbtA基因型藻株不具备高通量,在高浓度下对碳酸氢盐的转运速率不高。此外,Sandrini等[13]的竞争实验表明当sbtA基因型微囊藻处于高无机碳水平的环境中时,其生长速率会逐渐下降,因此它们常常在低无机碳的水体中具有明显的竞争优势从而在微囊藻水华中占据优势地位;而bicA基因型微囊藻藻株表现为碳酸氢盐低亲和力和高通量率,竞争实验表明其在高无机碳条件下的生长速率明显高于低无机碳条件下的生长速率。野外实验也支持了室内研究结果,即当水体中的无机碳在水华后期逐渐增加时,bicA相对丰度会逐渐增加。这表明了微囊藻能够调节不同CCM基因型来适应外界CO2浓度,当大气中的CO2浓度逐渐增加时,溶解于水体中的无机碳也会逐渐增加,此时bicA基因型藻株具有明显的竞争优势;而当水体中的无机碳水平下降时,基因型为sbtA的微囊藻藻株的生长速率增加,形成竞争优势。
4 结论云南滇池不同采样点之间空间差异较小。不同水华时期,sbtA基因型微囊藻始终占据绝对优势,随滇池水体无机碳浓度的变化促使微囊藻基因型呈现bicA→sbtA→bicA转变的趋势,使得具有CCM机制的微囊藻能够在生态系统中处于竞争优势。环境变量中,Chl.a浓度对水华早期的微囊藻有较强的相关性,总碱度和TN在水华中后期对两种基因型影响较大,而pH和CO2浓度对水华后期sbtA基因型产生了显著影响。室内模拟实验进一步验证了高浓度CO2适合bicA生长,而sbtA基因型对低浓度CO2具有更强的适应性。因此,CO2浓度对两种CCM机制微囊藻的演替起着重要的调控作用。
| [1] |
Pachauri RK, Allen MR, Barros VR et al. Climate Change 2014: Synthesis Report. Contribution of working groups Ⅰ, Ⅱ and Ⅲ to the fifth assessment report of the intergovernmental panel on climate change. Geneva, Switzerland: IPCC, 2014.
|
| [2] |
Li N, Bi YH, Gao DW et al. Effects of elevated CO2 concentration on growth of Microcystis aeruginosa. Acta Hydrobiologica Sinica, 2011, 35(4): 698-702. [李娜, 毕永红, 高大文等. 大气CO2浓度变化对铜绿微囊藻生长的影响. 水生生物学报, 2011, 35(4): 698-702.] |
| [3] |
Hargrave CW, Hamontree S, Gary KP. Direct and indirect food web regulation of microbial decomposers in headwater streams. Oikos, 2010, 119(11): 1785-1795. DOI:10.1111/j.1600-0706.2010.18537.x |
| [4] |
Low-Decarie E, Fussmann GF, Bell G. The effect of elevated CO2 on growth and competition in experimental phytoplankton communities. Global Change Biology, 2011, 17(8): 2525-2535. DOI:10.1111/j.1365-2486.2011.02402.x |
| [5] |
Tortell PD, Trimborn S, Li Y et al. Inorganic carbon utilization by ross sea phytoplankton across natural and experimental CO2 gradients. Journal of Phycology, 2010, 46(3): 433-443. DOI:10.1111/j.1529-8817.2010.00839.x |
| [6] |
Hopkinson BM, Xu Y, Shi D et al. The effect of CO2 on the photosynthetic physiology of phytoplankton in the Gulf of Alaska. Limnology and Oceanography, 2010, 55(5): 2011-2024. DOI:10.4319/lo.2010.55.5.2011 |
| [7] |
Zhao XH, Tang LS, Shi XL et al. Effects of simulated elevation of atmospheric CO2 concentration on the physiological features of spring phytoplankton in Taihu Lake. Environmental Science, 2013, 34(6): 2126-2133. [赵旭辉, 汤龙升, 史小丽等. 模拟大气CO2水平升高对春季太湖浮游植物生理特性的影响. 环境科学, 2013, 34(6): 2126-2133.] |
| [8] |
Collins S. Many possible worlds: Expanding the ecological scenarios in experimental evolution. Evolutionary Biology, 2011, 38(1): 3-14. DOI:10.1007/s11692-010-9106-3 |
| [9] |
Shapiro J. Current beliefs regarding dominance by blue-greens: The case for the importance of CO2 and pH. Internationale Vereinigung fur theoretische und angewandte Limnologie, 1990, 24(1): 38-54. |
| [10] |
Price GD, Badger MR, Woodger FJ et al. Advances in understanding the cyanobacterial CO2-concentrating-mechanism (CCM): Functional components, Ci transporters, diversity, genetic regulation and prospects for engineering into plants. Journal of Experimental Botany, 2008, 59(7): 1441-1461. DOI:10.1093/jxb/erm112 |
| [11] |
刘洋. 太湖水华鱼腥藻的多样性、时空分布及生理特性研究[学位论文]. 武汉: 中国科学院大学, 2013.
|
| [12] |
Sandrini G, Ji X, Verspagen JMH et al. Rapid adaptation of harmful cyanobacteria to rising CO2. PNAS, 2016, 113(33): 9315-9320. DOI:10.1073/pnas.1602435113 |
| [13] |
Sandrini G, Tann RP, Schuurmans JM et al. Diel variation in gene expression of the CO2-concentrating mechanism during a harmful cyanobacterial bloom. Frontiers in Microbiology, 2016, 7: 551. |
| [14] |
Sunagawa S, Coelho LP, Chaffron S et al. Structure and function of the global ocean microbiome. Science, 2015, 348(6237). |
| [15] |
Wu GZ, Xu ZX. Prediction of algal blooming using EFDC model: Case study in the Daoxiang Lake. Ecological Modelling, 2011, 222(6): 1245-1252. DOI:10.1016/j.ecolmodel.2010.12.021 |
| [16] |
Wang JH, He LQS, Yang C et al. Comparison of algal bloom related meteorological and water quality factors and algal bloom conditions among Lakes Taihu, Chaohu, and Dianchi (1981-2015). J Lake Sci, 2018, 30(4): 897-906. [王菁晗, 何吕奇姝, 杨成等. 太湖、巢湖、滇池水华与相关气象、水质因子及其响应的比较(1981—2015年). 湖泊科学, 2018, 30(4): 897-906. DOI:10.18307/2018.0403] |
| [17] |
范玉燕. 三峡库区支流水库流域非点源污染特征及其变化规律研究[学位论文]. 重庆: 重庆交通大学, 2014.
|
| [18] |
Li Y, Zhang M, Wang RN. The temporal and spation variation of the cyanobacteria which caused the water bloom in the Dianchi Lake, Kunming China. Journal of Yunnan University (Natural Sciences Edition), 2005(3): 272-276. [李原, 张梅, 王若南. 滇池的水华蓝藻的时空变化. 云南大学学报(自然科学版), 2005(3): 272-276. DOI:10.3321/j.issn:0258-7971.2005.03.020] |
| [19] |
Dai GY, Li J, Li L et al. The spatio-temporal pattern of phytoplankton in the north basin of Lake Dianchi and related environmental factors. Acta Hydrobiologica Sinica, 2012, 36(5): 946-956. [代龚圆, 李杰, 李林等. 滇池北部湖区浮游植物时空格局及相关环境因子. 水生生物学报, 2012, 36(5): 946-956.] |
| [20] |
Zeng JY, Jiang JY, Zuo J et al. Response of cyanobacteria with different inorganic carbon transport genotypes to environmental CO2 changes. Acta Hydrobiologica Sinica, 2023, 47(7): 1069-1077. [曾佳颖, 江婧宇, 左俊等. 不同无机碳转运基因型蓝藻对环境CO2变化的响应. 水生生物学报, 2023, 47(7): 1069-1077.] |
| [21] |
Sandrini G, Matthijs HCP, Verspagen JMH et al. Genetic diversity of inorganic carbon uptake systems causes variation in CO2 response of the cyanobacterium Microcystis. ISME Journal, 2014, 8(3): 589-600. DOI:10.1038/ismej.2013.179 |
| [22] |
Sandrini G, Jakupovic D, Matthijs HCP et al. Strains of the harmful Cyanobacterium Microcystis aeruginosa differ in gene expression and activity of inorganic carbon uptake systems at elevated CO2 levels. Applied and Environmental Microbiology, 2015, 81(22): 7730-7739. DOI:10.1128/AEM.02295-15 |
| [23] |
Price GD, Shelden MC, Howitt SM. Membrane topology of the cyanobacterial bicarbonate transporter, sbtA, and identification of potential regulatory loops. Molecular Membrane Biology, 2011, 28(5): 265-275. DOI:10.3109/09687688.2011.593049 |
| [24] |
Talling JF. Depletion of carbon-dioxide from lake water by phytoplankton. Journal of Ecology, 1976, 64(1): 79-121. DOI:10.2307/2258685 |
| [25] |
Maberly SC. Diel, episodic and seasonal changes in pH and concentrations of inorganic carbon in a productive lake. Freshwater Biology, 1996, 35(3): 579-598. DOI:10.1111/j.1365-2427.1996.tb01770.x |
| [26] |
Gu BH, Schelske CL, Coveney MF. Low carbon dioxide partial pressure in a productive subtropical lake. Aquatic Sciences, 2011, 73(3): 317-330. DOI:10.1007/s00027-010-0179-y |
| [27] |
Xu DM, Chen XS, Shao B. Oxidative Damage and cytotoxicity of perfluoro octane sulfonate on Chlorella vulgaris. Bulletin of Environmental Contamination and Toxicology, 2017, 98(1): 127-132. DOI:10.1007/s00128-016-1957-6 |
| [28] |
Yang B, Chu ZS, Jin XC et al. Influence of CO2/pH on growth and photosynthesis of three kinds of algae. China Environ Sci, 2007, 27(1): 54-57. [杨波, 储昭升, 金相灿等. CO2/pH对三种藻生长及光合作用的影响. 中国环境科学, 2007, 27(1): 54-57.] |
| [29] |
Wolf-Gladrow DA, Zeebe RE, Klaas C et al. Total alkalinity: The explicit conservative expression and its application to biogeochemical processes. Marine Chemistry, 2007, 106(1-2): 287-300. DOI:10.1016/j.marchem.2007.01.006 |
| [30] |
Schindler DW, Turner MA, Hesslein RH. Acidification and alkalinization of lakes by experimental addition of nitrogen-compounds. Biogeochemistry, 1985, 1(2): 117-133. DOI:10.1007/BF02185037 |
| [31] |
Verspagen JMH, Van de Waal DB, Finke JF et al. Rising CO2 levels will intensify phytoplankton blooms in eutrophic and hypertrophic lakes. PLoS One, 2014, 9(8): e104325. DOI:10.1371/journal.pone.0104325 |
| [32] |
Shi X, Zhao X, Zhang M et al. The responses of phytoplankton communities to elevated CO2 show seasonal variations in the highly eutrophic Lake Taihu. Canadian Journal of Fisheries and Aquatic Sciences, 2016, 73(5): 727-736. DOI:10.1139/cjfas-2015-0151 |
| [33] |
Price GD. Inorganic carbon transporters of the cyanobacterial CO2 concentrating mechanism. Photosynthesis Research, 2011, 109(1/2/3): 47-57. |
 2023, Vol. 35
2023, Vol. 35 

