近几十年来,水体富营养化已成为全球性的环境问题[1]。氮是组成生命的最基本的元素之一,同时也是造成水体富营养化的最主要的营养物质之一。反硝化或厌氧氨氧化(Anammox) 可以将水体中的氮素转化为N2逸出,因此被认为是水生态系统中氮素自净的最重要的两个途径[2]。然而,Anammox是自养型生物脱氮反应,较易发生于有机碳含量相对较低的区域,因此对于富营养化水体来说,反硝化可能才是最主要的脱氮途径[3]。
近年来,一种新型的由微生物介导的Anammox与三价铁[Fe (Ⅲ)]还原相结合的方式(铁氨氧化,Feammox)在活性污泥的厌氧培养过程中被发现,该过程中,在铵(NH4+)被氧化为亚硝酸盐(NO2-)的同时还伴随着Fe(Ⅲ)的还原[4]。此后,Feammox逐渐在许多生境,如水稻土[5],潮间带湿地[6],河岸带[7]和湖泊沉积物[8]中被发现。除NO2-外,Feammox过程中NH4+还可以被氧化为N2或硝酸盐(NO3-)[9]。从典型土壤中Feammox反应(方程(1)、(2)、(3))的吉布斯自由能变[10]来看,生成N2是该反应更为主要的氮素转化途径。由Feammox反应产生的N2可以直接从水体逸出,而其它产物(NO2-或NO3-)又可以为反硝化提供底物,因此Feammox同样可能对水生态系统中的氮素自净有着极大的作用。
| $3 \mathrm{Fe}(\mathrm{OH})_3+5 \mathrm{H}^{+}+\mathrm{NH}_4^{+} \rightarrow 3 \mathrm{Fe}(\text { II })+0.5 \mathrm{~N}_2+9 \mathrm{H}_2 \mathrm{O} \left(\Delta_r G_m=-245 \mathrm{~kJ} / \mathrm{mol}\right) $ | (1) |
| $6 \mathrm{Fe}(\mathrm{OH})_3+10 \mathrm{H}^{+}+\mathrm{NH}_4^{+} \rightarrow 6 \mathrm{Fe}(\text { II })+\mathrm{NO}_2^{-}+16 \mathrm{H}_2 \mathrm{O} \left(\Delta_r G_m=-164 \mathrm{~kJ} / \mathrm{mol}\right) $ | (2) |
| $ \begin{array}{ll} 8 \mathrm{Fe}(\mathrm{OH})_3+14 \mathrm{H}^{+}+\mathrm{NH}_4^{+} \rightarrow 8 \mathrm{Fe}(\text { II })+\mathrm{NO}_3^{-}+21 \mathrm{H}_2 \mathrm{O} \left(\Delta_r G_m=-207 \mathrm{~kJ} / \mathrm{mol}\right) \end{array} $ | (3) |
太湖,面积2239 km2,是我国的第三大淡水湖泊,具有饮用水源、蓄洪、工农业用水、航运等多重功能[11]。近几十年来,太湖富营养化日趋严重,并常年暴发蓝藻水华。研究表明,夏季太湖浮游植物处于氮限制状态,其原因可能是夏季太湖具有强大的氮素自净能力[12]。在此氮素自净过程中,除了常规反硝化和厌氧氨氧化以外,是否存在一些新的脱氮途径以及这些途径的脱氮潜力如何等尚不明确。
调查数据显示,太湖沉积物中含有较多的铁元素[13],而沉积物中衰亡蓝藻的降解又会产生大量的NH4+[14],这说明太湖沉积物中存在充足的Feammox反应底物。此外,蓝藻水华的暴发会营造出白天好氧、夜间厌氧的环境[15],而这种好氧/厌氧交替的环境被认为是Feammox反应的热点场所[7]。因此我们推测,Feammox可能在夏季太湖氮素自净的过程中发挥了较为重要的作用。为此,本研究采集太湖不同区域沉积物进行厌氧培养,结合分子生物学手段,对Feammox是否可以在太湖沉积物中发生、不同底物浓度对Feammox的影响以及太湖不同区域Feammox潜在速率等进行探究,以丰富湖泊氮素循环理论,并为太湖富营养化治理提供新的思路。
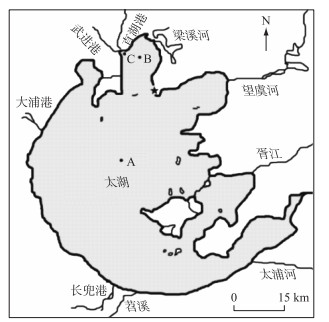
1 材料与方法 1.1 研究区域和样品采集于蓝藻暴发期(2022年8月)布点采集沉积物样品(图 1)。采样时间为下午14:00—16:00,天气晴,风力等级3级,采样时大量的蓝藻上浮并堆积在湖体表面。各采样点中,河口区(位点C)堆积了大量的蓝藻,梅梁湾区(位点B)湖面也有较多的蓝藻分布,而湖心区蓝藻密度则相对较低。使用彼得逊采泥斗采集湖泊表层沉积物样品,装入自封袋后置于保温箱中,低温下运回实验室后立即开展理化性质的检验和厌氧培养实验,剩余的沉积物样品置于4℃冰箱冷藏,用于测定细菌群落结构的样品则置于-70℃超低温冰箱中保存。
|
图 1 太湖采样位点 Fig.1 Location of sampling points in Lake Taihu |
为考察氨氮(NH4+-N)和Fe(Ⅲ)浓度对太湖沉积物中Feammox的影响,采用梅梁湾中心处(位点B)沉积物样品进行厌氧培养实验,具体操作如下:将沉积物样品与去离子水以质量比1 ∶3混合形成均质泥浆,取3份该泥浆于-70℃超低温冰箱中保存以进行细菌群落结构分析。称取12 g上述泥浆30份,分别与80 mL去离子水混合后加入血清瓶(约140 mL)中,氦气曝气20 min后加厌氧去离子水近满。厌氧手套箱中避光培养2 d,以去除样品本底的NO3-、NO2-以及残余的氧气。实验分为两组,第一组中加入0.5 mL 0.1 mol/L NH4Cl,再加入不同体积0.5 mol/L FeCl3使得Fe(Ⅲ)添加量分别为0、2.8、5.6、8.4、14.0 mg;第二组加入0.5 mL 0.5 mol/L FeCl3,再分别加入不同体积0.1 mol/L NH4Cl,使得NH4+-N添加量分别为0、0.14、0.28、0.42、0.7 mg NH4+-N,每个处理设3个平行。室温下厌氧避光培养,定时采集上方清液,测定硝酸盐氮(NO3--N)、亚硝酸盐氮(NO2--N)、NH4+-N和亚铁离子[Fe(Ⅱ)]浓度,每次取样后用封口膜密封,以防止厌氧手套箱中可能残留的氧气进入。实验结束时,选取沉积物颜色变化最明显的处理组,进行DNA提取和高通量测序。
1.3 不同蓝藻暴发区域沉积物Feammox潜在速率测定太湖不同区域3个位点的沉积物处理方法同上。在厌氧避光培养2 d后,将浆液混合均匀,取0.5 mL于含4.5 mL 2 mol/L KCl的离心管中,用以测定NH4+-N含量。根据上述实验结果,分别添加一定量的Fe(Ⅲ)和15NH4+-N(99%,源叶生物),每个位点设5个平行。25℃下厌氧避光培养24 h后,使用注射器加入0.1 mL 7 μmol/L ZnCl2以停止血清瓶中的微生物活动,通过膜接口质谱仪(MIMS)测定29N2和30N2的浓度。沉积物中含有较多的14NH4+-N会对Feammox潜在速率的测定产生干扰,因此参考Ding等[16]方法,采用公式R=R30/(P15)2进行校正,式中R为Feammox潜在速率,R30为30N2产生速率,P15为15NH4+-N占总NH4+-N的比例。
1.4 DNA提取和高通量测序采用EZNA土壤DNA提取试剂盒(Omega, USA)提取沉积物基因组DNA,选择引物对338F (5’-ACTCCTACGGGAGGCAGCA-3’)和806R (5’-GGACTACHVGGGTWTCTAAT-3’)对16S rRNA基因的V3~V4区域进行扩增。采用Illumina MiSeq平台进行高通量测序,利用Mothur等软件进行细菌群落结构及多样性分析,并将测序原始数据上传至NCBI数据库, SRA编号PRJNA905072。测序和数据分析工作由上海凌恩生物科技公司完成。
1.5 理化性质分析沉积物有机质含量和含水率的测定分别参照标准方法《GB9834—1988》和《HJ613—2011》进行;采用盐酸提取邻菲罗琳分光光度法测定沉积物活性铁,采用湿法消解-原子吸收分光光度法测定总铁含量,采用KCl提取水杨酸分光光度法测定沉积物中NH4+-N含量,结果均以干重计;采用YSI便携式水质分析仪测定表层水体的pH和溶解氧(DO);分别采用丙酮提取分光光度法、水杨酸分光光度法、紫外分光光度法和N-(1-萘基)-乙二胺分光光度法测定水中叶绿素a、NH4+-N、NO3--N和NO2--N浓度[17]。
1.6 数据分析参照Li等[6]方法,估算太湖由Feammox导致的氮去除量,其公式为:
| $ N_{\mathrm{r}}=3.65 \times \rho \times h \times(1-W) \times R $ | (4) |
式中,Nr为氮去除量(t/(km2 ·a));ρ为太湖沉积物密度(g/cm3);h为发生Feammox反应的沉积物深度(cm);W为含水率(%);R为Feammox潜在速率(mg/(kg ·d))。采用SPSS18.0软件进行相关性(Pearson)和单因素方差分析(One-way ANOVA),P < 0.05代表显著水平,P < 0.01代表极显著水平。
2 结果与分析 2.1 太湖不同区域水体和沉积物理化性质夏季是太湖蓝藻暴发季节,因此水体中叶绿素a浓度很高,其中河口区达到83.9 mg/m3,而湖心区也有47.7 mg/m3。受蓝藻光合作用的影响,3个位点的水体均有较高的溶解氧浓度,并且呈现弱碱性。3个位点的沉积物中有机质和铁元素的含量均比较高,其中梅梁湾中心位点的有机质浓度达到15.14 mg/L,河口区的总铁达23.7 g/kg, 而盐酸可提取Fe(Ⅱ)和Fe(Ⅲ)浓度达2.5、5.4 g/kg(DW)(表 1)。
| 表 1 太湖不同区域水体和沉积物理化性质 Tab. 1 Physiochemical properties of the water and sediments in different areas of Lake Taihu |
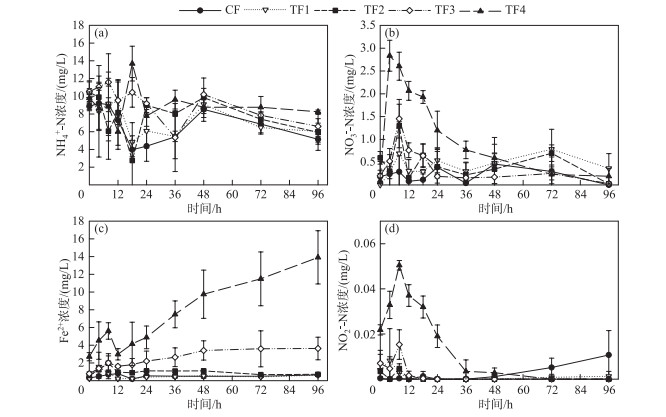
采用梅梁湾中心(位点B)的沉积物进行室内厌氧培养实验,考察不同Fe(Ⅲ)含量对Feammox过程的影响(图 2)。从图中可以看出,各处理组中的NH4+-N在培养的前24 h内均有较大幅度下降的过程,此后开始上升,在48 h后又持续下降。各实验组中的NO3--N浓度在培养后均急剧上升,且随着Fe(Ⅲ)添加量的增加而增大,此后NO3--N浓度又快速下降。与NO3--N浓度变化趋势类似,Fe(Ⅱ)浓度也在培养8 h后急剧上升,在经历短暂的下降过程后,Fe(Ⅱ)浓度又持续上升,其中Fe(Ⅲ)添加量最大的处理组中Fe(Ⅱ)浓度最高,在培养结束后达到13.9 mg/L。NO2--N浓度的变化趋势与NO3--N类似,但是始终处于较低的水平,其最大值仅有0.05 mg/L左右。
|
图 2 不同Fe(Ⅲ)添加量的处理中NH4+-N (a)、NO3--N (b)、Fe2+ (c)、NO2--N (d)的浓度变化(CF为对照组;TF1、TF2、TF3、TF4分别为添加2.8、5.6、8.4、14.0 mg Fe(Ⅲ)的处理) Fig.2 Variations of the concentrations of NH4+-N (a), NO3--N (b), Fe2+ (c) and NO2--N (d) in the treatments with different Fe(Ⅲ) addition (CF represented control group; TF1, TF2, TF3 and TF4 were the treatments with the additions of 2.8, 5.6, 8.4 and 14.0 mg Fe(Ⅲ), respectively) |
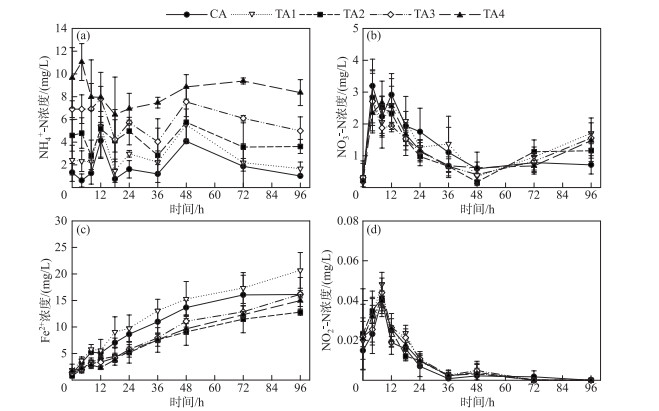
添加不同量NH4+-N各处理中,NH4+-N浓度在厌氧培养4~8 h后均有较大的下降,而与之相对应,NO3--N浓度快速上升。培养12 h后,NH4+-N浓度急剧上升,此后又继续下降,呈现出上下波动的变化过程,而NO3--N浓度则持续下降,但是在48 h后又开始缓慢上升。与NH4+-N和NO3--N不同,各处理组中Fe(Ⅱ)浓度均持续上升,其中处理组TA1(NH4+-N添加量为0.14 mg)的上升速度最快,在培养结束时该处理组中的Fe(Ⅱ)浓度达20.7 mg/L。与添加不同量Fe(Ⅲ)的处理相似,NO2--N浓度也维持在较低的水平,峰值仅0.05 mg/L左右(厌氧培养后8 h,图 3)。
|
图 3 不同NH4+-N添加量的处理中NH4+-N (a)、NO3--N (b)、Fe2+ (c)、NO2--N (d)浓度的变化(CA为对照组;TA1、TA2、TA3、TA4分别为添加0.14、0.28、0.42、0.7 mg NH4+-N的处理) Fig.3 Variations of the concentration of NH4+-N (a), NO3--N (b), Fe2+ (c), NO2--N (d) in the treatments with different NH4+-N addition (CA represented control group; TA1, TA2, TA3 and TA4 were the treatments with the additions of 0.14, 0.28, 0.42 and 0.7 mg NH4+-N, respectively) |
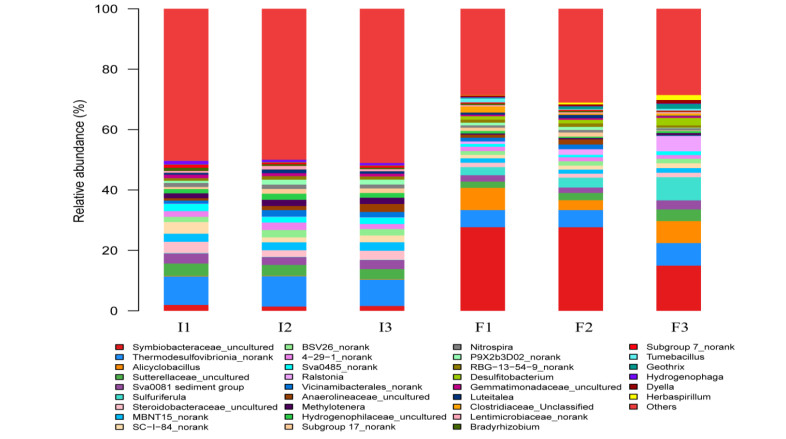
厌氧培养过程中,添加0.70 mg NH4+-N和8.4 mg Fe(Ⅲ)的处理(TF3)中沉积物颜色和形态变化最为明显,因此选择该处理的沉积物进行细菌群落结构分析。通过Illumina MiSeq测序共获得了221553个高质量序列(平均长度425 bp),各样品的Shannon稀释曲线均接近平台期,表明样本数据已达到饱和。基于97%的阈值进行OTU聚类,获得1904~2883个细菌OTU数,最终共鉴定出58门、154纲、335目、477科、741属。厌氧培养前后,细菌的群落结构有较大的变化。培养前以γ-变形菌纲为代表的变形菌(Proteobacteria)门最具优势(30.6%~37.0%),其次是硝化菌门(11.6%~13.9%)、脱硫菌门(7.0%~9.3%)、拟杆菌门(7.4%~10.1%)等。培养结束后,厚壁菌门的丰度大大提高,从培养前的1.9%~2.5%提高到26.2%~40.3%,其它门类的细菌的丰度都有不同程度的下降(附图Ⅰ),而Chao1、Simpson等物种丰富度指数也表明细菌的多样性在厌氧培养后有一定程度的降低(附表Ⅰ)。
在属水平上,Thermodesulfovibrionia_norank是培养前沉积物中的优势属,其丰度达到8.7%~10.0%,其次是uncultured Sutterellaceae(3.3%~4.1%)和uncultured Steroidobacteraceae(2.2%~3.7%),而在厌氧培养之后Symbiobacteraceae_uncultured成为优势属,其丰度达到15.0%~27.7%,其次是Thermodesulfovibrionia_norank(5.7%~7.4%)和Alicyclobacillus(3.3%~7.4%)(附图Ⅱ)。
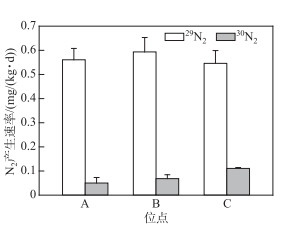
2.4 太湖不同区域沉积物Feammox潜在速率底物浓度对Feammox的影响结果表明,添加5.6 mg Fe(Ⅲ)(处理组TF2)和0.28 mg NH4+-N(处理组TA2)的两个处理中氨氧化和铁还原速率较高,因此选择这两个添加量对太湖不同区域沉积物Feammox潜在速率进行测定。如图 4所示,不同区域沉积物的同位素富集培养过程中均有较多的30N2产生,其中河口区速率最高,约0.11 mg N/(kg ·d),湖心区最低,但也达到0.05 mg N/(kg ·d)。不同区域沉积物中29N2产生速率达到0.55~0.59 mg N/(kg ·d),显著高于30N2产生速率(P < 0.01),说明体系中存在着较多的14NH4+。采用预培养2 d后泥浆中的NH4+-N含量,计算出湖心区、梅梁湾中心和直湖港河口区的Feammox潜在速率分别为0.17、0.28和0.51 mg N/(kg ·d)。假定太湖沉积物的湿体积密度为1.36 g/cm3,含水率为44.15%[18],并且发生Feammox反应的沉积物深度为0~5 cm[6],根据3个位点的Feammox潜在速率,可估算出太湖因Feammox导致的氮损失量约为2.4~7.2 t/(km2 ·a)。
|
图 4 同位素厌氧培养过程中30N2和29N2的产生速率(位点A、B和C分别为湖心区、梅梁湾中心和直湖港河口区) Fig.4 Production rates of 30N2 and 29N2 in the isotopic anaerobic culture (Sites A, B and C are the center of Lake Taihu, the center of Meiliang Bay and the estuary of Zhihugang, respectively) |
在添加Fe(Ⅲ)和NH4+前,所有沉积物浆液中的NO3-和NO2-都已通过厌氧培养去除,并且在整个实验过程中一直保持着严格的厌氧程序,因此培养过程中产生的NO3-只能通过NH4+的氧化而来,而同位素富集实验中产生的30N2也只能直接来源于15NH4+的厌氧氧化,或者来源于15NH4+的厌氧氧化产物15NO3-、15NO2-的反硝化或厌氧氨氧化过程[10]。添加Fe(Ⅲ)后,沉积物表层出现了棕色絮状物,这些絮状物在培养过程中逐渐消失(附图Ⅲ),并伴随着上覆水中Fe(Ⅱ)浓度的升高,说明沉积物表层的Fe(Ⅲ)迅速被还原。相关性分析结果(附表Ⅱ)表明,在96 h的厌氧培养过程中,NH4+-N浓度与Fe(Ⅱ)或NO3--N浓度显著负相关(P < 0.01),而Fe(Ⅱ)与NO3--N浓度显著正相关(P < 0.01),这表明Fe(Ⅲ)还原过程在NH4+厌氧氧化为NO3-的过程中发挥了重要作用,即发生了Feammox反应。研究发现,NH4+的厌氧氧化也可以在微生物的介导下由硫酸盐完成[19]。本研究未对硫酸盐还原产物进行检测,因而并不能确定硫酸盐还原对氨氧化的相对贡献。但是吴松峻等[20]发现,太湖沉积物中三价铁的还原速率是硫酸盐的7.4倍,因此实验过程中NO3-或N2的产生可能主要与Fe(Ⅲ)还原有关。
铁还原菌,如Exiguobacterium,Geobacter,Shewanella和Acidimicrobiaceae等[4, 21],可以利用Fe(Ⅲ)为电子受体,氧化氨、乙酸盐、乳酸盐等电子供体并从中获取生命活动所需能量。尽管目前尚不能直接鉴别参与铁氨氧化进程的细菌,但铁还原菌可以影响铁氨氧化过程已得到证明,因此有学者认为这类细菌是介导Feammox过程的主要细菌[8]。厌氧培养结束后,沉积物中铁还原菌丰度从培养前的2.83%±0.36%上升至4.3%±1.77%(附图Ⅳ),这也从微生物学角度证明了培养过程中的确发生了Feammox反应。
3.2 底物浓度对Feammox的影响Fe(Ⅲ)是Feammox反应中的电子受体,因此充足的Fe(Ⅲ)一般有利于NH4+的氧化[22]。Ding等[23]采用同位素添加法测定不同土壤中的Feammox速率时发现,30N2的产生速率与Fe(Ⅲ)含量显著正相关。本研究中,随着Fe(Ⅲ)添加量的增加,NO3--N的产生量也显著增加(图 2b),说明Fe(Ⅲ)浓度的提高可能会促进NH4+进一步氧化为NO3-。类似的现象也有报道,如Chen等[24]在厌氧氨氧化的研究中发现,随着Fe(Ⅲ)浓度的增加,NO3--N增加量与NH4+-N减少量的比例显著增加;Guan等[25]采用乙炔抑制法来区别Feammox过程产生的N2和NOx,发现添加氯化铁后45N2O或46N2O产生量显著提高。遗憾的是,这些文献均未对此现象进行分析。从Feammox反应方程(1)和方程(3)来看,1 mol NH4+厌氧氧化为NO3-需要消耗8 mol Fe(Ⅲ),因此相比于氧化为N2,增加Fe(Ⅲ)浓度对NH4+氧化为NO3-的吉布斯自由能变的影响更大,这可能是本研究中NO3--N的产生量随Fe(Ⅲ)添加量的增加而显著增加的原因。
作为Feammox过程中的电子供体,NH4+含量同样会影响该反应进程。但是针对Feammox的研究大多集中在废水处理中的应用,而废水中NH4+浓度一般都比较高,因此NH4+-N浓度对Feammox的影响的研究相对较少。一般而言,NH4+的添加有利于Fe(Ⅲ)的还原[8]。但是罗文齐等[26]在测定太湖梅梁湾沉积物Feammox潜在速率时发现,沉积物NH4+-N含量与Feammox速率之间并没有显著的相关性。而Desireddy等[27]在利用Feammox处理废水中NH4+时也发现,当达到一定浓度后,NH4+-N去除率随着NH4+浓度的增加而下降。本研究中,最低NH4+-N添加量(0.14 mg,TA1)的处理中的Fe(Ⅱ)浓度显著高于对照组(P < 0.01),而对照组又显著高于其它NH4+-N添加量的处理(P < 0.01,图 3c),其原因可能是NH4+-N浓度升高释放出的游离NH3抑制了微生物的活性导致[27]。
3.3 Feammox对湖泊氮素自净的贡献在浅水富营养化湖泊中,由于水生植物的光合作用和氧气在水-大气界面的充分交换,水体中的溶解氧在白天可能处于过饱和状态[28],此时沉积物中的氧气穿透深度可达到15 mm左右[29],进而有效促进了沉积物中有机氮的降解和Fe(Ⅱ)的氧化。藻华暴发过程中,夜间藻和其它微生物的呼吸作用会大大降低水体中的溶解氧水平,上覆水-沉积物界面2~6 mm深度以下已处于厌氧状态[30],这又为Feammox的进行营造了合适的环境条件[31]。铁被认为是除氮、磷外,影响蓝藻水华程度的最重要微量元素之一[32],因此一般而言,太湖、滇池、巢湖等蓝藻水华频发湖泊的沉积物中均含有较多的铁元素[33-34]。与之相对应,这些湖泊沉积物中也存在着较多的铁还原细菌,如巢湖中Thiobacillus、Desulfuromonas和Geobacter等铁还原菌相关属的相对丰度达到2.4%~ 6.7%[35],而本研究中,太湖沉积物中铁还原菌相对丰度也有2.83%±0.36%(附图Ⅳ),说明这些湖泊均具备发生Feammox反应的微生物基础[16]。充足的底物、适宜的环境条件和相关功能微生物的存在,表明Feammox反应同样可以在这些富营养化湖泊的实际环境中发生。
同位素富集培养过程中,29N2产生速率远高于30N2,说明体系中原有的14NH4+对Feammox潜在速率的测定有较大的影响[10],同时也说明有必要采用NH4+-N背景值对Feammox潜在速率进行校正。校正后湖心区和梅梁湾中心区的Feammox潜在速率分别为0.17、0.28 mg N/(kg ·d),与Li等[6]对长江口潮间带的测定结果(0.24~0.36 mg N/(kg ·d))接近,低于福建红树林土壤的0.48 mg N/(kg ·d)[25]。以该潜在速率计算,太湖因Feammox导致的氮损失量约占总输入量(约23.1 t/km2[36])的10.2%~31.2%。由于同位素示踪实验添加了Feammox底物,并且是在绝对厌氧的环境和适宜的温度下进行,所得结果必然过高地估计了实际水体中Feammox的脱氮能力。为此,采用添加相同量的Fe(Ⅱ)和15NO3--N方法测定了梅梁湾、湖心区两个位点的潜在反硝化速率[分别为5.28、6.10 mg N/(kg ·d)[37]],并将Feammox潜在速率与之进行对比,可发现太湖Feammox途径的脱氮速率约占反硝化途径的3.2%~5.3%,该结果略低于文献中太湖亲水河河岸带的4.0%~7.3%[7]。
Feammox反应可生成N2、NO3-或NO2-,其中N2被认为是Feammox的最主要产物[10],如Guan等[25]在红树林沉积物厌氧培养过程中发现,直接由Feammox产生的N2约占总N2产生量的75%~82%,而长江口潮间带沉积物直接由Feammox产生的N2的比例甚至达到78.5%~93.2%[6]。但是在添加Feammox底物的处理中,Yang等[10]发现Feammox产生的N2的比例仅为47%~72%,远低于上述研究,表明该处理中Feammox产物的反硝化或厌氧氨氧化对N2的生成有较大的贡献。Huang等[38]根据河岸湿地土壤厌氧培养过程中微生物群落结构的变化,也推测产生的N2可能有很大一部分来源于Feammox产物NO2-的反硝化或厌氧氨氧化。本研究中,NO3--N浓度在厌氧培养过程中有着显著的上升和下降趋势,48 h后其浓度已低于0.5 mg/L(图 3b),而培养结束后,uncultured Symbiobacteraceae这一具反硝化功能的菌属[39]的相对丰度也从培养前的0.25%~0.31%增加到15.0%~27.7%,说明厌氧条件下沉积物中发生了Feammox和反硝化的耦合,这种耦合可能对湖泊的氮素自净起到重要作用。
4 结论1) Feammox反应可以在太湖不同区域沉积物中发生,其潜在速率可达到0.17~0.51 mg N/(kg ·d);
2) Fe(Ⅲ)浓度的提高有利于Feammox反应,并可以促进NH4+进一步氧化为NO3-;
3) 一定浓度的NH4+可以促进Feammox反应,但浓度过高可能产生抑制作用;
4) Feammox可以促进反硝化功能菌属相对丰度的提高,形成Feammox和反硝化的耦合脱氮。
5 附录附图Ⅰ~Ⅳ和附表Ⅰ~Ⅱ见电子版(DOI: 10.18307/2023.0521)。

|
附图Ⅰ 厌氧培养前(I)、后(F)沉积物中细菌在门水平上的群落结构 AttachedFigureI Bacterial community structure at phyla level in sediments before (I) and after (F) anaerobic culture |
|
附图Ⅱ 厌氧培养前(I)、后(F)沉积物中细菌在属水平上的群落结构 AttachedFigureII Bacterial community structure at genus level in sediments before (I) and after (F) anaerobic culture |

|
附图Ⅲ 厌氧培养前(左)后(右)沉积物形态和颜色 AttachedFigureIII The sediment morphology and color before (L) and after (R) anaerobic culture |

|
附图Ⅳ 厌氧培养前(I)后(F)沉积物中Fe(III)还原相关属相对丰度的变化 AttachedFigureIV Changes in the abundance of the genera related to Fe (III) reduction before (I) and after (F) anaerobic culture |
| 附表Ⅰ 培养前后细菌多样性指数 Appendix Ⅰ Bacterial diversity index before (I) and after (F) anaerobic culture |
| 附表Ⅱ 厌氧培养过程中NH4+-N、NO3−-N和Fe(II)浓度相关性分析结果(n=300) Appendix Ⅱ Correlation between NH4+-N、NO3−-N and Fe (II) concentrations during anaerobic culture (n=300) |
| [1] |
Wurtsbaugh WA, Paerl HW, Dodds WK. Nutrients, eutrophication and harmful algal blooms along the freshwater to marine continuum. Wiley Interdisciplinary Reviews: Water, 2019, 6(5): e1373. DOI:10.1002/wat2.1373 |
| [2] |
Wang J, Kan J, Qian G et al. Denitrification and anammox: Understanding nitrogen loss from Yangtze Estuary to the east China sea (ECS). Environmental Pollution, 2019, 252: 1659-1670. DOI:10.1016/j.envpol.2019.06.025 |
| [3] |
Burgin AJ, Hamilton SK. Have we overemphasized the role of denitrification in aquatic ecosystems? A review of nitrate removal pathways. Frontiers in Ecology and the Environment, 2007, 5(2): 89-96. DOI:10.1890/1540-9295(2007)5[89:HWOTRO]2.0.CO;2 |
| [4] |
Sawayama S. Possibility of anoxic ferric ammonium oxidation. Journal of Bioscience and Bioengineering, 2006, 101(1): 70-72. DOI:10.1263/jbb.101.70 |
| [5] |
Ding LJ, An XL, Li S et al. Nitrogen loss through anaerobic ammonium oxidation coupled to iron reduction from paddy soils in a chronosequence. Environmental Science & Technology, 2014, 48(18): 10641-10647. |
| [6] |
Li X, Hou L, Liu M et al. Evidence of nitrogen loss from anaerobic ammonium oxidation coupled with ferric iron reduction in an intertidal wetland. Environmental Science & Technology, 2015, 49(19): 11560-11568. |
| [7] |
Ding B, Li Z, Qin Y. Nitrogen loss from anaerobic ammonium oxidation coupled to Iron (Ⅲ) reduction in a riparian zone. Environmental Pollution, 2017, 231: 379-386. DOI:10.1016/j.envpol.2017.08.027 |
| [8] |
Yao Z, Wang F, Wang C et al. Anaerobic ammonium oxidation coupled to ferric iron reduction in the sediment of a eutrophic lake. Environmental Science and Pollution Research, 2019, 26(15): 15084-15094. DOI:10.1007/s11356-019-04907-7 |
| [9] |
Zhu TT, Lai WX, Zhang YB et al. Feammox process driven anaerobic ammonium removal of wastewater treatment under supplementing Fe (Ⅲ) compounds. Science of the Total Environment, 2022, 804: 149965. DOI:10.1016/j.scitotenv.2021.149965 |
| [10] |
Yang WH, Weber KA, Silver WL. Nitrogen loss from soil through anaerobic ammonium oxidation coupled to iron reduction. Nature Geoscience, 2012, 5(8): 538-541. DOI:10.1038/ngeo1530 |
| [11] |
Qin B, Lake Taihu, China: Dynamics and environmental change. Springer Science & Business Media, 2008.
|
| [12] |
Chen X, Jiang H, Sun X et al. Nitrification and denitrification by algae-attached and free-living microorganisms during a cyanobacterial bloom in Lake Taihu, a shallow Eutrophic Lake in China. Biogeochemistry, 2016, 131(1): 135-146. |
| [13] |
Qu W, Mike D, Wang S. Multivariate analysis of heavy metal and nutrient concentrations in sediments of Taihu Lake, China. Hydrobiologia, 2001, 450(1): 83-89. |
| [14] |
Sima W, Hu M, He Q et al. Regulation of nitrogen dynamics at the sediment-water interface during HAB degradation and subsequent reoccurrence. RSC Advances, 2020, 10(23): 13480-13488. DOI:10.1039/C9RA10673A |
| [15] |
Chen X, Wang K, Li X et al. Microcystis blooms aggravate the diurnal alternation of nitrification and nitrate reduction in the water column in Lake Taihu. Science of the Total Environment, 2021, 767: 144884. DOI:10.1016/j.scitotenv.2020.144884 |
| [16] |
Ding B, Luo W, Qin Y et al. Effects of the addition of nitrogen and phosphorus on anaerobic ammonium oxidation coupled with iron reduction (Feammox) in the farmland soils. Science of the Total Environment, 2020, 737: 139849. DOI:10.1016/j.scitotenv.2020.139849 |
| [17] |
国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法: 第4版. 北京: 中国环境科学出版社, 2002.
|
| [18] |
Wang C, Xu D, Bai L et al. Effects of accumulated cyanobacterial bloom biomass contents on the characteristics of surface fluid sediments in a eutrophic shallow lake. Journal of Environmental Management, 2022, 308: 114644. DOI:10.1016/j.jenvman.2022.114644 |
| [19] |
Rios-Del Toro EE, Valenzuela EI, Lopez-Lozano NE et al. Anaerobic ammonium oxidation linked to sulfate and ferric iron reduction fuels nitrogen loss in marine sediments. Biodegradation, 2018, 29: 429-442. DOI:10.1007/s10532-018-9839-8 |
| [20] |
Wu SJ, Wang X, Ji QY et al. Iron-sulfur distribution and its environmental significance in three typical areas of western Lake Taihu. J Lake Sci, 2019, 31(4): 950-960. [吴松峻, 汪旋, 季秋忆等. 太湖西岸典型区域沉积物的硫铁分布特征及环境意义. 湖泊科学, 2019, 31(4): 950-960. DOI:10.18307/2019.0408] |
| [21] |
Xia Q, Ai Z, Huang W et al. Recent progress in applications of Feammox technology for nitrogen removal from wastewaters: A review. Bioresource Technology, 2022, 127868. |
| [22] |
Zhao S, Feng SJ, Wu CC et al. A review on new ammonium oxidation alternatives for effective nitrogen removal from wastewater. Journal of Chemical Technology & Biotechnology, 2022, 97(8): 1917-1928. |
| [23] |
Ding B, Chen Z, Li Z et al. Nitrogen loss through anaerobic ammonium oxidation coupled to Iron reduction from ecosystem habitats in the Taihu estuary region. Science of the Total Environment, 2019, 662: 600-606. DOI:10.1016/j.scitotenv.2019.01.231 |
| [24] |
Chen Y, Jia F, Liu Y et al. The effects of Fe (Ⅲ) and Fe (Ⅱ) on anammox process and the Fe-N metabolism. Chemosphere, 2021, 285: 131322. DOI:10.1016/j.chemosphere.2021.131322 |
| [25] |
Guan Q, Cao W, Wang M et al. Nitrogen loss through anaerobic ammonium oxidation coupled with iron reduction in a mangrove wetland. European Journal of Soil Science, 2018, 69(4): 732-741. DOI:10.1111/ejss.12552 |
| [26] |
Luo WQ, Xu MS, Li DD et al. Effect of cyanobacteria outbreak on Feammox rates in the sediments of Meiliang Bay, Taihu Lake. Acta Scientiae Circumstantiae, 2020, 40(8): 2828-2833. [罗文齐, 徐梦珊, 李丹丹等. 蓝藻暴发对太湖梅梁湾底泥中铁氨氧化速率的影响. 环境科学学报, 2020, 40(8): 2828-2833. DOI:10.13671/j.hjkxxb.2020.0090] |
| [27] |
Desireddy S, Sabumon P, Maliyekkal SM. Anoxic ammonia removal using granulated nanostructured Fe oxyhydroxides and the effect of pH, temperature and potential inhibitors on the process. Journal of Water Process Engineering, 2020, 33: 101066. DOI:10.1016/j.jwpe.2019.101066 |
| [28] |
Chen X, Yang L, Xiao L et al. Nitrogen removal by denitrification during cyanobacterial bloom in Lake Taihu. Journal of Freshwater Ecology, 2012, 27(2): 243-258. DOI:10.1080/02705060.2011.644405 |
| [29] |
Cui J, Jin Z, Wang Y et al. Mechanism of eutrophication process during algal decomposition at the water/sediment interface. Journal of Cleaner Production, 2021, 309: 127175. DOI:10.1016/j.jclepro.2021.127175 |
| [30] |
Zhu L, Shi W, Van Dam B et al. Algal accumulation decreases sediment nitrogen removal by uncoupling nitrification-denitrification in shallow eutrophic lakes. Environmental Science & Technology, 2020, 54(10): 6194-6201. |
| [31] |
Weber KA, Achenbach LA, Coates JD. Microorganisms pumping iron: Anaerobic microbial iron oxidation and reduction. Nature Reviews Microbiology, 2006, 4(10): 752-764. DOI:10.1038/nrmicro1490 |
| [32] |
Zhang S, Zheng X, Zhang W et al. The effect of bioavailable sedimentary iron on the growth of cyanobacteria in eutrophic lakes. Water, Air, & Soil Pollution, 2018, 229: 1-13. |
| [33] |
Gao L, Zhou JM, Yang H et al. Phosphorus fractions in sediment profiles and their potential contributions to eutrophication in Dianchi Lake. Environmental Geology, 2005, 48: 835-844. DOI:10.1007/s00254-005-0005-3 |
| [34] |
Yang C, Yang P, Geng J et al. Sediment internal nutrient loading in the most polluted area of a shallow eutrophic lake (Lake Chaohu, China) and its contribution to lake eutrophication. Environmental Pollution, 2020, 262: 114292. DOI:10.1016/j.envpol.2020.114292 |
| [35] |
Fan YY, Li BB, Yang ZC et al. Abundance and diversity of iron reducing bacteria communities in the sediments of a heavily polluted freshwater lake. Applied Microbiology and Biotechnology, 2018, 102: 10791-10801. DOI:10.1007/s00253-018-9443-1 |
| [36] |
Xu H, McCarthy MJ, Paerl HW et al. Contributions of external nutrient loading and internal cycling to cyanobacterial bloom dynamics in Lake Taihu, China: Implications for nutrient management. Limnology and Oceanography, 2021, 66(4): 1492-1509. DOI:10.1002/lno.11700 |
| [37] |
Chen XF, Wang RZ, Zhu SY et al. Nitrate dependent ferrous oxidation in the sediments of Lake Taihu. China Environmental Science, 2023. [J/OL]. [陈小锋, 王润竹, 朱诗雅等. 太湖沉积物硝酸盐依赖亚铁氧化性能研究. 中国环境科学, 2023. [J/OL]. ]
|
| [38] |
Huang S, Jaffe PR. Characterization of incubation experiments and development of an enrichment culture capable of ammonium oxidation under iron-reducing conditions. Biogeosciences, 2015, 12(3): 769-779. DOI:10.5194/bg-12-769-2015 |
| [39] |
Wu M, Li J, Leu AO et al. Anaerobic oxidation of propane coupled to nitrate reduction by a lineage within the class Symbiobacteriia. Nature Communications, 2022, 13(1): 1-12. DOI:10.1038/s41467-021-27699-2 |
 2023, Vol. 35
2023, Vol. 35 

