(2: 中国科学院地理科学与资源研究所, 中国科学院生态系统网络观测与模拟重点实验室, 北京 100101)
(3: 国家海洋环境监测中心, 大连 116023)
(4: 中国科学院大学, 北京 100049)
(2: Key Laboratory of Ecosystem Network Observation and Modeling, Institute of Geographic Sciences and Natural Resources Research, Chinese Academy of Sciences, Beijing 100101, P.R. China)
(3: National Marine Environmental Monitoring Center, Dalian 116023, P.R. China)
(4: University of Chinese Academy of Sciences, Beijing 100049, P.R. China)
植物枯落物分解是维持湿地生态系统能量流动、物质循环和养分平衡的关键生态过程,为全球碳收支做出了十分重要的贡献[1]。因为具有周期性淹水和厌氧及较低的氮利用率等特征,枯落物分解速度比较缓慢,湿地环境中往往储存有大量的植物枯落物[2],使得湿地成为重要的碳库和氮库[3]。湿地枯落物分解速率的微弱变化会对当地、区域甚至全球尺度上的碳通量产生重大的影响[4]。因此,研究湿地枯落物分解及其影响机制有助于加深对全球尺度碳、氮的生物地球化学循环的认识,也有助于湿地生态系统的保护与管理。
枯落物基质质量调控理论认为基质质量对分解速率有较强的控制作用,能决定枯落物被破碎分解的难易程度,是制约枯落物分解的内在因素[5-6]。基质质量如木质素含量、初始元素含量,尤其是氮、磷元素含量、C/N、N/P、木质素/N、初始碳组分中非极性提取物、水溶性组分和酸溶性组分等都与分解速率具有显著的相关关系[7],不同物种间的枯落物分解速率也会因此产生相当大的差异[8]。大多数关于枯落物分解的研究都致力于筛选和鉴定出能够预测枯落物分解速率的指标[9],然而并没有一致性的结论。有研究认为枯落物的氮浓度或碳氮比是分解速率的良好预测指标[10];也有研究表明,在枯落物分解的初始阶段,氮浓度能很好地预测分解速率,但在后期,木质素等化学化合物浓度的预测作用更明显[11]。因此,关于枯落物性质对其分解速率的影响及预测还有诸多不清楚的地方值得研究。
植物枯落物分解过程中13C和15N等稳定同位素动态特征是揭示其调控机制的有效工具,主要原因是枯落物分解过程中稳定同位素会发生分馏[12-13]。稳定同位素的分馏不仅受微生物的影响,还受枯落物化学性质及分解环境变异性的影响[14-15]。有研究认为枯落物分解过程中微生物活动对同位素分馏可能起了主导作用[16];也有研究通过枯落物中15N的变化特征发现稳定同位素的分馏作用可以通过分解环境中的外源氮来增强[17]。然而,稳定同位素特征与枯落物质量、环境条件和微生物生物量变异性的量化关系问题仍然存在许多争议,值得研究[13, 16, 18]。
鄱阳湖是我国第一大淡水湖泊,在维持长江洪泛平原生态系统独特生物群落方面发挥着重要作用。鄱阳湖年内丰水期和枯水期时间界限十分明显,丰枯期水位差可达十几米[19]。这种独特的丰枯变化节律使得鄱阳湖湿地成为典型的季节性洪泛平原湿地,具有非常大面积干湿交替的洲滩湿地。这些洲滩上主要分布着大量的挺水植物和湿生植物,如芦苇(Phragmites australis)、南荻(Triarrhena lutarioriparia)、薹草(Carex cinerascens)等[20], 这些植物死亡后为湿地提供了大量的枯落物,其分解过程在鄱阳湖湿地碳、氮和磷等养分元素的生物地球化学循环中有非常重要的作用[21]。然而迄今为止,涉及到鄱阳湖湿地不同类型湿地植物枯落物分解过程和稳定同位素分异特征的研究尚少。因此,本研究通过野外原位分解袋实验,研究了鄱阳湖湿地3种优势植物(芦苇、南荻和薹草)枯落物纤维素和木质素分解过程和δ13C、δ15N分异特征,以期加深对湿地枯落物分解基质质量调控机制的认识,深化对鄱阳湖湿地生物地球化学循环过程的科学理解。
1 材料和方法 1.1 研究区域概况鄱阳湖位于江西省北部,是长江流域的一个过水性、吞吐型、季节性重要湖泊。湖体南部宽广,北部狭长,自南向北在九江市湖口县石钟山附近汇入长江。水位涨落受入湖的赣江、修河、信江、饶河、抚河等来水与长江水位的双重影响,存在着明显的洪、枯水期湖泊水位变化:每年4—6月水位随五河洪水入湖而上涨,7—9月因长江洪水顶托或倒灌而维持高水位,10月后期才能稳定退水;丰水期和枯水期的水体面积、蓄水容量差异性极大,丰水期时以湖泊为主体,枯水期时以沼泽、草洲为主体,呈现为湖泊、河道、沼泽、洲滩湿水陆交替的生态景观[22]。这种特殊的水文节律使得保护区内形成了大量土壤肥沃、水热条件好的洲滩和浅滩,生长了丰富的湿生植物和水生植物,多样性极其丰富,其中以芦苇、南荻和薹草等为优势种[20]。本研究区域位于鄱阳湖南矶湿地国家级自然保护区,该保护区内有22个季节性天然碟形湖泊以及大量的湖湾、港湾、沼泽和草洲,总面积约330 km2,试验地点选择在典型的碟形湖白沙湖洲滩上(图 1)。

|
图 1 鄱阳湖湿地及样点位置 Fig.1 The position of sampling area in Lake Poyang wetland |
本研究实验在鄱阳湖湿地的枯水期内展开,始于2017年11月15日。如图 1所示,在白沙湖草洲上,大约在与湖心水体相距500 m左右的区域选定宽约300 m长约20 m的矩形区域,建立5块固定的实验样地(每块样地大约4 m2),作为分解实验的5个重复样点,每块样地之间大约间隔50 m左右。样地在枯水期长期露出水面,丰水期淹水时间较短,芦苇、南荻和薹草3种植物混合生长状况非常良好。各样点土壤理化性质初始值如表 1。
| 表 1 样点土壤理化性质初始值(n=3) Tab. 1 Initial value of soil physical and chemical properties at the sample point |
野外分解袋法(尼龙网袋法)是湿地枯落物分解研究中应用最广泛的一种方法[7, 23]。本研究选择100目(孔径为0.15 mm)、规格为15 cm×20 cm的白色网孔的尼龙网袋作为分解袋。采集样品时,植物刚开始枯黄,大部分叶片仍尚未凋落,因此用成熟的芦苇叶片(LW)、成熟的南荻叶片(ND)和成熟的薹草植株(TC)来模拟植物枯落物。将收割的样品带回实验室用去离子水冲洗干净,剪成10 cm长小段后混合均匀(消除尺寸对分解的影响)后置于烘箱内120℃杀青0.5 h后再60℃烘干72 h以上,直至叶片至恒重。分别各取5.00 g烘干的5个样品重复测量其初始养分含量(表 2),3种植物枯落物基质质量初始值差异性显著(P<0.0001)。剩下的样品分别装入分解袋。分解袋设置3种形式:第一种内装5.00 g芦苇叶片,第二种内装5.00 g南荻叶片,第三种内装5.00 g薹草叶片。将制作好的分解袋用PVC管固定在预先设置的5个样点的地表上,每个样点各放置10个3种不同形式的样品袋(不破坏地表原有枯落物结构)。分别于实验开始后第15、30、60、90、120和150天从各样点取回分解袋,每次每个样点每种植物类型各取回1个分解袋,每个样品5个重复。实验终止于2018年4月15日,因为此时洪水淹没样地改变了分解环境的水文条件。
| 表 2 芦苇、南荻和薹草枯落物基质质量初始值 Tab. 2 Initial substrate quality of three plants litter |
每次将分解袋取回后,除去样品上的泥土、藻类以及吸附物等杂物后再转装到牛皮信封中,置于60℃烘箱中烘干至恒重,称量其干物质重量再后将样品碾成粉末,分别密封于聚乙烯样品袋中待测。
土壤pH采用水土比2.5∶1 pH计(Sartorius,德国)测定;土壤含水量采用烘干法测定;土壤微生物量碳、氮选用氯仿熏蒸-K2SO4浸提法测定[24];土壤有机碳(TOC)和土壤总氮(TN)采用半元素分析仪测定(Elementar, Vario Max CN)[25];土壤总磷(TP)采用钼锑抗比色法测定[25]。枯落物样品纤维素和木质素含量采用酸性洗涤-碘量法测定[26-27];样品全碳(TC)和全氮(TN)含量使用元素分析仪(Vario Max CN Analyzer, Elementar Analysen systeme GmbH, 德国)测定;全磷(TP)含量使用电感耦合等离子体发射光谱仪(ICP-OES, Optima 5300DV, Perkin-Elmer, 美国)测定;稳定同位素δ13C和δ15N采用美国Thermo公司的元素分析仪与Delta Plus Finnigan MAT 253同位素质谱仪测定,计算公式为:
| $ {\rm{ \mathsf{ δ}}}{ }^{13} \mathrm{C}=\frac{{ }^{13} \mathrm{C} /{ }^{12} \mathrm{C}_{\text {sample }}}{{ }^{13} \mathrm{C} /{ }^{12} \mathrm{C}_{\text {standard }}}-1 $ | (1) |
| $ {\rm{ \mathsf{ δ}}}^{15} \mathrm{N}=\frac{{ }^{15} \mathrm{N} /{ }^{14} \mathrm{N}_{\text {sample }}}{{ }^{15} \mathrm{N} /{ }^{14} \mathrm{N}_{\text {standard }}}-1 $ | (2) |
式中,测定碳稳定同位素的标准物质是美洲拟箭石化石PDB,氮稳定同位素的标准物质为空气中的氮气。仪器分析重复样品的标准误δ13C为0.1‰,δ15N为0.4‰。
1.3 数据处理与统计分析植物枯落物分解过程的评估参数用以下公式计算:
1) 实测瞬时残留率(remaining rate, Rt): 计算公式为:
| $ R_t=\frac{M_t}{M_0} \times 100 \% $ | (3) |
式中, Rt表示t时刻残留率,Mt表示t时刻重量,M0表示初始重量,t表示分解时间。
2) 瞬时衰减系数(instantaneous loss rate, k): 用Olson负指数衰减模型[28]计算:
| $ M_t=M_0 \mathrm{e}^{-k t} $ | (4) |
式中, k表示t时刻瞬时分解速率常数,k值越大分解速度越快。Mt表示t时刻重量,M0表示初始重量,t表示分解时间。
3) 干物质残余率(y): 用负指数衰减模型[29]Levenberg Marquardt算法进行模拟:
| $ y=a \cdot \mathrm{e}^{-k t} $ | (5) |
式中,y为枯落物残留率,a为拟合参数,e为自然底数。
4) 相对养分归还指数(relative return index,RRI): 计算公式如下:
| $ R R I_t=\frac{M_0 \times C_0-M_t \times C_t}{M_0 \times C_0} \times 100 \% $ | (6) |
式中,Ct为t时刻某元素的浓度,C0为某元素的初始浓度,Mt表示t时刻干物质重量,M0表示初始的干物质重量。
数据在Excel2016中做基本运算,在Origin9.0软件中制图,在SPSS19.0中进行单因素方差分析(ANOVA)、Tukey's honestly差异显著性检验以及Pearson相关性分析,在MATLAB R201b中进行负指数衰减模型拟合与制图。
2 结果与分析 2.1 3种植物枯落物纤维素分解差异性3种植物枯落物纤维素k值都呈现出快速增大至最大值然后又迅速下降直至稳定的趋势(图 2A)。其中,芦苇纤维素k值在15 d内增加至最大值0.94,在15~90 d内快速下降至0.48左右,第90天后缓慢变小直至稳定;南荻和薹草纤维素k值在30 d左右增加至最大,分别约为0.56和0.87,在30~90 d内快速下降,第90天后也缓慢变小直至稳定。单因素方差检验发现,在试验期间芦苇、南荻和薹草枯落物纤维素k值的差异性极显著(P<0.0001)。此外,在每个分解时间点上枯落物纤维素k值都是芦苇最高,薹草次之,南荻最小(图 2A)。

|
图 2 芦苇、南荻和薹草枯落物纤维素分解速率(A)及残留率(B)动态拟合 Fig.2 Dynamics of decay rate andremaining rate of cellulose of LW, ND and TC litter |
在实验期间,芦苇、南荻和薹草枯落物纤维素残留率呈现逐渐减小趋势(图 2B)。分解时间对三种植物枯落物纤维素残留率的影响极显著(P<0.0001)。在实验期间,三种植物枯落物纤维素残留率也具有极显著的差异性(P<0.0001)。此外,在0~150 d内枯落物纤维素残留率总是南荻最高,薹草次之,芦苇最低。分解150 d后南荻、薹草和芦苇枯落物纤维素残留率依次约为70%、62% 和58% (图 2B)。
将枯落物纤维残留率用Olson负指数衰减模型的Levenberg Marquardt算法进行拟合,发现拟合效果非常好,拟合系数R2均在0.82以上,拟合方程的各参数如表 3所示。通过拟合方程预测出芦苇、南荻、薹草枯落物纤维素分解完成50% 所需的时间大约依次为186、275和212 d,分解完成95% 所需的时间依次为858 d(约2.21 a)、1188 d(约3.26 a)和916 d(约2.51 a),并且3种枯落物纤维素平均分解速率差异极显著(P<0.0001)。
| 表 3 芦苇、南荻和薹草枯落物纤维素分解过程Olson时间衰减模型拟合参数* Tab. 3 Fitting parameters of Olson decay model of cellulose decomposition |
3种植物枯落物木质素k值亦都呈现出快速增大至最大值然后又迅速下降直至稳定的趋势(图 3A)。其中,芦苇木质素k值在15 d内增加至最大值0.89,在15~90 d内快速下降至0.44左右,第90天后缓慢变小;南荻和薹草木质素k值在30 d左右增加至最大值,最大值分别约为0.46和0.80,在30~90 d内快速下降,第90天后也缓慢变小直至稳定。单因素方差检验发现,在试验期间内芦苇、南荻和薹草枯落物木质素k值的差异性极显著(P<0.001);此外,在每个分解时间点上枯落物木质素k值都是芦苇最高,薹草次之,南荻最小(图 3A)。

|
图 3 芦苇、南荻和薹草枯落物木质素分解速率(A)及残留率(B)动态拟合 Fig.3 Dynamics of decay rate andremaining rate of lignin of LW, ND and TC litter |
实验期间,芦苇、南荻和薹草枯落物木质素残留率呈现逐渐减小趋势(图 3B)。分解时间对3种植物枯落物木质素残留率的影响极显著(P<0.0001)。在实验期间,3种植物枯落物木质素残留率也具有极显著的差异性(P<0.0001)。此外,在0~150 d内的枯落物木质素残留率总是南荻最高,薹草次之,芦苇最低。分解150 d后南荻、薹草和芦苇枯落物木质素残留率依次约为72%、63% 和60% (图 3B)。
将枯落物木质素残留率用Olson负指数衰减模型的Levenberg Marquardt算法进行拟合,发现拟合效果非常好,拟合系数R2均在0.86以上(表 4)。通过拟合方程预测出芦苇、南荻、薹草枯落物木质素分解完成50% 所需的时间大约依次为203、290和221 d,分解完成95% 所需的时间依次为876 d(约2.40 a)、1253 d(约3.43 a)和954 d(约2.61 a),并且3种枯落物木质素平均分解速率差异极显著(P<0.0001),分别约为0.00342、0.00239和0.00314。
| 表 4 芦苇、南荻和薹草枯落物木质素分解过程Olson时间衰减模型拟合参数* Tab. 4 Fitting parameters of Olson decay Model of lignin decomposition |
从分解实验开始到结束,3种植物枯落物δ13C差异性极显著(P<0.0001)。在每个分解时间点的δ13C都是芦苇最小,薹草次之,南荻最大(图 4)。随着分解的进行,3种植物枯落物δ13C都呈现出上下波动的变化趋势。芦苇枯落物δ13C除了分解后30 d和90 d分别出现了2个高值外,总体上枯落物δ13C呈显著降低趋势(P<0.05),南荻枯落物δ13C在分解15 d后显著降低(P<0.05)。薹草在分解过程中,除了分解后90 d和150 d出现了高值变化外,其余时间δ13C都呈显著降低趋势(P<0.05)。在整个实验期间,芦苇、南荻和薹草枯落物的氮同位素δ15N都是从实验开始到第15天变化最大,其后波动(图 4)。从分解实验开始到结束,3种植物枯落物δ15N差异性显著(P<0.0001)。在每个分解时间点的δ15N都是芦苇最大,薹草次之,南荻最小。不同植物类型枯落物在分解过程中δ15N都呈现略有升高的趋势,其中薹草和南荻枯落物在分解90 d后δ15N显著高于分解初始状态(P<0.05),而南荻枯落物δ15N在不同分解阶段差异不显著(P>0.05)。
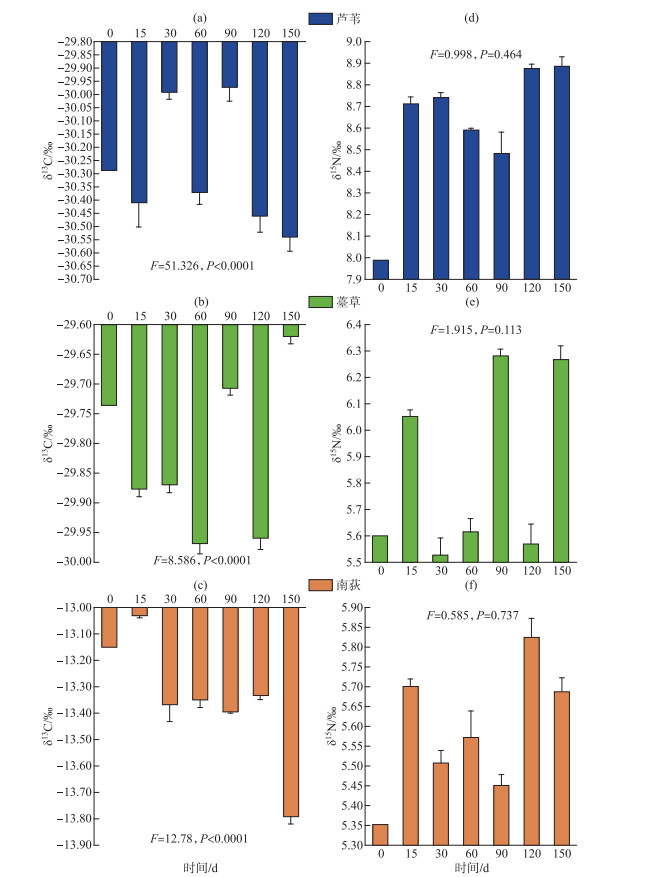
|
图 4 芦苇、南荻和薹草枯落物分解过程中δ13C和δ15N动态变化特征 Fig.4 Changes in δ13C and δ15N of LW, ND and TC litter during decomposition |
将分解过程中的枯落物纤维素和木质素分解速率常数及碳、氮、磷相对归还指数与δ13C和δ15N通过Pearson相关性分析(表 5)。结果显示,芦苇枯落物在分解过程中δ13C与纤维素和木质素分解速率常数均呈现显著正相关,但是与枯落物碳、氮、磷相对归还指数相关性不显著;δ15N与纤维素和木质素分解速率常数及碳、氮、磷相对归还指数相关性均不显著。而对于南荻枯落物而言,在分解过程中δ13C与木质素分解速率常数呈显著正相关关系,与纤维素分解速率常数相关性不显著,δ13C碳和磷相对归还指数呈显著负相关关系,与氮相对归还指数相关性不显著;δ15N与纤维素和木质素分解速率常数及碳、氮、磷相对归还指数相关性均不显著。至于薹草枯落物,在分解过程中δ13C只与氮相对归还指数呈显著正相关关系,与枯落物纤维素和木质素分解速率常数及碳、磷归还指数相关性均不显著;δ15N只与氮相对归还指数呈显著正相关关系,与枯落物纤维素和木质素分解速率常数及碳、磷归还指数相关性均不显著。
| 表 5 δ13C、δ15N与枯落物分解参数的相关关系 Tab. 5 Correlation between δ13C, δ15N and decomposition parameters of litter |
纤维素和木质素是枯落物中最丰富的成分,它们在很大程度上控制着枯落物的整个分解过程[30]。一般认为,在分解初始阶段枯落物质量损失是由易分解的水溶性成分和未受保护的纤维素等化合物控制的,在分解后期木质素的分解程度才逐渐加强,所以木质素是枯落物分解后期质量损失的主要控制因素[31]。然而木质素的分解受易分解性碳源(如水溶性化合物)的控制,这种控制作用在枯落物分解的初始阶段表现的最为明显,在易分解性碳源充足的情况下,木质素在枯落物分解初期也会开始分解[32]。这种现象在湿地生态系统中表现得更为明显,Yue[33]等在河流湿地枯落物分解研究中发现,木质素和纤维素在枯落物分解的41 d开始快速大量分解,张广帅等[34]的研究也得到了类似的结论,发现在前60 d纤维素和木质素分别分解了初始含量的53.81% 和58.05%。本研究结果显示芦苇、南荻和薹草3种植物枯落物在分解初期阶段就开始快速大量分解,这与前人在湿地生态系统的研究结果基本一致。
本研究还发现,芦苇、南荻和薹草枯落物纤维素和木质素分解速率k值及残留率在分解的0~150 d差异性极显著。纤维素和木质素是一般是结构复杂的大分子物质,分解缓慢,这是因为木质素在植物中的生物学作用主要是提高细胞壁的完整性和抵御病原体的攻击,只有专门的生物群(主要是真菌)合成的细胞外酶才能分解顽固的木质素结构,而且木质素对大部分纤维素和半纤维素具有物理保护作用,可以防止微生物酶进入细胞壁,进而阻止纤维素被生物酶分解[35]。一般情况下纤维素和木质素含量较高的且养分含量低的枯落物分解速率较低,较低木质素含量的枯落物分解速率较高[36]。另外,枯落物所处环境中水分状况、温度条件、土壤pH、土壤粒径组成、土壤养分浓度可获得性及土壤动物和微生物群落结构等条件的改变都会引起枯落物中纤维素和木质素的分解模式的改变[37]。在本研究中的所有枯落物处在同一个分解环境中,因此这种差异性是由3种枯落物纤维素、木质素、碳、氮、磷等初始含量及其比例,即基质质量的差异性所造成(表 2)。本研究中南荻枯落物的C/N和木质素/氮初始值都是最低的,N/P初始值是最低的,其分解速率是最慢的,而芦苇枯落物C/N和木质素/氮初始值都是最低的,N/P初始值是最高的,其分解速率是最快的。
3.2 枯落物分解过程中δ13C和δ15N差异性分析本研究中芦苇、南荻和薹草枯落物δ13C和δ15N差异性极显著。3种枯落物碳氮同位素值在分解前15 d内变化较大,但芦苇和薹草初始值和最终值差异不明显。南荻初始值比最终值有所下降,可能是些富含12C的组分不易分解造成的。枯落物的分解过程中,δ13C具有微弱的波动性变化,说明在分解过程中既存在碳的释放也存在碳的富集,两个过程交替进行。但是由于波动幅度非常小,也有可能是样品分析误差导致。在本研究中,与初始状态相比,薹草枯落物δ13C在分解过程0~15 d内迅速降低,这是早期分解过程的重要特征[38]。许多研究表明,在分解过程中分解残留物内的δ13C既有可能富集,也有可能减少,还有可能无显著变化[18, 39]。
一般认为枯落物残留物中同位素发生变化的主要原因包括[14, 18, 40]:(1)微生物分馏,分解过程中,轻同位素被微生物优先利用,而重同位素发生积累;(2)枯落物本身具有不同的同位素丰度。由于合成路径不同,在同一株植物中,糖类、纤维素等易分解化合物的δ13C相对偏正(富集),而木质素、脂类等难降解组分的δ13C相对偏负(贫化)。(3)土壤等外部环境中的同位素掺入到枯落物基质中。分解过程中13C的变化由以上3个过程的相对强弱决定。本研究中,从分解初期到第150 d,芦苇、南荻和薹草枯落物δ13C都表现出微弱减少的趋势。枯落物残留物中δ13C的减少是因为可溶性碳组分(这类组分一般13C含量较低)的损失,而δ13C的升高是因为微生物的转化以及外部碳的混入[38, 41]。另外,木质素含量也是限制稳定碳同位素动态的重要因子[18, 39-40],还有植物枯落物初始状态下的碳、氮元素含量以及叶片木质素的浓度大小都会影响分解过程中δ13C的动态变化[41]。在本研究中,芦苇和南荻枯落物δ13C和纤维素及木质素分解速率具有极显著的相关性,这为枯落物基质质量调控理论提供了一定的数据支撑。
薹草枯落物中的δ15N在分解前60 d内先微弱升高后又微弱降低,而在90~150 d略有升高,说明含14N的组分优先分解,这符合同位素分馏原理。δ15N在分解过程早期升高的原因可能是在植物枯落物高碳氮比条件下,分解者需要吸收外界的氮素来满足自身的生命代谢需求,微生物代谢过程中外部氮的输入能够增大15N浓度[42]。在分解的中后期,受难分解物质的影响,微生物的矿化过程占主导作用,14N富集的物质更容易矿化分解,进而使15N浓度降低[16]。本研究中芦苇的枯落物分解过程中表现为δ15N升高,而南荻分解过程中δ15N变化不显著。不同类型植物间δ15N的差异主要是因为其碳氮等养分含量和比例不同,一般在氮限制条件下,分解过程中δ15N会降低[23]。本研究中δ15N和氮元素浓度没有显著的相关性,说明除了氮元素的迁移转化,还有其他因子影响δ15N的变化。因为分解过程中氮的硝化、矿化和固定过程都会间接影响δ15N的变化[38]。此外,不同分解阶段土壤微生物群落的变化也会在分解过程中影响15N浓度的变化[43]。有研究发现偏好吸收14NH4的微生物群落类型能够降低δ15N,而偏好吸收富集15N的无机氮的微生物群落会增加δ15N[44]。
本研究中δ13C、δ15N值与纤维素、木质素分解速率密切相关。这可能是因为在枯落物分解初期阶段,富含13C的易分解化合物(如糖、淀粉和纤维素)的优先分解会不断地使枯落物中的13C浓度降低,但是难分解的纤维素和木质素中的13C则会得到选择性保留和积累[18]。枯落物分解初期阶段不稳定氮的流失(包含被吸收、淋溶和硝化)也会导致15N浓度的降低,而在分解中期阶段,由于微生物的代谢活动增强,微生物碳氮的增加会导致13C和15N不断发生富集[45-46]。在后期在纤维素和木质素分解阶段,会因细菌的代谢活动能消耗枯落物残留物中的15N而导致减少[46-47]。
4 结论本研究通过5个月的野外原位分解袋实验,对鄱阳湖湿地3种优势植物芦苇、南荻和薹草枯落物纤维素和木质素分解过程和δ13C、δ15N分异特征及其指示作用行了研究。主要得到如下结论:
1) 芦苇、南荻和薹草枯落物的纤维素和木质素的分解速率、干物质残留率以及δ13C、δ15N都有极显著的差异性,造成这种差异的主要原因是不同种类植物枯落初始化学特性的不同,尤其受是C/N和木质素/N差异性的影响较大。在0~150 d内枯落物中纤维素和木质素的分解速率都表现芦苇最大,薹草次之,南荻最小;Olson负指数衰减模型能非常好的模拟和预测3种植物枯落物的分解过程。
2) 在分解过程中,3种植物枯落物δ13C不断的上下微弱波动,但总体上呈微弱降低的趋势,而δ15N则都呈现波动性的略有升高趋势。说明在枯落物分解过程的不同阶段,受枯落物基质质量和微生物代谢活动的双重影响,13C与15N既有释放也有富集,在分解过程中各组分分解顺序有先后。δ13C与枯落物纤维素和木质素分解速率都显著正相关。而δ15N与分解速率相关性不显著,这说明除氮元素的迁移转化外,还有其他因素影响δ15N的变化。
未来的研究应该对不同植物枯落物不同分解阶段中13C与15N的分馏做出更为细致和高精度的测定,以及对在不同分解阶段微生物选择性利用碳氮稳定同位素的种类做出定量测定,以便更清晰地研究枯落物基质质量和微生物活动对枯落物分解过程的调控作用机制。
致谢: 感谢江西鄱阳湖南矶湿地国家级自然保护区管理局及相关工作人员对本研究野外工作的配合与支持。
| [1] |
Mitsch WJ, Gosselink JG. Wetlands, 5th Edition. New York: John Wiley & Sons Inc, 2015.
|
| [2] |
Boyero L, Pearson RG, Gessner MO et al. A global experiment suggests climate warming will not accelerate litter decomposition in streams but might reduce carbon sequestration. Ecology Letters, 2011, 14(3): 289-294. DOI:10.1111/j.1461-0248.2010.01578.x |
| [3] |
Berg B, McClaugherty C. Plant Litter: Decomposition, Humus Formation, Carbon Sequestration. Berlin, Heidelberg: Springer Berlin Heidelberg, 2014.
|
| [4] |
Kayranli B, Scholz M, Mustafa A et al. Carbon storage and fluxes within freshwater wetlands: A critical review. Wetlands, 2010, 30(1): 111-124. DOI:10.1007/s13157-009-0003-4 |
| [5] |
Cornelissen JHC. An experimental comparison of leaf decomposition rates in a wide range of temperate plant species and types. The Journal of Ecology, 1996, 84(4): 573. DOI:10.2307/2261479 |
| [6] |
Zhang QJ, Zhang GS, Yu XB et al. Dynamic characteristics of the decomposition rate and carbon, nitrogen and phosphorus release of the dominant plants in Poyang Lake wetland. Acta Ecologica Sinica, 2020, 40(24): 8905-8916. [张全军, 张广帅, 于秀波等. 鄱阳湖湿地优势植物枯落物的分解速率及碳、氮、磷释放动态特征. 生态学报, 2020, 40(24): 8905-8916.] |
| [7] |
Rejmankova E, Houdkova K. Wetland plant decomposition under different nutrient conditions: What is more important, litter quality or site quality?. Biogeochemistry, 2006, 80(3): 245-262. DOI:10.1007/s10533-006-9021-y |
| [8] |
Gao MM, Wan LF, Ma YT et al. A comparative study on the underwater decomposition of live and dried Carex cinerascens and Phalaris arundinacea. Acta Ecologica Sinica, 2018, 38(21): 7679-7687. [高敏敏, 万凌凡, 马燕天等. 水淹条件下灰化薹草和虉草活体、枯落物分解过程的比较. 生态学报, 2018, 38(21): 7679-7687.] |
| [9] |
Aerts R, de Caluwe H. Initial litter respiration as indicator for long-term leaf litter decomposition of Carex species. Oikos, 1997, 80(2): 353. DOI:10.2307/3546603 |
| [10] |
Vanlauwe B, Nwoke OC, Sanginga N et al. Impact of residue quality on the C and N mineralization of leaf and root residues of three agroforestry species. Plant and Soil, 1996, 183(2): 221-231. DOI:10.1007/BF00011437 |
| [11] |
Liu P, Sun OJ, Huang JH et al. Nonadditive effects of litter mixtures on decomposition and correlation with initial litter N and P concentrations in grassland plant species of Northern China. Biology and Fertility of Soils, 2007, 44(1): 211-216. DOI:10.1007/s00374-007-0195-9 |
| [12] |
Kramer MG, Sollins P, Sletten RS et al. N isotope fractionation and measures of organic matter alteration during decomposition. Ecology, 2003, 84(8): 2021-2025. DOI:10.1890/02-3097 |
| [13] |
Jiang CM, Yu WT. Combined influence of external nitrogen and soil contact on plant residue decomposition and indications from stable isotope signatures. Environmental Science and Pollution Research, 2019, 26(7): 6791-6800. DOI:10.1007/s11356-019-04135-z |
| [14] |
Schmidt MWI, Torn MS, Abiven S et al. Persistence of soil organic matter as an ecosystem property. Nature, 2011, 478(7367): 49-56. DOI:10.1038/nature10386 |
| [15] |
Gao SL, He ZM, Huang ZQ et al. Decomposition, carbon and nitrogen stable isotopes and chemical composition of dead leaves clinging in a Chinese fir(Cunninghamia lanceolata) plantation. Chinese Journal of Ecology, 2015, 34(9): 2457-2463. [郜士垒, 何宗明, 黄志群等. 杉木宿存叶片的分解及稳定性碳氮同位素和化学组成. 生态学杂志, 2015, 34(9): 2457-2463. DOI:10.13292/j.1000-4890.2015.0216] |
| [16] |
Gioacchini P, Masia A, Canaccini F et al. Isotopic discrimination during litter decomposition and δ13C and δ15N soil profiles in a young artificial stand and in an old floodplain forest. Isotopes in Environmental and Health Studies, 2006, 42(2): 135-149. DOI:10.1080/10256010600671357 |
| [17] |
Jiang C, Yu W, Ma Q et al. Nitrogen addition alters carbon and nitrogen dynamics during decay of different quality residues. Ecological Engineering, 2015, 82(1): 252-257. |
| [18] |
Osono T, Takeda H, Azuma JI. Carbon isotope dynamics during leaf litter decomposition with reference to lignin fractions. Ecological Research, 2008, 23(1): 51-55. DOI:10.1007/s11284-007-0336-5 |
| [19] |
Dai X, He Z, Wan RR et al. Variation of seasonal water-level fluctuations in river-connected lakes in the middle reaches of Yangtze River in the recent three decades. Resources and Environment in the Yangtze Basin, 2017, 26(1): 118-125. [戴雪, 何征, 万荣荣等. 近35 a长江中游大型通江湖泊季节性水情变化规律研究. 长江流域资源与环境, 2017, 26(1): 118-125. DOI:10.11870/cjlyzyyhj201701014] |
| [20] |
Zhang QJ, Yu XB, Qian JX et al. Distribution characteristics of plant communities and soil organic matter and main nutrients in the Poyang Lake Nanji Wetland. Acta Ecologica Sinica, 2012, 32(12): 3656-3669. [张全军, 于秀波, 钱建鑫等. 鄱阳湖南矶湿地优势植物群落及土壤有机质和营养元素分布特征. 生态学报, 2012, 32(12): 3656-3669.] |
| [21] |
Zhang QJ, Zhang GS, Wan SX et al. Effects of herbivorous overwintering migratory birds' droppings on the decomposition of Carex cinerascens Kükenth and C, N, P release in Lake Poyang wetland. J Lake Sci, 2019, 31(3): 814-824. [张全军, 张广帅, 万松贤等. 鄱阳湖植食越冬候鸟粪便对洲滩湿地薹草枯落物分解过程及碳、氮、磷释放的影响. 湖泊科学, 2019, 31(3): 814-824. DOI:10.18307/2019.0319] |
| [22] |
《鄱阳湖研究》编委会. 鄱阳湖研究. 上海: 上海科学技术出版社, 1988.
|
| [23] |
Zhang G, Yu X, Xu J et al. Effects of environmental variation on stable isotope abundances during typical seasonal floodplain dry season litter decomposition. Science of the Total Environment, 2018, 630(1): 1205-1215. |
| [24] |
Spohn M, Klaus K, Wanek W et al. Microbial carbon use efficiency and biomass turnover times depending on soil depth—Implications for carbon cycling. Soil Biology and Biochemistry, 2016, 96(1): 74-81. |
| [25] |
Wang XL, Han JY, Xu LG et al. Soil characteristics in relation to vegetation communities in the wetlands of Poyang Lake, China. Wetlands, 2014, 34(4): 829-839. DOI:10.1007/s13157-014-0546-x |
| [26] |
Fioretto A, Di nardo C, Papa S et al. Lignin and cellulose degradation and nitrogen dynamics during decomposition of three leaf litter species in a mediterranean ecosystem. Soil Biology and Biochemistry, 2005, 37(6): 1083-1091. DOI:10.1016/j.soilbio.2004.11.007 |
| [27] |
Ziegler F, Kogel I, Zech W. Alteration of gymnosperm and angiosperm lignin during decomposition in forest humus layers. Zeitschrift Für Pflanzenernährung und Bodenkunde, 1986, 149(3): 323-331. DOI:10.1002/jpln.19861490309 |
| [28] |
Olson JS. Energy storage and the balance of producers and decomposers in ecological systems. Ecology, 1963, 44(2): 322-331. DOI:10.2307/1932179 |
| [29] |
Wider RK, Lang GE. A critique of the analytical methods used in examining decomposition data obtained from litter bags. Ecology, 1982, 63(6): 1636-1642. DOI:10.2307/1940104 |
| [30] |
Schwarz W. The cellulosome and cellulose degradation by anaerobic bacteria. Applied Microbiology and Biotechnology, 2001, 56(5): 634-649. |
| [31] |
Berg B, Staaf H. Decomposition rate and chemical changes of scots pine needle litter. ii. influence of chemical composition. Swedish Natural Science Research Council, 1980, 32(1): 373-390. |
| [32] |
Klotzbücher T, Kaiser K, Guggenberger G et al. A new conceptual model for the fate of lignin in decomposing plant litter. Ecology, 2011, 92(5): 1052-1062. DOI:10.1890/10-1307.1 |
| [33] |
Yue K, Peng CH, Yang WQ et al. Degradation of lignin and cellulose during foliar litter decomposition in an alpine forest river. Ecosphere, 2016, 7(10): e01523. |
| [34] |
Zhang GS, Yu XB, Gao Y et al. Effects of water table on cellulose and lignin degradation of Carex cinerascens in a large seasonal floodplain. Journal of Freshwater Ecology, 2018, 33(1): 311-325. DOI:10.1080/02705060.2018.1459324 |
| [35] |
Pauly M, Keegstra K. Cell-wall carbohydrates and their modification as a resource for biofuels. The Plant Journal, 2008, 54(4): 559-568. DOI:10.1111/j.1365-313X.2008.03463.x |
| [36] |
Berg B, Laskowski R. Litter fall. Advances in Ecological Research. Amsterdam: Elsevier, 2005: 19-71.
|
| [37] |
Gingerich RT, Merovich G, Anderson JT. Influence of environmental parameters on litter decomposition in wetlands in West Virginia, USA. Journal of Freshwater Ecology, 2014, 29(4): 535-549. DOI:10.1080/02705060.2014.926463 |
| [38] |
Connin SL, Feng X, Virginia RA. Isotopic discrimination during long-term decomposition in an arid land ecosystem. Soil Biology and Biochemistry, 2001, 33(1): 41-51. |
| [39] |
Ngao J, Cotrufo MF. Carbon isotope discrimination during litter decomposition can be explained by selective use of substrate with differing δ13C. Biogeosciences Discussions, 2011, 8(1): 51-82. |
| [40] |
Zou J, Yu LF, Li YY et al. Changes in δ13C value of plant-litter-soil system in soils developed from different lithologies in Karst area. Journal of Soil and Water Conservation, 2020, 34(1): 186-194. [邹军, 喻理飞, 李媛媛等. 喀斯特区不同岩性发育的土壤上植物-枯落物-土壤系统δ13C值变化特征. 水土保持学报, 2020, 34(1): 186-194.] |
| [41] |
Gautam MK, Lee KS, Song BY et al. Early-stage changes in natural 13C and 15N abundance and nutrient dynamics during different litter decomposition. Journal of Plant Research, 2016, 129(3): 463-476. |
| [42] |
Natelhoffer KJ, Fry B. Controls on natural nitrogen-15 and carbon-13 abundances in forest soil organic matter. Soil Science Society of America Journal, 1988, 52(6): 1633-1640. |
| [43] |
Hobbie EA, Hobbie JE. Natural abundance of 15N in nitrogen-limited forests and tundra can estimate nitrogen cycling through mycorrhizal fungi: A review. Ecosystems, 2008, 11(5): 815-830. |
| [44] |
Fellerhoff C, Voss M, Wantzen KM. Stable carbon and nitrogen isotope signatures of decomposing tropical macrophytes. Aquatic Ecology, 2003, 37(4): 361-375. |
| [45] |
Dijkstra P, LaViolette CM, Coyle JS et al. N-15 enrichment as an integrator of the effects of C and N on microbial metabolism and ecosystem function. Ecology Letters, 2008, 11(4): 389-397. |
| [46] |
Hogberg P. 15N natural abundance in soil-plant systems. New Phytol, 1997, 137(1): 197-203. |
| [47] |
Bragazza L, Iacumin P. Seasonal variation in carbon isotopic composition of bog plant litter during 3 years of field decomposition. Biology & Fertility of Soils, 2010, 46(1): 877-881. |
 2023, Vol. 35
2023, Vol. 35 

