(2: 中国科学院大学, 北京 100039)
(3: 杭州千岛湖发展集团有限公司, 淳安 311700)
(2: University of the Chinese Academy of Sciences, Beijing 100049, P.R.China)
(3: Hangzhou Qiandaohu Development Group Co., Ltd., Chunan 311700, P.R.China)
同域物种(sympatric)的共存机制是群落生态学研究的核心内容[1-2]。根据竞争排斥原理(competitive exclusion rule),同域物种的长期稳定共存建立在物种的生态需求差异以及适应性的分化之上[3]。而同域物种对资源的利用或者生态习性上的差异,最终会产生生态位分化,这也被认为是驱动竞争性物种共存的关键因子[4-6]。鱼类在适应不同的栖息环境时,常在年龄、生长、繁殖等方面表现出可塑性的性状,这些适应性的性状被统称为生活史策略(life-history strategy)[7]。同域共存鱼类通常在生态习性上高度重叠,即便是细微的生活史策略差异也有利于减缓种间激烈地竞争,甚至支撑其出现生态位分化,最终实现共存[8]。因此,比较研究同域共存鱼类的生活史策略对揭示其实现同域共存的生态位分化机制,并实施有效的保护和管理策略具有重要意义[8-9]。
千岛湖是我国发展大水面生态渔业的典型湖库,现阶段主要开展以鲢、鳙等滤食性鱼类增殖和捕捞为主的渔业模式,但千岛湖的鱼食性鱼类(piscivorous fish)有近20种[10-12],在渔业中占据重要地位。同时,鱼食性鱼类也处于水生食物链的顶端,是水生态系统的顶级捕食者[13],在水域生态系统中具有通过营养级联调控食物网和生态系统结构[14]、参与营养物质循环[15-16]、调控物种入侵[17]等重要作用。近年来,千岛湖鱼食性鱼类资源出现了明显的下滑趋势[18],但目前对鱼食性鱼类的生活史策略及实现同域共存的分化特征研究十分匮乏,鱼食性鱼类资源如何恢复、重建及合理利用缺乏理论支撑。
翘嘴鲌(Culter alburnus)、蒙古鲌(Culter mongolicus)、大眼鳜(Siniperca knerii)和斑鳜(Siniperca scherzeri)是千岛湖生态系统中重要的鱼食性鱼类[11-12],也是当地渔民捕捞和休闲垂钓的主要对象,俗称“白花、红珠、扁鳜和筒鳜”,其肉质口感好、经济价值高,市场价格常在70~300元/kg之间。因此,本研究以翘嘴鲌、蒙古鲌、大眼鳜和斑鳜4种在千岛湖同域共存的鱼食性鱼类作为研究对象,系统研究并比较4种鱼食性鱼类年龄、生长和繁殖等生活史对策的特征与分化,探讨其实现同域共存的生态学机制,为进一步保护、恢复和科学利用千岛湖鱼食性鱼类资源提供理论依据。
1 材料与方法 1.1 样品采集与处理2021年3月至2022年12月,逐月在千岛湖收集4种鱼食性鱼类样本,共采集翘嘴鲌320尾、蒙古鲌477尾、大眼鳜124尾、斑鳜111尾。鱼类采样使用定制的三层多网目复合刺网和地笼在千岛湖5个湖区中均匀设置的15个采样点进行。在非禁渔期(当年7月-次年2月),选取3处具有代表性、规模较大的渔业码头(图 1),通过渔获物调查补充收集鱼类样本。其中三层多网目复合刺网分为浮式和沉式2种,浮式、沉式刺网网高分别为5 m和2 m。二者均由12种网目构成,网目(2 a/cm)分别为8.5、4.0、12.5、2.0、11.0、1.6、2.5、4.8、3.1、1.0、7.5和6.0,每种网目的网长为2.5 m,每条网的总长度均为30 m。地笼长20 m,网目为9 mm。所有鱼类样本均在新鲜状态下,测量其体长(standard length, SL, 1 mm)和体重(body weight, BW, 0.01 g),并采集背鳍起点下方、侧线鳞以上的5~10枚鳞片作为年龄鉴定材料。随机选取部分样本进行生物学解剖,鉴定性别(雌、雄和未分辨)后,统计不同种群的雌雄个体数量,用于计算各种群的雌雄性比。依据性腺的形状、色泽、体积等特征将性腺发育分为6期(Ⅰ~Ⅵ),并称量性腺重(gonad weight, GW, 0.01 g)。对于发育较好且达到Ⅳ期的卵巢,随机称取约0.5 g卵巢,置于5%的甲醛溶液中固定保存。随后移除所有内部器官后称量空壳重(somatic weight, SW, 0.01 g)。

|
图 1 千岛湖鱼类采样点分布 Fig.1 Sampling sites in Lake Qiandaohu |
采集的鳞片经4% NaOH溶液浸泡12 h,洗净后置于解剖镜(OLYMPUS)下观察。记录鳞片等组织上实际见到的年轮数,鳞片上没有年轮的用0表示;有1个年轮的用1表示;以此类推。轮纹外有新增生环片时用年轮数和“+”号表示,如0+、1+等。年轮正好落在边缘时使用年轮数后加点表示,如1.和2.。最终将n+ ~ n+1.记录为n龄鱼。将所取卵巢中的卵粒平铺至培养皿中统计其数量,并采用重量估算法计算成熟雌性个体的繁殖力。计数完成后置于解剖镜(OLYMPUS)下观察并使用LightTools软件分别测量每个成熟卵粒的长径和短径,取二者平均值作为成熟卵径(oocyte diameter, OD, 0.01 μm)。鱼类年龄鉴定及性腺发育分期均参照殷名称[7]的方法进行。
1.2 数据分析通过对每种鱼的体长-体重关系的拟合及其相关性、显著性的检验,发现幂函数最能反映4种鱼类体长和体重间的关系,表达式为:
| $ B W=a S L^b $ | (1) |
式中,BW为体重,SL为体长,a、b均为常数。
选择Von Bertalanffy (VBGF)生长方程拟合并描述每种鱼体长和体重的生长规律,公式如下:
| $ L_t=L_{\infty}\left[1-\mathrm{e}^{-k\left(t-t_0\right)}\right] $ | (2) |
| $ W_t=W_{\infty}\left[1-\mathrm{e}^{-k\left(t-t_0\right)}\right]^b $ | (3) |
式中,Lt和Wt分别表示t龄鱼的体长和体重,L∞和W∞分别表示渐近体长和渐近体重,k表示生长曲线的生长系数,t0表示理论上Lt=0时的年龄,b为前述体长-体重关系中所求得b值。
依据体长频率法(electronic length frequency analysis, ELEFAN)对其生长参数L∞和k值进行估算,理论生长起点年龄t0则根据Pauly[19]的经验公式获得,经验公式如下:
| $ \ln \left(-t_0\right)=-0.3922-0.2752 \ln \left(L_{\infty}\right)-1.038 \ln (k) $ | (4) |
考虑到不同体长分组组距对ELEFAN法结果的影响较大,综合采用Snedecor和Sturges方法[20]分别对4种鱼食性鱼类的体长分组组距进行估算并取平均值,以确定最适体长分组组距,二者公式分别为:
| $ C I( { Snedecor })= { Range } /( { Range } / S D \times 4) $ | (5) |
| $ C I( { Sturges })= { Range } /(1+3.322 \times \lg N) $ | (6) |
式中,CI表示计算出的分组组距,Range表示体长最大值与最小值的差值,SD表示体长的标准差,N表示样本总数量。
条件系数(condition factor, CF)是反映鱼体丰满程度、营养状况和环境条件的重要指标。为消除来自性腺重和消化道内食物团重量变化的影响,进而使用空壳重(SW)来计算条件系数[7],具体公式如下:
| $ C F=100\left(S W / S L^3\right) $ | (7) |
式中,SW为空壳重,SL为体长。
使用卡方检验判断各鱼类雌雄性比与理论值(1∶1)、不同鱼类间的雌雄性比是否存在显著差异。此外,计算每个样本的性体指数(gonado-somatic index, GSI),用来反映性腺发育程度,并根据性体指数的月度变化趋势判断其繁殖活动强度,其公式为:
| $ G S I=100(G W / S W) $ | (8) |
式中,GW为性腺重,SW为空壳重。
依据卵粒计数结果和所取的卵巢重计算每克重卵粒数,并结合性腺重和空壳重,分别推算出绝对繁殖力(absolute fecundity, AF)与相对繁殖力(relative fecundity, RF),其公式分别为:
| $ A F=n \cdot G W $ | (9) |
| $ R F=A F / S W $ | (10) |
式中,n表示每克重卵粒数,GW表示性腺重,SW表示空壳重。
采用Wilcoxon秩和检验比较不同鱼类间平均体长和体重的差异。t检验用来判断各鱼类体长体重关系的b值与理论值3之间是否存在显著性差异,以确定鱼类的生长型。使用Kruskal-Wallis检验来比较4种鱼类的条件系数和繁殖力是否存在显著的种间差异,若存在显著性差异,进一步使用Dunn's检验实现多重比较。Shapiro-Wilk检验和Levene's检验分别用于检验数据的正态分布和方差齐性。4种鱼类的Von Bertalanffy生长方程(VBGF)使用FISAT Ⅱ软件拟合并分析,其余数据分析和作图均在R 4.2.2中完成,并以P < 0.05作为检验的显著性水平。
2 结果 2.1 年龄与生长特征 2.1.1 个体分布及年龄结构翘嘴鲌和蒙古鲌种群的平均体长存在显著差异(Wilcoxon test,W=86308,P < 0.01),大眼鳜和斑鳜种群的平均体长则不存在显著差异(Wilcoxon test, W =7663.5, P>0.05)。具体而言,千岛湖翘嘴鲌和蒙古鲌的体长范围分别为123~445和119~645 mm,均值分别为(273.13±4.08)和(267.19±2.33) mm。翘嘴鲌的优势体长集中在230~310 mm之间(47.19%),蒙古鲌的优势体长范围则集中在230~290 mm之间(57.02%);大眼鳜和斑鳜的体长范围分别为113~415和118~307 mm,均值分别为(189.47±3.86)和(197.27±3.77) mm。大眼鳜优势体长为135~235 mm(79.84%),斑鳜优势体长为165~215 mm(55.86%)(图 2A)。
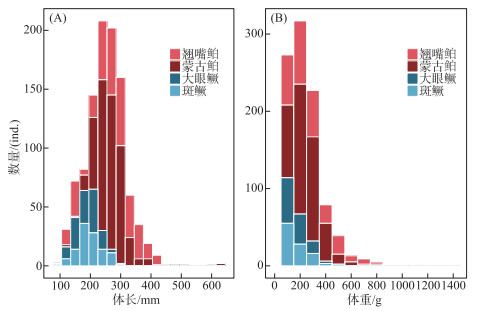
|
图 2 千岛湖4种鱼食性鱼类的体长(A)和体重(B)分布 Fig.2 Distribution of standard length(A) and body weight(B) of the four piscivorous fishes in Lake Qiandaohu |
翘嘴鲌和蒙古鲌的体重存在显著差异(Wilcoxon test,W=68181,P < 0.05),大眼鳜和斑鳜的体重则不存在显著差异(Wilcoxon test, W =6558, P>0.05)。具体而言:千岛湖翘嘴鲌和蒙古鲌的体重范围分别为10.31~875.20和26.50~4690.23 g,均值分别为(242.66±9.75)和(273.33±14.36) g。翘嘴鲌的优势体重集中在100~200 g(31.88%),蒙古鲌的优势体重范围则为200~300 g(36.48%);大眼鳜和斑鳜的体重范围分别为29.00~1505.00和16.55~540.05 g,均值分别为(166.48±13.41)和(165.61±9.18) g。大眼鳜优势体重为29~200 g(66.13%),斑鳜优势体重为100~200 g(46.85%)(图 2B)。
翘嘴鲌种群的年龄组成为1~5龄(N=268),以2~3龄为优势年龄组(67.16%),高龄(> 4)个体占比低(0.37%)。蒙古鲌种群的年龄组成为1~8龄(N=357),3龄为绝对优势年龄组(64.15%),高龄(> 4)和低龄(< 2)个体数量较少(5.04%)。大眼鳜种群的年龄组成同样为1~5龄(N=90),1龄为优势年龄组(56.67%),其他年龄组随年龄增加频率逐步下降。斑鳜种群的年龄组成为1~3龄(N=77),以2龄为优势年龄组(64.94%)(图 3)。总体上看,4种鱼食性鱼类中蒙古鲌种群的年龄结构最为完善,其次为翘嘴鲌和大眼鳜,斑鳜年龄结构最简单,且4种鱼食性鱼类的优势年龄组均未超过3龄。
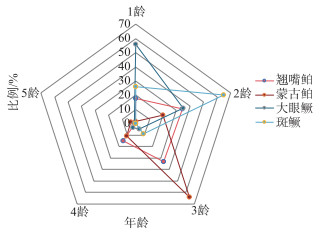
|
图 3 千岛湖4种鱼食性鱼类的年龄结构 Fig.3 Age structure of the four piscivorous fishes in Lake Qiandaohu |
对千岛湖这4种鱼食性鱼类的体长(SL)和体重(BW)关系进行拟合,结果显示4种鱼食性鱼类的体长和体重的最优回归关系均为幂指数,方程分别为:
| $ \begin{aligned} & B W_{C. alburnus }=9 \times 10^{-6} S L^{3.01}\left(R^2=0.9702, N=320\right) \\ & B W_{C . mogolicus }=6 \times 10^{-6} S L^{3.13}\left(R^2=0.9758, N=477\right) \\ & B W_{S . kneri }=4 \times 10^{-5} S L^{2.87}\left(R^2=0.9666, N=124\right) \\ & B W_{S . scherzeri }=4 \times 10^{-5} S L^{2.89}\left(R^2=0.9456, N=111\right) \end{aligned} $ |
式中,翘嘴鲌和蒙古鲌体长与体重关系中的幂指数(b=3.01和3.13)显著高于理论值3(t-test, P < 0.0001),符合正异速生长类型。大眼鳜和斑鳜体长与体重关系中的幂指数(b=2.87和2.89)则显著低于理论值3(t-test, P < 0.01),符合负异速生长类型。
2.1.3 生长参数与生长方程将每种鱼的体长分组数据输入FISAT Ⅱ软件分别计算出其渐近体长(L∞)和生长参数(k),结合前述4种鱼食性鱼类的体长-体重关系和Pauly经验公式进一步求得渐近体重(W∞)和t0,4种鱼食性鱼类的体长、体重的生长方程分别为:
| $ \begin{aligned} & L_{t { C. alburnus }}=736.05 \cdot\left[1-\mathrm{e}^{-0.19(t+0.61567)}\right] ; W_{t { C. alburnus }}=3758.66 \cdot\left[1-\mathrm{e}^{-0.19(t+0.61567)}\right]^{3.01} \\ & L_{t { C. mogolicus }}=694.05 \cdot\left[1-\mathrm{e}^{-0.29(t+0.40341)}\right] ; W_{t { C. mogolicus }}=4589.44 \cdot\left[1-\mathrm{e}^{-0.29(t+0.40341)}\right]^{3.13} \\ & L_{t { S. kneri }}=473.55 \cdot\left[1-\mathrm{e}^{-0.37(t+0.34803)}\right] ; W_{t { S. kneri }}=1924.74 \cdot\left[1-\mathrm{e}^{-0.37(t+0.34803)}\right]^{2.87} \\ & L_{t { S. scherzeri }}=400.05 \cdot\left[1-\mathrm{e}^{-0.43(t+0.31191)}\right] ; W_{t { S. scherzeri }}=1292.71 \cdot\left[1-\mathrm{e}^{-0.43(t+0.31191)}\right]^{2.89} \end{aligned} $ |
对千岛湖4种鱼食性鱼类的体长和体重的生长方程分别求一阶和二阶微分,获得其体长和体重生长的速率和加速度方程,以描述鱼类生长过程中不同阶段的变化趋势。体长、体重的生长速率和加速度方程分别为:
1) 体长生长速度和加速度:
| $ \begin{aligned} & \mathrm{d} L / \mathrm{d} t_{ {C. alburnus }}=139.85 \cdot \mathrm{e}^{-0.19(t+0.61567)} ; \mathrm{d}^2 L / \mathrm{d} t_{C . { alburnus }}^2=-26.57 \cdot \mathrm{e}^{-0.19(t+0.61567)} \\ & \mathrm{d} L / \mathrm{d} t_{ {C. mogolicus }}=201.27 \cdot \mathrm{e}^{-0.29(t+0.40341)} ; \mathrm{d}^2 L / \mathrm{d} t_{ {C. mogolicus }}^2=-58.37 \cdot \mathrm{e}^{-0.29(t+0.40341)}\\ & \mathrm{d} L / \mathrm{d} t_{ {S. kneri }}=175.21 \cdot \mathrm{e}^{-0.37(t+0.34803)} ; \mathrm{d}^2 L / \mathrm{d} t_{ {S. kneri }}^2=-64.83 \cdot \mathrm{e}^{-0.37(t+0.34803)} \\ & \mathrm{d} L / \mathrm{d} t_{ {S. scherzeri }}=172.02 \cdot \mathrm{e}^{-0.43(t+0.31191)} ; \mathrm{d}^2 L / \mathrm{d} t_{ {S. scherzeri }}^2=-73.97 \cdot \mathrm{e}^{-0.43(t+0.31191)} \end{aligned} $ |
2) 体重生长速度和加速度:
| $ \begin{aligned} & \mathrm{d} W / \mathrm{d} t_{ {C. alburnus }}=2149.58 \cdot \mathrm{e}^{-0.19(t+0.61567)} \cdot\left[1-\mathrm{e}^{-0.19(t+0.61567)}\right]^{2.01} \\ & \mathrm{~d}^2 W / \mathrm{d} t_{ {C. alburnus }}^2=408.42 \cdot \mathrm{e}^{-0.19(t+0.61567)} \cdot\left[1-\mathrm{e}^{-0.19(t+0.61567)}\right]^{1.01} \cdot\left[3.01 \cdot \mathrm{e}^{-0.19(t+0.61567)}-1\right] \\ & \mathrm{d} W / \mathrm{d} t_{ {C. mogolicus }}=4165.84 \cdot \mathrm{e}^{-0.29(t+0.40341)} \cdot\left[1-\mathrm{e}^{-0.29(t+0.40341)}\right]^{2.13} \\ & \mathrm{~d}^2 W / \mathrm{d} t_{C . { mogolicus }}^2=1208.09 \cdot \mathrm{e}^{-0.29(t+0.40341)} \cdot\left[1-\mathrm{e}^{-0.29(t+0.40341)}\right]^{1.13} \cdot\left[3.13 \cdot \mathrm{e}^{-0.29(t+0.40341)}-1\right] \\ & \mathrm{d} W / \mathrm{d} t_{ {S. kneri }}=2043.88 \cdot \mathrm{e}^{-0.37(t+0.34803)} \cdot\left[1-\mathrm{e}^{-0.37(t+0.34803)}\right]^{1.87} \\ & \mathrm{~d}^2 W / \mathrm{d} t_{ {S. kneri }}^2=756.24 \cdot \mathrm{e}^{-0.37(t+0.34803)} \cdot\left[1-\mathrm{e}^{-0.37(t+0.34803)}\right]^{0.87} \cdot\left[2.87 \cdot \mathrm{e}^{-0.37(t+0.34803)}-1\right] \\ & \mathrm{d} W / \mathrm{d} t_{ {S. scherzeri }}=1606.45 \cdot \mathrm{e}^{-0.43(t+0.31191)} \cdot\left[1-\mathrm{e}^{-0.43(t+0.31191)}\right]^{1.89} \\ & \mathrm{~d}^2 W / \mathrm{d} t_{ {S. scherzeri }}^2=690.77 \cdot \mathrm{e}^{-0.43(t+0.31191)} \cdot\left[1-\mathrm{e}^{-0.43(t+0.31191)}\right]^{0.89} \cdot\left[2.89 \cdot \mathrm{e}^{-0.43(t+0.31191)}-1\right] \end{aligned} $ |
鱼类体长和体重的生长速度曲线、生长加速度曲线显示,体长生长速度随着年龄的增长而递减,在高年龄时趋近于0,体长生长加速度则持续增加,最终也趋近于0(图 4A)。体重生长速度和加速度曲线均具有明显的拐点,在拐点前体重生长速度随着年龄增加逐渐上升,至拐点处达到最大值。拐点之后加速度为负值,对应体重生长速度呈递减变化(图 4B)。本研究计算出这4种鱼食性鱼类的拐点年龄以及拐点年龄对应的体长和体重见表 1。
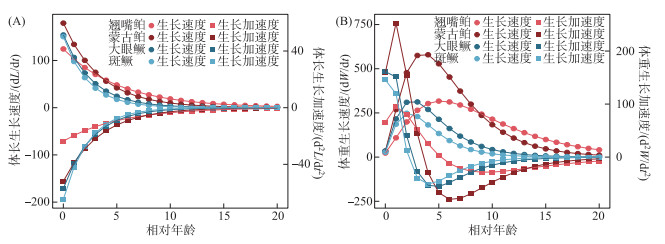
|
图 4 千岛湖4种鱼食性鱼类体长(A)和体重(B)生长速度、加速度曲线 Fig.4 Growth rate and growth acceleration rate of the standard length (A) and body weight(B) of the four piscivorous fishes in Lake Qiandaohu |
| 表 1 千岛湖4种鱼食性鱼类的生长参数* Tab. 1 Growth parameters of the four piscivorous fishes in Lake Qiandaohu |
4种鱼食性鱼类的条件系数(CF)显著不同(Kruskal-Wallis, H=742,P < 0.001)。具体而言,千岛湖的鳜属鱼类相对鲌属鱼类表现出更高的条件系数(Dunn's test, P < 0.0001)(表 1、图 5),其中,翘嘴鲌的条件系数显著低于蒙古鲌(Dunn's test, P < 0.0001),大眼鳜和斑鳜条件系数则较为接近(Dunn's test, P>0.05)。

|
图 5 千岛湖4种鱼食性鱼类条件系数(A)和性体指数(B)月变化趋势 Fig.5 Condition factor (CF) (A) and gonado-somatic index (B) variation by month of the four piscivorous fishes in Lake Qiandaohu |
翘嘴鲌和蒙古鲌的CF变化趋势较为一致,而大眼鳜的CF变化趋势则滞后于斑鳜的CF。总体上表现出:夏季繁殖消耗后CF的水平降低;秋季积累营养后CF开始升高;冬季受气温和饵料等条件影响,CF值又开始下降;直至翌年春季繁殖期前CF稍有回升(图 5A)。
2.2 繁殖特征 2.2.1 性比翘嘴鲌和蒙古鲌的雌雄性比均与理论值1∶1存在显著差异(翘嘴鲌:χ2=15.28,P < 0.001;蒙古鲌:χ2=4.48,P < 0.05),大眼鳜和斑鳜则无显著差异(大眼鳜:χ2=0.28,P=0.60;斑鳜:χ2=0.16,P=0.69)。具体而言,翘嘴鲌种群的雄性个体显著多于雌性,雌雄性比为0.47;蒙古鲌种群的雌性个体显著多于雄性,雌雄性比为1.33;大眼鳜和斑鳜种群中的雌性个体仅略多于雄性,雌雄性比分别为1.17和1.16(表 2)。
| 表 2 千岛湖4种鱼食性鱼类繁殖参数* Tab. 2 Reproductive parameters of the fecundity of four piscivorous fishes in Lake Qiandaohu |
蒙古鲌的GSI在5月已有显著升高趋势,于7月到达最高值,随后在9月迅速回落。翘嘴鲌的GSI则从6月开始升高,并在6-8月间没有明显的高峰,同样于9月迅速降低至较低水平。说明千岛湖的蒙古鲌(5-8月)相较翘嘴鲌(6-8月)更早进入繁殖期且繁殖期更长。2种鳜属鱼类间繁殖期也表现出一定差异,斑鳜GSI升高的趋势出现在3月,早于大眼鳜(4月),此后二者GSI变化趋向一致,均在5月到达最高值后开始下降,并在7月重新升高,8月后至翌年2月GSI持续保持低水平(图 5B)。
性腺发育情况与GSI变化趋势一致(图 6)。蒙古鲌在5月已有部分个体性腺发育至Ⅴ期,翘嘴鲌则在6月首次发现Ⅴ期个体,2个种群中Ⅵ期个体数量占比均在8月开始升高;斑鳜Ⅴ期的性腺最早在3月出现,大眼鳜则为4月。2个种群均在6月开始出现Ⅵ期的性腺。
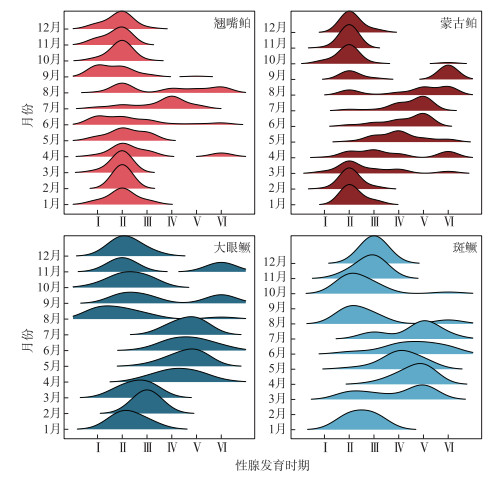
|
图 6 千岛湖4种鱼食性鱼类的性腺发育时期月度变化趋势 Fig.6 Monthly changes in the gonadal development stage of the four piscivorous fishes in Lake Qiandaohu |
综合来看,斑鳜的繁殖期(3-7月)比大眼鳜的繁殖期(4-7月)更长,此后为蒙古鲌(5-8月),翘嘴鲌的繁殖期(6-8月)最短。同时,大眼鳜和斑鳜均有多个繁殖高峰(5、7月),而翘嘴鲌的繁殖高峰较为持久(6-7月),蒙古鲌的繁殖高峰则较集中(7月)。
2.2.3 繁殖力4种鱼食性鱼类相对繁殖力存在显著的种间差异(Kruskal-Wallis, H=58.2,P < 0.001)。翘嘴鲌的相对繁殖力最高,显著高于蒙古鲌(Dunn's test, P < 0.05),蒙古鲌的相对繁殖力显著高于大眼鳜和斑鳜(Dunn's test, P < 0.0001),大眼鳜和斑鳜的相对繁殖力则较为接近,无显著性差异(Dunn's test, P>0.05)(表 2)。
2.2.4 卵径及产卵类型千岛湖翘嘴鲌和蒙古鲌种群的平均卵径分别为(972±25)和(1039±21) μm。卵径范围较广并呈单峰状分布,结合GSI的月度变化初步推测二者为单批次产卵类型。而千岛湖大眼鳜和斑鳜种群的平均卵径分别为(947±25)和(1201±54) μm。卵径范围呈双峰状分布,结合GSI同样出现2次高峰,推测二者为多批次产卵类型(图 7)。
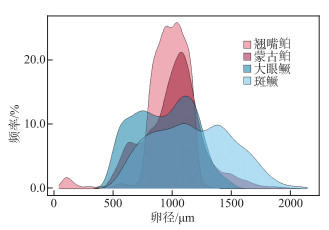
|
图 7 千岛湖4种鱼食性鱼类的卵径分布 Fig.7 Oocyte diameter distributions of the four piscivorous fishes in Lake Qiandaohu |
以上结果均说明千岛湖的2种鲌属鱼类和2种鳜属鱼类在不同属间表现出不同的繁殖策略。
3 讨论 3.1 年龄与生长策略鱼类生长参数可以有效反映鱼类的生命周期和生长速度[21],既是研究鱼类资源波动和合理利用的基础[22],也是渔业资源管理和保护的前提。本研究发现千岛湖4种鱼食性鱼类种群在体长、体重、生长式型和生长速率等方面表现出明显差异,一方面表现出了不同物种的种间差异,另一方面也反映了物种通过改变生活史对策实现对其所处环境的适应,为种群延续提供保障[23-24]。翘嘴鲌在鲌属鱼类中体型相对较大,常在竞争中处于优势地位并存在摄食其他同属鱼类[25]的现象。千岛湖翘嘴鲌的肠含物中尚未发现有蒙古鲌等同属鱼类(数据未发表),但千岛湖蒙古鲌与翘嘴鲌实现了同域共存,基于两个种群具有不同的k值、拐点年龄等,推测由于蒙古鲌和翘嘴鲌种群具有不同的生长速度和生长阶段。鱼类在性成熟前为快速生长期,此时体长增长迅速以摆脱捕食者吞食并进入性成熟阶段[7],因此,蒙古鲌较高的生长速度有利减弱其在生长初期来自翘嘴鲌的潜在捕食压力并增强其摄食能力。同时,蒙古鲌相较翘嘴鲌更高的b值也说明蒙古鲌的体重增速更快。这种由侧重体长增长向侧重体重增长的转变,反映了蒙古鲌遭受竞争压力后产生了适应性的生活史策略[26],以保证种群的生存和繁衍,最终与翘嘴鲌实现同域共存。此外,千岛湖小型鱼类资源丰富,翘嘴鲌和蒙古鲌生长参数的不同也反映了其潜在的饵料生物利用方面的差异。千岛湖的大眼鳜和斑鳜在生长参数表现出较高的一致性,尚未表现出激烈的种间竞争。根据竞争排斥原则,生态位相似物种对资源的利用分离,进而导致生态位分化[27],说明可能在其他生态习性、生活史策略及资源利用等方面出现了生态位分化进而实现共存。
条件系数(CF)是用以衡量鱼体能量储备情况、营养状况和环境条件的重要指标[7]。有研究认为条件系数主要反映了鱼类存储在肌肉中的能量,而这部分能量会在鱼类的繁殖活动中被大量消耗,因此繁殖活动也是导致鱼类的条件系数变化的重要原因[28]。千岛湖4种鱼食性鱼类的CF变化规律与各自繁殖活动变化和季节交替相符。例如,本研究中斑鳜的繁殖期相比大眼鳜到来的更早,因此斑鳜的CF会在繁殖期(3月)到来前稍有上升,并随着繁殖活动的开始CF水平持续降低;大眼鳜的CF的下降趋势出现的比斑鳜晚,这与其GSI变化趋势保持一致。此外,廖传松等[29]发现三峡光泽黄颡鱼种群的相对条件系数指数与底栖生物分布密切相关,表明饵料的可获得性也是影响条件系数的重要因素。Weinert等[30]和Storr-Paulsen等[31]也认为鱼类的食物组成同样能对肥满度产生明显影响,例如摄食更多的鱼类会比摄食更多的底栖动物的条件系数更高。因此,4种鱼食性鱼类CF变化和高低的细微差异反映了其在繁殖策略及摄食偏好上的潜在差异。
综上所述,千岛湖翘嘴鲌和蒙古鲌在生长参数上的差异反映了二者可能存在较为激烈的种间竞争,而蒙古鲌通过快速完成前期的体长增长和后期转为侧重体重增长的生长策略来减缓竞争压力。4种鱼食性鱼类条件系数的差异,反映了其在饵料生物选择偏好上的不同。在千岛湖,飘鱼、、似鱎为主的小型鱼类较多,虾类资源也较为丰富。翘嘴鲌和蒙古鲌均以鱼类为主要摄食对象,但蒙古鲌对虾类的摄食倾向较翘嘴鲌更明显。大眼鳜和斑鳜则主要以虾类为摄食对象,大眼鳜倾向于摄食多种虾类,斑鳜则以鱼类为次要饵料(数据未发表)。因此,4种鱼食性鱼类对不同饵料生物的选择偏好,体现了其对饵料资源利用的划分,饵料资源利用差异会进一步产生营养生态位的分化,最终支撑4种鱼食性鱼类在千岛湖实现同域共存。此外,依据4种鱼类在年龄与生长策略上的差异,能更具针对性地确定相应的开捕体长和捕捞限制规格,从而优化千岛湖对4种鱼食性鱼类的资源利用。
3.2 繁殖策略繁殖是鱼类生活史的重要环节,为鱼类种群的繁衍和发展提供保障。繁殖策略是鱼类长期适应自然环境的结果,鱼类总是不断地寻求最优的两性比例、繁殖时间和场所以及繁殖方式,最大限度地提高后代的成活率[27]。鱼类种群的雌雄性比通常接近1∶1,但产卵鱼群的性比多数为雄性多于雌性,以提高卵子的受精率[7]。本研究中,翘嘴鲌种群的雄性个体数量较多,可能是因为雄鱼的性成熟年龄较早。而蒙古鲌种群的雌性个体数量较多,有利于维持和增加种群数量[7]。大眼鳜和斑鳜的雌雄个体比例则与理论值较为相符,说明其繁殖群体数量相对稳定,为繁殖活动提供保障。4种鱼食性鱼类雌雄性比的差异也反映了鱼类种群对生态环境的适应。
鱼类倾向于延长繁殖时期,从而使其后代获得优渥的发育环境条件[7]。而水温是对鱼类繁殖时期产生显著影响的关键性因素[32-33]。千岛湖翘嘴鲌的繁殖时间与淀山湖翘嘴鲌[34]的繁殖时间相似,是因为淀山湖与千岛湖在地理位置上较为接近,具有相似的水温条件。千岛湖蒙古鲌相比贵州地区的蒙古鲌[35]明显具有更长的繁殖时期,这是因为贵州地区水温较低,升温较慢。赵莎莎[36]在三峡水库对大眼鳜的研究也印证了水温是驱动GSI变化的重要环境因子。总体上看,千岛湖斑鳜的繁殖期(3-7月)到来最早,持续时间最长,其次为大眼鳜(4-7月),但其持续时间与蒙古鲌(5-8月)相同,翘嘴鲌繁殖期(6-8月)开始较晚,持续时间也最短。4种鱼食性鱼类的GSI月度变化趋势与千岛湖水温变化趋势具有一致性[10]。蒙古鲌和斑鳜能相对更早地进入繁殖时期说明其对于诱导繁殖活动开始的水温阈值更低。
鱼类的繁殖力和卵径是繁殖策略的重要表征,两者通常存在权衡,以提高对环境的适应性[7]。千岛湖翘嘴鲌的繁殖力最高,其次为蒙古鲌,大眼鳜和斑鳜的繁殖力相对较低。高的繁殖力意味着能产生更多的后代,但往往平均卵径却更小,表明卵粒中营养物质较少,卵发育成功率较低,通过高繁殖力维持种群数量的增加[37]。较低的繁殖力通常具有更大的平均卵径,其卵粒中卵黄等营养物质也更充足,有利于提高胚胎和仔鱼的存活率。因此,千岛湖翘嘴鲌和蒙古鲌倾向于选择周期主义的繁殖策略,而大眼鳜和斑鳜则倾向于选择机会主义的繁殖策略[38]。此外,大眼鳜和斑鳜条件系数高于翘嘴鲌和蒙古鲌,也反映出4种鱼食性鱼类资源分配与利用策略上的差异:翘嘴鲌和蒙古鲌优先将摄食所获得能量用于繁殖活动,表现出更高的繁殖力;大眼鳜和斑鳜繁殖力较低,但能量更多的用于自身体重的增长,从而为卵粒提供更多的营养物质,这也是鱼类种群延续和繁衍的一种重要生态适应[7]。
鱼类产卵类型一般通过判断卵径分布类型为单峰或多峰,辅以GSI变化趋势来确定。本研究中翘嘴鲌和蒙古鲌的卵径分布均呈单峰状,繁殖期前后的GSI变化急剧,推测二者为单批次产卵类型。而大眼鳜和斑鳜的卵径分布均呈双峰状,GSI同样出现2个高峰(5月和7月)。推测二者为多批次产卵类型。多批次产卵能避免在恶劣环境下后代一次性死亡,同时对于增加个体繁殖力也具有一定帮助[39]。因此,多批次产卵类型是繁殖力较低的鱼类对环境适应性结果,也是其增加种群生存成功率的重要繁殖策略。
综上所述,千岛湖翘嘴鲌和蒙古鲌通过维持高繁殖力的手段来保障种群的繁衍,大眼鳜和斑鳜则通过保证卵粒中营养物质、采用多批次产卵模式提高成功率等方式来延续种群。这4种鱼食性鱼类在性比、繁殖时间、繁殖力、卵径大小、产卵类型等方面的差异,表明4种鱼食性鱼类在面临种间竞争时选择了不同的繁殖策略。鱼类用于繁殖活动的能量,主要是通过摄食来获取的。一般来说,鱼类在繁殖开始前会大量摄食为繁殖活动存储能量,开始繁殖后则会相应的减少摄食强度[7]。因此,4种鱼食性鱼类在繁殖时期上的高度重叠使它们在该时段的资源利用上存在激烈的竞争关系,但它们的种间特异的繁殖习性和繁殖策略能更好地降低集中繁殖产卵带来的资源竞争,为其实现同域共存提供了保障[40]。繁殖期较早的鱼类会率先大量摄食以保障繁殖活动,进入繁殖期后对饵料资源的利用强度减弱,此时其他鱼类开始大量摄食准备进入繁殖期,以此实现了在时间维度上对饵料资源利用的划分,这可能是千岛湖4种鱼食性鱼类同域共存的关键驱动因子。此外,依据4种鱼类在繁殖策略上的差异,能合理地优化现有的禁渔时期和禁渔区域,以对4种鱼食性鱼类资源起到更高效地保护。
4 结论1) 从生长对策上看,千岛湖4种鱼食性鱼类在各项生长参数上的异同,间接反映了4种鱼类种间的竞争情况。翘嘴鲌和蒙古鲌在生长系数(k)和幂指数(b)方面的差异,揭示了蒙古鲌通过快速增长体长和后期转为侧重增长体重等对策以增加自身的竞争力,为同域共存提供保障。而大眼鳜和斑鳜间各项参数保持较高的一致性,说明了其可能出现其他生态习性或生态位的分化从而减弱了种间竞争。条件系数的高低和变化趋势则反映了4种鱼食性鱼类在能量分配模式及摄食偏好上的差异化,食源差异会进一步产生营养生态位的分化,从而帮助4种鱼食性鱼类在千岛湖实现同域共存。
2) 从繁殖对策来看,千岛湖4种鱼食性鱼类在性比、繁殖时间、繁殖力、成熟卵径和产卵类型上均表现出不同的特征,也说明4种鱼食性鱼类在面临种间竞争时选择了不同的繁殖策略。千岛湖翘嘴鲌和蒙古鲌倾向于选择高繁殖力、后代成活率低、单批次产卵的周期主义繁殖策略,而大眼鳜和斑鳜则倾向于选择低繁殖力、后代成活率高、多批次产卵的机会主义繁殖策略。同时,4种鱼食性鱼类在繁殖时间趋向于互相错峰,繁殖高峰也出现了一定的分化。这种细微的差异能帮助其缓解由于繁殖时期高度重叠带来的种间竞争,反映其在资源利用方面的时间分化。因此,这种时间维度上的分化也可能是千岛湖4种鱼食性鱼类同域共存的关键驱动因子。
| [1] |
Begon M, Harper JL, Townsend CR. Ecology from individuals to ecosystems. Oxford: Blackwell Science, 2006: 1-675.
|
| [2] |
Ma KP. Frontiers in biodiversity science: insular biogeography, community assembly and application of big data. Biodiversity Science, 2017, 25(4): 343-344. [马克平. 生物多样性科学的若干前沿问题. 生物多样性, 2017, 25(4): 343-344. DOI:10.17520/biods.2017137] |
| [3] |
Silva JCD, Éder AG, Neves MP et al. Coexisting small fish species in lotic neotropical environments: Evidence of trophic niche differentiation. Aquatic Ecology, 2017, 51(2): 1-14. DOI:10.1007/s10452-017-9616-5 |
| [4] |
Eric RP. Evolutionary ecology. Ebook, 2011, 1-425. |
| [5] |
Frey S, Fisher JT, Burton AC et al. Investigating animal activity patterns and temporal niche partitioning using camera-trap data: Challenges and opportunities. Remote Sensing in Ecology and Conservation, 2017, 3(3): 123-132. DOI:10.1002/rse2.60 |
| [6] |
Davis CL, Rich LN, Farris ZJ et al. Ecological correlates of the spatial co-occurrence of sympatric mammalian carnivores worldwide. Ecology Letters, 2018, 21(9): 1401-1412. DOI:10.1111/ele.13124 |
| [7] |
殷名称. 鱼类生态学. 北京: 中国农业出版社, 1995: 1-293.
|
| [8] |
Melo RMC, Nunes DMF, Moreira DP et al. Comparative reproductive biology of two sympatric Hypostomus in a Neotropical river. Zoology, 2023, 156: 126065. DOI:10.1016/j.zool.2022.126065 |
| [9] |
Lv HJ, Yang LY, Fu M et al. Evaluation on trophic niche characteristics of Coilia nasus from the Three Gorges Reservoir based on stable carbon and nitrogen isotope analysis. Acta Ecologica Sinica, 2022, 42(21): 8739-8750. [吕红健, 杨丽亚, 付梅等. 基于稳定同位素技术的三峡库区短颌鲚营养生态位特征研究. 生态学报, 2022, 42(21): 8739-8750. DOI:10.5846/stxb202101030010] |
| [10] |
刘其根, 汪建敏, 何光喜. 千岛湖鱼类资源. 上海: 上海科学技术出版社, 2011: 1-330.
|
| [11] |
He GX, Zhang JD, Liu QG et al. Preliminary study on the fish community structure in Qiandaohu Lake based on single gillnet catch. Fisheries Science & Technology Information, 2011, 38(4): 197-203. [何光喜, 张峻德, 刘其根等. 基于单层刺网渔获物的千岛湖鱼类群落结构初步研究. 水产科技情报, 2011, 38(4): 197-203. DOI:10.3969/j.issn.1001-1994.2011.04.010] |
| [12] |
Hao YB, Liu JD, Guo AH et al. Fish community structure in Zitong core area in Qiandao Lake national aquatic genetic resources conservation area. Journal of Shanghai Ocean University, 2019, 28(4): 587-596. [郝雅宾, 刘金殿, 郭爱环等. 千岛湖国家级水产种质资源保护区(梓桐核心区)鱼类群落结构. 上海海洋大学学报, 2019, 28(4): 587-596. DOI:10.12024/jsou.20180802383] |
| [13] |
Xie SG, Cui YB, Li ZJ. Ecological studies on lake fisheries on piscivorous fishes: Theory and methods. Acta Hydrobiologica Sinica, 2000, 24(1): 72-81. [谢松光, 崔奕波, 李钟杰. 湖泊食鱼性鱼类渔业生态学的理论与方法. 水生生物学报, 2000, 24(1): 72-81. DOI:10.3321/j.issn:1000-3207.2000.01.012] |
| [14] |
Estes JA, Terborgh J, Brashares JS et al. Trophic downgrading of planet earth. Science, 2011, 333(6040): 301-306. DOI:10.1126/science.1205106 |
| [15] |
Capps KA, Flecker AS. Invasive aquarium fish transform ecosystem nutrient dynamics. Proceedings Biological Sciences, 2013, 280(1769): 20131520. DOI:10.1098/rspb.2013.1520 |
| [16] |
Atkinson CL, Capps KA, Rugenski AT et al. Consumer-driven nutrient dynamics in freshwater ecosystems: From individuals to ecosystems. Biological Reviews of the Cambridge Philosophical Society, 2017, 92(4): 2003-2023. DOI:10.1111/brv.12318 |
| [17] |
Prior KM, Powell THQ, Joseph AL et al. Insights from community ecology into the role of enemy release in causing invasion success: The importance of native enemy effects. Biological Invasions, 2015, 17(5): 1283-1297. DOI:10.1007/s10530-014-0800-4 |
| [18] |
Su H, Pan J, Feng Y et al. Stocking alien carp leads to regime shifts in native fish populations: Evidence from long-term observation and ecological modeling of a Chinese Reservoir. Ecological Indicators, 2021, 132: 108327. DOI:10.1016/j.ecolind.2021.108327 |
| [19] |
Pauly D. Theory and management of tropical multispecies stocks: A review, with emphasis on the Southeast Asian demersal fisheries. Working Papers, 1979, 1-35. |
| [20] |
Chen BG, Li YZ, Chen PM et al. Optimum interval class size of length-frequency analysis of fish. Journal of Fishery Sciences of China, 2008, 15(4): 8. [陈国宝, 李永振, 陈丕茂等. 鱼类最佳体长频率分析组距研究. 中国水产科学, 2008, 15(4): 8.] |
| [21] |
Cai XW, Guo C, Liao CS et al. Population growth characteristics and stock assessment of Paracanthobrama guichenoti (bleeker, 1864) in Kuilei Lake, Jiangsu Province, China. Acta Hydrobiologica Sinica, 2022, 46(3): 348-354. [蔡杏伟, 郭超, 廖传松等. 傀儡湖似刺鳊鮈种群生长特征及资源量评估研究. 水生生物学报, 2022, 46(3): 348-354. DOI:10.7541/2022.2020.029] |
| [22] |
詹秉义. 渔业资源评估. 北京: 中国农业出版社, 1995: 1-425.
|
| [23] |
Gutsch M, Hoffman J. A review of Ruffe (Gymnocepha-lus cernua) life history in its native versus non-native range. Reviews in Fish Biology and Fisheries, 2016, 26(2): 213-233. DOI:10.1007/s11160-016-9422-5 |
| [24] |
Liang YY, Sui XY, Chen YF et al. Life history traits of the Chinese minnow Rhynchocypris oxycephalus in the upper branch of Yangtze River, China. Zoological Studies, 2014, 53(1): 36. DOI:10.1186/s40555-014-0036-0 |
| [25] |
Yang RX, Xie CX, Yang XF. Study on the food composition of 6 species of fierce fish in Liangzi Lake. Reservoir Fisheries, 2002(3): 1-3. [杨瑞斌, 谢从新, 杨学芬. 梁子湖6种凶猛鱼食物组成的研究. 水利渔业, 2002(3): 1-3. DOI:10.15928/j.1674-3075.2002.03.001] |
| [26] |
蒋朝明. 嘉陵江不同江段蛇鮈(Saurogobio dabryi)的生物学特征差异比较[学位论文]. 南充: 西华师范大学, 2017.
|
| [27] |
Wootton RJ. Ecology of teleost fishes. Springer Science & Business Media, 2012, 1-505. |
| [28] |
Shankar DS, Kulkarni RS. Somatic condition of the fish, Notopterus notopterus (Pallas) during different phases of the reproductive cycle. Journal of Environmental Biology, 2005, 26(1): 49-53. DOI:10.2535/ofaj1936.68.2-3_111 |
| [29] |
Liao CS, Li W, Yuan J et al. Age, growth, and motality characteristics of Pelteobagrus nitidus (Sauvage etDabry) in the Three Gorges Reservoir. Acta Hydrobiologica Sinica, 2022, 46(1): 29-36. [廖传松, 李为, 苑晶等. 三峡水库光泽黄颡鱼年龄、生长与死亡特征研究. 水生生物学报, 2022, 46(1): 29-36. DOI:10.7541/2021.2021.120] |
| [30] |
Weinert M, Floeter J, Kroncke I et al. The role of prey composition for the condition of grey gurnard (Eutrigla gurnardus). Journal of Applied Ichthyology, 2010, 26(S1): 75-84. DOI:10.1111/j.1439-0426.2010.01448.x |
| [31] |
Storr-Paulsen M, Carl J, Wieland K. The importance of Atlantic cod (Gadus morhua) predation on northern shrimp (Pandalus borealis) in Greenland waters 2005. Northwest Atlantic Fisheries Organization, 2006, 1-16. |
| [32] |
Wang N, Teletchea F, Kestemont P et al. Photothermal control of the reproductive cycle in temperate fishes. Reviews in Aquaculture, 2010, 2(4): 209-222. DOI:10.1111/j.1753-5131.2010.01037.x |
| [33] |
Zhu FY, Rypel AL, Murphy BR et al. Rapid life-history diversification of an introduced fish species across a localized thermal gradient. Plos One, 2014, 9(2): e88033. DOI:10.1371/journal.pone.0088033 |
| [34] |
Lv DW, Zhou YF, Ge Y et al. Individual fecundity of culter Culter alburnus in Dianshan Lake. Journal of Dalian Ocean University, 2017, 32(6): 5. [吕大伟, 周彦锋, 葛优等. 淀山湖翘嘴鲌繁殖力研究. 大连海洋大学学报, 2017, 32(6): 5.] |
| [35] |
Li SH. Biological characteristics of Erythroculter mongolicus and its breeding technology. Aquaculture and Fisheries, 2006, 371(10): 22-23. [李世华. 蒙古红鲌生物学特性及其养殖技术. 中国水产, 2006, 371(10): 22-23.] |
| [36] |
赵莎莎. 三峡水库香溪河库湾大眼鳜种群的渔业生物学与资源管理对策研究[学位论文]. 北京: 中国科学院大学, 2016.
|
| [37] |
Mollet HF, Cliff G, Pratt HL et al. Reproductive biology of the female shortfin mako, Isurus oxyrinchus Rafinesque, 1810, with comments on the embryonic development of lamnoids. Fishery Bulletin- National Oceanic and Atmospheric Administration, 2000, 98(2): 299-318. |
| [38] |
Winemiller KO. Patterns of variation in life history among South American fishes in seasonal environments. Oecologia, 1989, 81(2): 225-241. |
| [39] |
Nikolsky GV. The ecology of fishes. New York: Academic Press, 1963.
|
| [40] |
毛聆. 嘉陵江鮈亚科鱼类繁殖特征的差异及演化规律研究[学位论文]. 南充: 西华师范大学, 2022.
|
 2023, Vol. 35
2023, Vol. 35 

