(2: 云南省生态环境科学研究院, 云南省高原湖泊流域污染过程与管理重点实验室, 昆明 650034)
(2: Yunnan Key Laboratory of Pollution Process and Management of Plateau Lake-Watershed, Yunnan Research Academy of Eco-environmental Sciences, Kunming 650034, P.R. China)
微囊藻是具有较宽生态位的藻类水华常见优势属之一,微囊藻水华因严重威胁水生态系统健康和饮用水安全而备受关注[1-4]。要深入揭示微囊藻水华的发生机制,对其增殖过程与特征的刻画必不可少,而经室内培养实验得出的结果往往不同于野外实际[5],原位增殖(生长)则可表征藻类在水体中生长快慢的程度,反映自然条件下藻类实际的生长特征[6-7],有助于开展藻类水华模拟及预测预警工作[8-9]。藻类的原位增殖与种间差异及光照、温度、营养盐、流速等生境条件密切相关,进而存在不同水域、垂直分布、昼夜及季节等方面的差异[6, 10-12]。在我国,目前针对藻类原位生长速率的研究主要集中于太湖、三峡水库等湖库[9-11, 13-17],其中聚焦于微囊藻原位生长的研究仍较为零星且大多研究时段相对较窄[10-11, 13-14, 16],难以全面反映微囊藻原位生长的季节变化。
多年来,国内外学者建立了藻类原位增殖的多种表征方法,包括基于藻细胞特征的细胞分裂频率(frequency of dividing cells,FDC)法,以及基于藻类现存量增减的原位培养法和流式细胞仪法等[6, 14, 18]。其中,FDC法是基于藻细胞增殖的二分裂方式,以分裂期细胞为主要观测对象的测定方法,是直接表征或间接计算微囊藻原位生长速率的理想方法,在国内外诸多水体得到了运用[7, 10, 12-13, 16, 19-20]。洱海是云贵高原第二大湖泊,正面临多重压力下的富营养化进程加快、蓝藻水华暴发等生态环境问题[21-23]。例如,1957年在洱海南部发现了束丝藻水华[24],1996年首次出现全湖性蓝藻水华(鱼腥藻占优)后,该湖陆续发生规模不一的蓝藻水华[23, 25-26];2000年左右开始,微囊藻成为该湖藻类水华的常见优势属之一[26-29],但关于其原位增殖的研究尚未见报道。同时,受湖泊水动力条件的影响,近岸水域可成为敞水区微囊藻的种源之一[30]。因此,本研究基于在洱海(南部)近岸开展的原位观测,比较了微囊藻FDC和原位生长速率的点位异同、垂直分布及昼夜与季节变化,并探讨了主要影响因子,旨在为深入研究洱海微囊藻生消及水华发生机制与预测预警提供参考。
1 材料与方法 1.1 研究区域与样品采集洱海(25°36′~25°58′N,100°06′~100°18′E)属构造断陷湖、澜沧江水系,位于云南省大理白族自治州境内,海拔1974 m,水面面积249 km2,流域面积2565 km2,平均水深10.2 m,蓄水量约28×108 m3。洱海属亚热带高原季风气候,多年平均日照时数2247.8 h,多年平均气温15.1℃,多年平均降水量1050 mm,年内干湿气候明显,主导风向为西南风。洱海的主导功能为饮用水源地,目前属中营养湖泊。
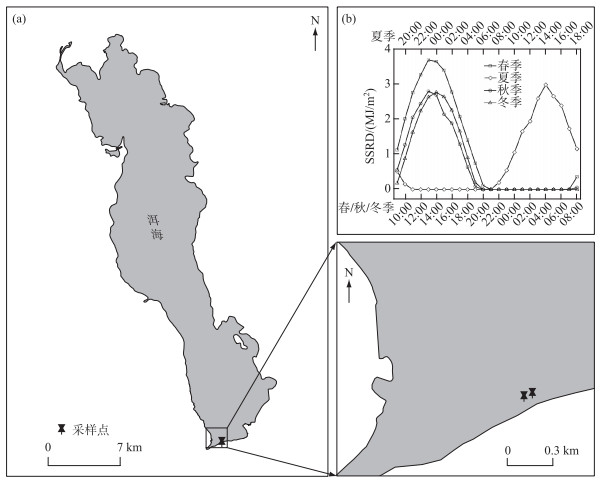
受昼夜连续采样条件的限制,本研究仅在洱海南部的海心亭附近布设2个近岸观测点位(图 1a,点位间相距约60 m;水深均 < 2 m)开展了4个季度的调查。其中,2017年7月13—14日(夏季)于首日的19:00、21:00、23:00及次日的1:00、3:00、5:00、7:00、9:00、11:00、13:00、15:00、17:00分表、中、底3层采集水样(表层,0.5 m;中层,1.0 m;底层,1.5 m),2017年10月28—29日(秋季)、2018年1月23—24日(冬季)及4月25—26日(春季)则于首日的9:00、11:00、13:00、15:00、17:00、19:00、21:00、23:00及次日的1:00、3:00、5:00、7:00分表、中、底3层(各采样水深与夏季的相同)采集水样。
|
图 1 采样点位(a)、四季采样期间地表太阳辐射的逐小时变化(b) Fig.1 Location of sampling sites (a) and seasonal variations in hourly surface solar radiation downwards in the sampling period (b) in Lake Erhai |
样品采集后立即用戊二醛固定,随后用超声细胞破碎仪(S-450D 400W, Branson Ultrasonics Corporation)处理若干次(25% 振幅,5 s)打散微囊藻群体而不破坏细胞,并及时用显微镜拍照后计算微囊藻的FDC(即f),每个样品随机计数至少200个细胞。微囊藻增殖中,有球状或中部没有收缢拉长的单细胞、拉长且中部有收缢的分裂期细胞(计为1个细胞)以及2个细胞相互粘连的双细胞(计为2个细胞)3种状态,f为分裂期细胞占总细胞数的百分比[12]。原位生长速率(比生长速率,μ)的计算参照公式(1)[12]:
| $ \mu=\frac{1}{n T_{\mathrm{d}}} \sum\limits_{i=1}^n \ln \left(1+f_i-f_{\min }\right) $ | (1) |
式中,n为f的测定次数;fi为不同采样时间微囊藻的FDC,fmin为连续监测过程中微囊藻的最小FDC,其中24 h内的20:00至次日4:00微囊藻细胞无有效分裂(fi视为0);Td为细胞分裂所需时间,铜绿微囊藻和惠氏微囊藻的细胞分裂时间分别为3.30、3.07 h[12]。在计算中,根据对洱海全湖开展的同期调查结果[27],春、夏季惠氏微囊藻为属内优势种,分别占2个季节微囊藻总量(以细胞密度计)的100% 和79%,Td以惠氏微囊藻的3.07 h计;秋季以铜绿微囊藻占优势(92%),Td以铜绿微囊藻的3.30 h计;冬季由于大部分微囊藻未鉴定到种,Td取铜绿微囊藻和惠氏微囊藻的均值(即3.185 h)。
1.3 水体理化指标测定及辐射数据来源采样期间,利用经校正的多参数水质监测仪(EXO2, Xylem, USA)同步测定相应水层的水温(WT)、溶解氧(DO)与pH。同时,2017年7月13—14日于首日的19:00及次日的1:00、7:00、13:00,2017年10月28—29日、4月25—26日则于首日的9:00、15:00、21:00及次日的3:00,2018年1月23日的9:00、15:00、21:00分表中底3层采集水样用于溶解性总氮(DTN)、溶解性总磷(DTP)和叶绿素a(Chl.a)浓度的测定[31]。期间,地表太阳辐射(surface solar radiation downwards, SSRD)的逐小时数据源自ERA5-Land[32]。
1.4 数据处理与统计分析本研究中,冬季5:00、7:00及19:00中层的FDC数据为缺失值;7:00—19:00视为白天,21:00—次日5:00视为夜间。水柱理化指标及微囊藻FDC和原位生长速率的点位、昼夜、季节和垂向分层的比较采用T检验或单因素方差分析,FDC的总体比较采用三因素方差分析,由于样本量限制未开展原位生长速率的三因素方差分析。鉴于原位生长速率的样本量相对有限,仅以广义加性模型(所有样本)、Pearson相关性(各季节样本)来探索FDC与主要环境因子的关系;由于实验室测定指标的样本量较少,加之营养盐和叶绿素a浓度对FDC的影响有限,仅选取地表太阳辐射、水温、溶解氧和pH为自变量开展随机森林分析以研究其对FDC的相对贡献大小。以上分析方法均在IBM SPSS Statistics 22.0和R 4.1.3完成,P < 0.05表示显著,P < 0.01表示极显著。
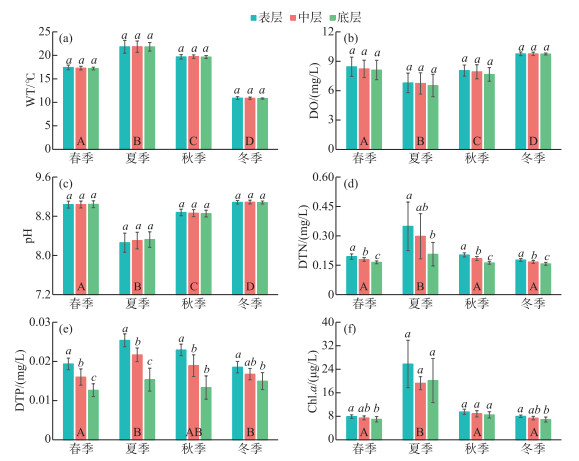
2 结果 2.1 太阳辐射和水柱理化指标调查期间,春季和秋季的地表太阳辐射最大值分别为3.69和2.80 MJ/m2,均出现在13:00;夏季和冬季的最大值分别为2.98和2.76 MJ/m2,均出现在14:00(图 1b)。就水柱理化指标而言,2个点位间的水温、溶解氧、pH、溶解性总氮、溶解性总磷和叶绿素a浓度均无显著差异(P>0.05);水温、溶解氧、pH、溶解性总氮、溶解性总磷和叶绿素a浓度则存在显著的季节差异(P < 0.05,图 2),而对于分层,仅溶解性总氮、溶解性总磷和部分时段的叶绿素a浓度具有显著差异(P < 0.05)。
|
图 2 水柱理化指标(平均值±标准差)的变化(2个点位的所有样本;A、B、C、D和a、b、c分别表示基于单因素方差分析的季节间差异和各季节内的分层差异,事后多重比较采用Duncan法) Fig.2 Changes of physical and chemical parameters (mean±SD) in the water column (combined the two sites; A, B, C, and D represent seasonal differences based on One-way ANOVA, and a, b, and c represent the vertical differences based on One-way ANOVA in each season, the Duncan method was used for post-hoc multiple comparisons) |
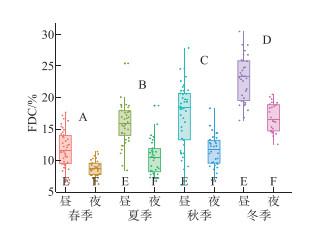
微囊藻FDC的变化范围为6.13%~29.23%,在2个点位和3个分层间均无显著性差异(P>0.05),但具有极显著的季节差异(P < 0.01),表现为冬季(19.65% ±4.10%)>秋季(14.48% ±4.73%)>夏季(12.77% ±3.81%)>春季(10.37% ±2.64%);各季节白天的FDC均显著大于夜间(P < 0.01,图 3)。点位、季节和分层间的三因素方差分析显示,FDC的变化主要受制于季节及其与点位的交互作用,季节变化的影响最大(表 1)。经计算,微囊藻原位生长速率均值为(0.36±0.06) d-1,范围为(0.20~0.42) d-1;其中,1#和2#点位的原位生长速率分别为(0.37±0.04)、(0.34±0.07) d-1,表、中、底3层的原位生长速率分别为(0.38±0.03)、(0.33±0.07)和(0.36±0.05) d-1,2个点位间和3个分层间均无显著性差异(P>0.05);就季节变化而言,春、夏、秋、冬4季的原位生长速率分别为(0.30±0.06)、(0.37±0.07)、(0.36±0.02)和(0.39±0.01) d-1(表 2),其中春季显著低于其它3季(P < 0.05)。
|
图 3 微囊藻细胞分裂频率(FDC)的季节与昼夜变化(两个点位的所有样本;A、B、C、D表示基于单因素方差分析的季节间差异,事后多重比较采用Duncan法;E、F表示基于T检验的昼夜差异比较) Fig.3 Seasonal and diel variations in the frequency of dividing cells (FDC) of Microcystis (combined the two sites; A, B, C, and D represent the seasonal differences based on the One-way ANOVA, and the Duncan method is used for post-hoc multiple comparisons; E and F represent the diel differences based on the T-test) |
| 表 1 细胞分裂频率响应点位、季节及分层变化的三因素方差分析结果* Tab. 1 Results of the Three-way analysis of variance for the frequency of dividing cells comparing the two sites, the four seasons and the three depths |
| 表 2 基于细胞分裂频率法的微囊藻原位生长速率 Tab. 2 The in-situ growth rates of Microcystis spp. calculated by the frequency of dividing cells |
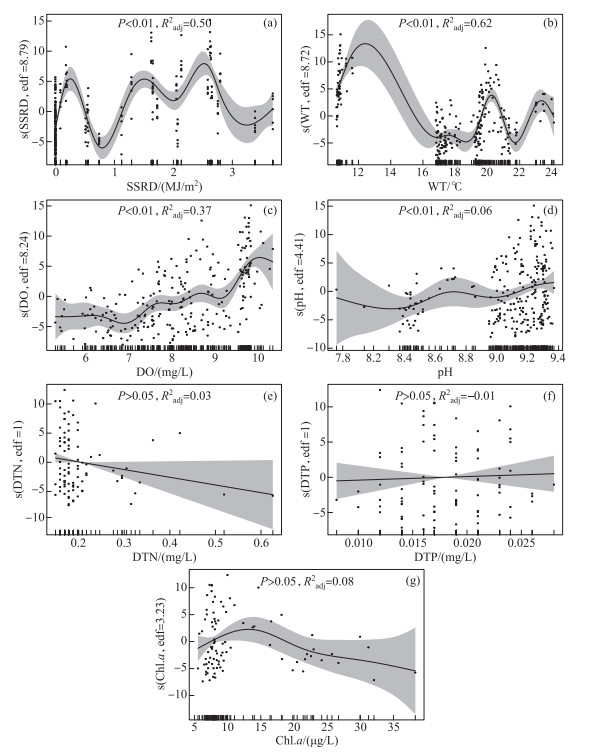
总体上,微囊藻FDC随地表太阳辐射和水温的升高而呈明显的波动变化,随溶解氧和pH的升高而升高,但与溶解性总氮、溶解性总磷和叶绿素a浓度的关系不显著(图 4)。鉴于微囊藻FDC和原位生长速率的差异主要体现在季节变化上,将各季节内的FDC与有关环境因子做了进一步分析,结果显示(图 5):在春季,FDC与地表太阳辐射、溶解氧和pH呈显著正相关,地表太阳辐射的贡献最大;在夏季,FDC与地表太阳辐射、水温、溶解氧、pH呈显著正相关,地表太阳辐射的贡献较大,溶解氧次之;在秋季,FDC与地表太阳辐射、水温、溶解氧、pH、叶绿素a浓度呈显著正相关,地表太阳辐射的贡献最大,水温和溶解氧次之;在冬季,FDC与地表太阳辐射和水温呈显著正相关,与pH呈显著负相关,地表太阳辐射的贡献最大,pH和水温次之。
|
图 4 基于广义加性模型的微囊藻细胞分裂频率随主要环境因子的变化(两个点位的所有样本;解释变量分别为SSRD (a)、WT (b)、DO (c)、pH (d)、DTN (e)、DTP (f)和Chl.a (g);s()即指定样条平滑,edf表示自由度,该值为1表示线性、越大表示非线性越强) Fig.4 Responses of the frequency of dividing cells of Microcystis (response variable) to major environmental factors (explanatory variables: a, SSRD; b, WT; c, DO; d, pH; e, DTN; f, DTP; g, Chl.a) based on generalized additive model (s() represents spline smoothing; edf=1 indicates linearity, and larger values indicate stronger nonlinearity) |
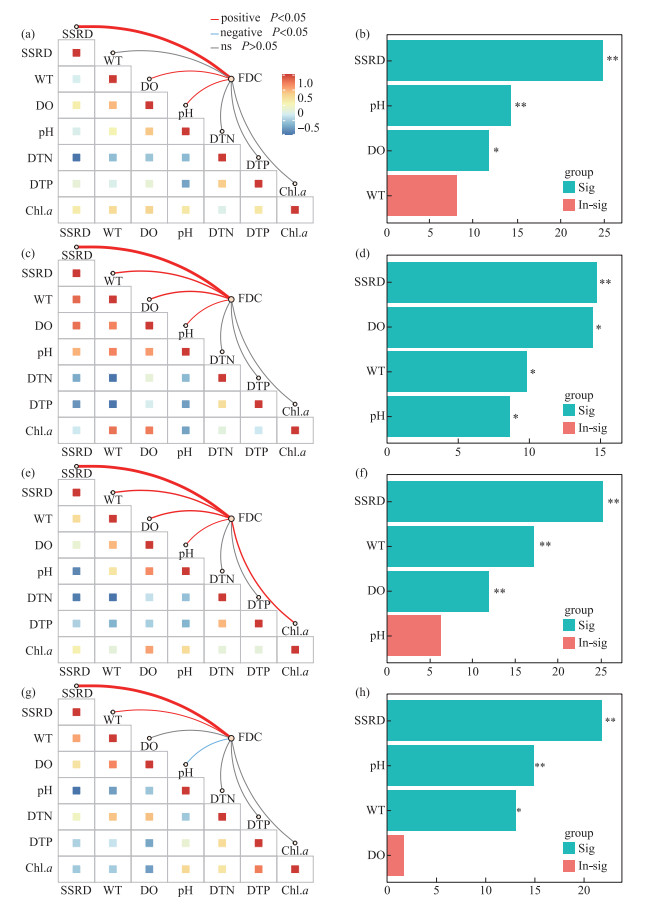
|
图 5 不同季节微囊藻细胞分裂频率与环境因子的相关性及权重分析 (a、b,春季;c、d,夏季;e、f,秋季;g、h,冬季) Fig.5 Correlation and weight analysis of the frequency of dividing cells of Microcystis with selected environmental factors in different seasons (a & b, spring; c & d, summer; e & f, autumn; g & h, winter) |
受制于湖泊地理位置、营养状态及微囊藻自身特性等条件的差异,藻类原位增殖常具有湖泊间异质性。就研究较多的夏秋季而言,本研究计算得到的微囊藻原位生长速率处于日本琵琶湖的范围,但总体大于太湖梅梁湾和巢湖西北部等(表 2)。据报道,莱茵衣藻的每员增长率(per capita growth rate)随营养盐浓度的升高而降低[34],通过打捞解除“密度制约”则促进微囊藻原位生长速率升高[33];相较于富营养湖泊,中营养洱海相对较低的营养盐浓度可加剧微囊藻的种内竞争,而相对低密度的微囊藻则利于自身增殖。同时,有研究指出铜绿微囊藻的比生长速率随细胞体积的增大而减小[35],群体微囊藻的比生长速率小于单细胞[4];类似地,洱海微囊藻群体粒径较小[36],比表面积大或有助于提高生长速率。
在洱海,光照和温度被认为是微囊藻生物量、浮游植物群落演替及多样性等的重要影响因子[27, 37];本研究中,虽然叠加了季节与昼夜不同幅度变化的地表太阳辐射(季节变化小、昼夜变化大)和水温(季节变化大、昼夜变化小)对FDC的总体影响较为复杂(图 4a和b),但二者在微囊藻原位增殖中均发挥了重要作用。尽管洱海地处高原、辐射较强,但自然条件下微囊藻常以群体形式存在,对耐受高光强具有积极作用[38]。在各季节内,受制于太阳辐射等的变化,洱海微囊藻FDC的昼夜变化总体呈先上升后下降的趋势,约13:00达到最大值,在夜间(21:00—5:00)则相对稳定,且均是白天大于夜间(图 3),与此前的室内培养及在自然水体的研究结果一致[10, 12-13, 33],因为白天的光照有利于藻类光合作用和细胞分裂,而夜间无光期藻细胞分裂会暂停[12, 39]。一般而言,微囊藻的增殖能力随温度的升高而升高[7, 19, 40],这也在本研究中得以体现,如大多季节的日内水温与FDC均呈显著正相关(图 5),以及春季至夏秋季微囊藻FDC和原位生长速率的升高;春季微囊藻FDC和原位生长速率低可能还与较强的辐射有关,洱海春季的地表太阳辐射强(图 1b)、漫射衰减系数小[41],光强升高被认为有助于微囊藻群体形成和尺寸变大[42],进而可降低比生长速率[4]。本研究发现冬季微囊藻FDC和原位生长速率总体较高,在Hirosawa-no-ike Pond中也有类似结果——10月铜绿微囊藻的原位生长速率大于水温更高的8月和9月[7]。据报道,太湖微囊藻在春季水温为11~14℃时复苏[40],但事实上在冬季(水温低于10℃)仍可发生小型水华[43],春化作用期间的低温(4、10℃)更利于促进微囊藻的后续增殖[44];有监测显示洱海的年最低水温为8.7℃(12月)[45],在不常监测的夜晚甚至会更低,本研究期间的冬季水温约为11℃,先期的相对低温及当前的水温或利于微囊藻在升温后的复苏及更快速地增殖。虽然溶解氧和pH的变化会受藻类光合与呼吸作用的影响,但在冬季二者受藻类生物量的影响有限(图 5g);相较于其它季节,冬季较高的溶解氧和pH(图 2和图 4),反而有利于提高微囊藻的生理活性及增殖能力[46-47]。同时,洱海冬季的浮游动物相对较少[48],其捕食压力减弱可能也有助于微囊藻FDC的升高,如含色素微型鞭毛虫对聚球藻的摄食效率与聚球藻FDC呈反向关系[49],当然也不排除冬季FDC部分缺失值及种间异质性对结果的影响。在营养盐方面,本研究发现其对微囊藻FDC的影响不显著,可能是当前的可利用营养盐浓度对低生物量藻类的增殖相对充足(溶解性总氮、溶解性总磷及叶绿素a的平均浓度分别为(0.20±0.08) mg/L、(0.02±0.00) mg/L、(11.62±7.04) μg/L;这可使藻类由对营养盐的竞争转向对光的竞争[25],有研究发现洱海浮游植物分类与功能多样性的季节变化与营养盐浓度无关,但会受制于光照[37],而藻类增殖的种间异质性是浮游植物群落发生演替的重要基础。由于研究尺度不同,四季一并分析和分别分析的结果会有所差异,后者主要反映了各季节内影响微囊藻FDC昼夜变化的关键因子。例如,微囊藻FDC总体随溶解氧的增加而增加(图 4c),但夏季相对较低的溶解氧易成为除光照外的关键限制因子,而适宜温度的限制性较小(图 5d),在冬季(低温、高溶解氧)二者的贡献大小则相反(图 5h);再如,春季微囊藻FDC与水温的关系不显著,在其它季节则均呈显著正相关,这可能与春季较强的太阳辐射及相对中等的水环境条件有关,其中首要因子太阳辐射的影响与第二因子的贡献差值最大(图 5)。
在同一个湖泊内,藻类的原位增殖常具有水平和垂向的空间差异,但这并未在本研究中发现。有研究指出,近岸微囊藻的原位生长速率会大于敞水区[12],太湖梅梁湾不同点位间微囊藻原位生长速率的差值可达0.18 d-1 [13],在不同实验或生境条件下的微囊藻原位生长速率亦具有水平空间的差异(表 2)。本研究中,两个点位间距离短、生境条件相对一致,故微囊藻FDC和原位生长速率均未表现出明显的点位差异;在垂向变化上,营养盐浓度及部分时段的叶绿素a浓度均表现出了不同深度间的差异,但微囊藻FDC和原位生长速率总体上并未表现出显著的差异。据报道,洱海没有稳定的热力分层、垂向混合强[50],但部分时段内也在北部湖心观测到了微囊藻生物量、垂直迁移等的垂向差异[36]。藻类生物量与原位增殖的垂直差异会具有不同步性,如太湖梅梁湾秋季蓝藻(微囊藻占优)生物量的垂直差异不明显但表层的原位生长速率高于中层和底层[10],Lake Toya热分层期间真光层中的蓝藻细胞密度和FDC随深度变化会呈反向趋势[51],海洋中聚球藻细胞密度最大值所处深度大于比生长速率最大值所在深度[52],一项针对甲藻细胞密度和FDC垂直变化的模拟试验亦发现了二者的不同步性且具有昼夜变化[53]。在洱海,根据我们先期四个季节调查结果的换算[41],该湖平均真光层深度达(6.17±1.44) m,充足的光照叠加相对较低的营养盐浓度和较小的微囊藻粒径等,可使微囊藻具有较弱的垂直分层[36],尽管叶绿素a浓度并不能直接代表该湖微囊藻的生物量[27]。本研究中,两个观测点位的水深均较浅,虽然表层的营养盐浓度较高但对微囊藻增殖无促进作用(表 1,图 2d~e),充足的光照和较强的混合可能是导致微囊藻FDC和原位生长速率总体无垂向差异的重要原因,但并不排除部分时间段微囊藻原位增殖的垂向差异。由于未同步测定现场风速、水动力及微囊藻生物量、浮力调控与垂直迁移等直接或间接影响原位生长速率的有关指标[11, 17, 33],本研究难以深入探讨不同时间段微囊藻增殖垂向异同的主导因子。
从原位增殖的角度来看,洱海(南部近岸)的微囊藻全年均能保持较好的生长状态,这对该湖微囊藻水华的季节生消及防治具有一定参考价值,其中需重点关注光照的影响,而不同季节需关注的水温、溶解氧等生境条件有所差异;FDC与原位生长速率不等于生物量,虽然本研究中的营养盐浓度未表现出对微囊藻FDC的促进或抑制作用,但这不等于可以放松富营养化治理。本研究只涉及了洱海南部近岸微囊藻的原位增殖,FDC和原位生长速率的具体数值不能完全代表全湖尤其敞水区的状况,且因未测定藻类群落组成、生理指标及刻画更高营养级的作用而缺乏更深入的机制探讨,这需在今后的研究中关注,以全面掌握洱海浮游植物的生长规律,为藻类水华防治提供科学借鉴。需要指出的是,由于研究方法限制和水动力条件等的影响,本研究得到的有关结果并非严格意义上的“原位”。
4 结论洱海南部近岸微囊藻FDC的变化范围为6.13%~29.23%,水平和垂向空间差异均不显著;白天的FDC显著大于夜间,主要是受太阳辐射昼夜变化的影响,其它因子的贡献则具有一定的季节异质性。经计算,微囊藻原位生长速率的均值为(0.36±0.06) d-1,范围为0.20~0.42 d-1,总体较其它有相关研究的湖泊高,或与洱海微囊藻自身特性及营养状态等条件有关。微囊藻FDC和原位生长速率具有显著的季节差异,主要表现为冬季最大、秋季和夏季次之、春季最小,其中营养盐浓度的作用不明显,太阳辐射、水温则扮演了重要角色,还可能与溶解氧、pH和捕食压力等的变化有关。
致谢: 感谢黄立成、李凯迪、陈乐、奚满松、黄娇园和邢梦梦等在野外调查及指标测定方面的帮助!
| [1] |
Huo D, Gan NQ, Geng RZ et al. Cyanobacterial blooms in China: Diversity, distribution, and cyanotoxins. Harmful Algae, 2021, 109: 102106. DOI:10.1016/j.hal.2021.102106 |
| [2] |
Xu H, Qin BQ, Paerl HW et al. Environmental controls of harmful cyanobacterial blooms in Chinese inland waters. Harmful Algae, 2021, 110: 102127. DOI:10.1016/j.hal.2021.102127 |
| [3] |
Huisman J, Codd GA, Paerl HW et al. Cyanobacterial blooms. Nature Reviews Microbiology, 2018, 16(8): 471-483. DOI:10.1038/s41579-018-0040-1 |
| [4] |
Xiao M, Li M, Reynolds CS. Colony formation in the cyanobacterium Microcystis. Biological Reviews, 2018, 93(3): 1399-1420. DOI:10.1111/brv.12401 |
| [5] |
Xiao M, Hamilton DP, O'Brien KR et al. Are laboratory growth rate experiments relevant to explaining bloom-forming cyanobacteria distributions at global scale?. Harmful Algae, 2020, 92: 101732. DOI:10.1016/j.hal.2019.101732 |
| [6] |
Dugenne M, Thyssen M, Nerini D et al. Consequence of a sudden wind event on the dynamics of a coastal phytoplankton community: An insight into specific population growth rates using a single cell high frequency approach. Frontiers in Microbiology, 2014, 5: 485. DOI:10.3389/fmicb.2014.00485 |
| [7] |
Yamamoto Y, Tsukada H. Measurement of in situ specific growth rates of Microcystis (cyanobacteria) from the frequency of dividing cells. Journal of Phycology, 2009, 45(5): 1003-1009. DOI:10.1111/j.1529-8817.2009.00723.x |
| [8] |
Wang C, Kong HN, Wang XZ et al. Early-warning and prediction technology of harmful algal bloom: A review. Chinese Journal of Applied Ecology, 2009, 20(11): 2813-2819. [王崇, 孔海南, 王欣泽等. 有害藻华预警预测技术研究进展. 应用生态学报, 2009, 20(11): 2813-2819.] |
| [9] |
Kong FX, Ma RH, Gao JF et al. The theory and practice of prevention, forecast and warning on cyanobacteria bloom in Lake Taihu. J Lake Sci, 2009, 21(3): 314-328. [孔繁翔, 马荣华, 高俊峰等. 太湖蓝藻水华的预防、预测和预警的理论与实践. 湖泊科学, 2009, 21(3): 314-328. DOI:10.18307/2009.0302] |
| [10] |
Zhou QC, Zhao S, Peng CR et al. The in situ growth and vertical distribution of cyanobacteria in autumn in Meiliang Bay, Lake Taihu, China. Ecological Science, 2016, 35(5): 117-125. [周起超, 赵爽, 彭成荣等. 秋季太湖梅梁湾蓝藻的原位增殖与垂直分布. 生态科学, 2016, 35(5): 117-125.] |
| [11] |
Weng CS, Liu DF, Zhang JL et al. Influence of rainfall on the in situ growth of dominant algae species in Xiangxi River. Environmental Science, 2019, 40(7): 3108-3117. [翁传松, 刘德富, 张佳磊等. 降雨对香溪河库湾主要藻种原位生长的影响. 环境科学, 2019, 40(7): 3108-3117. DOI:10.13227/j.hjkx.201811235] |
| [12] |
Tsujimura S. Application of the frequency of dividing cells technique to estimate the in situ growth rate of Microcystis (Cyanobacteria). Freshwater Biology, 2003, 48(11): 2009-2024. DOI:10.1046/j.1365-2427.2003.01147.x |
| [13] |
Wu XD, Kong FX. The determination of in situ growth rates of the bloomed Microcystis in Meiliang Bay, Lake Taihu. China Environmental Science, 2008, 28(6): 552-555. [吴晓东, 孔繁翔. 水华期间太湖梅梁湾微囊藻原位生长速率的测定. 中国环境科学, 2008, 28(6): 552-555. DOI:10.3321/j.issn:1000-6923.2008.06.015] |
| [14] |
Li Z, Xie D, Guo JS et al. Preliminary study on in situ growth rate of dominant algae species in Pengxi River of the Three Gorges Reservoir. J Lake Sci, 2012, 24(5): 746-754. [李哲, 谢丹, 郭劲松等. 三峡水库澎溪河典型优势藻原位生长速率的初步研究. 湖泊科学, 2012, 24(5): 746-754. DOI:10.18307/2012.0516] |
| [15] |
Feng J, Li Z, Yan B et al. In situ growth rate of dominant algae species in Pengxi River of the Three Gorges Reservoir. J Lake Sci, 2014, 26(2): 235-242. [冯婧, 李哲, 闫彬等. 三峡水库不同运行阶段澎溪河典型优势藻原位生长速率. 湖泊科学, 2014, 26(2): 235-242. DOI:10.18307/2014.0210] |
| [16] |
Wang L, Cai Q, Zhang M et al. Estimating in situ growth rate of Microcystis by FDC technique, with comparison of different sampling periods—A case study from Xiangxi Bay, Three Georges Reservoir, China. Fresenius Environmental Bulletin, 2010, 19(8A): 1576-1581. |
| [17] |
Li Z, Zhang ZY, Yang ZH et al. Effects of flow speed on the change of in situ growth rates of algae in Pengxi River backwater zone, Three Gorges Reservoir. J Lake Sci, 2015, 27(5): 880-886. [李哲, 张曾宇, 杨中华等. 三峡澎溪河回水区流速对藻类原位生长速率的影响. 湖泊科学, 2015, 27(5): 880-886. DOI:10.18307/2015.0514] |
| [18] |
McDuff RE, Chisholm SW. The calculation of in situ growth rates of phytoplankton populations from fractions of cells undergoing mitosis: A clarification. Limnology and Oceanography, 1982, 27(4): 783-788. DOI:10.4319/lo.1982.27.4.0783 |
| [19] |
Latour D, Giraudet H, Berthon JL. Frequency of dividing cells and viability of Microcystis aeruginosa in sediment of a eutrophic reservoir. Aquatic Microbial Ecology, 2004, 36(2): 117-122. DOI:10.3354/ame036117 |
| [20] |
Yamamoto Y, Shiah FK. Relationship between cell growth and frequency of dividing cells of Microcystis aeruginosa. Plankton and Benthos Research, 2010, 5(4): 131-135. DOI:10.3800/pbr.5.131 |
| [21] |
Chen XH, Qian XY, Li XP et al. Long-term trend of eutrophication state of Lake Erhai in 1988-2013 and analyses of its socio-economic drivers. J Lake Sci, 2018, 30(1): 70-78. [陈小华, 钱晓雍, 李小平等. 洱海富营养化时间演变特征(1988—2013年)及社会经济驱动分析. 湖泊科学, 2018, 30(1): 70-78. DOI:10.18307/2018.0107] |
| [22] |
Wang JY, Chen GJ, Huang LP et al. Spatio-temporal patterns and drivers of cyanobacteria blooms in Erhai Lake, Southwest China. Acta Ecologica Sinica, 2017, 37(14): 4831-4842. [王教元, 陈光杰, 黄林培等. 洱海蓝藻爆发的时空特征及影响因子. 生态学报, 2017, 37(14): 4831-4842. DOI:10.5846/stxb201604200740] |
| [23] |
Yang SB, Chen XL, Lu JZ et al. Impacts of agricultural topdressing practices on cyanobacterial bloom phenology in an early eutrophic Plateau Lake, China. Journal of Hydrology, 2021, 594: 125952. DOI:10.1016/j.jhydrol.2020.125952 |
| [24] |
Li SH, Yu MJ, Li GZ et al. Limnological survey of the lakes of Yunnan Plateau. Oceanologia et limnologia Sinica, 1963, 5(2): 87-114. [黎尚豪, 俞敏娟, 李光正等. 云南高原湖泊调查. 海洋与湖沼, 1963, 5(2): 87-114.] |
| [25] |
Yang RB, Fan X, Zhao L et al. Identification of major environmental factors driving phytoplankton community succession before and after the regime shift of Erhai Lake, China. Ecological Indicators, 2023, 146: 109875. DOI:10.1016/j.ecolind.2023.109875 |
| [26] |
Chen JL, Hu MM, Zhou HD et al. Studies on population dynamics and the underlying impact factors of phytoplankton during the cyanobacteria bloom in Lake Erhai. Acta Hydrobiologica Sinica, 2015, 39(1): 24-28. [陈建良, 胡明明, 周怀东等. 洱海蓝藻水华暴发期浮游植物群落变化及影响因素. 水生生物学报, 2015, 39(1): 24-28.] |
| [27] |
Hu LL, Shan K, Huang LC et al. Environmental factors associated with cyanobacterial assemblages in a mesotrophic subtropical plateau lake: A focus on bloom toxicity. Science of the Total Environment, 2021, 777: 146052. DOI:10.1016/j.scitotenv.2021.146052 |
| [28] |
Cao J, Hou ZY, Li ZK et al. Succession of phytoplankton functional groups and their driving factors in a subtropical plateau lake. Science of the Total Environment, 2018, 631/632: 1127-1137. DOI:10.1016/j.scitotenv.2018.03.026 |
| [29] |
Jiang YG, Xiao P, Yu GL et al. Revealing cryptic changes of cyanobacterial community structure in two eutrophic lakes using eDNA sequencing. International Journal of Environmental Research and Public Health, 2020, 17(17): 6356. DOI:10.3390/ijerph17176356 |
| [30] |
Ishikawa K, Kumagai M, Vincent WF et al. Transport and accumulation of bloom-forming cyanobacteria in a large, mid-latitude lake: The gyre-Microcystis hypothesis. Limnology, 2002, 3(2): 87-96. DOI:10.1007/s102010200010 |
| [31] |
国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法: 第4版. 北京: 中国环境科学出版社, 2002.
|
| [32] |
Muñoz Sabater J. ERA5-Land hourly data from 1981 to present. Copernicus Climate Change Service (C3S) Climate Data Store (CDS). 2019. DOI: 10.24381/cds.e2161bac.
|
| [33] |
Chen BF, Feng MH, Shang LX et al. Effects on cyanobacterial growth and water quality after harvesting accumulated cyanobacteria in autumn: An in situ experiment in Lake Chaohu. J Lake Sci, 2016, 28(2): 253-262. [陈丙法, 冯慕华, 尚丽霞等. 秋季聚积蓝藻打捞对蓝藻生长及水质影响的原位实验. 湖泊科学, 2016, 28(2): 253-262. DOI:10.18307/2016.0203] |
| [34] |
Borlestean A, Frost PC, Murray DL. A mechanistic analysis of density dependence in algal population dynamics. Frontiers in Ecology and Evolution, 2015, 3: 37. DOI:10.3389/fevo.2015.00037 |
| [35] |
Kong HN, Wang C, He SB et al. Prediction of the specific growth rate based on the cell characteristics of Microcystis aeruginosa. Environmental Monitoring and Forewarning, 2010, 2(2): 1-6. [孔海南, 王崇, 何圣兵等. 基于细胞自身特征的铜绿微囊藻比生长速率预测. 环境监控与预警, 2010, 2(2): 1-6. DOI:10.3969/j.issn.1674-6732.2010.02.001] |
| [36] |
Wang C, Hou ZY, Chu ZS et al. Vertical distribution of Microcystis and its influence factors in Lake Erhai during high risk period for algal bloom. Research of Environmental Sciences, 2018, 31(7): 1250-1257. [汪偲, 侯泽英, 储昭升等. 藻华高风险期微囊藻在洱海中的垂直分布特征及其影响因素. 环境科学研究, 2018, 31(7): 1250-1257. DOI:10.13198/j.issn.1001-6929.2018.01.14] |
| [37] |
Wang H, Zhao DD, Chen L et al. Light, but not nutrients, drives seasonal congruence of taxonomic and functional diversity of phytoplankton in a eutrophic highland lake in China. Frontiers in Plant Science, 2020, 11: 179. DOI:10.3389/fpls.2020.00179 |
| [38] |
Xu S, Yang YJ, Xu JZ et al. The physiological response of colonial and single-celled form of microcystis to short-term high stress. Acta Hydrobiologica Sinica, 2017, 41(2): 443-447. [徐沙, 杨燕君, 许金铸等. 群体和单细胞微囊藻对短期高光胁迫的生理响应. 水生生物学报, 2017, 41(2): 443-447.] |
| [39] |
Jahan N, Alam MG, Sugiura N et al. Seasonal variation in frequency of dividing cells of freshwater phytoplankters. Environmental Technology, 2001, 22(4): 429-438. DOI:10.1080/09593332208618267 |
| [40] |
Yang Z, Zhang M, Yu Y et al. Temperature triggers the annual cycle of Microcystis, comparable results from the laboratory and a large shallow lake. Chemosphere, 2020, 260: 127543. DOI:10.1016/j.chemosphere.2020.127543 |
| [41] |
Wang WL, Yang XA, Huang LC et al. Attenuation of ultraviolet radiation and photosynthetically active radiation in six Yunnan Plateau Lakes of China based on seasonal field investigations. Journal of Limnology, 2020, 79(2): 151-163. DOI:10.4081/jlimnol.2020.1951 |
| [42] |
Xiao Y, Gan NQ, Zheng LL et al. Studies on morphological responses to light in colonial microcystis and the underlying physiological mechanisms. Acta Hydrobiologica Sinica, 2014, 38(1): 35-42. [肖艳, 甘南琴, 郑凌凌等. 光强对微囊藻群体形态的影响及其生理机制研究. 水生生物学报, 2014, 38(1): 35-42. DOI:10.7541/2014.05] |
| [43] |
Ma JR, Qin BQ, Paerl HW et al. The persistence of cyanobacterial (Microcystis spp.) blooms throughout winter in Lake Taihu, China. Limnology and Oceanography, 2016, 61(2): 711-722. DOI:10.1002/lno.10246 |
| [44] |
Ming H, Yan G, Zhang X et al. Harsh temperature induces Microcystis aeruginosa growth enhancement and water deterioration during vernalization. Water Research, 2022, 223: 118956. DOI:10.1016/j.watres.2022.118956 |
| [45] |
Yu GL, Jiang YG, Song GF et al. Variation of Microcystis and microcystins coupling nitrogen and phosphorus nutrients in Lake Erhai, a drinking-water source in Southwest Plateau, China. Environmental Science and Pollution Research, 2014, 21(16): 9887-9898. DOI:10.1007/s11356-014-2937-1 |
| [46] |
Wang Z, Li D, Li Z. Rainfalls accelerate the decline process of Microcystis (Cyanophyceae) blooms. Fresenius Environmental Bulletin, 2012, 21(8A): 2145-2152. |
| [47] |
Huang YP, Pan HY, Liu HG et al. Characteristics of growth and microcystin production of Microcystis aeruginosa exposed to low concentrations of naphthalene and phenanthrene under different pH values. Toxicon: Official Journal of the International Society on Toxinology, 2019, 169: 103-108. DOI:10.1016/j.toxicon.2019.09.004 |
| [48] |
Li Y, Xie P, Zhao DD et al. Eutrophication strengthens the response of zooplankton to temperature changes in a high-altitude lake. Ecology and Evolution, 2016, 6(18): 6690-6701. DOI:10.1002/ece3.2308 |
| [49] |
An-Yi T, Chin WM, Chiang KP. Diel patterns of grazing by pigmented nanoflagellates on Synechococcus spp. in the coastal ecosystem of subtropical western Pacific. Hydrobiologia, 2009, 636(1): 249-256. DOI:10.1007/s10750-009-9954-y |
| [50] |
Zhao L, Cheng SH, Sun YX et al. Thermal mixing of Lake Erhai (Southwest China) induced by bottom heat transfer: Evidence based on observations and CE-QUAL-W2 model simulations. Journal of Hydrology, 2021, 603: 126973. DOI:10.1016/j.jhydrol.2021.126973 |
| [51] |
Nakano A, Ban S. Microbial communities in oligotrophiclake Toya, japan. Limnology, 2003, 4(3): 177. DOI:10.1007/s10201-003-0109-y |
| [52] |
Neuer S. Growth dynamics of marine Synechococcus spp. in the Gulf of Alaska. Marine Ecology Progress Series, 1992, 83(2/3): 251-262. DOI:10.3354/meps083251 |
| [53] |
Olsson P, Granéli E. Observations on diurnal vertical migration and phased cell division for three coexisting marine dinoflagellates. Journal of Plankton Research, 1991, 13(6): 1313-1324. DOI:10.1093/plankt/13.6.1313 |
 2023, Vol. 35
2023, Vol. 35 

