(2: 中国科学院海岸带环境过程与生态修复重点实验室, 烟台 264003)
(3: 中国科学院大学, 北京 100049)
(2: Key Laboratory of Coastal Zone Environmental Processes, Chinese Academy of Sciences, Yantai 264003, P.R. China)
(3: University of Chinese Academy of Sciences, Beijing 100049, P.R. China)
水库藻类和细菌群落是库区生态系统的重要组成部分,其显著影响着水库生态系统稳定性,并直接或间接地影响着居民饮用水安全。由于氮磷等营养物质不断输入,多地大型湖泊与水库面临不同程度富营养化问题,部分水库已出现硝态氮及总氮浓度居高不下的严峻现实[1-2]。随着水体富营养化程度和范围不断加重和扩大,藻类水华现象屡见不鲜,对国民经济造成了一定损失。在水体富营养化演变过程中,营养物质迁移转化、藻类及细菌新陈代谢均发挥着重要作用。
水体中氮是藻类生长必需的生源要素,也是衡量富营养化程度的重要指标,其在水体中的形态主要包括硝态氮、亚硝态氮、氨氮和有机氮,其中有机氮浓度相对较少[3]。藻类可通过吸收和转化,将无机氮转变为有机氮,为自身生长与繁殖提供营养,随后不同形式有机氮再逐级分解,最后又转化为无机氮。适宜的氮浓度和氮形态会促进藻类生长[4-5],而过高的氮浓度则会抑制其生长[6],且不同形态氮对藻类生长和竞争的影响机制不同[7-8]。同时,不同形态氮还会影响细菌的群落结构[9-10],其中一定浓度氮还会促进微生物生物量的积累。目前,关于氮对微藻及细菌的研究多集中在不同形态氮对单一藻种生长的影响,以及不同形态氮对菌群的影响。而硝态氮作为水体中总氮的主要赋存形态,特别是胶东半岛地区部分水库,库区水体呈现显著“低碳高氮”特征,总氮浓度甚至远高于2 mg/L(地表Ⅴ类限值),其中硝态氮对总氮的占比高达95% 以上[10-11],在这些水库中,水华现象时有发生,但硝态氮对微藻及细菌群落结构的影响尚不清晰。
凤凰山水库位于胶东半岛北部,是当地重要的备用水源及景观水体之一,库区水体绝大部分水质指标常年在地表水Ⅲ类~Ⅴ类之间,其中化学需氧量(COD)低于20 mg/L,但总氮却高于10 mg/L(硝态氮>95%),属于典型的“低碳高氮”水体,其水质变化影响着下游。该水库2019年春季局部曾暴发微囊藻水华,水库总氮明显超标。近年来频繁暴发的藻类水华,直接影响库区水上乐园及水库下游重要景观河流逛荡河的水质[12],而水质演变过程可能与库区水体较高硝态氮负荷密切相关。因此,探究水库不同浓度硝态氮对藻类及细菌群落结构的潜在影响,对认识库区水体水质演变过程和生态系统稳定性具有重要现实意义。
1 材料与方法 1.1 水样来源2021年11月于凤凰山水库(37°28′17.258″N,121°25′44.695″E)采集水样。水样监测后发现库区水体叶绿素a浓度0.01 mg/L,硝态氮浓度1.84 mg/L,总磷浓度0.08 mg/L,铁浓度0.1 mg/L。将300 mL水样经0.45 μm滤膜(Millipore Filter Membrane,Aquo-system,直径47 mm)过滤后,获得测定藻类群落结构样品(a0);300 mL水样过0.22 μm滤膜(Millipore Filter Membrane,Aquo-system,0.22 μm/47 mm)后,获得测定细菌群落结构样品(b0)。
1.2 实验设计将采集的原水20 L分别倒入5个20 L透明广口玻璃瓶,持续增氧曝气14天,获取高浓度藻菌培养物,培养条件为室温培养,光暗比12 h ∶12 h,光照强度为30 μmol photons/(m2·s)。将获得的20 L培养物过0.22 μm滤膜进行收集。共收集15份过滤1 L培养物滤膜。将滤膜放置于5 L磷浓度为0.08 mg/L(添加K2HPO3作为磷源),铁浓度为0.1 mg/L (依据水库水浓度进行设定)的无菌培养液,为保证细菌顺利生长,每1 L培养液增加1 mL由2.86 mg/L H3BO4、1.81 mg/L MnCl2、0.222 mg/L ZnSO4、0.39 mg/L Na2MoO4、0.079 mg/L CuSO4等配置的微量元素溶液(依据培养蓝绿藻的BG11培养基和硅藻的CSI培养基进行调制)。根据湖泊(水库)营养状态评价标准及分级方法及下游河流逛荡河总氮浓度(2018—2019年为2.18~11.22 mg/L)[12-13],设置以硝态氮(NaNO3)为单一氮源的实验组,浓度分别为2、6、10、15 mg/L。对照组与实验组均设置3个重复。实验过程中,取样间隔时间1天,每次取样补充同样体积和同样浓度培养液。培养条件: 室温培养,光暗比12 h ∶12 h,光照强度30 μmol photons/(m2·s),持续曝气培养。
1.3 测定指标与方法 1.3.1 不同形态氮测定50 mL水样经0.45 μm滤膜(HAWP02500,Millipore,US)过滤,滤液测定氨氮、硝态氮和亚硝态氮。采用水杨酸-次氯酸盐紫外光度法测定697 nm吸光度,计算氨氮浓度[14]。采用GB/T 5750—2006紫外分光光度法测定220和275 nm波长的样品吸光度,计算硝态氮浓度。采用GB/T 7493—1987的N-(1-萘基)-乙二胺光度法测定波长为540 nm样品吸光度,计算亚硝态氮浓度[15]。
1.3.2 叶绿素a浓度测定5 mL水样移至尖底离心管,8000 r/min离心15 min去掉上清液,加入80% 丙酮使沉淀再悬浮,避光提取24 h,再次离心以丙酮溶液作为参比,取上清液测定663.2和648.8 nm波长的吸光度值,计算叶绿素a浓度,计算公式为:
| $ \text { Chl. } a=12.25 \times A_{663.2}-2.79 \times A_{648.8} $ | (1) |
取100 mL水样鲁哥试剂固定浓缩,于0.1 mL水样于藻类计数框内,400倍光学显微镜(BX23,Olympus,Japan)进行藻类物种鉴定和计数。利用香农-威纳指数进行藻类多样性分析[16]。300 mL水样过0.45 μm滤膜,高通量测序技术分析滤膜藻类群落结构。300 mL水样过0.22 μm滤膜测定细菌群落多样性。根据叶绿素浓度将实验分为3个阶段,即藻类水华暴发前(叶绿素a < 20 μg/L)、藻类水华暴发期(叶绿素a≥20 μg/L)和藻类水华衰亡期(叶绿素a浓度开始下降)[17]。取3个阶段藻类样品: a17 (暴发前)、a35(暴发期)和a49(暴发后),对应的细菌样品名称为b17、b35和b49,具体操作步骤如下:
1) 基因组DNA的提取和PCR扩增
采用CTAB方法对样品基因组DNA进行提取,琼脂糖凝胶电泳检测提取DNA纯度和浓度; 取适量DNA于离心管,无菌水稀释至1 ng/μL。对细菌16S rDNA的V4~V5区基因片段进行PCR扩增,正向引物和反向引物515F(5’-GTGCCAGCMGCCGCGGTAA)和806R(3’-CCGTCAATTCCTTTGAGTTT)。藻类18S rDNA基因片段采用正向引物528F(5’-GCGGTAATTCCAGCTCCAA),反向引物706R(3’-AATCCRAGAATTTCACCTCT) 2% 浓度琼脂糖凝胶电泳进行。PCR产物纯度检测,目的条带使用Qiagen公司胶回收试剂盒进行回收。
2) 文库构建和上机测序
NEBNextⓇ UltraTM IIDNA Library Prep Kit建库试剂盒进行文库构建,将构建好的文库进行Qubit和Q-PCR定量; 待文库检验合格,NovaSeq6000进行上机测序。根据Barcode序列和PCR扩增引物序列从下机数据中拆分出各样本数据,截去Barcode和引物序列使用FLASH对每个样本reads进行拼接,拼接序列为原始Tags数据(Raw Tags)[17]。使用fastp软件对拼接得到的Raw Tags经过严格过滤处理得到高质量Tags数据(Clean Tags)经过处理后得到的Tags需要进行去除嵌合体序列处理,Tags序列通过(https://github.com/torognes/vsearch/)与物种注释数据库进行比对检测嵌合体序列,去除其中的嵌合体序列[18-19],得到最终的有效数据(Effective Tags)。利用Uparse算法(Uparse v7.0.1001,http://www.drive5.com/uparse/)对所有样本的全部Effective Tags进行聚类,默认以97% 的一致性(Identity)将序列聚类成为OTUs(Operational Taxonomic Units),选取OTUs代表性序列,依据算法原则,筛选OTUs中出现频数最高的序列作为OTUs代表序列。用Mothur方法与SILVA138.1(http://www.arb-silva.de/)的SSUrRNA数据库进行物种注释分析(设定阈值为0.8~1)[20-21],获得分类学信息分别在各个分类水平统计各样本群落组成。MUSCLE(Version 3.8.31,http://www.drive5.com/muscle/)软件进行快速多序列比对,得到OTUs代表序列的系统发生关系。最后对各样本数据进行均一化处理,以样本中数据量最少为标准进行均一化处理,后续分析基于均一化处理后的数据。
1.4 数据分析Office Excel、SPSS和Origin 2017进行数据的归纳和图表分析。采用QIIME的FAPROTAX进行功能预测分析。
2 结果与讨论 2.1 藻类生物量对不同浓度硝态氮的响应 2.1.1 藻类叶绿素a浓度变化叶绿素a是衡量藻类现存生物量的重要指标,通过叶绿素a浓度分析藻类生长及生物量。在未添加硝态氮的对照组中,叶绿素a浓度无明显变化(浓度维持在0.01 mg/L) (图 1A),说明对照组的藻类生物现存量较少,氮缺乏会抑制初级生产者生长。添加不同浓度硝态氮的实验组,叶绿素a浓度随着培养时间延长显著上升。受硝态氮浓度影响,藻类生物量有明显差异,硝态氮浓度6 mg/L时,藻类叶绿素达到最大值1.23 mg/L。硝态氮浓度为10和15 mg/L时,藻类叶绿素a浓度分别为1.11和1.05 mg/L,表明高浓度硝态氮可限制藻类的生长,这可能是由于硝态氮浓度升高,改变藻类最适生长的氮磷比,进而影响藻类叶绿素及细胞内蛋白合成过程[22-23]。硝态氮浓度为2 mg/L时,培养过程中叶绿素a浓度最高为0.86 mg/L,低于其他硝态氮浓度。通常叶绿素a浓度超过20 μg/L时认为发生了蓝藻水华[24],本研究叶绿素a浓度于第17天超过20 μg/L,即模拟实验在第17天后可被视为处于藻类水华阶段。同时藻类水华暴发后,藻类香农-威纳指数显著降低(图 1B),最初原始样品小球藻和栅藻等为优势藻类,与对照组相比,添加硝态氮的实验组中蓝藻门相对丰度明显升高,藻华暴发后,蓝藻门相对丰度明显高于绿藻门,说明实验组暴发以蓝藻门中微囊藻属为优势藻类的藻类水华(图 1C~F)。本研究中实验组中藻类水华暴发,表明添加硝态氮会促进藻类水华形成,印证了硝态氮等营养过量显著加快藻类生长速度,出现藻类过度增殖和暴发藻类水华现象[25]。
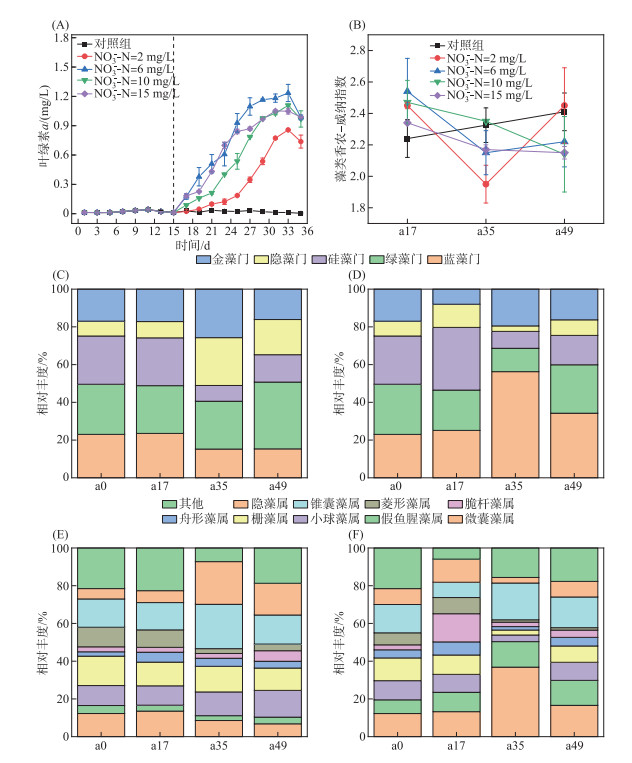
|
图 1 基于镜检的藻类群落结构分析: (A)叶绿素a浓度变化; (B)香农-威纳指数变化; (C)对照组门水平藻类相对丰度; (D)6 mg/L实验组门水平藻类相对丰度; (E)对照组属水平藻类相对丰度; (F)6 mg/L实验组属水平藻类相对丰度 Fig.1 Phytoplankton community composition based on microscopic examination: changes of chlorophyll-a in the study (A); Shannon-Winener diversity index of phytoplankton (B); relative abundance of different phyla in control (C) and in 6 mg/L groups (D); and relative abundance of different genus in control (E) and 6 mg/L groups (F) |
对照组和实验组中硝态氮浓度在培养前15天均呈现缓慢下降的趋势,从第15天后对照组和实验组硝态氮浓度出现明显差异,对照组硝态氮浓度无明显变化,浓度维持在0.02 mg/L左右(图 2)。实验组不同硝态氮浓度变化曲线呈先降低后升高的起伏变化趋势。第31~35天,不同浓度硝态氮浓度基本保持稳定,此时叶绿素a浓度略有所下降。已有研究表明,藻类生长过程中,对营养盐呈现不均匀吸收状态,藻类吸收大量营养盐储存在细胞内[25], 导致硝态氮浓度起伏变化。
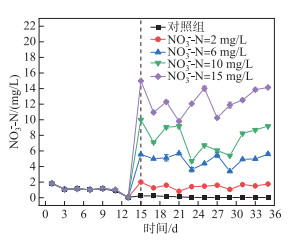
|
图 2 硝态氮浓度变化 Fig.2 Variation of nitrite concentration |
为探究藻类生长过程硝态氮的转化与利用路径,对水样氨氮浓度也进行测定,结果见图 3A。采自水库原水中氨氮初始浓度为0.32 mg/L,经过14天培养,氨氮浓度下降至0.05 mg/L。第15~35天,对照组中氨氮浓度没有明显变化。在加入硝态氮的实验组,氨氮浓度有不同幅度的增加。当硝态氮浓度为6 mg/L时,氨氮浓度最高增加至0.28 mg/L,硝态氮浓度分别为2、10、15 mg/L时,氨氮浓度分别增加至0.17、0.22、0.23 mg/L。采用斯皮尔曼相关性分析硝态氮浓度为6 mg/L时,氨氮浓度增长趋势与叶绿素a浓度变化之间的相关性,得到的相关系数为0.75,这表明水体中藻类生长繁殖时,硝态氮会通过藻细胞的破裂或细菌作用向氨氮转化,其转化程度与硝态氮初始浓度呈正相关。
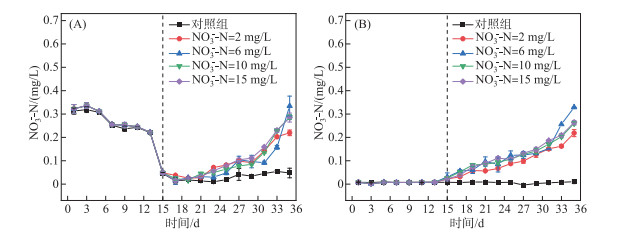
|
图 3 氨氮(A)和亚硝态氮(B)浓度变化 Fig.3 Variations of ammonia (A) and nitrite (B) concentrations |
连续培养过程亚硝态氮随时间变化趋势显示(图 3B),对照组亚硝态氮浓度没有显著变化,加入不同浓度硝态氮,实验组中亚硝态氮浓度随培养时间延长显著升高,硝态氮浓度为2、6、10、15 mg/L,亚硝态浓度从初始0.01 mg/L分别增加至0.22、0.33、0.25、0.26 mg/L。在6 mg/L的硝态氮浓度条件下,亚硝态氮浓度变化最为显著,采用斯皮尔曼相关分析后得出亚硝态氮与叶绿素a的相关系数为0.90。这说明亚硝态氮浓度增加趋势与叶绿素a浓度变化呈显著相关,表明藻类生长繁殖过程中可能会释放亚硝态氮。
2.2 硝态氮对微藻和细菌群落结构演替的影响为解析硝态氮对水体微藻及细菌群落结构演替的影响,通过高通量测序技术对硝态氮浓度为6 mg/L时不同生长阶段藻类与细菌的群落结构及相对丰度进行鉴定。
2.2.1 高通量测序结果与质量分析采用NovaSeq高通量测序平台得到细菌和藻类样本原始序列与其碱基长度可见表 1。由表 1可知,藻类样品经过拼接、质控过滤后获得有效序列占原始序列的比值均在96% 以上,说明样品文库的覆盖率较高,对于细菌样品筛检后得到的有效序列占比达80% 左右,表明高通量测序得到的有效序列,可以满足后续对藻类群落结构研究。
| 表 1 真核藻类群落变化统计结果 Tab. 1 Statistical results of changes in eukaryotic algal communities |
对样品中藻类和细菌群落结构进行Alpha多样性分析,结果见表 2。样品的覆盖率为1,表明测序结果能很真实有效地反映样品的生物多样性。采用OTUs和Chao1丰富度估计量(Chao1 richness estimator)来衡量物种丰富度,其中OTUs代表观察到的物种数目,数值越大说明物种越多。Chaol指数越大,群落丰富度越高。采用香农-威纳指数和辛普森指数,评价藻类和细菌群落丰富度和均匀性。香农-威纳指数代表样品分类总数及占比,香农-威纳指数越大,群落多样性越高,物种分布越均匀。辛普森指数表征群落内物种分布多样性和均匀度,辛普森指数越大,说明群落种数越多,物种分配越均匀,物种多样性程度高。由表 2可见,藻类暴发期间,藻类的物种丰度呈现下降趋势,OTUs个数由135种降到47种,香农-威纳指数和辛普森指数也低于藻类水华发生前。细菌物种在藻类暴发前为531种,藻类暴发时细菌群落降为221种,说明藻类水华暴发后会降低水中细菌丰富度。藻类衰亡期样品中物种数增加至312种,代表物种丰富度和多样性的香农-威纳指数和辛普森指数呈现先降后升趋势。
| 表 2 藻类水华前后藻类和细菌的Alpha多样性 Tab. 2 Alpha diversity of phytoplankton and microorganisms before and after algal blooms |
藻类水华暴发前后真核藻类在门水平的分析结果见图 4A。通过高通量测序分析,水库真核藻类主要包括绿藻门、金藻门、硅藻门和隐藻门4大类,相对丰度分别为75.87%、0.13%、1.05% 和0.05%,藻为绿藻门; 在暴发藻类水华后,绿藻门的相对丰度由75.87% 下降至32.68%,金藻门相对丰度由0.13% 增加至4.64%,硅藻门和隐藻门丰度几乎下降为0,表明出现以绿藻门为优势藻的藻类水华。实验后期优势藻是金藻门,相对丰度为16.45%,其次为绿藻门(1.65%),说明在以硝态氮作为氮源时,绿藻门比其他藻类具有较好的竞争优势[26]。而硅藻门和隐藻门已无法检出。基于高通量测序方法,绿藻门仅为真核类中的优势藻类,结合镜检数据发现,模拟实验中暴发了以蓝藻门为优势藻类的藻类水华现象。

|
图 4 基于扩增子测序的门水平(A)和属水平(B)的真核藻类群落结构分析 Fig.4 Analysis of phytoplankton community structure based on the phylum (A) and genus (B) levels |
藻类水华暴发前后真核藻类在属水平分析结果见图 4B。主要属为未分类绿藻纲(Chlorophyceae)、近囊胞藻属(Paraphysomonas)、四孢藻属(Trebouxiophyceae)、麦可属(Mychonastes)、脆杆藻属(Fragilaria)、曲丝藻属(Achnanthidium)、菱形藻属(Nitzschia)、舟形藻属(Navicula)、隐藻属(Cryptomonas)和其他硅藻属(Bacillariophyceae),相对丰度分别为62.32%、0.11%、7.70%、5.83%、0.41%、0.27%、0.13%、0.06%、0.05% 和0.04%。藻类水华形成时,近囊胞藻属的相对丰度由0.11% 增至4.44%,麦可属的相对丰度由5.83% 增加至6.39%,其余藻类相对丰度呈现降低趋势,未分类的绿藻纲相对丰度显著降至24.55%,四孢藻属相对丰度减少为1.74%,其余藻属降至未检出。衰亡期后,近囊胞藻属相对丰度增加至15.21%,成为优势属。而未分类绿藻纲、四孢藻属和麦可属相对丰度均呈现下降, 分别为0.62%、0.23% 和0.80%。其中近囊胞藻属较其他藻属的竞争力更强。虽未发现近囊胞藻对不同形态氮利用效率的报道,但近囊胞藻隶属于金藻门,曾有研究认为部分金藻对硝态氮的利用效率可能要高于氨氮等氮源[27-28]。
2.2.4 细菌群落结构多样性图 5A是基于门水平藻类暴发前后的细菌菌群结构分析结果。藻类水华暴发前,细菌在门水平上主要蓝藻门(Cyanobacteria)、变形菌门(Proteobacteria)、浮霉菌门(Planctomycetota)、疣微菌门(Verrucomicrobiota)、拟杆菌门(Bacteroidota)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteriota)、酸杆菌门(Acidobacteriota)和粘细菌门(Myxococcota),比例分别为6.59%、74.48%、9.78%、0.35%、2.79%、0.89%、1.98%、1.29%、0.59% 和0.45%。Chen等研究发现[29],细菌将硝态氮转化成亚硝态氮和氨氮,氨氮等氮形态直接被藻类吸收,促进蓝藻和绿藻等优势藻生长。藻类水华暴发时,蓝藻门占比从6.59% 增加至78.40%,绿弯菌门占比从0.89% 略增加至1.03%,变形菌门、浮霉菌门、疣微菌门、拟杆菌门、厚壁菌门、放线菌门、酸杆菌门和粘细菌门的相对丰度均呈现下降趋势,相对丰度分别为17.26%、0.07%、0.24%、0.26%、1.40%、1.27%、0.02% 和0.04%。藻类衰亡期蓝藻门相对丰度降至46.47%,其余细菌相对丰度均有回升,变形菌门、浮霉菌门、疣微菌门、拟杆菌门、绿弯菌门、厚壁菌门、放线菌门、酸杆菌门和粘细菌门相对丰度分别为31.39%、0.35%、8.99%、7.25%、1.99%、1.40%、1.87%、0.03% 和0.07%。蓝藻门相对丰度显著增加,表明藻类水华由于蓝藻大量繁殖,造成硝态氮浓度明显降低。部分蓝藻会向水体中释放微囊藻毒素和鱼腥藻毒素,造成细菌的多样性减少[30-31]; 藻类凋亡期,由于藻类大量死亡造成藻细胞内的营养物质释放,疣微菌门、拟杆菌门和放线菌门丰度增加,上述细菌多数是化能有机营养细菌,与有机物降解密切相关。如拟杆菌门作为高效碳水化合物分解者,对藻类细胞壁含有的纤维素降解有良好的效果[32]。
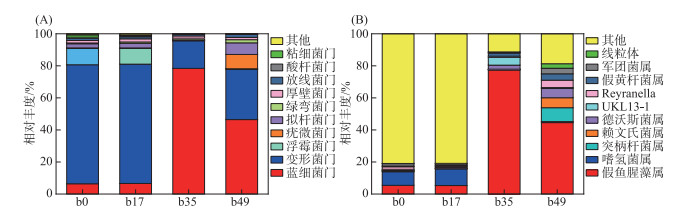
|
图 5 基于门水平(A)和属水平(B)的菌群结构分析 Fig.5 Analysis of bacterial community structures based on the phylum (A) and genus (B) level |
细菌群落属水平分析结果表明(图 5B),藻类水华暴发过程中主要由假鱼腥藻属(Pseudanabaena)、嗜氢菌属(Hydrogenophaga)、突柄杆菌属(Prosthecobacter)、赖文氏菌属(Lewinella)、德沃斯菌属(Devosia)、UKL13-1(隶属于变形菌门)、Reyranella、假黄杆菌属(Pseudoxanthobacter)、军团菌属(Legionella)组成,相对丰度分别为5.31%、10.38%、0.26%、0.09%、0.74%、0.36%、0.69%、0.41% 和0.84%。其中,嗜氢菌属是能够发生氢自养反硝化过程的菌属,假鱼腥藻属和假黄杆菌属都具有固氮能力[33],这导致在加入硝态氮培养过程中,硝态氮浓度变化不明显但叶绿素a浓度仍然增加的现象。藻类水华形成后假鱼腥藻属比例迅速增至77.43%,微生物扩增子数据表明,藻类水华优势藻为假鱼腥藻属,这与显微镜下微囊藻为优势藻类的结果相违背,这可能是与分子方法测定时所采用引物为真核微生物引物有关。藻类水华发生期间,UKL13-1(隶属于变形菌门)占比升至4.84%,而嗜氢菌属占比降至0.22%。藻类水华衰亡期虽然假鱼腥藻属占比降低至44.58%,但依然是优势菌。突柄杆菌属、赖文氏菌属、德沃斯菌属、Reyranella、假黄杆菌和军团菌属相对丰度均显著增加,分别为8.65%、6.24%、5.82%、4.61%、3.99% 和3.47%。这些菌具有一定降解有机化合物和脱氮功能[34],模拟实验由于硝态氮作为唯一氮源引起的藻类水华改变了水体中细菌的群落结构,异养固氮细菌等功能菌群的丰度显著增加。
2.3 功能预测FAPROTAX软件是基于物种信息的功能分类数据库[35-36]。根据数据库注释结果,统计每个样本的丰度信息后(图 6)。藻类水华暴发前后细菌群落结构功能发生了明显的变化,藻类水华暴发前,b17样品氮循环有关nitrite reduction,nitrogen respiration,nitrate respiration,nitrate denitrification等功能过程占据优势。藻类水华暴发期间b35样品oxygenic photoautotrophy等碳功能过程相对于样品b17具有明显提高,氮循环有关功能过程细菌相对丰度减少。藻类水华进入衰亡期,oxygenic photoautotrophy等碳功能过程有关菌群相对减少,其他功能过程包括氮循环等相对丰度明显提高。功能注释结果表明,藻类水华暴发后自养型功能基因等丰度最高,其次nitrogen reduction、denitrification、nitrate respiration等氮循环代谢功能菌群在藻类水华衰亡期明显增强,反硝化过程功能菌群过程也存在一定的比例。实验过程中添加的硝态氮浓度要远大于转化的氨氮和亚硝态氮浓度,说明部分氮元素可能被转化成氮气释放,培养过程中可能存在部分的反硝化过程。这与野外环境中藻类水华期间会出现厌氧层有关的报道吻合[37],藻类在培养过程中虽然会产生氧气,但高密度藻类分解耗氧会造成藻类水华期间水体厌氧环境。有关细菌碳氮循环功能预测分析由于硝态氮的升高导致的藻类水华暴发机制及生态过程提供了参考。
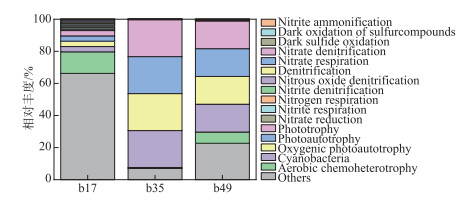
|
图 6 FAPROTAX功能注释相对丰度柱形图 Fig.6 Column chart of relative abundance based on FAPROTAX |
“低碳高氮”型水体中过剩硝态氮会显著促进水体藻类水华形成,同时会影响微藻及细菌群落结构。
1) 硝态氮作为唯一氮源,硝态氮会被微藻吸收利用,水体藻类群落结构会逐步转变为蓝藻门及绿藻门为优势藻的群落并诱发藻类水华,因此当水库出现硝态氮浓度升高时,水库可能会伴生以蓝藻门为优势藻的藻类水华灾害。
2) 硝态氮浓度为6 mg/L时,突柄杆菌属、赖文氏菌属、德沃斯菌属、Reyranella、假黄杆菌属和军团菌属等细菌相对对照组明显增加,其代谢作用会直接影响不同形态氮的转化效率。
3) 硝态氮作为唯一氮源时,在藻华暴发时样品b35和暴发后b49样品观察到相对丰度较高具有硝酸盐反硝化和亚硝酸盐反硝化的细菌,这些细菌促进硝酸盐反硝化过程。参与亚硝酸氨化过程部分细菌也在样品b17和暴发后b49中检测到,这些细菌促进了亚硝酸盐转换成氨。表明硝态氮的外源输入会导致水体营养失衡,促进水体富营养化及藻类水华形成。
| [1] |
Shen LD, Tian MH, Cheng HX et al. Different responses of nitrite- and nitrate-dependent anaerobic methanotrophs to increasing nitrogen loading in a freshwater reservoir. Environmental Pollution, 2020, 263(Pt A): 114623. DOI:10.1016/j.envpol.2020.114623 |
| [2] |
Picetti R, Deeney M, Pastorino S et al. Nitrate and nitrite contamination in drinking water and cancer risk: A systematic review with meta-analysis. Environmental Research, 2022, 210: 112988. DOI:10.1016/j.envres.2022.112988 |
| [3] |
Zhang L, Liu YJ, Ge FJ et al. Spatial characteristics of nitrogen forms in a large degenerating lake: Its relationship with dissolved organic matter and microbial community. Journal of Cleaner Production, 2022, 371: 133617. DOI:10.1016/j.jclepro.2022.133617 |
| [4] |
Ding YQ, Xu H, Deng JM et al. Impact of nutrient loading on phytoplankton: A mesocosm experiment in the eutrophic Lake Taihu, China. Hydrobiologia, 2019, 829(1): 167-187. DOI:10.1007/s10750-018-3830-6 |
| [5] |
Yang L, Zhang M, Liu ZW. Uptake of various forms of nitrogen by phytoplankton community in spring in Lake Taihu. J Lake Sci, 2011, 23(4): 605-611. [杨柳, 章铭, 刘正文. 太湖春季浮游植物群落对不同形态氮的吸收. 湖泊科学, 2011, 23(4): 605-611. DOI:10.18307/2011.0417] |
| [6] |
Kumar A, Bera S. Revisiting nitrogen utilization in algae: A review on the process of regulation and assimilation. Bioresource Technology Reports, 2020, 12: 100584. DOI:10.1016/j.biteb.2020.100584 |
| [7] |
Liu CG, Jin XC, Sun L et al. Effects of nitrogen source and aeration mode on algae growth in freshwater. Environmental Science, 2006, 27(1): 101-104. [刘春光, 金相灿, 孙凌等. 不同氮源和曝气方式对淡水藻类生长的影响. 环境科学, 2006, 27(1): 101-104. DOI:10.13227/j.hjkx.2006.01.019] |
| [8] |
Zhang Y, Zhang HC, Liu Q et al. Total nitrogen and community turnover determine phosphorus use efficiency of phytoplankton along nutrient gradients in plateau lakes. Journal of Environmental Sciences, 2023, 124: 699-711. DOI:10.1016/j.jes.2022.02.005 |
| [9] |
Wang K, Ke S, Yuan H et al. Effect of ammonia-nitrogen concentration on microbial community structure in a mbbr process. Environment Engineering, 2020, 38(9): 119-125. |
| [10] |
Zheng M, Sheng YQ, Sun RC et al. Identification and quantification of nitrogen in a reservoir, Jiaodong peninsula, China. Water Environment Research, 2017, 89(4): 369-377. DOI:10.2175/106143017X14839994523226 |
| [11] |
Liu J, Jiang LH, Zhang CJ et al. Nitrate-nitrogen contamination in groundwater: Spatiotemporal variation and driving factors under cropland in Shandong Province, China. IOP Conference Series: Earth and Environmental Science, 2017, 82: 012059. DOI:10.1088/1755-1315/82/1/012059 |
| [12] |
贾梦黎. 烟台逛荡河流域水质评价及水环境容量研究[学位论文]. 烟台: 烟台大学, 2021.
|
| [13] |
Gong C, Chen X, Rui F et al. Water quality status and eutrophication trend of medium-sized reservoirs in Lishui district from 2011 to 2021. Jiangsu Water Resources, 2022(5): 11-16. [龚畅, 陈霞, 芮峰等. 2011—2021年溧水区中型水库水质状况及富营养化趋势. 江苏水利, 2022(5): 11-16.] |
| [14] |
王文萍, 郭周芳, 尚伟伟等. 水中铵态氮的测定方法. 水科学与工程技术, 2012(3): 26-28. |
| [15] |
国家环境保护总局. 水质亚硝酸盐氮的测定分光光度法(GB/T 7493—1987). 北京: 中国标准出版社, 1987: 149-153.
|
| [16] |
Niu Y, Shen H, Chen J et al. Phytoplankton community succession shaping bacterioplankton community composition in Lake Taihu, China. Water Research, 2011, 45(14): 4169-4182. DOI:10.1016/j.watres.2011.05.022 |
| [17] |
Bokulich NA, Subramanian S, Faith JJ et al. Quality-filtering vastly improves diversity estimates from Illumina amplicon sequencing. Nature Methods, 2013, 10(1): 57-59. DOI:10.1038/nmeth.2276 |
| [18] |
Rognes T, Flouri T, Nichols B et al. VSEARCH: A versatile open source tool for metagenomics. Peer J, 2016, 4: e2584. DOI:10.7717/peerj.2584 |
| [19] |
Haas BJ, Gevers D, Earl AM et al. Chimeric 16S rRNA sequence formation and detection in Sanger and 454-pyrosequenced PCR amplicons. Genome Research, 2011, 21(3): 494-504. DOI:10.1101/gr.112730.110 |
| [20] |
Wang Q, Garrity GM, Tiedje JM et al. Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy. Applied and Environmental Microbiology, 2007, 73(16): 5261-5267. DOI:10.1128/AEM.00062-07 |
| [21] |
Quast C, Pruesse E, Yilmaz P et al. The SILVA ribosomal RNA gene database project: Improved data processing and web-based tools. Nucleic Acids Research, 2013, 41(D1): D590-D596. DOI:10.1093/nar/gks1219 |
| [22] |
Xu H, Paerl HW, Qin B et al. Determining critical nutrient thresholds needed to control harmful cyanobacterial blooms in eutrophic Lake Taihu, China. Environmental Science & Technology, 2015, 49(2): 1051-1059. DOI:10.1021/es503744q |
| [23] |
Tan X, Shi L, Duan ZP et al. Influence of N ∶P ratio on the phosphorus accumulation and distribution of Microcystis and Scenedesmus. J Lake Sci, 2022, 34(5): 1461-1470. [谭啸, 石琳, 段志鹏等. 氮磷比对微囊藻与栅藻磷赋存及分配的影响. 湖泊科学, 2022, 34(5): 1461-1470. DOI:10.18307/2022.0505] |
| [24] |
Ma JR, Deng JM, Qin BQ et al. Progress and prospects on cyanobacteria bloom-forming mechanism in lakes. Acta Ecologica Sinica, 2013, 33(10): 3020-3030. [马健荣, 邓建明, 秦伯强等. 湖泊蓝藻水华发生机理研究进展. 生态学报, 2013, 33(10): 3020-3030. DOI:10.5846/stxb201202140200] |
| [25] |
Zhu YF, Ju SS, Cai QH et al. Community characteristics of the spring phytoplankton in the Three Gorges Reservoir and the influencing factors. Resources and Environment in the Yangtze Basin, 2019, 28(12): 2893-2900. [朱永锋, 琚珊珊, 蔡庆华等. 三峡水库春季浮游植物群落特征及影响因素. 长江流域资源与环境, 2019, 28(12): 2893-2900. DOI:10.11870/cjlyzyyhj201912010] |
| [26] |
Zhou BF. Effect of nitrogen-phosphorus ratio on growth competition of phytoplankton. Hebei Fisheries, 2013(4): 54-55, 58. [周兵飞. 氮磷比对浮游藻类生长竞争的影响. 河北渔业, 2013(4): 54-55, 58. DOI:10.3969/j.issn.1004-6755.2013.04.021] |
| [27] |
Scoble JM, Cavalier-Smith T. Scale evolution in Paraphysomonadida (Chrysophyceae): Sequence phylogeny and revised taxonomy of Paraphysomonas, new genus Clathromonas, and 25 new species. European Journal of Protistology, 2014, 50(5): 551-592. DOI:10.1016/j.ejop.2014.08.001 |
| [28] |
Lu DX. Effects of different nitrogen sources on the proliferation of Isochrysis globosa 3011. Hebei Fzsheries, 2004(4): 14-15, 19. [陆德祥. 不同氮源对球等鞭金藻3011增殖的影响. 河北渔业, 2004(4): 14-15, 19. DOI:10.3969/j.issn.1004-6755.2004.04.007] |
| [29] |
Chen D, Wei L, Zou ZC et al. Bacterial communities in a novel three-dimensional bioelectrochemical denitrification system: The effects of pH. Applied Microbiology and Biotechnology, 2016, 100(15): 6805-6813. DOI:10.1007/s00253-016-7499-3 |
| [30] |
Ding Q, Liu KY, Song ZQ et al. Effects of microcystin-LR on metabolic functions and structure succession of sediment bacterial community under anaerobic conditions. Toxins, 2020, 12(3): 183. DOI:10.3390/toxins12030183 |
| [31] |
Lin J, Chen J, He J et al. Effects of microcystin-LR on bacterial and fungal functional genes profile in rat gut. Toxicon, 2015, 96: 50-56. DOI:10.1016/j.toxicon.2015.01.011 |
| [32] |
Taillefer M, Arntzen MØ, Henrissat B et al. Proteomic dissection of the cellulolytic machineries used by soil-dwelling Bacteroidetes. mSystems, 2018, 3(6): e00240-e00218. DOI:10.1128/msystems.00240-18 |
| [33] |
郭明月. 基于微生物群落结构和病原菌分布的尾水棑海安全研究[学位论文]. 青岛: 青岛理工大学, 2016.
|
| [34] |
Zhang XL, Song YJ, Liu DY et al. Macroalgal blooms favor heterotrophic diazotrophic bacteria in nitrogen-rich and phosphorus-limited coastal surface waters in the Yellow Sea. Estuarine, Coastal and Shelf Science, 2015, 163: 75-81. DOI:10.1016/j.ecss.2014.12.015 |
| [35] |
Louca S, Parfrey LW, Doebeli M. Decoupling function and taxonomy in the global ocean microbiome. Science, 2016, 353(6305): 1272-1277. DOI:10.1126/science.aaf4507 |
| [36] |
Louca S, Jacques SMS, Pires APF et al. High taxonomic variability despite stable functional structure across microbial communities. Nature Ecology & Evolution, 2017, 1: 15. DOI:10.1038/s41559-016-0015 |
| [37] |
Liu XQ, Huang TL, Li N et al. Algal bloom and mechanism of hypoxia in the metalimnion of the Lijiahe Reservoir during thermal stratification. Environmental Science, 2019, 40(5): 2258-2264. [刘雪晴, 黄廷林, 李楠等. 水库热分层期藻类水华与温跃层厌氧成因分析. 环境科学, 2019, 40(5): 2258-2264. DOI:10.13227/j.hjkx.201809026] |
 2023, Vol. 35
2023, Vol. 35 

