(2: 西安理工大学水利水电学院, 西安 710048)
(3: 华中农业大学水产学院, 武汉 430070)
(2: State Key Laboratory of Eco-hydraulic in Northwest Arid Region of China, Xi'an University of Technology, Xi'an 710048, P.R. China)
(3: College of Fisheries, Huazhong Agricultural University, Wuhan 430070, P.R. China)
生物多样性的形成与维持是进化和自然选择的结果,一直是群落生态学领域的中心论题[1]。相比于陆生植物和动物,有关河流生物群落多样性维持机制的研究相对滞后[2]。作为河流生态系统的重要组分,大型无脊椎动物因其种类繁多、生活史复杂、对环境变化响应敏感等特点,成为研究群落构建、多样性维持及环境评价的模式生物[2-3]。开展对大型无脊椎动物的群落生态学研究,尤其在不同的时空尺度上,探讨其物种共存和维持机制,对河流生态学理论的发展以及河流的监测、管理和保护具有重要意义[4-5]。
目前普遍认为,大型无脊椎动物的群落组成和多样性格局受到多种生态学过程如确定性过程(deterministic process,如环境过滤)和随机性过程(stochastic process,如扩散)的共同影响[6]。这些过程的相对重要性因研究区域的范围大小、空间结构、环境异质性以及研究类群的不同而存在差异[2, 7]。已有的研究多集中于温带及热带地区,且多聚焦溪流或小型河流,有关亚热带季风区大型河流无脊椎动物群落多样性维持的研究仍然不足[6]。由于河流环境的变化及生物复杂的生活史特征,群落多样性的维持机制在时间上(如季节/年际间)可能存在差异[7-8]。以往的研究多只基于单次调查所获取的生物和环境数据来开展,极少有研究关注大型无脊椎动物多样性维持机制在时间上的变化规律[9-10]。
汉江上游地处中纬度北亚热带季风区,气候夏热冬温,四季分明。作为南水北调中线工程的水源地,其水体的健康状况事关国家长治久安和经济可持续发展,受到全社会的高度关注[11]。中线工程从丹江口水库调水,为沿线数十个不同规模的城市提供基本的生产和生活用水,极大缓解中北方诸多省市的水源短缺问题。汉江上游亦属国务院“十二五”期间颁布的25个国家重点生态功能区之一的秦巴生物多样性生态功能区,是生物多样性研究的热点区域,也是我国“两屏三带”生态安全战略格局和华中生态安全屏障的重要组成部分[12]。该功能区隶属暖温带落叶阔叶林向北亚热带落叶和阔叶混交林的过渡区,同时还是动物区划上的古北界与东洋界的分界线,因此在动植物类群组成上具有明显过渡带特征[13]。
摸清汉江上游大型无脊椎动物种类组成、多样性格局及其维持机制,不仅对秦巴地区水生生物多样性的保护具有重要意义,亦可为南水北调中线水源地河流的健康评估提供指导。因此,亟需开展对该区域大型无脊椎动物的系统调查。本研究共布设样点150个,涵盖激流、静水、深潭等不同生境类型,亦囊括城镇干扰、农业活动、采砂和水电开发等多种人类干扰方式。本文主要关注:(1)南水北调中线水源地大型无脊椎动物的种类组成;(2)大型无脊椎动物群落多样性的时空格局;(3)驱动大型无脊椎动物群落时空分布格局的关键过程和机制。
1 研究方法 1.1 研究区域及样点布设汉江(30°8′~34°11′N,106°12′~114°14′E)又称汉水,发源于秦岭南麓陕西宁强县境内,是长江最长的支流。其中,湖北省丹江口市以上的河段为上游,干流长约925 km,流域内地形陡峻,水系发达,河网密布。该区域地处北亚热带向暖温带的过渡地带,气候类型主要为亚热带季风气候。冬季温暖,最冷月平均气温在0℃以上;夏季炎热,最热月平均气温高于22℃,气温的季节变化显著,四季分明[14]。水源补给以降雨为主,多年平均雨量约700~1100 mm,且季节分配极不均匀。
于2015—2017年在汉江上游开展了为期3年的野外采样工作,共计布设样点150个(图 1)。其中,2015年和2016年共调查80个样点(灰色),调查频次为一次;另外70个样点(黑色,泗河、金水河、淇河、月河和金钱河)于2016—2017年的春夏秋冬4个季节进行调查。其中,金水河上游位于佛坪县国家级自然保护区内,是自然属性保持最为完好的河流;泗河上游位于赛武当保护区内,中游和下游则受到生活污水及工业废水的影响而污染严重;淇河遭受农业活动影响,水土流失严重;月河上游主要受农业面源污染的影响,而中下游主要受城镇聚集区的干扰;金钱河受农业污染和河道采砂活动的影响,其上游支流还受到城镇生活污水影响(附表Ⅰ)。

|
图 1 南水北调中线水源地样点布设状况 Fig.1 Locations of sampling sites in the water source area of the middle route of the South-to-North Water Diversion Project |
在各样点所在的100 m河段范围内,选取底质、水深和流速等均有代表性的生境(如深潭、激流、有机质或沉水植物等)进行样品采集。其中,在可涉水和以石块底质为主的河段,使用索伯网(Surber sampler,孔径420 μm,面积0.09 m2)进行定量采集;在不可涉水和以淤泥或细沙为主的河段,使用1/16 m2彼得逊采泥器进行定量采集。每个样点采集3~5个定量样方,并混合成1个样品。此外,还使用手抄网进行定性采集,目的是对定量采集进行补充和完善,以尽可能地反映采样区域大型无脊椎动物物种组成的真实状况。样品经40目分样筛筛洗后, 置入封口袋中, 带回室内进行分拣。将洗净的样品倒入解剖盘中,用镊子仔细将大型无脊椎动物标本捡出,置入50 mL的塑料标本瓶中,加入75%的酒精保存标本。在实验室内,依据相关参考文献完成种类鉴定[15-19]。水生昆虫除摇蚊及其他少数科属外,皆在解剖镜下鉴定到属,多数软体动物和水栖寡毛类均鉴定到种。
1.3 环境指标的测定在大型无脊椎动物采集的同时,进行环境因子的测定。海拔和经纬度使用GPS仪(麦哲伦探险家210型)测定,河宽用优利德激光测距仪(LM600型)测量,水深使用标尺测定。使用LJD-10流速仪测定流速,在同一样点内测定5~7次重复,并取平均值。水温、溶解氧、电导、pH使用美国YSI公司多参数水质分析仪(YSI6600)测定。依照Barbour等的标准[20],将底质组成分为5大类:1) 沙和黏土;2) 砾石;3) 圆石;4) 鹅卵石;5) 大石,并在每一采样点估算各类型的百分比。在采集样本的同时,在每个样点使用pH < 2的硫酸处理过的500 mL聚乙烯瓶在水下30 cm采集两瓶水样,低温保存并在24 h内带回实验室内测定水化学指标。所测指标主要包括:化学需氧量(CODMn)、溶解性正磷酸盐(SRP)、总磷(TP)、氨氮(NH3-N)、硝态氮(NO3--N)、亚硝态氮(NO2--N)和总氮(TN)。水体化学指标的测定依据《水和废水监测分析方法》第四版[21]。
采用ArcGIS软件(ArcGIS 10.3,ESRI)从Landsat7 ETM+的卫片中提取各位点的土地利用数据,一般应选取当年获取的、且云量较少的卫片数据进行提取。采用Erdas Imagine 9.2模块,并用监督分类法分类。土地利用类型可分为七大类:农田、森林、灌草、城镇、水域、裸地和其它。根据流域的数字高程模型(digital elevation model),并采用SWAT(soil and water assessment tool)模型运算出各位点的汇水区域(亚流域)面积。
1.4 数据分析本研究使用全部调查所获取的样本(150样点的定量和定性数据)来回答南水北调中线水源地大型无脊椎动物的γ多样性状况;为比较大型无脊椎动物群落结构、密度和多样性的时空变化,则使用5条代表性河流(70个样点的定量数据)4个季节的数据进行分析。
1.4.1 多样性指数和优势种首先,使用区域的总物种数来表征大型无脊椎动物群落的γ多样性(或称区域多样性);使用物种丰富度(species richness,R)和香农-威纳多样性指数(Shannon-Wiener index,H′)来度量群落的α多样性(或称局域多样性)。之后,使用优势度指数(dominance index, Y)遴选大型无脊椎动物群落的优势种。当优势度指数>0.02时,该物种即为优势种[3]。相关指数的计算公式如下:
| $ R=S $ | (1) |
| $ N=n / T $ | (2) |
| $ H^{\prime}=-\sum\limits_{i=1}^s\left(P_i\right)\left(\ln P_i\right) $ | (3) |
| $ Y=\left(n_i / N\right) f_i $ | (4) |
式中,S为样本中总分类单元数;N为总物种密度;n为定量样品鉴定计数获得的个体数;T为各样点采样的总面积;Pi为物种i占样本中总物种数的百分比。ni为物种i的密度;fi为该种的出现频率。
1.4.2 环境因子和群落结构的时空变化使用置换多元方差分析(permutational multivariate analysis of variance,PERMANOVA)来检测环境条件及群落结构在空间(河流)和时间(季节)上的变异[22]。该分析是一种对多个分组中检测多个指标变量的样本整体均值的检验方法。之后,使用单因素方差分析(One-way ANOVA)比较不同河流土地利用类型的差异;采用单因素重复测量方差分析(One-way repeated measures ANOVA)比较环境参数和群落指标(物种丰富度、密度、香农-威纳多样性指数以及主要类群的物种数)在河流间和季节间的差异。重复测量的方差分析是对同一观察对象(如受试者、动物、标本等)的同一观察指标(如某项环境因子)在不同时间点上进行的多次测量,适用于本研究的季节性调查数据[23]。为提高环境/生物数据的方差齐性(homogeneity of variance)和正态性(normality),对数据进行了log10(x+1) 转换。如果方差分析的总体差异显著,就进行多重比较;如果方差齐次,就进行HSD(Tukey's honestly significant difference)检验;如果方差不齐次,则选用Games-Howell检验[23]。
1.4.3 群落变化的驱动力解析为研究大型无脊椎动物的群落构建机制,本研究选取了三组解释变量—各自代表不同的生态学过程,用于对群落构建机制进行探索。其中,(1)环境因子(environmental variables)可以代表物种筛选作用(生态位过程或确定性过程);(2)河流内部的空间因子(within-river spatial factors)可以表征扩散过程(dispersal-related processes)在群落构建中的作用;(3)流域的限制作用(river basin constraints)则可表示扩散限制或历史过程的影响。
由于受限于自身扩散能力、地形阻隔和河流网络结构,大型无脊椎动物的迁移通常发生于河流内部[24]。因此,本研究使用Moran特征向量图(Moran's eigenvector maps,MEM)来检查各河流内部样点之间的空间结构,并对大型无脊椎动物群落结构的变异进行建模[23]。采用Declerck等的方法,基于笛卡尔地理坐标系(Cartesian geographic coordinates)、河流数量(number of blocks)和各河流的样点信息,生成多个正交的空间变量(orthogonal spatial factors) [23, 25]。这些空间变量描述了河流内部的空间结构(即一种错列的空间变量矩阵):当仅考虑特定河流的空间结构时,其余4条河流样点的空间因子特征值(eigenvalues)为零。因此,这种方法非常适合研究区域内包含多个相互分离的子流域的情况[25]。此外,为了测度流域限制对不同河流间物种交流的“屏障”作用,按照Heino等的方法,使用哑变量(dummy variable)作为流域限制作用的替代[26]。由于其操作简单且行之有效,这种方法已被许多大尺度生物多样性研究所采用。本研究共使用5个哑变量(即河流1~5)分别代表所研究的5条河流。
采取变差分解(variance partitioning)比较环境因子、空间因子及流域限制对各季节大型无脊椎动物群落变化的相对作用。首先,选用基于距离的冗余分析(distance-based redundancy analysis,db-RDA)对关键因子进行筛选[27]。在该模型中,生物群落结构(各个样点的密度数据)作为生物数据源,环境因子、空间因子(MEMs)和流域因子(即哑变量)作为环境数据源。分析前,将生物数据进行log10(x+1)转化,剔除较高相关性(r>0.75)及膨胀因子(inflation factor)大于20的环境因子。用前选法(forward selection)和Monte Carlo置换检验确定对群落变异具有重要且独立作用的最小变量组合。最后,采用变差分解计算出三组因子单独及协同作用对各季节大型无脊椎动物群落变化的影响程度及大小。
PERMANOVA分析于PRIMER 6.0中完成;单因素重复测量的方差分析在SPSS 22.0软件中运行;MEM分析采用R语言(R 3.5.1)中的“adespatial”软件包计算;db-RDA和变差分解采用“vegan”软件包进行分析。
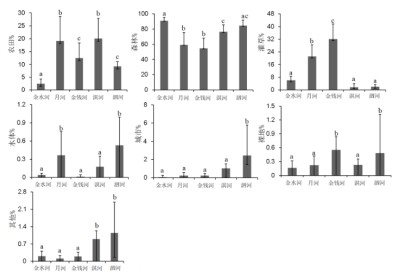
2 结果 2.1 环境条件的时空变化单因素方差分析显示,不同河流的土地利用类型存在显著差异(P < 0.05,附图Ⅰ)。其中,自然河流金水河拥有最低比例的农田和城镇,和最高的森林覆盖率。相比之下,与人类活动相关的土地利用类型在月河、金钱河、淇河和泗河则占据较高的比例:月河和淇河有着最高比例的农田;金钱河拥有最高比例的灌草和裸地;而泗河则有着最高的城镇占比(附图Ⅰ)。
PERMNOVA分析显示,环境条件在空间(河流间)和时间(季节间)尺度上差异显著(P < 0.05,表 1)。进一步的重复测量方差分析表明,除水深外,其余环境因子在河流和季节间均存在显著差异(P < 0.05,附表Ⅱ)。空间上,金水河具有更高的pH值、更快的流速以及更高比例的粗颗粒底质(大石和卵石),同时该河流也有更低的电导率、浊度,较少比例的细颗粒底质(小圆石和砾石)以及更低的营养盐浓度。相比之下,金钱河具有最高的电导率和浊度以及更多的细碎底质,而淇河和泗河则拥有更高水平的营养盐浓度。时间上,春季河流的pH值,磷酸盐和总磷高于其他季节;夏季则拥有最高的水温以及最低的溶解氧;秋季河流拥有最高的总氮、亚硝氮、硝态氮以及化学需氧量;而冬季则有最低的水温,最高的电导率和铵盐浓度。其余理化指标,如浊度、水深、流速、卵石% 和总磷在季节间没有显著差异(P>0.05)。
| 表 1 环境条件和群落结构在河流和季节间变化的PERMANOVA分析结果 Tab. 1 Differences in environmental conditions and community structure among rivers and seasons based on PERMANOVA analysis |
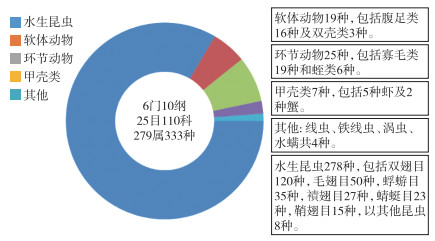
共计采集到标本68063条,鉴定出大型无脊椎动物333个分类单元,隶属于6门10纲25目110科279属(附表Ⅲ)。其中,水生昆虫包括278个分类单元(占总物种数的83.5%),环节动物为25个(7.5%),软体动物19个(5.7%),软甲类7个以及其它动物4个(图 2)。该流域的常见种(出现率>50%)为蜉蝣目的四节蜉属(Baetis sp.)和扁蜉属(Heptagenia sp.),毛翅目的短脉纹石蛾(Cheumatopsyche sp.)以及双翅目的朝大蚊(Antocha sp.)等。
|
图 2 南水北调中线水源地河流大型无脊椎动物群落的物种组成 Fig.2 Species composition of macroinvertebrate communities in the water source area of the middle route of the South-to-North Water Diversion Project |
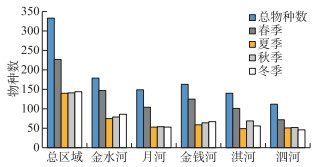
大型无脊椎动物的物种数在河流和季节间存在明显差异。时间上,春季物种数最多,为227种,夏季、秋季和冬季物种数较少,分别仅为140、141和144种;空间上,金水河的物种数最多(179种),其次为金钱河(163种)、月河(149种)、淇河(140种)和泗河(112种)(图 3)。
|
图 3 大型无脊椎动物物种数在不同季节和河流间的比较 Fig.3 Comparations of taxa richness between seasons and rivers |
各季节的优势种存在一定的差异(附表Ⅳ)。其中,春季的优势种包括四节蜉属、扁蜉属、蜉蝣属(Ephemera sp.)、缺纹石蛾属(Potamyia sp.)和细蜉属(Caenis sp.);夏季的优势种为短脉纹石蛾属、纹石蛾属(Hydropeyche sp.)、四节蜉属、扁蜉属和宽基蜉属(Choroterpes sp.);秋季的优势种为短脉纹石蛾属、四节蜉属、蜉蝣属、侧枝纹石蛾属(Ceratopsyche sp.)和扁蜉属;冬季的优势种包括四节蜉属、纹石蛾属、扁蜉属、短脉纹石蛾属和等蜉属(Isonychia sp.)。
不同河流的优势种亦有所差异(附表Ⅴ)。在金水河,优势种为缺纹石蛾属、朝大蚊属、高翔蜉属(Epeorus sp.)、扁蜉属和舌石蛾属(Glossosoma sp.);月河的优势种为蜉蝣属、四节蜉属、短脉纹石蛾属、扁蜉属和细蜉属;金钱河的优势种为蜉蝣属、四节蜉属、缺纹石蛾属、圆溪泥甲属(Optioservus sp.)和细蜉属;淇河的优势种为扁蜉属、宽基蜉属、等蜉属、短脉纹石蛾属和缺纹石蛾属;泗河的优势种包括四节蜉属、细蜉属、宽基蜉属、短脉纹石蛾属和等蜉属(附表Ⅴ)。
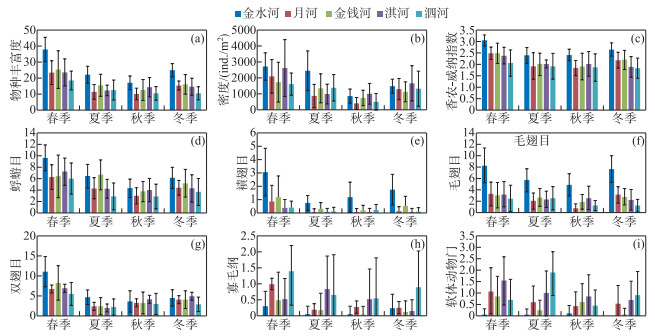
2.3 群落的时空差异PERMNOVA分析表明,大型无脊椎动物群落结构在空间和时间尺度上均差异显著(P < 0.05,表 1)。重复测量方差分析显示,大型无脊椎动物群落多样性亦存在显著的时空差异性。空间上,相比于其余4条河流,金水河拥有更高的群落多样性(物种丰富度、密度和多样性)和更为丰富的水生昆虫物种(蜉蝣目、襀翅目、毛翅目和双翅目);其余4条河流(尤其是泗河)则栖息着更多的寡毛类和软体动物。时间上,春季大型无脊椎动物具有更高的群落多样性,而夏季、秋季和冬季3个季节的多样性则相对较低(表 2,图 4)。
| 表 2 物种丰富度、密度、香农-威纳多样性指数和主要类群的物种数在河流和季节间差异的方差分析结果 Tab. 2 Results of One-way repeated measures ANOVA, showing the differences of species richness, density, Shannon-Wiener index and species richness of main taxa groups among rivers and seasons |
|
图 4 物种丰富度(a)、密度(b)、香农-威纳多样性指数(c)以及蜉蝣目(d)、襀翅目(e)、毛翅目(f)、双翅目(g)、寡毛纲(h)和软体动物(i)的物种数在河流和季节间的比较 Fig.4 Comparison of (a) species richness, (b) density, (c) Shannon-Wiener index and species richness of (d) Ephemeroptera, (e) Plecoptera, (f) Trichoptera, (g) Diptera, (h) Oligochaeta and (i) Mollusc among rivers and seasons |
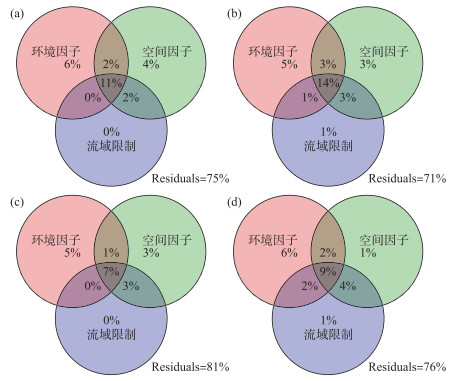
db-RDA分析显示,尽管不同季节所筛选出的关键因子有所差异(表 3),环境因子、空间因子和流域因子在解释大型无脊椎动物群落变化中均起着重要作用(表 3)。进一步的变差分解分析表明,环境因子的解释率在各个季节均高于空间因子和流域因子(图 5)。模型的解释率在春夏秋冬4季分别为25%、29%、19%和24%(均值为24.3%);环境因子单独解释率的均值为5.5%,空间因子为2.8%,交互作用为16%。此外,尚有大量的群落变异(71%~81%)未被模型所解释(图 5)。
| 表 3 db-RDA及前向选择所筛选出的关键环境因子、空间因子及流域因子(哑变量) Tab. 3 Results of db-RDA and forward selection showing the relationships between community structure and significant environmental, spatial and basin dummy variables |
|
图 5 环境因子、空间因子和流域限制对大型无脊椎动物群落变化的相对重要性 a: 春季;b: 夏季;c: 秋季;d: 冬季 Fig.5 Relative importance of environmental variables, spatial factors and basin constrains for macroinvertebrate assemblages in the four seasons a: spring; b: summer; c: autumn; d: winter |
汉江上游地处秦巴山区,其密集的水网结构、复杂的地形地貌以及适宜的气候条件维持了丰富的水生生物类群。然而,人们对该区域水生生物的调查仍然缺乏,对大型无脊椎动物群落组成及其驱动机制的认识依然有限。已有的研究多只聚焦于少数支流或河段,缺乏大范围、多位点的调查工作,亦缺乏多季节、连续性的动态观测,所得结论难以充分反映大型无脊椎动物多样性的真实状况。本研究历时3年,共布设样点150个,涵盖大小河流十余条,是南水北调中线水源地大型无脊椎动物调查中较为全面的一次。流域内共发现大型无脊椎动物333个分类单元,高于Jiang等在该区域所采集到的186种[28],远高于池仕运等报道的57种[29]以及张敏等记录的61种[30]。因此,本研究较为系统地揭示了汉江上游大型无脊椎动物物种组成及多样性的现状,可为后续水生生物资源的保护和恢复,以及水源地河流生态健康评估提供数据支撑。
大型无脊椎动物群落多样性存在着较高的时空差异。从时间尺度来看,春季的γ多样性和α多样性均显著高于夏季、秋季和冬季。有研究表明,亚热带地区的水生昆虫(如蜉蝣目、襀翅目、毛翅目和双翅目)在春季多处于其生活史的水生幼虫/稚虫阶段,更易于采集,因此多样性较高[4, 28]。而在夏季和秋季,水生昆虫逐渐羽化,其生活史经历了由水生幼虫/稚虫向陆生成虫的转变,导致夏秋季大型无脊椎动物的多样性较低[15]。此外,在丰水期,季风区河流洪水的冲刷亦会显著降低大型无脊椎动物的密度和多样性[9]。在冬季,许多水生昆虫处于卵茧或低龄幼虫阶段[15],难以采集和鉴定,导致其物种丰富度相对较低。从空间尺度来看,金水河的γ多样性和α多样性均处于较高水平,而其余河流的多样性则相对较低,尤其是在城镇干扰最为严重的泗河。许多研究表明,人类干扰会严重影响大型无脊椎动物群落的物种组成,造成敏感种(如蜉蝣目、襀翅目和毛翅目昆虫等)的丧失和耐污种(如摇蚊类和寡毛类等)的增加,进而导致群落内物种数和多样性的下降,并最终对生态系统的结构和功能造成损害[28, 31-33]。因此,自然河流(金水河)与人为干扰河流(月河、金钱河、淇河和泗河)之间物种组成和群落多样性的差异与流域内的农业活动、城镇建设、水电开发、采石挖砂等人类活动密切相关。
3.2 群落多样性维持机制变差分解模型显示,环境因子、空间因子以及流域限制均解释了一定的群落变化(图 5),表明大型无脊椎动物的群落组成是多种生态学过程共同作用的结果。其中,环境因子解释了更多的群落变异。该结果与当前多数河流生物群落构建机制的研究结论相一致[34-37]。在群落构建过程中,环境过滤的作用往往随环境因子变异幅度的增加而增加,并在环境异质性高的区域占据优势[38-39]。由于河流生态系统的高度复杂性,加之流域内自然条件的变化以及人为干扰的影响,海拔、土地利用方式、水温、底质类型和营养盐浓度等环境因子均产生不同程度的变化。各样点间环境状况的巨大差异维持了水源地河流较高的环境异质性,同时也形成了强大的“环境过滤器(environmental filters)”,使确定性过程在大型无脊椎动物群落构建中占据主导地位[40-41]。
另一方面,空间因子对群落也有着不可忽视的影响,表明扩散过程(dispersal related processes)在大型无脊椎动物群落构建中亦发挥着重要作用[9, 41]。值得注意的是,质量效应(mass effects)和扩散限制(dispersal limitation)都可以产生空间作用,且难以通过变差分解等方法将两个过程的影响进行区分[42-43]。在本研究中,空间作用主要源自于扩散限制而非质量效应。这是因为汉江上游有着近10万km2的集水面积,其中的75%被山脉和丘陵所覆盖[2], 较大的空间范围、复杂的地形地貌和河网结构以及河流流向的单一性等因素,使得流域内的水生生物受到扩散限制作用的强烈影响。高山和丘陵地貌为流域内的物种提供了诸多特有的小生境,但同时也限制了物种的迁移、定殖和基因交流。这使得孑遗物种和后形成的物种分布范围偏小,形成某些区域或者生境类型中特有的物种组成[44]。此外,汉江上游的大型无脊椎动物中有着较多的稀有种(附表Ⅵ),这些物种密度较低且迁移能力差,因而容易受到扩散限制的影响[45]。
尽管环境过滤在各季节均处于主导地位,本研究发现不同季节所筛选出的关键因子以及这些因子的相对作用存在一定差异。这可能与环境特征的季节变化以及大型无脊椎动物(尤其是水生昆虫)复杂的生活史有关[46]。一方面,环境的季节变化在时间序列上形成了特定的生态位空间。不同物种按其生态需求/环境偏好依次出现并有序地排列在时间轴上,为实现时间尺度上的物种共存创造了条件,有助于河流中较高的生物多样性的维持[2, 15]。另一方面,大型无脊椎动物自身的生活史特征亦影响着其群落构建过程。例如,水生昆虫在春季多处于水生幼虫/稚虫阶段,其活动范围受限于河道,扩散能力往往较弱;到了夏、秋季节,部分水生昆虫羽化为成虫,可通过飞行进行长距离迁移[47-48]。物种生活习性及扩散方式的季节性变化,可能是群落结构的影响因素在季节间有所差异的原因[49-50]。值得注意的是,db-RDA在各季节的解释率仅为20%左右,模型存在较多未解释的部分(图 5)。这可能与一些未被考虑的生态过程有关,如区域的物种形成和消亡、同/异营养级生物间相互作用(如共生、竞争、捕食和寄生)、外来种入侵以及未测量的重要环境参数(如重金属指标)等[9, 26, 28]。后续应考虑更多的生态学过程,并尝试多种统计分析手段,从而更为深入地揭示河流大型无脊椎动物多样性的维持机制。
4 结论通过为期3年的调查,本研究系统回答了南水北调中线水源地大型无脊椎动物的物种组成及多样性现状,初步探索了其群落多样性的维持机制,弥补了该区域大型无脊椎动物研究的不足。总体而言,中线水源地维系了极为丰富的大型无脊椎动物多样性。但由于人类活动的影响、自然条件的变化以及动物生活史的差异,物种多样性存在明显的时空变化。在空间上,自然河流大型无脊椎动物的物种多样性明显高于人类干扰河流;在时间上,春季大型无脊椎动物种类最多,其它季节则相对较少。在群落多样性维持方面,环境过滤和扩散过程同时作用于大型无脊椎动物群落,但前者的重要性明显高于后者,表明生态位确定性过程是影响流域内大型无脊椎动物多样性格局的主导因素。此外,模型所筛选的关键因子以及这些因子对群落变异的解释率在季节间存在差异,说明不同季节的大型无脊椎动物群落受到不同的生态学过程驱动。因此,季节性的连续监测能够更清晰地反映大型无脊椎动物群落多样性格局及其维持机制的真实状况。
5 附录附表Ⅰ~Ⅵ和附图Ⅰ见电子版(DOI: 10.18307/2023.0634)。
| 附表Ⅰ 5条代表性河流的流域面积、长度及主要干扰类型 Appendix Ⅰ Basin area, length and main disturbance types of the five representative rivers |
| 附表Ⅱ 环境因子在河流和季节间差异的单因素重复测量的方差分析结果 Appendix Ⅱ spatial and seasonal variation of environmental parameters based on One-way Repeated Measures Anova |
| 附表Ⅲ 南水北调中线水源地河流大型底栖无脊椎动物物种组成 Appendix Ⅲ Species composition of macroinvertebrates in the water source of the middle route of the South-to-North Water Diversion Project |
| 附表Ⅳ 不同季节的大型底栖无脊椎动物优势种(优势度Y > 0.02) Appendix Ⅳ Dominant species of macroinvertebrates in different seasons (dominance value Y > 0.02) |
| 附表Ⅴ 不同河流大型底栖无脊椎动物的优势种(优势度Y > 0.02) Appendix Ⅴ Dominant species of macroinvertebrates in different rivers (dominance value Y > 0.02) |
| 附表Ⅵ 各季节大型底栖无脊椎动物稀有种(出现率< 5%) 所占比例 Appendix Ⅵ Rare species of macroinvertebrates in each season (occurrence rate < 5%) |
|
附图Ⅰ 南水北调中线水源地五条代表性河流土地利用方式的比较 不同字母代表存在显著性差异(P <0.05) AttachedFig1 Comparation of land use types of the five representative rivers in the water source of the middle route of the South-to-North Water Diversion Project. Different letters represent there exist significant difference (P < 0.05) |
致谢: 感谢中国科学院水生生物研究所吴辰熙、贾银涛老师以及中国科学院武汉植物园的谭香老师在课题实施过程中给予的帮助。
| [1] |
Chase JM. Community assembly: When should history matter?. Oecologia, 2003, 136: 489-498. DOI:10.1007/s00442-003-1311-7 |
| [2] |
Li Z, Heino J, Song Z et al. Spatio-temporal variation of macroinvertebrate metacommunity organization in a monsoon-climate region. Journal of Biogeography, 2021, 48(12): 3118-3130. DOI:10.1111/jbi.14270 |
| [3] |
Zhu CX, Mo KL, Tang L et al. Spatial-temporal distribution and ecological effects of macroinvertebrate functional feeding groups in the Lijiang River. Acta Ecologica Sinica, 2020, 40(1): 60-69. [朱晨曦, 莫康乐, 唐磊等. 漓江大型底栖动物功能摄食类群时空分布及生态效应. 生态学报, 2020, 40(1): 60-69. DOI:10.5846/stxb201811262574] |
| [4] |
Krajenbrink HJ, Acreman M, Dunbar MJ et al. Macroinvertebrate community responses to river impoundment at multiple spatial scales. Science of the Total Environment, 2019, 650: 2648-2656. DOI:10.1016/j.scitotenv.2018.09.264 |
| [5] |
Clarke A, Mac Nally R, Bond N et al. Macroinvertebrate diversity in headwater streams: A review. Freshwater Biology, 2008, 53(9): 1707-1721. DOI:10.1111/j.1365-2427.2008.02041.x |
| [6] |
Jiang XM, Xu X, Tao M et al. The effects of dispersal ability on metacommunity structure of macroinvertebrates in subtropical Chinese high-mountain streams: Seasonal shifts in relative contribution of local environment and spatial processes. Environmental Science and Pollution Research, 2021, 28(29): 38573-38583. DOI:10.1007/s11356-021-13281-2 |
| [7] |
Csercsa A, Krasznai-K. EÁ, Várbíró G et al. Seasonal changes in relative contribution of environmental control and spatial structuring on different dispersal groups of stream macroinvertebrates. Hydrobiologia, 2018, 828(1): 101-115. DOI:10.1007/s10750-018-3806-6 |
| [8] |
Árva D, Tóth M, Mozsár A et al. The roles of environment, site position, and seasonality in taxonomic and functional organization of chironomid assemblages in a heterogeneous wetland, Kis-Balaton (Hungary). Hydrobiologia, 2016, 787(1): 1-21. DOI:10.1007/s10750-016-2980-7 |
| [9] |
Li ZF, Tonkin JD, Meng XL et al. Seasonal variation in the metacommunity structure of benthic macroinvertebrates in a large river-connected floodplain lake. Ecological Indicators, 2022, 136: 108662. DOI:10.1016/j.ecolind.2022.108662 |
| [10] |
Li ZF, Jiang XM, Wang J et al. Species diversity and driving factors of benthic macroinvertebrate assemblages in the middle and lower reaches of the Yarlung Zangbo River. Biodiversity Science, 2022, 30(6): 21431. [李正飞, 蒋小明, 王军等. 雅鲁藏布江中下游底栖动物物种多样性及其影响因素. 生物多样性, 2022, 30(6): 21431. DOI:10.17520/biods.2021431] |
| [11] |
Li SY, Liu WZ, Gu S et al. Eco-environmental crisis and countermeasures of the upper Han River basin (water source area of the middle route of the South-to-North Water Transfer Project), China. Resources and Environment in the Yangtze Basin, 2009, 18(3): 275-280. [李思悦, 刘文治, 顾胜等. 南水北调中线水源地汉江上游流域主要生态环境问题及对策. 长江流域资源与环境, 2009, 18(3): 275-280.] |
| [12] |
Wu D, Zou CX, Gao JX. Variation of ecology in the key ecological function zones in China. Journal of Ecology and Rural Environment, 2016, 32(5): 703-707. [吴丹, 邹长新, 高吉喜. 我国重点生态功能区生态状况变化. 生态与农村环境学报, 2016, 32(5): 703-707.] |
| [13] |
Song T, Li DQ, Zhang LB et al. Importance evaluation of ecosystem services and construction of ecological security pattern in Qinba Mountain Area. Strategic Study of CAE, 2020, 22(1): 64-72. [宋婷, 李岱青, 张林波等. 秦巴山脉区域生态系统服务重要性评价及生态安全格局构建. 中国工程科学, 2020, 22(1): 64-72. DOI:10.15302/J-SSCAE-2020.01.007] |
| [14] |
Li ZF, Liu ZY, Heino J et al. Discriminating the effects of local stressors from climatic factors and dispersal processes on multiple biodiversity dimensions of macroinvertebrate communities across subtropical drainage basins. Science of the Total Environment, 2020, 711: 134750. DOI:10.1016/j.scitotenv.2019.134750 |
| [15] |
Morse JC, Yang L, Tian L. Aquatic insects of China useful for monitoring water quality. Nanjing: Hohai University Press, 1994.
|
| [16] |
刘月英, 张文珍, 王耀先. 医学贝类学. 北京: 海洋出版社, 1993.
|
| [17] |
Epler JH. Identification Manual for the Larval Chironomidae (Diptera) of North and South Carolina. America: EPA Grant X984l70-97, 2001.
|
| [18] |
Zhou CF, Gui H, Zhou KY. Larval key to families of ephemeroptera from China (Insecta). Journal of Nanjing Normal University, 2003, 26(2): 65-68. [周长发, 归鸿, 周开亚. 中国蜉蝣目稚虫科检索表(昆虫纲). 南京师大学报(自然科学版), 2003, 26(2): 65-68.] |
| [19] |
Oscoz J, Galicia D, Miranda R. Identification guide of freshwater macroinvertebrates of Spain. Springer Science & Business Media, 2011.
|
| [20] |
Barbour M, Gerritsen J, Snyder B et al. Rapid bioassessment for use in streams and wadeable rivers: Periphyton, benthic macroinvertebrates and fish. Washington DC: Environment Protection Agency, 1999.
|
| [21] |
国家环境保护总局. 水和废水监测分析方法(第四版). 北京: 中国环境科学出版社, 2002.
|
| [22] |
Anderson MJ. Permutational multivariate analysis of variance (PERMANOVA). Wiley statsref: Statistics reference online, 2014: 1-15.
|
| [23] |
Legendre P, Legendre L. Numerical ecology. Elsevier, 2012.
|
| [24] |
Tonkin JD, Altermatt F, Finn DS et al. The role of dispersal in river network metacommunities: Patterns, processes, and pathways. Freshwater Biology, 2018, 63(1): 141-63. DOI:10.1111/fwb.13037 |
| [25] |
Declerck SA, Coronel JS, Legendre P et al. Scale dependency of processes structuring metacommunities of cladocerans in temporary pools of High-Andes wetlands. Ecography, 2011, 34(2): 296-305. DOI:10.1111/j.1600-0587.2010.06462.x |
| [26] |
Heino J, Soininen J, Alahuhta J et al. Metacommunity ecology meets biogeography: Effects of geographical region, spatial dynamics and environmental filtering on community structure in aquatic organisms. Oecologia, 2017, 183(1): 121-37. DOI:10.1007/s00442-016-3750-y |
| [27] |
Legendre P, Anderson MJ. Distance-based redundancy analysis: Testing multispecies responses in multifactorial ecological experiments. Ecological monographs, 1999, 69(1): 1-24. DOI:10.1890/0012-9615(1999)069[0001:DBRATM]2.0.CO;2 |
| [28] |
Jiang XM, Song ZY, Xiong J et al. Can excluding non-insect taxa from stream macroinvertebrate surveys enhance the sensitivity of taxonomic distinctness indices to human disturbance?. Ecological Indicators, 2014, 41: 175-182. DOI:10.1016/j.ecolind.2014.01.036 |
| [29] |
Chi SY, Chen S, Wang HJ et al. Zoobenthos communities in the middle and lower reaches of the Hanjiang River. Journal of Hydroecology, 2014, 35(5): 82-90. [池仕运, 陈胜, 汪红军等. 汉江中下游底栖动物群落结构特征研究. 水生态学杂志, 2014, 35(5): 82-90.] |
| [30] |
Zhang M, Shao ML, Cai QH et al. Macroinvertebrate community structure and the biological assessment to the water quality of the Danjiangkou Reservoir. J Lake Sci, 2010, 22(2): 281-290. [张敏, 邵美玲, 蔡庆华等. 丹江口水库大型底栖动物群落结构及其水质生物学评价. 湖泊科学, 2010, 22(2): 281-290. DOI:10.18307/2010.0219] |
| [31] |
Li ZF, Wang J, Liu ZY et al. Different responses of taxonomic and functional structures of stream macroinvertebrate communities to local stressors and regional factors in a subtropical biodiversity hotspot. Science of the Total Environment, 2019, 655: 1288-1300. DOI:10.1016/j.scitotenv.2018.11.222 |
| [32] |
Piggott JJ, Townsend CR, Matthaei CD. Climate warming and agricultural stressors interact to determine stream macroinvertebrate community dynamics. Global Change Biology, 2015, 21(5): 1887-906. DOI:10.1111/gcb.12661 |
| [33] |
Davis SJ, Mellander PE, Kelly AM et al. Multiple-stressor effects of sediment, phosphorus and nitrogen on stream macroinvertebrate communities. Science of the Total Environment, 2018, 637: 577-587. DOI:10.1016/j.scitotenv.2018.05.052 |
| [34] |
Cottenie K. Integrating environmental and spatial processes in ecological community dynamics. Ecology Letters, 2005, 8(11): 1175-1182. DOI:10.1111/j.1461-0248.2005.00820.x |
| [35] |
Göthe E, Baattrup-pedersen A, Wiberglarsen P et al. Environmental and spatial controls of taxonomic versus trait composition of stream biota. Freshwater Biology, 2017, 62(2): 397-413. DOI:10.1111/fwb.12875 |
| [36] |
Heino J, Melo AS, Bini LM et al. A comparative analysis reveals weak relationships between ecological factors and beta diversity of stream insect metacommunities at two spatial levels. Ecology and Evolution, 2015, 5(6): 1235-1248. DOI:10.1002/ece3.1439 |
| [37] |
Der Gucht KV, Cottenie K, Muylaert K et al. The power of species sorting: Local factors drive bacterial community composition over a wide range of spatial scales. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(51): 20404-20409. DOI:10.1073/pnas.0707200104 |
| [38] |
Jackson DA, Peresneto PR, Olden JD. What controls who is where in freshwater fish communities the roles of biotic, abiotic, and spatial factors. Canadian Journal of Fisheries and Aquatic Sciences, 2001, 58(1): 157-170. DOI:10.1139/f00-239 |
| [39] |
Firmiano KR, Cañedo-Argüelles M, Gutiérrez-Cánovas C et al. Land use and local environment affect macroinvertebrate metacommunity organization in Neotropical stream networks. Journal of Biogeography, 2021, 48(3): 479-491. DOI:10.1111/jbi.14020 |
| [40] |
Liu SR, Xie GX, Wang LZ et al. Different roles of environmental variables and spatial factors in structuring stream benthic diatom and macroinvertebrate in Yangtze River Delta, China. Ecological Indicators, 2016, 61: 602-611. DOI:10.1016/j.ecolind.2015.10.011 |
| [41] |
Cai YJ, Xu H, Vilmi A et al. Relative roles of spatial processes, natural factors and anthropogenic stressors in structuring a lake macroinvertebrate metacommunity. Science of the Total Environment, 2017, 601: 1702-1711. DOI:10.1016/j.scitotenv.2017.05.264 |
| [42] |
Petsch DK, Pinha GD, Takeda AM. Dispersal mode and flooding regime as drivers of benthic metacommunity structure in a Neotropical floodplain. Hydrobiologia, 2017, 788(1): 131-41. DOI:10.1007/s10750-016-2993-2 |
| [43] |
Brown B, Swan C. Dendritic network structure constrains metacommunity properties in riverine ecosystems. Journal of Animal Ecology, 2010, 79(3): 571-580. DOI:10.1111/j.1365-2656.2010.01668.x |
| [44] |
Li ZF, Heino J, Liu ZY et al. The drivers of multiple dimensions of stream macroinvertebrate beta diversity across a large montane landscape. Limnology and Oceanography, 2021, 66(1): 226-236. DOI:10.1002/lno.11599 |
| [45] |
Heino J. Does dispersal ability affect the relative importance of environmental control and spatial structuring of littoral macroinvertebrate communities?. Oecologia, 2013, 171(4): 971-980. DOI:10.1007/s00442-012-2451-4 |
| [46] |
Cai YJ, Zhang Y, Hu Z et al. Metacommunity ecology meets bioassessment: Assessing spatio-temporal variation in multiple facets of macroinvertebrate diversity in human-influenced large lakes. Ecological Indicators, 2019, 103: 713-721. DOI:10.1016/j.ecolind.2019.03.016 |
| [47] |
Boda P, Csabai Z. When do beetles and bugs fly? A unified scheme for describing seasonal flight behaviour of highly dispersing primary aquatic insects. Hydrobiologia, 2013, 703(1): 133-47. DOI:10.1007/s10750-012-1350-3 |
| [48] |
Csabai Z, Kalman Z, Szivak I et al. Diel flight behaviour and dispersal patterns of aquatic Coleoptera and Heteroptera species with special emphasis on the importance of seasons. Naturwissenschaften, 2012, 99(9): 751-65. DOI:10.1007/s00114-012-0957-6 |
| [49] |
Fitzgerald DB, Winemiller KO, Sabaj Pérez MH et al. Seasonal changes in the assembly mechanisms structuring tropical fish communities. Ecology, 2017, 98(1): 21-31. DOI:10.1002/ecy.1616 |
| [50] |
Schmera D, Arva D, Boda P et al. Does isolation influence the relative role of environmental and dispersal-related processes in stream networks? An empirical test of the network position hypothesis using multiple taxa. Freshwater Biology, 2018, 63(1): 74-85. DOI:10.1111/fwb.12973 |
 2023, Vol. 35
2023, Vol. 35 

