(2: 西北农林科技大学林学院, 杨凌 712100)
(3: 大通湖区农业技术推广中心, 益阳 413207)
(2: College of Forestry, Northwest Agriculture and Forestry University, Yangling 712100, P.R. China)
(3: Agricultural Technology Extension Center of Datonghu Section, Yiyang 413207, P.R. China)
鼠类动物种群繁殖特征包括性比、年龄组成等指标,是鼠类生活史参数的重要组成部分,是种群结构变动的重要驱动力,也是物种长期适应环境的结果[1]。不同物种繁殖特征不尽相同,同一物种也会因食物[2-4]、经纬度[5-6]、海拔[7-9]、气候等环境的变化以及人类活动的干扰程度而有所差异[10-12]。张知彬等[10]研究了我国鼠类繁殖参数的地理差异特征规律,发现东方田鼠的怀胎率随纬度增加而增加;Hille等[9]研究发现小尺度的海拔改变对欧䶄 (Myodes glareolus)的繁殖参数有影响。因此,研究动物繁殖特征对了解其对环境的适应具有重要意义。
黑线姬鼠(Apodemus agrarius)在我国分布于除新疆、西藏以外的其余各省(市、区),是分布区内农田生境中的优势鼠种,对当地农作物造成严重危害[13]。黑线姬鼠作为重要的农业害鼠和人兽共患病宿主,可传播的疾病多达17种,同时由于与水域关系密切,在血吸虫病流行区内又是血吸虫的主要宿主之一[14]。洞庭湖区的黑线姬鼠属长江亚种(Apodemus agrarius ningpoensis),是洞庭湖区农田生境中的主要优势鼠种之一[15-18]。在三峡工程启动前,在洞庭湖湖滩生境中很少有该物种的分布。三峡工程启动后,长江中下游的水流量发生急剧变化,使洞庭湖区湿地的洲滩分布、洲滩暴露时间(即未被水覆盖时间)、动植物生长环境等均发生相应变化[19]。调查显示洞庭湖区域黑线姬鼠种群数量在湖滩生境鼠群落中的比例呈明显上升趋势,且与该生境中唯一的优势种东方田鼠(Microtus fortis)形成了湖滩生境二者共存的局面,甚至在很多湖滩生境中黑线姬鼠已成为第一优势物种[16, 19]。洞庭湖区域湖滩生境与黑线姬鼠的传统农田生境差别巨大,特别是前者具有独特的水文形势。当前,虽然关于黑线姬鼠种群繁殖特征的报道较多[13-14, 20-22],但对其侵入或扩散至新生境后的种群繁殖情况及其变化的研究鲜有报道。
洞庭湖是长江中下游重要通江湖泊,也是鼠类的重要栖息地。洞庭湖显著的水位变化导致鼠类在堤外农田与堤内湖滩之间频繁迁徙[23]。为确定迁入洞庭湖湖滩的黑线姬鼠种群的繁殖特征,并从繁殖角度评估黑线姬鼠是否适应洲滩生境,研究基于2003—2020年间洞庭湖湖滩和农田生境中的捕获的黑线姬鼠解剖数据,分析侵入湖滩生境黑线姬鼠的种群繁殖状况,并与周围农田生境种群比较。通过比较湖滩生境和农田生境中的黑线姬鼠种群繁殖特征,试图了解三峡工程启动后洞庭湖水位的变化是否对湖滩上黑线姬鼠的繁殖行为产生适应性影响。黑线姬鼠如何适应湖滩生境,并维持种群存续是洞庭湖湖区鼠害生态治理需要关心的一个重要问题,研究结果可为洞庭湖湖滩黑线姬鼠的预测预报和生态防控提供科学依据。
1 材料与方法 1.1 调查地概况洞庭湖(27°39′~29°51′N,111°19′~113°34′E)位于湖南省北部,长江中游荆江的南岸,属于亚热带季风气候区,四季分明,年平均气温16~17℃,年平均降雨量1200~1550 mm。该区域雨量充沛,但季节分布不均,汛期长(5—10月),年内水位变幅大[24]。调查点分布于东洞庭湖、西洞庭湖、南洞庭湖,调查生境大体可分为湖滩和农田2种类型。依据植被结构的差异,可将洞庭湖湖滩分为5种植被结构类型:(1)苔草地,以岳阳县麻塘镇春风村为代表,其优势种苔草(Carex sp.)的覆盖度接近100%,且人为干扰较少;(2)南荻地,如大通湖区北洲子镇、团洲等,该生境种植有大面积的南荻(Miscanthus sp.)和芦苇(Phragmites australis)(盖度约为80%),有少量苔草(约为20%);(3)林地,该生境以人工种植的美洲黑杨(Populus deltoides)为优势物种,人为干扰较大,如沅江市南嘴镇目平湖;(4)苔草+南荻,该生境植被以苔草为主(盖度约为60%),南荻和芦苇(盖度约为40%)次之,如岳阳市采桑镇洞庭湖湿地生态系统观测研究站样地;(5)苔草+南荻+美洲黑杨,该生境以美洲黑杨、南荻、苔草相互镶嵌,植被结构较为复杂,如沅江市南大镇外湖滩。
1.2 调查方法及内容采用夹日法调查,诱饵使用生葵花籽,用大号铁板夹(江西贵溪李氏捕鼠器械有限公司生产)。湖滩调查沿直线布夹,农田调查沿田埂布夹,每个样区设3~4条样线,样线间相距150 m以上,每条样线放夹约80个,每5 m/夹,每个调查点总计约200~300夹日。当天17:00—19:00布放,翌日清晨收回。对所捕获的黑线姬鼠样本称量体重,解剖观察其繁殖情况,记录雄鼠的睾丸状况,雌鼠的怀孕情况,胎仔数及胚胎斑数等。分别计算参产率、怀孕率、平均胎仔数、雄鼠睾丸下降率、雌雄鼠性比、繁殖指数:参产鼠数=怀孕鼠(只)+ 有宫斑但未怀孕鼠(只),参产率(%)=参产鼠数(只)/雌鼠数(只)×100;怀孕率(%)=孕鼠数(只)/雌鼠数(只)×100;睾丸下降率(%)=睾丸下降鼠数(只)/雄鼠数(只)×100;性比=雌鼠数(只)/雄鼠数(只);繁殖指数=胎仔总数/总鼠数。以胴体重作为指标,将黑线姬鼠划分5个年龄组:幼年组(Ⅰ)、亚成年组(Ⅱ)、成年Ⅰ组(Ⅲ)、成年Ⅱ组(Ⅳ)、老年组(Ⅴ)[25]。调查自2003年4月起连续18年,至2020年10月,在每年的1月(冬季)、4月(春季)、7月(夏季)和10月(秋季)进行。由于洞庭湖夏季汛期涨水(5—10月),大多数湖滩被水淹没,无法调查,如果仍有少部分地势较高湖滩未被淹没,也进行了部分调查。
为了解黑线姬鼠进入湖滩生境后的种群适应情况,根据三峡水库的蓄水阶段,将洞庭湖区域黑线姬鼠繁殖情况分为5个阶段:(1)第一个蓄水阶段(2003—2006年),水库从135 m逐步蓄水到2006年底的156 m; (2)第二个蓄水阶段(2007—2008年),蓄水至172 m; (3)第三个蓄水阶段(2009—2010年),每年进行试验蓄水,最终水位达到175 m; (4)水位连续10年保持175 m,为了解其种群繁殖状况是否有变化过程,将此时期分成2011—2015年(Ⅳ1)和2016—2020年(Ⅳ2)两个阶段[19]。水位数据取自湖南水文公众服务“一张图”(http://yzt.hnswkcj.com:9090/#/)洞庭湖唯一出口城陵矶水文站的实测水位,时间序列覆盖2000—2020年。
1.3 数据分析生境间的繁殖参数比较用K-S检验以分析其正态性,当数据呈正态分布时,用t检验对均值进行比较;若为非正态分布,则采用非参数Mann-Whitney U检验。采用方差分析和LSD比较不同年龄组、不同季节、不同植被结构类型黑线姬鼠繁殖状况的差异性。采用χ2检验性比与理论值1 ∶1的差异性。文中平均数以平均值±标准差(Mean±SD)表示,P<0.05为差异显著,P<0.01为差异极显著。以上分析均在SPSS 19.0统计分析软件中完成,图表制作在GraphPad Prism 8中完成。
2 结果与分析2003—2020年在洞庭湖区的系统调查中共捕获3220只黑线姬鼠。其中,湖滩夹日数为55904,黑线姬鼠捕获2170只,捕获率3.88%;农田夹日数为63476,黑线姬鼠捕获1050只,捕获率1.65%。所捕获的黑线姬鼠中,有解剖记录的2832只,其中能辨别性别的2819只,雌雄分别为1333和1486只,雌雄比为0.90(F/M)。有繁殖参数记录的2786只(湖滩1914只,农田872只),本文以此样本进行分析。
2.1 湖滩和农田生境中黑线姬鼠繁殖特征在三峡工程开始蓄水(2003年)后的18年中,湖滩生境中黑线姬鼠种群总性比为0.89,雄鼠总数显著多于雌鼠(χ2=6.554,P<0.05)。侵入湖滩的黑线姬鼠已可进行正常的繁殖活动,湖滩生境中黑线姬鼠总的参产率(χ2=4.852,P=0.03)、怀孕率(χ2=8.974,P<0.01)和睾丸下降率(χ2=36.641,P<0.01)都显著低于农田生境,平均胎仔数则显著高于农田生境(P<0.01),湖滩上黑线姬鼠的繁殖指数为0.88,略低于农田生境的1.08(附表Ⅰ)。
湖滩生境中黑线姬鼠的参产率和怀孕率在2003—2015年的前4个蓄水阶段均低于农田生境,其中参产率在2009—2010年(χ2=20.424,P<0.01)差异显著,而怀孕率在2003—2006年(χ2=6.241,P=0.01)、2009—2010年(χ2=12.046,P<0.01)与2011—2015年(χ2=5.499,P=0.02)具有显著性差异。2016—2020年湖滩上黑线姬鼠的参产率和怀孕率高于农田生境,但差异不显著。2003—2020年的5个蓄水阶段湖滩生境中黑线姬鼠的睾丸下降率均小于农田生境,其中2009—2010年(χ2=4.178,P=0.04)、2011—2015年(χ2=15.280,P<0.01)和2016—2020年(χ2=17.230,P<0.01)具有显著性差异;湖滩生境中黑线姬鼠的平均胎仔数在2003—2006年低于农田,2006—2020年则高于农田生境,但均无显著性差异。湖滩生境中黑线姬鼠的雌雄比只有2009—2010年高于农田,其他4个蓄水阶段皆低于农田生境,差异不显著。湖滩生境中黑线姬鼠的繁殖指数在2003—2015年的4个蓄水阶段均低于农田生境,到2016—2020年湖滩0.99略高于农田0.96。上述结果表明,传统生境在农田中的黑线姬鼠进入湖滩生境后能正常进行繁殖,湖滩上雌鼠的繁殖能力从开始的低于农田到2016—2020年高于农田,而雄鼠在湖滩上的繁殖能力低于农田。
2.2 湖滩和农田生境中黑线姬鼠胎仔数2003—2020年湖滩、农田生境黑线姬鼠胎仔数均呈正态分布,其中湖滩生境胎仔数变幅为2~12只,农田生境变幅为2~9只。统计显示黑线姬鼠在两生境之间的平均胎仔数虽无显著差异(P>0.05),但湖滩生境的孕鼠在繁殖中偏向具有更多的胎仔数。湖滩生境小于6只胎仔数的占比(34.41%)低于农田(50.90%),但6只以上胎仔数的孕鼠占比(65.59%)高于农田生境(49.10%)(图 1)。
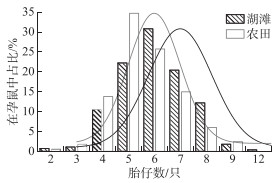
|
图 1 不同生境黑线姬鼠胎仔数频次 Fig.1 Frequency diagram of fetal number of Apodemus agrarius in different habitats |
湖滩生境中,不同年龄组黑线姬鼠均可参与繁殖,且其繁殖能力均存在显著差异,其繁殖指数、参产率、怀孕率及雄鼠的睾丸下降率均随年龄的增长而增加(图 2)。18年间在湖滩生境黑线姬鼠种群的性比随年龄增加而下降,依次为亚成年组(1.43±0.67)>成年Ⅰ组(1.38±0.64)>幼年组(1.25±0.61)>成年Ⅱ组(0.84±0.15)>老年组(0.67±0.20),但无显著差异。亚成年组的平均胎仔数最低,为5.33±0.90只,显著低于老年组的6.35±1.47只。
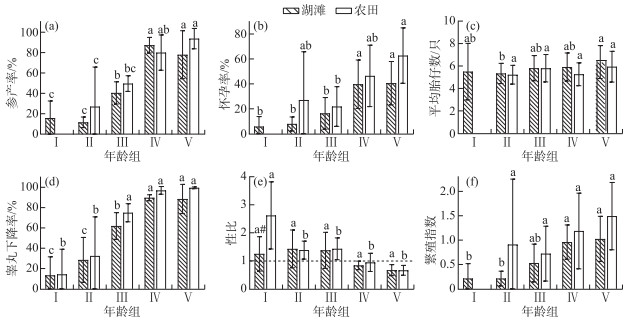
|
图 2 湖滩和农田生境中黑线姬鼠不同年龄组的繁殖参数比较 不同字母表示同一生境不同年龄组间有显著差异,“#”表示同一年龄组湖滩和农田生境有显著差异;图e虚线表示雌雄鼠比例为1 ∶1,虚线上雌鼠较雄鼠多,虚线下雄鼠较雌鼠多,下同 Fig.2 Comparison of reproductive parameters of Apodemus agrarius indifferent age groups in lake beach and farmland habitat |
湖滩生境中,黑线姬鼠幼年组和亚成年组的繁殖力较弱,但各繁殖参数间均无显著性差异;其幼年组的参产率(15.73%±16.80%(PⅠ-Ⅳ<0.01,PⅠ-Ⅴ<0.01)、怀孕率(5.73%±8.02%(PⅠ-Ⅳ<0.01,PⅠ-Ⅴ<0.01)、睾丸下降率(13.33%±18.26%(PⅠ-Ⅳ<0.01,PⅠ-Ⅴ<0.01)和繁殖指数0.21±0.31(PⅠ-Ⅳ<0.01,PⅠ-Ⅴ<0.01)都显著低于成年Ⅱ组和老年组。老年组(1.02±0.46)的繁殖指数最大,成年Ⅱ组(0.96±0.35)稍次,且两组各繁殖参数间不存在显著性差异(P>0.05)。综上,湖滩生境中黑线姬鼠的成年Ⅱ组和老年组是参与种群繁殖的主要群体。
比较分析表明,黑线姬鼠在湖滩和农田生境中的繁殖情况随年龄增长而变化的趋势基本相同,洞庭湖区农田生境中不同年龄组黑线姬鼠的参产率、怀孕率及雄鼠的睾丸下降率也都随年龄递增,成年Ⅱ组和老年组也是其主要繁殖群体,繁殖指数分别为1.19±0.78和1.49±0.69;不同的是,湖滩上发现有少数幼年组的黑线姬鼠雌鼠参与繁殖,而农田生境中幼年组雌鼠不参与繁殖。除幼年组,两生境其它年龄组繁殖参数均无显著性差异,说明湖滩生境种群未成年前繁殖能力与农田生境有差别,但成年后,基本维持与农田生境相似的水平。
在湖滩和农田生境中,不同年龄组参与繁殖的黑线姬鼠占比均随年龄递增,老年组前各年龄组参与繁殖的黑线姬鼠占比湖滩均高于农田,老年组反之。成年Ⅱ组和老年组为主要繁殖群体,其孕鼠在湖滩上占总孕鼠的75.28%,农田占78.92%;幼年组到成年Ⅱ组孕鼠占比湖滩均略大于农田,而老年组孕鼠占比农田(52.52%)显著大于湖滩(36.02%)(P=0.01)(图 3a)。睾丸下降的雄鼠在湖滩生境中成年Ⅱ组占35.84%,显著高于农田老年组占比26.69%(P=0.03);老年组睾丸下降雄鼠占比农田(59.42%)显著高于湖滩(39.64%)(P<0.01)(图 3b)。综上,湖滩生境中参与繁殖的老年组黑线姬鼠占比较农田低。
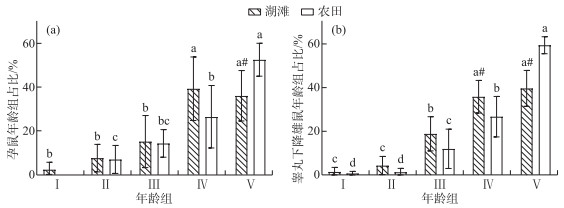
|
图 3 黑线姬鼠不同年龄组参与繁殖的占比 不同字母表示同一生境不同年龄组间有显著差异,“#”表示同一年龄组湖滩和农田生境有显著差异 Fig.3 Proportion of Apodemus agrarius participating in reproduction in different age groups |
按春季(3—5月)、夏季(6—8月)、秋季(9—11月)、冬季(12—2月)四季统计,洞庭湖湖滩生境中黑线姬鼠可全年繁殖,呈现明显的双峰型季节波动,春季和秋季是湖滩黑线姬鼠的繁殖高峰,其繁殖指数分别为1.37±0.16和1.62±0.26(图 4)。春季和秋季各繁殖参数间无显著性差异(P>0.05),其参产率(P春夏<0.01,P春冬<0.01)、怀孕率(P春夏<0.01,P春冬<0.01)以及繁殖指数(P春夏<0.01,P春冬<0.01)都极显著的高于夏季和冬季;夏季和冬季的怀孕率(P=0.98)、繁殖指数(P=0.10)差异不显著,而冬季参产率(24.44%±14.93%)(P冬夏=0.02)和睾丸下降率(22.37%±6.51%)(P春冬<0.01,P夏冬<0.01,P秋冬<0.01)显著低于其它3个季节;与雌鼠不同,夏季雄鼠的睾丸下降率仍能保持与春(85.89%± 10.15%)、秋季(82.53%±16.39%)相当的较高水平,为(83.22%± 11.01%);且夏季(1.39±0.39)性比显著高于其它3个季节(P春夏<0.01,P夏秋<0.01,P夏冬<0.01),但其平均胎仔数(4.88±0.96)显著低于春季和秋季(P春夏<0.01,P夏秋<0.01)。

|
图 4 湖滩和农田生境中黑线姬鼠不同季节的繁殖参数比较 不同字母表示同一生境不同季节间有显著差异,“#”表示同一季节湖滩和农田生境有显著差异 Fig.4 Comparison of reproductive parameters of Apodemus agrarius in different seasons in lake beach and farmland habitat |
不同季节黑线姬鼠在湖滩和农田生境中的繁殖情况基本相同,春季和秋季同样也是农田生境中黑线姬鼠的繁殖高峰,其繁殖指数分别为1.82±0.63和1.92±0.17,各繁殖参数与同季节湖滩无显著差异。两生境间的差异主要在夏季和冬季;夏季湖滩上黑线姬鼠的怀孕率(5.79%±2.36%)(P=0.02)和繁殖指数(0.16±0.06)(P=0.04)都显著低于农田生境;冬季,黑线姬鼠的睾丸下降率湖滩显著低于农田(P<0.01)。
2.5 不同植被结构对湖滩生境黑线姬鼠繁殖特征的影响对湖滩上5种主要的植被结构类型中的黑线姬鼠繁殖情况进行比较分析,结果如图 5所示。苔草地、苔草+南荻和苔草+南荻+杨树3种植被类型黑线姬鼠的繁殖情况基本一致,各繁殖参数均无显著性差异。黑线姬鼠在林地类型的湖滩上除睾丸下降率(55.62%)显著低于苔草地(93.89%)(P=0.04),繁殖参数与其它植被类型湖滩无显著性差异。南荻地的怀孕率(20.62%)(P<0.01)和繁殖指数(0.59)(P=0.01)显著低于苔草+南荻(怀孕率和繁殖指数分别为54.54%和1.62)。黑线姬鼠在苔草+南荻的的各繁殖参数均居5种植被结构类型湖滩的前两位,而南荻地和林地的繁殖指数、参产率和怀孕率均位于后两位。

|
图 5 湖滩生境不同植被结构对黑线姬鼠繁殖参数的影响(不同字母表示有显著差异) Fig.5 Effects of different vegetation structures in lake beach habitat on reproductive parameters of Apodemus agrarius |
与农田生境中黑线姬鼠的繁殖情况相比较,各生境类型的繁殖指数、性比、参产率和平均胎仔数之间均无显著性差异。除农田中雄鼠的睾丸下降率(89.60%±6.36%)显著高于湖滩林地(P<0.01)和苔草+南荻+杨树(69.70%±19.00%)(P=0.04),雌鼠的怀孕率(44.21%±16.49%)显著高于南荻地(P=0.01),其在苔草地和苔草+南荻与传统农田生境中的繁殖情况基本相同,各繁殖参数均无显著性差异。
3 讨论本文基于2003—2020年连续18年洞庭湖区鼠情的调查数据,从不同年龄组、不同季节两个维度对黑线姬鼠在湖滩和农田两种生境下的繁殖状况进行比较分析,结果显示黑线姬鼠已能在洞庭湖湖滩生境中进行正常的繁殖活动,且侵入湖滩的黑线姬鼠在繁殖方面与其在农田生境中的同类出现了一些差异分化,但总体趋势相似。进一步分析湖滩上5种不同植被结构类型中黑线姬鼠的繁殖情况发现,其繁殖受植被结构影响较小。
3.1 黑线姬鼠已适应湖滩生境并具相当繁殖能力比较黑线姬鼠不同年龄组的繁殖特征发现,湖滩生境中全年龄组的黑线姬鼠均参与繁殖,且不同年龄组种群繁殖均存在显著差异,其繁殖指数、参产率、怀孕率及雄鼠的睾丸下降率均随年龄递增,这与众多小型哺乳动物或短寿动物繁殖与年龄的关系研究结果一致[26-27];其性比有从年轻雌性占优到年老雄性占优的转移变化,可能是老年雌性较雄性死亡率高,其繁殖力随年龄增长而不断增加,这与Jones等[27]关于年龄较大的小型哺乳动物繁殖力强的研究结果基本一致,较大的繁殖投入可能挤占了其生存活动的投入,进而增加个体死亡的风险[26]。而湖滩的生存风险(特别是洪水)较大,这可能是湖滩黑线姬鼠性比随年龄下降的主要原因。
比较黑线姬鼠不同季节的繁殖特征发现,湖滩生境中黑线姬鼠可全年进行繁殖,且呈现明显的双峰型季节波动,春季和秋季为主要繁殖季节,而冬季黑线姬鼠的繁殖能力较弱,其参产率和睾丸下降率都显著低于其它3个季节,表明湖滩上黑线姬鼠依然主要在长日照季节进行繁殖,与大多动物选择的繁殖时机一致[1, 28]。在短日照的冬季,食物十分匮乏,存在激烈的食物竞争和有限资源的分配,且较低的温度不利于幼崽存活。之前的研究结果,湖滩的原生优势物种东方田鼠在冬季依然可以保持较高的繁殖[29],这可能是对洞庭湖独特的水文形势的适应。
3.2 黑线姬鼠在湖滩生境的繁殖特征变化及其适应性研究在湖滩上发现有少数幼年组的黑线姬鼠雌鼠参与繁殖,而在农田中并未发现参与繁殖的幼年组雌鼠,这与之前研究报道的黑线姬鼠幼年组不参与繁殖[6, 30-31]的研究结果不一致。杨再学等[32]报道黑线姬鼠孕鼠的最低体重为17.61 g,这与在农田的调查结果一致,但在湖滩上发现有体重为16.0 g的黑线姬鼠孕鼠,这可能是黑线姬鼠为适应湖滩生境而形成的繁殖对策。从以下两点分析这一差异的原因:(1)有研究认为动物繁殖可能受到种群密度的制约[33-35],在洞庭湖的枯水期,大面积的湖滩露出使随之迁入的黑线姬鼠种群密度可能较农田低,从而使其获得更多的食物资源和生存空间,为幼年组雌鼠参与繁殖提供可能。Kruczek等[36]发现在高密度种群中饲养的欧洲棕背䶄 (Clethrionomys glareolus)雌鼠比在孤立环境中饲养的雌鼠性成熟延迟;(2)湖滩环境资源相对更加贫瘠且需要应对洪水的威胁,资源的贫瘠或外部高死亡率的影响可使得动物的繁殖年龄提前[37],为增加种群的扩增和维持能力,雌鼠更早地参与繁殖,这对其适应湖滩生境可能有利。
夏季湖滩上黑线姬鼠的怀孕率和繁殖指数都极显著低于农田生境,而夏季正是洞庭湖的丰水期,这可能是限制其繁殖的主要原因。夏季湖滩生境中黑线姬鼠的性比显著高于其它季节,且略高于同季节农田生境的性比,造成该现象的原因可能是湖滩上雌鼠在面临涨水风险时的存活率可能高于雄鼠,该情况在洞庭湖东方田鼠上有所发现,因雌性总体上游泳迁徙能力强于雄性,因此在洪水中东方田鼠种群可更多地保留雌性,这可能是一种应对洞庭湖水文环境的独特适应[38]。
胎仔数是影响种群数量消长的重要指标,有研究显示随着种群数量升高,平均胎仔数相对下降,反之平均胎仔数相对升高[39-40]。湖滩生境较农田生境中的雌鼠在繁殖中更偏向产生多的胎仔数,湖滩生境中有6只以上胎仔数的孕鼠占比高于农田生境,可能是湖滩黑线姬鼠种群密度较低而影响胎仔数,也可能是雌鼠繁育更多胎仔数,提高繁殖成功率以对抗更恶劣的环境(湖滩),又或者是与湖滩生境能给孕鼠提供更多保证,孕鼠不用付出更多的繁殖代价,而能哺育更多后代[41], 具体原因待进一步研究。
洞庭湖区湖滩生境的独特水文环境条件可能是侵入黑线姬鼠在繁殖方面与传统农田生境出现差异分化的原因:湖滩生境中黑线姬鼠有幼年组雌鼠参与繁殖,较农田生境中的雌鼠在繁殖中更偏向产生多的胎仔数,以及冬季湖滩上黑线姬鼠的平均胎仔数仍能保持较高水平,与其他季节间无显著差异,且显著高于冬季农田。这些繁殖差异分化可能使湖滩上的黑线姬鼠更接近于r-对策,以提早生育、产仔数多的方式大量投资于繁殖,来应对更严峻的湖滩生境和每年洪水的威胁。
4 结论研究发现黑线姬鼠已能在洞庭湖湖滩生境中进行正常的繁殖活动,且侵入湖滩的黑线姬鼠在繁殖方面与其在农田生境中的同类出现了分化,其种群已逐渐适应洞庭湖区的湖滩生境,其繁殖动态也与农田生境基本相似。
1) 湖滩生境中黑线姬鼠总的参产率(χ2=4.852,P=0.03)、怀孕率(χ2=8.974,P<0.01)和睾丸下降率(χ2=36.641,P<0.01)都显著低于农田生境,平均胎仔数则显著高于农田生境(P<0.01);但在2016—2020年湖滩上黑线姬鼠除睾丸下降率仍显著低于农田(χ2=17.230,P<0.01),参产率、怀孕率和平均胎仔数均已高于农田生境(P>0.05),繁殖指数0.99也略高于农田的0.96。
2) 湖滩生境中全年龄组的黑线姬鼠均参与繁殖,但不同年龄组种群繁殖存在显著差异,其繁殖指数、参产率、怀孕率及雄鼠的睾丸下降率均随年龄递增,该趋势与其在农田生境一致,但湖滩上有少数幼年组的黑线姬鼠雌鼠参与繁殖,而农田生境中幼年组雌鼠不参与繁殖。
3) 湖滩生境中黑线姬鼠可进行全年繁殖,不同季节种群繁殖存在显著差异,春季和秋季为湖滩主要繁殖季节;湖滩和农田间的差异主要在夏季和冬季,夏季湖滩上黑线姬鼠的怀孕率(P=0.02)和繁殖指数(P=0.04)都极显著低于农田生境,冬季湖滩上黑线姬鼠的睾丸下降率极显著低于农田(P<0.01)。
4) 湖滩生境不同植被结构对黑线姬鼠的繁殖有影响,黑线姬鼠在苔草+南荻的湖滩生境中繁殖能力较强,与其在农田中的繁殖情况基本相同;在南荻地和林地的繁殖力较弱。
5 展望通过对三峡工程蓄水后(2003年)连续18年洞庭湖区黑线姬鼠繁殖情况的研究,得出原栖息在洞庭湖区农田生境中的黑线姬鼠已基本适应湖滩生境。湖滩生境中的黑线姬鼠的一些具体繁殖特征与其传统生境中的同类已产生差异分化,但暂不清楚这些差异是其形成的新适应还是应对湖滩独特环境条件的差异化繁殖策略。洞庭湖水文形势对湖滩生境中黑线姬鼠繁殖特征的影响可能是形成这种差异的重要因素,其作用机制有待进一步研究。
6 附录附表Ⅰ见电子版(DOI: 10.18307/2023.0638)。
| 附表Ⅰ 2003—2020年期间在湖滩和农田生境中黑线姬鼠的繁殖特征 Appendix Ⅰ Reproductive characteristics of Apodemus agrarius in lake beach and farmland during 2003-2020 |
致谢: 王广力、邢廷杰、郭宗明、韩立亮、邢廷杰、邓武军、雍仲禹、杨玉超、范尊龙、陈剑、彭真、李亚衡、张宣、姜路帆、郑普阳、吴康娟等先后参加部分调查工作,深表谢忱!
| [1] |
孙儒泳. 动物生态学原理: 第三版. 北京: 北京师范大学出版社, 2001.
|
| [2] |
White TCR. Outbreaks of house mice in Australia: Limitation by a key resource. Australian Journal of Agricultural Research, 2002, 53(5): 505-509. DOI:10.1071/ar01132 |
| [3] |
Mulungu LS, Ngowo V, Mdangi M et al. Population dynamics and breeding patterns of multimammate mouse, Mastomys natalensis (Smith 1834), in irrigated rice fields in eastern Tanzania. Pest Management Science, 2013, 69(3): 371-377. DOI:10.1002/ps.3346 |
| [4] |
Vadell MV, Villafañe IEG, Cavia R. Are life-history strategies of Norway rats (Rattus norvegicus) and house mice (Mus musculus) dependent on environmental characteristics?. Wildlife Research, 2014, 41(2): 172. DOI:10.1071/wr14005 |
| [5] |
Li ZJ, Cai HX, Ye H et al. A study on relationship between litter sizes of rodents and latitude. Journal of Sichuan University (Natural Science Edition), 2004(4): 845-851. [李正洁, 蔡红霞, 叶华等. 啮齿动物胎仔数和纬度关系的研究. 四川大学学报(自然科学版), 2004(4): 845-851. DOI:10.3969/j.issn.0490-6756.2004.04.037] |
| [6] |
Yang ZX, Zheng YL, Jin X. Species reproductive parameters and the comparison of geography variation in Apodemus agrarius. Acta Ecologica Sinica, 2007, 27(6): 2425-2434. [杨再学, 郑元利, 金星. 黑线姬鼠(Apodemus agrarius)的种群繁殖参数及其地理分异特征. 生态学报, 2007, 27(6): 2425-2434. DOI:10.3321/j.issn:1000-0933.2007.06.035] |
| [7] |
Bronson MT. Altitudinal variation in the life history of the golden-mantled ground squirrel (Spermophilus lateralis). Ecology, 1979, 60(2): 272-279. DOI:10.2307/1937655 |
| [8] |
Millar JS, Innes DGL. Breeding by Peromyscus maniculatus over an elevational gradient. Canadian Journal of Zoology, 1985, 63(1): 124-129. DOI:10.1139/z85-021 |
| [9] |
Hille SM, Rödel HG. Small-scale altitudinal effects on reproduction in bank voles. Mammalian Biology, 2014, 79(2): 90-95. DOI:10.1016/j.mambio.2013.09.001 |
| [10] |
Zhang ZB, Zhu J, Yang HF. Regional variations of reproductive parameters of some rodents in China. Current Zoology, 1991, 37(1): 36-46. [张知彬, 朱靖, 杨荷芳. 中国啮齿类繁殖参数的地理变异. 动物学报, 1991, 37(1): 36-46.] |
| [11] |
Bao WD, Wang DH, Wang ZW et al. The comparison of reproductive traits of the striped hamster from Kubuqi Sandy-land and Hohhot Plain of Inner Mongolia. Chinese Journal of Zoology, 2001(1): 15-18. [鲍伟东, 王德华, 王祖望等. 内蒙古库布齐沙地和呼和浩特平原黑线仓鼠种群繁殖特征的比较. 动物学杂志, 2001(1): 15-18. DOI:10.3969/j.issn.0250-3263.2001.01.004] |
| [12] |
Yang SW, Yuan S, Fu HP et al. The population density and breeding characteristic of mid-day jerbil (Meriones meridianus) in the desert habitats with different disturbance. Chinese Journal of Zoology, 2017, 52(5): 745-753. [杨素文, 袁帅, 付和平等. 不同干扰荒漠生境中子午沙鼠的繁殖及种群动态特征. 动物学杂志, 2017, 52(5): 745-753. DOI:10.13859/j.cjz.201705003] |
| [13] |
Yang ZX, Guo YW, Wang D et al. Reproduction characteristics of the striped field mouse (Apodemus agrarius) population in Guizhou Province. Chinese Journal of Comparative Medicine, 2016, 51(6): 939-948. [杨再学, 郭永旺, 王登等. 贵州地区黑线姬鼠种群繁殖特征. 动物学杂志, 2016, 51(6): 939-948. DOI:10.13859/j.cjz.201606002] |
| [14] |
Wang Y, Chen AG, Li B et al. Study on reproductive characteristics of Apodemus agrarius in Dongting plain. Acta Theriologica Sinica, 1994, 14(2): 138-145. [王勇, 陈安国, 李波等. 洞庭平原黑线姬鼠繁殖特性研究. 兽类学报, 1994, 14(2): 138-145. DOI:10.16829/j.slxb.1994.02.007] |
| [15] |
Wang Y, Zhang MW, Li B et al. Rodent community structure and succession in different ecotypic areas in Dongting Lake region. Rural Eco-Environment, 2003, 19(1): 13-17. [王勇, 张美文, 李波等. 洞庭湖地区不同生态类型区鼠类群落组成及其演替趋势. 农村生态环境, 2003, 19(1): 13-17.] |
| [16] |
Li B, Wang Y, Zhang MW et al. Basic characteristics of rodent communities in lakefront rice area of Dongting Lake. Chinese Journal of Eco-Agriculture, 2005, 13(1): 152-155. [李波, 王勇, 张美文等. 洞庭湖滨湖稻区鼠类群落基本特征研究. 中国生态农业学报, 2005, 13(1): 152-155.] |
| [17] |
Zhang MW, Wang Y, Li B et al. Reproduction characteristics of striped field mouse (Apodemus agrarius) and Yangtze voles (Microtus fortis) in the polder of return farmland back into lake in Dongting Lake region. Acta Theriologica Sinica, 2009, 29(4): 396-405. [张美文, 王勇, 李波等. 洞庭湖不同退田还湖类型区东方田鼠和黑线姬鼠的繁殖特性. 兽类学报, 2009, 29(4): 396-405. DOI:10.16829/j.slxb.2009.04.009] |
| [18] |
Zheng PY, Zhou XJ, Zhang MW et al. The situation of small mammal community in beach of Dongting Lake after the official operation of the Three Gorges Reservoir. Chinese Journal of Zoology, 2020, 55(2): 141-152. [郑普阳, 周训军, 张美文等. 三峡水库运行后洞庭湖洲滩小型兽类群落状况. 动物学杂志, 2020, 55(2): 141-152. DOI:10.13859/j.cjz.202002003] |
| [19] |
Zhang MW, Wang Y, Li B et al. Small mammal community succession on the beach of Dongting Lake, China after the Three Gorges Project. Integrative Zoology, 2014, 9(3): 294-308. DOI:10.1111/1749-4877.12073 |
| [20] |
Zhao F, Long GX, Yang ZX et al. Population dynamics and propagation characteristics of Apodemus agrarius in the field of northwest Guizhou Province. Subtropical Agriculture Research, 2015, 11(1): 46-50. [赵芳, 龙贵兴, 杨再学等. 黔西北地区农田黑线姬鼠种群数量动态及繁殖特征变化. 亚热带农业研究, 2015, 11(1): 46-50. DOI:10.13321/j.cnki.subtrop.agric.res.2015.01.010] |
| [21] |
Yuan ZQ, Dong J, Qiao Y et al. The comparation of propagation ability between two mouse populations in farm fields of Shunyi district in Beijing. Current Biotechnology, 2016, 6(2): 146-150. [袁志强, 董杰, 乔岩等. 北京顺义区农田两大害鼠种群繁殖力比较. 生物技术进展, 2016, 6(2): 146-150. DOI:10.3969/j.issn.2095-2341.2016.02.12] |
| [22] |
Long XG, You X, Peng ZY. Age and seasonal variation of breeding parameters of Apodemus agrarius in Dafang County. Anhui Agricultural Science Bulletin, 2021, 27(13): 37-39. [龙贵兴, 游雪, 彭忠勇. 大方县黑线姬鼠种群繁殖参数的年龄和季节变化. 安徽农学通报, 2021, 27(13): 37-39. DOI:10.3969/j.issn.1007-7731.2021.13.013] |
| [23] |
Xu ZG, Zhao YL, Li B et al. Habitat evaluation for outbreak of Yangtze voles (Microtus fortis) and management implications. Integrative Zoology, 2015, 10(3): 267-281. DOI:10.1111/1749-4877.12119 |
| [24] |
谢永宏, 张琛, 蒋勇. 洞庭湖湿地生态环境演变. 长沙: 湖南科学技术出版社, 2014.
|
| [25] |
Yang ZX, Zheng YL. Age estimation of population of Apodemus agrarius with body weight without viscera. Journal of Mountain Agriculture and Biology, 2003, 22(5): 393-398. [杨再学, 郑元利. 应用胴体重法鉴定黑线姬鼠种群年龄. 山地农业生物学报, 2003, 22(5): 393-398. DOI:10.3969/j.issn.1008-0457.2003.05.005] |
| [26] |
Millar JS. Senescense in a population of small mammals?. Écoscience, 1994, 1(4): 317-321. DOI:10.1080/11956860.1994.11682257 |
| [27] |
Jones OR, Scheuerlein A, Salguero-Gómez R et al. Diversity of ageing across the tree of life. Nature, 2014, 505(7482): 169-173. DOI:10.1038/nature12789 |
| [28] |
Simonneaux V, Ansel L, Revel FG et al. Kisspeptin and the seasonal control of reproduction in hamsters. Peptides, 2009, 30(1): 146-153. DOI:10.1016/j.peptides.2008.06.006 |
| [29] |
Wu ZJ, Chen AG, Li B et al. Study on reproductive characteristics of Microtus fortis in Dongting Lake region. Acta Theriologica Sinica, 1996(2): 142-150. [武正军, 陈安国, 李波等. 洞庭湖区东方田鼠繁殖特性研究. 兽类学报, 1996(2): 142-150. DOI:10.16829/j.slxb.1996.02.011] |
| [30] |
Bai ZJ, Yang ZX, Qin ZY et al. Age change of population reproduction parameter of Apodemus Agrarius in Yuqing County. China Plant Protection, 2016, 36(7): 43-46. [白智江, 杨再学, 秦治勇等. 余庆县黑线姬鼠种群繁殖参数的年龄变化. 中国植保导刊, 2016, 36(7): 43-46. DOI:10.3969/j.issn.1672-6820.2016.07.009] |
| [31] |
Cai MY. Variation law of reproductive characteristics of Apodemus agrarius in cropland in Wenling City. Journal of Zhejiang Agricultural Sciences, 2021, 62(3): 572-574. [蔡美艳. 温岭市农田黑线姬鼠繁殖特征变化规律. 浙江农业科学, 2021, 62(3): 572-574. DOI:10.16178/j.issn.0528-9017.20210337] |
| [32] |
Yang ZX, Zheng YL, Guo YW et al. Population reproductive capacity in different body weight of Apodemus agrarius. Chinese Agricultural Science Bulletin, 2008, 24(9): 348-352. [杨再学, 郑元利, 郭永旺等. 黑线姬鼠不同体重种群繁殖力变化. 中国农学通报, 2008, 24(9): 348-352.] |
| [33] |
Rödel HG, Bora A, Kaiser J et al. Density-dependent reproduction in the European rabbit: A consequence of individual response and age-dependent reproductive performance. Oikos, 2004, 104(3): 529-539. DOI:10.1111/j.0030-1299.2004.12691.x |
| [34] |
Yang HF, Wang SQ. Effect of population density, sex ratio on population unmbers of rodentsⅠ. Effect of population density, sex ratio on reproduction in female mice. Acta Theriologica Sinica, 1984(4): 301-309. [杨荷芳, 王淑卿. 鼠类种群密度, 性比对其数量的调节作用Ⅰ.不同密度, 性比对雌小白鼠繁殖的影响. 兽类学报, 1984(4): 301-309. DOI:10.16829/j.slxb.1984.04.011] |
| [35] |
Er J, Zhang FS, Yu YD et al. Population dynamics and reproduction characteristic of Mid-day gerbil under farmland disturbance in desert region. Journal of Inner Mongolia Agricultural University: Natural Science Edition, 2009, 30(2): 140-144. [鄂晋, 张福顺, 余奕东等. 荒漠区开垦干扰下子午沙鼠种群数量动态与繁殖特征. 内蒙古农业大学学报: 自然科学版, 2009, 30(2): 140-144.] |
| [36] |
Kruczek M, Marchlewska-Koj A. Puberty delay of bank vole females in a high-density population. Biology of Reproduction, 1986, 35(3): 537-541. DOI:10.1095/biolreprod35.3.537 |
| [37] |
Reznick DN, Bryant MJ, Roff D et al. Effect of extrinsic mortality on the evolution of senescence in guppies. Nature, 2004, 431(7012): 1095-1099. DOI:10.1038/nature02936 |
| [38] |
Zhang C, Wang Y, Zhang MW. Swimming behavior and ability of Microtus fortis. Chinese Journal of Zoology, 2019, 54(3): 311-320. [张琛, 王勇, 张美文. 东方田鼠的游泳行为和能力. 动物学杂志, 2019, 54(3): 311-320. DOI:10.13859/j.cjz.201903001] |
| [39] |
Tai F, Zhao Y, Wang T. Reproduction and density-dependent regulation in population of mandarin vole (microtus mandarinus). Acta Theriologica Sinica, 2006, 18(3): 208-214. DOI:10.16829/j.slxb.1998.03.008 |
| [40] |
Goswami VR, Getz LL, Hostetler JA et al. Synergistic influences of phase, density, and climatic variation on the dynamics of fluctuating populations. Ecology, 2011, 92(8): 1680-1690. DOI:10.1890/10-2317.1 |
| [41] |
Ma JB, Du YR. Studies on the strategies of mateeernal production in mammals. Journal of Qinghai Normal University: Natural Science, 2001, 17(3): 70-73, 93. [马建滨, 都玉蓉. 哺乳动物母体繁殖对策的研究. 青海师范大学学报: 自然科学版, 2001, 17(3): 70-73, 93. DOI:10.3969/j.issn.1001-7542.2001.03.021] |
 2023, Vol. 35
2023, Vol. 35 

