高山湖泊通常远离人类的直接干扰,具有面积小、水温低、寡营养等特点且对气候环境变化十分敏感,在全球变化研究中扮演着重要角色[1]。气候变暖导致高寒地区冰雪覆盖减少、水温升高、生长期延长和湖泊热力循环模式改变。这些关键湖泊物理过程的变化可以导致湖泊藻类生物量和物种多样性的变化[2],从而影响湖泊生态系统的结构和功能[3]。如在高纬地区湖泊的研究显示,随着20世纪初气候逐渐变暖,生长季延长和底栖生境增加使得硅藻群落组合出现小型物种或底栖属种逐渐增加的显著变化[4]。气候变暖对湖泊水体的影响还受到湖泊形态特征的调节,对深水湖泊而言,气候变暖主要直接影响湖泊热力分层结构,分层的持续时间和强度一般会增加[5],进而降低深层水的氧浓度,影响营养盐循环[6]。温度持续升高还会加快流域植被发育和土壤微生物活动,而植被和土壤的长期变化则会造成流域营养物质和溶解有机碳(DOC)输出增加[7]。营养盐输入是当前湖泊普遍面临的另一个重要环境胁迫因子。在无人类活动直接干扰的情况下,高山湖泊的营养物质主要来源于流域和湖泊内部循环过程。近两百年来,大气活性氮沉降改变了高海拔和高纬地区湖泊的营养限制状况,湖泊营养水平明显上升[8]。对湖泊沉积物中δl5N的分析可以有效识别湖泊氮的主要来源和历史时期氮源变化过程[9-10]。一般而言,大气中的氮具有较低δl5N值(约0.2 ‰ ~0.8 ‰)[11],来自于人类活动(如工业生产合成肥料)造成的活性氮(Nr) 沉降的δ15N比较亏损(在-4 ‰ ~4 ‰之间)[12],而来自人类和动物的废物明显富集δ15N(约10 ‰ ~20 ‰)[13],土壤有机氮硝酸盐δl5N信号的变化约在4 ‰ ~9 ‰之间[12]。我国西南高山地区的研究发现,自1850s以来该地区湖泊δl5N开始出现逐渐下降的趋势,反映了区域大气Nr沉降过程[14]。氮沉降对不同流域类型和水体理化特征湖泊的影响存在着明显差异,流域及水体酸中和能力较弱的湖泊对酸性沉降敏感,氮沉降导致此类湖泊水体酸化[15]。在高山湖泊酸化现象更加明显,如受到酸性物质沉降的影响,1960s欧洲和北美地区的大多数湖泊出现水体酸化现象。对于酸中和能力强(流域基岩多碳酸岩)的湖泊,氮沉降则会引起水体营养水平明显上升[16],尤其是对于寡营养的湖泊来说,营养盐输入会显著促进藻类生物量的上升。如Hu等[17]对我国西南地区9个高山湖泊的研究发现,近两百年来大气氮沉降导致的营养输入是这些湖泊营养水平上升和硅藻群落结构发生明显变化的主要驱动因素之一。
基于高山湖泊在全球变化研究中的重要性,国内外已开展了大量的相关研究,比较系统地揭示了高山地区气候环境变化的关键因子和湖泊生物群落的响应过程。湖泊物理特征(面积、水深、海拔、pH等)及流域差异往往会影响湖泊对气候变化和营养盐输入的响应过程,以及浮游生物群落结构和生物量的变化[17]。如孔令阳等[18]对西南地区两个高山湖泊的研究,识别了近两百年来分别位于树线上下的湖泊环境演化过程异同以及枝角类群落的响应特征差异。Li等[19]利用多指标分析揭示了滇西北高山湖泊错恰湖枝角类群落对末次冰盛期以来长尺度气候变化和流域营养物质输入的响应过程。高山地区还存在地形、地貌和流域植被差异,在持续升温和不断加剧的人为干扰(大气氮沉降)下高山湖泊响应不同环境压力的长期过程可能会出现较大差异。此外,目前国内关于高山湖泊响应区域环境变化的研究多以初级生产者(藻类)、底栖无脊椎动物(揺蚊)为研究载体[20]。因此,有必要系统识别高山湖泊浮游动物群落对气候变化和流域扰动的响应及其机制。
在湖泊生态系统中,浮游动物枝角类处于湖泊食物网中间环节,扮演着承上启下的作用。由于其能够在湖泊沉积物中很好地保存,被视为湖泊古环境、古气候演化研究良好的代用指标而广泛用于湖泊环境变化(如营养状况、水温、水深、水体pH值等)过程重建[21-22]。本研究选择滇西北地区未受人类活动直接影响的高山湖泊沃迪错为研究对象,以沉积物枝角类为主要代用指标,应用多指标分析重建了近200年来湖泊环境的变化历史,结合区域气候变化和氮沉降等重建数据,揭示了该高山湖泊的环境变化对枝角类群落演替的长期影响,识别了区域大气与流域过程对高山湖泊生态系统重要特征的驱动机制。
1 研究区概况沃迪错(28°14′57.15″N,99°58′21.67″E)位于滇西北香格里拉县,海拔为3842 m,是小型高山深水湖泊(图 1),平均水深8.2 m,最大水深20.7 m,为具有季节性热力分层特征的冷水多次混合型湖泊。湖泊面积0.17 km2,流域面积36.04 km2,流域和湖泊面积之比为212。该湖水源补给以降水为主,同时接纳流域冰雪融水;该湖营养水平低,水体TP浓度为0.005 mg/L、TN浓度为1.15 mg/L; 透明度为10.1 m,pH为8.12,呈弱碱性。流域基岩为砂岩、泥岩、灰岩,局部夹玄武岩。该湖位于树线以下,流域植被以云杉为主,湖周分布为草甸。

|
图 1 沃迪错地理位置(a)、流域照片(b)与等深图和采样位点(c) Fig.1 Map showing lake location (a), photo of the catchment (b), lake bathymetry and sampling site (c) of Wodi Co |
2019年8月利用Hon-Kajak大口径(直径9 cm)重力采样器在沃迪错湖心水深20.7 m处(图 1)采集长度为41 cm的沉积柱,现场对钻孔沉积物表层5 cm按0.5 cm间隔分样,余下按1 cm分样。样品保存在自封袋中放于4℃的冰箱中冷藏以备分析。现场用多参数水质仪(YSI 6600)测定溶解氧(DO)浓度、pH值、电导率、浊度等指标,测定湖泊水深并利用赛氏盘测定水体透明度。采集表层水样低温保存带回实验室后立即使用SmartChem 200 (AMS Alliance) 测定水质指标,其中总磷(TP)浓度用钼锑抗分光光度法测定,总氮(TN)浓度用偶氮比色分光光度法测定。
2.2 实验室分析实验室内,首先对沉积钻孔进行210Pb和137Cs年代测试,利用210Pb比活度衰变的CRS模型(the constant rate of supply model)和137Cs活度的峰值分别对沉积物进行年代序列的建立与校准[23]。沉积物TN和氮稳定同位素(δl5N)指标通过MAT-253气体质谱仪(美国Thermo公司)与元素分析仪(FLASH 2000)测定。分析测试时分为沉积物有机样品和全岩样品,以获得有机和全岩的碳氮含量及氮稳定同位素。烧失量和磁化率按标准方法进行测试[24-25],沉积物TP含量的测定采用碱熔-钼锑抗分光光度法[26],沉积物叶绿素a(Chl.a)含量采用紫外分光光度法进行测定[27]。
沉积物枝角类样品的处理参照Korhola等的方法进行[22]。称取约0.1 g干重样品加入100 mL 10 % 的KOH溶液并在50℃电热板上加热50 min以解凝沉积物样品,样品清洗后用38 μm孔径的滤网进行过滤,收集滤网上的残留物进行染色制片,然后在光学显微镜(放大200倍)下进行种类鉴定。统计时把所有化石残体(头壳、壳瓣、后腹部、尾爪、卵鞍)都进行统计,选择数量最丰富的片段进行计数来代表枝角类个体数。每个样品中的枝角类统计数均达100以上,以减小数据统计的误差。枝角类化石的分类鉴定主要参考Szeroczyńska等[28]和Korosi等[29-30]的图谱进行。统计出的枝角类用相对丰度和绝对丰度2种方式表达。相对丰度为样品中某个种的个体数占枝角类总个体数的百分比(%),绝对丰度指单位重量沉积物中所含的枝角类个体数(ind./g(dw))。
2.3 区域数据收集用于分析的气候数据来源包括:距离沃迪错最近的气象站点香格里拉站(海拔3500 m)和丽江站近60年的气象监测数据(来源于国家气象数据网http://data.cma.cn/),基于树轮重建的近300年香格里拉夏季温度变化序列[31],基于brGDGTs(branched glycerol dialkyl glycerol tetraethers,支链甘油二烷基链甘油四醚)指标的丽江高山湖泊天才湖(26°37′N,99°42′E)温度重建数据[32]及滇西北PDSI(帕默尔干旱指数)[33]。同时,收集整理了我国西南地区高山湖泊(月亮湖、太极湖、沙德错)[14, 34]、喜马拉雅山及格陵兰冰芯中的TN和硝酸盐(NO3-)浓度及δ15N记录[35-36]。
2.4 数据分析选取至少在两个样品中出现且一个样品中含量超过1 % 的枝角类属种建立地层序列图。首先,利用降维对应分析(detrended correspondence analysis,DCA)确定枝角类数据的最大变率与梯度长度(standard deviance,SD),以揭示枝角群落变化的特征。当物种梯度SD>2时,一般应用对应分析(correspondence analysis,CA);当SD<2时,一般用主成分分析(principal component analysis,PCA)方法。为减小优势枝角物种的权重,对枝角类属种的百分比数据进行平方根转换后,得到枝角群落变化的主要方向与代表的生态变化梯度,并利用断棍模型检验(Broken-stick)提取出统计学上显著的主轴数。使用限制性聚类分析方法(CONISS)划分出枝角群落在地层变化中的主要时段。
应用冗余分析(redundancy analysis,RDA)识别重要环境变量对枝角群落变化的驱动影响。贫营养水平的高山湖泊中食物资源较为匮乏,藻类作为枝角类主要的食物来源,其可获得性是影响枝角类群落结构变化的重要限制因子,因此冗余分析中将沉积物叶绿素浓度(指示湖泊初级生产力)与其它环境要素(TN浓度、TP浓度和气温)作为枝角类群落的解释变量。1958 2018年香格里拉监测温度与丽江监测温度显著相关(r=0.73,P<0.001),均能较好地指示地区气候变化模式,因此在排序分析及相关分析中,选取距沃迪错更近的中甸重建温度序列作为解释变量。冗余分析前对各解释变量进行标准化处理,保留具有显著性(P<0.05)的环境变量并剔除方差膨胀系数(variance inflation factor,VIF)>20的环境因子,然后进行前向模型选择选出显著的环境变量,生成RDA排序图。进一步开展方差分解分析(variance partitioning analysis,VPA)用于识别驱动枝角类群落变化的显著环境变量及其驱动强度。为了探究气候变暖和区域氮沉降过程对湖泊营养水平、初级生产力和枝角类群落的驱动影响,进一步进行Pearson相关性分析,相关性分析前对数据进行正态分布检验。地层序列图和统计分析分别在C2软件和R(4.1.0)软件中完成。
3 结果 3.1 年代学结果沉积钻孔中210Pb的比活度总体呈现指数型衰减趋势,到18 cm深度以下比活度逐渐稳定,到22.5 cm以下样品比活度衰变到地质背景值(图 2a)。137Cs比活度在11.5 cm深度出现峰值(12.21 Bq/kg)(图 2a),对应于1963年北半球137Cs散落高峰。利用210Pb活度衰变及CRS模型建立沉积物的年代序列,并利用137Cs活度在1963年处于峰值的特点对沉积物年代序列进行标定和校准(图 2b)。22.5 cm以下的沉积物年代通过17.5~21.5 cm深度的平均沉积速率外推而得,结果显示钻孔40.5 cm对应年代约为1743年,22.5 cm深度对应约为1905年。根据沉积通量(DMAR)计算,整个钻孔的平均沉积通量为0.08 g/(cm2 ·a)。1960 AD以来,沉积通量上升明显((0.11±0.04)g/(cm2 ·a)),2000年以来沉积通量快速上升到0.13 g/(cm2 ·a)(图 2b)。
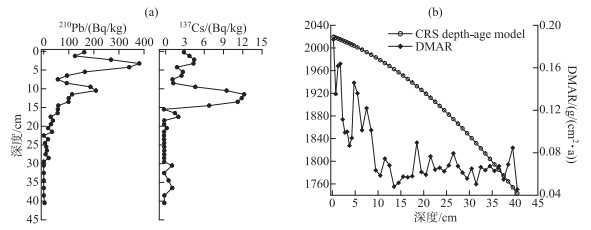
|
图 2 沃迪错钻孔137Cs和210Pbex比活度变化(a)与CRS年代模型和干沉积通量(b) Fig.2 Depth profiles showing the 137Cs and 210Pbex activities (a), the CRS age-depth model and sedimentation rate (DMAR) (b) of Wodi Co |
监测记录显示,香格里拉和丽江近60年的气温呈上升趋势,在经历1960 1970年的低值段后出现波动上升,近二十年来升温趋势明显(图 3)。重建的温度序列[33]显示,香格里拉和丽江地区气温在过去200多年间总体呈波动上升趋势(图 3),1900s以前香格里拉地区夏季温较低,其中在1800和1880s出现两次明显降温,1900s之后夏季温上升并在经历1950 1970s明显降温后持续上升。香格里拉1958 2002年实际监测温度与中甸树轮重建温度显著相关(r=0.69,P<0.001),1951 2015年丽江气象监测温度与天才湖基于brGDGTs指标的重建温度显著相关(r=0.70,P<0.001),说明重建数据均能较好地代表地区过去的温度变化过程。重建的香格里拉地区干旱指数(PDSI)在过去近200年中地区干湿状况出现较明显波动[32],在1780 1790s、1830 1860s、1890 1910s和1990 2010s间出现明显偏湿(图 3)。
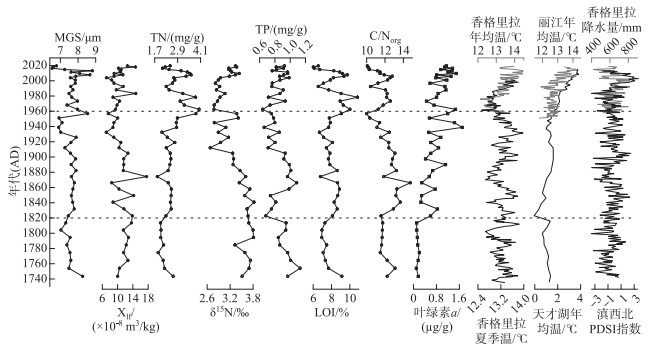
|
图 3 沉积物多指标变化序列和站点气象监测数据(灰线)及区域重建气候记录(黑线)的对比 Fig.3 Comparison of multi-proxy sediment records, regional meteorological monitoring data (gray line) and reconstructed climatic records (black line) from Shangri-La, Northwest Yunnan |
近两百年来,钻孔中值粒径有较明显波动,1820s以前相对较低,之后略有上升并保持相对稳定((7.68±0.17)μm),在经过1930 1960s较明显的下降((6.98±0.08)μm)后再次上升到1930s以前的水平。磁化率在1820s以前略有上升,在经历1820 1880s较明显的波动后出现持续下降,1940s以来总体较稳定状态。TN浓度在1820s以前相对较低,之后出现上升趋势并在1960有明显上升,1960s以来则出现波动下降(图 3)。δ15N在1800s开始出现波动下降,到1960s以来略有上升的趋势。拐点分析结果表明δ15N在1820s有明显变化,从1820s以前的(3.64 ‰ ±0.16 ‰)下降到1960s的(3.32 ‰ ±0.33 ‰),1960s以来出现波动上升的趋势(图 4)。与TN总体上升的变化趋势不同,TP含量在1820s以前处于相对较高水平((0.96±0.08)mg/g)且呈明显下降趋势,1860s出现明显上升后再次呈现持续下降趋势,1960s以来有所波动并在2000s达到(0.80±0.07)mg/g。有机碳氮比(C/Norg)总体在10~15(11.93±1.02)之间,1820s以前比较稳定(11.98±0.50),之后开始上升并在1860s达到最大值(14.75)后逐渐下降,1960年以来C/Norg总体波动下降(11.50±0.87)。叶绿素a浓度在1820s以前几乎接近于0,之后明显波动上升,2000s以来达到(1.15±0.22)μg/g。总体上,叶绿素a浓度与TN浓度有较相似的变化趋势,而与δ15N有相反的变化趋势。
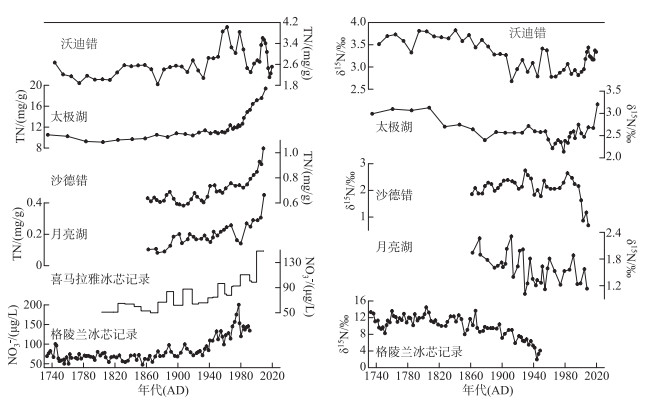
|
图 4 西南地区高山湖泊钻孔和喜马拉雅山及格陵兰冰芯记录[14, 33-36] Fig.4 Temporal comparison of TN and δ15N records from sediments of alpine lakes in Southwest China, as well as ice core records from Himalayas and Greenland[14, 33-36] |
钻孔沉积物中一共鉴定枝角类6属14种(图 5)。优势种为浮游种(总含量>80 %),包括Daphnia longispina、Daphnia pulex、Bosmina longispina和Bosmina longirostris。沿岸种仅有少量发现,包括Chydorus sphaericus、Alona guttata/rectangula、Alona affinis、Leydigia leydigi、Leydigia acanthocercoides、Alona quadrangularis、Monospilus dispar、Alona intermedia。依据属种相对丰度数据的聚类分析结果,枝角群落可划分为2个组合带,且组合带Ⅰ可分为2个亚带:
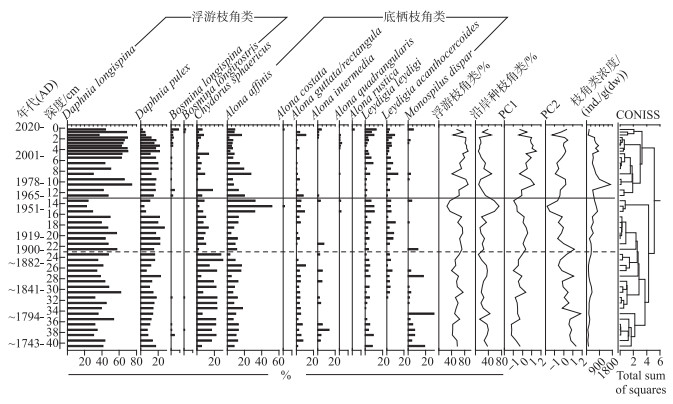
|
图 5 沃迪错钻孔主要枝角类属种(>1 %)组合及群落变化特征序列 Fig.5 Stratigraphic profile showing cladoceran composition of dominant taxa (>1 %), PCA1 and PCA2 sample scores, and total cladoceran concentration in Wodi Co |
组合带Ⅰ-1(约1900AD以前):浮游种D. longispina(40.83 % ±8.02 %)为主要优势种,C. sphaericus(18.13 % ±7.57 %)和浮游种D. pulex以及底栖种A. affinis(10.38 % ±3.96 %)和A. guttata/rectangula丰度较高且变化不明显。L. leydigi、L. acanthocercoides、M. dispar、B. longispina和B. longirostris等均有少量出现,L. acanthocercoides在1840s开始出现,并且相对丰度略有增加。M. dispor和A. intermedia呈下降趋势。枝角类浓度较低((199.57±77.86)ind./g(dw)), 但略有上升趋势。
组合带Ⅰ-2(约1901 1965AD):浮游种D. longispina(41.58 % ±12.06 %)仍然为主要优势种,明显的变化是C. sphaericus、M. dispar和A. intermedia的相对丰度均在1900s左右出现较明显下降。底栖种A. affinis相对丰度明显增加(18.52 % ±14.37 %),A. guttata/rectangula、L. leydigi相对丰度也有增加趋势。1940 1960s,D. longispina相对丰度出现下降(22.02 %)而A. affinis相对丰度达到了最大值(51.78 %),A. guttata/rectangula和L. leydigi相对丰度也处于较高值。枝角类浓度显著增加,平均达到(454.06±163.94)ind./g(dw)。
组合带Ⅱ(约1965AD以来):浮游种D. longispina相对丰度在经过1980s的短暂下降后上升并成为主要的优势种(61.47 % ±10.42 %),D. pulex相对丰度呈现相同的变化趋势但在2000年以来明显下降。底栖种A. affinis相对丰度出现明显波动下降。2000年以来,浮游种B. longispina和沿岸种(如L. leydigi、A. guttata/rectangula)相对丰度有所上升。枝角类浓度在1970s达到峰值后快速下降并维持在530.60 ind./g(dw)左右。
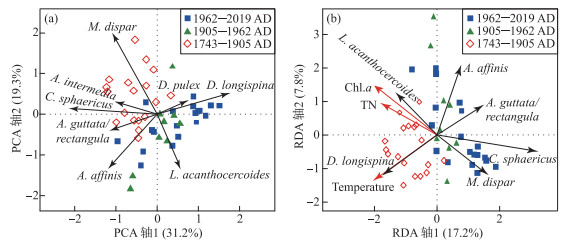
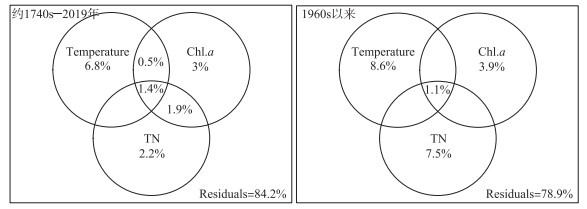
3.4 主要环境压力及驱动强度识别枝角类群落的PCA结果显示,PCA前两轴具有显著的统计学特征且分别解释了群落变化的31.2 % 和19.3 % (图 6)。其中,浮游种D. longispina、D. pulex分布在PCA主轴1正半轴方向,C. sphaericus和沿岸种A. guttata/rectangula、A. affinis及M. dispar分布在轴1负半轴方向。相关分析结果也显示枝角类PCA1得分与浮游枝角类百分比显著相关(r=0.92,P<0.001)(图 8f),因此,PC1反映了时间序列上枝角类群落由底栖种向浮游种的转变。PCA2得分与A. affinis相关性显著(r=0.64,P<0.001),主要指示该种相对丰度的变化。RDA结果表明(图 6b),其主轴1解释了枝角类群落变化的17.2 %,且与温度、Chl.a、TN浓度等环境变量显著相关。主轴2则解释了枝角类群落变化的7.8 %,与TN和Chl.a浓度呈正相关而与温度负相关。RDA结果表明,驱动沃迪错近两百年来枝角组合变化的显著环境因子为温度、TN和Chl.a(图 7)。方差分解结果揭示,过去两百多年来气温独立解释了枝角类群落方差的6.8 %,TN解释了2.2 %,Chl.a指示的初级生产力的变化解释了3 %,分别指示了气候变暖和湖泊营养水平的驱动影响。自1960年以来,三者对湖泊生态系统的影响份额都有所提升,其对枝角类群落变量的解释比例分别为8.6 %,7.5 % 和3.9 %。
|
图 6 沃迪错钻孔枝角类群落PCA双序图(a)和RDA三序图(b) Fig.6 PCA biplot (a) and RDA triplot (b) of cladoceran assemblages in Wodi Co |
|
图 7 不同时间窗口显著环境因子生态效应的方差分解分析 Fig.7 Variance partitioning results showing the main environmental gradients and their explanatory power (variance explained, %) for Cladocera changes in two time windows |
|
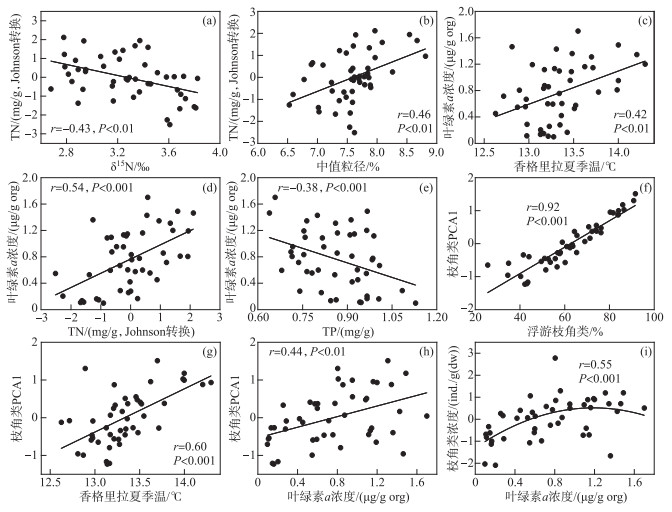
图 8 沃迪错钻孔TN、Chl.a、枝角类PCA1样点得分、枝角类浓度与重要驱动因子的关系识别 Fig.8 Scatter plots showing the relationships among cladoceran community (PCA1 scores, concentration), summer temperature, grain size, nutrients, and Chl.a concentration |
为了识别影响湖泊营养水平(TN)的主要环境因子,将δ15N、中值粒径与TN进行相关性检验。结果显示,沉积物中TN与δ15N(r=-0.43,P<0.01)和中值粒径(r=0.46,P<0.01)均有相关性(图 8a~b)。为了探究气候变化和区域大气沉降过程对湖泊生态系统及流域环境变化的驱动作用,进一步对显著环境因子(温度、TN、TP)及湖泊生物特征数据(Chl.a、枝角类PC1得分、枝角类浓度以及浮游枝角类百分比)开展了相关关系分析(图 8),Chl.a浓度与香格里拉年均温度、TN和TP浓度均显著相关(图 8c~e),枝角类PCA1主要指示浮游种枝角类相对丰度的变化(图 8f),且PCA1与地区年均温度和Chl.a浓度显著正相关(图 8g~h)。此外,枝角类浓度与Chl.a浓度显著正相关(r=0.55,P<0.001,图 8i)而与TP浓度呈负相关关系(r=-0.51,P<0.01)。
多元回归分析显示,近两百年来枝角类PCA1与温度和TN变化呈正相关,枝角类PCA2与Chl.a负相关和TN正相关(表 1)。枝角类浓度受到TN浓度的显著影响。1960 AD以来(表 2),枝角类PCA1主要受到温度的影响,枝角类PCA2与温度和TN呈正相关关系。枝角类浓度受到TN浓度的影响,且呈显著正相关关系。
| 表 1 近两百年来沃迪错枝角类与显著环境因子多元回归分析 Tab. 1 Multiple regression analysis showing the significant environmental factors for cladoceran community change during the past 200 years |
| 表 2 1960年以来钻孔枝角类与显著环境因子多元回归分析 Tab. 2 Multiple regression analysis showing the significant environmental factors for cladoceran community change since 1960s |
钻孔TN浓度在近两百年来总体呈现明显的波动上升趋势,指示湖泊营养盐不断富集的过程。在无人类活动干扰的情况下,高山湖泊的营养物质主要来源于流域和湖泊内源生产力[14]。在1820s钻孔TN浓度波动上升时,δ15N也开始逐渐偏负(图 3),钻孔TN浓度与δ15N表现出高度相关关系(r=-0.43,P<0.001,图 8a)。大量研究显示,工业革命以来化石燃料和农业化肥的使用导致大气中活性氮浓度的升高、远距离大气输送和大气氮沉降的增加[37],引起近两百年来冰芯、湖泊中硝酸盐及TN浓度明显上升,偏远的高纬、高山地区也出现了明显的大气氮沉降信号,湖泊沉积物中的δ15N出现明显下降趋势[17, 36]。过去近一百多年来,亚洲地区由于高强度的农业耕作和现代工业的快速发展,已经成为Nr沉降的中心区域[14, 17]。沃迪错TN含量和δ15N间的负相关关系,指示了近两百年来沃迪错TN含量上升可能主要是由于大气氮沉降导致的。沃迪错钻孔的δ15N记录与格陵兰以及西南地区高山湖泊中的δ15N记录具有很好的一致性(图 4)。在西南地区的4个湖泊中,除沙德错δ15N变化不明显外,另外3湖沉积物中δ15N均在1850s左右出现明显下降趋势,反映了区域大气氮沉降过程。格陵兰冰芯中硝酸盐浓度在1800s开始显著上升,并和δ15N值下降的趋势对应,表明北半球长期经历的大气氮沉降过程[36]。
然而,4个地区湖泊的δ15N值在1960s以来出现了差异性的变化趋势。位于树线以下的沃迪错、太极湖的δ15N在1960s达到谷值后出现波动上升,且变化趋势较为一致;而位于树线以上的月亮湖和沙德错的δ15N在1960s以来下降趋势减缓并在1980s开始快速下降。1960s以来西南地区的大气活性氮沉降明显增加[38-39],沃迪错的δ15N波动上升表明了该同位素指标指示大气氮沉降过程的敏感性下降。现代调查表明,流域地表过程和湖泊内部氮循环均可以影响沉积物δ15N值的变化模式。如活性氮沉降到流域地表后可被植被与土壤微生物吸收利用,植被发育时更多的活性氮会主要被流域植被截留,导致湖泊活性氮输入减少[14]。1960s以来,监测数据显示该时期气温上升明显、降水增多,气候暖湿可能促进了沃迪错流域植被生长以及对活性氮的吸收作用。流域植被和土壤过程对活性氮组分的分馏作用影响了流域有机质和活性氮的输出,可以导致湖泊活性氮输入减少,植被覆盖下土壤有较高的δ15N信号,从而引起沉积钻孔中δ15N信号出现明显上升趋势。类似地,该研究区位于树线以下的太极湖中沉积物δ15N信号在近几十年来也出现了上升趋势(图 4)。
此外,区域气候波动和流域侵蚀强度也可能影响了流域营养物质的湖泊输入过程。粒度组成受流域侵蚀强度、湖泊水动力等水文条件的影响显著[40],沃迪错钻孔TN浓度与中值粒径(MGS)呈现显著的负相关关系(r=-0.46,P<0.001,图 8b),可能反映了湖泊TN变化受到了水文过程的影响。同时,钻孔MGS与香格里拉地区年均温度呈一定的相关性(r=0.14,P<0.05)。气候变化会改变土壤微生物活性,进而影响流域物理风化、侵蚀过程[41],也会通过流域植被发育作用于流域营养物质输出过程[42]。沃迪错钻孔MGS在1820s以前相对较低且呈下降趋势,重建的PDSI指数指示这一时期该地区总体处于相对偏干偏冷环境(图 3),可能指示了较低的流域侵蚀强度。另外,相对较干冷的气候环境也可能限制了植被发育,导致外源有机质输入较少,因而TN含量和C/N比值在1820s以前均相对较低。与TN浓度总体呈上升趋势不同,沉积物TP浓度总体呈现波动下降趋势。高山湖泊中的磷主要来自地表侵蚀过程和湖泊沉积物中磷的再次释放[43]。1820s以前TP呈现持续下降趋势,可能与这一时期较低的流域侵蚀强度有关。1820s较快上升后,TP浓度在1860s再次下降,Xlf和C/Norg均呈现同步的下降趋势,反映了流域地表侵蚀强度先上升后逐渐下降的过程。
1960s以来,TN浓度出现明显波动,TP有波动上升((0.80±0.07)mg/g),但仍低于1820s以前水平((0.96±0.08)mg/kg)。虽然TN、TP浓度的上升趋势并不十分显著,但通量结果显示这一时期湖泊营养盐总体明显上升,可能反映了这一时期流域外源输入和湖泊内部营养循环增强过程。钻孔沉积速率从1960s开始明显上升,尤其是1980s上升更加明显(图 2b),意味着较多外源颗粒物输入导致了沉积物中TN、TP浓度被稀释。一方面,本地区自1960s以来存在较明显的升温过程且地区降水也有增加趋势,气候条件的改变可能促进了流域植被发育进而导致外源有机质输入增多。同时,流域人类活动增加(如放牧、筑路)也会导致颗粒物输入增多,进而影响营养盐的浓度水平。钻孔MGS在2000年以来出现波动下降,而Xlf有波动上升但总体处于剖面最低值段,指示这一时期流域侵蚀强度增强但总体较之前略弱。TN含量和C/N在1960s以来出现两次峰值,也指示了这一时期流域植被发育导致外源有机质输入增多。在加拿大落基山脉地区的研究发现,过去100年气候变暖影响了湖区植被的发育导致入湖有机质的增多,从而促进了湖泊营养水平上升[37]。此外,气候变暖会增强深水湖泊的热力分层和底层水体的厌氧条件,促进表层水体营养盐浓度的提高[44]和水-土界面沉积物中营养盐的释放[45]。因此,1960s以来氮磷浓度的上升也可能受到了区域增温引起的热力分层、内源释放等增强作用的影响。
4.2 枝角类群落对近两百年来气候变化的响应钻孔枝角类群落的主要变化特征是浮游种枝角类百分含量的多次波动变化。相关分析结果显示枝角类PCA1得分主要反映了时间序列上枝角类浮游种相对丰度的变化(图 8g)。而枝角类PCA1与重建的地区夏季温(r=0.6,P<0.001,图 8g)和Chl.a浓度(r=0.44,P<0.001,图 8h)显著相关,指示区域气候变化和湖泊初级生产力是影响枝角类群落结构变化的主要驱动因子。温度变化会直接影响枝角类的个体繁殖速率,还通过影响湖泊冰封持时、浮游生物生长期以及湖泊生产力水平,进而改变枝角类群落的物种组成和生物量[46]。1900年以前,优势种D. longispina和D. pulex丰度增加,而在1840s后逐渐降低,C. sphaericus在1900年以前也具有相对较高的占比(18.13 % ±7.57 %)。已有研究表明,D. longispina对温度变化敏感,受生长期时长和食物质量影响明显[47]。该种在极地/亚极地地区和欧洲的高山湖泊中也普遍存在[48-49],可见其能够耐受低温环境. D. pulex属广适性种类,常见于高海拔和高纬地区湖泊[50-51],气候环境恶化时期也有较多分布[52]。C. sphaericus常被认为是一个广布种[53],同时也能耐受贫营养、冷水环境而被定义为耐寒种或极地种[54],在低温、贫营养的高山湖泊和极地地区湖泊中均有分布[55-56]。Li等[19]对滇西北高山湖泊错恰湖的研究发现在末次盛冰期时C. sphaericus是该湖一个明显的优势种,而进入全新世以来随着气候变暖该种相对丰度出现持续下降。因此Daphnia和耐冷种C. sphaericus、A. affinis等属种在枝角类群落中的优势组成,可能表明了该湖泊在1900年以前(如小冰期)具有较低的水体温度。
1900年左右C. sphaericus相对丰度出现快速下降,而浮游枝角类相对丰度在1900 1945年间有所提高(69.30 % ±5.00 %,图 5)。重建的香格里拉和天才湖温度数据均显示这一时期区域气候逐渐变暖,可能反映了升温环境促进了大个体、竞争力相对较强的主要营浮游生活的Daphnia相对丰度的上升。约1948 1965年间Daphnia相对丰度出现明显下降(相对丰度25 % ~35 %),而沿岸种A. affinis相对丰度出现明显上升。相关分析显示枝角类PCA2得分主要反映沿岸种A. affinis相对丰度的变化(r=0.64,P<0.001),A. affinis相对丰度与重建的夏季温有较显著的负相关关系(r=-0.54,P<0.001)。已有研究表明,A. affinis可耐受冷水环境并具有较强的环境适应能力,在亚北极湖泊中也比较常见[57-58]。相对耐冷水环境的A. affinis相对丰度在这一时期明显增多,指示湖泊水温降低,同时重建的香格里拉气候数据显示这一时期地区有明显降温。因此,短暂的降温可能直接影响了枝角类的生长分布和物种组成。研究发现D. longispina也偏好温暖和富营养化环境[57],2000年以来,D. longispina相对丰度的较明显上升指示了增加的食物资源(如叶绿素a浓度上升)和有利于生物生长的环境条件。对滇西北高山湖泊错恰湖的研究也发现,随着湖泊外源有机质输入增多和内源生产力的上升,D. longispina在进入全新世后出现明显上升趋势并成为近6000年来唯一的优势种[19]。
4.3 营养盐富集对枝角类群落的驱动相关分析显示钻孔叶绿素浓度与香格里拉夏季温和TN呈正相关关系(图 8c,d),指示了气候变化和营养水平对湖泊初级生产力的驱动影响。气候变暖会缩短湖泊的冰封持时,延长了湖泊生物的生长季节。此外,增温也会加快湖泊内部营养盐的循环,为湖泊藻类和水生植物的生长带来营养物质[15-16]。在升温和营养盐增加的背景下,湖泊的总初级生产力会明显上升[45]。1820s在TN、TP浓度开始上升时Chl.a浓度开始波动上升,1960s起,沃迪错钻孔Chl.a浓度呈持续上升趋势且波动幅度减小,均指示了随着湖泊营养水平上升,湖泊内源生产力也出现明显上升的过程。北极多个湖泊沉积物结果表明,湖泊初级生产力上升(Chl.a)与区域气候变暖趋势一致,湖泊冰封持时缩短和营养盐增加的共同作用下,藻类、水生植物的生物量明显增长[50]。Kang对滇西北高山湖泊太极湖的研究发现,1970年以来区域气候变暖促进了流域土壤风化和植被生长,引起随地表径流进入湖泊的营养盐和有机质快速上升,湖泊初级生产力(Chl.a)也随之同步提高[34]。
值得注意的是,钻孔TP浓度与Chl.a浓度呈负相关关系(r=-0.38,P<0.05,图 8e),与富营养化湖泊中营养水平(TP)上升促进初级生产力(藻类)上升的模式[59]相反。如前所述,沃迪错中TP浓度的变化(尤其是1860 1960s TP浓度总体呈现下降趋势)明显受到流域侵蚀强度变化的影响。但另一方面,TP浓度的变化可能也受到了湖泊内部磷的利用及循环模式的影响。野外调查显示沃迪错水体中TP浓度为0.005 mg/L(表 1),水体TN/TP质量比为230,远超7.2,属于P限制湖泊[60],与青藏高原东南缘4000 m以上的大多数高山湖泊营养限制模式相同[61]。对于寡营养的高山湖泊来说,藻类生物量的增加需要额外的营养补充。1860s以来,沉积物中Chl.a浓度波动上升趋势明显,而沉积物TP浓度出现明显波动下降趋势,由此可以推测在沃迪错流域输入P有限的情况下,藻类的生长过度利用了水体中的P而导致沉积物中埋藏量的下降。
RDA分析结果显示,Chl.a和TN也是影响枝角类群落变化的主要驱动因子。相关分析显示,枝角类PCA1得分与Chl.a浓度显著正相关(r=0.44,P<0.01,图 8h)。在贫营养的高山湖泊中,食物资源往往比较匮乏,藻类作为枝角类主要的食物来源,其可获得量是影响枝角类群落结构变化的主要因素之一[62]。方差分解结果(图 7)显示,温度、营养水平(TN、TP)和Chl.a浓度三者的协同作用对近两百年来枝角类群落结构的影响较为明显。对全钻孔和1960年以来的方差分解表明温度对枝角类群落变化的单独解释量都是最高的,但1960s以来三者对枝角类群落结构变化的独立解释量都有所提高,TN的独立解释量升高最明显(由2.2 % 上升到7.5 %),说明湖泊营养水平升高和气候变暖对枝角类群落构建的影响明显增加。由此推测,1960s以前在贫营养的沃迪错中,温度对湖泊生物群落结构的影响是主要的,但在1960s以来气候变暖和湖泊营养盐不断富集的环境下,湖泊营养水平和内源生产力(藻类生物量)的上升成为影响枝角类群落结构变化的主要驱动因素,尤其是2000年以来,区域快速升温背景下叶绿素浓度的上升可能明显促进了浮游种D. longispina相对丰度上升。
此外,钻孔中枝角类浓度总体呈现持续上升趋势,反映了枝角类生物量不断增加的过程。相关分析显示,钻孔枝角类浓度与Chl.a浓度呈显著正相关(r=0.55,P<0.001,图 8i),而Chl.a浓度与温度(r=0.42,P<0.01,图 8c)和TN浓度(r=0.54,P<0.001,图 8d)呈显著正相关。上述结果反映了过去200多年来随着区域气候变暖和大气氮沉降的持续,沃迪错营养水平上升、内源生产力(藻类浓度)提高,并通过上行效应间接促进了枝角类生物量的提高。枝角类浓度和Chl.a同时还与TP呈显著负相关关系(r=-0.51,P<0.001),如前面所讨论的,磷限制的沃迪错中藻类生物量的上升引起TP的消耗,而藻类又是影响枝角类生物量的一个重要因子,因此枝角类浓度和Chl.a同步响应了TP浓度的变化。此外,枝角类的生长分布还会受到气候的直接和间接影响,气候变暖会直接促进枝角类的生长,生长期的延长也将改变枝角类的生长分布[54],因此气候变暖也是近两百年来枝角类浓度波动上升的一个重要因素。
5 结论沉积物多指标分析表明,沃迪错近两百年来出现了明显的生态环境变化。受区域大气沉降和流域有机质输入的影响, TN浓度呈现波动上升趋势,反映了沃迪错营养盐不断富集的过程。在TN含量上升和区域气候波动的影响下,湖泊初级生产力(Chl.a)水平呈现明显的上升趋势,并通过上行效应影响了枝角类群落结构的组成, 并造成枝角类浓度的上升。气候变化也是影响枝角类群落结构变化的主要驱动因子,相对偏暖时期浮游枝角类Daphnia占优势,气候相对较冷期C. sphaericus和A. affinis相对丰度上升。总体上,1960s以前在贫营养的沃迪错湖温度对湖泊生物群落结构的影响是主要的,但1960s以来气候变暖和湖泊营盐不断富集的环境下,湖泊营养水平和内源生产力上升成为影响枝角类群落结构变化的主要驱动因素,浮游种D. longispina成为显著的优势种。另外气候变暖的直接影响和间接影响(如生长延长和藻类数量增加)可能也是引起枝角类浓度上升的一个重要因素。
| [1] |
Chapin Ⅲ FS, Zavaleta ES, Eviner VT et al. Consequences of changing biodiversity. Nature, 2000, 405(6783): 234-242. DOI:10.1038/35012241 |
| [2] |
Schindler DW, Beaty KG, Fee EJ et al. Effects of climatic warming on lakes of the central boreal forest. Science, 1990, 250(4983): 967-970. |
| [3] |
Battarbee RW. Aquatic ecosystem variability and climate change—A palaeoecological perspective. Climate Change Impacts on Freshwater Ecosystems.. Oxford, UK: Wiley-Blackwell, 2010: 15-37. DOI:10.1002/9781444327397.ch2
|
| [4] |
Karst-Riddoch TL, Pisaric MFJ, Smol JP. Diatom responses to 20th century climate-related environmental changes in high-elevation mountain lakes of the northern Canadian Cordillera. Journal of Paleolimnology, 2005, 33(3): 265-282. DOI:10.1007/s10933-004-5334-9 |
| [5] |
Rühland KM, Paterson AM, Smol JP. Lakediatom responses to warming: Reviewing the evidence. Journal of Paleolimnology, 2015, 54(1): 1-35. DOI:10.1007/s10933-015-9837-3 |
| [6] |
Missaghi S, Hondzo M, Herb W. Prediction of lake water temperature, dissolved oxygen, and fish habitat under changing climate. Climatic Change, 2017, 141(4): 747-757. DOI:10.1007/s10584-017-1916-1 |
| [7] |
Neff JC, Hooper DU. Vegetation and climate controls on potential CO2, DOC and DON production in northern latitude soils. Global Change Biology, 2002, 8(9): 872-884. DOI:10.1046/j.1365-2486.2002.00517.x |
| [8] |
Holland EA, Braswell BH, Sulzman J et al. Nitrogen deposition onto the United States and western Europe: Synthesis of observations and models. Ecological Applications, 2005, 15(1): 38-57. DOI:10.1890/03-5162 |
| [9] |
林光辉. 稳定同位素生态学. 北京: 高等教育出版社, 2013.
|
| [10] |
Kendall C, Elliott EM, Wankel SD. Tracing anthropogenic inputs of nitrogen to ecosystems. In: Stable isotopes in ecology and environmental science. Oxford, UK: Blackwell Publishing Ltd, 2008: 375-449. DOI: 10.1002/9780470691854.ch12.
|
| [11] |
Sigman DM, Altabet MA, Francois R et al. The isotopic composition of diatom-bound nitrogen in Southern Ocean sediments. Paleoceanography, 1999, 14(2): 118-134. DOI:10.1029/1998PA900018 |
| [12] |
Heaton THE. Isotopic studies of nitrogen pollution in the hydrosphere and atmosphere: A review. Chemical Geology: Isotope Geoscience Section, 1986, 59: 87-102. DOI:10.1016/0168-9622(86)90059-X |
| [13] |
Ruiz-Fernández AC, Hillaire-Marcel C, Ghaleb B et al. Recent sedimentary history of anthropogenic impacts on the Culiacan River Estuary, northwestern Mexico: Geochemical evidence from organic matter and nutrients. Environmental Pollution, 2002, 118(3): 365-377. DOI:10.1016/S0269-7491(01)00287-1 |
| [14] |
Hu ZJ, Anderson NJ, Yang XD et al. Catchment-mediated atmospheric nitrogen deposition drives ecological change in two alpine lakes in SE Tibet. Global Change Biology, 2014, 20(5): 1614-1628. DOI:10.1111/gcb.12435 |
| [15] |
KopáČek J, Hardekopf D, Majer V et al. Response of alpine lakes and soils to changes in acid deposition: The MAGIC model applied to the Tatra Mountain region, Slovakia-Poland. Journal of Limnology, 2004, 63(1): 143. DOI:10.4081/jlimnol.2004.143 |
| [16] |
Kong LY, Yang XD, Wang Q. Paleoecological change of cladoceran and the response to climatic environmental change from an alpine lake—Jiren Co. J Lake Sci, 2017, 29(3): 730-739. [孔令阳, 羊向东, 王倩. 高山湖泊吉仁错枝角类古生态变化及其对气候环境的响应. 湖泊科学, 2017, 29(3): 730-739. DOI:10.18307/2017.0323] |
| [17] |
Hu ZJ, Yang XD, Anderson NJ et al. The landscape atmosphere continuum determines ecological change in alpine lakes of SE Tibet. Ecosystems, 2018, 21(5): 839-851. DOI:10.1007/s10021-017-0187-z |
| [18] |
Kong LY, Yang XD, Wang Q et al. Environmental change and biological response during the past 200 years from two alpine lakes below and above modern treeline in southwest China. Quaternary Sciences, 2018, 38(4): 926-938. [孔令阳, 羊向东, 王倩等. 我国西南地区树线高山湖泊过去200年环境变化及生物群落响应研究. 第四纪研究, 2018, 38(4): 926-938. DOI:10.11928/j.issn.1001-7410.2018.04.11] |
| [19] |
Li Y, Wang Q, Anderson NJ et al. Cladocera responses to climate changes and treeline shifts in an alpine lake-catchment since the Last Glacial Maximum. Palaeogeography, Palaeoclimatology, Palaeoecology, 2021, 577(1): 110547. DOI:10.1016/j.palaeo.2021.110547 |
| [20] |
Zhang EL, Jones R, Bedford A et al. A chironomid-based salinity inference model from lakes on the Tibetan Plateau. Journal of Paleolimnology, 2007, 38(4): 477-491. DOI:10.1007/s10933-006-9080-z |
| [21] |
Davidson TA, Bennion H, Jeppesen E et al. The role of cladocerans in tracking long-term change in shallow lake trophic status. Hydrobiologia, 2011, 676(1): 299-315. DOI:10.1007/s10750-011-0851-9 |
| [22] |
Korhola A, Rautio M. Cladocera and other branchiopod crustaceans. In: Tracking environmental change using lake sediments. Dordrecht: Springer Netherlands, 2001: 5-41. DOI: 10.1007/0-306-47671-1_2.
|
| [23] |
Chen SY, Wang SM, Chen YY et al. Vertical distribution and chronologica implication of 210Pb and 137Cs in sediments of DongPing Lake Shandong province. Quaternary Sciences, 2009, 29(5): 981-987. DOI:10.1016/S1874-8651(10)60080-4 |
| [24] |
Wang XY, Wu L, Zhang GS et al. Characteristics and environmental significance of magnetic susceptibility and grain size of lake sediments since Holocene in Chaohu Lake, Anhui Province. Scientia Geographica Sinica, 2008, 28(4): 548-553. [王心源, 吴立, 张广胜等. 安徽巢湖全新世湖泊沉积物磁化率与粒度组合的变化特征及其环境意义. 地理科学, 2008, 28(4): 548-553.] |
| [25] |
Heiri O, Lotter AF, Lemcke G. Loss on ignition as a method for estimating organic and carbonate content in sediments: Reproducibility and comparability of results. Journal of Paleolimnology, 2001, 25(1): 101-110. DOI:10.1023/A:1008119611481 |
| [26] |
环境保护部. 土壤总磷的测定-碱熔钼锑抗分光光度法(HJ 632-2011), 2012.
|
| [27] |
Swain EB. Measurement and interpretation of sedimentary pigments. Freshwater Biology, 1985, 15(1): 53-75. DOI:10.1111/j.1365-2427.1985.tb00696.x |
| [28] |
Szeroczyńska K, Sarmaja-Korjonen K. Atlas of subfossil Cladocera from central and northern Europe. Swiecie: Friends ofthe Lowver Vistula Society, 2007.
|
| [29] |
Korosi JB, Smol JP. An illustrated guide to the identification of cladoceran subfossils from lake sediments in northeastern North America: Part 1—The Daphniidae, Leptodoridae, Bosminidae, Polyphemidae, Holopedidae, Sididae, and Macrothricidae. Journal of Paleolimnology, 2012, 48(3): 571-586. DOI:10.1007/s10933-012-9632-3 |
| [30] |
Korosi JB, Smol JP. An illustrated guide to the identification of cladoceran subfossils from lake sediments in northeastern North America: Part 2—The Chydoridae. Journal of Paleolimnology, 2012, 48(3): 587-622. DOI:10.1007/s10933-012-9636-z |
| [31] |
Li ZS, Zhang QB, Ma KP. Tree-ring reconstruction of summer temperature for A.D. 1475-2003 in the central Hengduan Mountains, Northwestern Yunnan, China. Climatic Change, 2012, 110(1/2): 455-467. DOI:10.1007/s10584-011-0111-z |
| [32] |
Feng XP, Zhao C, D'Andrea WJ et al. Temperature fluctuations during the Common Era in subtropical southwestern China inferred from brGDGTs in a remote alpine lake. Earth and Planetary Science Letters, 2019, 510(15): 26-36. DOI:10.1016/j.epsl.2018.12.028 |
| [33] |
Li JB, Shi JF, Zhang DD et al. Moisture increase in response to high-altitude warming evidenced by tree-rings on the southeastern Tibetan Plateau. Climate Dynamics, 2017, 48(1): 649-660. DOI:10.1007/s00382-016-3101-z |
| [34] |
Kang WG, Chen GJ, Wang JY et al. Assessing the impact of long-term changes in climate and atmospheric deposition on a shallow alpine lake from southeast Tibet. Science of the Total Environment, 2019, 650: 713-724. DOI:10.1016/j.scitotenv.2018.09.066 |
| [35] |
Thompson LG, Yao T, Mosley-Thompson E et al. A high-resolution millennial record of the South Asian monsoon from Himalayan ice cores. Science, 2000, 289(5486): 1916-1920. DOI:10.1126/science.289.5486.1916 |
| [36] |
Hastings MG, Jarvis JC, Steig EJ. Anthropogenic impacts on nitrogen isotopes of ice-core nitrate. Science, 2009, 324(5932): 1288. DOI:10.1126/science.1170510 |
| [37] |
Luckman B, Kavanagh T. Impact of climate fluctuations on mountain environments in the Canadian Rockies. AMBIO: A Journal of the Human Environment, 2000, 29(7): 371-380. DOI:10.1579/0044-7447-29.7.371 |
| [38] |
Zheng XH, Fu CB, Xu XK et al. The Asian nitrogen cycle case study. Ambio, 2002, 31(2): 79-87. DOI:10.1579/0044-7447-31.2.79 |
| [39] |
Klimont Z, Streets DG, Gupta S et al. Anthropogenic emissions of non-methane volatile organic compounds in China. Atmospheric Environment, 2002, 36(8): 1309-1322. DOI:10.1016/S1352-2310(01)00529-5 |
| [40] |
Chen JA, Wan GJ, Xu JY. Sediment particle sizes and the dry-humid transformation of the regional climate in Erhai Lake. Acta Sedimentologica Sinica, 2000, 18(3): 341-345. [陈敬安, 万国江, 徐经意. 洱海沉积物粒度记录与气候干湿变迁. 沉积学报, 2000, 18(3): 341-345.] |
| [41] |
Freeman C, Evans CD, Monteith DT et al. Export of organic carbon from peat soils. Nature, 2001, 412(6849): 785. DOI:10.1038/35090628 |
| [42] |
Liu YY, Chen GJ, Meyer-Jacob C et al. Land-use and climate controls on aquatic carbon cycling and phototrophs in Karst Lakes of southwest China. Science of the Total Environment, 2021, 751: 141738. DOI:10.1016/j.scitotenv.2020.141738 |
| [43] |
Kalff J. Limnology: Inland water ecosystems. New Jersey: Prentice Hall, 2002.
|
| [44] |
Guo XC, Potito AP, Luo L et al. Twentieth century human and climate impacts on a large mountain lake in southwest China. Hydrobiologia, 2013, 718(1): 189-206. DOI:10.1007/s10750-013-1615-5 |
| [45] |
Wilhelm S, Adrian R. Impact of summer warming on the thermal characteristics of a polymictic lake and consequences for oxygen, nutrients and phytoplankton. Freshwater Biology, 2008, 53(2): 226-237. DOI:10.1111/j.1365-2427.2007.01887.x |
| [46] |
Paul RJ, Lamkemeyer T, Maurer J et al. Thermal acclimation in the microcrustacean Daphnia: A survey of behavioural, physiological and biochemical mechanisms. Journal of Thermal Biology, 2004, 29(7/8): 655-662. DOI:10.1016/j.jtherbio.2004.08.035 |
| [47] |
Nevalainen L, Luoto TP. Faunal (Chironomidae, Cladocera) responses to post-Little Ice Age climate warming in the high Austrian Alps. Journal of Paleolimnology, 2012, 48(4): 711-724. DOI:10.1007/s10933-012-9640-3 |
| [48] |
Samchyshyna L, Hansson LA, Christoffersen K. Patterns in the distribution of Arctic freshwater zooplankton related to glaciation history. Polar Biology, 2008, 31(12): 1427-1435. DOI:10.1007/s00300-008-0482-4 |
| [49] |
Zhu QS, Kong LY, Chen L et al. Spatial distribution of cladoceran assemblages in surface sediments of shallow lakes in Yunnan. Chinese Journal of Applied Ecology, 2018, 29(9): 3111-3119. [朱庆生, 孔令阳, 陈丽等. 浅水湖泊表层沉积物记录的枝角类群落空间分布特征. 应用生态学报, 2018, 29(9): 3111-3119. DOI:10.13287/j.1001-9332.201809.032] |
| [50] |
DeSellas AM, Paterson AM, Sweetman JN et al. Cladocera assemblages from the surface sediments of south-central Ontario (Canada) lakes and their relationships to measured environmental variables. Hydrobiologia, 2008, 600(1): 105-119. DOI:10.1007/s10750-007-9180-4 |
| [51] |
Korosi JB, Smol JP. Distribution of cladoceran assemblages across environmental gradients in Nova Scotia (Canada) lakes. Hydrobiologia, 2011, 663(1): 83-99. DOI:10.1007/s10750-010-0556-5 |
| [52] |
Słowiński M, Zawiska I, Ott F et al. Differential proxy responses to late Allerød and early Younger Dryas climatic change recorded in varved sediments of the Trzechowskie palaeolake in Northern Poland. Quaternary Science Reviews, 2017, 158: 94-106. DOI:10.1016/j.quascirev.2017.01.005 |
| [53] |
Kultti S, Nevalainen L, Luoto TP et al. Subfossil chydorid (Cladocera, Chydoridae) ephippia as paleoenvironmental proxies: Evidence from boreal and subarctic lakes in Finland. Hydrobiologia, 2011, 676(1): 23-37. DOI:10.1007/s10750-011-0869-z |
| [54] |
Harmsworth RV. The developmental history of blelham tarn (england) as shown by animal microfossils, with special reference to the Cladocera. Ecological Monographs, 1968, 38(3): 223-241. DOI:10.2307/1942429 |
| [55] |
Bigler C, Heiri O, Krskova R et al. Distribution of diatoms, chironomids and Cladocera in surface sediments of thirty mountain lakes in south-eastern Switzerland. Aquatic Sciences, 2006, 68(2): 154-171. DOI:10.1007/s00027-006-0813-x |
| [56] |
Lotter AF, Hofmann W et al. Modern diatom, Cladocera, chironomid, and chrysophyte cyst assemblages as quantitative indicators for the reconstruction of past environmental conditions in the Alps. Ⅱ. Nutrients. Journal of Paleolimnology, 1998, 19(4): 443-463. DOI:10.1023/A:1007994206432 |
| [57] |
Korhola A. Distribution patterns of Cladocera in subarctic Fennoscandian Lakes and their potential in environmental reconstruction. Ecography, 1999, 22(4): 357-373. DOI:10.1111/j.1600-0587.1999.tb00573.x |
| [58] |
de Eyto E, Irvine K. The response of three chydorid species to temperature, pH and food. Hydrobiologia, 2001, 459: 165-172. DOI:10.1023/A:1012585217667 |
| [59] |
Schindler DW, Kling H, Schmidt RV et al. Eutrophication of Lake 227 by addition of phosphate and nitrate: The second, third, and fourth years of enrichment, 1970, 1971, and 1972. Journal of the Fisheries Research Board of Canada, 1973, 30(10): 1415-1440. DOI:10.1139/f73-233 |
| [60] |
Klausmeier CA, Litchman E, Daufresne T et al. Optimal nitrogen-to-phosphorus stoichiometry of phytoplankton. Nature, 2004, 429(6988): 171-174. DOI:10.1038/nature02454 |
| [61] |
胡竹君. 青藏高原东南缘高山湖泊生态变化与驱动机制[学位论文]. 南京: 中国科学院南京地理与湖泊研究所, 2013.
|
| [62] |
Sterner RW, Hagemeier DD, Smith WL et al. Phytoplankton nutrient limitation and food quality for Daphnia. Limnology and Oceanography, 1993, 38(4): 857-871. DOI:10.4319/lo.1993.38.4.0857 |
 2023, Vol. 35
2023, Vol. 35 

