(2: 中国环境科学研究院, 湖泊水污染治理与生态修复技术国家工程实验室, 北京 100012)
(2: National Engineering Laboratory for Lake Pollution Control and Ecological Restoration, Chinese Research Academy of Environmental Sciences, Beijing 100012, P.R. China)
近年来,富营养化湖泊中蓝藻水华问题愈发普遍,随之带来的环境、社会与经济问题也更加严重,这引起了人们的广泛关注[1]。蓝藻水华会增加氧气消耗,这可能导致湖体局部缺氧和鱼类死亡[2-3]。蓝藻水华还会阻止光线透过水面,抑制底栖初级生产者活动,从而可能对依赖湖底生境的食物网产生不利影响[4]。蓝藻水华导致水质恶化不仅会使当地渔业减少和水处理成本增加,还会对湖泊景观效应产生负面影响[5]。除了上述更广泛的生态影响外,蓝藻最重要的危害之一是会产生一系列次生代谢物,包括肝毒素、神经毒素和皮肤毒性化合物[6]。微囊藻毒素(Microcysins,MCs)是一类环状七肽类肝毒素,其广泛产生于蓝藻水华污染的水体中。由于对蛋白磷酸酶活性的强烈抑制作用以及肝脏肿瘤促进作用,MCs不仅会对水生生物产生毒害作用,还可能通过饮用水和食物链的生物富集危害人类健康[7-8]。在已经发现的上百种MCs的同分异构体中,MC-LR、MC-RR和MC-YR(L、R和Y分别代表亮氨酸、精氨酸和酪氨酸)是最受人们关注的,其中又以MC-LR的毒性较强[9]。
MCs的产生受多种环境因子影响,包括非生物因子如营养盐[10]、水力条件、光照和温度[11],以及生物因子如藻类生物量等[12-13]。大量野外和实验室研究考察了环境因素对MCs浓度的影响,其中总氮(TN)、总磷(TP)和浮游植物生物量等是最重要的。例如:低N∶P比值有利于产毒微囊藻菌株的生长;高N∶P比值和溶解性总磷浓度较低的湖泊区域的MCs毒性相对较小[14]。Horst等[15]在野外调查分析铜绿微囊藻的MCs浓度与硝酸盐呈正相关关系,也证明了N限制导致纯培养实验中铜绿微囊藻MCs浓度的减少。Lee等[16]发现正磷酸盐是影响有毒和无毒蓝藻丰度以及细胞内MCs浓度的主要环境变量。王敏等[17]在洋河水库调查发现产毒微囊藻种群丰度及其比例是影响MCs浓度变化的主要因子,且其与TP和Chl.a浓度呈显著正相关(P<0.01)。因此,环境中非生物与生物因子均会对MCs的产生与毒性造成影响。在这种复杂的综合作用下,MCs在不同湖泊流域中的时空分布特征与环境风险会存在较大的变化。相对于低海拔地区的湖泊,高原湖泊具有气温低、辐射强等特点,对研究MCs污染特征与影响因素具有重要意义。
杞麓湖是云南九大高原湖泊之一,流域处于典型的高原湖盆地,中部为湖泊,湖周为平坝区。杞麓湖作为悬挂式湖泊,自然生态在空间上呈环状分布,系统高度封闭,先天脆弱[18]。由于杞麓湖处于流域最低位置,是流域污染物的积聚地,工业废水、生活污水和农田灌溉向湖体输入物质大大增加其污染负荷[19]。早在1980s初已进入富营养化状态,近年来水质不断恶化,营养水平持续增加,到2019年,已经成为全国营养状态第二高、云贵湖区营养状态最高的典型富营养化湖泊[20]。得益于云南地区四季如春的气候特征,秋季流域内浮游植物的密度相对较高,因此相对国内其他湖泊,杞麓湖的MCs污染可能具有独特的季节污染特征;同时杞麓湖流域秋冬季多雨,其作为典型的高原富营养化封闭性湖泊,大量污染物通过地表径流、农业径流等方式经主要入湖河流汇入杞麓湖造成污染,可能具有明显的空间特征。尽管已有学者调查了杞麓湖的整体浮游生物群落,但尚无研究MCs污染情况与环境因子对MCs的潜在影响,也缺乏MCs的健康风险评价。因此本研究的目的为:(1)确定总MCs及其主要异构体的来源与时空分布特征;(2)分析MCs与环境因子的相关性;(3)评估杞麓湖MCs的潜在健康风险。以期为杞麓湖水生态安全和科学治理提供依据,助力推动高原湖泊水生态健康保护。
1 材料和方法 1.1 研究区域概况与采样点位杞麓湖(24°4′36″~24°14′2″N,102°33′48″~102°52′36″E)位于云南省中部,隶属玉溪市通海县,是云南省九大高原湖泊之一。杞麓湖流域面积354.22 km2,湖面海拔1796.62 m,湖泊湖面面积37.26 km2,最大水深6.8 m,平均水深4.5 m,湖泊容积1.83×108 m3,湖岸线长42 km,属珠江流域西江水系,是珠江水系上源海拔最高的湖泊之一[21]。杞麓湖位于流域中部稍偏东北,为流域内地表径流汇集的中心地,流域内产水主要来源于陆地产流和湖面降雨,多年平均产水量11700万m3,包括陆面产流量8430万m3和湖面降雨量3270万m3[22]。
杞麓湖藻华暴发一般在6-8月,秋季浮游植物密度达到最高,同时秋季为雨季,外源污染负荷较重,MCs是细胞内合成毒素,待细胞裂解后即释放入水体中,表现出毒性,考虑到杞麓湖流域可能存在的独特季节污染特征,因此本研究重点针对9月和11月进行采样,考虑湖泊面积与主要入湖河流情况(纳入监测考核的7条:红旗河、中河、者湾河、大新河、白渔河、窑沟、万家大沟),共设置10个采样点(图 1),分别为S1(马家湾)、S2(湖心)、S3(湖管站)、S4(大新河入湖口)、S5(白鱼河入湖口)、S6(窑沟入湖口)、S7(中河入湖口)、S8(万家大沟入湖口)、S9(红旗河入湖口)和S10(者湾河入湖口)。
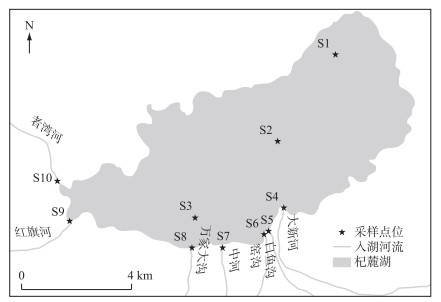
|
图 1 杞麓湖采样点示意图 Fig.1 Location of sampling sites of Lake Qilu |
使用YSI多功能水质参数仪原位测定各点位的pH、溶解氧(DO)、透明度(SD)等指标,按照《湖泊富营养化调查规范》,每个点位采集200 mL水样用于常规水质检测,主要包括高锰酸盐指数(CODMn)、化学需氧量(COD)、总磷(TP)、氨氮(NH3-N)、总氮(TN)、叶绿素a(Chl.a)等指标[23]。
1.2.2 浮游植物定性样品采集:用25号浮游生物网在水面以下约0.5 m处以“∞”字形反复划动,将采集到的样品转移至50 mL的采样瓶中并加入4%甲醛固定。定量样品采集:在水面以下约0.5 m处取1 L表层水样,加入15 mL鲁哥试剂,静止48 h后,使用虹吸法将水样浓缩至50 mL。依据《中国淡水藻类——系统、分类及生态》,在光学显微镜下对浮游植物进行鉴定和计数。浮游植物生物量的计算采用体积法,根据形态相近似的几何体积公式计算而得[24]。
1.2.3 藻毒素采集1 L水样用真空泵经过1.2 μm玻璃纤维滤膜(GF/C)过滤后分为滤液和滤膜两部分,滤膜中颗粒物质用于测定胞内MCs(IMCs),滤液则用于测定胞外MCs(EMCs)。EMCs:1 L滤液通过HLB固相萃取柱(6 cc,200 mg)进行富集,萃取柱分别先后用5 mL分析纯甲醇和5 mL去离子水活化调节,然后将1 L滤液分次加入进行过滤富集,富集好的萃取柱用15 mL 5%(v/v)的甲醇溶液淋洗,最后再10 mL 100%的甲醇溶液洗脱,用离心管收集洗脱液。将收集的洗脱液用氮吹仪吹干,残留物用100%甲醇溶解定容至1 mL,转移至EP离心管,冷冻保存,待测。IMCs:将GF/C滤膜冷冻干燥,剪碎滤膜置于50 mL离心管中,加入5 mL 5%的乙酸,接着超声粉碎5 min,然后在4℃条件下以10000转/min离心15 min得到上清液,吸取上清液,重复以上步骤3次,收集上清液等待下一步固相萃取。3次得到的上清液中MCs固相萃取及后续实验步骤方法同上述水体中EMCs的提取。
采用超高效液相色谱(H-Class,Waters,USA)串联三重四极杆质谱(XEVO-TQD,Waters,USA)色谱柱:Acquity UPLC BEH C18(100 mm×1 mm,1.7 μm)测定MC-LR、MC-YR和MC-RR的浓度。液相色谱: 流动相为含1%甲酸(A)和乙腈(B)的蒸馏水,流动相梯度洗脱流程为:0~0.5 min,B的比例从0%增加到25%;0.5~4.0 min,B的比例从25%增加到60%;在0.1 min内B的比例降至25%,4.1~6.0 min保持不变。流速为0.3 μL/min,进样量为10 μL。3种MC同源物的校准范围(R2≥0.99)为0~200 μg/L,MC标准品均购买自Sigma-Aldrich(≥95%,München,德国)。
1.3 数据分析与统计 1.3.1 水质营养状态分析应用综合营养状态指数(TLI)评价水质营养状态:
| $ T L I(\Sigma)=\sum\limits_{j=1}^m W_j \cdot T L I(j) $ | (1) |
式中,TLI(Σ)为综合营养状态指数;j为具体参数,包括Chl.a、TP、TN、SD和CODMn;Wj为第j种参数的营养状态指数的相关权重;TLI(j)为第j种参数的营养状态指数。TLI(Σ)<30为贫营养, 30≤TLI(Σ)≤50为中营养, 50<TLI(Σ)≤60为轻度富营养, 60<TLI(Σ)≤70为中度富营养, TLI(Σ)>70为重度富营养。
1.3.2 浮游植物分析将浮游植物的优势度≥0.02的种类作为该水域的优势种类。优势度(Y)计算公式为:
| $ Y=f_i \cdot n_i / N $ | (2) |
式中,ni为第i种的个体数量(cells/L);N为某点位总生物数量(cells/L);fi为某种生物的出现频率(%)。
1.3.3 风险评价方法参照优化的USEPA推荐的模型,采用风险熵值法(HQ)评估杞麓湖及主要入湖河口水体中MCs对人体的非致癌健康风险大小,计算公式为:
| $ H Q=C D I / R f D $ | (3) |
式中,CDI为长期日摄入剂量(μg/(kg·d));RfD为最大暴露参考剂量(μg/(kg·d)),在未规定RfD时可用日容许摄入量(TDI)代替,因此取值为0.04 μg/kg。经口饮用方式暴露时的CDI可按下式计算:
| $ C D I=C_{\text {water }} \cdot I R / B W $ | (4) |
式中,CDI为污染物经口的摄入剂量(μg/(kg·d)),Cwater为饮用水MCs的浓度(μg/L),IR为饮水摄入量(L/d),取值1.85 L/d,BW为体重(kg),取值60.6 kg。由于MCs不同异构体的毒性不同,因此在估算人体通过水产品摄入MCs的健康风险时,按照不同异构体对生物的半致死剂量的比例,将MC-RR和MC-YR分别换算为0.2和0.4倍的MC-LR。因此,Cwater=CMC-LR+CMC-RR×0.2+CMC-YR×0.4。具体方法参照丁剑楠等[25]和葛思敏[26]文献中的描述。按照风险等级,MCs的非致癌健康风险分为5个等级:HQ≤0.03为极低风险,0.03<HQ≤0.71为低风险,0.71<HQ≤1为中风险,1<HQ≤2.86为高风险,HQ>2.86为极高风险。
1.3.4 统计分析本研究中除pH外,其他藻毒素、影响因子等数据都经过lg(X+1)转换用于相关性分析,采用R 4.2.3软件绘制Heatmap图,分析杞麓湖MCs浓度与浮游植物、理化指标等参数的相关关系。单因素方差分析等数据统计分析由SPSS 22软件完成。使用Origin 2022软件绘图。
2 结果 2.1 水质指标与生物因子变化特征杞麓湖表层水中常规水质pH无明显季节差异,空间分布存在一定规律,湖内pH高于入湖口,整体呈弱碱性;溶解氧浓度范围为3.2~10.8 mg/L,最高值出现在秋季湖内点位,最低值出现在冬季入湖口。综合营养状态指数均值分别为65.84(秋季)和59.04(冬季),属于轻度-中度富营养状态。营养盐CODMn、COD、TP、NH3-N和TN等浓度呈现明显的时空分布特征:季节上CODMn浓度最高值(18.1 mg/L)出现在秋季,最低值(7.0 mg/L)出现在冬季,秋季CODMn平均浓度高于冬季;空间上,入湖口CODMn平均浓度高于湖内。COD浓度范围为17.0~74.0 mg/L,秋季COD平均浓度高于冬季;秋季浓度空间分布为湖内>入湖口,而冬季相反。TP浓度时空分布特征为秋季>冬季,最高值为0.92 mg/L(秋季),最低值为0.03 mg/L(冬季),空间上:入湖口>湖内,NH3-N、TN与TP呈现相同的时空分布特征。生物因子中Chl.a平均浓度秋季(0.10 mg/L)高于冬季(0.03 mg/L),最高值为0.14 mg/L,最低值为0.01 mg/L。藻类密度(3.70×106~12.01×107 cells/L)和微囊藻密度(1.20×104~7.68×107 cells/L)均呈现秋季高于冬季的特征,空间分布上秋季湖内藻类密度高于入湖口,冬季相反(表 1)。
| 表 1 杞麓湖各水质与生物指标的时空变化 Tab. 1 Temporal-spatial variations of water quality and biological indexes in Lake Qilu |
杞麓湖共检出浮游植物153种,隶属于8门84属,其中绿藻门(38属86种)占浮游植物总种类数的56.2%,蓝藻门(17属23种)和硅藻门(15属22种)分别占浮游植物总种类数的15.0%和14.4%,裸藻门(7属12种)占总种类数的7.8%,隐藻门(2属4种)占总种类数的2.6%,金藻门(3属3种)占总种类数的2.0%,甲藻门(2属2种)占总种类数的1.3%,黄藻门(1属1种)仅占总种类数的0.7%。从种类数的季节变化来看,冬季(121种)>秋季(118种)。从种类数的空间变化来看,S9点位(60种)>S8(54种)>S2(52种)=S10(52种)>S4(48种)>S3(46种)=S7(46种)>S5(44种)>S1(35种)>S6(29种),湖内藻类种类数空间分布差异小于入湖口之间藻类空间分布差异。
杞麓湖秋季与冬季蓝藻平均细胞密度明显高于其他藻类,占总密度的87.5%和60.8%,为主要优势类群。10个采样点位秋季和冬季浮游植物的平均密度分别为5.22×107和2.24×107 cells/L,细胞密度分别介于(0.37~12.01)×107和(1.28~3.91)×107 cells/L之间,其中秋季最高值在S10点位,最低值在S4点位,冬季最高值在S4点位,最低值在S1点位。10个采样点位秋季和冬季浮游植物的生物量分别介于1.11~6.57和0.81~12.21 mg/L之间,平均生物量分别为3.75和3.49 mg/L。秋季蓝藻平均生物量高于其他藻类,占总生物量的52.5%,其中最高值出现在S10点位,最低值出现在S4点位。冬季S4和S10点位硅藻生物量较高,使得平均生物量高于其他藻类,占总生物量的53.0%,最高值出现在S4点位,最低值出现在S1点位(图 2)。
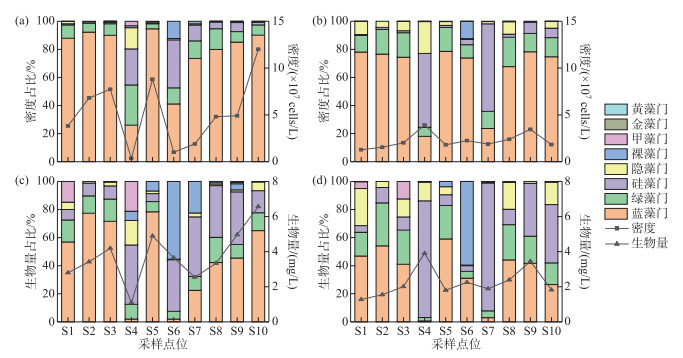
|
图 2 杞麓湖浮游植物密度(a:秋季;b:冬季)和生物量(c:秋季;d:冬季)的时空分布 Fig.2 Temporal-spatial distribution of phytoplankton density (a: autumn; b: winter) and biomass (c: autumn; d: winter) in Lake Qilu |
杞麓湖秋季湖内与主要入湖口浮游植物优势种共3种(图 3a),分别为微囊藻(Microcystis spp.)、假鱼腥藻(Pseudanabaena spp.)和四尾栅藻(Scenedesmus quadricauda)。微囊藻为第一优势种,优势度为0.70,平均细胞密度为3.64×107 cells/L,在S10点位占比最高;假鱼腥藻(Pseudanabaena spp.)第二优势种,平均细胞密度为5.70×106 cells/L,优势度为0.10,同样在S10点位占比最高。冬季浮游植物优势种共7种,分别为微囊藻、小环藻(Cyclotella spp.)、颤藻(Oscillatoria spp.)、隐球藻(Aphanocapsa sp.)、四尾栅藻、尖尾蓝隐藻(Chroomonas acuta)和隐藻(Cryptomonas spp.)(图 3b)。与秋季相同,微囊藻仍为第一优势种,优势度为0.33,平均细胞密度为7.50×106 cells/L,在S9点位占比最高;小环藻为第二优势种,平均细胞密度为3.60×106 cells/L,优势度为0.16,在S4点位占比最高。
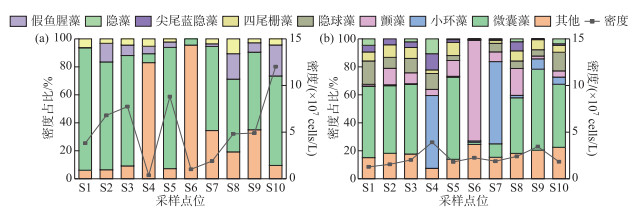
|
图 3 杞麓湖浮游植物优势种的时空分布(a:秋季;b:冬季) Fig.3 Temporal-spatial distribution of dominant phytoplankton species in Lake Qilu (a: autumn; b: winter) |
杞麓湖秋季总MCs浓度范围为0.05~23.54 μg/L,平均值为6.46 μg/L,湖内总MCs浓度平均值(12.15 μg/L)显著高于入湖河口(4.02 μg/L),其中,入湖口内总MCs浓度差异明显,S10点位高达23.54 μg/L,其次为S9(2.89 μg/L),其余入湖口的总MCs浓度均处于较低水平(<1 μg/L)。冬季总MCs浓度范围为0.05~0.46 μg/L,平均值为0.24 μg/L,湖内总MCs浓度范围为0.08~0.20 μg/L,平均值为0.13 μg/L。其中,S1点位总MCs浓度最高(0.20 μg/L),其次为S2(0.10 μg/L)。7个主要入湖河口的总MCs浓度范围为0.05~0.53 μg/L,平均值为0.29 μg/L,冬季湖泊总MCs浓度整体处于较低水平。3种异构体(MC-LR、MC-RR、MC-YR)在秋季与冬季均有检出,检出率均为100%。其中,秋季占比最高的为MC-RR,占比为31.29%~72.45%,浓度范围为0.01~15.26 μg/L,其次为MC-LR,占比为24.59%~59.33%,浓度范围为0.05~23.54 μg/L。冬季占比最高的为MC-LR,占比为26.22%~75.61%,浓度范围为0.02~0.38 μg/L,其次为MC-RR,占比为19.81%~71.02%,浓度范围为0.03~0.32 μg/L(图 4)。
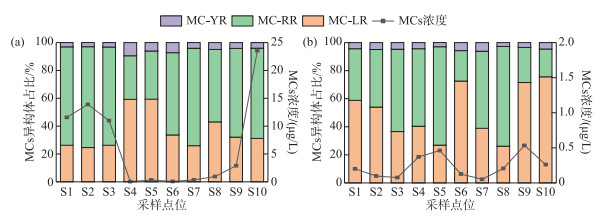
|
图 4 杞麓湖微囊藻毒素浓度及其异构体占比(a:秋季;b:冬季) Fig.4 Concentration of microcystin and proportion of isomers in Lake Qilu (a: autumn; b: winter) |
秋季EMCs浓度范围为0.01~0.20 μg/L,平均值为0.06 μg/L,IMCs浓度范围为0.004~23.54 μg/L,平均值为6.41 μg/L(图 5)。IMCs浓度水平显著高于EMCs(约116倍),说明秋季蓝藻等浮游植物大量繁殖,细胞内产生的毒素大量累积。冬季EMCs浓度范围为0.03~0.28 μg/L,平均值为0.09 μg/L,IMCs浓度范围为0.04~0.45 μg/L,平均值为0.15 μg/L,IMCs浓度水平为EMCs的1.67倍。因此,EMCs季节上呈冬季高于秋季的趋势,而IMCs呈秋季高于冬季的趋势。空间上,杞麓湖秋季南岸入湖河口S4~S8表层水中EMCs平均浓度(0.10 μg/L)高于湖内(0.01 μg/L)和西岸河口(0.01 μg/L),浓度最高值出现在南岸S8点位。冬季则呈南岸河口(0.11 μg/L)>西岸河口(0.08 μg/L)>湖内(0.06 μg/L),浓度最高值出现在南岸S4点位。IMCs秋季空间分布为西岸河口(13.20 μg/L)>湖内(12.14 μg/L)>南岸河口(0.25 μg/L),而冬季为西岸河口(0.31 μg/L)>南岸河口(0.13 μg/L)>湖内(0.06 μg/L),两个季节浓度最高值也均位于西岸河口,分别为S8(秋季23.54 μg/L)和S9(冬季0.45 μg/L)。
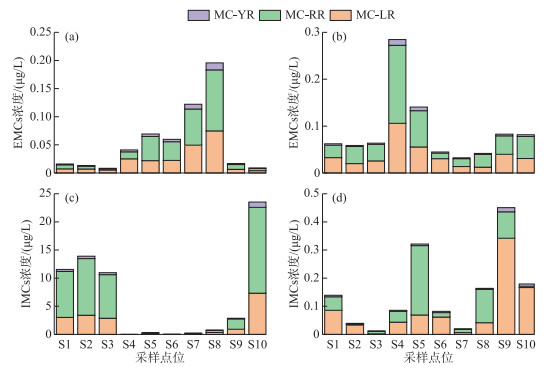
|
图 5 胞内与胞外微囊藻毒素异构体浓度的时空分布(a、c:秋季;b、d:冬季) Fig.5 Temporal-spatial distribution of intracellular and extracellular microcystin isomers (a, c: autumn; b, d: winter) |
EMCs异构体(EMC-YR、EMC-RR和EMC-LR)呈现明显的时空差异。季节上,EMC-RR和EMC-LR平均浓度均为秋季高于冬季,EMC-YR为冬季高于秋季。秋季EMC-RR和EMC-LR的平均浓度占比接近,分别为45.52%和45.93%,EMC-YR占比最低(8.55%),而冬季3种异构体的比例有所变化,EMC-RR占比升高(52.09%),EMC-LR和EMC-YR占比分别下降至42.96%和4.94%。空间上,3种异构体秋季和冬季浓度分布均为南岸河口>西岸河口>湖内。IMCs的3种异构体(IMC-YR、IMC-RR和IMC-LR)时空差异更为显著。季节上,3种异构体平均浓度均为秋季高于冬季。秋季IMC-RR平均浓度占比最高(61.50%),IMC-LR和IMC-YR占比分别为32.44%和6.06%,冬季IMC-LR占比最高为53.59%,IMC-RR占比降低至41.78%,IMC-YR占比仅为4.92%。空间上,3种异构体秋季浓度分布均为西岸河口>湖内>南岸河口,而冬季IMC-LR和IMC-YR为西岸河口>南岸河口>湖内,IMC-RR最高值则出现在南岸河口(S5),浓度分布呈现南岸河口>西岸河口>湖内。
2.4 微囊藻毒素与环境因子的关系杞麓湖MCs浓度与浮游植物、理化指标等参数的相关关系如图 6所示。环境因子从聚类分析上被归为了5类:CODMn单独为一类,COD、TP和NH3-N为一类,TN、pH和DO为一类,Chl.a与藻毒素归为一类,浮游植物参数浮游植物密度(PD)、微囊藻密度(MD)、蓝藻密度(CD)与蓝藻生物量(CB)被归为一类。TMCs、IMCs和EMCs三者呈极显著正相关(P<0.01),藻毒素与环境因子的相关关系基本保持一致。TMCs、IMCs和EMCs三者与PD、MD、CD和CB呈显著正相关关系(P<0.05),与TP、NH3-N和TN呈显著的负相关关系(P<0.05),与pH、DO和Chl.a呈正相关关系,与COD和CODMn基本无相关性。4个浮游植物参数PD、MD、CD与CB之间均两两极显著正相关(P<0.01)。
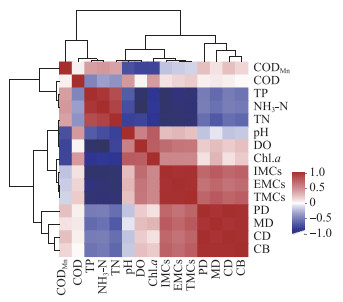
|
图 6 微囊藻毒素及不同环境因子之间的相关关系热图 (PD-浮游植物密度,MD-微囊藻密度,CD-蓝藻密度,CB-蓝藻生物量) Fig.6 Heat map of correlation between microcystin and different environmental factors (PD-phytoplankton density; MD-Microcystis density; CD-cyanobacteria density; CB-cyanobacteria biomass) |
杞麓湖3种EMCs的人体健康风险评价值计算结果显示(图 7),在研究期内,秋季EMCs健康风险指数范围为0.004~0.077,平均值为0.023,总体处于极低和低风险等级,最高值出现在S8点位,其次为S7点位。其中,EMC-LR的健康风险指数范围为0.003~0.057,贡献EMCs风险指数的67.90%~87.38%,其次为EMC-RR,最后为EMC-YR。冬季EMCs健康风险指数范围为0.014~0.110,平均值为0.037,均为极低和低风险等级,但整体风险水平高于秋季,最高值出现在S4点位。EMC-LR的健康风险指数范围为0.009~0.042,贡献EMCs风险指数的66.19%~89.99%,其次为EMC-RR,最后为EMC-YR。

|
图 7 杞麓湖水体胞外微囊藻毒素对人体非致癌风险指数 Fig.7 Non-carcinogenic risk index of extracellular microcystin in Lake Qilu |
研究结果显示,微囊藻为杞麓湖秋冬季节的第一优势种属,在MCs与环境因子的相关性分析中也发现微囊藻与TMCs、EMCs和IMCs呈极显著正相关关系,可能是杞麓湖流域MCs的主要贡献者,其作为典型的蓝藻优势属也已在巢湖[27]和太湖[28]等多个湖泊中发现对MCs的产生有较大贡献。值得注意的是,秋季微囊藻密度湖内/入湖河流比值为1.57,湖内原生微囊藻对MCs起主要贡献,而冬季该比值降为1.10,说明输入性微囊藻源贡献增强。这种动态变化的过程可能是受微囊藻的生长特性影响,蓝藻水华暴发后微囊藻由浮游生长转变为下沉至沉积物表面休眠[28],此时入湖河流的微囊藻输入会对湖内MCs的浓度起到促进效果。因此,秋冬季的MCs可能是来自湖内藻华暴发与入湖河流持续汇入的微囊藻的共同贡献,针对杞麓湖这类高原富营养化湖泊的MCs治理,往往需要治内源与控外源结合的治污手段才能起到最好的效果。
3.2 微囊藻毒素时空分布特征明显杞麓湖冬季总MCs的浓度水平显著低于秋季(P<0.01)。杞麓湖近年来富营养化严重,夏季藻华暴发,蓝藻大量繁殖,而随着秋季气温降低和光照减弱,藻类生长变缓,同时考虑到微囊藻的生理特点较易沉降至沉积物中休眠,因此杞麓湖MCs浓度水平自秋入冬后降低。不仅如此,杞麓湖作为高原浅水湖泊,年平均风速在2.7 m/s左右,对湖水的扰动较弱,也是有利于微囊藻沉降的一个关键因素[29]。微囊藻休眠和沉降导致冬季IMCs的大量减少,使EMCs浓度占比上升接近45%。同为高原富营养化湖泊的滇池和洱海MCs浓度也呈现秋季高于冬季的现象,与巢湖和洞庭湖等平原湖泊相比,浓度也普遍较高,冬季尤为明显[26]。值得注意的是,较浅的水深和较弱的风浪扰动同样有利于春夏微囊藻的复苏与繁殖[28],这可能是杞麓湖藻华常年暴发的重要因素之一。从藻毒素组成来看,秋季以IMCs为主,湖内的IMCs浓度占比超过99%,7条入湖河口中S9和S10点位IMCs浓度占比同样也超过99%,其MCs浓度与湖内接近,因此红旗河与者湾河可能是湖内MCs的重要输入源。袁丽娟等[30]在研究鄱阳湖MCs时也发现秋高东低的季节变化趋势,蚌湖入湖口处EMCs浓度高于其他区域。丁剑楠等[25]对太湖贡湖湾MCs分析时发现EMC/TMC接近70%,与本研究杞麓湖MCs组成差异较大,这种现象是否受高原富营养化湖泊独特的地理与环境条件影响值得进一步的研究。
杞麓湖MCs异构体的时空分布呈现一定的规律性,秋季以MC-RR为主,冬季以MC-LR为主,MC-YR一直保持较低浓度水平,这与余丽等[27]在巢湖的研究结果相似。从秋季MC-RR空间分布特征可以看出,IMC-RR在湖内与S9和S10点位的浓度及占比均高于S4~S8点位,而EMC-RR则呈现相反的分布规律。因此秋季西岸河流以IMC-RR为主,南岸河流以EMC-RR为主,可能由于红旗河与者湾河对湖泊的补给能力较强,导致大量未裂解藻类能够随水流快速输入湖内,而南岸河网多为小型河道,藻类流动性差,易大量繁殖裂解释放藻毒素。此外,有研究表明随着湖水温度与水质的变化,湖泊中本土藻类与外源输入藻类的竞争关系会发生变化[31],从杞麓湖浮游植物群落的季节性演替也发现,秋冬季节蓝藻会取代绿藻成为优势藻[20],这都会影响藻类中MCs的产生。冬季随着浓度占比较大的IMCs减少,MCs总浓度降低,杞麓湖流域MC-LR浓度水平基本一致,从MC-LR组成来看,IMC-LR平均浓度仅略高于EMC-LR。
3.3 微囊藻毒素与环境因子的相关性分析生物因子(蓝藻生物量及微囊藻密度)与营养盐(TN、TP和NH3-N)均对杞麓湖的MCs浓度水平有影响。本研究显示蓝藻生物量及微囊藻密度与MCs呈显著正相关关系,微囊藻生长对MCs浓度的上升有着促进作用。同时Chl.a和MCs的正相关关系也说明了这一点,秋季微囊藻大量繁殖,藻类生物量和Chl.a浓度增加,胞内合成的MCs浓度也升高。秋季后微囊藻逐渐停止生长,生物量下降,不利于毒素的产生,使得进入冬季后总MCs及其3种异构体的浓度均降至最低。有研究将这种生物因素引起的变化归因于环境温度的改变,不同季节水温的差异以及生物生命周期不断循环,使得MCs浓度水平产生季节差异[32]。氮、磷等营养元素对湖泊水环境中的蓝藻生长与衰亡也同样起到关键作用,相关性分析发现TN、TP和NH3-N与MCs浓度均呈现显著的负相关关系(P<0.05),说明杞麓湖流域氮、磷是MCs的限制性因素,这与袁丽娟等[30]在鄱阳湖的研究结果相同。在富营养化严重的高原湖泊滇池也发现MCs浓度与TP和TN呈显著负相关关系,其原因归结于多雨少光照的气候条件与流域内氮、磷大量排入河流的情况[33]。氮是藻类生长的必需营养元素,同时氮被认为是MCs产生的决定因素,因此藻的生长以及藻毒素的分泌均会受到氮缺乏的抑制[34]。有研究认为高浓度磷有利于微囊藻产毒,也有研究表明微囊藻的产毒能力随着磷浓度的减小而增加[16, 35]。考虑到营养盐对藻类的限制作用,在对太湖MCs研究中,Wan等[36]建议将氮、磷阈值分别限定为1.19和0.0714 mg/L进行营养控制管理,以降低MCs产生浓度较高的可能性。而Agathokleous等[37]实验发现,鉴于菌落形成以及藻毒素的产生和释放因污染物浓度小于毒理学阈值而增强的现象,低浓度污染物会刺激有害藻类生物生长并促进毒素释放。因此目前关于氮、磷营养元素对MCs的影响仍然没有一致的研究结论。
3.4 微囊藻毒素的潜在健康风险从基于EMCs数据核算的人体健康风险来看,杞麓湖湖体与7个主要入湖河口的EMCs人体非致癌健康风险处于极低或低风险水平,3种EMCs异构体中EMC-LR对风险贡献占比最大。湖内3种EMCs人体健康风险指数低于7个主要入湖口,均为极低风险水平。除S7和S8点位以外,其余点位冬季风险水平均高于秋季,S4和S5点位秋季为低风险,S7和S8点位冬季为低风险,可见杞麓湖南岸输入EMCs污染具有一定风险。有研究指出,位于云贵高原湖区的滇池和洱海相对于东部平原湖区的巢湖和洞庭湖MCs的人体健康综合风险度要高[26]。Wan等[36]对中国东部30个亚热带湖泊进行了调查,发现有28个湖泊均检出MCs,除巢湖和太湖外,其余湖泊MCs对人体健康的风险均处于中低水平。Xue等[38]对太湖MCs进行生态风险评估,发现MCs已经对淡水螺产生了显著的不良影响;虽然对人类的不良影响较弱,但儿童比成人面临的风险更大。Metcalf等[39]对佛罗里达州西海岸河湖内藻华暴发进行研究,强调了多种潜在有毒水华共存的可能性以及对人类和动物健康的可能影响。整体来看,杞麓湖EMCs的健康风险较低,但是MCs长期低剂量暴露引发的健康风险不容忽视。大量的鱼类实验表明,慢性低剂量暴露MCs表现出显著的肝脏、神经、生殖和胚胎毒性。例如,MC-LR会引发雄鱼的睾丸损伤,使性腺组织萎缩,卵黄含量降低[40];降低鱼类的先天免疫力,诱发雄性斑马鱼的免疫紊乱[41]。长期低剂量暴露于MC-LR会引起大鼠肝脏中氨基酸含量显著下降,干扰络氨酸的合成与分解代谢,影响肝脏功能[42]。流行病学研究发现MCs长期暴露严重危害人体肝脏功能。饮用水中的MCs浓度与当地原发性肝癌的发病率有很大的相关性[43]。关于通过饮用水和食用水产品方式长期慢性暴露于MCs的渔民相关研究显示,指示肝脏损伤的生化指标显著升高[44]。男性血清睾酮水平下降和生殖障碍也是MCs引发的健康问题之一[45]。此外,秋季蓝藻IMCs含量显著高于EMCs,且超过了我国地表水环境质量标准中规定的MC-LR限值(1 μg/L)。虽然高生物量和高IMCs浓度不会迅速导致MCs的大量释放,但当蓝藻细胞死亡和水华消失时,MCs会被大量释放到水中,对饮用水供应构成巨大威胁[46],因此胞内毒素释放后的健康风险仍值得持续关注。
4 结语1) 杞麓湖MCs主要贡献者为蓝藻中的微囊藻属,秋季湖内原生微囊藻对MCs起主要贡献,而从秋季进入冬季后湖内产生的MCs的占比下降,入湖河流输入的MCs对杞麓湖内TMCs的贡献增强。
2) 杞麓湖内MCs总体呈现秋高冬低的季节特征,湖内IMCs浓度在冬季受微囊藻密度下降和营养盐(TN、TP和NH3-N)浓度增加等因素影响而显著下降是出现季节差异的主要原因,入湖河流MCs浓度季节变化不明显。MCs异构体中MC-RR在秋季占比高于MC-LR和MC-YR,而冬季MC-LR占比最高。空间上,秋季湖内MCs污染浓度高于入湖河流,而冬季相反。西岸河流入湖口IMCs平均浓度最高,EMCs平均浓度在南岸河流入湖口最高。
3) 基于人体非致癌健康风险评价发现,杞麓湖EMCs污染总体上呈极低或低风险水平,冬季风险略高于秋季。可以通过有效削减主要入湖河流营养盐的输入来降低藻华暴发的风险,同时加强藻华暴发时期的应急处理处置以降低藻毒素的释放与迁移危害。
| [1] |
Zhang YL, Qin BQ, Zhu GW. Long-term changes in physical environments and potential implications for the eco-environment of Lake Taihu in the past four decades. J Lake Sci, 2020, 32(5): 1348-1359. [张运林, 秦伯强, 朱广伟. 过去40年太湖剧烈的湖泊物理环境变化及其潜在生态环境意义. 湖泊科学, 2020, 32(5): 1348-1359. DOI:10.18307/2020.0503] |
| [2] |
Qin BQ. Shallow lake limnology and control of eutrophication in Lake Taihu. J Lake Sci, 2020, 32(5): 1229-1243. [秦伯强. 浅水湖泊湖沼学与太湖富营养化控制研究. 湖泊科学, 2020, 32(5): 1229-1243. DOI:10.18307/2020.0501] |
| [3] |
Xue QJ, Su XM, Xie LQ. Advances on cyanotoxin toxicology of zoobenthos. Acta Ecologica Sinica, 2015, 35(14): 4570-4578. [薛庆举, 苏小妹, 谢丽强. 蓝藻毒素对底栖动物的毒理学研究进展. 生态学报, 2015, 35(14): 4570-4578. DOI:10.5846/stxb201308262157] |
| [4] |
Wu TF, Qin BQ, Ma JR et al. Movement of cyanobacterial colonies in a large, shallow and eutrophic lake: A review. Chinese Science Bulletin, 2019, 64(36): 3833-3843. [吴挺峰, 秦伯强, 马健荣等. 浅水富营养化湖泊中蓝藻群体运动研究述评. 科学通报, 2019, 64(36): 3833-3843. DOI:10.1360/TB-2019-0033] |
| [5] |
Qin BQ, Gao G, Zhu GW et al. Lake eutrophication and its ecosystem response. Chin Sci Bull, 2013, 58(10): 855-864. [秦伯强, 高光, 朱广伟等. 湖泊富营养化及其生态系统响应. 科学通报, 2013, 58(10): 855-864. DOI:10.1007/s11434-012-5560-x] |
| [6] |
Li DM, Kong FX, Zhang M et al. Spatial changes in abundance of microcystin-producing and non-microcystin producing Microcystis populations in the Taihu Lake and the Chaohu Lake during cyanobacterial bloom period. Chin J Appl Environ Biol, 2011, 17(4): 480-485. [李大命, 孔繁翔, 张民等. 太湖和巢湖夏季蓝藻水华期间产毒微囊藻和非产毒微囊藻种群丰度的空间分布. 应用与环境生物学报, 2011, 17(4): 480-485. DOI:10.3724/SP.J.1145.2011.00480] |
| [7] |
Wan X, Xue QJ, Gu YR et al. Advance on combined toxicity of microcystins and other environmental pollutants. Asian Journal of Ecotoxicology, 2021, 16(2): 50-62. [万翔, 薛庆举, 顾毓蓉等. 微囊藻毒素及其与其他环境污染物的联合毒性研究进展. 生态毒理学报, 2021, 16(2): 50-62. DOI:10.7524/AJE.1673-5897.20200402001] |
| [8] |
Zhao YY, Yan YJ, Xie LQ et al. Long-term environmental exposure to microcystins increases the risk of nonalcoholic fatty liver disease in humans: A combined fisher-based investigation and murine model study. Environment International, 2020, 138: 105648. DOI:10.1016/j.envint.2020.105648 |
| [9] |
Du C, Zheng SL, Yang Y et al. Chronic exposure to low concentration of MC-LR caused hepatic lipid metabolism disorder. Ecotoxicology and Environmental Safety, 2022, 239: 113649. DOI:10.1016/j.ecoenv.2022.113649 |
| [10] |
Wang M, Shi WQ, Chen QW et al. Effects of nutrient temporal variations on toxic genotype and microcystin concentration in two eutrophic lakes. Ecotoxicology and Environmental Safety, 2018, 166: 192-199. DOI:10.1016/j.ecoenv.2018.09.095 |
| [11] |
Peng NY, Dai GF, Zhang W et al. Differences in nutrition condition and algae population in different areas of Poyang Lake. J Lake Sci, 2018, 30(5): 1295-1308. [彭宁彦, 戴国飞, 张伟等. 鄱阳湖不同湖区营养盐状态及藻类种群对比. 湖泊科学, 2018, 30(5): 1295-1308. DOI:10.18307/2018.0512] |
| [12] |
Song CY, Bai F, Li TL et al. Inhibitory effect of Scenedesmus sp. on Microcystis aeruginosa and its evaluation. Acta Hydrobiologica Sinica, 2022, 46(12): 1916-1923. [宋婵媛, 白芳, 李天丽等. 绿藻栅藻对微囊藻的抑制效应及评价. 水生生物学报, 2022, 46(12): 1916-1923. DOI:10.7541/2023.2022.0042] |
| [13] |
Bi XD, Dai W, Zhang SL et al. Research progress on the competitive advantages and formation mechanism of Microcystis colony. Environmental Science & Technology, 2014, 37(7): 41-44. [毕相东, 戴伟, 张树林等. 微囊藻群体的竞争优势及其形成机制的研究进展. 环境科学与技术, 2014, 37(7): 41-44.] |
| [14] |
Otten TG, Xu H, Qin B et al. Spatiotemporal patterns and ecophysiology of toxigenic Microcystis blooms in Lake Taihu, China: Implications for water quality management. Environmental Science & Technology, 2012, 46(6): 3480-3488. DOI:10.1021/es2041288 |
| [15] |
Horst GP, Sarnelle O, White JD et al. Nitrogen availability increases the toxin quota of a harmful Cyanobacterium, Microcystis aeruginosa. Water Research, 2014, 54: 188-198. DOI:10.1016/j.watres.2014.01.063 |
| [16] |
Lee TA, Rollwagen-Bollens G, Bollens SM et al. Environmental influence on cyanobacteria abundance and microcystin toxin production in a shallow temperate lake. Ecotoxicology and Environmental Safety, 2015, 114: 318-325. DOI:10.1016/j.ecoenv.2014.05.004 |
| [17] |
Wang M, Liu X, Chen QW et al. Spatio-temporal distribution of microcystins and microcystin-producing cells in the Yanghe Reservoir. Acta Scientiae Circumstantiae, 2017, 37(4): 1307-1315. [王敏, 刘祥, 陈求稳等. 洋河水库微囊藻毒素及产毒株种群丰度的时空分布特征. 环境科学学报, 2017, 37(4): 1307-1315. DOI:10.13671/j.hjkxxb.2016.0281] |
| [18] |
Dong YX, Liu Y, Li YX et al. Analysis on factors of ecological vulnerability of Qilu Lake in Yunnan Province. Environmental Science Survey, 2011, 30(5): 24-29. [董云仙, 刘宇, 李荫玺等. 云南杞麓湖生态脆弱因素分析. 环境科学导刊, 2011, 30(5): 24-29.] |
| [19] |
Wang WB, Guan TZ, Liang QB et al. Study on the estimation of pollution loads and water environmental capacity in Qilu Lake watershed. Environmental Pollution and Control, 2020, 42(11): 1436-1442. [王万宾, 管堂珍, 梁启斌等. 杞麓湖流域污染负荷及水环境容量估算研究. 环境污染与防治, 2020, 42(11): 1436-1442.] |
| [20] |
Yang HY, Yang S, Liu Y et al. Seasonal succession of plankton community and driving factors in hypereutrophic Qilu Lake (Yunnan-Guizhou Plateau). Research of Environmental Sciences, 2020, 33(4): 876-884. [杨鸿雁, 杨劭, 刘毅等. 云贵高原富营养化湖泊杞麓湖浮游生物群落的季节性演替及其驱动因子分析. 环境科学研究, 2020, 33(4): 876-884.] |
| [21] |
杨鸿雁. 湖泊浮游植物演替历史与流域人类活动的关系分析——以杞麓湖为例[学位论文]. 武汉: 华中师范大学, 2020.
|
| [22] |
陈异晖. 高原湖滨农业区营养盐输移转化模拟及BMP优化布局研究[学位论文]. 昆明: 云南大学, 2015.
|
| [23] |
金相灿, 屠清瑛. 湖泊富营养化调查规范: 2版. 北京: 中国环境科学出版社, 1990.
|
| [24] |
胡鸿钧, 魏印心. 中国淡水藻类——系统、分类及生态. 北京: 科学出版社, 2006.
|
| [25] |
Ding JN, Zhang SS, Wu XY et al. Spatial and temporal distribution and health risk assessment of microcystins in water of Gonghu Bay, Taihu Lake. Ecology and Environmental Sciences, 2018, 27(11): 2095-2101. [丁剑楠, 张闪闪, 武旭跃等. 太湖贡湖湾水体中微囊藻毒素的时空分布及健康风险评估. 生态环境学报, 2018, 27(11): 2095-2101.] |
| [26] |
葛思敏. 重点湖泊微囊藻毒素时空分布特征及综合健康风险评估[学位论文]. 北京: 中国环境科学研究院, 2021.
|
| [27] |
Yu L, Zhu GW, Kong FX et al. Spatiotemporal characteristics of microcystin variants composition and associations with environmental parameters in Lake Chaohu, China. J Lake Sci, 2019, 31(3): 700-713. [余丽, 朱广伟, 孔繁翔等. 巢湖微囊藻毒素异构体组成的时空分布特征及影响因子. 湖泊科学, 2019, 31(3): 700-713. DOI:10.18307/2019.0309] |
| [28] |
Shu XB, Xie LQ, Wan X et al. Vertical distribution characteristics of microcystin concentration in water and sediment of Meiliang Bay, Lake Taihu. J Lake Sci, 2019, 31(4): 976-987. [舒秀波, 谢丽强, 万翔等. 太湖梅梁湾水体及沉积物中微囊藻毒素含量垂向分布特征. 湖泊科学, 2019, 31(4): 976-987. DOI:10.18307/2019.0426] |
| [29] |
Zhao XH, Wu WW, Tian J. Research on ecological restoration and returning the pond back to the lake engineering in Qiluhu Lake of Tonghai. Environmental Science Survey, 2009, 28(1): 41-44. [赵祥华, 吴文卫, 田军. 通海杞麓湖退塘还湖及生态修复工程研究. 环境科学导刊, 2009, 28(1): 41-44.] |
| [30] |
Yuan LJ, Liao QG, Zhang L et al. Seasonal and spatial variations of microcystins and their relationships with physiochemical and biological factors in Poyang Lake. Environmental Science, 2018, 39(1): 450-459. [袁丽娟, 廖且根, 张莉等. 鄱阳湖微囊藻毒素时空分布格局及其与理化和生物因子的关系. 环境科学, 2018, 39(1): 450-459. DOI:10.13227/j.hjkx.201708227] |
| [31] |
Savadova-Ratkus K, Mazur-Marzec H, Karosiené J et al. Interplay of nutrients, temperature, and competition of native and alien cyanobacteria species growth and cyanotoxin production in temperate lakes. Toxins, 2021, 13(1): 23. DOI:10.3390/toxins13010023 |
| [32] |
Layden TJ, Kremer CT, Brubaker DL et al. Thermal acclimation influences the growth and toxin production of freshwater cyanobacteria. Limnology and Oceanography Letters, 2022, 7(1): 34-42. DOI:10.1002/lol2.10197 |
| [33] |
Pan XJ, Chang FY, Shen YW et al. The correlation between the variation of microcystin content and environment factors in Dianchi Lake. J Lake Sci, 2006, 18(6): 572-578. [潘晓洁, 常锋毅, 沈银武等. 滇池水体中微囊藻毒素含量变化与环境因子的相关性研究. 湖泊科学, 2006, 18(6): 572-578. DOI:10.18307/2006.0603] |
| [34] |
Dai RH, Wang PF, Jia PL et al. A review on factors affecting microcystins production by algae in aquatic environments. World Journal of Microbiology and Biotechnology, 2016, 32(3): 51. DOI:10.1007/s11274-015-2003-2 |
| [35] |
Zhang W, Lin YQ, Guo DF et al. Influence of different nitrogen and phosphorus concentrations on growth, photosynthesis and microcystin production of Microcystis aeruginosa. Acta Hydrobiologica Sinica, 2006, 30(3): 318-322. [张玮, 林一群, 郭定芳等. 不同氮、磷浓度对铜绿微囊藻生长、光合及产毒的影响. 水生生物学报, 2006, 30(3): 318-322.] |
| [36] |
Wan X, Steinman AD, Gu YR et al. Occurrence and risk assessment of microcystin and its relationship with environmental factors in lakes of the eastern plain ecoregion, China. Environmental Science and Pollution Research, 2020, 27(36): 45095-45107. DOI:10.1007/s11356-020-10384-0 |
| [37] |
Agathokleous E, Peñuelas J, Azevedo RA et al. Low levels of contaminants stimulate harmful algal organisms and enrich their toxins. Environmental Science & Technology, 2022, 56(17): 11991-12002. DOI:10.1021/acs.est.2c02763 |
| [38] |
Xue QJ, Steinman AD, Xie LQ et al. Seasonal variation and potential risk assessment of microcystins in the sediments of Lake Taihu, China. Environmental Pollution, 2020, 259(C): 113884. DOI:10.1016/j.envpol.2019.113884 |
| [39] |
Metcalf JS, Banack SA, Wessel RA et al. Toxin analysis of freshwater cyanobacterial and marine harmful algal blooms on the west coast of Florida and implications for estuarine environments. Neurotoxicity Research, 2020, 39(1): 1-9. |
| [40] |
Isabelle T, Chakib D, Hélène H et al. Pathological modifications following sub-chronic exposure of medaka fish (Oryzias latipes) to microcystin-LR. Reproductive Toxicology, 2011, 32(3): 329-340. DOI:10.1016/j.reprotox.2011.07.006 |
| [41] |
Lin W, Guo HH, Wang LK et al. Waterborne microcystin-LR exposure induced chronic inflammatory response via MyD88-dependent toll-like receptor signaling pathway in male zebrafish. Science of the Total Environment, 2020, 702: 134969. DOI:10.1016/j.scitotenv.2019.134969 |
| [42] |
He J, Chen J, Wu LY et al. Metabolic response to oral microcystin-LR exposure in the rat by NMR-based metabonomic study. Journal of Proteome Research, 2012, 11(12): 5934-5946. DOI:10.1021/pr300685g |
| [43] |
Zhou XF, Dong CH, Yu SZ. Study on hepatocarcinogenic factors in higher incidence regions of Taixing County. Modern Preventive Medicine, 1999, 26(3): 350-351. [周学富, 董传辉, 俞顺章. 泰兴地区肝癌高发因素研究. 现代预防医学, 1999, 26(3): 350-351.] |
| [44] |
Chen J, Xie P, Li L et al. First identification of the hepatotoxic microcystins in the serum of a chronically exposed human population together with indication of hepatocellular damage. Toxicological Sciences, 2009, 108(1): 81-89. DOI:10.1093/toxsci/kfp009 |
| [45] |
Wang J, Chen YB, Chen ZP et al. Microcystin-leucine arginine inhibits gonadotropin-releasing hormone synthesis in mice hypothalamus. Ecotoxicology and Environmental Safety, 2018, 163: 391-399. DOI:10.1016/j.ecoenv.2018.07.094 |
| [46] |
Zhu R, Wang H, Shen H et al. The dynamics and release characteristics of microcystins in the plateau Lake Erhai, Southwest China. Environmental Science and Pollution Research, 2021, 28(18): 23473-23481. DOI:10.1007/s11356-020-12312-8 |
 2024, Vol. 36
2024, Vol. 36 

