(2: 中国气象局生态系统碳源汇开放重点实验室, 南京 210044)
(3: 南京信息工程大学, 固碳减排与全球变化研究中心, 南京 210044)
(2: Key Laboratory of Ecosystem Carbon Source and Sequestration, China Meteorological Administration, Nanjing 210044, P.R. China)
(3: Research Center for Carbon Sequestration and Global Change, Nanjing University of Information Science and Technology, Nanjing 210044, P.R. China)
湖泊富营养化是当前最突出的水环境问题之一,水体氮素增加是导致水体富营养化主要原因之一,降低氮负荷有利于减轻富营养化程度[1]。已有研究表明,反硝化作用是水体去除氮素的重要途径之一[2],通过反硝化作用去除氮的总量约占湖泊生态系统氮输入的1%~36%[3]。由此可见,反硝化脱氮对于自然湖泊氮的去除具有重要的作用。
目前研究表明,自然水体中参与反硝化的微生物多是兼性厌氧反硝化菌,水体中沉积物和附着生物复杂的结构为反硝化微生物提供了厌氧环境,因此反硝化作用主要发生在沉积物以及附着生物中[4]。已有的研究多集中在湖泊沉积物反硝化作用[5],而对附着生物的反硝化作用关注比较少。事实上,附着生物的生物群落是由细菌、真菌、微藻以及有机、无机碎屑等构成的内部环境复杂的微型复合群落,生长在浸没于水中的各种基质表面[6]。浅水湖泊有利于沉水植物的发展,其茎叶为附着生物提供大量附着面积,附着生物附着在沉水植物表面,形成了特殊的生物-水微界面。随着水体富营养化的加剧,沉水植物上附着生物的生物量逐渐增加,附着生物群落中附着藻类及微生物的代谢活动增加了附着层的厚度,减缓氧气的扩散速率,附着生物内部发生光合作用及呼吸作用也造成茎叶表面富氧-微氧的微环境,有利于反硝化作用的发生[7-8]。研究发现,沉水植物附着层反硝化细菌丰度较沉积物反硝化细菌丰度高[9-10],且附着生物的反硝化速率与沉积物反硝化速率相当,甚至超过沉积物[4]。
附着生物的生物量及反硝化作用受到诸多因素影响,如温度、pH、可利用的有机碳、氮磷浓度、水力条件等环境因素[11-12]。氮是反硝化作用的主要底物,水体中氮的浓度被认为是反硝化作用的主要影响因素,当水体氮充足时,反硝化作用会受到有机碳、pH、溶解氧、温度、沉水植物分布及类型等因素的限制[13-14]。不同湖泊水体氮磷浓度、沉水植物分布及其他环境条件存在差异,有必要针对具体的湖泊进行沉水植物附着生物生物量及反硝化作用的研究。太湖是中国第三大淡水湖泊,流域内经济发达,人口密集。受到人类活动的影响,太湖蓝藻水华频发,富营养化严重,成为国内外重点关注的热点问题[15]。针对太湖富营养化内源治理,沿湖滨带实施了以恢复水生植物为核心的生态系统修复等工程措施[16-17]。在沉水植被大量恢复的情况下,太湖沉水植物附着生物的生物量存在怎样的变化?事实上,太湖营养盐含量空间异质性明显,不同湖区营养盐浓度、沉水植物分布情况等存在明显差异。已有研究表明,太湖水体中的反硝化作用每年可以去除接近54%的外源氮负荷[18]。有关太湖生态系统中反硝化过程的研究主要集中于沉积物[19-21],针对太湖沉水植物表面附着生物生态作用的报道较少。太湖沉水植物附着生物膜是否是湖泊生态系统反硝化作用的重要场所?太湖常见沉水植物附着生物的潜在反硝化速率(DNP)有多大?影响太湖沉水植物附着生物的生物量及潜在反硝化速率的因素有哪些?基于以上问题,本研究在沉水植物生长盛期将太湖东部沉水植物主要分布湖区作为采样区域,对太湖常见的3种沉水植物的附着生物生物量进行研究,并利用乙炔抑制法测定了沉水植物上附着生物的潜在反硝化速率,分析了太湖沉水植物附着生物的生物量及其潜在反硝化速率的主要影响因素,以期为太湖水体氮污染治理及沉水植物的科学管理提供一定的理论依据。
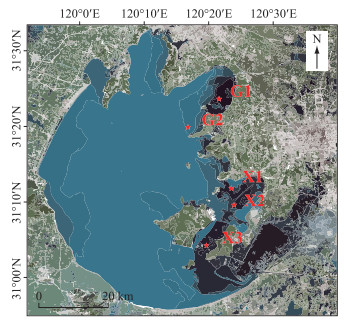
1 材料与方法 1.1 样品采集与分析在沉水植物生长盛期(7月底),根据太湖沉水植物分布及环境条件设置5个采样点(图 1)。在采样前利用便携式多参数水质分析仪(YSI 6000,USA)现场测定各采样点水体溶解氧、pH、水深、温度等指标,用赛氏盘测定采样点水体透明度,并按照《湖泊调查技术规程》[22]采集水体及沉水植物样品,每个采样点设置3个重复。在5个采样点共采集3种沉水植物(狐尾藻(Myriophyllum spicatum)、马来眼子菜(Potamogeton malaianus)、苦草(Vallisneria natans))。采集的沉水植物和水样立即低温运回实验室进行处理。
|
图 1 太湖采样点分布 Fig.1 Location of the sampling sites in Lake Taihu |
采集的水样取一定体积用于测定总氮(TN)、总磷(TP)。取一定体积的原位水经过Whatman GF/F滤膜(Φ47mm)过滤,过滤水样用于测定溶解性总氮(TDN)、溶解性总磷(TDP)、氨氮(NH3-N)、亚硝态氮(NO2--N)、硝态氮(NO3--N)、磷酸根磷(PO43--P)、溶解性有机碳(DOC)等。另取一定体积的原位水经过滤膜过滤,滤膜经过热乙醇提取后,利用分光光度法测定叶绿素a(Chl.a)。用称重过的Whatman GF/F滤膜过滤一定体积的原位水,滤膜经过105℃烘干恒重后称重计算水体悬浮物干重(DW),之后置于马弗炉经过550℃燃烧4 h后称重,计算得到水体悬浮物无灰干重(AFDM)。水体氮磷测定方法参考《水和废水监测分析方法》[23]。
用水轻轻地冲洗采集的沉水植物,用软毛刷轻轻刷洗沉水植物表面去除沉水植物表面附着物[24],将刷洗的附着液定容后用于分析附着层理化特征。附着生物DW、AFDM、Chl.a及氮磷指标的测定方法与水体相同。
1.3 潜在反硝化速率的测定使用乙炔抑制法对沉水植物及附着生物的潜在反硝化速率进行测定[25-26]。随机取各采样点长势一致的每种沉水植物约10 g(湿重),分别放入装有450 mL原位水的1 L容器中。另取一部分沉水植物使用软毛刷轻轻刷洗沉水植物茎叶,去除附着物[26],再随机取长势适中的刷洗后的沉水植物10 g(湿重)左右放入装有450 mL原位水的容器中。每种植物每个处理设置3个重复。将容器密封,黑暗条件下经过12 h预培养,预培养后向培养容器中注入175 mL氩气以保持厌氧环境,注入50 mL含硝态氮及有机碳的浓缩液(KNO3:7.21 g/L、葡萄糖:18 g/L)[11]增加底物浓度,并向容器中注入75 mL乙炔气体(乙炔压力:C2H2=0.1 atm)[3],混匀,在25℃条件下进行避光培养。开始培养时,用注射器抽取培养容器中12 mL气体注入12 mL真空顶空瓶中,用于测定N2O浓度,培养4 h后[11],轻轻摇动培养容器,抽取培养容器气体用于N2O浓度分析。培养结束后,取出沉水植物,使用叶面积仪(Yaxin-1241)对沉水植物叶面积进行测量,沉水植物经过茎叶面积测量后进行烘干,称量植物干重。
抽取顶空瓶中气体5 mL推进气相色谱仪测定N2O浓度。利用单位时间单位沉水植物体表面积N2O生成量表征沉水植物潜在反硝化速率。N2O样品浓度使用Agilent 7890B气相色谱仪进行测定,利用标气N2O浓度对仪器测得结果进行订正,并根据亨利定律计算水中溶解N2O的浓度[27],利用顶空气体和水中溶解N2O浓度之和通过下列公式计算获得沉水植物或带有附着生物的沉水植物的潜在反硝化速率:
| $ D N P=\frac{\left(c_t-c_0\right) \cdot v+\left(c_{\mathrm{w} t}-c_{\mathrm{w} 0}\right) \cdot v_{\mathrm{w}}}{s \cdot t} $ | (1) |
式中,DNP为潜在反硝化速率,μmol/(m2·h);ct为培养t时间后顶空N2O浓度,μmol/L;c0为初始容器顶空N2O浓度,μmol/L;cwt为培养t时间后水中溶解N2O浓度,μmol/L;cw0为初始容器水中溶解N2O浓度,μmol/L;v为密闭容器顶空体积,L;vw为密闭容器中水的体积,L;s为容器中沉水植物体表面积,m2;t为培养时间,h。
附着生物潜在反硝化速率计算公式为:
| $ D N P_{\mathrm{f}}=D N P_{\mathrm{c}+\mathrm{f}}-D N P_{\mathrm{qf}} $ | (2) |
式中,DNPf为附着生物潜在反硝化速率,μmol/(m2·h);DNPc+f为未除去附着物的沉水植物(沉水植物+附着生物)潜在反硝化速率,μmol/(m2·h);DNPqf为除去附着物后沉水植物(沉水植物)潜在反硝化速率,μmol/(m2·h)。
1.4 统计分析使用Excel 2019和SPSS 26软件进行数据分析,利用Origin 2021软件进行数据绘图。采用单因素方差分析(ANOVA)对数据差异显著性进行检验,P<0.05作为差异显著水平。采用Spearman相关系数(P<0.05,显著相关;P<0.01,极显著相关)判断附着生物的生物量和潜在反硝化速率与水体环境因素及附着层理化性质之间的相关关系,并通过逐步回归方法进一步选取对附着生物的潜在反硝化速率影响最显著的因子。
2 结果与分析 2.1 采样点水体理化特征太湖不同采样点水体理化特征存在一定的差异(表 1)。G1采样点水体TN、TP、TDN、TDP、DOC、COD、Chl.a及各种形态氮和磷的浓度均显著高于其他采样点(P<0.05)。G2采样点水体TN、TDN、TDP、Chl.a、COD及DOC浓度显著高于胥口湾X1、X2、X3采样点(P<0.05),但TP浓度与胥口湾3个采样点差异不大,均在0.080~0.125 mg/L之间变化。水体NH3-N、NO3--N、NO2--N及PO43--P浓度在G2采样点和胥口湾3个采样点之间没有明显的变化规律。水体中各种理化指标在胥口湾3个采样点之间存在差异,但变化规律不一致。总体来看,贡湖湾水体TN、TDN、TDP、COD、DOC、Chl.a浓度显著高于胥口湾。
| 表 1 不同采样点水体理化性质* Tab. 1 Physical and chemical properties of water at different sampling sites |
太湖沉水植物附着层理化指标存在一定差异(表 2)。所测试的沉水植物中,狐尾藻附着层中TN、TP、TDN、NH3-N、NO3--N、NO2--N、COD含量均显著高于其他沉水植物附着层对应的理化指标(P<0.05)。分析同种沉水植物不同采样点沉水植物附着层理化性质发现,贡湖湾采样点苦草及马来眼子菜附着层TN含量分别高于胥口湾各采样点对应沉水植物附着层TN含量(P<0.05),进一步分析发现,马来眼子菜附着层TP、TDN、NH3-N、NO3--N、NO2--N、COD的变化规律与附着层TN变化规律相似,即贡湖湾各采样点显著高于胥口湾采样点(P<0.05),而苦草附着层TP含量在各采样点之间无显著差异,苦草附着层DOC含量在胥口湾各采样点却显著高于贡湖湾各采样点,其原因有待进一步研究。总的来说,太湖沉水植物附着层TN、TP等理化指标变化比较复杂,随着采样点以及宿主植物类型不同存在差异,对于同种沉水植物而言,贡湖湾各采样点的沉水植物附着层TN含量均高于胥口湾各采样点。
| 表 2 单位沉水植物体表面积附着层理化性质* Tab. 2 Physical and chemical properties of epiphyton on the submerged plants |
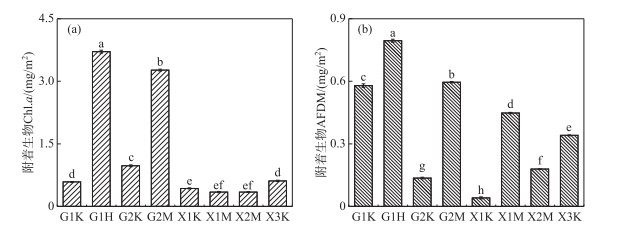
附着生物Chl.a含量常用于表征附着生物中附着藻类的生物量[28],附着生物AFDM含量常用于表征附着生物的生物量[29]。从图 2可看出,附着生物的Chl.a含量在不同采样点不同沉水植物之间存在差异。G1采样点狐尾藻附着生物的Chl.a含量最高,显著高于其他沉水植物附着生物的Chl.a含量(P<0.05),其次是G2采样点的马来眼子菜附着生物的Chl.a含量,而胥口湾各采样点不同沉水植物附着生物的Chl.a含量相对较低。在贡湖湾,比较同一采样点不同沉水植物附着藻类生物量发现,苦草附着生物的Chl.a含量较低,显著低于相同采样点其他沉水植物附着生物的Chl.a含量(P<0.05)。进一步分析同种沉水植物不同采样点的附着生物的Chl.a含量发现,贡湖湾G2采样点马来眼子菜附着生物的Chl.a含量显著高于胥口湾X1、X2采样点(P<0.05),胥口湾X1采样点与X2采样点差异不大;苦草则表现为贡湖湾G2采样点附着生物的Chl.a含量显著高于其他3个采样点苦草附着生物的Chl.a含量,G1采样点与X3采样点无显著差异,但都显著高于X1采样点。附着生物的AFDM在不同采样点不同沉水植物之间均存在着显著差异(图 2)。G1采样点狐尾藻附着生物的生物量显著高于其他沉水植物附着生物的生物量(P<0.05),其次是G2采样点马来眼子菜附着生物的生物量,G1采样点苦草附着生物的生物量也比较高。对相同采样点而言,苦草附着生物的生物量显著低于其他沉水植物附着生物的生物量(P<0.05)。进一步分析同种沉水植物不同采样点附着生物的生物量发现,马来眼子菜附着生物的生物量表现为G2>X1>X2,苦草附着生物的生物量表现为G1>G2(X3)> X1。
|
图 2 沉水植物附着生物Chl.a和AFDM含量(不同字母表示不同采样点间差异显著(P<0.05)) Fig.2 Chl.a and AFDM of epiphyton on the submerged plants (different letters indicate significant differences among different sampling sites (P < 0.05)) |
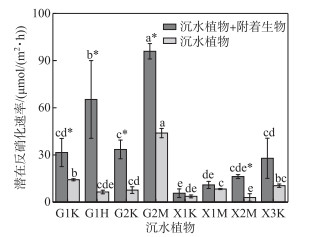
从图 3可知,有附着生物的沉水植物潜在反硝化速率在贡湖湾及胥口湾之间变化明显,其中G1、G2采样点有附着沉水植物的潜在反硝化速率均高于胥口湾X1采样点(P<0.05);无附着生物的沉水植物潜在反硝化速率在贡湖湾及胥口湾之间变化不显著,但同一湖湾内存在点位间差异。从图 3还可以看出,在贡湖湾各采样点,有附着生物的沉水植物潜在反硝化速率均显著高于无附着生物的沉水植物潜在反硝化速率(P<0.05)。进一步分析沉水植物附着生物的潜在反硝化速率发现,不同沉水植物的附着生物潜在反硝化速率存在明显的变化,G1采样点狐尾藻附着生物的潜在反硝化速率可达(58.80±20.20)μmol/(m2·h),G2采样点马来眼子菜附着生物的潜在反硝化速率((51.98±4.91)μmol/(m2·h))也较高,与G1采样点狐尾藻附着生物的潜在反硝化速率相当,二者均显著高于其他植物附着生物的潜在反硝化速率(P<0.05)。对于同一采样点不同沉水植物而言,附着生物潜在反硝化速率存在一定差异,但也因采样点不同而不同。G1采样点狐尾藻附着生物的潜在反硝化速率显著高于同一采样点苦草附着生物的潜在反硝化速率(P<0.05),但在X1采样点苦草与马来眼子菜附着生物的潜在反硝化速率差异不大。进一步分析同种沉水植物在不同采样点沉水植物上附着生物的潜在反硝化速率发现,苦草附着生物的潜在反硝化速率表现为:G2> G1(X3)>X1。马来眼子菜附着生物的潜在反硝化速率表现为:G2>X2>X1。总的来看,贡湖湾附着生物潜在反硝化速率较高,而胥口湾各沉水植物上附着生物潜在反硝化速率较低。
|
图 3 有、无附着生物的沉水植物潜在反硝化速率(不同字母表示不同采样点间差异显著(P<0.05),*表示有、无附着生物处理间差异显著(P<0.05)) Fig.3 Potential denitrification rate of the submerged plants with and without epiphyton (different letters indicate significant differences among different sampling sites (P < 0.05), * indicate significant differences between submerged plants with and without epiphyton (P < 0.05)) |
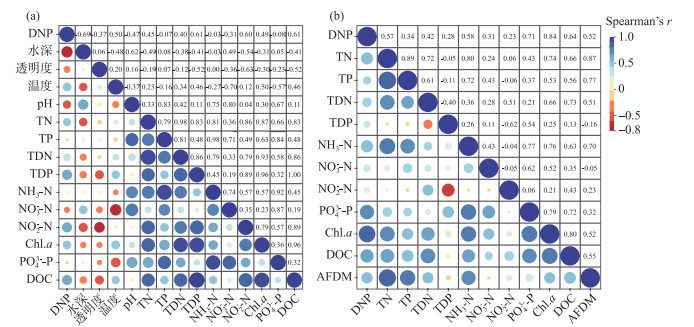
为探讨沉水植物附着生物的生物量与环境因子之间的关系进行了相关性分析,附着生物Chl.a含量与环境因子的相关分析结果表明,附着生物附着藻类生物量与水体的TN、TDN、TDP、NO2--N、NH3-N、DOC、透明度、温度及水深均呈显著相关(P<0.05),其中,与水深、TN、TDN、TDP、NO2--N、DOC显著性达到极显著水平(P<0.01)(图 4)。附着生物AFDM与环境因子的相关分析结果表明,附着生物的生物量与水体的透明度、TN、TP、TDN、TDP、NH3-N、NO2--N、PO43--P、DOC呈极显著相关(P<0.01),与水体NO3--N相关性达到显著水平(P<0.05)(图 4)。

|
图 4 单位沉水植物体表面积附着生物Chl.a和AFDW与环境因素的相关热图(n=48) Fig.4 Heat map of theepiphytic algae and epiphyton load on the submerged plants and environmental factors per unit submerged plant body surface area(n=48) |
为探讨沉水植物附着生物的潜在反硝化速率(DNP)的影响因素,分别对沉水植物附着生物的潜在反硝化速率与水体理化指标和附着层理化指标进行相关性分析(图 5)。附着生物的潜在反硝化速率与水体理化指标的相关分析表明,附着生物潜在反硝化速率与水体的水深、温度、pH、TN、TDP、NO2--N、Chl.a、DOC呈极显著相关(P<0.01),附着生物的潜在反硝化速率对水体的TDP、DOC含量响应最强(图 5a)。附着生物的潜在反硝化速率与附着层理化指标的相关性分析结果表明,附着生物潜在反硝化速率与附着层TN、TP、TDN、NH3-N、Chl.a、PO43--P、DOC、AFDM呈极显著相关(P<0.01),附着生物的潜在反硝化速率对附着生物Chl.a含量响应最强(图 5b)。在上述相关关系分析基础上,进一步探讨了沉水植物附着生物的潜在反硝化速率与主要环境因子及附着层理化性质的关系。经过逐步线性回归获得附着生物的潜在反硝化速率与附着藻类生物量(Chl.a)、pH及水体DOC含量的回归方程DNP=0.012Chl.a-80.456pH+5.366DOC+613.100(R2=0.812),利用Chl.a、pH、DOC的变异可以解释81.2%的沉水植物附着生物的潜在反硝化速率。
|
图 5 单位沉水植物体表面积附着生物潜在反硝化速率与水体理化特征(a)和附着层理化特征(b)的相关热图(n=48) Fig.5 Heat map of DNP and physicochemical properties of water (a) and physicochemical properties of epiphyton on submerged plant (b) (n=48) |
太湖3种常见沉水植物上附着生物的生物量存在空间差异,Chl.a和AFDM受到生长环境水体理化因子共同作用的影响[30-31]。已有研究表明,水体氮磷浓度对附着生物生物量的影响较大,附着生物生物量与水体氮磷浓度存在显著正相关关系[32-33]。由表 1及图 2可知,G1、G2采样点水体总氮浓度相对较高,X1、X2、X3采样点相对较低,沉水植物附着生物生物量的最高值出现在G1采样点,最低值出现在X1采样点。进一步分析发现,附着生物生物量与水体氮磷浓度呈显著正相关(P<0.01)(图 4)。附着生物生物量不仅受水体氮磷浓度的影响,附着藻类是附着生物群落中重要组成成分,其作为浅水湖泊重要的初级生产者,光照是影响其生长的主要因素[34-35]。由表 1可知,G1采样点水体氮磷浓度高于G2采样点,而G2采样点苦草附着藻类生物量显著高于G1采样点(图 2),主要与光照条件有关。由表 1可知,由于G1采样点水体氮磷浓度高于G2采样点,G1采样点浮游藻类生物量高于G2采样点,进而影响水体透明度,G2采样点透明度比G1采样点高(表 1)。此外,G1采样点水深较G2采样点深(表 1),到达G1点叶片表面的光照强度大大降低。本文研究结果表明,附着生物的生物量与水深呈现相关关系(P<0.01)(图 4)。
附着生物除受到环境因素影响,附着在沉水植物表面的附着生物生物量还会受到沉水植物形态结构及其特性的影响[36-37]。在本研究中,相同条件下不同沉水植物附着生物的生物量存在差异,狐尾藻和马来眼子菜附着生物的生物量均高于苦草,这可能与沉水植物形态结构及生活习性有关。狐尾藻叶片呈羽状,形态结构比较复杂,相对而言,马来眼子菜与苦草形态结构简单,呈条状或带状,但前者更有利于附着生物的附着。在相同的采样点,苦草附着生物的生物量与马来眼子菜上的也存在明显差异,这可能是由于苦草属于底层性沉水植物,而马来眼子菜属于冠层性沉水植物,底层性沉水植物上的附着生物受光的限制。此外,沉水植物上附着生物的发展也可能受宿主植物分泌物的影响。研究表明,不同沉水植物分泌物存在差异,进而可能影响附着生物群落中异养生物的生长[38]。
3.2 太湖沉水植物附着生物潜在反硝化速率的影响因素太湖常见的3种沉水植物附着生物潜在反硝化速率存在一定的空间差异。相比较而言,贡湖湾沉水植物附着生物潜在反硝化速率相对较高,而胥口湾相对较低(图 3)。相关分析表明,附着生物潜在反硝化速率与水体及附着生物的理化指标密切相关(图 5)。事实上,反硝化作用是由反硝化微生物介导的在厌氧条件下以硝态氮作为代谢底物的氮代谢过程,附着生物潜在反硝化速率与附着生物生物量及附着层群落结构密切相关。附着藻类生物量的增加有利于反硝化作用的进行[13, 39],沉水植物及附着藻类进行光合作用,引起微环境溶氧浓度、氧化还原电位、pH等发生变化[30, 40],附着生物膜内部形成厌氧区,有利于反硝化作用的进行。同时附着生物膜内部的反硝化细菌生长代谢所需碳源依赖于自养微生物(如藻类)分泌有机产物或死亡分解提供[11, 39],附着生物内部的调节作用影响微生物群落的活性[41],附着生物潜在反硝化速率与附着生物的生物量存在线性相关关系[24, 41]。这些与本文研究结果中沉水植物附着生物的潜在反硝化速率与附着层附着藻类生物量(Chl.a)及附着生物生物量(AFDM)具有显著的正相关关系是一致的(P<0.01)(图 5b)。
附着生物的潜在反硝化速率除受到附着生物生物量及附着藻类生物量影响外,还受水环境营养条件的影响[11-14]。由表 1及图 3可知,贡湖湾采样点水体总氮浓度相对较高,而胥口湾采样点相对较低。贡湖湾各采样点附着生物的潜在反硝化速率较高,而胥口湾相对较低(图 3)。相关研究也表明,不同营养状态水体中附着生物的潜在反硝化作用存在差异[13],适应高营养负荷的沉水植物附着生物潜在反硝化速率较适应低营养负荷的高100倍左右[14],这与在不同营养条件下反硝化微生物丰度发生变化进而影响潜在反硝化速率相关[40]。附着生物的潜在反硝化速率不仅受水体氮浓度的影响,与水体DOC浓度、pH等多种生态因子也密切相关。由图 2可知,X1采样点马来眼子菜附着生物生物量显著高于X2采样点,但X2采样点马来眼子菜附着层的潜在反硝化速率却显著高于X1采样点(图 3),究其原因可能受到水体DOC浓度影响。水体DOC在反硝化过程担任电子供体的来源,同时还在反硝化细菌生长代谢过程中提供能量,是影响反硝化作用的重要因素[42-43]。相关分析也表明,附着生物的潜在反硝化速率与水体DOC浓度呈显著正相关(P<0.01)(图 5a)。pH通过对附着微生物活性产生影响进而影响附着生物的潜在反硝化速率[44]。由图 2可知,G1采样点苦草附着生物生物量显著高于G2采样点,但G2采样点苦草附着层潜在反硝化速率高于G1采样点,究其原因可能受到水体pH影响。相关分析结果表明,附着生物的潜在反硝化速率与水体pH呈显著负相关(P<0.01)(图 5a)。通过逐步回归分析可知,附着藻类生物量(Chl.a)、水体pH和DOC的变异可以解释81.2%的太湖沉水植物附着生物的潜在反硝化速率变化。
3.3 太湖沉水植物附着生物反硝化过程在水体脱氮中的作用通过研究发现,太湖3种常见沉水植物上的附着生物潜在反硝化速率在3.09~51.98 μmol/(m2·h)之间,单位体表面积沉水植物附着生物潜在反硝化速率相对较低,但夏季沉水植物生长旺盛,生物量大且覆盖大部分水面,单位湖泊面积上沉水植物叶面积较大,已有的研究表明,太湖有沉水植物分布区域单位湖泊面积沉水植物生物量为(101.23±58.23) g/m2[45],根据沉水植物生物量计算单位湖泊面积沉水植物附着生物潜在反硝化速率,其值为(0.81±0.24)~(157.57±33.85) μmol/(m2·h)。Eriksson等[3]对污水池中植被附着生物的反硝化作用进行研究时发现,沉水植物附着生物潜在反硝化速率可达7.5~250 μmol/(m2·h),较同条件的沉积物潜在反硝化速率(168 μmol/(m2·h))高。Bourgues等[4]对城市湿地沉积物和附生生物膜潜在反硝化速率进行研究时发现,受污染最严重的湿地具有最高的反硝化潜力,且附生生物膜潜在反硝化速率达到(980±300)~(1860±830) μmol/(m2·h)。与已有的研究相比,本研究测定的附着生物反硝化速率略低。相关的研究表明,不同营养状态水体中附着生物的潜在反硝化作用存在差异[13],本研究中贡湖湾为草藻过渡型湖区、胥口湾为草型湖区,营养盐浓度相对较低,与营养盐浓度较高的环境相比,长期营养盐浓度较低的环境中,反硝化微生物丰度较低[40],进而可能导致本研究结果略低于前人的研究结果。
结合已有的研究,董彬等[46]的研究表明,菹草暴发生长期附着生物反硝化速率显著升高,是春季水体重要的脱氮过程。Eriksson[12]的研究表明,夏季沉水植物为反硝化细菌提供附着表面,显著提高浅层富营养淡水系统中氮的去除率。研究结果说明,沉水植物附着生物反硝化脱氮是水体重要的氮去除过程。同时进一步分析太湖常见沉水植物附着生物反硝化作用在太湖脱氮中的重要性,赵锋等[21]对于太湖春夏两季沉积物反硝化空间差异的研究中发现贡湖湾沉积物反硝化速率为(72.78±11.83)μmol/(m2·h)。康丽娟等[20]对太湖主要环湖河道沉积物反硝化潜力的研究中发现太湖环湖河道沉积物反硝化潜力为(0.87±0.62)μmol/(m2·h)。本研究中沉水植物附着生物潜在反硝化速率((0.81±0.24)~(157.57±33.85) μmol/(m2·h))与太湖沉积物潜在反硝化速率相当,甚至高于有些文献中关于太湖沉积物的潜在反硝化速率,分析结果表明,太湖沉水植物附着生物反硝化脱氮是太湖水体重要的氮去除过程。为有效控制太湖富营养化程度,建议对沉水植物进行人工管理,可将狐尾藻、苦草、马来眼子菜等沉水植物与春末生根发芽夏初衰亡的菹草交替种植,充分发挥沉水植物附着层的生态功能。本研究对太湖3种常见的沉水植物附着生物的生物量及潜在反硝化速率进行分析,研究结果可为湖泊系统沉水植物的管理提供一定的科学依据。
致谢: 感谢中国科学院南京地理与湖泊研究所太湖湖泊生态系统国家野外科学观测研究站在野外采样所给予的支持!
| [1] |
Qin BQ. Research on limnology of shallow lakes and eutrophication control in Lake Taihu. J Lake Sci, 2020, 32(5): 1229-1243. [秦伯强. 浅水湖泊湖沼学与太湖富营养化控制研究. 湖泊科学, 2020, 32(5): 1229-1243. DOI:10.18307/2020.0501] |
| [2] |
Seitzinger SP. Denitrification in freshwater and coastal marine ecosystems: Ecological and geochemical significance. Limnology and oceanography, 1988, 33(4part2): 702-724. DOI:10.4319/lo.1988.33.4part2.0702 |
| [3] |
Eriksson PG, Weisner SEB. Nitrogen removal in a wastewater reservoir: The importance of denitrification by epiphytic biofilms on submersed vegetation. Journal of Environmental Quality, 1997, 26(3): 905-910. DOI:10.2134/jeq1997.00472425002600030043x |
| [4] |
Bourgues S, Hart BTH. Nitrogen removal capacity of wetlands: Sediment versus epiphytic biofilms. Water Science and Technology, 2007, 55(4): 175-182. DOI:10.2166/wst.2007.107 |
| [5] |
Seitzinger SP, Styles RV, Boyer EW et al. Nitrogen retention in rivers: Model development and application to watersheds in the northeastern U.S.A. . The nitrogen cycle at regional to global scales. Dordrecht: Springer, 2002: 199-237. DOI: 10.1007/978-94-017-3405-9_6
|
| [6] |
Sand-Jensen K. Environmental variables and their effect on photosynthesis of aquatic plant communities. Aquatic Botany, 1989, 34(1/2/3): 5-25. DOI:10.1016/0304-3770(89)90048-X |
| [7] |
Dong B, Han RM, Wang GX et al. Spatiotemporal dynamics of O2 at the stem and leaf microinterface of Rhizophylla sinica. Acta Ecological Sinica, 2015, 35(24): 8202-8210. [董彬, 韩睿明, 王国祥等. 菹草茎叶微界面O2时空动态. 生态学报, 2015, 35(24): 8202-8210. DOI:10.5846/stxb201406101195] |
| [8] |
Ventullo RM, Rowe JJ. Denitrification potential of epilithic communities in a lotic environment. Current Microbiology, 1982, 7(1): 29-33. DOI:10.1007/bf01570976 |
| [9] |
Pang S, Zhang SH, Lv XY et al. Characterization of bacterial community in biofilm and sediments of wetlands dominated by aquatic macrophytes. Ecological Engineering, 2016, 97: 242-250. DOI:10.1016/j.ecoleng.2016.10.011 |
| [10] |
Jensen SI, Kühl M, Priemé A. Different bacterial communities associated with the roots and bulk sediment of the seagrass Zostera marina. FEMS Microbiology Ecology, 2007, 62(1): 108-117. DOI:10.1111/j.1574-6941.2007.00373.x |
| [11] |
Sirivedhin T, Gray KA. Factors affecting denitrification rates in experimental wetlands: Field and laboratory studies. Ecological Engineering, 2006, 26(2): 167-181. DOI:10.1016/j.ecoleng.2005.09.001 |
| [12] |
Eriksson PG. Interaction effects of flow velocity and oxygen metabolism on nitrification and denitrification in biofilms on submersed macrophytes. Biogeochemistry, 2001, 55(1): 29-44. DOI:10.1023/A:1010679306361 |
| [13] |
Sørensen J, Jørgensen T, Brandt S. Denitrification in stream epilithon: Seasonal variation in Gelbæk and Rabis Bæk, Denmark. FEMS Microbiology Ecology, 1988, 4(6): 345-353. DOI:10.1111/j.1574-6968.1988.tb02701.x |
| [14] |
Eriksson P, Weisner S. Functional differences in epiphytic microbial communities in nutrient-rich freshwater ecosystems: An assay of denitrifying capacity. Freshwater Biology, 1996, 36(3): 555-562. DOI:10.1046/j.1365-2427.1996.00120.x |
| [15] |
Qin BQ, Zhu GW, Yang HW et al. New methods and theories provide scientific and technological support for environmental governance and ecological restoration of Lake Taihu. Bulletin of Chinese Academy of Sciences, 2017, 32(6): 654-660. [秦伯强, 朱广伟, 杨宏伟等. 新方法、新理论为太湖环境治理和生态修复提供科技支撑. 中国科学院院刊, 2017, 32(6): 654-660.] |
| [16] |
Wu YL, Xu H, Yang GJ et al. Progress in nitrogen pollution research in Lake Taihu. J Lake Sci, 2014, 26(1): 19-28. [吴雅丽, 许海, 杨桂军等. 太湖水体氮素污染状况研究进展. 湖泊科学, 2014, 26(1): 19-28. DOI:10.18307/2014.0103] |
| [17] |
Chen C, Zhong JC, Fan CX et al. Simulation study on the influence of lake dredging on endogenous release. Environmental Science, 2013, 34(10): 3872-3878. [陈超, 钟继承, 范成新等. 湖泊疏浚方式对内源释放影响的模拟研究. 环境科学, 2013, 34(10): 3872-3878.] |
| [18] |
Xu H, McCarthy MJ, Paerl HW et al. Contributions of external nutrient loading and internal cycling to cyanobacterial bloom dynamics in Lake Taihu, China: Implications for nutrient management. Limnology and Oceanography, 2021, 66(4): 1492-1509. DOI:10.1002/lno.11700 |
| [19] |
Wang HL, Cao H, Zhang WS et al. Characteristics of denitrification potential change characteristics and influencing factors of typical reservoirs in the hilly area of the upper reaches of Taihu Lake. J Lake Sci, 2022, 34(6): 1937-1948. [王慧亮, 曹恒, 张汪寿等. 太湖上游丘陵区典型水塘反硝化潜力变化特征及其影响因素. 湖泊科学, 2022, 34(6): 1937-1948. DOI:10.18307/2022.0611] |
| [20] |
Kang LJ, Xu H, Zhu GW et al. Denitrification potential and control factors of sediments in the main surrounding channels of Lake Taihu. Environmental Science, 2021, 41(4): 1393-1400. [康丽娟, 许海, 朱广伟等. 太湖主要环湖河道沉积物反硝化潜力及其控制因子. 环境科学学报, 2021, 41(4): 1393-1400. DOI:10.13671/j.hjkxxb.2021.0007] |
| [21] |
Zhao F, Xu H, Zhan X et al. Spatial differences and influencing factors of denitrification and ANAMMOX rates in spring and summer in Lake Taihu. Environmental Science, 2021, 42(5): 2296-2302. [赵锋, 许海, 詹旭等. 太湖春夏两季反硝化与厌氧氨氧化速率的空间差异及其影响因素. 环境科学, 2021, 42(5): 2296-2302. DOI:10.13227/j.hjkx.202008303] |
| [22] |
中国科学院南京地理与湖泊研究所. 湖泊调查技术规程. 北京: 科学出版社, 2015.
|
| [23] |
国家环境保护总局. 水和废水监测分析方法(第4版). 北京: 中国环境科学出版社, 2002.
|
| [24] |
Adame MF, Waltham NJ, Iram N et al. Denitrification within the sediments and epiphyton of tropical macrophyte stands. Inland Waters, 2021, 11(3): 257-266. DOI:10.1080/20442041.2021.1902214 |
| [25] |
Ishida CK, Arnon S, Peterson CG et al. Influence of algal community structure on denitrification rates in periphyton cultivated on artificial substrata. Microbial Ecology, 2008, 56(1): 140-152. DOI:10.1007/s00248-007-9332-0 |
| [26] |
Arnon S, Packman AI, Peterson CG et al. Effects of overlying velocity on periphyton structure and denitrification. Journal of Geophysical Research: Biogeosciences, 2007, 112(G1). DOI:10.1029/2006JG000235 |
| [27] |
Weiss RF, Price BA. Nitrous oxide solubility in water and seawater. Marine Chemistry, 1980, 8(4): 347-359. DOI:10.1016/0304-4203(80)90024-9 |
| [28] |
Wei HN, Pan JL, Zhao K et al. Response of minnow attachment to nutrient salt concentration and its relationship with minnow decay. Journal of Ecology, 2013, 33(24): 7661-7666. [魏宏农, 潘建林, 赵凯等. 菹草附着物对营养盐浓度的响应及其与菹草衰亡的关系. 生态学报, 2013, 33(24): 7661-7666. DOI:10.5846/stxb201208251202] |
| [29] |
Asaeda T, Sultana M, Manatunge J et al. The effect of epiphytic algae on the growth and production of Potamogeton perfoliatus L. in two light conditions. Environmental and Experimental Botany, 2004, 52(3): 225-238. DOI:10.1016/j.envexpbot.2004.02.001 |
| [30] |
Hempel M, Blume M, Blindow I et al. Epiphytic bacterial community composition on two common submerged macrophytes in brackish water and freshwater. BMC Microbiology, 2008, 8: 58. DOI:10.1186/1471-2180-8-58 |
| [31] |
Allgaier M, Grossart HP. Seasonal dynamics and phylogenetic diversity of free-living and particle-associated bacterial communities in four lakes in northeastern Germany. Aquatic Microbial Ecology, 2006, 45: 115-128. DOI:10.3354/ame045115 |
| [32] |
Song YZ, Feng Y, Wang JQ et al. Effects of nitrogen and phosphorus levels of water and sediments on epiphytic algae. Environmental Science, 2018, 38(12): 4721-4727. [宋玉芝, 丰叶, 王锦旗等. 水体及沉积物氮磷水平对附植藻类的影响. 环境科学学报, 2018, 38(12): 4721-4727. DOI:10.13671/j.hjkxxb.2018.0338] |
| [33] |
Song YZ, Qin BQ, Gao G. Effects of nitrogen and nitrogen-phosphorus ratio on attached algae and planktonic algae. J Lake Sci, 2007, 19(2): 125-130. [宋玉芝, 秦伯强, 高光. 氮及氮磷比对附着藻类及浮游藻类的影响. 湖泊科学, 2007, 19(2): 125-130. DOI:10.18307/2007.0203] |
| [34] |
Moore JW. Some factors effecting algal densities in a eutrophic farmland stream. Oecologia, 1977, 29(3): 257-267. DOI:10.1007/BF00345700 |
| [35] |
McCormick PV, O'Dell MB, Shuford RBE et al. Periphyton responses to experimental phosphorus enrichment in a subtropical wetland. Aquatic Botany, 2001, 71(2): 119-139. DOI:10.1016/S0304-3770(01)00175-9 |
| [36] |
Song YZ, Zhang YD, Zheng JW et al. Advances in the ecology of attached algae in freshwater lakes. Journal of Ecology, 2016, 35(2): 534-541. [宋玉芝, 张亚冬, 郑建伟等. 淡水湖泊附着藻类生态学研究进展. 生态学杂志, 2016, 35(2): 534-541. DOI:10.13292/j.1000-4890.201602.003] |
| [37] |
James CS, Eaton JW, Hardwick K. Responses of three invasive aquatic macrophytes to nutrient enrichment do not explain their observed field displacements. Aquatic Botany, 2006, 84(4): 347-353. DOI:10.1016/j.aquabot.2006.01.002 |
| [38] |
Liu KH, Zhang SH, Lv XY et al. Characteristics of microbial communities attached to the surface of three submerged plants in Nanjing Huashen Lake. J Lake Sci, 2015, 27(1): 103-112. [刘凯辉, 张松贺, 吕小央等. 南京花神湖3种沉水植物表面附着微生物群落特征. 湖泊科学, 2015, 27(1): 103-112. DOI:10.18307/2015.0113] |
| [39] |
Toet S, Huibers LHFA, Van Logtestijn RSP et al. Denitrification in the periphyton associated with plant shoots and in the sediment of a wetland system supplied with sewage treatment plant effluent. Hydrobiologia, 2003, 501(1): 29-44. DOI:10.1023/A:1026299017464 |
| [40] |
Zhang SH, Pang S, Wang PF et al. Responses of bacterial community structure and denitrifying bacteria in biofilm to submerged macrophytes and nitrate. Scientific Reports, 2016, 6: 36178. DOI:10.1038/srep36178 |
| [41] |
Baldwin DS, Mitchell AM, Rees GN et al. Nitrogen processing by biofilms along a lowland river continuum. River Research and Applications, 2006, 22(3): 319-326. DOI:10.1002/rra.896 |
| [42] |
Yang S, Shi WH, Wang H et al. Research progress on the influence of admitted carbon sources on heterotrophic denitrification and denitrification and denitrification in water. Environmental Science and Technology, 2014, 37(8): 54-58, 86. [杨珊, 石纹豪, 王晗等. 外加碳源影响水体异养反硝化脱氮的研究进展. 环境科学与技术, 2014, 37(8): 54-58, 86.] |
| [43] |
Yang LY, Wang CC, Sun X et al. Study on microbial nitrification and denitrification processes and influence factors in freshwater lakes. Water Resources Protection, 2016, 32(1): 12-22, 50. [杨柳燕, 王楚楚, 孙旭等. 淡水湖泊微生物硝化反硝化过程与影响因素研究. 水资源保护, 2016, 32(1): 12-22, 50.] |
| [44] |
Morse JL, Bernhardt ES. Using 15N tracers to estimate N2O and N2 emissions from nitrification and denitrification in coastal plain wetlands under contrasting land-uses. Soil Biology and Biochemistry, 2013, 57: 635-643. DOI:10.1016/j.soilbio.2012.07.025 |
| [45] |
Zhao K, Zhou YF, Jiang ZL et al. Changes of aquatic vegetation in Lake Taihu since 1960s. J Lake Sci, 2017, 29(2): 351-362. [赵凯, 周彦锋, 蒋兆林等. 1960年以来太湖水生植被演变. 湖泊科学, 2017, 29(2): 351-362. DOI:10.18307/2017.0211] |
| [46] |
Dong B, Wang LZ, Song HL et al. Potamogeton crispus attached biofilm becomes a hot spot for denitrification in urban rivers. J Lake Sci, 2023, 35(1): 145-154. [董彬, 王立志, 宋红丽等. 暴发生长期菹草(Potamogeton crispus)附着生物膜成为城市河流反硝化作用热点. 湖泊科学, 2023, 35(1): 145-154. DOI:10.18307/2023.0109] |
 2024, Vol. 36
2024, Vol. 36 

